
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 4
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
1
Ćwiczenie 4
Temat: KATALIZA ENZYMATYCZNA. KLASYFIKACJA ENZYMÓW.
OZNACZANIE AKTYWNOŚCI ENZYMATYCZNEJ
W MATERIALE BIOLOGICZNYM.
Część teoretyczna
Enzymy spełniają w organizmach żywych rolę katalizatorów – umożliwiają przebieg tysięcy
reakcji chemicznych z szybkością, wydajnością i specyficznością trudną do osiągnięcia w układach
sztucznych. Podstawową właściwością każdego enzymu jest jego aktywność katalityczna, ponadto
optima temperatury i pH oraz skład ewentualnych kofaktorów koniecznych do działania. Przez
długi czas uważano, że działanie enzymatyczne jest nieodłącznie związane ze strukturami
białkowymi. Od kilku lat wiadomo, że dosyć krótkie odcinki RNA (35-55 jednostek) o
charakterystycznej sekwencji mogą również katalizować reakcje. Ponad wszelką wątpliwość
wykazano, że dzieje się to bez obecności nawet śladów substancji białkowych i że za efekt
katalityczny odpowiedzialny jest odcinek RNA o określonej kolejności nukleotydów. Reakcje te
mają wszelkie cechy reakcji enzymatycznych i dotyczą głównie przekształceń RNA. Niemniej
jednak potocznie uznaje się enzymy za substancje białkowe.
Enzymy nie zmieniają końcowego składu mieszaniny reagującej ani stanu równowagi danej
reakcji, przyśpieszają jedynie osiągnięcie stanu równowagi w reakcjach termodynamicznie
możliwych. Są to reakcje egzoergiczne, którym towarzyszy utrata energii swobodnej (ΔG ma znak
ujemny). Zasadniczą funkcją enzymu jest aktywowanie substratu (i ewentualnie koenzymu) przez
ustawienie go w przestrzeni w sposób najbardziej sprzyjający oddziaływaniu enzymu. Białko
enzymatyczne jest pewnego rodzaju matrycą, na której układa się lub wiąże substrat i kosubstrat.
Dany enzym wchodzi w połączenie i aktywuje tylko określone substraty (specyficzność
substratowa), a reakcja zachodzi nie w dowolnych, lecz w ściśle określonych miejscach na
powierzchni enzymu (centrum aktywne). Swoistość działania enzymów jest miarą stopnia
„dopasowania się” enzymu i substratu. Owo „dopasowanie” może być niezupełnie doskonałe,
wskutek czego cząsteczka substratu uzyskuje pewne napięcie wewnętrzne, czego wynikiem jest
wzrost reaktywności chemicznej, określany jako aktywacja.
Katalizowana przez enzym reakcja chemiczna jest więc swoistą cechą odróżniającą każdy
enzym i właśnie ona jest podstawą klasyfikacji i nomenklatury enzymów. Reakcja ta łącznie z
nazwą substratu (substratów) służy za podstawę terminologii poszczególnych enzymów. Enzymy
mają z reguły dwie nazwy: systematyczną i potoczną. Nazwa systematyczna powinna
identyfikować dany enzym i określać jego działanie. Zgodnie z zaleceniami Międzynarodowej Unii
Biochemicznej wszystkie enzymy grupuje się w 6 klas, a każda z nich ma od 4 do 13 podklas.
Podstawowe klasy enzymów to:
Oksydoreduktazy – katalizujące odwracalne reakcje utleniania i redukcji,
Transferazy – katalizujące odwracalne reakcje przeniesienia grup funkcyjnych z donora na
akceptor,
Hydrolazy – katalizujące nieodwracalne reakcje hydrolizy różnych wiązań,
Liazy – rozszczepiające wiązania bez przyłączania cząsteczki wody, niektóre reakcje są
odwracalne,
Izomerazy – powodujące odwracalną izomeryzację cząsteczek substratów,
Ligazy – katalizujące tworzenie nowych wiązań kowalencyjnych, z wykorzystaniem wiązań
makroergicznych ATP.
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 4
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
2
Klasa oksydoreduktaz obejmuje enzymy katalizujące reakcje oksydoredukcyjne, a więc
przemiany związane z przenoszeniem protonów, elektronów i tlenu.
W przenoszeniu tych elementów uczestniczą zwykle charakterystyczne koenzymy lub atomy
metali związanych w grupie prostetycznej enzymu. Klasa ta obejmuje enzymy o potocznych
nazwach: dehydrogenazy, reduktazy, oksydazy, oksygenazy, hydroksylazy i peroksydazy.
Dehydrogenazy: Katalizują zwykle pierwszy etap utlenienia i przenoszą atomy wodoru z
utlenionego substrat na koenzymy NAD
+
lub NADP
+
. Zasadniczo atomy wodoru związane z NAD
+
są przenoszone dalej na tlen przez następne przenośniki łańcucha oddechowego.
Reduktazy: Stanowią pośrednie ogniwo w przenoszeniu protonów i elektronów nie
kontaktując się bezpośrednio z substratem ani z tlenem. W typowym łańcuchu oddechowym
funkcję reduktaz pełnią enzymy flawinowe. Redukowane są one przez NAD
+
, a przekazują
elektrony na dalsze przenośniki. Oprócz FAD (rzadziej FMN) jako koenzym w skład ich wchodzi
metal np. Fe
3+
, Mo
2+
, Mn
2+
, są więc one metaloflawoproteidami. Niekiedy koenzymy flawinowe
współdziałają z dehydrogenazami lub oksydazami. W tym ostatnim przypadku w wyniku
przeniesienia elektronów z substratu na tlen tworzy się nadtlenek wodoru.
Oksydazy:
Aktywują tlen cząsteczkowy przez przeniesienie nań elektronów. Dzięki temu
może się on łączyć ze znajdującymi się w roztworze protonami tworząc cząsteczkę wody (w
przypadku oksydaz flawinowych H
2
O
2
). Obok typowej dla łańcucha oddechowego oksydazy
cytochromowej (zawiera ona 6 cząsteczek żelazoporfiryny i 6 atomów Cu) należy tu szereg
enzymów, które nie stanowią jednak ogniw w łańcuchu oddechowym. Są one również
miedzioproteidami, lecz nie zawierają układu porfirynowego. Należy tu wymienić oksydazę p-
fenolową, oksydazę o-dwufenolową (tyrozynazę), oksydazę askorbinianową i szereg innych.
Oksygenazy i hydroksylazy: Katalizują odpowiednio włączanie cząsteczki tlenu (lub
połowy tej cząsteczki) do związków organicznych według reakcji:
A + O
2
AO
2
(dioksygenazy- oksygenazy właściwe)
AH
2
+ DH + O
2
AOH + D + H
2
O (monooksygenazy- hydroksylazy)
Peroksydazy i katalazy: Rozkładają nadtlenek wodoru powstały w wyniku działania
oksydaz flawinowych. Enzymy te należą do hemoproteidów. Peroksydazy charakterystyczne dla
roślin katalizują reakcję:
A
H
H
+
OH
OH
A + 2 H O
2
Katalazy są obecne we wszystkich organizmach tlenowych (np. w znacznym stężeniu w
wątrobie zwierząt). Katalazy charakteryzują się dużą aktywnością, a ich inhibitorami są m.in. jony
CN
-
i S
2-
. Mechanizm działania katalaz polega na odwracalnym wytworzeniu nadtlenku enzymu z
udziałem O
2
oderwanego z jednej cząsteczki H
2
O
2
i jednoczesnym przeniesieniu odłączonych
protonów i elektronów na drugą cząsteczkę nadtlenku wodoru, w myśl reakcji:
H
2
O
2
+ H
2
O
2
2 H
2
O + O
2
Do klasy hydrolaz zalicza się enzymy katalizujące proces rozpadu substratu z udziałem
wody. Enzymy te nie wymagają do aktywności katalitycznej współdziałania koenzymów, a ich
nazwy systematyczne tworzy się dodając do terminu hydrolaza nazwę substratu, np. hydrolaza
acetylo-CoA. Nazwy potoczne mają przeważnie końcówkę -aza dodaną do nazwy substratu, np.
ureaza, lub też są to nazwy zwyczajowe, np. pepsyna, trypsyna, papaina. Ze względu na rodzaj
hydrolizowanego wiązania w klasie hydrolaz można wyróżnić następujące ważniejsze podklasy
enzymów: esterazy (3.1), glikozydazy (3.2), peptydazy (3.4), amidazy (3.5) oraz hydrolazy
bezwodników kwasowych (3.6).
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 4
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
3
Część praktyczna
A) IDENTYFIKACJA OKSYDOREDUKTAZ W MATERIALE BIOLOGICZNYM.
1. WYKRYWANIE OKSYDAZ I PEROKSYDAZ W ZIEMNIAKU
W ziemniakach podobnie jak w innych tkankach roślinnych występują licznie tzw. oksydazy
fenolowe. Posiadają one zdolność utleniania jednofenoli (oksydazy jednofenolowe), dwu- i
trójfenoli (oksydazy wielofenolowe) do chinonów, które kondensując często tworzą barwne
pochodne. Elektrony z tych substratów są przenoszone przez oksydazy na tlen atmosferyczny.
Opisane reakcje są przyczyną ciemnienia niektórych tkanek roślinnych pojawiającego się w
odpowiedzi na kontakt z tlenem powietrza.
Wykonanie:
Umyty i obrany ziemniak utrzeć na tarce. Miazgę włożyć do zlewki z około 200 ml
3
wody.
Zawartość zlewki łagodnie wymieszać. Uzyskuje się w ten sposób wodny ekstrakt zawierający
enzymy i skrobię. Otrzymany roztwór zdekantować i przesączyć.
Do 6 probówek wlać po 5 ml
3
wyciągu ziemniaczanego. Do dwóch dodać 10 kropli 1%
roztworu fenolu, do dalszych dwóch 10 kropli 1% roztworu pirokatechiny, a do pozostałych po 10
kropli 1% roztworu pirogalolu. Zawartość probówek wymieszać. Następnie do jednej probówki z
każdej pary dodać 10 kropli 3% roztworu H
2
O
2
, wymieszać i obserwować zmianę zabarwienia. W
probówkach zawierających obok związków fenolowych H
2
O
2
zmiana zabarwienia następuje o
wiele szybciej bowiem równocześnie działają oksydazy i peroksydazy.
Podobną reakcję obserwuje się nawet bez powyższych odczynników, np. na obranym
ziemniaku, który po pewnym czasie sinieje, ponieważ zawarte w nim związki typu o-dwufenoli
ulegają utlenieniu. Z tego samego powodu obrane ze skórki jabłko brązowieje.
2
OH
OH
HO
HO
+ 3 H O
2 2
HO
HO
O
O
H
+ 5 H O + CO
2
2
pirogalol
purpurogalina
(pomarańczowa)
2. WRAŻLIWOŚĆ OKSYDAZ I PEROKSYDAZ NA TEMPERATURĘ
Wykonanie:
Do 3 probówek odmierzyć po 3 ml
wyciągu ziemniaczanego. Dwie probówki ogrzewać na
łaźni wodnej w temperaturze 75 C przez 10 minut. Następnie ostudzić i dodać do pierwszej
probówki 10 kropli pirokatechiny (powinny działać oksydazy), do drugiej 10 kropli 1% roztworu
pirokatechiny i 3% roztworu H
2
O
2
(powinny działać oksydazy i peroksydazy). Trzecią próbówkę z
zawartością zagotować i dodać 10 kropli 1% roztworu pirokatechiny i 10 kropli 3% roztworu H
2
O
2
.
Wynik doświadczenia wskaże, że peroksydazy nie zostały zniszczone przez ogrzewanie w
temperaturze 75 C. Natomiast oksydazy utraciły aktywność. Peroksydazy inaktywują się dopiero
po ogrzaniu we wrzącej łaźni wodnej.
3. WYKRYWANIE KATALAZY
Katalaza (E.C. 1.11.1.6) jest powszechnie występującym w różnych tkankach enzymem
hemoproteinowym o ciężarze cząsteczkowym 240 kDa, optimum pH 6-7, optimum temperatury ok.
50
o
C. Inhibitory katalazy są charakterystyczne dla większości metaloenzymów. Są nimi cyjanki,
fluorki, siarczki, azydki, kwasy i zasady, a także substrat czyli H
2
O
2
(!).

Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 4
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
4
Wykonanie:
Do dwóch probówek wlać po 2 ml wyciągu ziemniaczanego. Jedną probówkę ogrzać do
wrzenia i ostudzić. Do obu probówek dodać po 2 ml
3% H
2
O
2
. Obserwować zmiany.
4. OZNACZANIE KATALAZY METODĄ EULERA-JOSEPHSONA
Szybkość reakcji rozkładu H
2
O
2
przez katalazę zmniejsza się w miarę upływu czasu. Spadek
szybkości spowodowany jest nie tylko wyczerpywaniem się substratu, lecz także niszczącym
działaniem H
2
O
2
(substratu) na białko enzymowe.
Reakcja ta jest początkowo typową reakcją I-go rzędu. Właściwą miarą aktywności
katalitycznej enzymu jest szybkość reakcji w chwili t=0 czyli szybkość początkowa (V
o
),
proporcjonalna do stężenia dodanego enzymu.
Oznaczenie aktywności katalazy można przeprowadzić trzema metodami: manometryczną,
spektrofotometryczną i miareczkową. Ta ostatnia metoda jest prosta i wygodna, polega na
oznaczaniu ubytku substratu przez miareczkowanie manganometryczne próbek pobieranych z
mieszaniny inkubacyjnej (zbuforowany roztwór substratu + roztwór enzymu). Miareczkowanie
H
2
O
2
nadmanganianem przebiega wg równania:
5 H
2
O
2
+ 2 MnO
4
-
+ 6 H
+
→ 5 O
2
+ 2 Mn
2+
+ 8 H
2
O
Na tej podstawie można wyliczyć, że 1 ml
3
0,02 M KMnO
4
utlenia 50 μmol H
2
O
2
.
Zasada metody:
Katalaza rozkłada nadtlenek wodoru na wodę i tlen. Ilość nierozłożonego H
2
O
2
oznacza się
manganometrycznie w próbkach z czynnym i nieczynnym enzymem. Z różnicy wylicza się ilość
rozłożonego nadtlenku wodoru.
2 H
2
O
2
→ 2 H
2
O + O
2
5 H
2
O
2
+ 2 KMnO
4
+ 4 H
2
SO
4
→ 5 O
2
+ 2 KHSO
4
+ 2 MnSO
4
+ 8 H
2
O
Materiał: kapusta lub chrzan
Postępowanie:
30 g świeżego materiału rozdrobnić w mikserze z 200 ml wody z dodatkiem 5 g CaCO
3
i
odwirować (10 min 4500 obrotów/minutę). Do 4 kolbek stożkowych
odmierzyć po 10 ml 0,05 M
H
2
O
2
+ 40 ml
H
2
O zbuforowanej do pH 6,8. Następnie, co 30 sekund, do kolejnych kolb dodawać
po 2 ml wyciągu badanego enzymu. Dokładnie po upływie 5, 7, 9 i 12 minut działania enzymu
przerwać reakcję dodając do kolejnych kolb po 10 ml 1 M H
2
SO
4
. Równocześnie wykonać próbę
kontrolną dodając do roztworu H
2
O
2
10 ml H
2
SO
4
, a dopiero na końcu 2 ml wyciągu enzymu. We
wszystkich próbach odmiareczkować nierozłożony H
2
O
2
0,02 M KMnO
4
.
Opracowanie wyników:
Obliczyć ilość μmoli H
2
O
2
rozłożonego przez enzym. Wyniki przedstawić rysując krzywą
progresji tj. zależność ilości rozłożonego substratu (μmole rozłożonego H
2
O
2
) od czasu. Z wykresu
wyznaczyć szybkość reakcji dla czasu zerowego (V
o
).
B) OZNACZANIE AKTYWNOŚCI HYDROLAZ W MATERIALE BIOLOGICZNYM.
1. WYKRYWANIE AKTYWNOŚCI LIPAZ TRZUSTKOWYCH
Lipazy są esterazami katalizującymi hydrolizę tłuszczów do alkoholu i kwasów tłuszczowych
według schematu:

Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 4
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
5
R
1
-O-CO-R
2
+ H
2
O → R
1
-OH + R
2
-COOH
Lipazy wykazują niewielką specyficzność substratową i katalizują rozkład estrów,
utworzonych zarówno przez kwasy o krótkim jak i o długim łańcuchu, nasycone i nienasycone, oraz
alkohole mające łańcuch krótki lub długi, jedno- lub wielowodorotlenowe. Lipazy występują w
dużym stężeniu m.in. w soku trzustkowym, a ich aktywność wzmagają kwasy żółciowe, które
ułatwiają emulgowanie tłuszczu.
Wykonanie:
Do 5 ml mleka dodać 5 kropli 1% roztworu fenoloftaleiny i parę kropli 1% roztworu węglanu
sodu do lekko różowego zabarwienia. Do tak przygotowanego roztworu dodać skrawek trzustki
świni dokładnie utarty w moździerzu. Probówkę wstawić do łaźni wodnej o temp. 40
o
C.
Obserwować zmianę zabarwienia.
2. WYKRYWANIE AKTYWNOŚCI AMYLAZY TRZUSTKOWEJ
Wszystkie amylazy należą do klasy hydrolaz i podklasy glikozydaz. Amylaza trzustkowa
wykazuje wyższą aktywność od amylazy ślinowej. Enzym ten działa jeszcze w rozcieńczeniu
1: 100 000 000, a w ciągu 30 min 1 mg amylazy trawi 20 g skrobi. Do tej aktywności niezbędne są
niektóre jony nieorganiczne, szczególnie chlorki. Amylaza trzustkowa, w odróżnieniu od ślinowej,
hydrolizuje skrobię niegotowaną.
Wykonanie:
Do 3 ml 1% roztworu skrobi dodać kroplę 0,2% roztworu jodu w KI, parę kropli 1% roztworu
NaCl i skrawek utartej trzustki. Wstawić do łaźni wodnej o temp. 40
o
C. Obserwować odbarwienie
się zawartości probówki będące wynikiem postępującej hydrolizy skrobi.
3. WYKRYWANIE AKTYWNOŚCI PEPSYNY
Pepsyna jest proteazą produkowaną przez komórki główne gruczołów błony śluzowej żołądka
w postaci nieczynnej – pepsynogenu, który przez odszczepienie silnie zasadowego polipeptydu (o
dużej zawartości argininy) przechodzi w formę czynną. Pepsyna podobnie jak większość proteaz
wykazuje małą specyficzność substratową. Trawienie białek z jej udziałem nie wychodzi poza
stadium dużych fragmentów polipeptydowych. Pepsyna nie rozkłada keratyn i protamin.
Wykonanie:
Do dwóch probówek oznaczonych literami A i B odmierzyć po 2,5 ml roztworu kazeiny*. Do
probówki A dodać 0,75 ml 0,2% roztworu pepsyny w 0,1 M roztworze HCl, a do probówki B 0,75
ml przegotowanego i ostudzonego roztworu pepsyny. Obie probówki wstawić do łaźni wodnej o
temp. 40
o
C na 20 min. Po tym czasie do obu probówek dodać 10 kropli 10% roztworu CH
3
COONa.
W probówce B pojawia się obfity osad kazeiny, w probówce A roztwór pozostaje klarowny lub
tylko nieznacznie mętnieje ponieważ kazeina pod wpływem działania pepsyny ulega hydrolizie do
rozpuszczalnych związków prostszych. W probówce B hydroliza nie nastąpiła z powodu termicznej
inaktywacji enzymu.
* do 0,2 g kazeiny dodać 10 ml wody. 10 ml 0,1 M roztworu NaOH i 80 ml wody ogrzanej do temperatury 60
o
C. Po
rozpuszczeniu kazeiny wlać roztwór, mieszając, do 100 ml 0,1 M roztworu HCl. Roztwór kazeiny powinien mieć pH
około 1,4. W celu konserwacji dodać kroplę toluenu i przechowywać w lodówce.
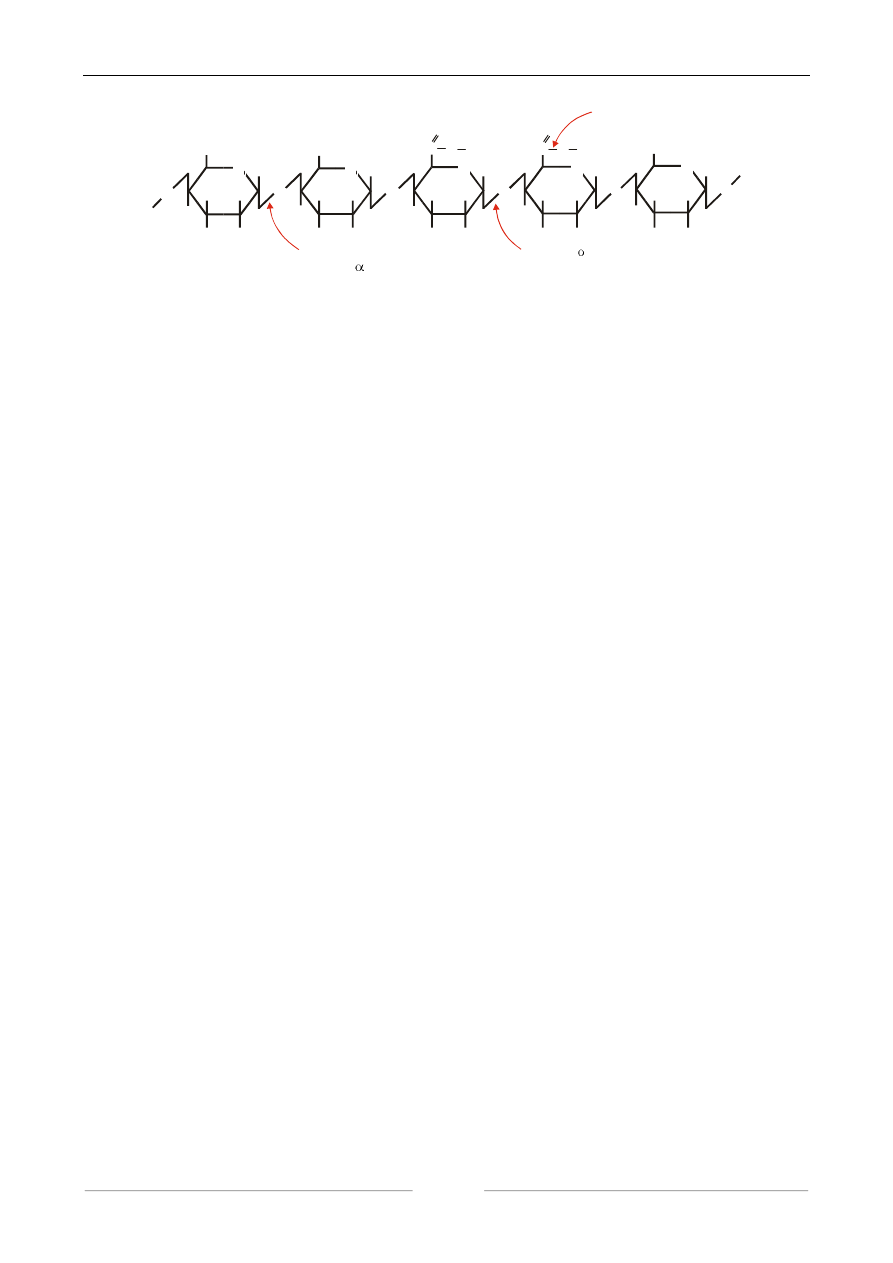
4. WYKRYWANIE AKTYWNOŚCI PEKTYNAZOWEJ
Enzymy pektynolityczne (pektolity) stanowią mieszaninę kilku enzymów (protopektynaz,
esteraz pektynowych, liaz pektynowych, liaz kwasu pektynowego, poligalakturonaz)
niejednorodnych pod względem systematycznym. Katalizują one rozkład pektyn (zgodnie ze
schematem przedstawionym poniżej) i odgrywają istotną rolę w przemyśle spożywczym. Jednym ze
sposobów oznaczania ich aktywności jest pomiar spadku lepkości roztworu pektyny.
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 4
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
6
O
O
O
O
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
O
COOH
COOH
COOH
O
pektynoesteraza
poligalakturonaza i
liaza poli- -1,4-galakturonianu
liaza poli- 1,4-metylogalakturonianu
-
O
C
CH
3
O
O
C
CH
3
O
O
O
O
O
O
Rysunek. Miejsce ataku katalitycznego enzymów pektynolitycznych na łańcuch pektyny.
Wykonanie:
Przygotować 100 ml 0,5% roztworu pektyny w 20% roztworze sacharozy. W tym celu
odważyć 0,5 g pektyny, wsypać do 100 ml gorącego 20% roztworu sacharozy (zakwaszonego 25%
kwasem cytrynowym w proporcji 1 ml kwasu na 100 ml sacharozy) intensywnie mieszając.
Doprowadzić do wrzenia i mieszając cały czas ostudzić do temperatury pokojowej (w razie
potrzeby przesączyć przez gazę).
Zmierzyć lepkość uzyskanego żelu pektynowego w wiskozymetrze Höplera. Następnie żel
wlać z powrotem do zlewki na 50 ml. Z tego żelu odmierzyć 40 ml i dodać 0,8 ml roztworu
enzymatycznego preparatu pektynolitycznego "Pektopol PT" (rozcieńczonego 1:20) i w tym
momencie zanotować czas 0 minut. Tak przygotowanym żelem napełnić wiskozymetr i mierzyć
lepkość w odstępach trzyminutowych.
Opracowanie wyników:
Narysować wykres zmiany lepkości w czasie, odcinając na osi rzędnych czas opadania w
sekundach, a na osi odciętych czas działania preparatu pektynolitycznego "Pektopol PT" w
minutach.
Ostatnie zmiany: 13.02.2013
Wyszukiwarka
Podobne podstrony:
Biochemia(ZCz)Cw7 Otrzymywanie Nieznany (2)
Biochemia(ZCz)Cw5 Wlasciwosci f Nieznany
Biochemia(ZCz)Cw6 Oznaczanie za Nieznany (2)
Biochemia(ZCz)Cw6 Oznaczanie za Nieznany (2)
biochemia cukry instrukcja id 8 Nieznany (2)
biochemia kolo id 86264 Nieznany (2)
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
biochemia egzam1 id 86330 Nieznany
Cw 2 Biochemia OS id 121642 Nieznany
Nowy folder (3) wkr 2012 cw4 I1 Nieznany
Biochemia Wyklad 2 id 86540 Nieznany (2)
Biochemia II Wypasiony Egzamin Nieznany (2)
15 BIOCHEMIA 2008 Metabolizm we Nieznany
# Skrypt Biochemia czesc4 id 30 Nieznany
Biochemia 8K Fosforylacja oksyd Nieznany
BIOCHEMIA egzamin2 id 86591 Nieznany
Biochemia(ŻCz)Ćw2 Właściwości fizyko chemiczne białek
Biochemia(ŻCz)Ćw3 Wyznaczanie stałej Michaelisa Km
więcej podobnych podstron