
Stan termodynamiczny jest to stan wkładu
termodynamicznego, który opisuje tzw. równanie stanu wiążące
parametry makroskopowe tego układu (np. ciśnienie, objętość,
liczbę cząsteczek)z temperaturą. W najprostszym przypadku gazu
doskonałego jest to równanie Clapeyrona
p V
nRT
⋅ =
Do określania substancji służą :
-masa m[kg],
-liczba cząstek n [kmol], liczba Avogadra N
a
=6,02283
•
10
26
[drobin/kmol],
-objętość gazu w określonych warunkach V
u
[um
3
],
Umowny metr sześcienny jest to ilość substancji która w
warunkach umownych zajmuje objętość 1 m
3
.
Związki pomiędzy ilościami substancji różnych jednostkach
1kmol~Mkg~22,4um3
G=Mn (każdy mol ma M. kilogramów)
G=M/22,4 Vu
Zerowa zasada termodynamiki
Jeżeli dwa ciała są w równowadze z trzecim ciałem tzn. że są
wszystkie w równowadze. Z zasady tej wynika istnienie funkcji
stanu, zwanej temperaturą empiryczną, o tej własności, że dwa
ciała są w równowadze termicznej wtedy i tylko wtedy gdy ich
temperatury empiryczne są sobie równe.
Temperaturą empiryczną nazywa się każdą wielkość fizyczną
taką, że dwa układy znajdują się w równowadze termicznej
wtedy i tylko wtedy, gdy ich temperatury empiryczne są sobie
równe.
Nadciśnienie - ciśnienie występujące w danym układzie, wyższe
od ciśnienia otoczenia.
Ciśnienie dynamiczne - to ciśnienie powstające w wyniku
izentropowego zahamowania strumienia płynu do prędkości
równej zeru i zmiany jego energii kinetycznej w potencjalną.
Dla płynów nieściśliwych
2
2
ρω
=
d
P
Równanie stanu gazu doskonałego:
pV=RT
p - ciśnienie [Pa]; R - stała gazowa;
pV=n(MR)T
V - objętość właściwa [m
3
/kg];
(MR)-8314,7[J/kmolK]; T - temperatura absolutna gazu [K];
Układ termodynamiczny - część przestrzeni wyodrębniona za
pomocą abstrakcyjnej osłony, nazywanej kontrolną.
-układ odosobniony (izolowany) - jest odgraniczony od otoczenia
osłoną uniemożliwiającą zarówno przepływanie substancji, jak i
przenikanie energii;
-układ zamknięty - substancja nie może przepływać;
-układ otwarty - substancja może przepływać;
-układ jednostronnie otwarty - substancja przepływa tylko w
jednym kierunku,
-układ przepływowy - otwarty, przez którego granice przepływa
substancja zarówno do wewnątrz jak i na zewnątrz,
Prawo Daltona - Suma ciśnień składnikowych p
i
wszystkich
składników roztworu gazów doskonałych jest równa jest równa
ciśnieniu całkowitemu roztworu p.
p
p
i
i
∑
=
Praca absolutna:
L
pdV
1 2
1
2
−
=
∫
W układzie p-V pracę absolutną przemiany przedstawia
przedstawia pole pod linią zależności p=p(V).
Praca zewnętrzna przemiany - praca jaką wykonuje gaz na
pokonanie sił zewnętrznych (np. tarcia).
L
L
L
z
F
=
−
−
−
1 2
1 2
Praca użyteczna przemiany
L
p
p dV
L
pdv
p dV
L
pdV
p V
V
L
L
p V
V
u
u
u
u
1 2
0
1
2
1 2
1
2
0
1
2
1 2
1
2
0
2
1
1 2
1 2
0
2
1
−
−
−
−
−
=
−
=
−
=
−
−
=
−
−
∫
∫
∫
∫
(
)
(
)
(
)
Praca techniczna przemiany
Lt = L1-2 + p1v1 – p2v2
( )
∫
−
=
2
1
p
p
t
dp
p
v
L
Związek pomiędzy pracą absolutną a techniczną:

Lt1-2 = L1-2 + p1v1 – p2v2
Ciepło przemiany:
Q1-2 = Qz1-2 + Qf1-2 [J]
Qf1-2 = Lf1-2
Pojemność cieplna właściwa - W odniesieniu do 1kg i przy
nieskończenie małym przyroście temp. Stosunek ciepła
przemiany do przyrostu temp. podczas tej przemiany.
C = dqc/dT C = dQc/GdT
Cv(T;V) = dqv/dT
Cp(T;p) = dqp/dT
Wzór na średnią w przedziale T1,T2 pojemność cieplną
właściwą:
(
)
(
)
[
]
0
1
T
T
0
2
T
T
1
T
T
T
T
C
T
T
C
T
T
1
C
1
0
2
0
2
1
−
−
−
−
=
α
Związek pomiędzy c
p
i c
y
:
κ
= c
p
/c
v
(Mc
p
) =
κ
(MC
v
)
c
p
– c
v
= R (Mc
p
) – (Mc
v
) = (MR) = 8,314 [kJ/(kmol*K)]
c
p
– ciepło właściwe przy stałym ciśnieniu
c
v
– ciepło właściwe przy stałej objętości
Pierwsza zasada dla układu przepływowego:
∆
U = U
2
– U
1
= I
d
– I
w
+ Qz
1-2
– Lz
1-2
(dla skończonego czasu)
Energia układu zamkniętego może się zmienić tylko na skutek
przekazywania z zewnątrz ciepła. Ciepło powoduje wzrost
energii wewnętrznej układu.
U- energia wew.
I – entalpia
Qz
1-2
– ciepło dopr.
I = U + pV
Pierwsza zasada dla układu zamkniętego:
Ciepło doprowadzone do układu zamkniętego z zewnątrz jest
zużywane na wzrost jego energii wew. oraz na wykonanie pracy
zew.
∆
U = U
2
– U
1
= Qz
1-2
– Lz
1-2
U
2
– U
1
= Qz
1-2
+ Qf
1-2
– Lz
1-2
– Lf
1-2
Qf
1-2
= Lf
1-2
U
2
– U
1
= Qz
1-2
– Lz
1-2
Entalpia jest to suma U + pV. Entalpia jest znamieniem stanu,
gdyż „U” jak i „p” są znamionami stanu.
i = u + pv; I = U + pv; di = c
p
dT
u – energia właściwa wew.
v – objętość właściwa
i – entalpia właściwa
Rodzaje przemian termodynamicznych:
-odwracalne (brak strat energii)
-nieodwracalne (dyspersjia energii, rozpraszanie)
-równowagowe (składają się z elementów równ. Termodyn.)
-izobara p = idem;
v
2
/v
1
= T
2
/T
1
-izochora v = idem;
p
2
/p
1
= T
2
/T
1
-izoterma T = idem;
pv = idem
-izentropa S = idem
idem
p
T
idem
Tv
idem
pv
=
=
=
−
−
κ
κ
κ
κ
1
1
;
;
-izentalpa i = idem
-politropa pv
n
= idem; n = idem
Energia wewnętrzna i entalpia gazu doskonałego:
Energia wew. zależą od temp.
Gaz doskonały
U = cv T
i = cp T
DU = cv dT;
di = cp dT; cp – cv = R
p = idem
Entalpia:
Energia:
( )
( )
∑
∑
⋅
=
⋅
=
i
i
i
i
i
Mi
z
Mi
i
g
i
( )
( )
∑
∑
⋅
=
⋅
=
i
i
i
i
i
Mu
z
Mu
u
g
u
Przemiana izochoryczna:
Jest to przemiana zachodząca przy stałej objętości, a przy
rozpatrywaniu stałej ilości substancji, jest to także przemiana
przy stałej objętości właściwej.
p/T =idem; v1 = v2 = v =idem;
dv = 0
Praca
absolutna,
techniczna
i
ciepło
przemiany
izochorycznej:
(
)
(
)
(
)
1
2
v
1
2
2
1
v
p
p
2
1
2
1
2
1
t
V
V
2
1
T
T
C
U
U
q
T
T
R
p
p
V
Vdp
L
0
pdV
L
2
1
2
1
−
=
−
=
−
=
−
=
=
=
=
−
−
−
∫
∫
Przemiana izobaryczna:
Przemiana przy stałym ciśnieniu p = idem, T/v = idem, v/T =
idem
Ciepło przemiany izobarycznej zużywane jest w całości na
przyrost entalpii.
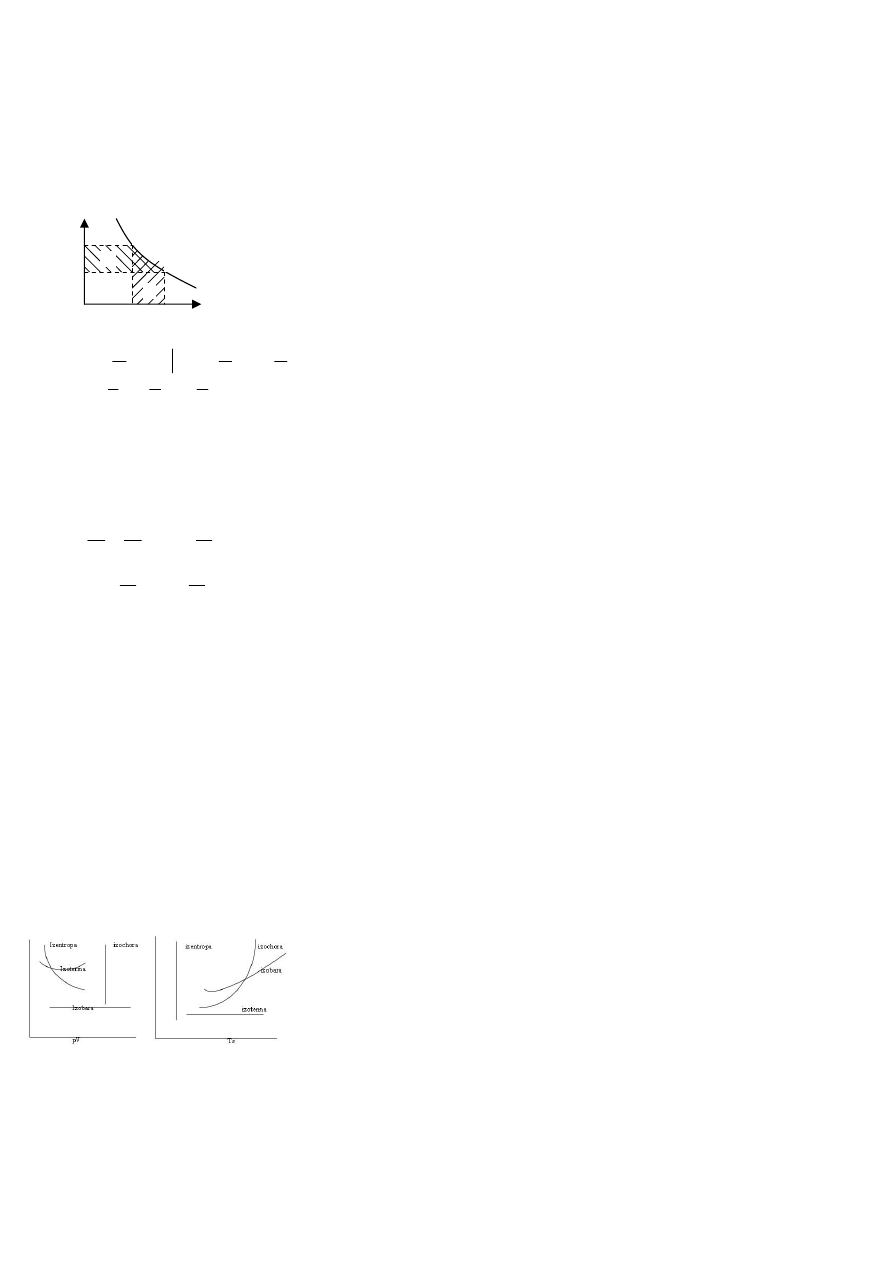
Wzory na pracę absolutną, techniczną i ciepło przemiany
izobarycznej:
(
)
(
)
(
)
1
2
p
1
2
2
1
p
p
p
2
1
pt
V
V
1
2
1
2
2
1
p
T
T
c
i
i
q
0
Vdp
L
T
T
R
V
V
p
pdV
L
2
1
2
1
−
=
−
=
=
−
=
−
=
−
=
=
−
−
−
∫
∫
Przemiana izotermiczna:
Jest to przemiana przy stałej temp.
T
1
= T
2
= T = idem
dT = 0
p*V = idem
Przemiany izotermiczna gazów doskonałych są przemianami
izoenergetycznymi (u=idem) oraz izoentalpowymi (i=idem).
Wzory na pracę absolutną, techniczną i ciepło przemiany
izotermicznej:
∫
∫
=
=
=
=
=
−
2
1
2
1
2
1
V
V
V
V
1
2
1
1
1
2
V
V
2
1
T
V
V
ln
V
p
V
V
ln
RT
V
ln
RT
V
dV
RT
pdV
L
∫
=
⇒
=
=
=
=
−
=
−
−
2
1
p
p
2
2
1
1
2
1
T
1
2
1
1
1
2
2
1
2
1
t
V
p
V
p
L
V
V
ln
V
p
V
V
ln
RT
p
p
ln
RT
Vdp
L
Q
T 1-2
= L
T 1-2
Przemiana izentropowa
Przemiany przy stałej entropii (s), a w przypadku stałej ilości
substancji są przemianami przy stałej entropii właściwej.
gaz doskon. pV
κ
= idem
TV
κ
-1
= idem; T/p
(
κ
-1)/
κ
=
idem
Wzory na pracę absolutną, techniczną i ciepło przemiany
izentropowej:
(
)
(
)
(
)
(
)
(
)
(
)
0
L
0
q
L
V
p
V
p
1
V
p
V
p
1
T
T
c
i
i
L
T
T
c
U
U
L
V
p
V
p
1
1
V
V
1
idem
dV
V
idem
pdV
L
ad
2
1
ad
2
1
ad
2
2
1
1
1
1
2
2
2
1
p
2
1
2
1
t
2
1
v
2
1
2
1
ad
1
1
2
2
1
1
1
2
V
V
V
V
2
1
ad
2
1
2
1
=
=
κ
=
−
−
κ
κ
=
−
κ
−
κ
=
−
=
−
=
−
=
−
=
−
κ
−
=
−
κ
−
=
=
=
−
−
−
−
κ
−
κ
−
κ
−
∫
∫
Przemiana politropowa - przemianę dla której zależność p od V
da się przedstawić za pomocą równania pV
n
=idem dla n=iden
(dowolna stała od -
≡
do +
≡
) oraz C
n
=idem
Dla przemiany politropowej można wyprowadzić następujące
zależności:
p1/p2=(v2/v1)
n
(p1/p2)
n-1/n
=t1/t2
t1/t2=(v2/v1)
n-1
Praca absolutna przemiany
l
n1=2
=-
!
v1
v2
p dV= 1/n-1(p1v1-p2v2)
Entropia - termodynamiczna funkcja, która wraz z temperaturą
tworzy taki układ parametrów, że pole pod krzywą przemiany na
wykresie T-S jest ciepłem przemiany .
Entropia właściwa dla gazów doskonałych wyraża się wzorem :
s = c
p
ln T –R ln p+s
1
s = c
v
ln V + R ln V +s
2
s = c
p
ln V + c
v
ln p+ s
3
Jeśli poziom odniesienia określony jest parametrami p0 T0 V0 to
entropię właściwą można wyrazić wzorami :
s = cp ln T/T0 –R ln p/p0
s = cv ln T/T0 + R ln V/V0
s = cp ln V/V0 + cv ln p/p0
Wykresy przemian charakterystycznych w układach p-v i T-
s:
Wielkości intensywne - np. temperatuta ,ciśnienie objętość
właściwa – nie zalerzy od wielkości układu.
Wielkości ekstensywne - np. objętość , energia , entropia –
zalerzą od wielkości układu i podlegają prawom sumowania.
Obiegi termodynamiczne - jest to zespół przemian , w których
stan końcowy czynnika pokrywa się ze stanem początkowym .
Dla wszystkich obiegów prawdziwa jest równość L
ob.
= Q
ob.
Obiegi prawo bieżne (silnikowe):
Sprawność obiegu silnikowego
η
ob. = Lob./Qob. = Qob.+. – Qob.-/ Qob.+
L
L
T
1
2

Obieg lewo bieżny(obieg chłodniczy):
sprawność chłodnicza obiegu chłodniczego :
η
= Q
ob.
+
/L
ob.
II zasady termodynamiki:
Oswald - nie jest możliwe zbudowanie perpetum mobile II
rodzaju (jest to silnik lub prawo bieżne urządzenie obiegowe
pracujące ze sprawnością równą 1.
Claucius - ciepło nie może samorzutnie przechodzić z ciała o
temperaturze niższej do ciała o temperaturze wyższej.
Zasadę wzrostu entropii Clauciusa:
Suma przyrostów entropii:
π
=
Σ∆
Si ciał tworzących układ
odosobniony musi być zawsze >0
Jest to matematyczne sformułowanie II z.t. gdy
Π
>0 proces jest
nieodwracalny
π
=0 proces jest odwracalny (nie istnieje w
przyrodzie).
Prawo Gouya-Stodoli dla układu zamkniętego:
L
z1-2
= U
1
– U
2
+ (S
2
-S
1
) T
0
-
Π
T
0
aby praca zewnętrzna L
z1-2
była pracą maksymalną to przyrost
entropii
Π
musi = 0 (nie możliwe w przyrodzie)
Praca max wyraża się wzorem L
z1-2 max
= U
1
– U
2
+ (S
2
-S
1
) T
0.
Prawo Gouya-Stodoli dla układu otwartego:
L
z1-2
= I
1
– I
2
+ (S
1
-S
2
) T
0
-
Π
T
0
aby praca zewnętrzna L
z1-2
była pracą maksymalną to przyrost
entropii
Π
musi = 0 (nie możliwe w przyrodzie)
Praca max wyraża się wzorem L
z1-2 max
= I
1
– I
2
+ (S
1
-S
2
) T
0
Egzergia fizyczna:
Egzergia – max zdolność ciała do wykonywania pracy w
naturalnym otoczeniu B=B
k
+B
p
+B
f
gdzie:
B – egzergia strugi substancji
B
k
– egzergia potencjalna
B
t
– egzergia termiczna
B
t
= B
f
+B
ch
gdzie B
f
= egzergia fizyczna, B
ch
– egzergia chemiczna
b
f
= i
f
– T
0
s
f
lub dla gazu doskonałego b
f
= cp (T-T
0
-T
0
lnT /
T
0
)+T
0
R ln p/p
0
B
j
– egzergia jądrowa
Bi – inne składniki egzergii
Podać prawo znikania egzergii:
otoczenia
a
temperatyr
T
egzergii
przyrost
S
gdzie
T
egzergii
strata
B
B
L
n
f
f
z
t
−
−
∆
=
⋅
=
−
−
−
=
−
0
0
2
1
2
1
π
π
δβ
δβ
δβ
Przyczyny strat egzergii:
-przepływ ciepła przy skończonym spadku;
-mieszanie cieł o różnych składach chemicznych;
-spadek ciśnienia płynu spowodowany tarciem przy przepływie;
Stopień suchości pary wilgotnej:
Stopień suchości pary wilgotnej jest to stosunek ilości pary
nasyconej suchej m
pns
do ilości pary nasyconej wilgotnej
(mokrej)
M
pnw
. Ilość pary nasyconej wilgotnej jest suma ilości n
pns
i cieczy
nasyconej m.
cn
.
cn
pns
pns
pnw
pns
m
m
m
m
m
X
+
=
=
Objętość właściwą i entropię właściwą pary wilgotnej:
Vx=(1-xV)’+xV’’=V’+x(V”-V’)
1 kg pary mokrej zawiera:
- x kg pary nasyconej suchej o objętości V”
- (1-x) kg cieczy o objętości V’
entropia właściwa:
ρ
x=(1-x)S’ +xS”=S’+x(S”-S’)
para wilgotna: Vx,V”, Sx<S” dla p=idem lub T=idem
Ciepło parowania - ciepło potrzebne do otrzymania pary
nasyconej, suchej z cieczy o tym samym ciśnieniu i tej samej
temperaturze (r-ciepło potrzebne do całkowitego odparowania
1 kg wody)
Ciepło zawrzenia - (q
z
) ciepło potrzebne do ogrzania 1 kg
cieczy o temperaturze topnienia tt do temperatury wrzenia
Ciepło odparowania - suma ciepła zawrzenia i ciepła parowania
λ
=q
z
+r
Dławienie - proces podczas którego praca ekspansji czynnika
zostaje zużyta do pokonania tarcia
1. dławienie adiabatyczno-izoenergrtyczne U
1
=U
2
T
1
=T
2
2. dławienie adiabatyczno-izentropowe (układ zamknięty) i
1
=i
2
T
1
=T
2
3. dławienie izentropowe (układ otwarty i=idem)
i
1
, r
1
wartości z tabeli pary wilgotnej na
podstawie zmierzonego ciśnienia
i
2
wartość zmierzona ciśnienia i temperatury
pary przegrzanej
Temperatura punktu rosy - w parze znikają ostatnie krople
cieczy. Przy parowaniu substancji jednorodnej temperatura
jest podawana w punktach pęcherzyków ( pojawienie się w
cieczy pierwszych pęcherzyków pary) i punktach rosy.
Wilgotnośc bezwzględna
ρ
p jest stosynkiem ilości pary m.
p
[kg]
do
objętości V[m
3
] gazu wilgotnego. Jest gęstością pary przy
ciśnieniu
składnikowego p
p
i temperaturze gazu wilgotnego. Jest
maksymalna,
gdy tempeartura gazu staje się równa temperaturze
pary.
V
Gp
T
p
p
V
m
p
p
p
p
=
⋅
=
=
ρ
Wilgotność względna jest stosunkiem wilgotności
bezwzględnych
ρ
p
do maksymalnej wilgotności
ρ
p
” dla tej samej temperatury. Może
być
stosunkiem ciśnienia składnikowego pary p
p
do ciśnienia
maksymalnego pary p
p max
przy tej samej temperaturze
ρ
p max
=
ρ
”
=ρ
n
dla temperatury powietrza wilgotnego
1
0
max
"
≤
≤
=
=
ϕ
ρ
ρ
ϕ
T
p
p
T
p
p
p
p
Stopień zawilżenia powietrza wilogotnego jest stosunkiem
pary wodnej do powietrza suchego:
pn
pn
ps
pw
s
p
ps
pw
s
p
p
kmol
kmol
m
m
Xm
molowy
stpoie ń
kg
g
kg
kg
G
G
X
ϕ
ϕ
−
⋅
=
=
=
=
662
,
0
Równanie stanu van der Waalsa
(
)
gazu
danego
kg
spręprę
możoż
której
do
objębjętoś
a
najmniejsz
b
mi
cząząstecz
mięięd
ia
przyciąrzy
sila
V
a
RT
b
V
V
a
p
1
,
2
2
−
−
=
−
+
Wykres wody p(t):
Tr – k linia parownia
0 -Tr linia sublimacji i
resublimacji
Tr --- pTr = 611,2 Pa
Tr = 273, 115 K
K --- pk =22,115 Mpa
Tk = 647,27 K
Wykres wody p(v):
Cn – ciecz nagrzana
pw – para wilgotna
pp – para przegrzana
pn – para nagrzana
Wykres wody t(s):
Wykres wody i(s):
Wykres i
1+x
-x moliera dla powietrza wilgotnego:
p=idem
I
2
-I
1
=Q
1-2
-L
t12
Qr
1
=I
2
-I
1
=[(i
1
+x)
2
-(i
1
+x)
1
]Gs
Gs+(i
2
-i
1
)Gs
1
1
2
1
r
i
i
X
−
=

Wykres i
1+x
-x mieszanie dwóch strumieni powietrza:
Wykres amagata:
Wirtualna równania stanu :
...
)
(
)
(
)
(
1
3
2
+
+
+
+
=
=
V
T
D
V
T
C
V
T
B
RT
V
z
φ
φ
-stopień ściśliwości
z=1 dla gazów doskonałych
z>1 objętość jest większa niż w gazie doskonałym
z<1 objętość jest mniejsza (trzy warunki dla T=idem,
p=idem)
B,C,D
współczynniki wirtualne, są funkcją temperatury,
odpowiadają sumowaniu efektów oddziaływania na odległość
odpowiedniej liczby cząstek między sobą (B między 2 cząstkami, a C
między 3). Wyznaczaja się je empirycznie lub przy pewnych
załozeniach.
Oblicza się teretycznymi metodami fizyki statystycznej
1
2
1
2
1
2
2
1
x
x
x
x
L
x
x
x
x
L
m
m
−
−
=
−
−
=
Wyszukiwarka
Podobne podstrony:
Futsal mala pilka id 182381 Nieznany
Mala duza id 278114 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
więcej podobnych podstron