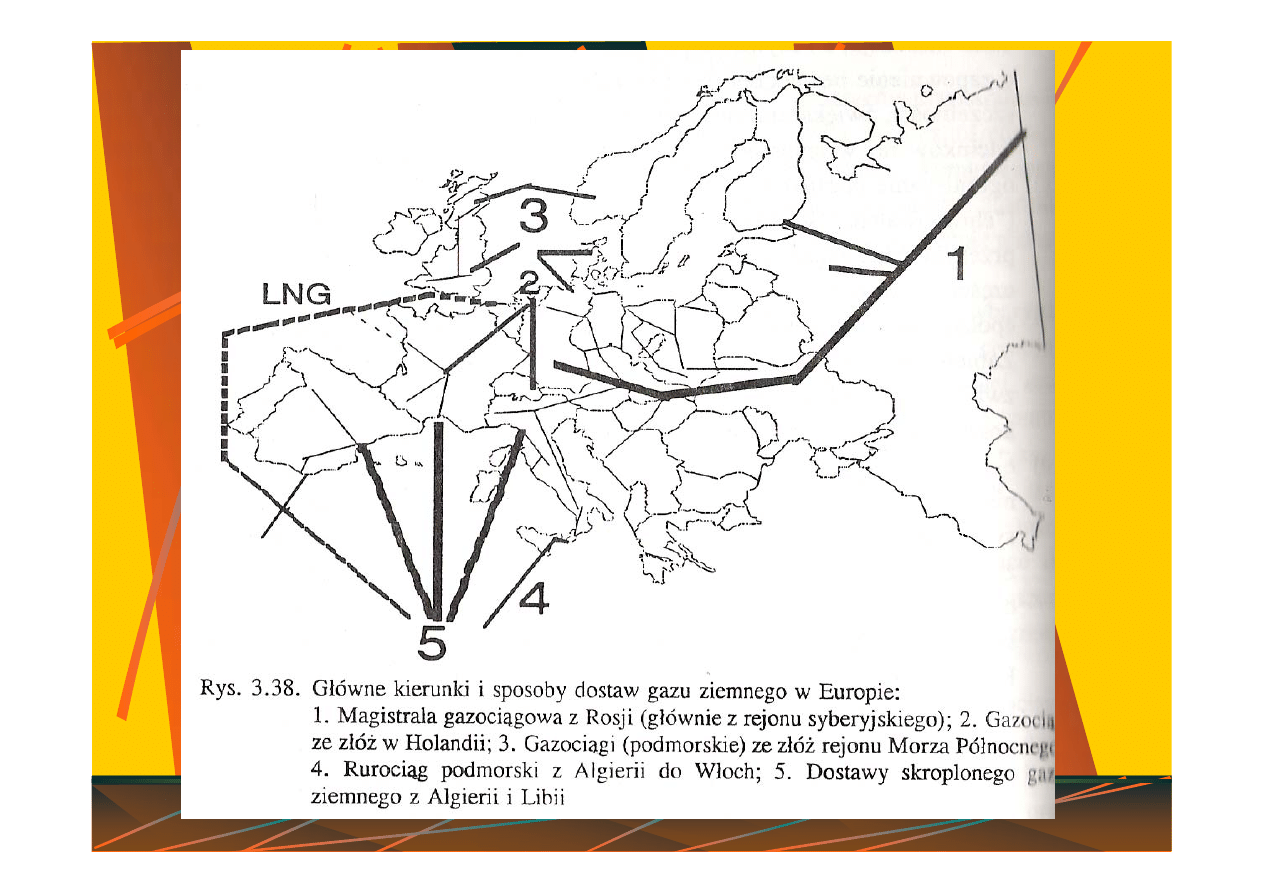
Pr. Zb., Technologia chemiczna –
surowce, Wydawnictwo Politechniki Śląskiej, Gliwice 1997.

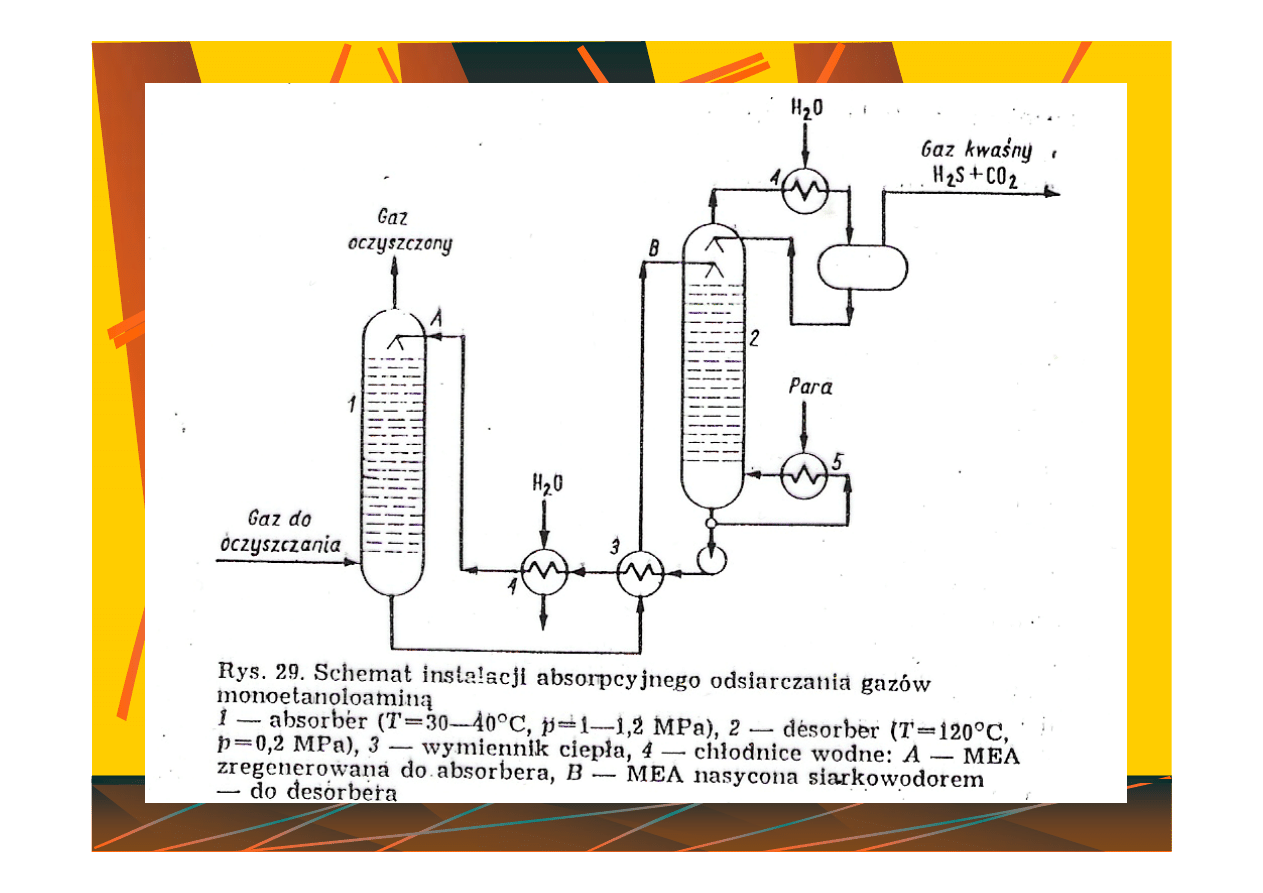
Absorpcja z reakcją
chemiczną
Absorbent
Odwracalne reakcje kwas + zasada
Węglan potasu
K
2
CO
3
+ CO
2
+ H
2
O = 2 KHCO
3
___________________________________________________________
Aminy pierwszorzędowe
2RNH
2
+ H
2
S = (RNH
3
)
2
S
2RNH
2
+ CO
2
+ H
2
O = (RNH
3
)
2
CO
3
Monoetanoloamina
(MEA)
R = ─CH
2
CH
2
OH
2HOCH
2
CH
2
NH
2
+ H
2
S = (HOCH
2
CH
2
NH
3
)
2
S
2HOCH
2
CH
2
NH
2
+CO
2
+ H
2
O = (HOCH
2
CH
2
NH
3
)
2
CO
3
Diglikoloamina
R = ─CH
2
CH
2
OCH
2
CH
2
OH
(eter β-hydroksy-
β’aminoetylowy)
___________________________________________________________
Aminy drugorzędowe
2R
2
NH + H
2
S = (R
2
NH
2
)
2
S
2R
2
NH + CO
2
+ H
2
O = (R
2
NH
2
)
2
CO
3
Dietanoloamina
(DEA)
R = ─CH
2
CH
2
OH
2(HOCH
2
CH
2
)
2
NH+H
2
S = ((HOCH
2
CH
2
)
2
NH
2
)
2
S
2(HOCH
2
CH
2
)
2
NH+CO
2
+H
2
O
= ((HOCH
2
CH
2
)
2
NH
2
)
2
CO
3
Diizopropanoloamina
R = ─CH
2
CH(OH) CH
3

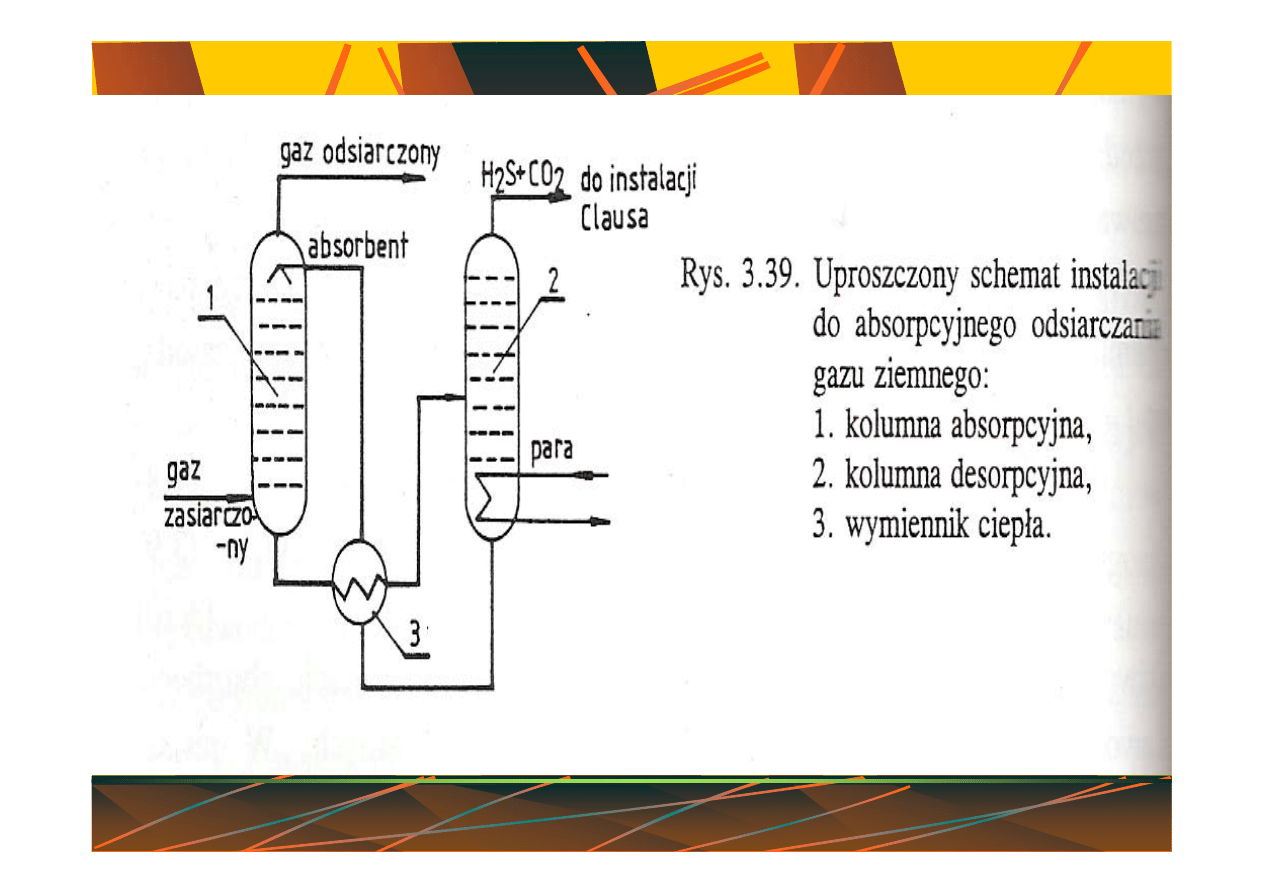
Pr. Zb., Technologia chemiczna –
surowce, Wydawnictwo Politechniki Śląskiej, Gliwice 1997
.
Odsiarczanie, II
st.
Odsiarczanie, I st.
Reforming, I st.
Reforming, II
st.
CS
2
+ 4H
2
= CH
4
+ 2H
2
S
400
0
C, 3 MPa, kat. niklowo -
molibdenowy
ZnO
+ H
2
S = ZnS + H
2
O
400
0
C, 3 MPa,
CH
4
+ H
2
O = CO + 3H
2
– 206 kJ
850
0
C, 3 MPa, katalizator Ni
CH
4
+ ½O
2
= CO + 2H
2
+ 35
kJ
1100
0
C, 3 MPa, katalizator Ni
Surowy gaz do syntezy
Gaz ziemny
CH
4
+ H
2
O =
= CO + 3H
2
– 206 kJ
CO + H
2
O = CO
2
+ H
2
+ 42 kJ
CO + H
2
= C + H
2
O + 120 kJ

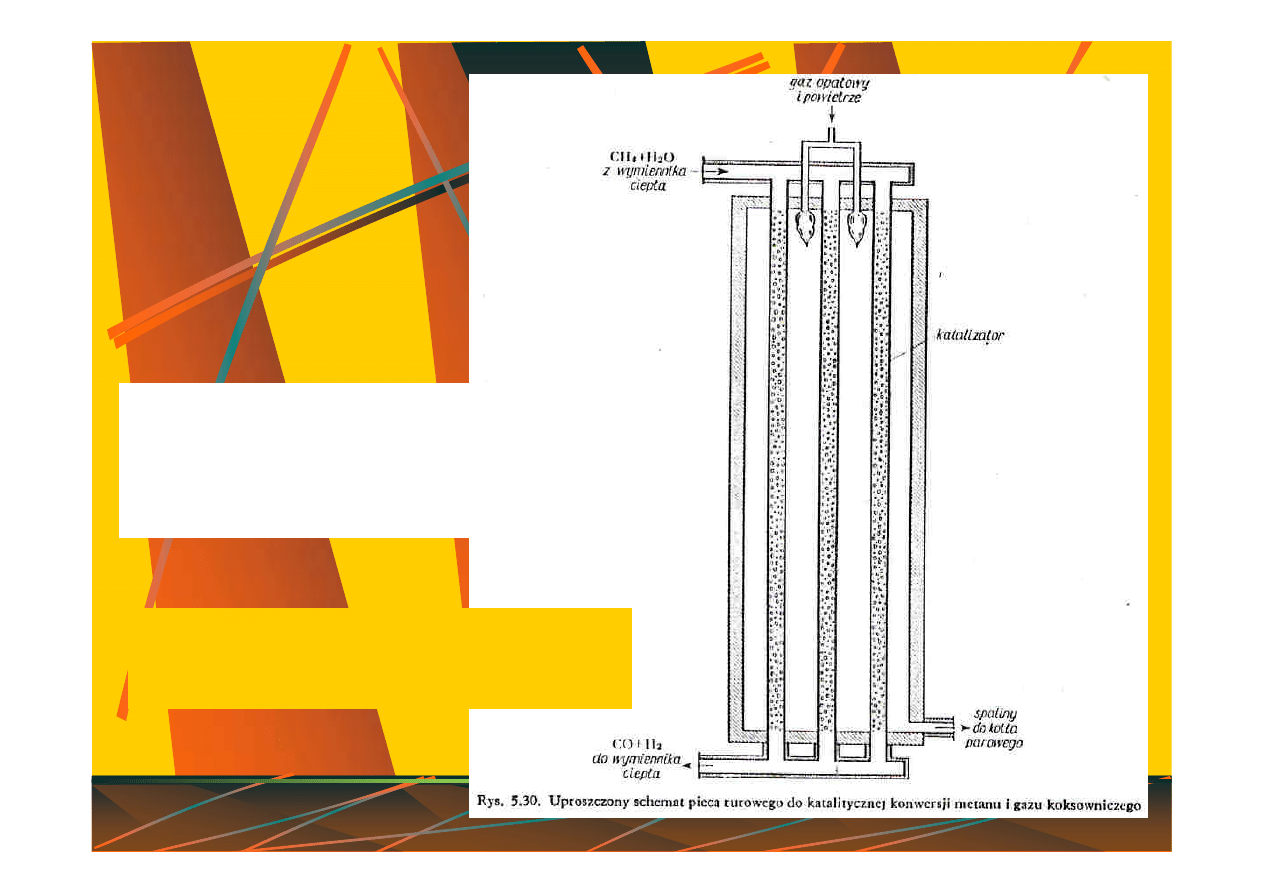
Uproszczony schemat pieca
rurowego do katalitycznej
konwersji metanu lub gazu
koksowniczego
CH
4
+ H
2
O
z wymiennika ciepła
CO + H
2
do wymiennika ciepła
katalizator
Produkty z
IIst. reformingu
Do produkcji pary
= CO + 2H
2
+ 35 kJ
CH
4
+
½
O
2
=
CH
4
+ 2O
2
= CO
2
+ 2 H
2
O + 798 kJ
Konwersja CO
NTKCO
Konwersja CO
WTKCO
Absorpcja CO
2
, I st.
Absorpcja CO
2
, II
st.
CO + 3H
2
= CH
4
+ H
2
O +
206 kJ
350
0
C, katalizator Ni
CO
+ H
2
O = CO
2
+ H
2
+ 42
kJ
400
0
C, 3 MPa, katalizator Fe-Cr
CO
+ H
2
O = CO
2
+ H
2
+ 42
kJ
200
0
C, 3 MPa, katalizator Cu-Zn
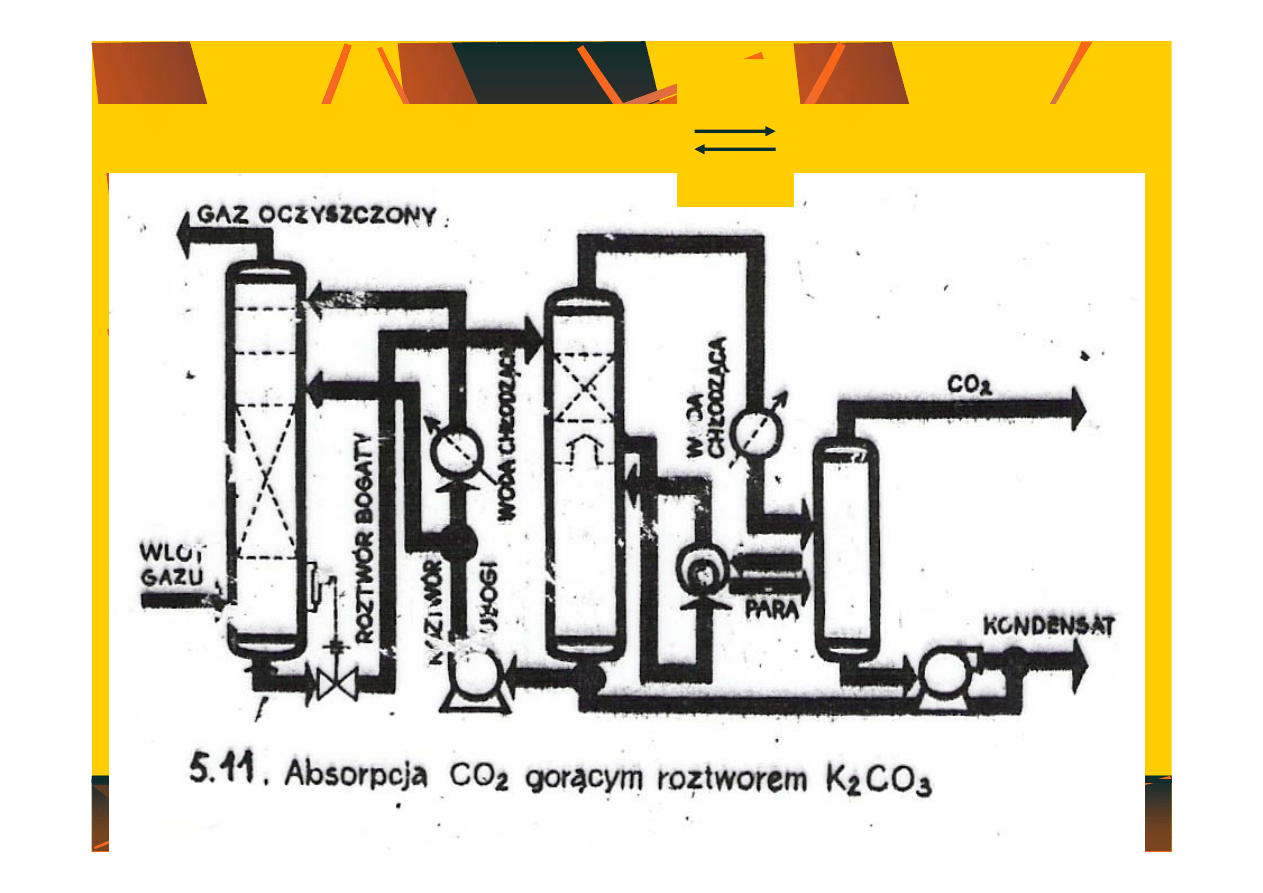
Absorpcja fizyczna, 40
0
C, 3 MPa
Desorpcja, 110
0
C, 0,1 MPa
K
2
CO
3
+ CO
2
+ H
2
O = 2 KHCO
3
110
0
C, absorp. 1,5 –
3 MPa, desorp. 0,1 MPa
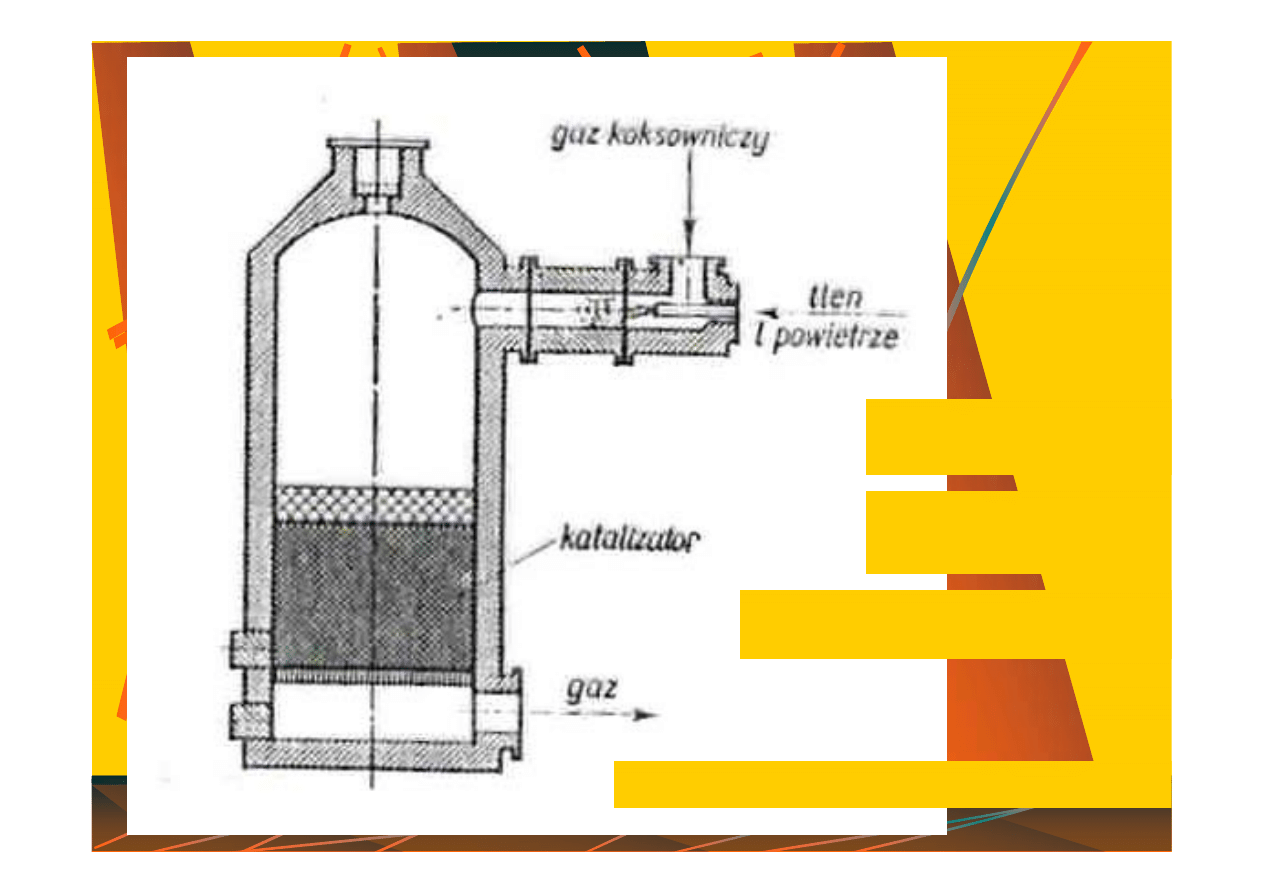
Metanizacja
Surowy gaz do syntezy
Wodór
CO
2
CO
2
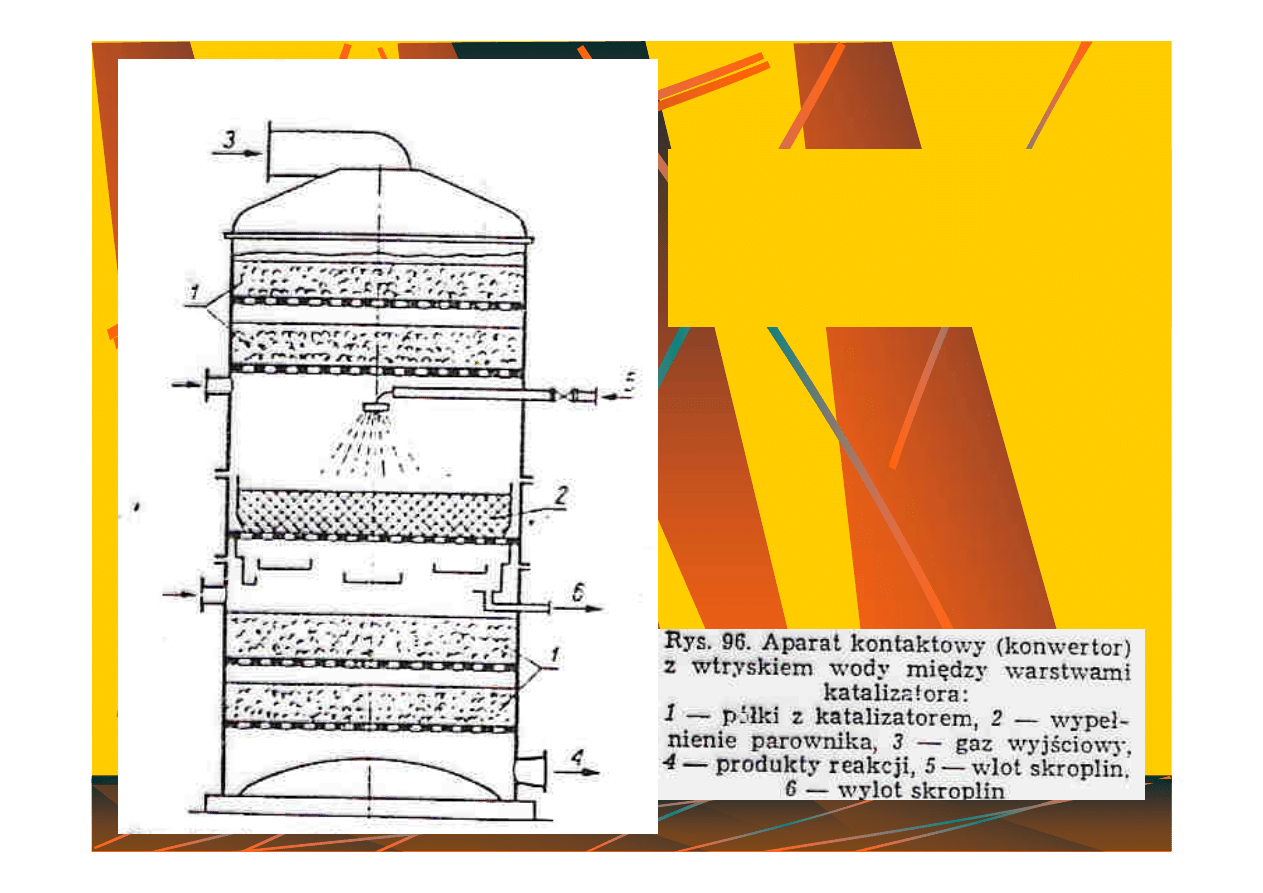
CO + H
2
O
(g)
=
CO
2
+ H
2
+ 42 kJ
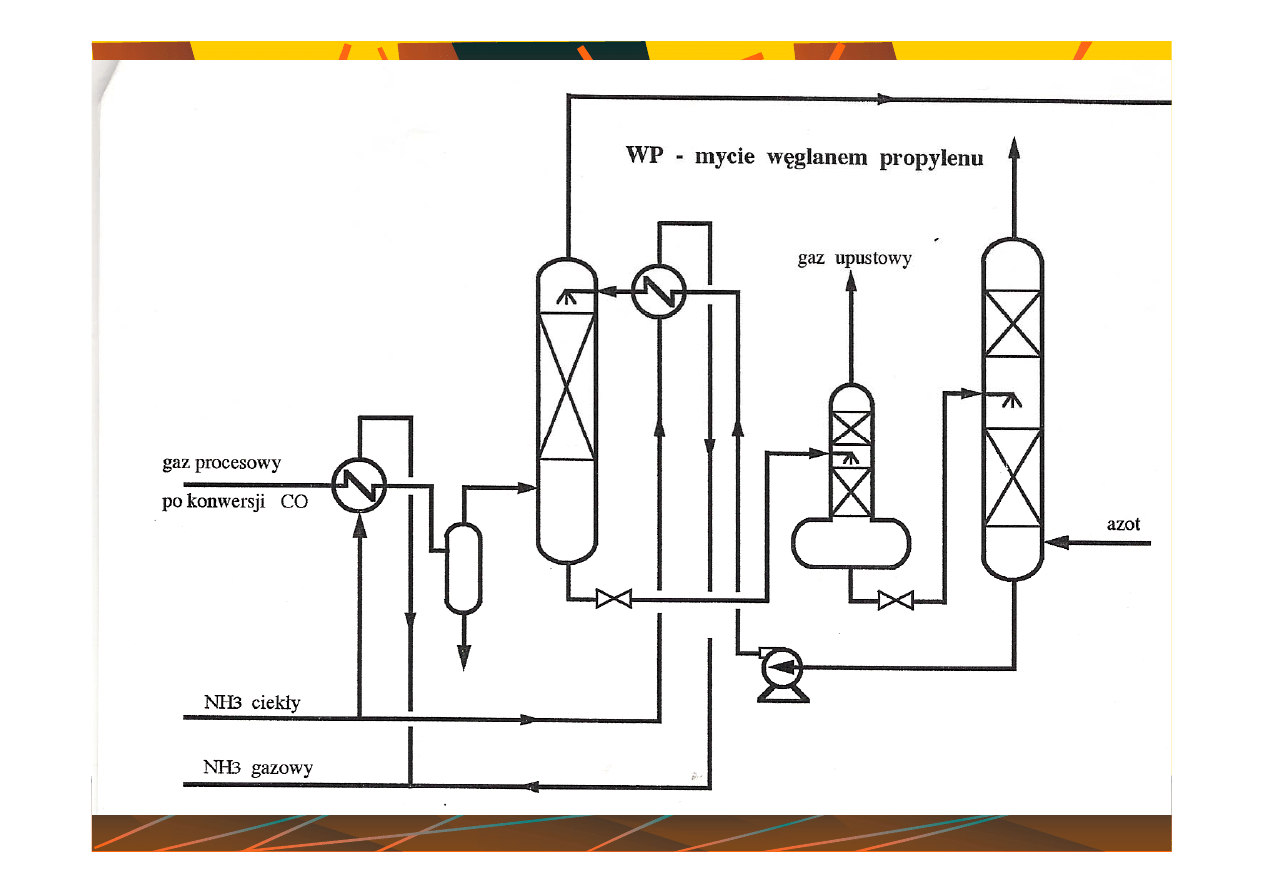
110
0
C
3 MPa
0,1 MPa
K
2
CO
3
+ CO
2
+ H
2
O 2 KHCO
3
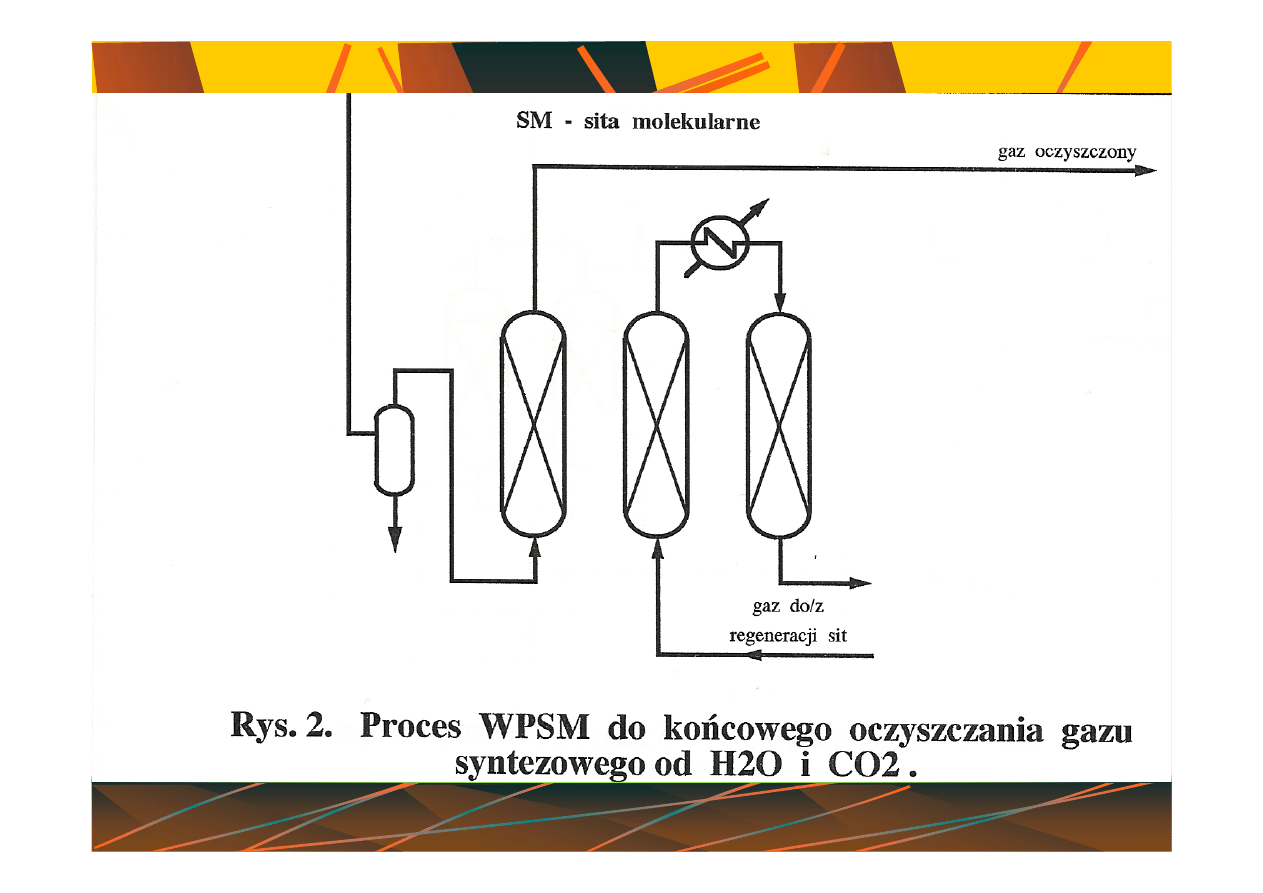

Instalacja
do
produkcji
amoniaku
http://www.zchpolice.com
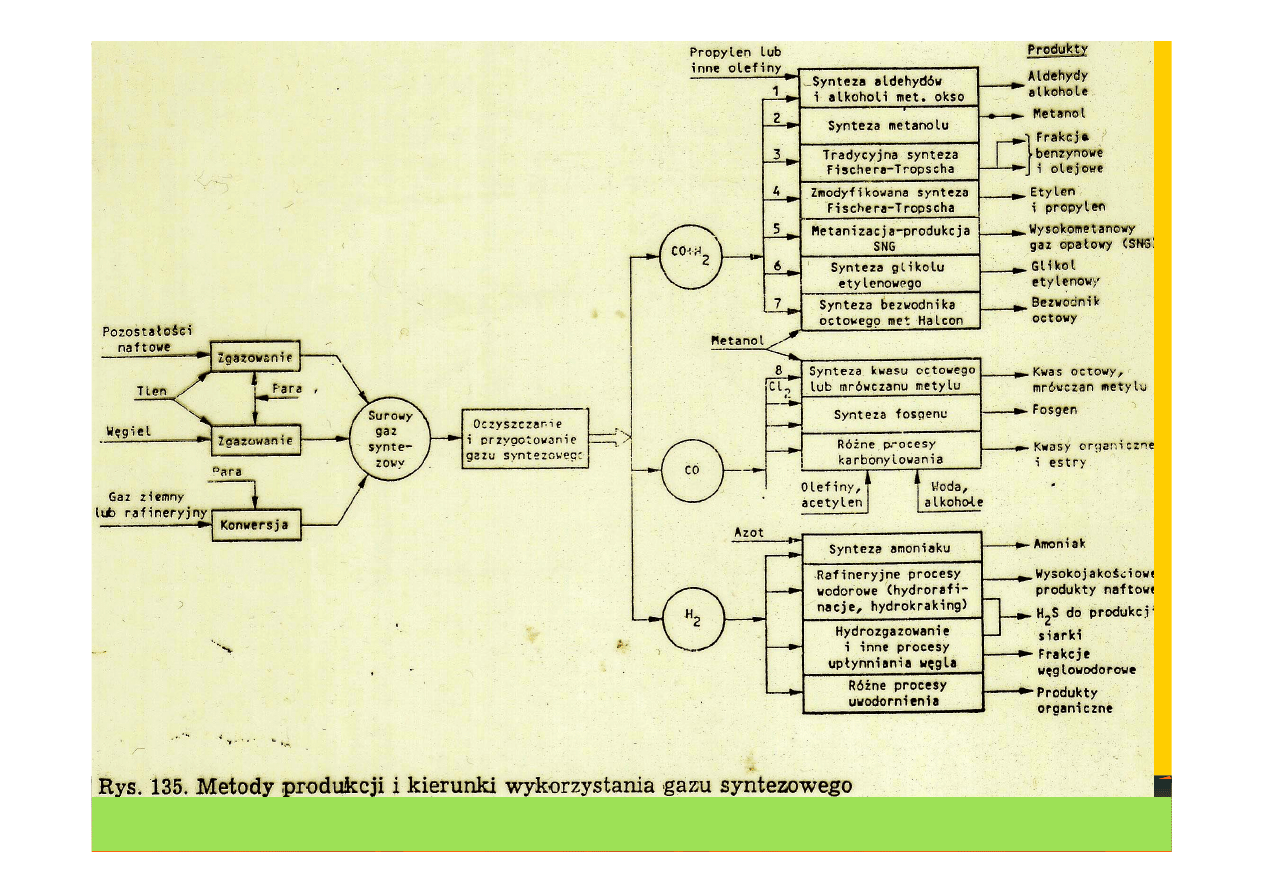
Metody produkcji i kierunki wykorzystania gazu syntezowego
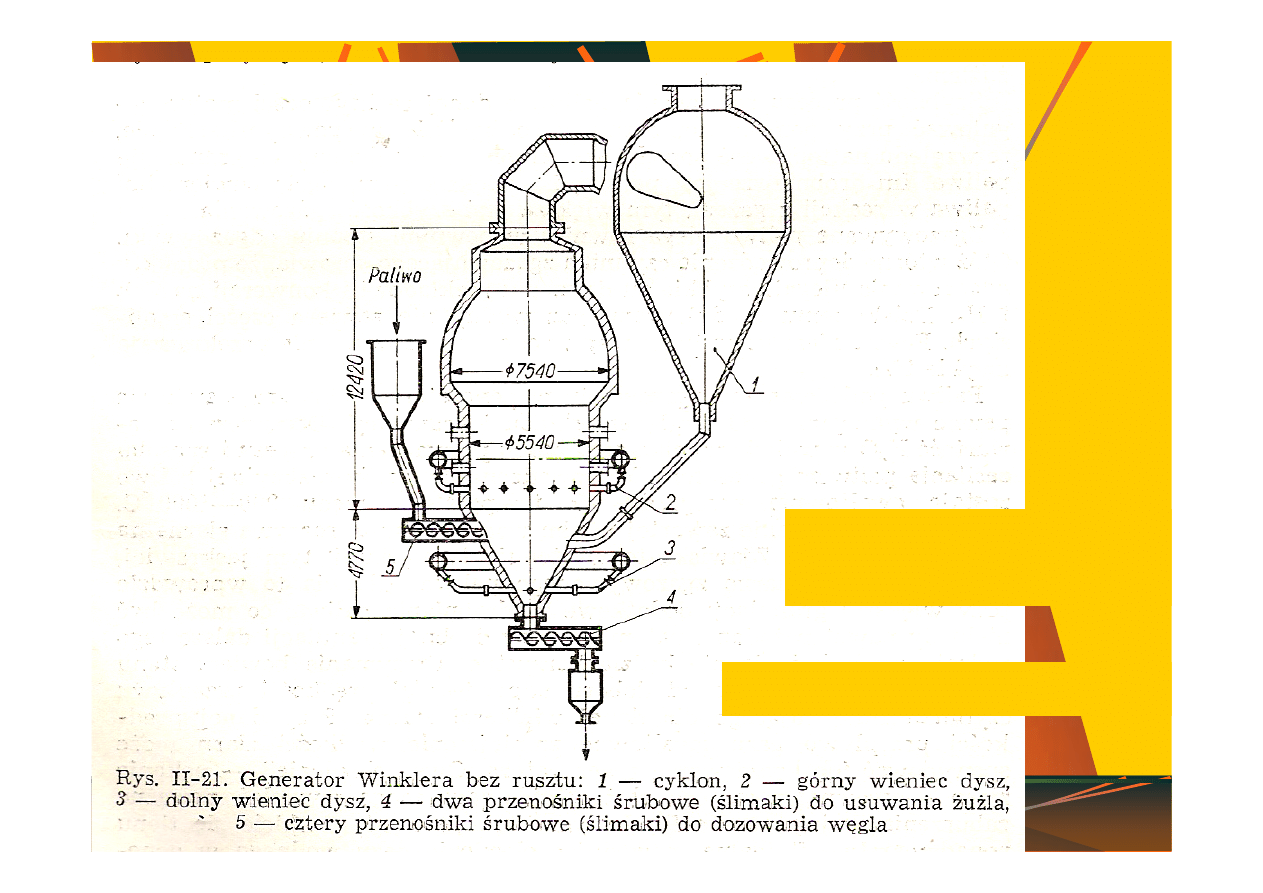
C + H
2
O =
CO + H
2
–
120 kJ
C + O
2
= CO
2
+ 405 kJ
Odsiarczanie, II
st.
Odsiarczanie, I st.
Reforming, I st.
Reforming, II
st.
CO
+ H
2
O = CO
2
+ H
2
+ 42
kJ
400
0
C, 3 MPa, katalizator Fe-Cr
CS
2
+ 4H
2
= CH
4
+ 2H
2
S
400
0
C, 3 MPa, kat. molibdenowo-
niklowy
ZnO
+ H
2
S = ZnS + H
2
O
400
0
C, 3 MPa,
CH
4
+ H
2
O = CO + 3H
2
– 206 kJ
850
0
C, 3 MPa, katalizator Ni
CH
4
+ ½O
2
= CO + 2H
2
+ 35
kJ
1100
0
C, 3 MPa, katalizator Ni
Konwersja CO
WTKCO
Gaz ziemny
CO +2H
2
= CH
3
OH + 111 kJ
250
0
C, 5 -
10
MPa, katalizator Cu-Zn
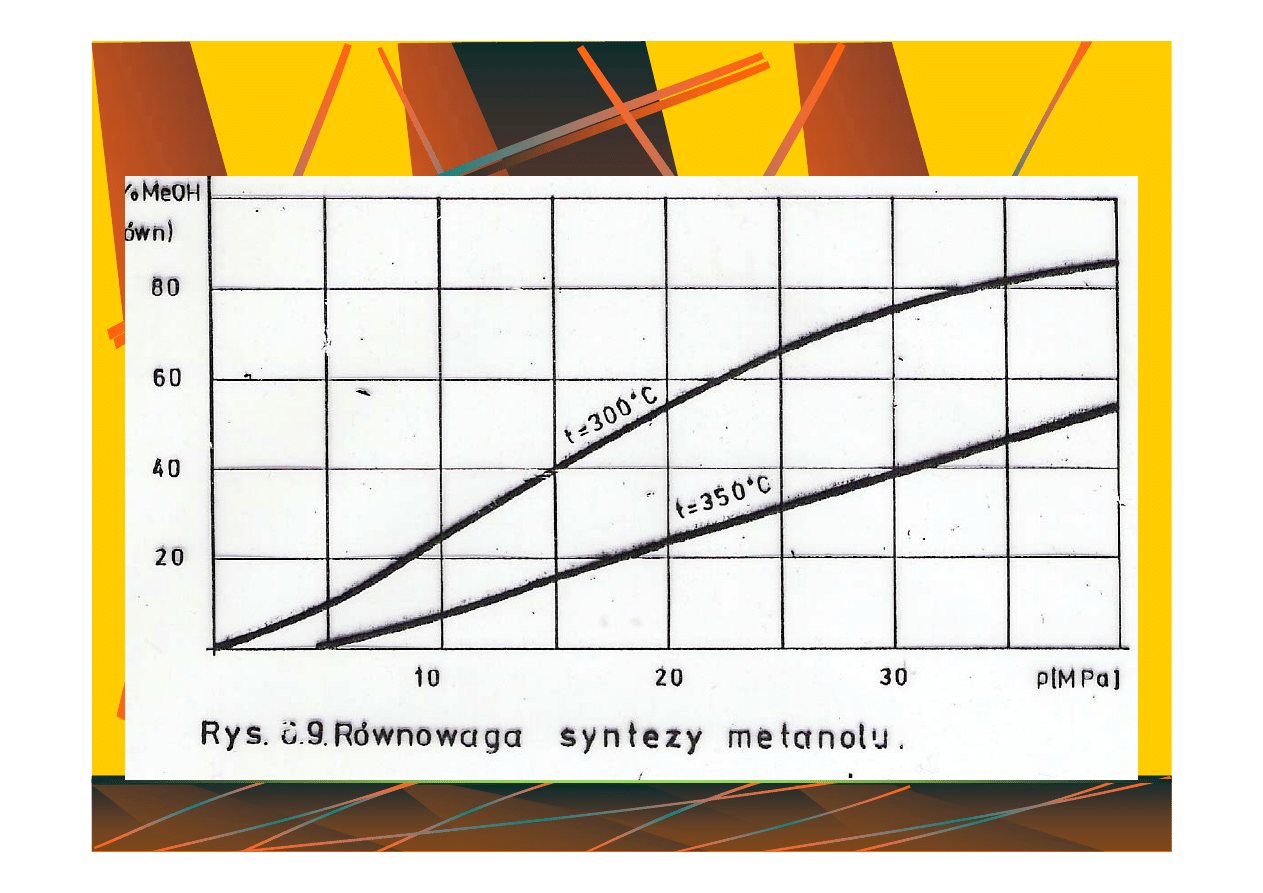
Synteza metanolu
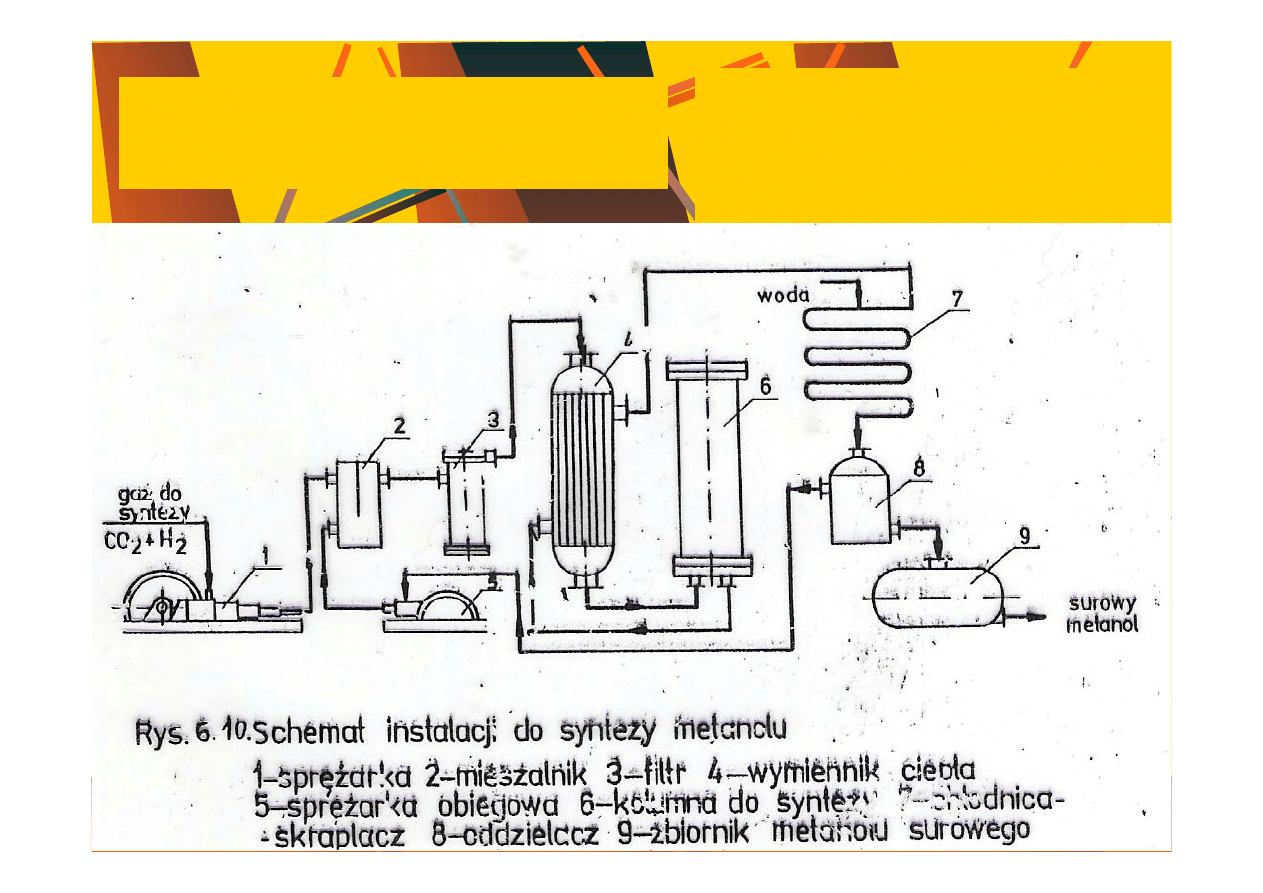
CO +2H
2
= CH
3
OH + 111 kJ
CO
2
+ 3H
2
= CH
3
OH + H
2
O
CO + 3H
2
= CH
4
+ H
2
O + 209 kJ
2CO + 2H
2
= CH
4
+ CO
2
+ 252 kJ
2CO = CO
2
+ C
CO + H
2
= CH
2
O
(formaldehyd)
+ 8,4 kJ
Document Outline
- Slajd numer 1
- Slajd numer 2
- Slajd numer 3
- Slajd numer 4
- Slajd numer 5
- Slajd numer 6
- Slajd numer 7
- Slajd numer 8
- Slajd numer 9
- Slajd numer 10
- Slajd numer 11
- Slajd numer 12
- Slajd numer 13
- Slajd numer 14
- Slajd numer 15
- Slajd numer 16
- Slajd numer 17
- Slajd numer 18
- Slajd numer 19
- Slajd numer 20
- Slajd numer 21
Wyszukiwarka
Podobne podstrony:
GAZ SYNTEZOWY 2009
06 Podstawy syntezy polimerówid 6357 ppt
8a Syntezy prostych aminokwasów
Wykład VIII Synteza układów sekwencyjnych
02 Metody syntezy organicznej VI s1id 3675
Ćwiczenia usprawniające analizę i syntezę wzrokową oraz orientację przestrzenną(1), Ćwiczenia uspraw
Zastosowanie enzymow w syntezie- wyniki, PWR, III semestr
d4 synteza aztreonamu
Chrom gaz I
Synteza jodku ołowiu sprawozdanie
Stan skupienia gaz
kwasy i pochodne Synteza kwasu?etylosalicylowego1
NANOC W Nano Wyklad 05 Synteza Metodami Chemicznymi II (1)
GAZ 07
gaz zestaw0
GAZ 01
więcej podobnych podstron