Ć
WICZENIA 1, 2
Gaz doskonały - gaz, w którym nie istnieją siły
przyciągania międzycząsteczkowego, a objętość cząsteczki
równa jest zeru.
PRAWA GAZÓW DOSKONAŁYCH
Określają zależności między parametrami czynnika
termodynamicznego.
Prawo Boyle
′′′′
a- Mariotte
′′′′
a (przemiana izotermiczna) -
iloczyn ciśnień i objętości właściwej gazu przy stałej
temperaturze jest wielkością stałą.
const
T
====
(dla m = 1 kg gazu)
1
2
2
1
2
2
1
1
p
p
const
p
p
ϑϑϑϑ
ϑϑϑϑ
====
====
ϑϑϑϑ
====
ϑϑϑϑ
const
V
p
V
p
2
2
1
1
====
====
(dla m kg gazu)
Prawo Gay - Lussaca (przemiana izobaryczna) - objętość
gazu ogrzewanego lub ochładzanego przy stałym ciśnieniu
zmienia się wprost proporcjonalnie do zmiany temperatury
bezwzględnej
const
T
V
T
V
lub
const
T
T
const
p
2
2
1
1
2
2
1
1
====
====
====
ϑϑϑϑ
====
ϑϑϑϑ
====
Prawo Charlesa (przemiana izochoryczna) - ciśnienie
gazu ogrzewanego lub chłodzonego przy stałej objętości
zmienia się wprost proporcjonalnie do zmiany temperatury
bezwzględnej
ϑϑϑϑ ====
====
====
const
p
T
p
T
const
1
1
2
2
Równanie stanu gazu (równanie Clapeyrona)
p V
T
p V
T
mR
const
1
1
1
2
2
2
====
====
====
•
dla 1kg masy gazu
p
RT
ϑϑϑϑ ====
•
dla m kg masy gazu
pV
mRT
====
υ
- objętość właściwa gazu, m
3
/kg
V - objętość gazu, m
3
m - masa gazu, kg
R - stała gazowa, J/(kg
⋅
K)
•
stała gazowa:
R
B
M
====
B - uniwersalna stała gazowa, B=8314,3J/(kmol
⋅
K)
M - masa molowa gazu, kg/kmol
•
Inna postać równania:
p
BT
M
pV
nTB
Φ
Φ
Φ
Φ
Φ
Φ
Φ
Φ
====
====
====
ϑϑϑϑ
Φ
- objętość molowa gazu, m
3
/kmol
n - ilość kmol gazu
Prawo Avogadra -przy jednakowej temperaturze i
ciśnieniu różne gazy doskonałe mają tę samą ilość
cząsteczek w równych objętościach
n
n
m
m
M
M
M
const
1
2
1
2
1
2
====
====
====
====
ϑϑϑϑ Φ
Φ
Φ
Φ
Warunki normalne fizyczne
T
N
=273,15K
t
N
=0
o
C
p
N
=101325Pa
p
N
=760mmHg
Φ
N
=22,4136m
3
/kmol
Przeliczanie jednostek ciśnienia
760Tr=101325Pa
1Tr=133,322Pa
1Tr=1mmHg
1atm=101325Pa (atmosfera fizyczna)
1at=98066,5Pa
≈
10
5
Pa (atmosfera techniczna)
1bar=10
5
Pa=750Tr
1at=1kG/cm
2

Ć
WICZENIA 1, 2
MIESZANINY GAZÓW
Prawo Daltona - w danej objętości V mieszaniny gazów o
temperaturze T i ciśnieniu p każdy ze składników
mieszaniny m
1
, m
2
, ...,m
n
zachowując się tak jakby nie było
innego gazu w tej objętości, czyli zajmuje całą objętość V,
przyjmuje temperaturę T i ciśnienie p
icz
.
p
p
p
p
m
m
m
m
cz
cz
czk
k
====
++++
++++ ++++
====
++++
++++ ++++
1
2
1
2
. . .
. . .
Skład mieszaniny gazów określają udziały masowe lub
objętościowe składników.
•
Udział masowy
g
m
m
i
i
====
m
i
- masa i-tego składnika mieszaniny
m - masa mieszaniny
m
m
m
m
g
g
g
k
k
====
++++
++++ ++++
++++ ++++ ++++
====
1
2
1
2
1
. . .
. . .
•
Udział objętościowy
r
V
V
i
i
====
V
i
- objętość i-tego składnika mieszaniny
V - objętość mieszaniny
V
V
V
V
r
r
r
k
k
====
++++
++++
++++ ++++
====
1
2
1
2
1
. . .
. . .
•
Udział molowy
z
n
n
i
i
====
n
i
- ilość moli i-tego składnika
n - ilość moli mieszaniny
n
n
n
n
z
z
z
k
k
====
++++ ++++ ++++
++++ ++++
====
1
2
1
2
1
. . .
. . .
Wielkości zastępcze
•
Pozorna względna masa cząsteczkowa składnika
mieszaniny gazowej
i
k
1
i
i
i
k
1
i
i
m
M
z
M
r
M
∑
∑
∑
∑
∑
∑
∑
∑
====
====
⋅⋅⋅⋅
====
⋅⋅⋅⋅
====
M
i
- masa molowa i-tego składnika mieszaniny
z
i
- udział molowy i-tego składnika mieszaniny
r
i
- udział objętościowy i-tego składnika mieszaniny
g
r
M
M
i
i
i
m
====
CIEPŁO WŁAŚCIWE
Ciepło właściwe oznacza ilość ciepła potrzebną do
ogrzania jednostki masy substancji o 1K.
W zależności od warunków w jakich następuje ogrzewanie
lub chłodzenie gazu rozróżniamy:
•
ciepło właściwe przy stałym ciśnieniu
c
p
, J/(kg
⋅
K), k J/(kg
⋅
K)
•
ciepło właściwe przy stałej objętości
c
v
, J/(kg
⋅
K), k J/(kg
⋅
K)
Ciepło właściwe może być odniesione do:
•
jednostki masy gazu
c
p
, c
v
, J/(kg
⋅
K), k J/(kg
⋅
K)
•
jednostki objętości
C
p
, C
v
, J/(um
3
⋅
K) k J/( um
3
⋅
K)
•
jednostki masy molowej
C
p
M
, C
v
M
, J/(kmol
⋅
K), kJ/(kmol
⋅
K)
Zależność pomiędzy c
p
i c
v
(równanie Mayera):
B
C
C
R
M
c
M
c
M
R
c
c
M
v
M
p
v
p
v
p
====
−−−−
⋅⋅⋅⋅
====
⋅⋅⋅⋅
−−−−
⋅⋅⋅⋅
====
−−−−
M - masa molowa
B - uniwersalna stała gazowa, B
≅
8314 J/(kmol
⋅
K)
Molowe ciepło właściwe
C
B
i
C
B i
p
M
v
M
==== ⋅⋅⋅⋅ ⋅⋅⋅⋅ ++++
==== ⋅⋅⋅⋅ ⋅⋅⋅⋅
1
2
2
1
2
(
)
i - liczba stopni swobody dla danego gazu
•
dla gazu jednoatomowego i=3
•
dla gazu dwuatomowego i=5
•
dla gazu trójatomowego i o większej liczbie atomów w
cząsteczce i=7
Zależności
c
C
M
J
kg K
c
C
J
kg K
C
C
J
um
K
M
M
====
⋅⋅⋅⋅
====
⋅⋅⋅⋅
====
⋅⋅⋅⋅
, / (
)
, / (
)
, / (
)
ρρρρ
Φ
Φ
Φ
Φ
3
M - masa molowa, kg/kmol
ρ
- gęstość, kg/m
3
Ciepło właściwe dla mieszaniny gazów
c
g c J
kg K
C
z C
J
kmol K
C
r C J
um
K
m
i
i
k
i
m
M
i
i
k
i
M
m
i
i
k
i
====
⋅⋅⋅⋅
⋅⋅⋅⋅
====
⋅⋅⋅⋅
⋅⋅⋅⋅
====
⋅⋅⋅⋅
⋅⋅⋅⋅
====
====
====
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
1
1
1
3
, / (
)
, / (
)
, / (
)
g
i
- udział masowy
z
i
- udział molowy
r
i
- udział objętościowy
Wzory na obliczanie ilości ciepła
Q
n C
T
Q
m c
T
Q
V C
T
M
==== ⋅⋅⋅⋅
⋅⋅⋅⋅
==== ⋅⋅⋅⋅ ⋅⋅⋅⋅
==== ⋅⋅⋅⋅ ⋅⋅⋅⋅
∆∆∆∆
∆∆∆∆
∆∆∆∆
Q - ilość ciepła, J
C
M
- ciepło właściwe molowe, J/(kmol
⋅
K)
c - ciepło właściwe masowe, J/(kg
⋅
K)
C - ciepło właściwe objętościowe, J/(um
3
⋅
K)
∆
T - różnica temperatury, K
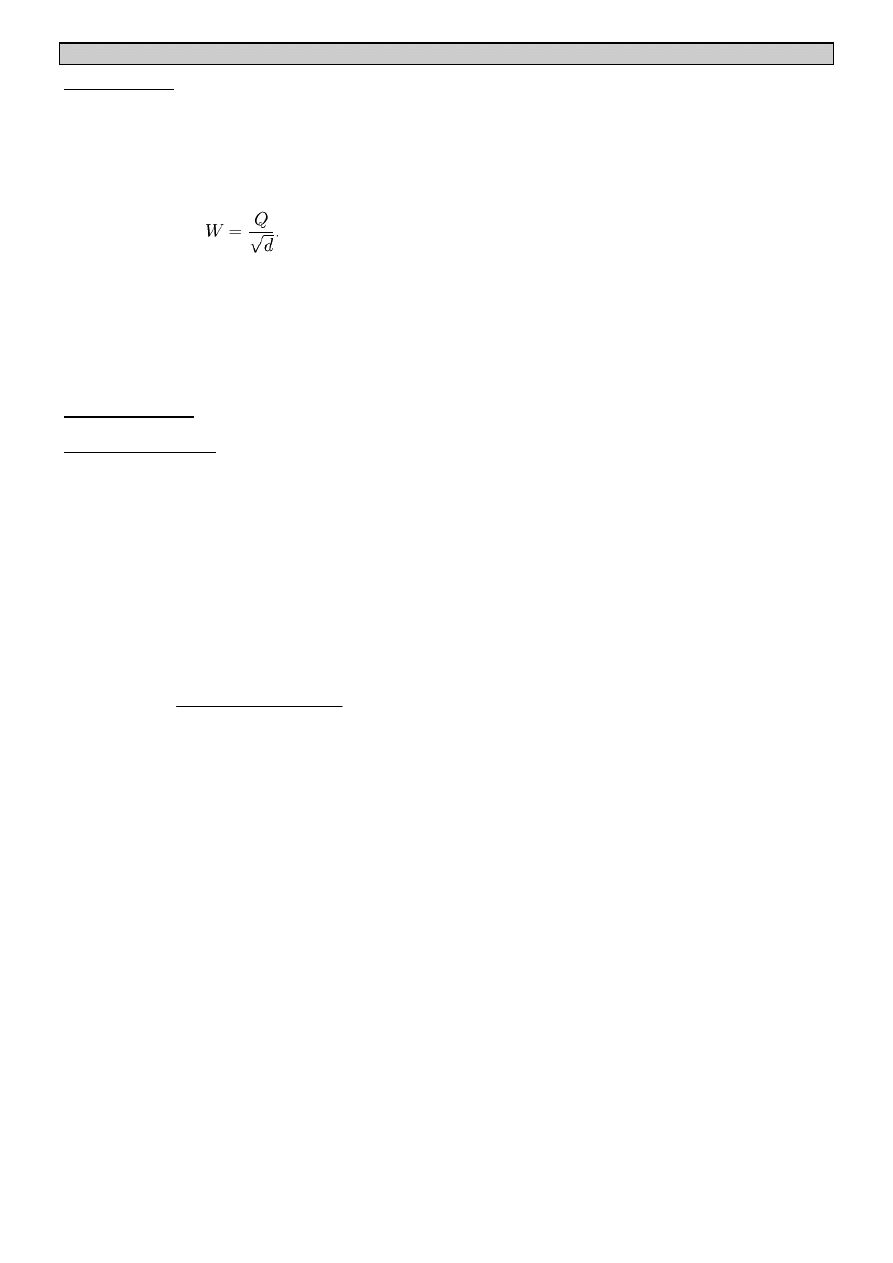
Ć
WICZENIA 1, 2
Liczba Wobbego - (MJ/m³) lub (MJ/mol) lub (MJ/kg) –
jest to stosunek wartości kalorycznej odniesionej do
jednostki objętości gazu, do pierwiastka kwadratowego
jego gęstości względnej, w tych samych warunkach
odniesienia. Jeśli przez Q oznaczymy wartość kaloryczną,
a przez d gęstość względną, wtedy liczbę Wobbego W
można przedstawić następująco
Wyróżnia się:
•
dolną Liczbę Wobbego – gdy za wartość
kaloryczną przyjmuje się jego wartość opałową;
•
górną Liczbę Wobbego – gdy za wartość
kaloryczną przyjmuje się jego ciepło spalania.
Wartość liczby Wobbego jest podstawą do podziału paliw
gazowych na podgrupy.
Gęstość względna d - stosunek gęstości rozpatrywanego
gazu do gęstości powietrza.
Granica wybuchowości – wielkość stężenia par, gazów
lub pyłów substancji, które w mieszaninie z powietrzem
mogą zapalić się od bodźca termicznego.
Wyróżnia się:
•
dolną granicę wybuchowości – czyli najniższe
stężenie substancji palnej,
•
górną granicę wybuchowości – najwyższe
stężenie substancji palnej w mieszaninie z
powietrzem, przy którym jeszcze może nastąpić
zapalenie się tej substancji i jej wybuch pod
wpływem bodźca termicznego.
Granice wybuchowości mieszanin gazowych oblicza się za
pomocą wzoru Le Chatelier’a:
n
n
m
G
r
G
r
G
r
G
/
...
/
/
100
2
2
1
1
+
+
+
=
G
m
– dolna lub górna granica wybuchowości
r
n
- udział objętościowy n-tego składnika mieszaniny
G
n
– dolna lub górna granica wybuchowości składników
mieszaniny
Ć
WICZENIA 1, 2
GAZ PÓŁDOSKONAŁY
Gaz półdoskonały - czynnik termodynamiczny spełniający
równania gazu doskonałego, ale jego ciepło właściwe jest
zmienne i zależy od temperatury.
W obliczeniach technicznych przemian gazów rzeczywistych
traktuje się je przeważnie jako gazy półdoskonałe.
Średnie ciepło właściwe
c
c
t
c
t
t
t
t
t
t
t
1
2
2
1
0
2
0
1
2
1
====
⋅⋅⋅⋅ −−−−
⋅⋅⋅⋅
−−−−
t
1
, t
2
- temperatura początkowa i końcowa przemiany,
0
C
c
t1
0
-średnie ciepło właściwe gazu od temp. 0
0
C do temp. t
1
,
0
C
c
t2
0
- średnie ciepło właściwe gazu od temp. 0
0
C do temp. t
2
,
0
C
Mieszanina gazów półdoskonałych
c
g c
J
kg K
kg K
C
r C
J
um
K
um
K
C
z C
J
kmol K
kmol K
m t
t
i
i
k
mi t
t
m t
t
i
i
k
mi t
t
m
M
t
t
i
i
k
mi
M
t
t
1
2
1
2
1
2
1
2
1
2
1
2
1
1
3
3
1
====
⋅⋅⋅⋅
⋅⋅⋅⋅
⋅⋅⋅⋅
====
⋅⋅⋅⋅
⋅⋅⋅⋅
⋅⋅⋅⋅
====
⋅⋅⋅⋅
⋅⋅⋅⋅
⋅⋅⋅⋅
====
====
====
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
∑
, / (
),
/ (
)
, / (
),
/ (
)
, / (
),
/ (
)
kJ
kJ
kJ
g
i
- udział masowy
z
i
- udział molowy
r
i
- udział objętościowy
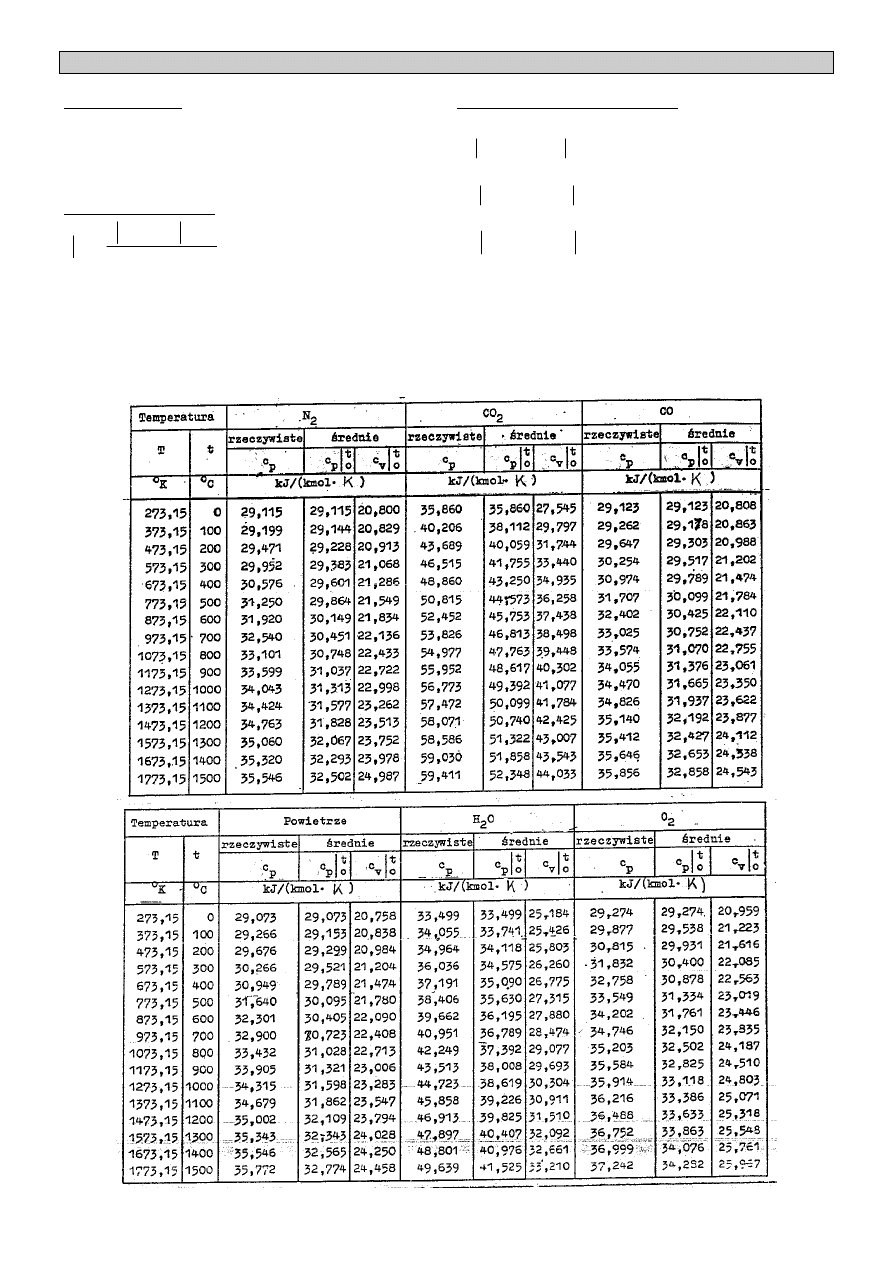
Ciepło właściwe gazów półdoskonałych
Wyszukiwarka
Podobne podstrony:
ROZTWORY GAZÓW DOSKONAŁYCH
PRZEMIANY GAZÓW DOSKONAŁYCH 1
Referaty, Stała gazowa R, Równanie stanu gazów doskonałych ( równanie Clapeyrona )
PRZEMIANY CHARAKTERYSTYCZNE GAZÓW DOSKONAŁYCH I
Doskonalimy technikę kozłowania prawą i lewą ręką, AWF Wro, koszykówka
P.K. Doskonalimy technikę kozłowania prawą i lewą, konspekty
11, 11-teoria, Gaz doskonały to model, słuszny w pełni jedynie dla bardzo rozrzedzonych gazów (wzros
Doskonalenie kozłowania lewą i prawą ręką - koszykówka, Dokumenty(1)
Doskonalenie techniki kozłowania prawą i lewą ręką, AWF Wro, koszykówka
gaz doskonały, Gaz doskonały - nie istnieje ale doskonale oddaje cechy gazów rzeczywistych
Doskonalenie kozłowania piłki prawą i lewą ręką, KONSPEKT LEKCJI WYCHOWANIA FIZYCZNEGO
więcej podobnych podstron