
Biotechnologia Leków – instrukcja do ćwiczeń laboratoryjnych
1
Biosynteza, wykrywanie oraz oznaczanie aktywności przeciwgrzybowej makrolidów
polienowych.
Opracowanie: dr inż. Roland Wakieć
Wprowadzenie.
Promieniowce są bakteriami Gram-dodatnimi. Obficie występują w glebie lub na
rozkładającej się masie roślinnej. Większość z nich prowadzi saprofityczny tryb życia,
niektóre są chorobotwórcze dla roślin i zwierząt. Degradują sterydy, ligninę, chityny,
węglowodory, długołańcuchowe kwasy tłuszczowe, kwasy huminowe, a więc związki z
trudem rozkładane przez inne bakterie. W trakcie rozkładu tych substancji wytwarzają m.in.
związki zapachowe. Substancje produkowane i wydzielane na zewnątrz komórek na zasadzie
sekrecji odpowiedzialne są m.in. za „ziemisty” zapach gleby, powodowany przez substancję
zwaną geosminą (1,10-dimetylo-9-dekalol), którą wytwarza Streptomyces griseus.
Promieniowce są bakteriami chemoorganotroficznymi, które rosnąc, tworzą kolonie o
kształcie wydłużonych rozgałęziających się nitek, (przypominających grzybnię). Organizmy
te zajmują wśród bakterii miejsce szczególne, ich komórki maja budowę prokariotyczną, ale
morfologią, cyklem rozwojowym i sposobem rozmnażania przypominają grzyby strzępkowe.
Strzępki promieniowców mają jednak znacznie mniejszą średnicę (szerokość nitek od 1-5
mm) i są mniej zróżnicowane morfologicznie niż w przypadku grzybów. W hodowli wgłębnej
(płynnej) promieniowce rosną w sposób charakterystyczny – w postaci grzybni nitkowatej,
kłaczków lub kuleczek nieco analogicznie do przemysłowych grzybów strzępkowych (po 2-3
dniach wzrostu, hodowla przypomina nieco namoczoną w wodzie watę).
Rysunek 1. Cykl życiowy promieniowców z rodzaju Sterptomyces.
(źródło:
http://microbewiki.kenyon.edu/index.php/Streptomyces
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
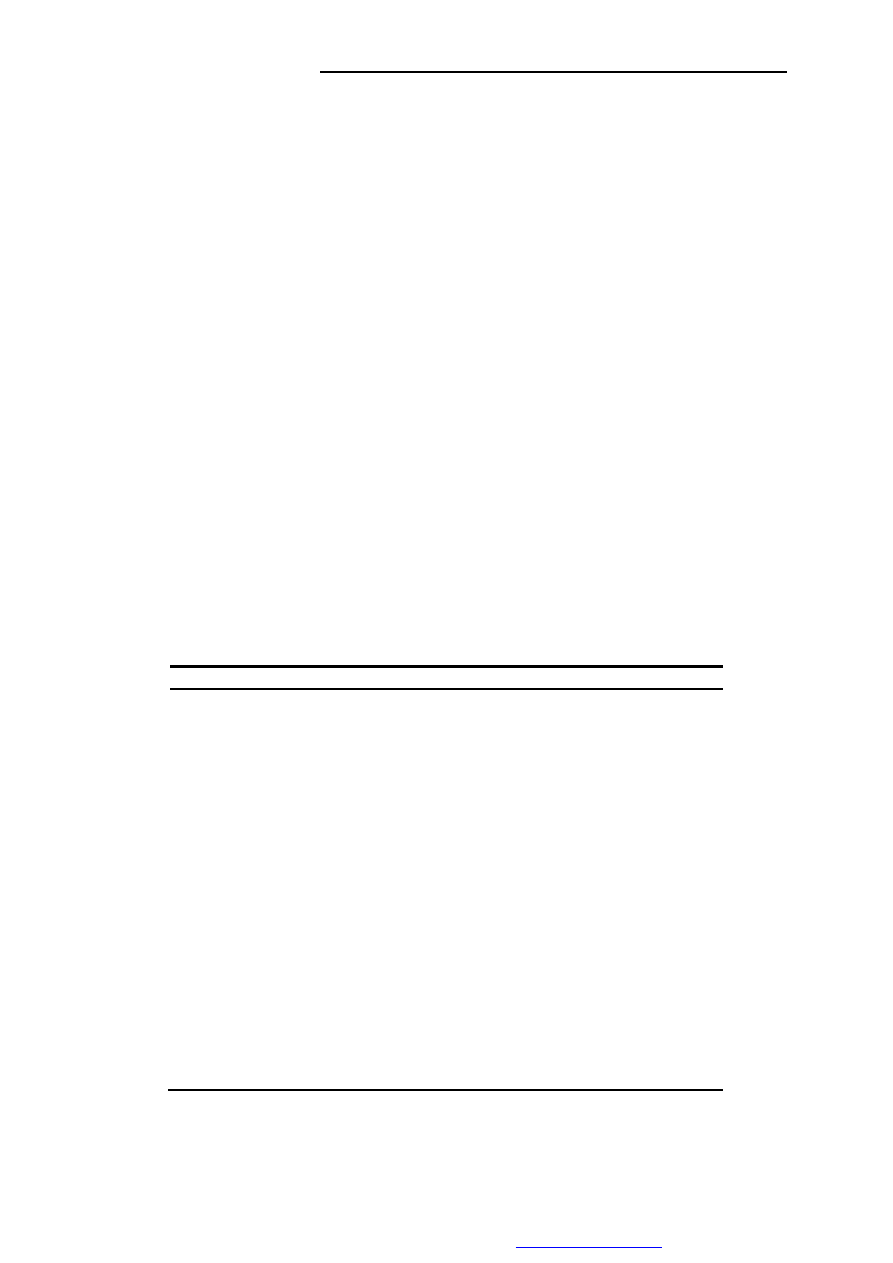
Biotechnologia Leków – instrukcja do ćwiczeń laboratoryjnych
2
Wzrost kolonii promieniowców z rodziny Streptomyces polega na rozwoju w pierwszej
fazie delikatnej, luźnej siatki strzępek wnikających w głąb podłoża, skąd pobierane są
składniki odżywcze – jest to tak zwana grzybnia substratowa (inaczej podstawowa lub
wegetatywna). W drugiej kolejności powstaje grzybnia generatywna, zwana inaczej wtórną
bądź powietrzną. Tworzy ona wypiętrzoną bardzo zwartą część kolonii. Tworzenie grzybni
powietrznej zakończone jest procesem sporulacji – zarodnikowania. Soronośne nitki grzybni
powietrznej – sporofory tworzą tzw. artrospory określane również jako konidia. Konidia
promieniowców mogą przetrwać w stanie uśpienia nawet do kilkunastu lat. Procesowi
kiełkowania zarodników sprzyja obecność w podłożu takich składników jak: L-alanina, L-
tyrozyna, zasady purynowe i pirymidynowe, dwutlenek węgla, jony magnezowe i wapniowe.
Po wykiełkowaniu zarodników następuje okres rozwoju grzybni, która w początkowej fazie
wzrostu rzadko podzielona jest przegrodami.
Spośród promieniowców największe znaczenie biotechnologiczne mają gatunki
tlenowe, saprofityczne, bytujące w glebie lub kompoście. Najważniejsze z tej grupy są
organizmy należące do rodzaju Sterptomyces. Wytwarzają one
2
/
3
wszystkich znanych
dotychczas antybiotyków i aż 90% antybiotyków stosowanych w lecznictwie. Poniższa tabela
przedstawia przykłady antybiotyków o różnym zastosowaniu, produkowanych przez
promieniowce, w znaczącej przewadze należące do rodzaju Streptomyces.
Promieniowce
Antybiotyki
Aktywność przeciwbakteryjna
Micromonospora purpurea
gentamycyny
Nocardia mediterrana
ryfamycyny
Streptomyces aureofaciens
tetracykliny
S. canamyceticus
kanamycyny
S. erythreus
erytromycyna
S. fradiae
neomycyna
S. griseus
streptomycyna
S. lincolnensis
linkomycyna
S. orientalis
wankomycyna
S. tenebrarius
tobramycyna
Aktywność przeciwgrzybowa
S. nodosus
amfoterycyna
S. noursei
nystatyna
Aktywność przeciwnowotworowa
S. antibioticus
aktynomycyna
S. caespitosus
mitomycyna
S. peuceticus
daunorubicyna
S. verticillus
bleomycyna
Tabela 1. Antybiotyki stosowane w lecznictwie produkowane przez promieniowce.
(za: Chmiel i Stefański, Biotechnologia i Chemia Antybiotyków, 1998).
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
Biotechnologia Leków – instrukcja do ćwiczeń laboratoryjnych
3
Przedstawicielem promieniowców z rodziny Sterptomyces jest Stereptomyces
coelicolor. W chwili obecnej jest to pierwszy organizm z tej grupy, którego genom (jego
sekwencja) została całkowicie poznana. Składa on się z 8 667 507 par zasad. Genom
przypuszczalnie zawiera 7 825 genów, w skład których wchodzi ponad 20 klasterów
kodujących poznane lub przypuszczalne metabolity wtórne, wśród których są substancje o
różnorakiej aktywności biologicznej. Większość rozpoznanych genów tego organizmu jest
podobna do opisanych już wcześniej genów innych bakterii oraz genów regulatorowych.
Niezwykłe i unikalne posród organizmów bakteryjnych są geny odpowiedzialne za
różnicowanie faz rozwoju kolonii Streptomyces. Spośród metabolitów wtórnych
produkowanych przez Streptomyces coelicolor na szczególną uwagę zasługują: aktynorodyna,
undecylodigiosyna, metylenomycyna, CDA (calcium-dependent peptide antibiotic) oraz
przeciwgrzybowy antybiotyk polienowy będący pochodną amfoterycyny B. Związki te mogą
być wytwarzane przez kolonie S. coelicolor w różnych ilościach w zależności od
zmieniających się warunków bytowania. Obecność tych związków w zawiesinie
fermentacyjnej można wykrywać na różne sposoby. Jednym z najprostszych jest wykrycie
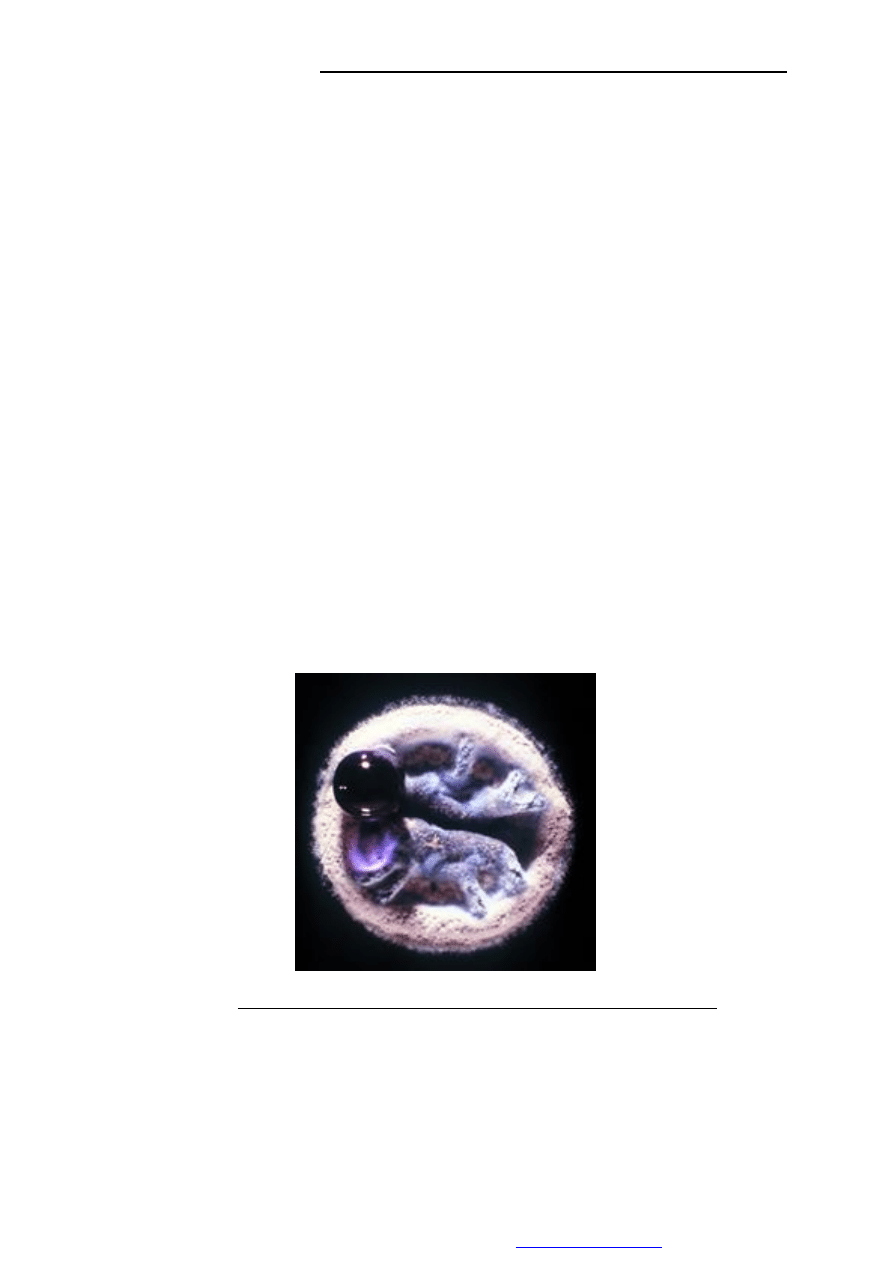
actinorodyny – niebieskiego (w pH powyżej 8,5) barwnika o właściwościach
przeciwdrobnoustrojowych. Związek ten jest produkowany przez kolonie S. coelicolor i
wydzielany z komórek na zasadzie sekrecji.
Zdjęcie 1. Sekrecja aktynorodyny przez kolonię Sterptomyces
(źródło:
http://www.hero.ac.uk/sites/hero/uk/research/archives/2002/genome_keys_unlock_nature1588.cfm)
Wygodnym i prostym sposobem na identyfikację związków w mieszaninie
pofermentacyjnej jest zastosowanie metod spektroskopowych w zakresie światła widzialnego
i UV, jeżeli oczywiście poszukiwane związki posiadają w tym przedziale długości fal
charakterystyczne maksima absorpcji. Maksimum absorpcji w przypadku aktynorodyny w pH
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
Biotechnologia Leków – instrukcja do ćwiczeń laboratoryjnych
4
zasadowym występuje przy długości fali 615nm dla undecylprodigiosyny w zależności od pH
wynosi 533nm lub 468nm (odpowiednie pH kwaśne i zasadowe). W przypadku związków
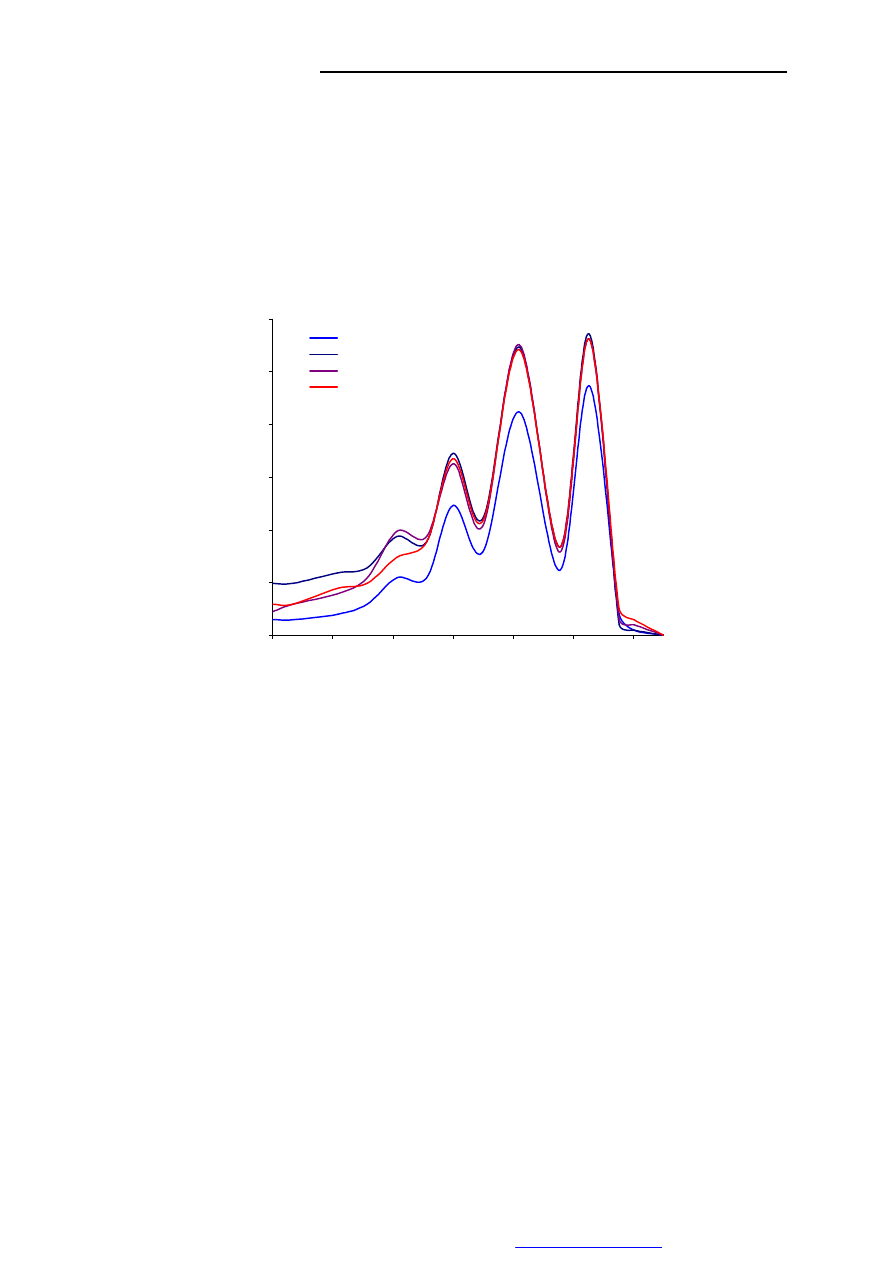
polienowych, do których zalicza się m.in. amfoterycyna B, w zakresie niskich stężeń (c<10
-7
M) w obszarze 420-320 nm obserwuje się 4 pasma absorpcji przy 409, 385, 365, 347 nm
(charakterystyczne widmo tzw. oscylacyjne). Intensywność tych pasm wzrasta wraz z
długością fali.
0
0,1
0,2
0,3
0,4
0,5
0,6
300
320
340
360
380
400
420
D
ługość fali [nm]
A
b
s
o
rp
c
ja
AMB
AMA
Orn-AMA
Orn-AME
Wykres 1. Charakterystyczne widma metanolowych roztworów amfoterycyny B i jej
syntetycznych pochodnych.
Makrolidy polienowe (tzw. polieny) należą do związków przeciwgrzybowych
pochodzenia naturalnego. Najskuteczniejszym chemoterapeutykiem z tej grupy jest
amfoterycyna B. Mechanizm jej działania związany jest z obecnością ergosterolu w błonie
cytoplazmatycznej grzybów. Wykazując nieco większe powinowactwo do ergosterolu niż do
występującego w komórkach ssaków cholesterolu amfoterycyna B (AMB) wiąże się
preferencyjnie z tym pierwszym, tworząc transbłonowy kanał, przez który dochodzi do
niekontrolowanego wypływu jonów jedno i dwuwartościowych (m.in. K
+
, Mg
2+
) co leży u
podstaw działania przeciwgrzybowego.
Cel ćwiczenia.
Biosynteza oraz stwierdzenie obecności w zawiesinie pofermentacyjnej Streptomyces
coelicolor antybiotybiotyków polienowych. Zapoznanie z technikami spektroskopowymi
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

Biotechnologia Leków – instrukcja do ćwiczeń laboratoryjnych
5
(UV-Vis). Zapoznanie ze sposobami wzrostu promieniowców z rodzaju Streptomyces w
podłożu płynnym oraz stałym a także z morfologią ich komórek i kolonii.
Wykonanie ćwiczenia.
1. Na uprzednio przygotowane szalki Petiego (bądź skosy) z podłożem Streptomyces
Medium wysiać Streptomyces coelicolor z pożywki płynnej (lub wytwarzających
spory kolonii na podłożu stałym). Inkubować w temperaturze 26-28
0
C przez 7-10 dni
do momentu uzyskania kolonii wytwarzających spory.
(Koniec pierwszych zajęć)
2. Przy pomocy pipety nanieść na szalkę Petriego około 1 ml pożywki płynnej
Streptomyces
medium,
zmywając
powierzchnię
sporujących
kolonii
promieniowców. Po zmyciu powierzchni pobrać pipetą powstałą zawiesinę sporów w
pożywce i przenieść do kolby z pożywką płynną (ok. 100ml pożywki Sterptomyces
medium w kolbie o objętości 300-500ml) – zachować sterylne warunki pracy!!!
3. Zaszczepione kolby z pożywką płynną przenieść do wytrząsarki i prowadzić hodowlę
Streptomyces przez okres 7 dni w 26-28
0
C z intensywnym wytrząsaniem (180-200
obr/min – rpm).
4. Obejrzeć pod mikroskopem (w powiększeniu 5x i 10x) płytki z koloniami
Sterptomyces coelicolor. Zwrócić uwagę na budowę grzybni powietrznej i konidia.
Płytki oglądać uprzednio zdejmując pokrywkę, dopiero po zmyciu spor i
zaszczepieniu podłoża płynnego!!! W miarę możliwości sporządzić dokumentację
zdjęciową lub rysunki.
(Koniec drugich zajęć)
5. Przeprowadzić analizę mieszaniny pofermentacyjnej Sterptomyces coelicolor:
• Odwirować (10min, 10000 RPM) około 2 ml zawiesiny pofermentacyjnej, uzyskując
w ten sposób pozbawiony komórek supernatant.
• Pobrać do probówki typu „Falcon” około 5ml zawiesiny pofermentacyjnej oraz około
3ml n-butanolu. Wytrząsać całość przez około 15 minut. Po wytrząsaniu odwirować
(3000 RPM, 5 min.), doprowadzając do rozdzielenia faz. Zebrać fazę butanolową
(zwrócić uwagę na zmianę koloru – nie jest ona spowodowana kolorem pożywki!).
• Przeprowadzić skaningowe badanie spektroskopowe w przedziale 300-700 nm w
poszukiwaniu maksimów absorpcji charakterystycznych dla poszukiwanych
metabolitów wtórnych (na zebranej fazie butanolowej i pozbawionym komórek
supernatancie).
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

Biotechnologia Leków – instrukcja do ćwiczeń laboratoryjnych
6
• Po przeprowadzeniu badań spektroskopowych, odparować na odparowywaczu
mieszaninę azeotropową butanolu z wodą (pochodzącą z pożywki), ewentualny
pozostały na ściankach w postaci filmu związek rozpuścić w niewielkiej ilości DMSO
i nanieść na krążki bibułowe (max. 20μl/krążek) na uprzednio przygotowanych
szalkach Petriego z wysianymi powierzchniowo szczepami testowymi Candida
albicans (podłoże YEPG), Bacillus cereus i E. coli (podłoże TSB). Po 24 godzinach
inkubacji (w 30
0
C w przypadku szczepu grzybowego i 37
0
C w przypadku szczepów
bakteryjnych) odczytać ewentualne strefy zahamowania wzrostu.
(Koniec trzecich zajęć – ostatnich)
Sprawozdanie
Opisać wygląd kolonii promieniowca, obserwacje mikroskopowe zilustrować zdjęciami lub
rysunkami. Opisać wygląd hodowli płynnej po 7 dniowej inkubacji. Załączyć do
sprawozdania uzyskane podczas pomiarów spektroskopowych wykresy. Opisać i
przeanalizować ewentualną zmianę koloru fazy butanolowej po ekstrakcji. Opisać ewentualne
wyniki badań aktywności biologicznej. Obecność jakich metabolitów wtórnych udało się
potwierdzić?
Sprawozdanie powstało na podstawie/literatura uzupełniająca:
1. Biotechnologia i chemia antybiotyków, A. Chmiel, S. Grudziński Wydawnictwo
Naukowe PWN, 1998
2.
Bentley, S.D. et al. Complete genome sequence of the model actinomycete
Streptomyces coelicolor A3(2). Nature 417, 141-147 (May 9, 2002).
3.
http://www.hero.ac.uk/sites/hero/uk/research/archives/2002/genome_keys_unlock_nat
ure1588.cfm
4.
http://microbewiki.kenyon.edu/index.php/Streptomyces
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
Wyszukiwarka
Podobne podstrony:
BIOSYNTEZA BIAŁKA
transkrypcja biosynteza rna, INNE KIERUNKI, biologia
Oleksyszyn, biochemia II, biosynteza nukleotydów
biosynteza witamin
BIOSYNTEZA PURYN, Biochemia
BIOSYNTEZA BIALEK
KWASY NUKLEINOWE I BIOSYNTEZA BIAŁEK, Spis treści
Biosynteza lipidow2
Mineralokortykoidy struktura, biosynteza, przedstawiciele,
Biosynteza bialka
BIOSYNTEZA HORMONÓW ppt
Biosynteza aminokwasów
BIOSYNTEZA BIAŁEK, fizjoterapia, biologia medyczna
Biochemia TZ wyklad 10 biosynteza I id 86517
Biochemia TZ wyklad 11 biosynteza II aminokwasy low
Collagens structure, function, and biosynthesis
więcej podobnych podstron