
Biosynteza aminokwasów
Sergiusz Winogrodzki

Wstęp
20 podstawowych aminokwasów dzielimy na:
-endogenne (gdy są syntezowane przez organizm);
-egzogenne (gdy są niezbędne dla organizmu).
Rośliny i mikroorganizmy syntetyzują wszystkie.
Ssaki syntetyzują mniej – człowiek 11 z nich.
Aminokwasy dzielimy również ze względu na
różne
właściwości fizykochemiczne (zależne od ich
reszt).

Wstęp
Szlaki biosyntezy aminokwasów są różne.
Szkielet węglowy wszystkich
aminokwasów pochodzi
z kluczowych metabolitów pośrednich w
głównych szlakach
metabolicznych:
-glikoliza;
-cykl kwasu cytrynowego;
-szlak pentozofosforanowy.

Wstęp
Aminokwasy dzielimy na sześć rodzin
biosyntetycznych,
w zależności od metabolitu
pośredniego, z którego powstały.
Grupa α-aminowa pochodzi zwykle z
transaminacji
glutaminianu.

Wstęp
Cykl kwasu cytrynowego:
α-ketoglutaran > Glu > Gln/Pro/Arg
szczawiooctan > Asp > Ans/Met/Thr/Lys
(Thr > Ile)
Glikoliza:
3-fosfoglicerynian > Ser > Cys/Gly
pirogronian > Ala/Val/Leu
fosfoenolopirogronian > Phe/Tyr/Trp

Wstęp
Szlak pentozofosforanowy:
erytrozo-4-fosforan > Phe/Tyr/Trp
rybozo-5-fosforan > His

Metabolizm aminokwasów
Aminokwas + α-ketoglutaran > α-ketokwas +
glutaminian.
Aminokwas > łańcuch węglowodorowy +
amoniak.
Szkielet węglowodorowy > keton (aminokwasy
ketogenne).
Szkielet węglowodorowy > glukoza (aminokw.
glukogenne).
(Może też powstać acetylo~S-CoA, reakcje
egzoergiczne
tworzące ATP itd.).

Metabolizm aminokwasów
Egzogenna fenyloalanina >
endogenna tyrozyna.
Egzogenna metionina > endogenna
cysteina.
Glutaminian > glutamina.
Seryna/treonina > glicyna.

Skąd NH
3
?
Bakterie diazotroficzne wiążą azot
atmosferyczny przy
pomocy reduktazy i nitrogenazy (kompleks
nitrogenazy).
Elektrony ze zredukowanej ferredoksyny są
przenoszone
przez reduktazę na nitrogenazę z użyciem ATP.
N
2
+8e+8H
+
+16ATP+16H
2
O >
2NH
3
+H
2
+16ADP+16P
i
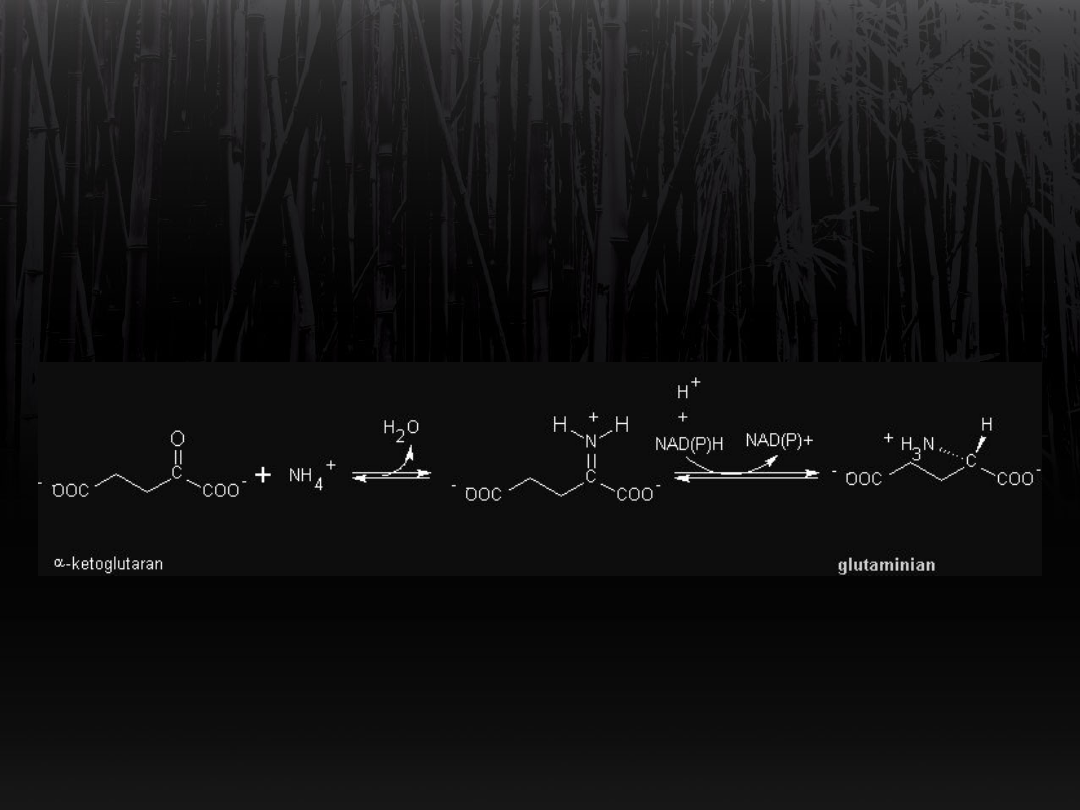
Synteza glutaminianu
Ważnym enzymem w tej reakcji jest
dehydrogenaza
glutaminianowa, która nie rozróżnia
NADH i NADPH.
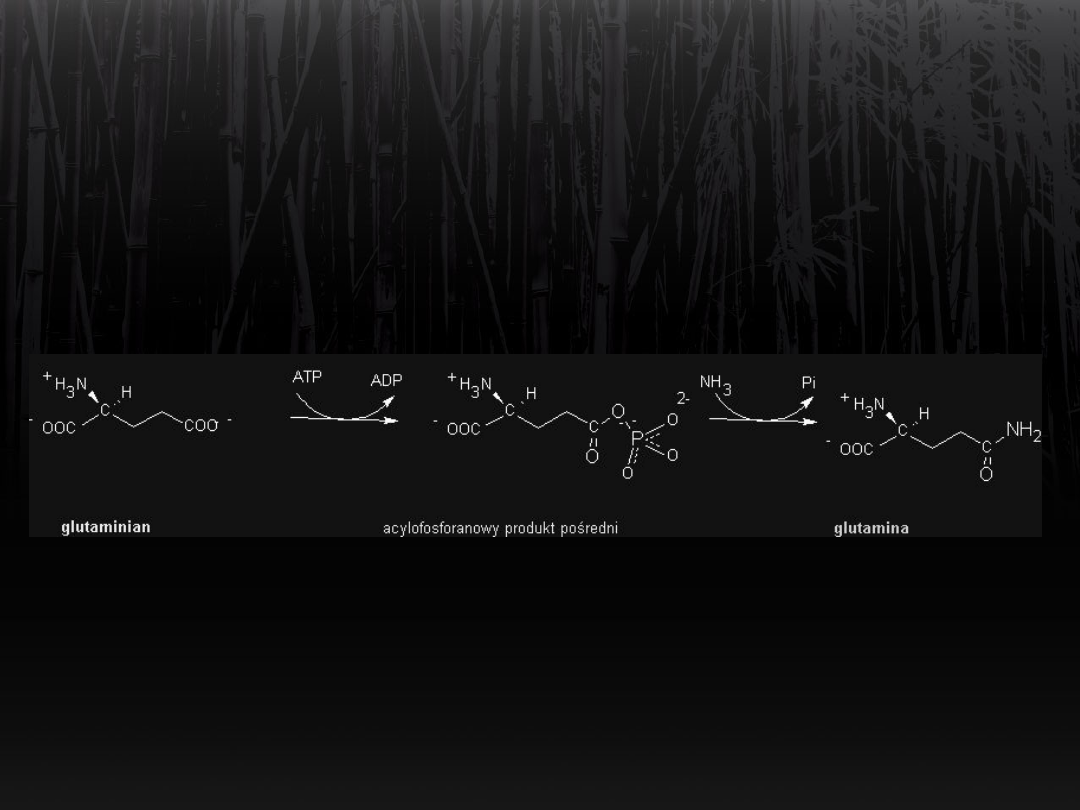
Synteza glutaminy

Synteza glutaminianu
U prokariontów występuje syntaza
glutaminianowa
przekształcająca glutaminę w
glutaminian:
α-ketoglutaran+glutamina+NADP+H
+
<> 2glutaminian+NADP
+

Transaminacja
Grupa α-aminowa + α-ketokwas > α-aminokwas.
Dawcą grupy α-aminowej może być każdy
aminokwas
z wyjątkiem lizyny, treoniny, proliny i
hydroksyproliny.
(Dwa ostatnie – iminokwasy z grupą iminową
wbudowaną
w pierścień pirolowy).
Ketokwasami mogą być:
pirogronian, szczawiooctan, α-ketoglutaran.
(Odpowiednie enzymy: AlAT, AspAT, GluAT).
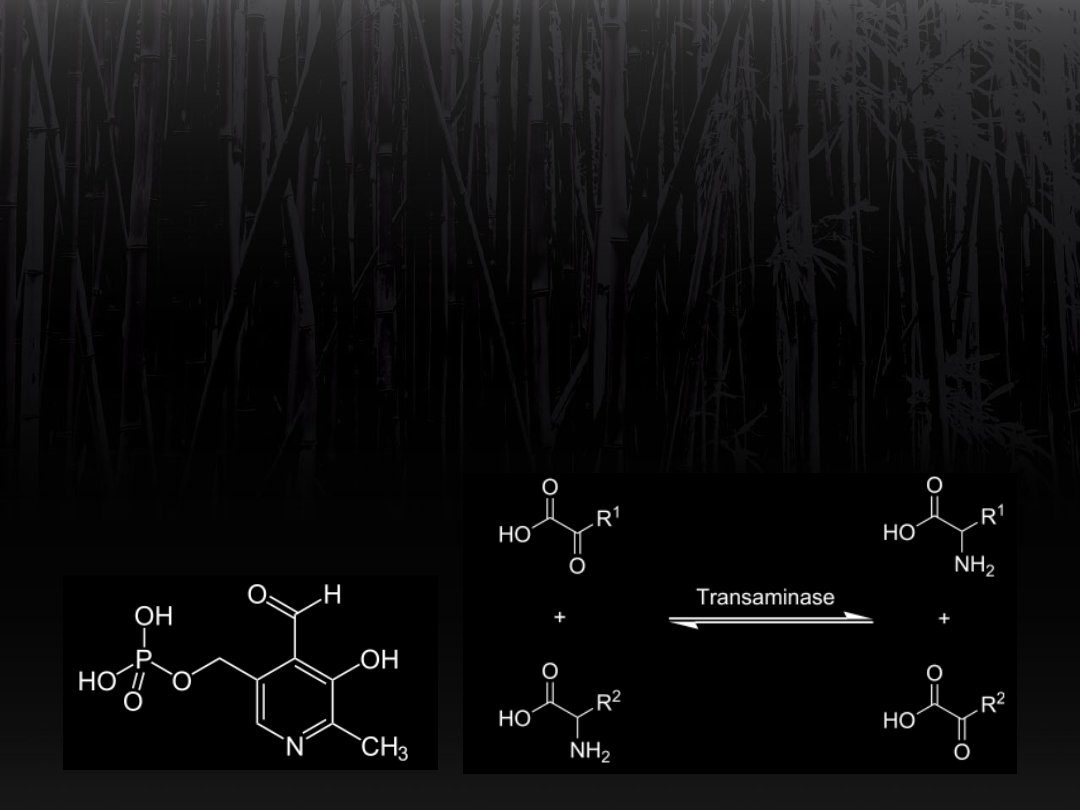
Transaminacja
Przenośnik grupy -NH
2
to fosforan
pirydoksalu (koenzym).
Jest to pochodna witaminy B
6
(pirydoksyny).
Reakcje te są odwracalne i zachodzą
w równowadze.
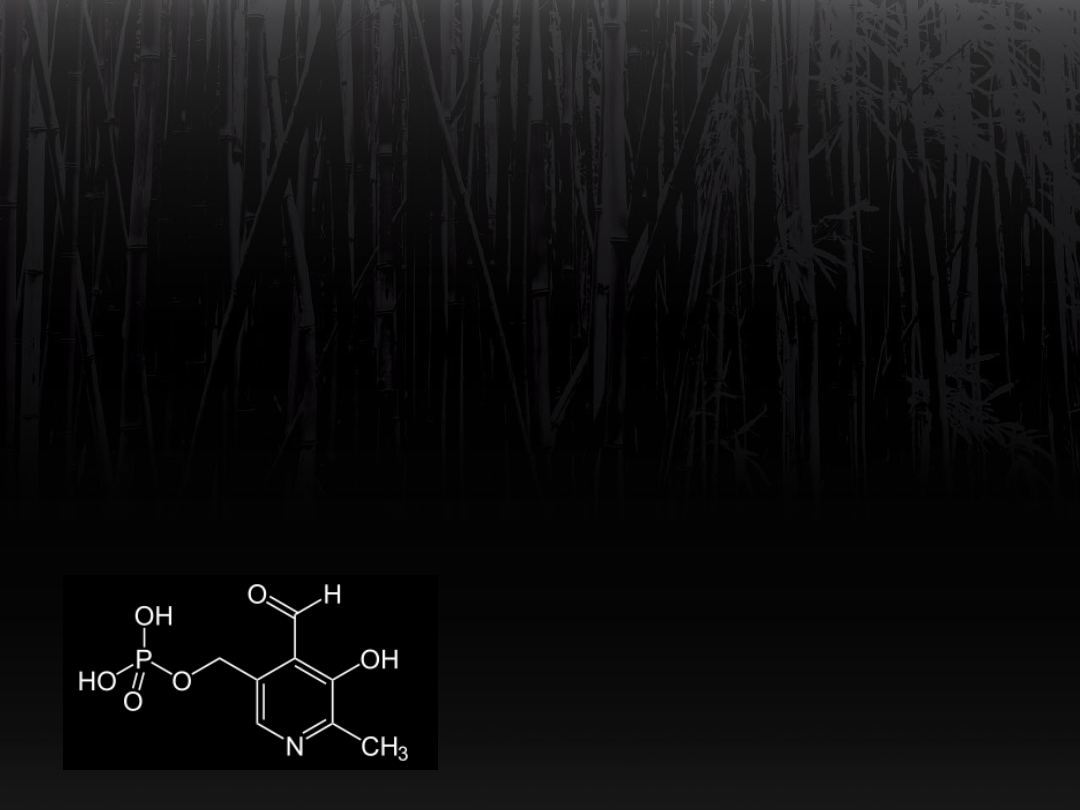
Transaminacja
Grupa aldehydowa fosforanu pirydoksalu
wchodzi w reakcję
z grupą aminową aminokwasu, odłącza się
cząsteczka H
2
O.
Podwójne wiązanie między azotem i
węglem.
Powstaje przejściowa zasada Schiffa.
Rozpad wiązania przy udziale cząsteczki
wody.
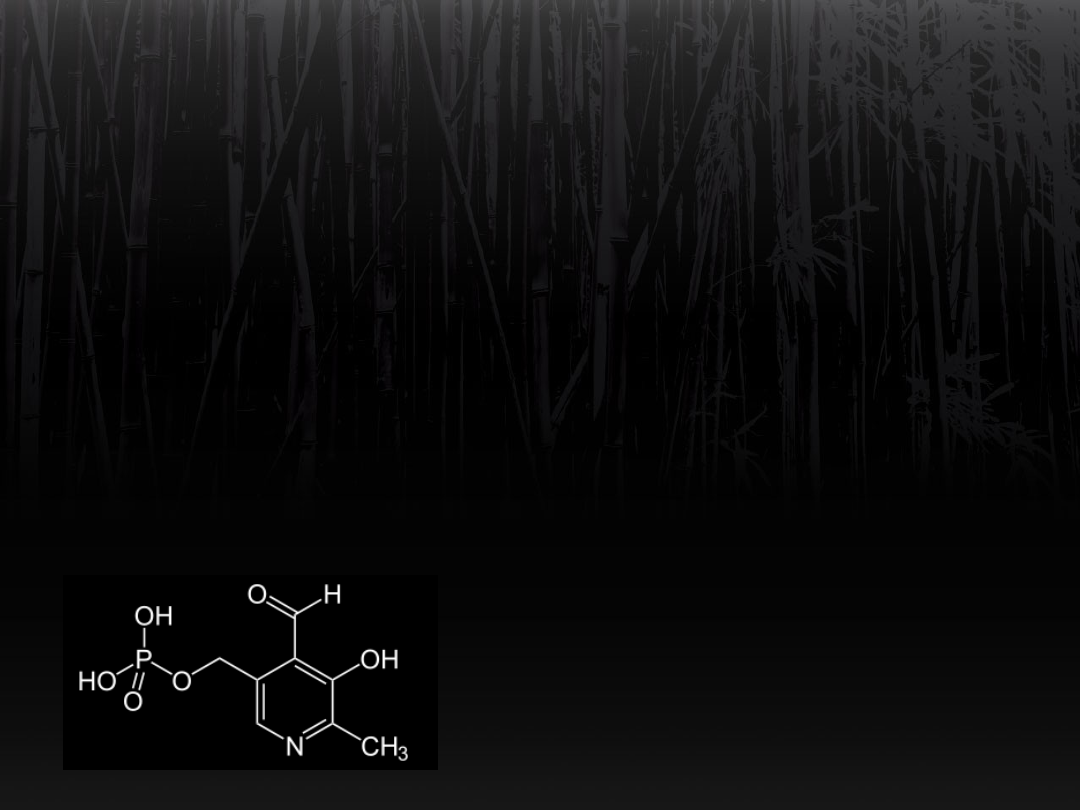
Transaminacja
Fosforan pidydoksalu > fosforan
pirydoksaminy.
Grupa aminowa reaguje z grupą
ketonową α-ketokwasu.
(Przekazanie grupy aminowej na
szkielet węglowodorowy).
Koenzym się odtwarza.
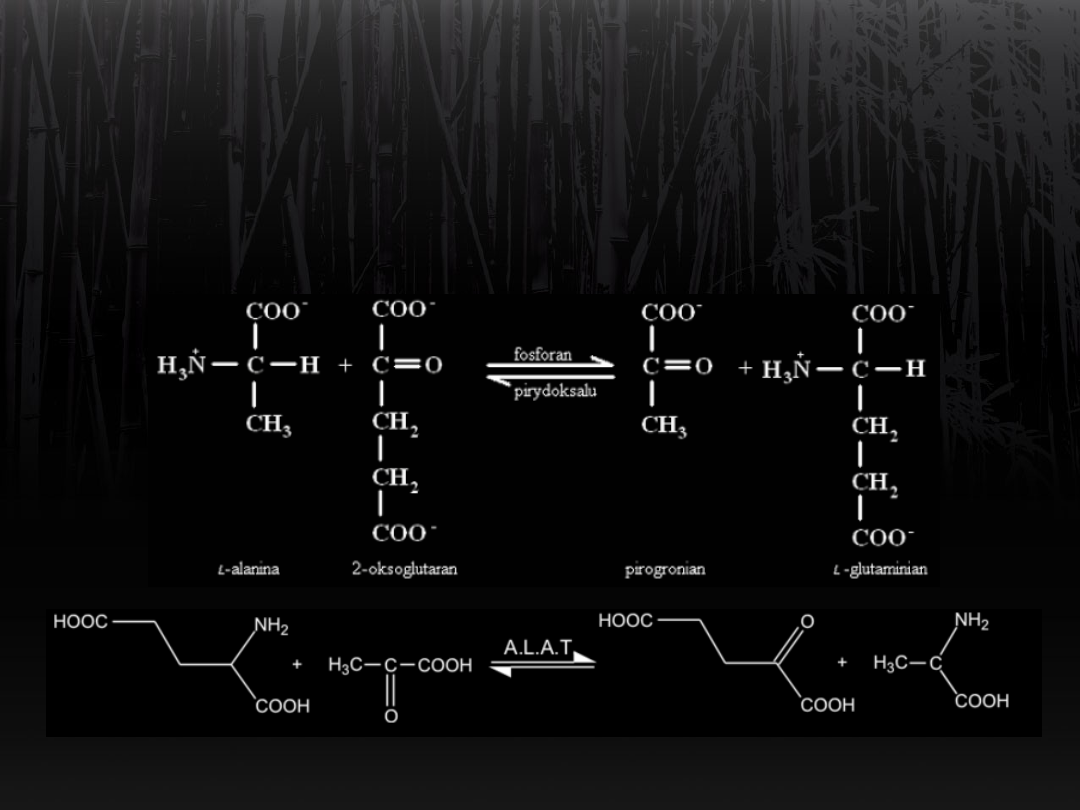
Transaminacja
Na przykładzie aminotransferazy
alaninowej:
Transaminacja
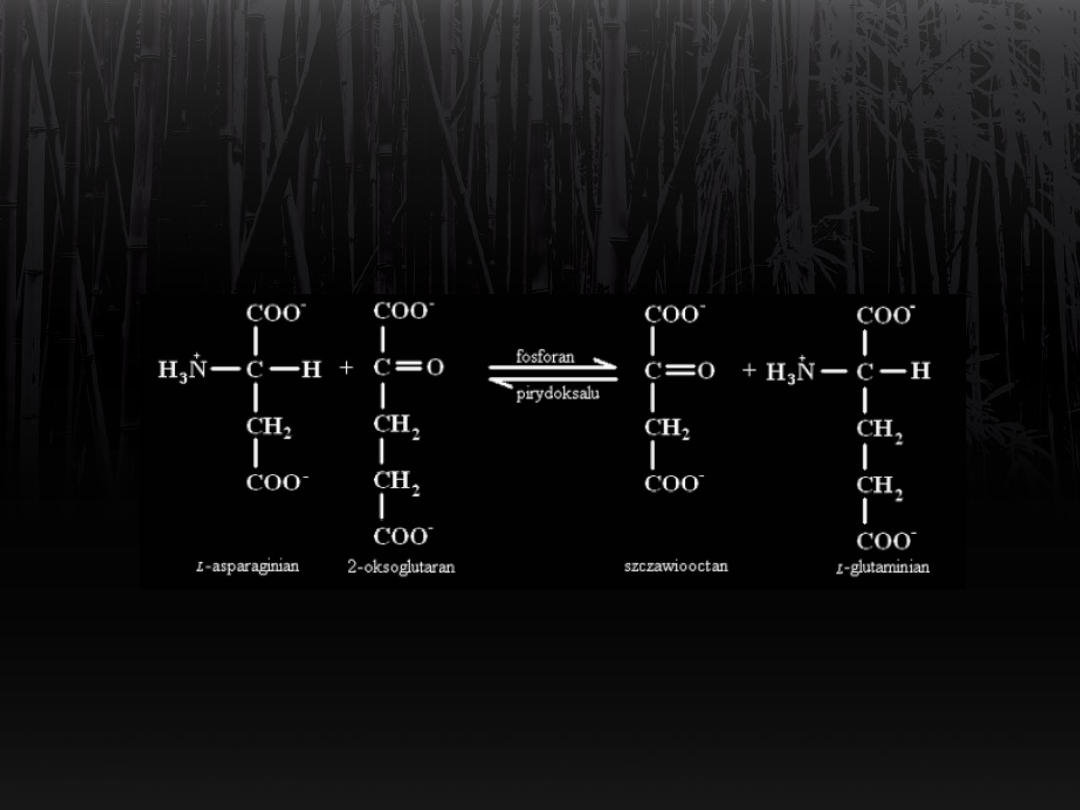
Na przykładzie aminotransferazy
asparaginianowej:
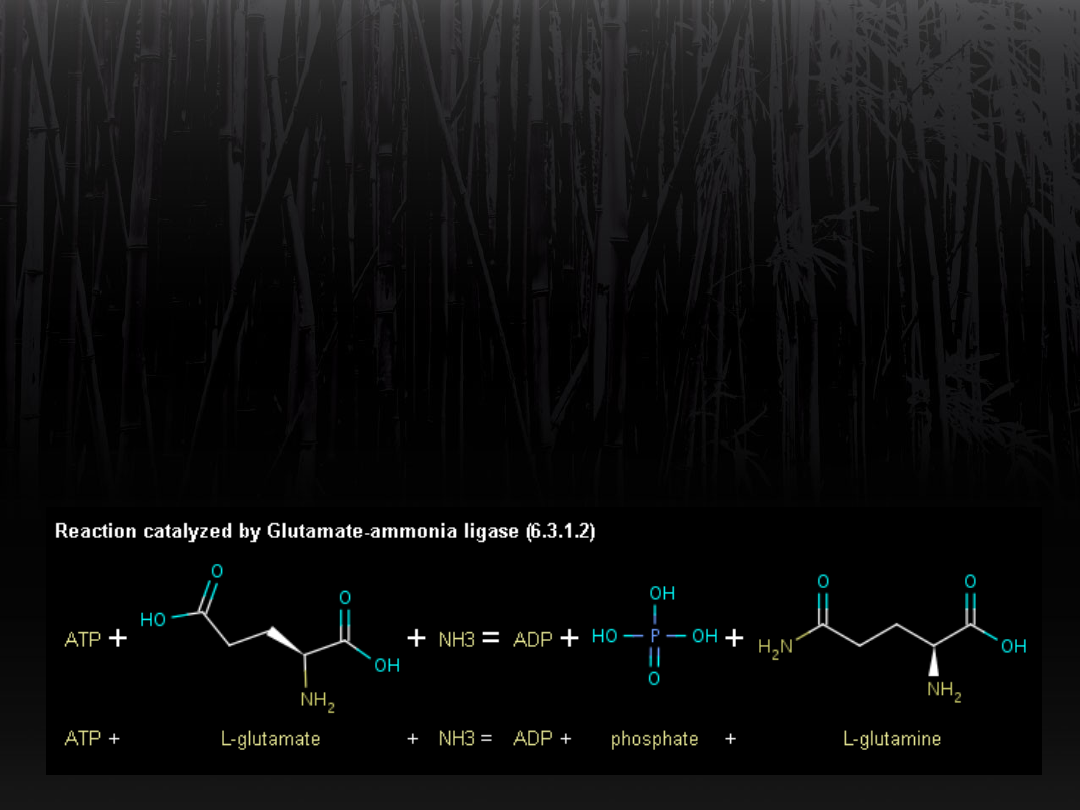
Wiązanie amoniaku przez
glutaminian
Syntetaza glutaminowa katalizuje
powstawanie wiązań
C-N. Nadmiar amoniaku jest wiązany
przez grupę
γ-karboksylową kwasu glutaminowego.
Powstaje glutamina.
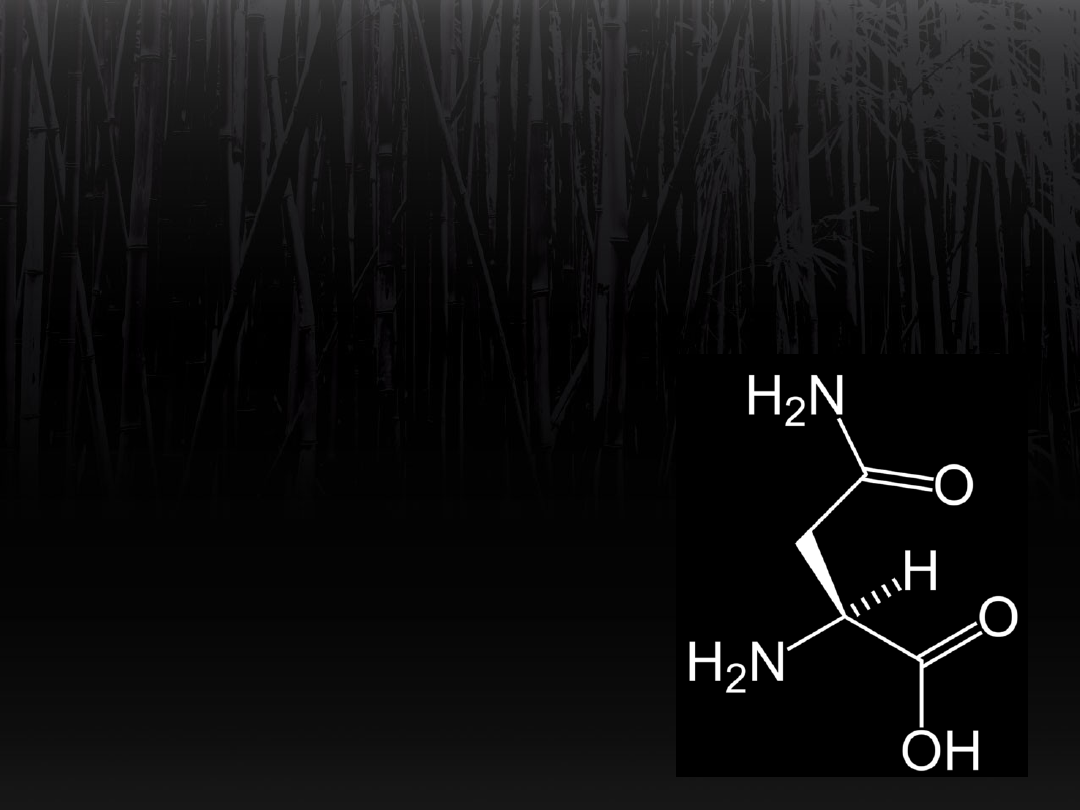
Biosynteza asparaginy z
glutaminy
Fragment –NH
2
z grupy amidowej
glutaminy jest przenoszony
na grupę β-karboksylową asparaginianu.
Powstaje asparagina.
ATP > AMP + pirofosforan.
(Syntetaza asparaginowa).
Asparaginaza może cofnąć tę reakcję
poprzez hydrolityczny rozpad wiązania
amidowego w asparaginie.
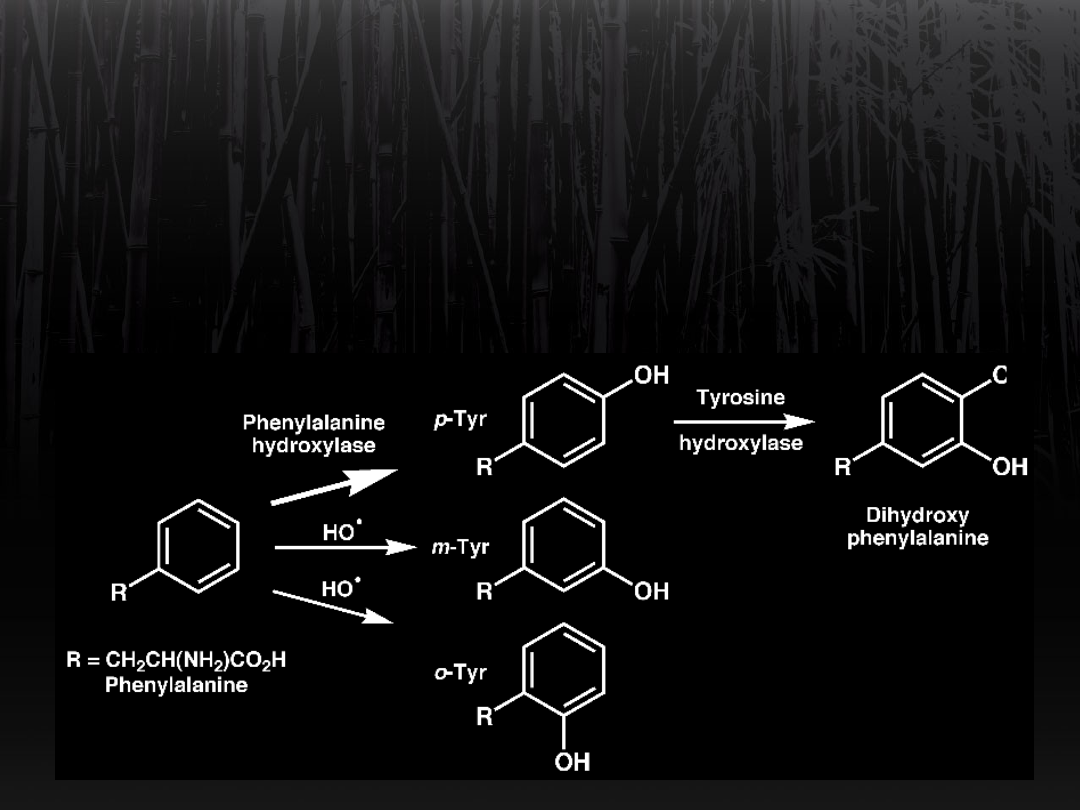
Przemiana fenyloalaniny w
tyrozynę
Uczestniczy w niej tlen cząsteczkowy,
reduktorem jest THF,
który odłączając dwa wodory
przechodzi w DHF.
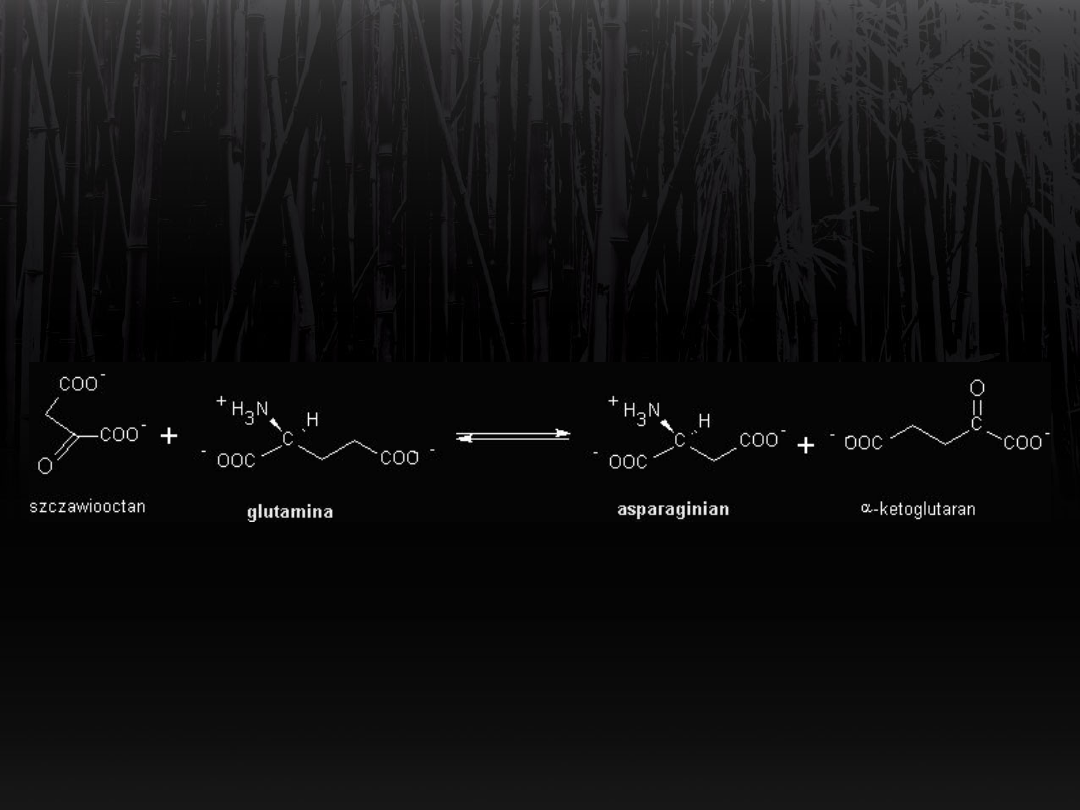
Synteza asparaginianu
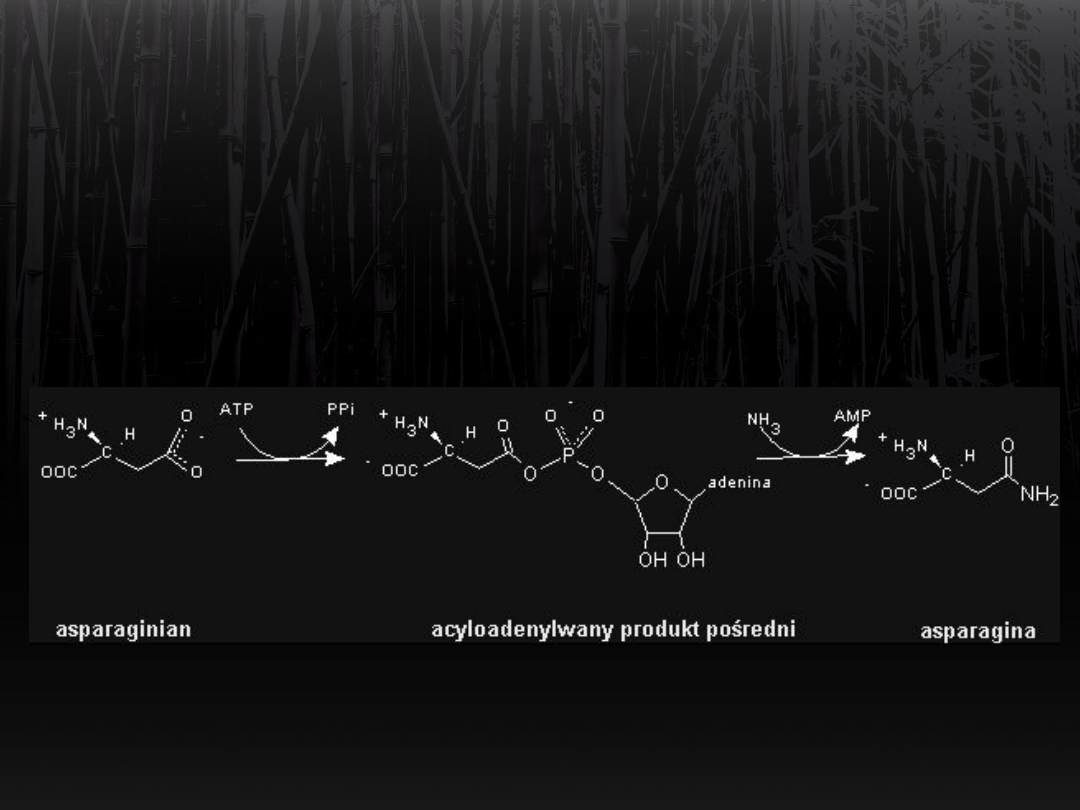
Synteza asparaginy
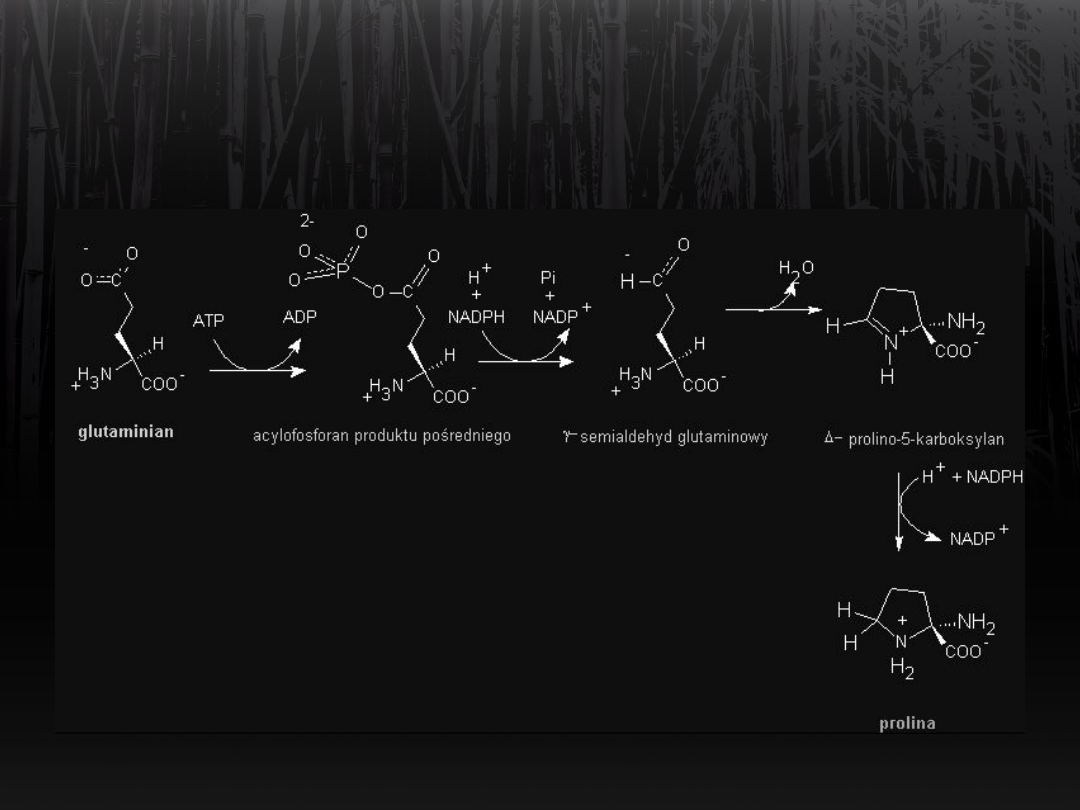
Synteza proliny
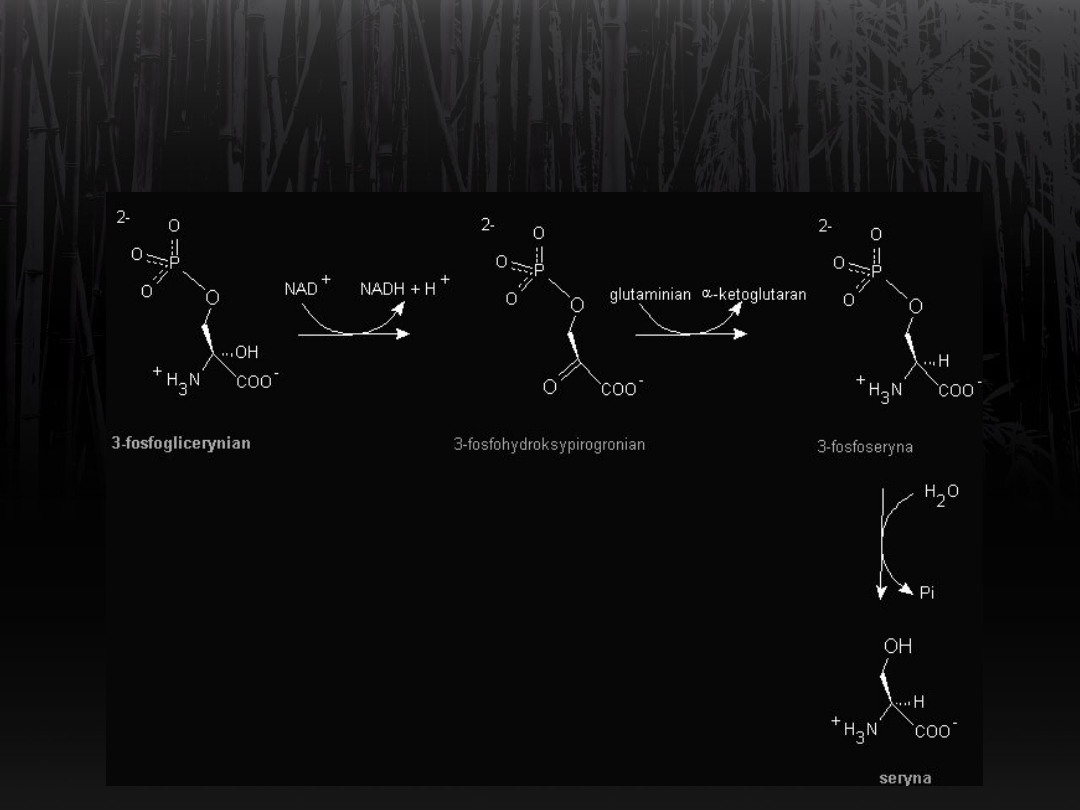
Synteza seryny
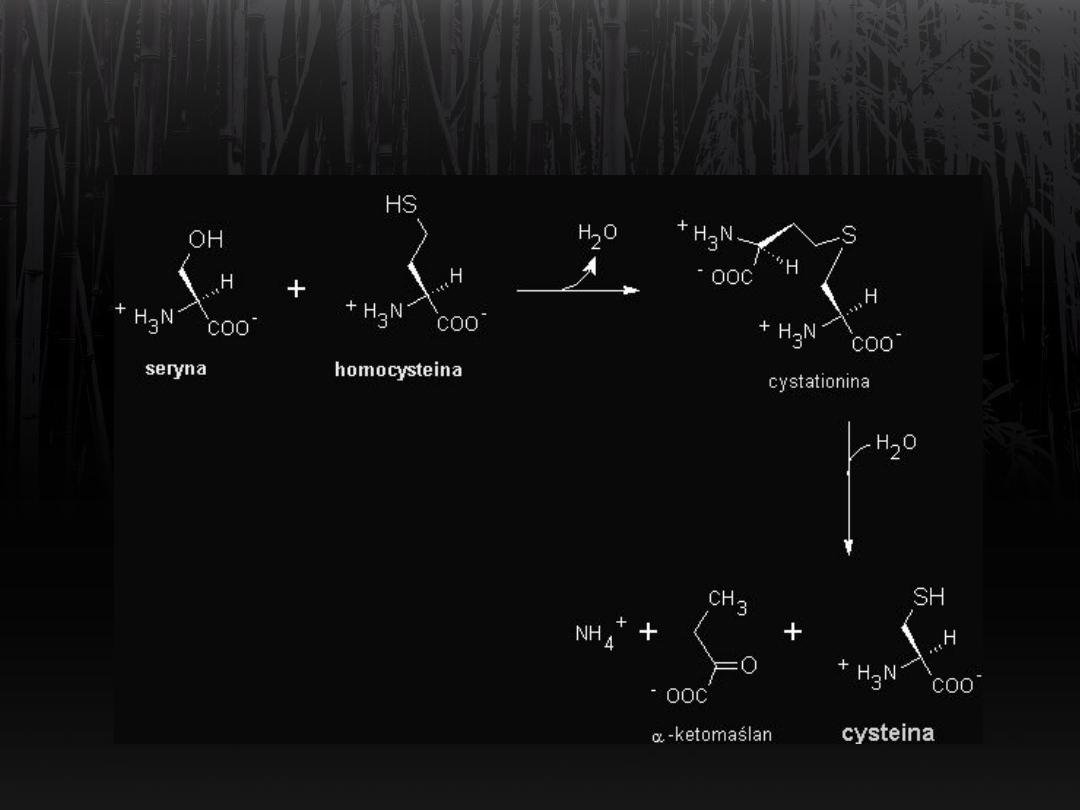
Synteza cysteiny
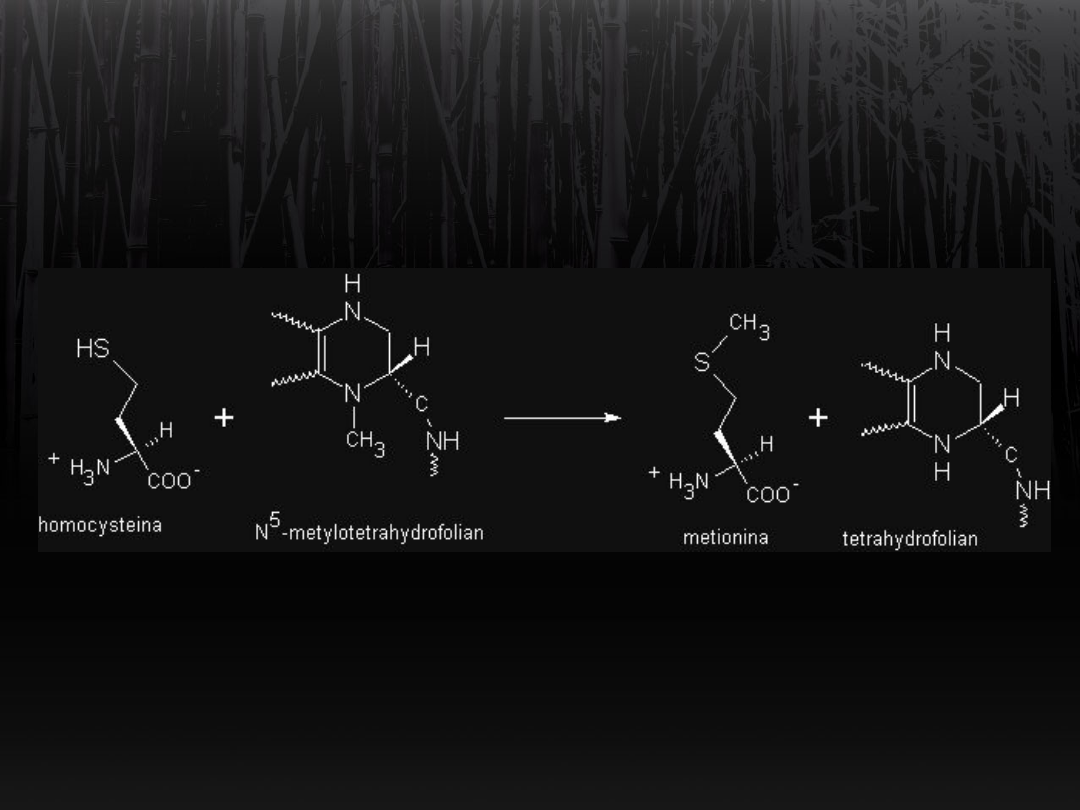
Synteza metioniny
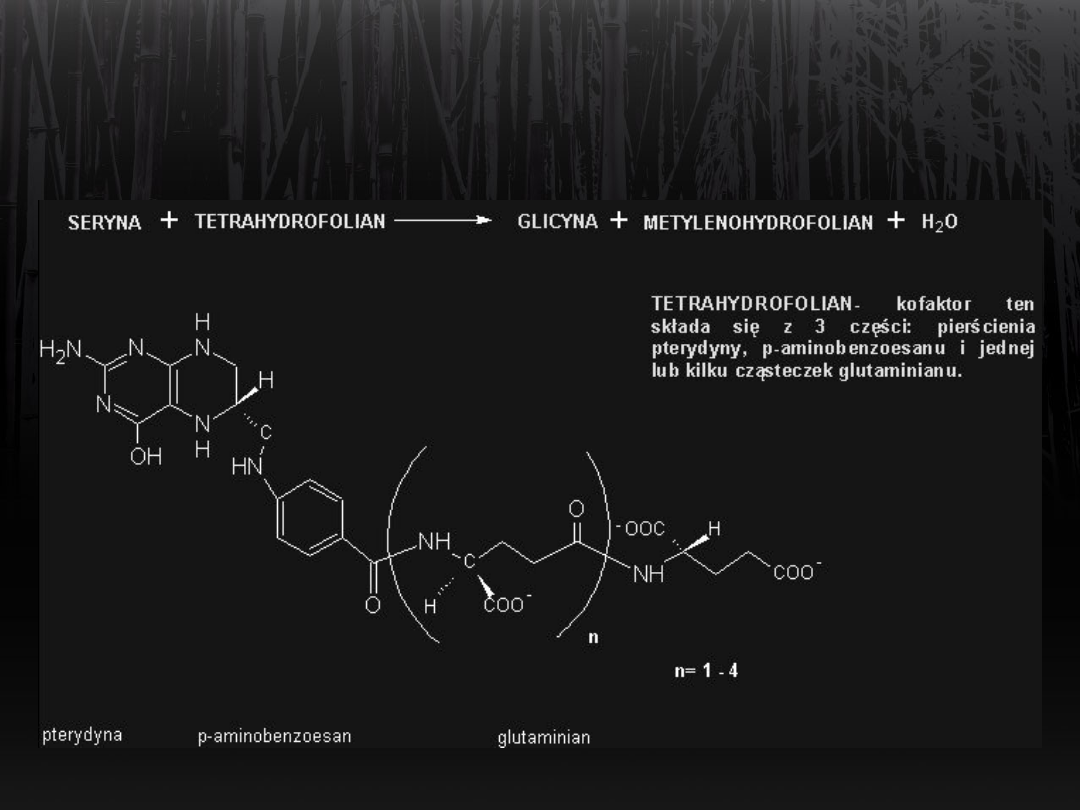
Synteza glicyny

Synteza leucyny

Synteza waliny
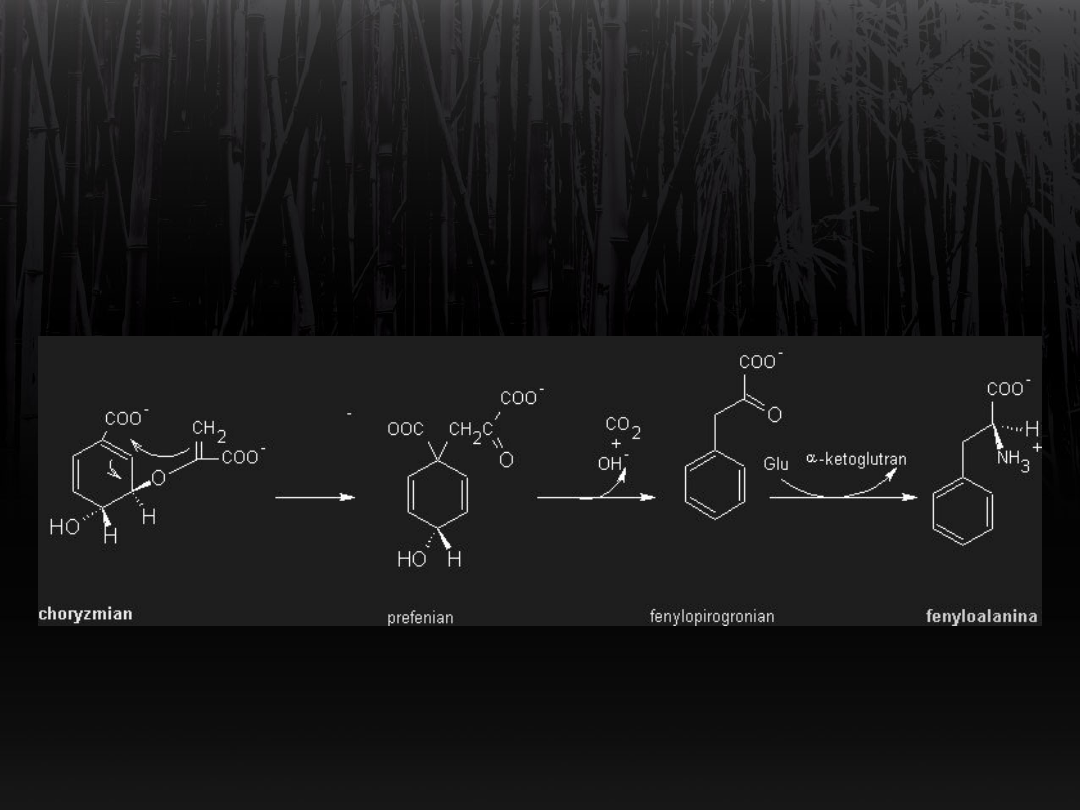
Synteza fenyloalaniny
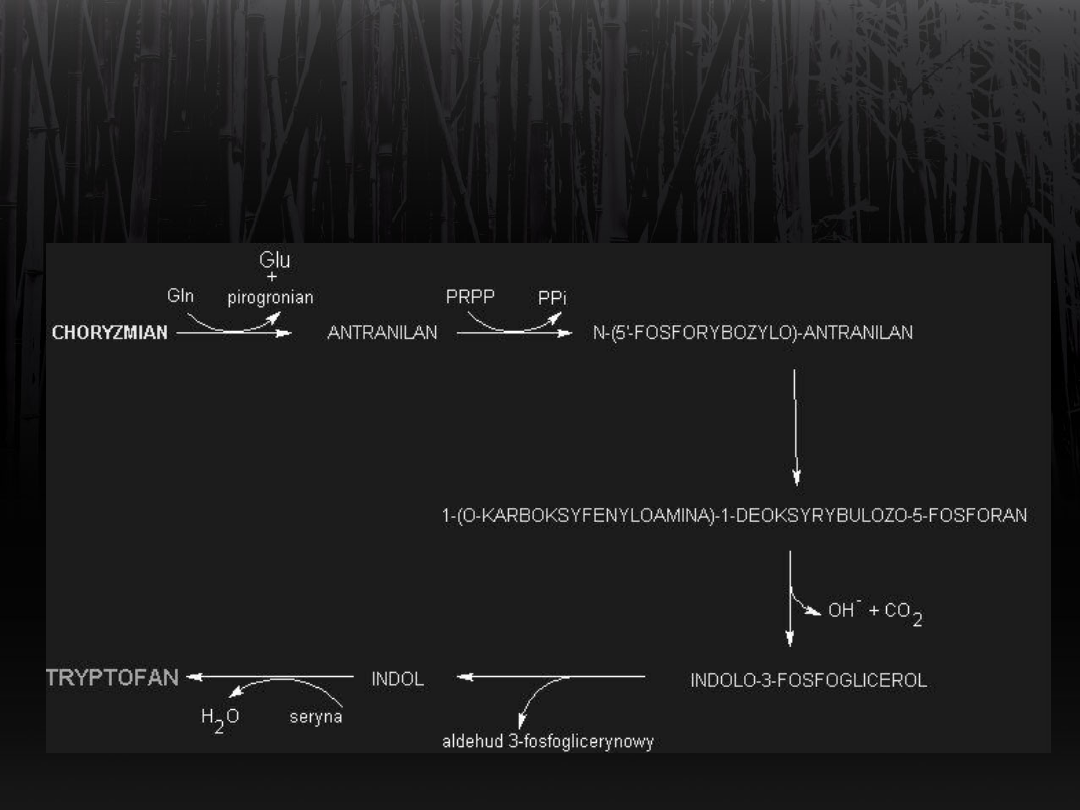
Synteza tryptofanu
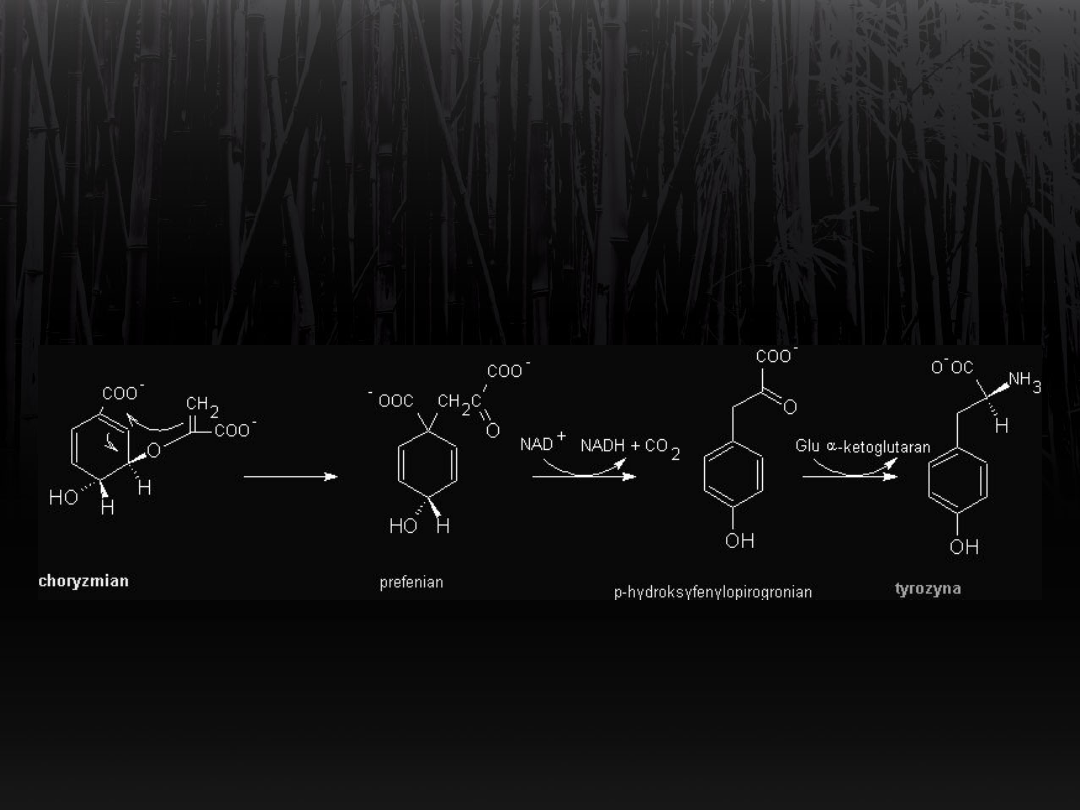
Synteza tyrozyny

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
biosynteza aminokwasow endogennych(glutaminian, glutamina, alanina, cysteina, glicyna)
zestaw74, Rola t-RNA w biosyntezie aminokwasow
PREZENTACJA BIOSYNTEZA AMINOKWASÓW EGZOGENNYCH
Biochemia TZ wyklad 11 biosynteza II aminokwasy low
Biochemia TZ wyklad 11 biosynteza II aminokwasy low
aminokwasy
AMINOKWASY 7
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
8a Syntezy prostych aminokwasów
Wykład katabolizm azotu aminokwasów
aminokwasy 1
BIOSYNTEZA BIAŁKA
Metabolizm aminokwasów
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
cwiczenie 7 Aminokwasy id 125541
aminokwasy wersja IV
3 NOWY Aminokwasy II 2012 2013(1)
Aminokwasy
więcej podobnych podstron