
Transaminacja i
dezaminacja

Transaminacja i dezaminacja są to proste przemiany
aminokwasów zazwyczaj zachodzące w cytoplazmie.
Niektóre aminokwasy najpierw ulegają reakcji
transaminacji co oznacza, że grupa aminowa zostaje
przeniesiona na inny związek. Inne są dezaminowane
bezpośrednio bez uprzedniego odczepienia reszty
aminowej. W obu przypadkach produktami są ketokwasy i
amoniak. Ketokwasy mogą być wykorzystywane do
syntezy innych aminokwasów, cukrów lub przekształcone
w tłuszcze zapasowe. Niektóre ketokwasy można zużyć na
cele energetyczne w glikolizie i cyklu Krebsa. Amoniak
jest silnie toksyczny, powoduje podrażnienie śluzówki
oczu, nosa i dróg oddechowych. NH
3
to związek
szkodliwy trzeba go więc zneutralizować np. przez
utlenienie go do tlenków azotu.
Co to jest?
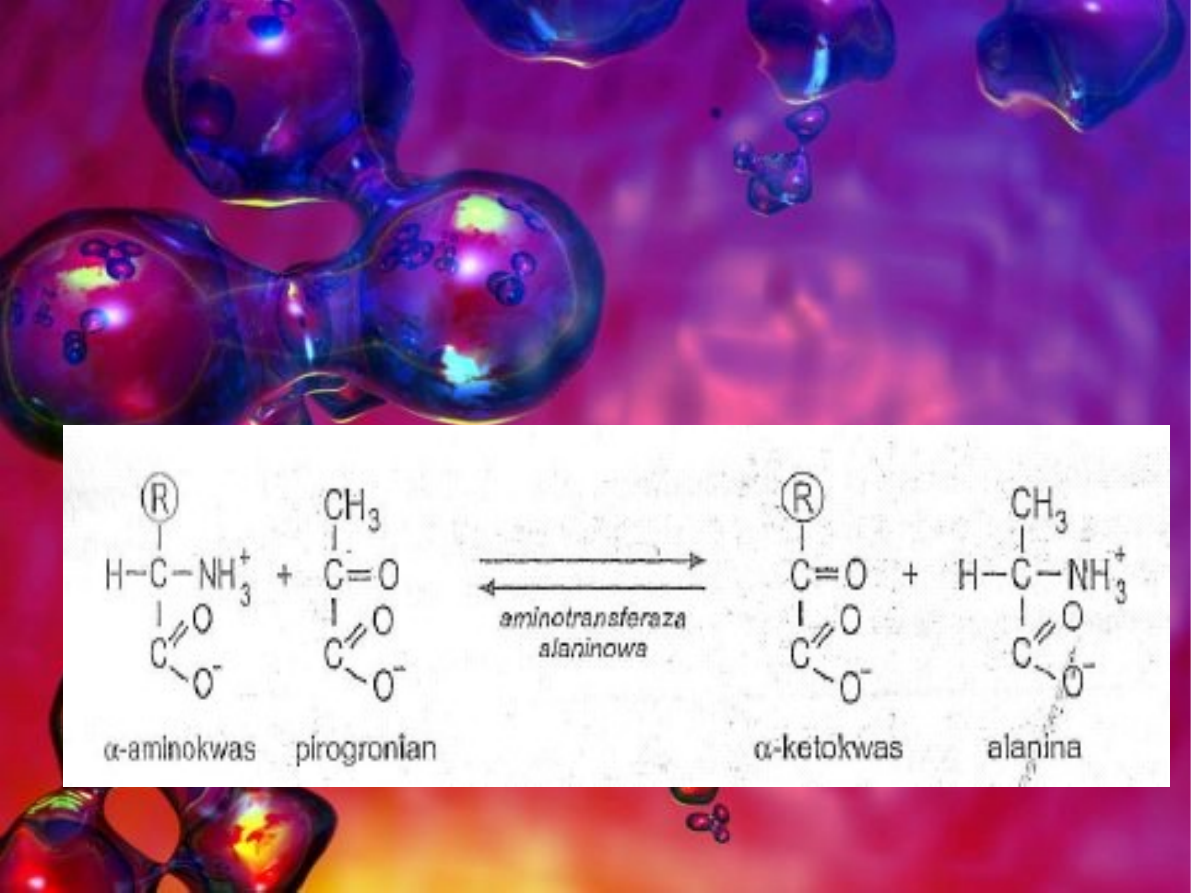
Ketokwasy:
- pirogronian (trójwęglowy ketokwas)
Transaminacja
Jest to reakcja odwracalna polegająca na odczepieniu grupy
aminowej należącej do aminokwasu i przyłączeniu jej do jednego z
trzech ketokwasów.
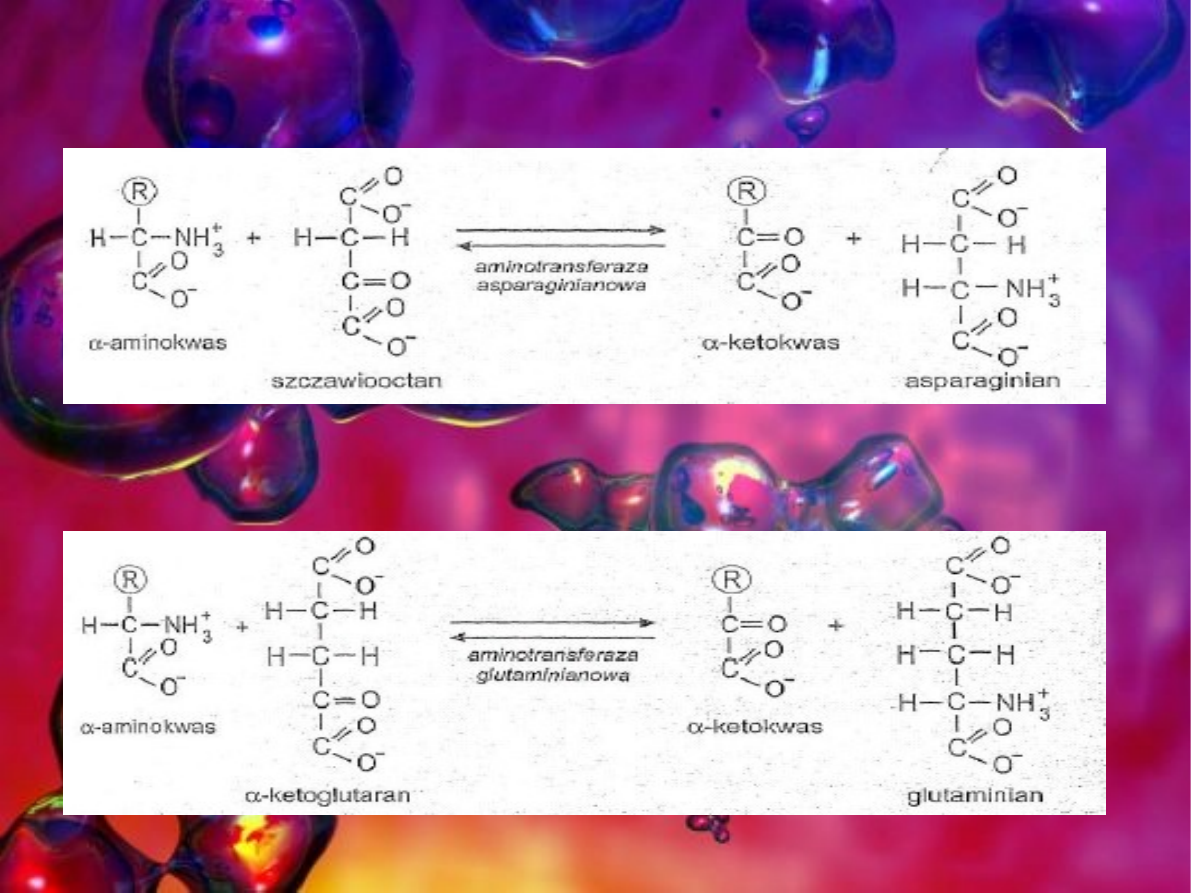
- szczawiooctan, forma zjonizowana kwasu szczawiowooctowego
- α-ketoglutaran (pięciowęglowy ketonokwas)
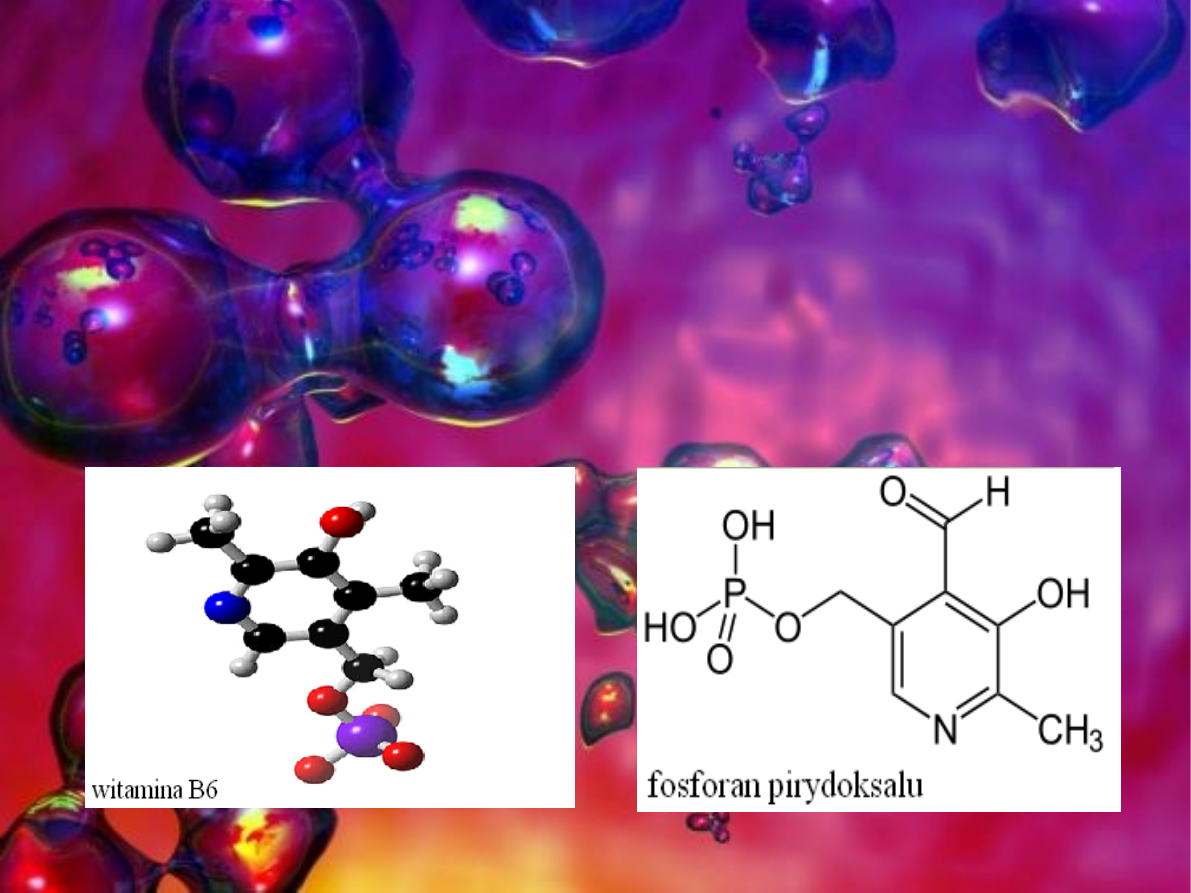
W wyniku jej przebiegu aminokwas przekształca się
w nowy ketokwas a ketokwas, który odbiera grupę
aminową zmienia się w nowy aminokwas. Podczas
reakcji odtwarza się pochodna witaminy B
6
czyli
fosforan pirydoksalu który pełni funkcję przenośnika
grupy aminowej.

Proces ten katalizowany jest przez transaminazy inaczej
nazywane aminotransferazami, które są także enzymami
wskaźnikowymi mającymi duże znaczenie w diagnostyce
medycznej.Są to przede wszystkim dwa enzymy:
- aminotransferaza alaninowa oznaczana skrótami: AlAT, ALAT,
ALT lub GPT
- aminotransferaza asparaginianowa oznaczana skrótami: AST,
AspAT, GOT
Transaminacje można porównać do „wycinania” grup
aminowych z wielu aminokwasów i „wklejaniu” ich na nieliczne
akceptory. Powstałe w tej reakcji produkty ułatwiają dalszą
przemianę azotu aminowego. Glutaminian bardzo łatwo
uwalnia grupy aminowe w postaci amoniaku włączanego do
cyklu mocznikowego, asparaginian przekazuje grupy aminowe
bezpośrednio do tego cyklu a alanina pełni role transportera
grup aminowych z mięśni do wątroby gdzie zachodzi synteza
mocznika.
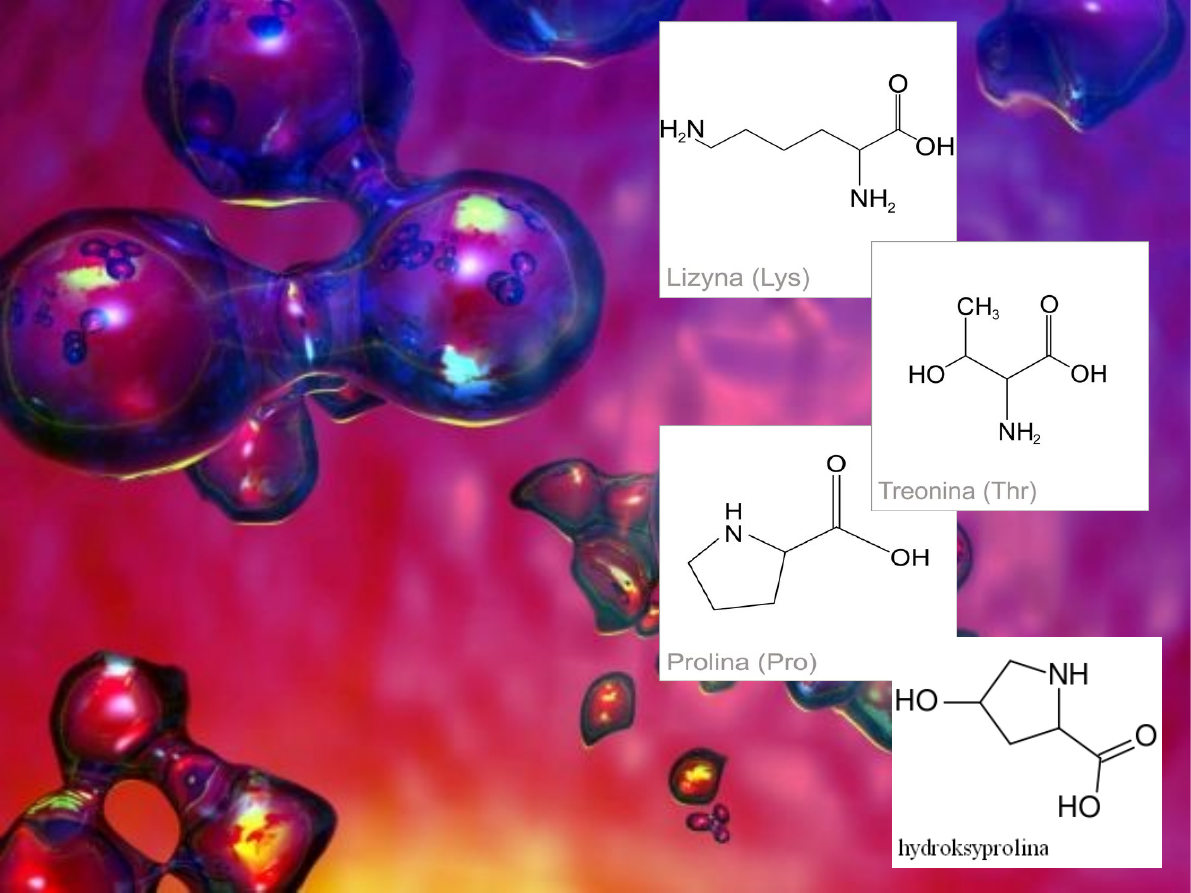
Nie wszystkie aminokwasy
podlegają transaminacji. Wśród nich
jest lizyna (C
6
H
14
N
2
O
2
) należąca do
grupy aminokwasów niezbędnych
które nie mogą być syntezowane w
organizmie człowieka i musza być
dostarczane z dietą. Kolejnym jest
treonina (C
4
H
9
NO
3
) która tak samo
jak lizyna dostarczana jest z dietą,
jest to aminokwas optycznie czynny
posiadający drugi asymetryczny
atom węgla obok węgla α. Trzecim z
aminokwasów jest prolina (C
5
H
9
NO
2
)
zawierająca w swej strukturze
pięcioczłonowy pierścień
pirolidynowy . Ze względu na
obecność dodatkowego wiązania
węgiel–azot jest często błędnie
nazywana iminokwasem jednak z
punktu widzenia chemii nie jest
iminą a aminą drugorzędową.
Ostatnia jest hydroksyprolina
(C
5
H
9
NO
3
), produkt reakcji
hydroksylowania proliny, w której
bierze udział kwas askorbinowy.
Dezaminacja
Jest to reakcja chemiczna polegająca na eliminacji grupy
aminowej z aminokwasu w postaci amoniaku (NH
3
). Proces
może zachodzić tlenowo i beztlenowo. Niektóre z tych reakcji
zachodzą drogą oksydoredukcji. Noszą one nazwę oksydacyjnej
deaminacji. Takiej dezaminacji ulega przede wszystkim
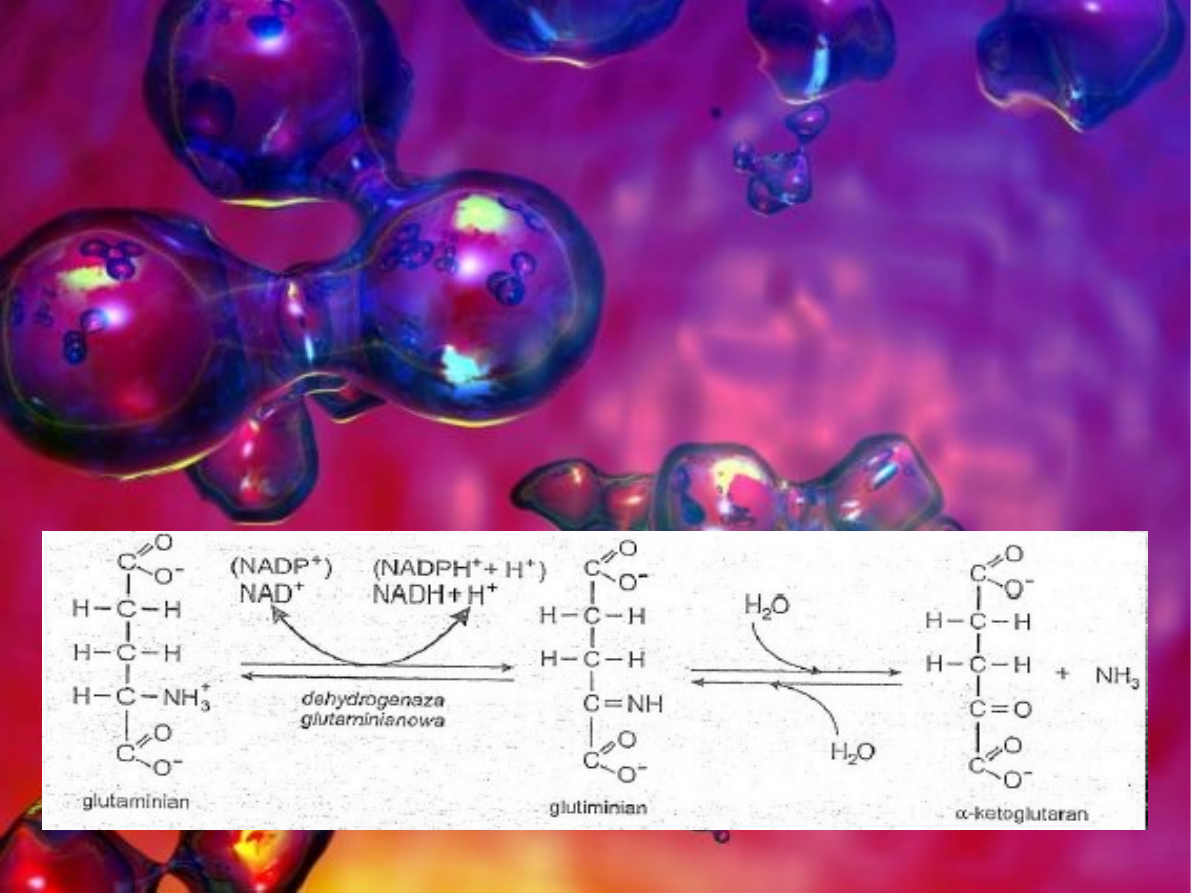
glutaminian. Oksydacyjna deaminacja glutaminianu polega na
odłączeniu grupy aminowej i utlenianiu węgla α do grupy
ketonowej. Powstaje α-ketoklutaran i amoniak.
Najważniejszym enzymem katalizującym tego typu reakcje jest
dehydrogenaza glutaminianowa której kofaktorem jest NAD
+ lub NADP
+
. Przy udziale wody nastepuje rozpad utlenianego
intermediatu do ketoglutaranu.
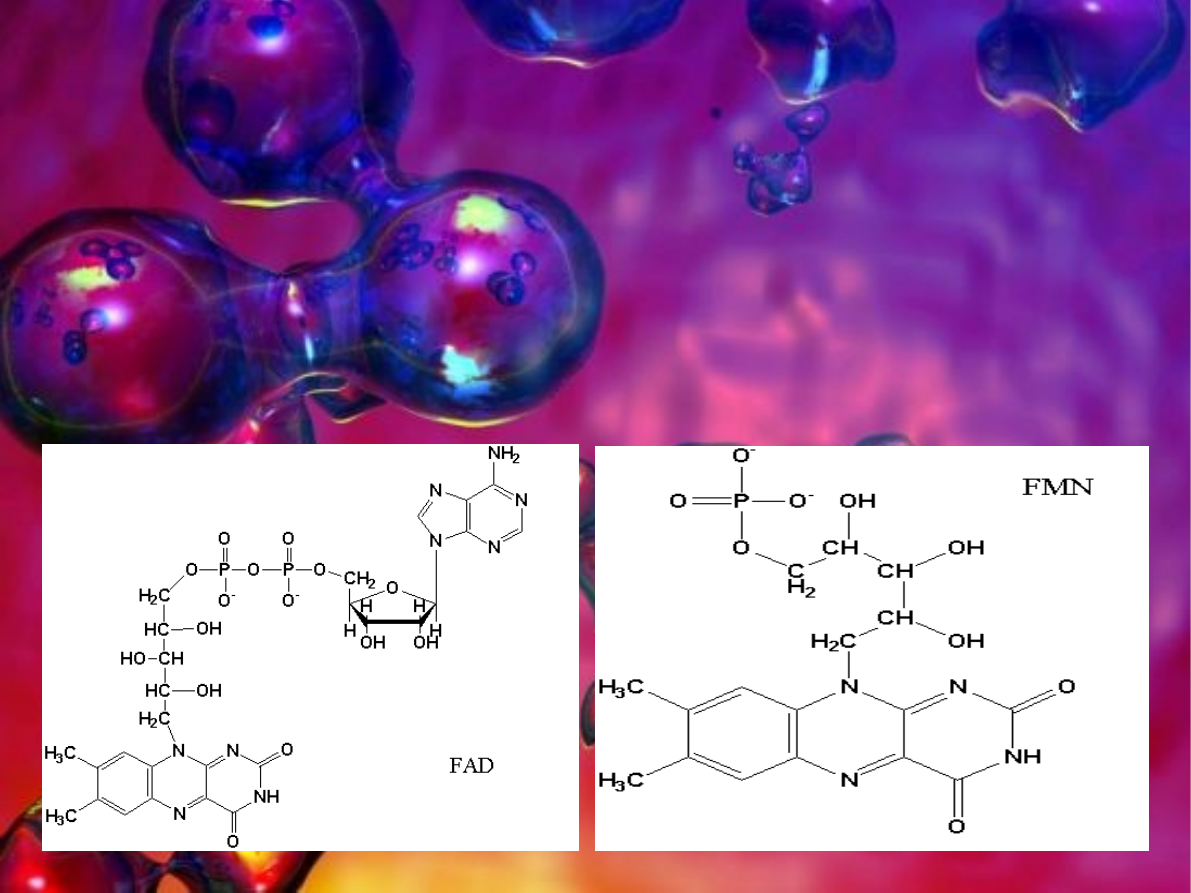
W procesie deaminacji mają znaczenie także oksydazy
aminokwasowe współdziałające z nukleotydami flawinowymi
takimi jak FMN lub FAD. FMN (C
17
H
21
N
4
O
9
P) jest to
mononukleotyd flawinowy w organizmie wytwarzany z
witaminy B
2
. Uczestniczy w wielu reakcjach redoks
zachodzących w organizmach żywych. FAD (C
27
H
33
N
9
O
15
P
2
) to
dinukleotyd flawinoadeninowy złożony z mononukleotydu
flawinowego czyli pochodnej ryboflawiny i
adenozynomonofosforanu, pełni on funkcję przenośnika
elektronów i protonów.
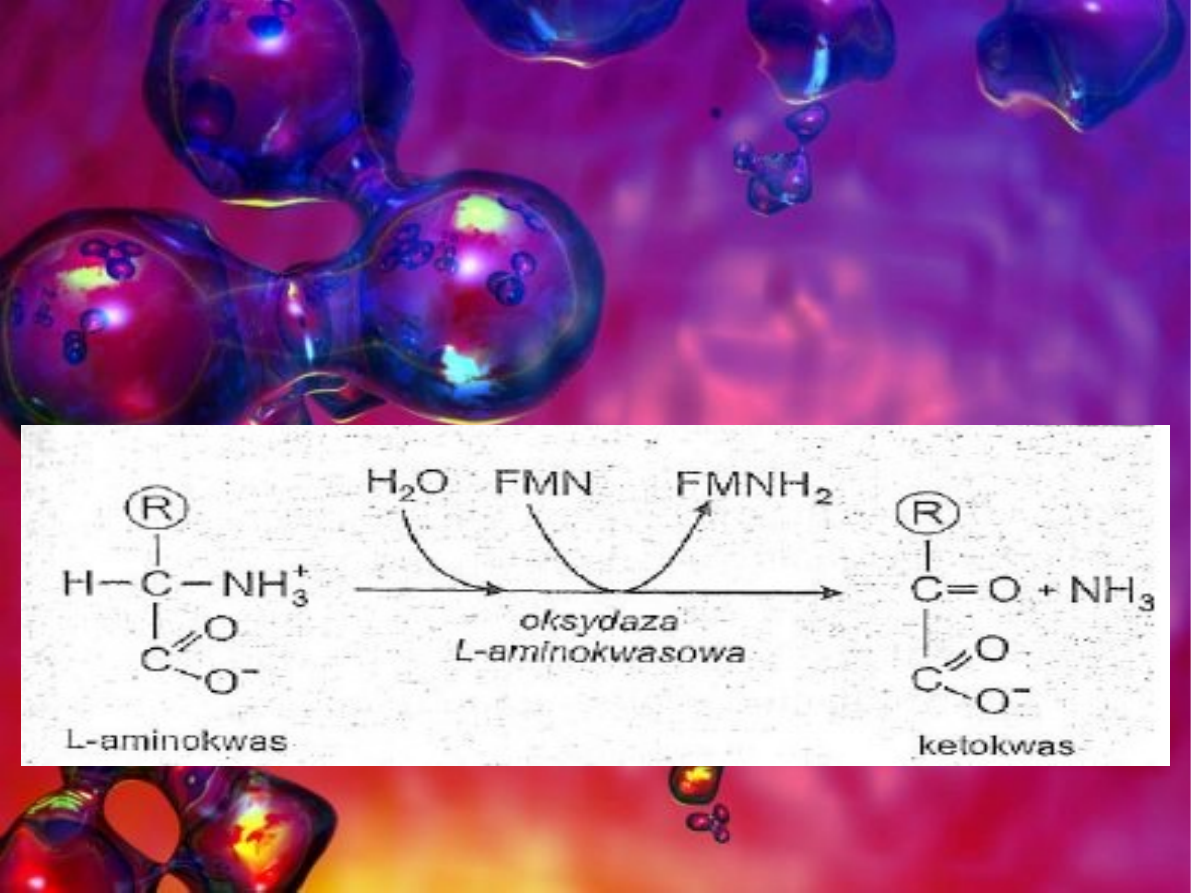
Pod działaniem oksydazy aminokwas utlenia się do ketokwasu a
FMN redukuje się do FMNH
2
lub FAD do FADH
2
. Grupa
aminowa odłącza się w postaci amoniaku. Zredukowane
nukleotydy flawinowe FMNH
2
lub FADH
2
przekazują atomy
wodoru na tlen cząsteczkowy z wytworzeniem H
2
O
2
. Na
rysunku przedstawiono oksydacyjną deaminację L-aminokwasu
katalizowaną przez oksydazę aminokwasową.
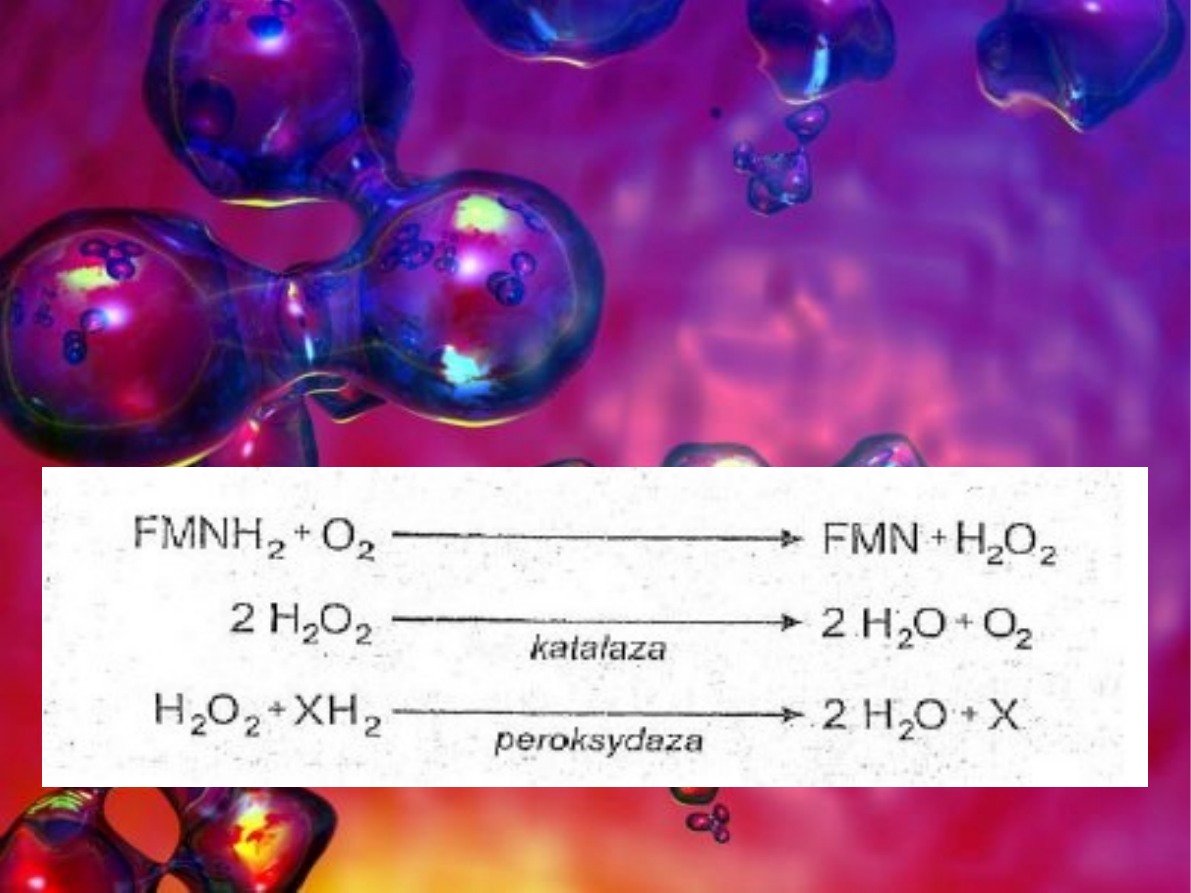
Ponieważ powstający nadtlenek jest toksyczny wymagane jest
skuteczne usuwanie tego produktu. Jest on rozkładany przez
dwa enzymy katalazę lub proksydazę. W obu przypadkach H
2
O
2
jest rozkładany do H
2
O.
Istnieją również enzymy deaminujące nie należące do oksydaz.
Przykładem może być dehydrataza serynowo-treoninowa.
Enzym ten deaminuje serynę lub treoninę. Taka reakcja jest
dwuetapowa. W pierwszym etapie zachodzi dehydratacja czyli
odłączenie cząsteczki wody a w drugim deaminacja właściwa
polegająca na odłączeniu grupy aminowej.
Detoksykacja amoniaku
Można ją przeprowadzić na drodze różnych procesów.
Człowiek i większość kręgowców lądowych przekształca
amoniak i wydala w postaci mocznika, a ptaki i gady lądowe w
postaci kwasu moczowego. Wiele zwierząt wodnych wydala go
bezpośrednio do środowiska.
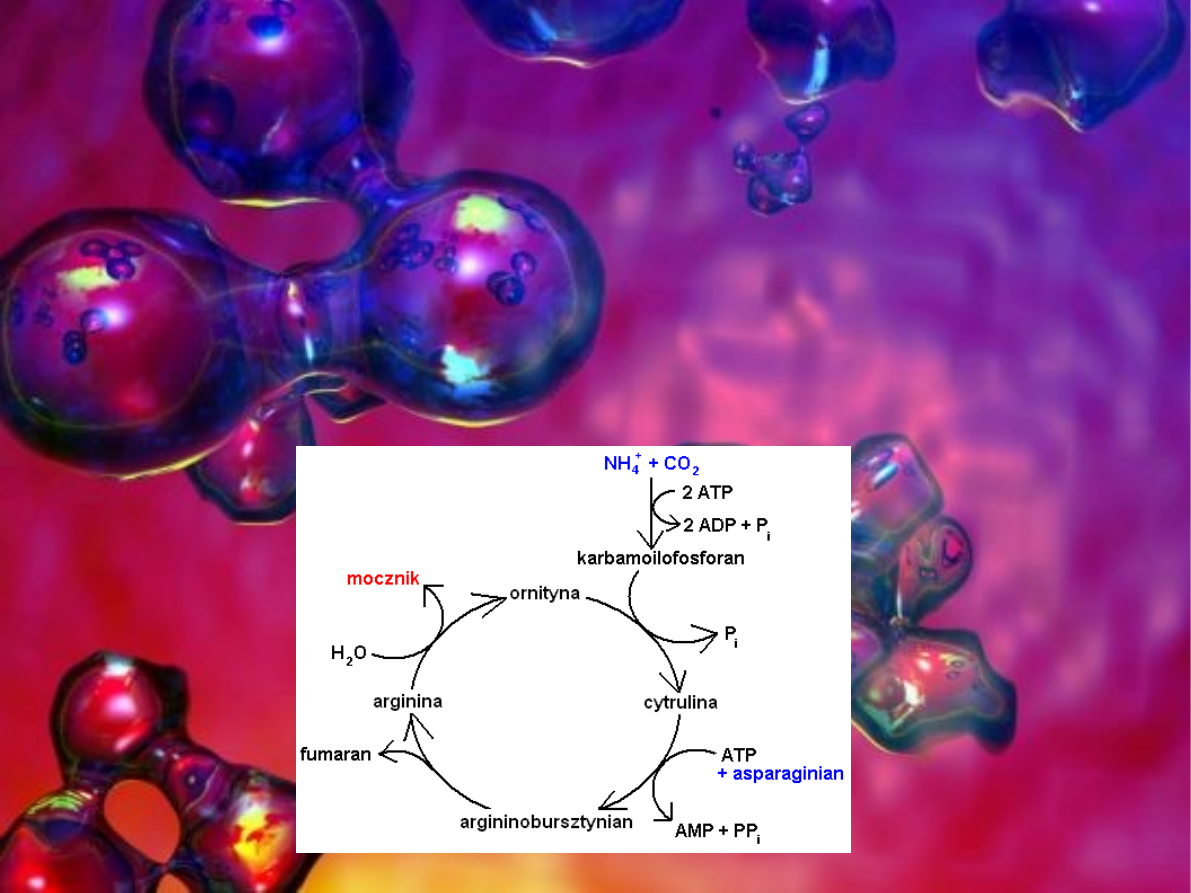
Proces przekształcania toksycznego amoniaku w mocznik nosi
nazwę cyklu mocznikowego (cykl Krebsa).
Reakcja sumaryczna cyklu mocznikowego:
NH
4
+
+ HCO
3
-
+ H
2
O + 3ATP + ASP → mocznik + 2 ADP + AMP + 2Pi + PPi
+ fumaran

Bibliografia:
www.wikipedia.pl
www.portalwiedzy.onet.pl
www.edunauka.pl
„Biochemia” Edward Bańkowski
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
aminokwasy
AMINOKWASY 7
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
8a Syntezy prostych aminokwasów
Wykład katabolizm azotu aminokwasów
Metabolizm aminokwasów
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
cwiczenie 7 Aminokwasy id 125541
aminokwasy wersja IV
3 NOWY Aminokwasy II 2012 2013(1)
Aminokwasy
aminokwasy I
Aminokwasy dzielimy na
Aminokwasy
Aminokwasy i białka
Aminokwasy i białka 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
więcej podobnych podstron