Inżynieria Biomedyczna
Wykład 11
WIĄZANIA CHEMICZNE cd

Plan
Kierunkowość wiązań
Hybrydyzacja
Typy hybrydyzacji
Wiązania podwójne i potrójne

Kierunkowość wiązań
Struktura cząsteczek:
Cząsteczki dwuatomowe – struktura liniowa
Cząsteczki trójatomowe – struktura liniowa lub kątowa
Cząsteczki o więcej niż trzech atomach - struktura
może być trójwymiarowa
Wiązania chemiczne tworzą się w tych kierunkach
przestrzeni, w których prawdopodobieństwo napotkania
elektronów jest duże
Struktura geometryczna cząsteczki jest więc wynikiem
rozkładu prawdopodobieństwa napotkania elektronów w
przestrzeni wokół jąder atomów, które tworzą cząsteczkę
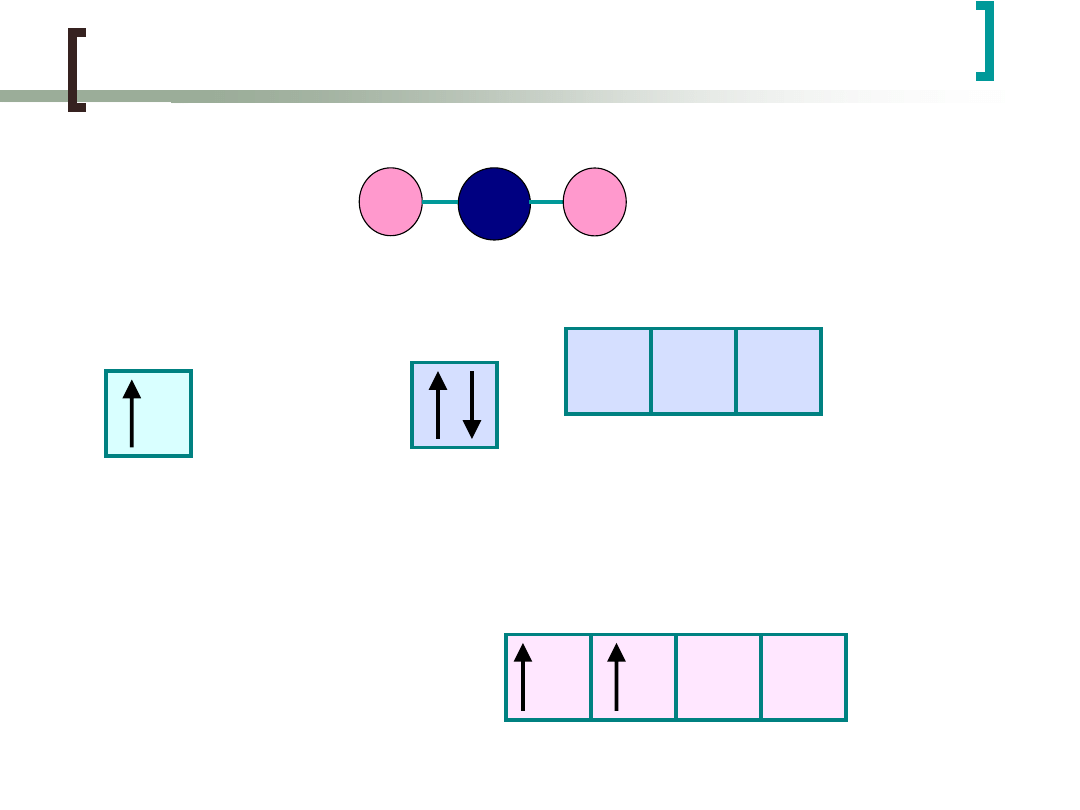
Cząsteczka BeH
2
ma strukturę liniową
H: 1s
1
Be: He2s
2
p
0
Jeżeli energie dwóch bliskich poziomów, np. 2s i 2p są
podobne, to elektrony mogą być
"promowane"
(czyli
wzbudzone) w dość niskiej temperaturze
Kierunkowość wiązań cd
H
Be
H
Stan wzbudzony
Stan podstawowy
2s 2p
Be: He2s
1
p
1

Cząsteczka BeH
2
cd
Atomy wodoru wnoszą do kombinacji liniowej
BeH2
takie same orbitale typu 1s, natomiast beryl orbital
2s i 2p
Powinny więc powstać 2 różne orbitale wiążące typu
(
s
i
s-p
) oraz 2 antywiążące
Z danych eksperymentalnych wynika że długość
wiązań w cząsteczce BeH
2
JEST TAKA SAMA
Co oznacza ze oba wiązania są równocenne
(charakteryzują się taka samą energią)
Hybrydyzacja –czyli mieszanie orbitali
atomowych

Hybrydyzacja
Hybrydyzacja - przekształcenie orbitali, polegające
na „zmieszaniu" dwóch lub więcej orbitali atomowych,
na skutek czego powstają nowe orbitale, posiadające
inny
kształt
i
energię
.
Hybrydyzacja jest operacją matematyczną
ułatwiającą skonstruowanie orbitali wchodzących w
skład kombinacji liniowych (orbitali molekularnych)
Reguły hybrydyzacji:
•
tworzymy kombinację liniową orbitali ("atomu
centralnego") o takiej samej lub zbliżonej energii;

Reguły cd
•
liczba hybrydów jest równa liczbie wziętych do
kombinacji O.A., których jednakowy udział w
kombinacji bierzemy pod uwagę;
•
efektem kombinacji są hybrydy o jednakowych
funkcjach radialnych, a funkcje kątowe różnią się
tylko kierunkiem (mają jednakowy kształt);
•
przy udziale orbitali zhybrydyzowanych tworzą się
wyłącznie orbitale cząsteczkowe (wiązania) typu σ
;
jedno
wiązanie chemiczne tworzy się przy udziale
kilku
orbitali jednego z atomów ...
wiązania mają charakter
skierowany
w pewnym
określonym kierunku w przestrzeni
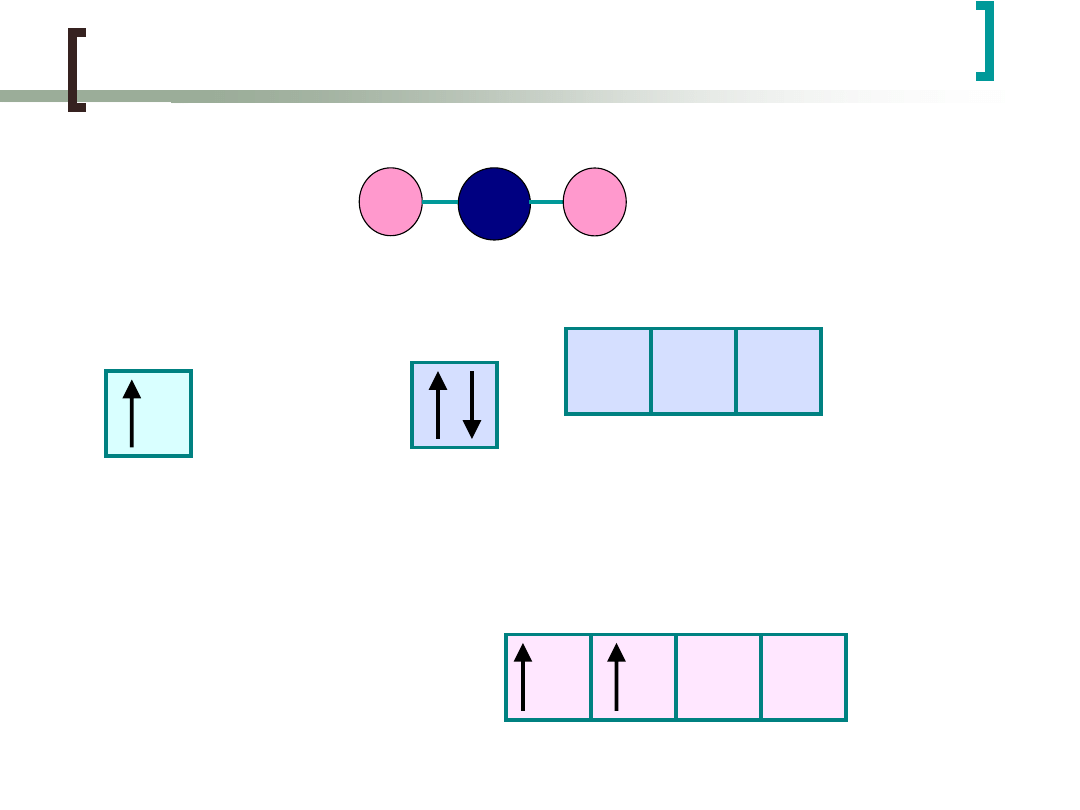
Cząsteczka BeH
2
ma strukturę liniową
H: 1s
1
Be: He2s
2
p
0
Jeżeli energie dwóch bliskich poziomów, np. 2s i 2p są
podobne, to elektrony mogą być
"promowane"
(czyli
wzbudzone) w dość niskiej temperaturze
Kierunkowość wiązań cd
H
Be
H
Stan wzbudzony
Stan podstawowy
2s 2p
Be: He2s
1
p
1
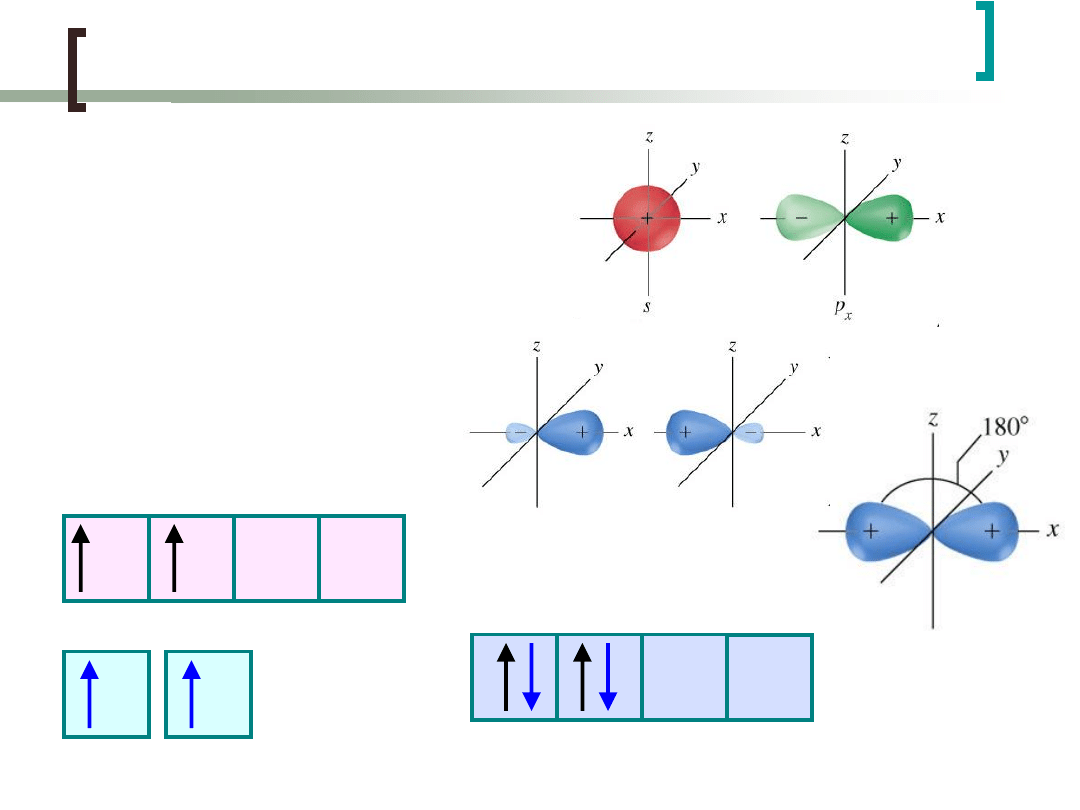
Cząsteczka BeH
2
-hybrydyzacja sp
Powstają dwie jednakowe
hybrydy, leżące na osi x
skierowane względem
siebie pod kątem 180º -
można je wykorzystać w
kombinacji liniowej do
utworzenia wiązań z
innymi atomami ...
1
2
H
H
promowany
Be
H H
hybrydyzacja
sp
- liniowa
(dygonalna)
Udział biorą orbitale: 1 orbital typu s i 1 orbiral typu p
Wynikiem hybrydyzacji są 2 orbitale zhybrydyzowane o
symetrii
Hybrydyzacja liniowa występuję w cząsteczkach BeCl
2
,
BeH
2
, CO
2
Hybrydyzacja sp
2
(dla
BF
3
)
B: 1s
2
2s
2
p
1
,
F
: 1s
2
2s
2
p
5
,
Trzy hybrydy utworzone przez orbitale 2s, 2px i
2py atomu boru tworzą wiązania z trzema
orbitalami 2px fluoru. Elektrony orbitali 2s oraz
2py i 2pz atomów fluoru, prostopadłych do
płaszczyzny xy lub osi wiązania nie biorą udziału w
wiązaniu B-F.
F F F
Cząsteczka BF
3
jest trójkątna i
płaska
1
2
3
120
o
120
o
120
o
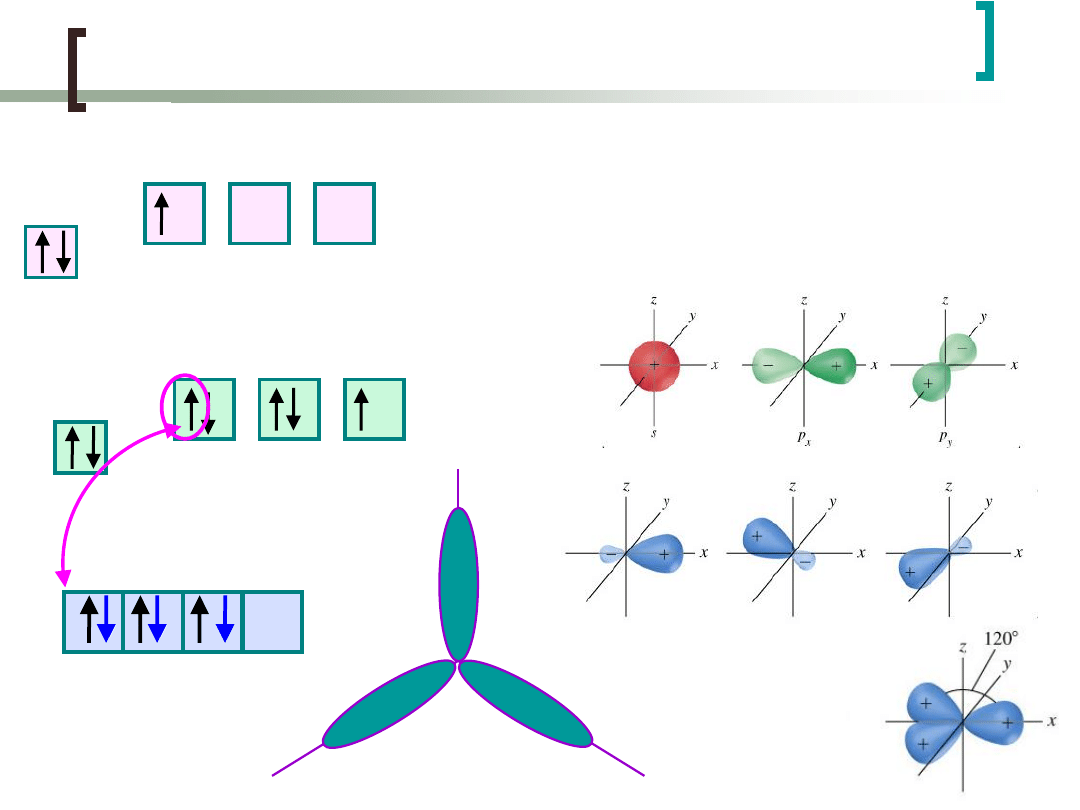
Hybrydyzacja sp
3
Powstają cztery jednakowe hybrydy,
skierowane ku narożom czworościanu
foremnego (tetraedru) - można je
wykorzystać w kombinacji liniowej do
utworzenia wiązań z innymi atomami
...
C: 1s
2
2s
2
2p
2
H: 1s
1
1
2
3
4
H H H H
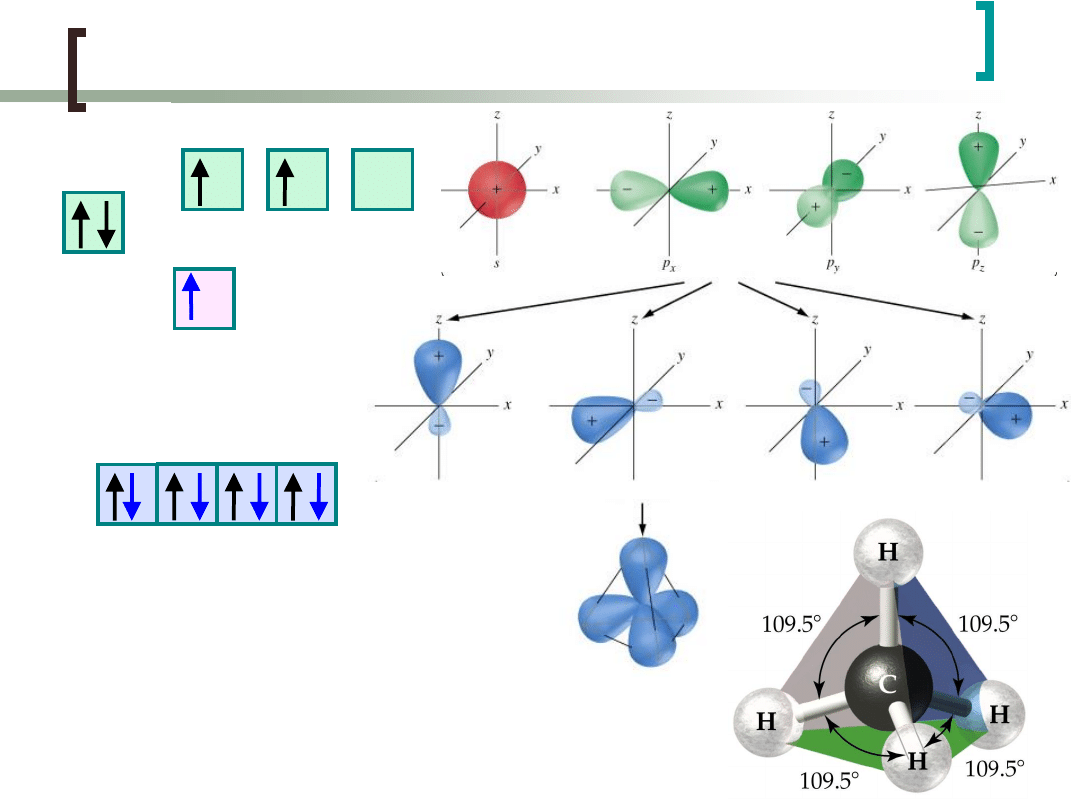
Hybrydyzacja sp
3
Przyjmując hybrydyzację sp
3
można również wyjaśnić
kształt cząsteczek amoniaku NH
3
.
Hybrydyzacji ulegają orbitale atomów N.
NH
3
N:1s
2
2s
2
p
3
H:1s
1
1
2
3
H H H
„wolne”
elektrony
„wolne” elektrony
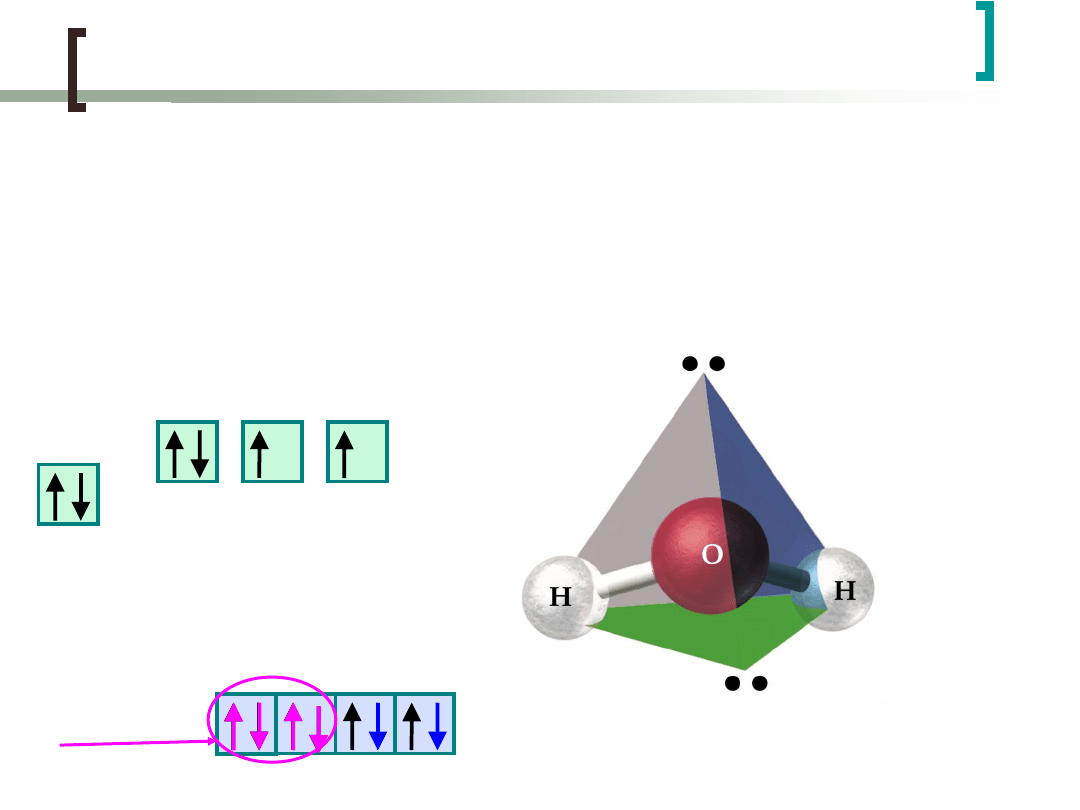
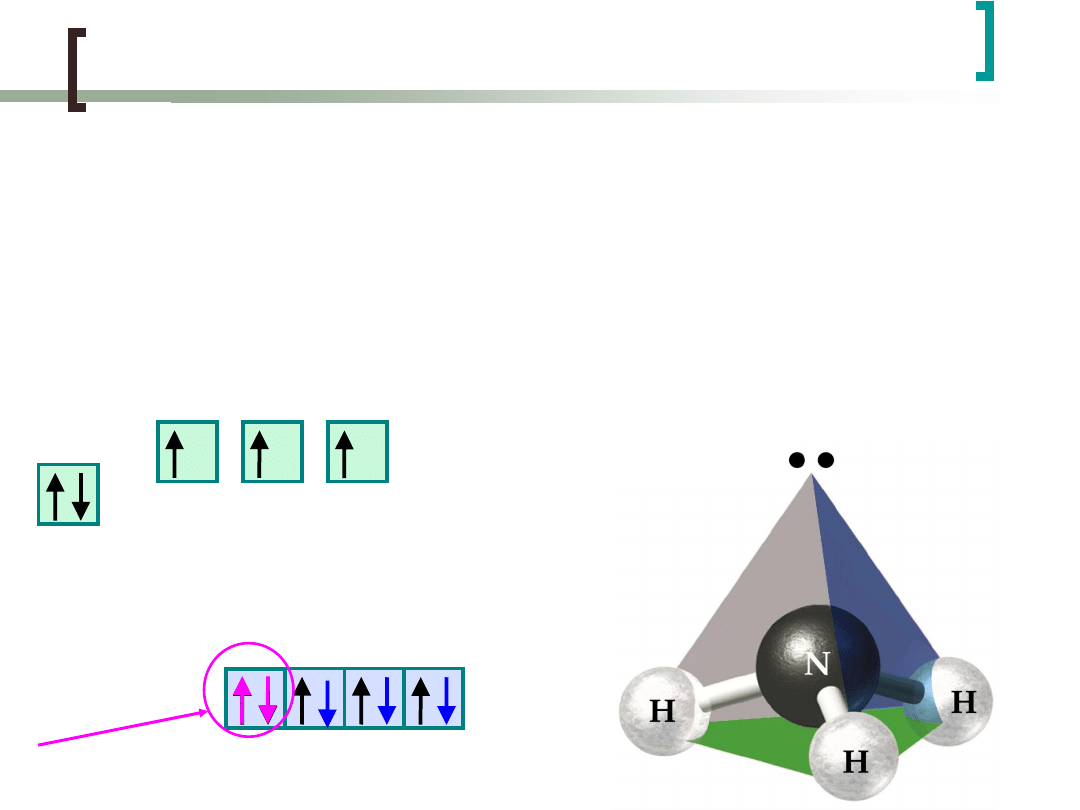
Hybrydyzacja sp
3
W przypadku cząsteczki H
2
O hybrydyzacji ulegają
orbitale atomów O.
H
2
O
O:1s
2
2s
2
p
4
,
H:1s
1
1
2
H H
„wolne”
elektrony
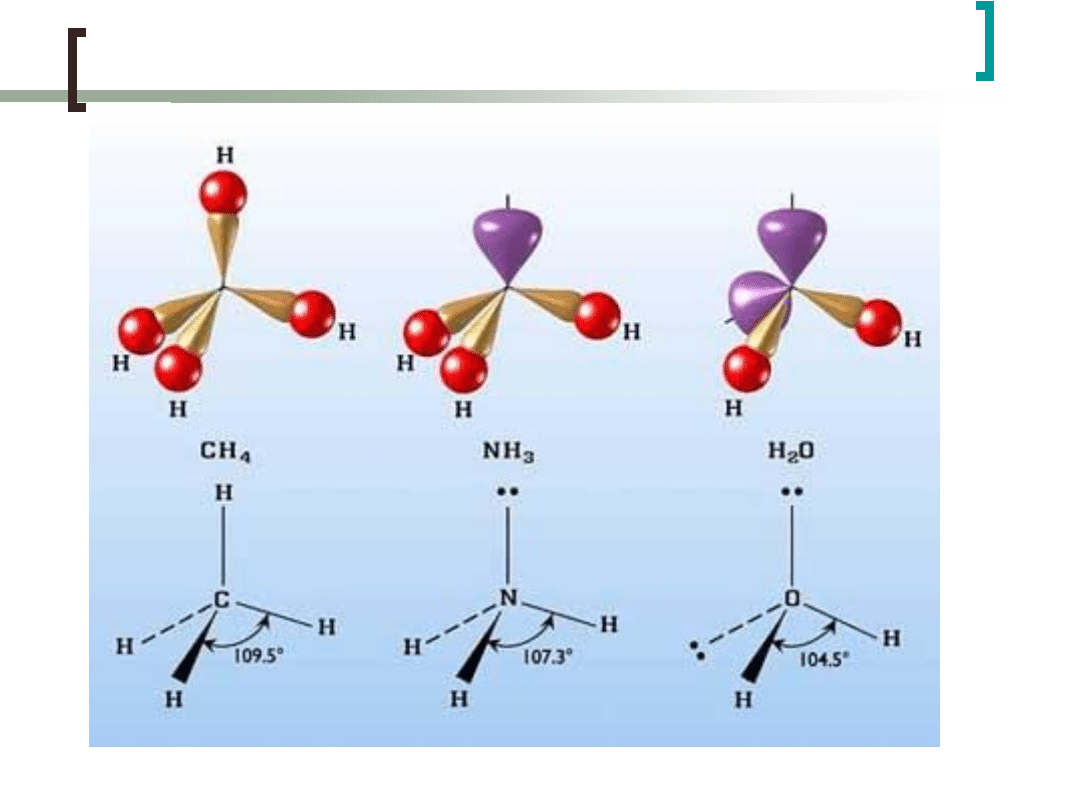
Hybrydyzacja cd
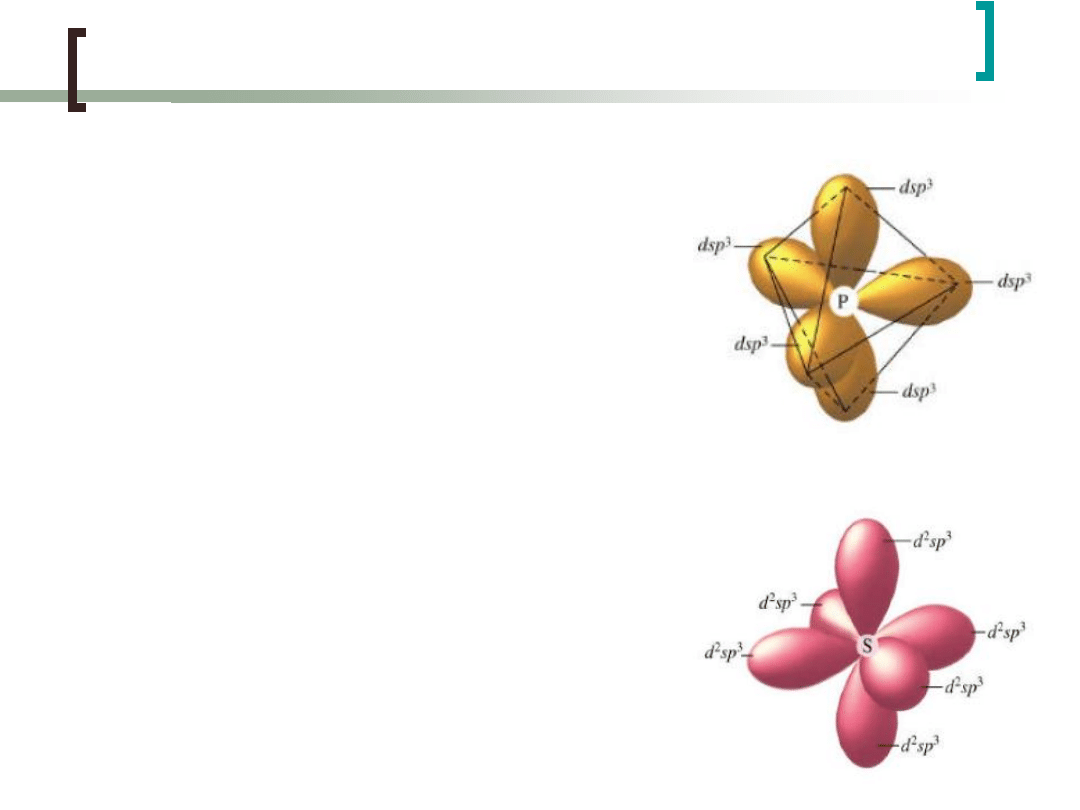
Hybrydyzacja dsp
3
- bipiramida
trygonalna
Przykładem zastosowania hybrydyzacji
dsp3 (sp3d) jest wytłumaczenie kształtu
cząsteczki
PCl
5
. Orbitale
zhybrydyzowane tworzą pięć orbitali
typu σ z orbitalami 2px atomów chloru.
Elektrony orbitali 2s, 2py i 2pz atomów
chloru nie biorą udziału we wiązaniu
(tworzeniu orbitali cząsteczkowych.
Hybrydyzacja d
2
sp
3
-
oktaedryczna
Przykładem zastosowania hybrydyzacji
d
2
sp
3
(sp
3
d
2
) jest wytłumaczenie kształtu
cząsteczki SF6, powstaje sześć orbitali
zhybrydyzowanych, z których tworzy się
sześć orbitali molekularnych
Wyszukiwarka
Podobne podstrony:
Naped hybrydowy id 313570 Nieznany
znakowanie i hybrydyzacja id 59 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
więcej podobnych podstron