
1. Wstęp teoretyczny
Zapłon wymuszony następuje wtedy gdy proces spalania i dalsze jego rozprzestrzenianie
zapoczątkujemy źródłem zapłonu takim jak np. iskra elektryczna płomień pilotujący.
Proces zapłonu charakteryzuje się określonymi stężeniowymi granicami, poza którymi zapłon nie
nastąpi w żadnych warunkach. W gazowych mieszaninach paliwo-powietrze, nawet wtedy, gdy
źródło zapłonu jest nieskończenie wielkie zapłon następuje wówczas, kiedy stężenie składników
palnych w mieszaninie z utleniaczem występuje w określonych granicach.
Granice zapłonu mieszanin składająch się z wielu składników palnych (nie zawierających składników
obojętnych) można określić ze wzoru Le Chateliera.
gdzie:
L
g.d
– dolna lub górna granica zapłonu wyrażona w procentach,
a
i
– zawartość i-tego składnika palnego w paliwie wyrażona w procentach.
Wybuch lub inaczej eksplozja chemiczna jest to gwałtowna reakcja chemiczna połączona
z intensywnym wydzielaniem ciepła, zdolna do samopodtrzymującej się propagacji w materiale.
Zwiekszenie ciśnienia podczas wybuchu spowodowane jest wzrostem temperatury lub zmianą liczby
moli gazu w wyniku reakcji chemicznych. Wybuchy paliw możemy podzielić na gazowe i pyłowe.
Jeżeli w powietrzu oprócz pyłu jest też gaz palny to mówimy o mieszaninie hybrydowej. Dynamika
wybuchu jest zdeterminowana prędkością rozprzestrzeniania się płomienia w kierunku świeżej
mieszanki. Wybuchy paliw zachodzą w fazie gazowej.
2. Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z podstawowymi parametrami dotyczącymi palności
paliw gazowych oraz określenie granic palności mieszaniny propan-butanu.
3. Przebieg ćwiczenia
Podczas tego doświadczenia badać będziemy dolną granice palności, a więc użyjemy dużo
utleniacza i mało paliwa. Do dyspozycji mamy zbiornik o objętości 4dm
3
,wypełniony powietrzem.
Do tego zbiornika wtłaczać będziemy propan-butan (o składzie propan=70%, butan=30%) oraz
powietrze lub też z tego zbiornika wytłaczać powietrze. Wtłaczając paliwo i powietrze będziemy
powodować nadciśnienie, które zmierzymy i dzięki niemu dowiemy się ile danego gazu dodaliśmy.
Badając różne proporcje mieszaniny paliwo-powietrze będziemy sprawdzać jej granice palności
stosując zapłon wymuszony za pomocą iskry elektrycznej.
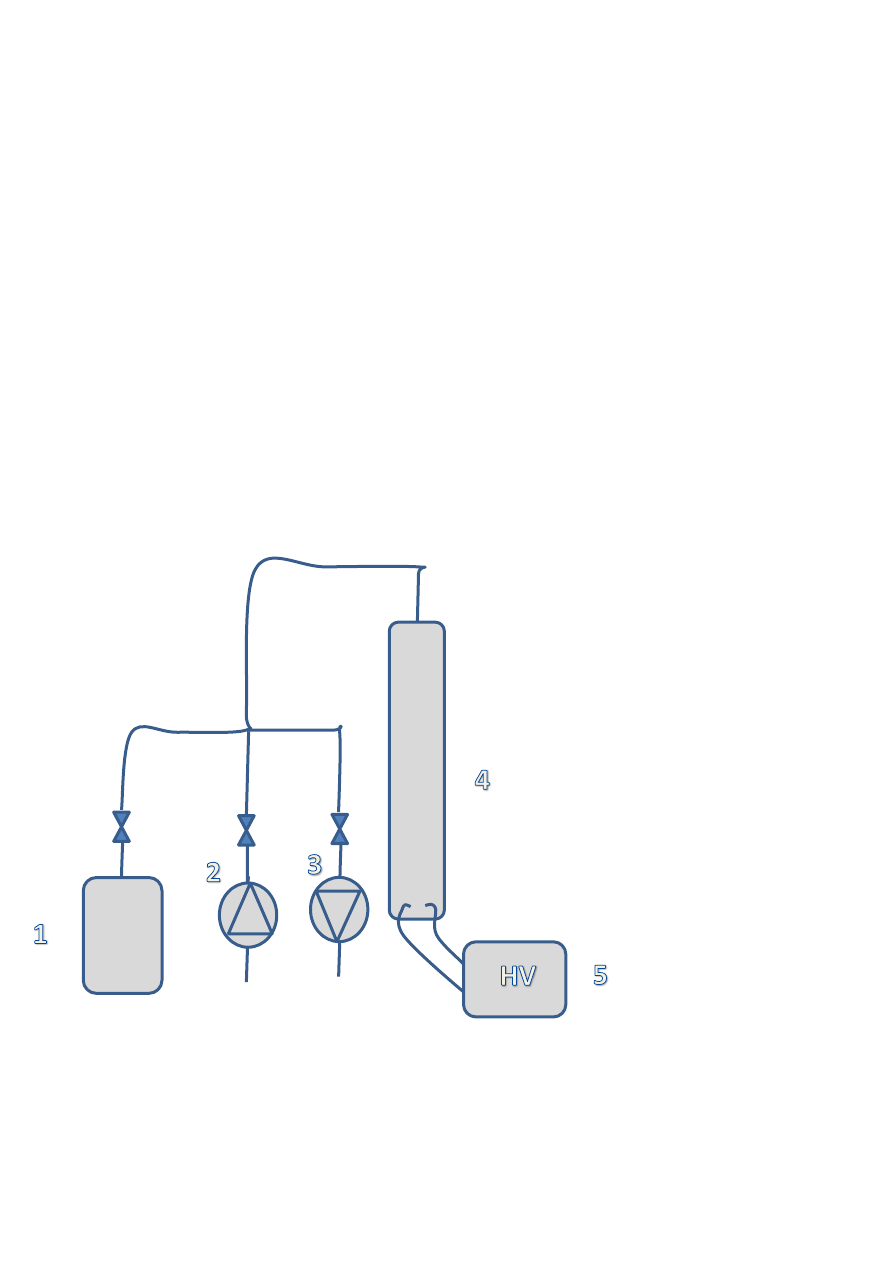
4. Schemat pomiarowy
gdzie:
1. Butla z propan-butanem, 2. Sprężarka powietrza, 3. Pompa próżniowa, 4. Zbiornik z mieszanina,
5. Zapalarka wysokonapięciowa.
P-B
[bar]
[bar]
0,112
4,00
TAK
0,095
3,72
TAK
0,092
3,92
NIE
0,132
3,34
TAK
0,155
3,86
TAK
Zapłon
Nadciśnienie
(propan-butan)
Nadciśnienie
(powietrze)
[bar]
[bar]
[bar]
0,300
2,31
NIE
Podciśnienie
(propan-butan)
Nadciśnienie
(powietrze)
Zapłon
5. Obliczenie teoretycznej granicy palności (dolnej i górnej)
a
p
– ilość procentowa propanu,%
a
b
– ilość procentowa butanu, %
L
p.d
– dolna granica zapłonu propanu w powietrzu, %
L
b.d
– dolna granica zapłonu butanu w powietrzu, %
L
p.g
– górna granica zapłonu propanu w powietrzu, %
L
b.g
– górna granica zapłonu butanu w powietrzu, %
6. Pomiary
Tabela 2
7. Przykładowe obliczenia
Ilość propan-butanu i powietrza wtłoczonego przy nadciśnieniu obliczamy z proporcji:
gdzie 4l to objętość zbiornika a 1 bar to wartość ciśnienia atmosferycznego.
Tabela 1
Ilość propan-
butanu
Ilość
powietrza
Ilość
mieszaniny
[litr]
[litr]
[litr]
0,45
16,00
20,45
0,38
14,88
19,26
0,37
15,68
20,05
0,53
13,36
17,89
0,62
15,44
20,06
Ilość propan-
butanu
Ilość
powietrza
Ilość
mieszaniny
[litr]
[litr]
[litr]
1,20
9,24
13,24
Całkowita ilość mieszaniny będzie, więc równa:
Druga sytuacja z tabeli nr 2 przedstawia sytuacje gdy na początku za pomocą pompy próżniowej
wytłaczamy powietrze do pewnego podciśnienia i wtłaczamy w jego miejsce propan-butan
aż do stanu początkowego 4l. Obliczenia ilości substancji palnej i powietrza są następujące:
A całkowita ilość mieszaniny będzie równa:
Procentowa ilość propan-butanu będzie wynosić:
8. Wyniki pomiarów
Ilość propan-
butanu w
mieszaninie
[%]
2,19
TAK
1,97
TAK
1,84
NIE
2,95
TAK
3,09
TAK
9,06
NIE
Zapłon

9. Oś granicy palności
10. Wnioski
Pomiary i obliczenia stężeniowych granic zapłonu ,przy którym ten zapłon zachodzi, mniej
więcej pokrywają się z oczekiwanymi wynikami. Błąd obliczeń wynika z trzech podstawowych
czynników takich jak: warunki otoczenia (temperatura, ciśnienie atmosferyczne) mieszanki paliwa
i powietrza przy których powinno się wykonywać badanie granic palności nie są idealne; nie znamy
dokładnej wartości procentowej mieszanki propan-butanu (bierzemy tą wartość z pewną
niedokładnością); pod uwagę należy też wziąć niedokładność przyrządów pomiarowych. Dwa wyniki
(jeden dla dolnej i jeden dla górnej granicy palności) minimalnie nie pokrywają się z teoretycznymi
granicami palności wyznaczonych ze wzoru Le Chateliera, jednak możemy przyjąć ten błąd jako
dopuszczalny biorąc pod uwagę wszystkie czynniki, które decydują o dokładności pomiarów.
Widzimy, że propan-butan to gaz, który ma mały zakres granic palności porównując do innych
gazów, a już bardzo daleki od wartości zakresu palności acetylenu, który jest blisko czternastokrotnie
większy.
Wyszukiwarka
Podobne podstrony:
granice palności
granice palności gazów
granice palności
RASFF odrzucenia na granicy
14 Nośnośc Graniczna Przekroju Poprzecznego
F19 fale na granicy o rodk w
Dla wyjeźdżających za granice
Zestaw graniceciagow
2 5 Granice jednostronne
14 Offe, Nowe ruchy społeczne Przekraczanie granic polityki instytucjonalnej
ABC bezpiecznych e zakupów za granicą
FW14 fale na granicy osrodkow 0 Nieznany
granice (2)
5 Ciagi,granica i ciaglosc funkcji
granicefun
więcej podobnych podstron