Marek Jarosz
dr Andrzej Baranowski
Fizyka techniczna I rok
Wtorek 16:00 – 18:15
nr. 24 WYZNACZANIE MECHANICZNEGO
RÓWNOWAŻNIKA CIEPŁA
1.Tabela pomiarowa, aparatura użyta do przeprowadzenia doświadczenia
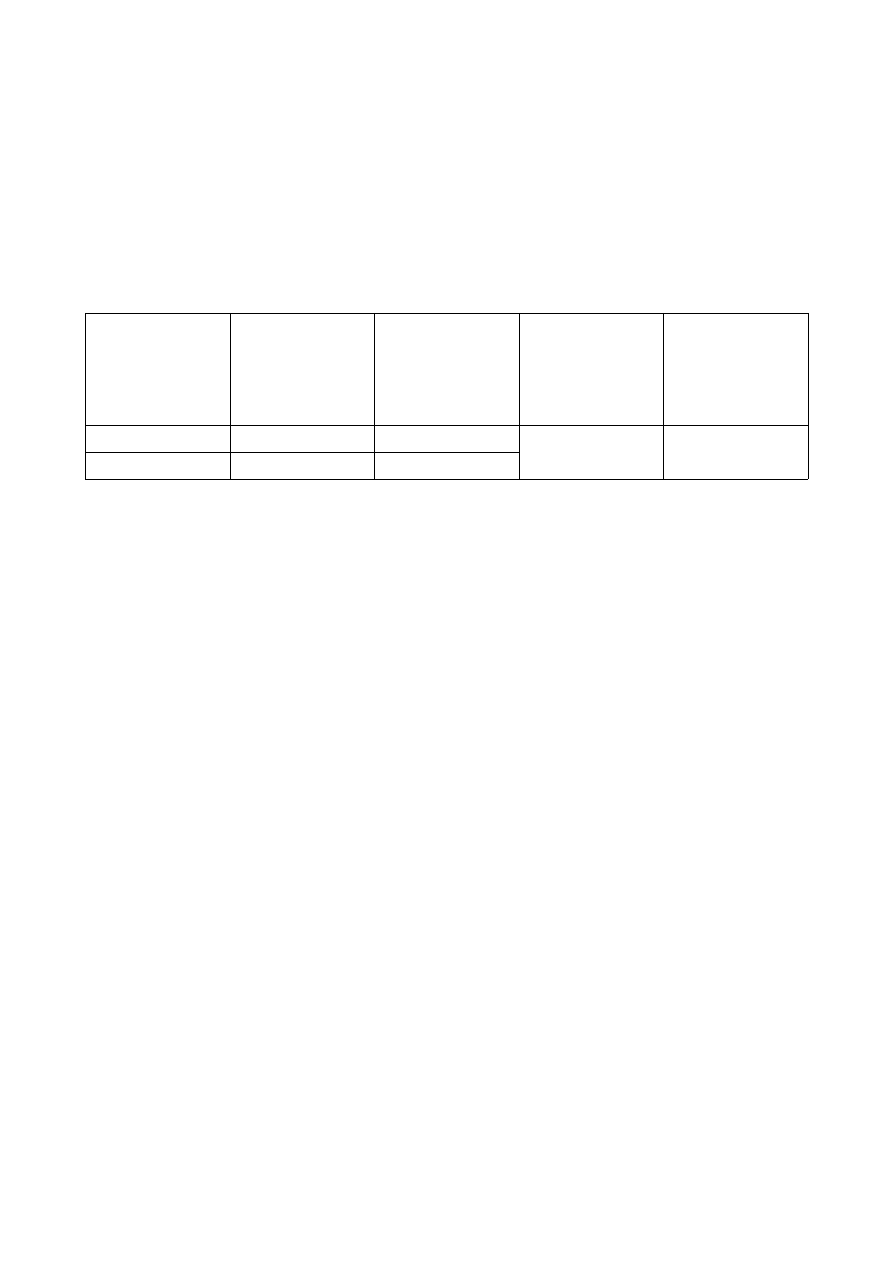
Tabela pomiarowa
Nr pomiaru
Obliczona wartość
mech.
równoważnika
ciepła ∆J
J/cal
Niepewność
pomiarowa
Uc (J)
Średnia wartość
mech.
równoważnika
ciepła
ΔJ
Średnia
niepewność
pomiarowa
Uc(J)
1
5,17 J / cal
1,36
5,07
1,16 ~ 23%
2
4,98
0,96
Aparatura użyta do przeprowadzenia doświadczenia:
Zasilacz
napięcie maksymalne – 24V
Amperomierz analogowy
zakres maksymalny – 3A
Woltomierz analogowy
zakres maksymalny – 75V
Termometr cyfrowy
Opornica suwakowa
Kalorymetr
Stoper cyfrowy
Waga naczyńka kalorymetrycznego - 92,8g
Waga naczyńka kalorymetrycznego z wodą - 228,2g
Masa wody - 135,4g
Początkowa temperatura wody dla pierwszego pomiaru - 26,9°
Początkowa temperatura wody dla drugiego pomiaru - 30,7°
Błąd przy pomiarze temperatury: +/-0,1°
Błąd przy pomiarze czasu: +/-0,1s
Błąd przy pomiarze masy: +/-0,1g
Błąd pomiaru woltomierza=1V+75V x 2/100=2,5V
Błąd pomiaru amperomierza= 0,02A+3A x 2/100=0,08A

2. Zagadnienia teoretyczne
Praktycznie wszystkie zjawiska fizyczne da się wytłumaczyć na podstawie kinetyczno-molekularnej
teorii budowy ciała. Materią nazywamy wszystkie ciała, z których zbudowany jest otaczający nas świat.
Współczesna fizyka rozszerza pojęcie materii na fale radiowe, świetlne, promienie kosmiczne i inne rodzaje
energii. Aby odróżnić materię w rozumieniu fizyki współczesnej od materii rozumianej jako ciała stałe ciecze i
gazy, tą ostatnią nazwano materią korpuskularną. Zalążki teorii atomistycznej budowy świata powstały już w
starożytnej Grecji stworzone przez Demokryta. Uważał on, że ciała zbudowane są z maleńkich drobin
zbudowanych z elementów materii zwanych atomami. Teoria atomistyczna rozwijana była następnie przez wielu
badaczy: Daltona, Avogadro, Maxwella, Boltzmanna, Łomonosowa, Smoluchowskiego i innych.
Kinetyczno - molekularna teoria budowy ciał umożliwia wytłumaczenie większości zjawisk cieplnych.
Podstawowym założeniem tej teorii jest ruch cząstek materii z tym większą prędkością im wyższa jest
temperatura ciała. W przypadku ciał stałych gdzie cząsteczki nie mogą zmienić swojego położenia ruch ten jest
ruchem drgającym wokół położenia równowagi. W przypadku płynów, gdzie położenie cząstek nie jest ściśle
związane z konkretnym miejscem ruch ten może przybierać inne formy.
Energia kinetyczna cząstek dla wszystkich trzech stanów skupienia jest wprost proporcjonalna do
temperatury bezwzględnej ciała:
Ek = 3/2 * k * T
Dlatego uważa się, że ciepło jest ściśle związane z energią kinetyczną cząsteczek ciała.
Kinetyczno – molekularna budowa ciała mówi, że przekazywanie ciepła polega na zwiększeniu energii
kinetycznej cząsteczek. Cząsteczki ciała o wyższej temperaturze poruszają się z większą prędkością. W momencie
zderzenia z cząsteczkami ciała o niższej temperaturze przekazują im część swojej energii kinetycznej pobudzając
je do szybszego ruszania się. W ten sposób zwiększana jest energia kinetyczna cząsteczek ciała o niższej
temperaturze co w rezultacie prowadzi do zwiększenia jego temperatury. Podobnie tłumaczy się zjawisko
przewodzenia ciepła przez ciała. Przyjęcie zasady, że ciepło jest energią kinetyczną cząsteczek pozwala wyjaśnić
istotę zamiany energii mechanicznej w ciepło.
Pierwsza zasada termodynamiki mówi, że zmiana energii wewnętrznej układu jest równa sumie
dostarczonej energii Q i pracy wykonanej nad układem W:
ΔU = Q + W
W życiu codziennym często spotykamy przemianę energii mechanicznej w ciepło np. w tokarce podczas
obróbki skrawaniem. Zjawisko to doświadczalnie zbadał Joule. Doświadczenie Joule'a polegało na umieszczeniu
w kalorymetrze mieszadełka. Mieszadełko to podłączone było za pomocą przekładni krążkowej do ciężarków.
Praca wykonana przez opadające ciężarki przekładana była na ruch obrotowy mieszadełka. Ponieważ ciecz
stawiała opór mieszadełku, praca wykonana przez to mieszadełko została zamieniona w ciepło. Joule wykonał
jeszcze kilka doświadczeń ( mieszanie rtęci, przepychanie wody przez wąskie rury, wzajemne pocieranie
pierścieni zanurzonych w rtęci ). Na podstawie swoich doświadczeń stwierdził, że zamiana energii mechanicznej
na ciepło zachodzi zawsze w jednakowym stosunku ilościowym:
L = J * Q
Q – ciepło
L – doprowadzona praca
J – współczynnik proporcjonalności nazywany mechanicznym równoważnikiem ciepła (4,19 J/cal).
Procesy zachodzące w przyrodzie mają charakter nieodwracalny. Cechę tą wyraża II zasada
termodynamiki. Możliwa jest zamiana całej energii mechanicznej w ciepło, natomiast zamiana całego ciepła na
energię mechaniczną jest już dość trudna i nigdy nie zachodzi całkowicie. Ciepło może być zamienione na prace
tylko wtedy gdy istnieje różnica temperatur ciał wymieniających ciepło ( istnieje ciało o wyższej temperaturze –
grzejnica i ciało o niższej temperaturze – chłodnica ). II zasada termodynamiki mówi, że całkowita zamiana
energii cieplnej w mechaniczną jest niemożliwa a także niemożliwe jest przekazywanie ciepła od ciała
chłodniejszego do cieplejszego.
Energia prądu elektrycznego. Jeżeli opór przewodnika pomiędzy dwoma punktami A i B wynosi R i przez
ten przewodnik płynie prąd o natężeniu I, to w czasie t przeniesiony jest z punktu A do punktu B ładunek q = It W
punkcie A ma on potencjał Va a w punkcie B Vb. Przeniesienie tego ładunku jest pewną pracą, która pojawia się w
przewodniku w postaci ciepła.
W = (Va - Vb)It = JQ
J – mechaniczny równoważnik ciepła
Po przekształceniach z wykorzystaniem prawa Ohma otrzymujemy
W = R I² t
Ciepło, które zostało wydzielone w przewodniku nosi nazwę ciepła Joule’a. Prawo Joule’a: ciepło wydzielone
podczas przepływu prądu stałego przez przewodnik jest proporcjonalne do oporu przewodnika, kwadratu
natężenia prądu i do czasu jego przepływu.
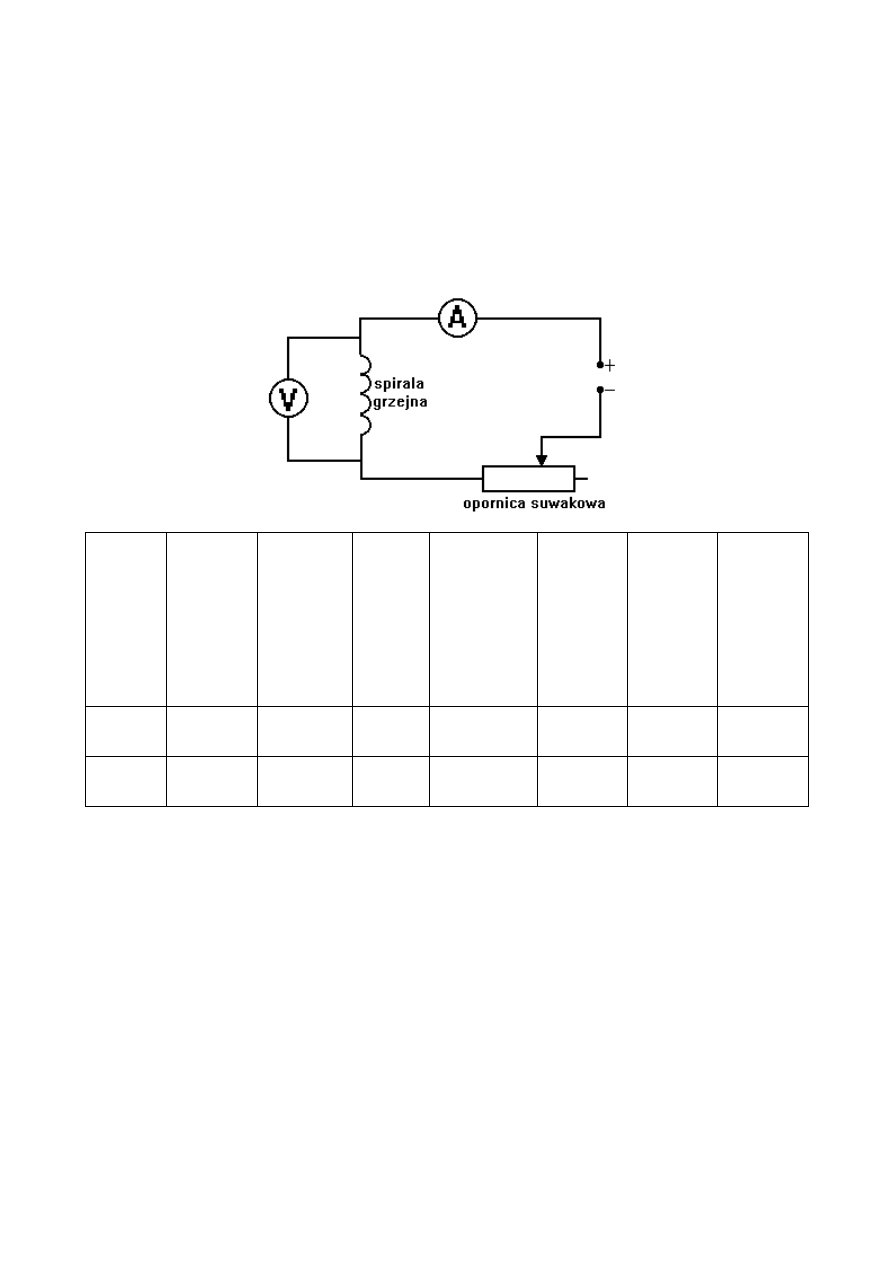
3. Opis przeprowadzenia doświadczenia
Najpierw dokonałem pomiaru masy pustego kalorymetru, kalorymetru napełnionego wodą do 2/3 wysokości oraz
temperatury wody. Następnie złożyłem układ tak jak jest pokazane na schemacie.
Aby ustalić mechaniczny równoważnik ciepła, zmierzyłem czas, jaki jest
potrzebny na podgrzanie wody w naczynku kalorymetrycznym o 5°C, przy natężeniu prądu stałego I=1A.
Następnie powtórzyłem pomiar przy natężeniu prądu stałego I=1,4A. W trakcie przeprowadzania
doświadczenia zapisałem odpowiednie napięcia na elemencie grzejnym, wyniki wszystkich
pomiarów są przedstawione w tabeli która mieści się na pierwszej stronie.
Schemat układu pomiarowego:
Napięcie
zasilające
[V]
Napięcie na
spirali
grzewczej
[V]
Prąd
[A]
Temperatura
wody przed
ogrzaniem
[°C]
Temperatu
ra wody po
podgrzaniu
[°C]
Czas
jakiego
potrzeba
na
podgrzanie
wody o
5°C
[s]
Czas
jakiego
potrzeba
na
podgrzanie
wody o
0.1°C
[s]
Pomiar
nr. 1
10,4
7,4
1,0
26,9
31,9
503
( 8'23” )
9
Pomiar
nr. 2
15
10,4
1,40
30,8
35,8
246
( 4'6” )
7
4.Opracowanie otrzymanych wyników
Opracowanie wyników.
Najpierw obliczam ilość ciepła potrzebną do ogrzania kalorymetru z wodą o 5°C korzystając ze
wzoru:
Q=( m
w
c
w
+ m
k
c
k
)* ∆T
c
w
=0.998 cal/ g*K , c
k
=0.094 cal/ g*K ,m
w
=135.4g ,m
k
=92.8g
Q=135.4 g
∗0.998 cal/ gK92.8 g∗0.094 cal / gK ∗
5=135.1292 cal/K8.7232 cal /K
∗
5=
=719.262 cal
Następnie obliczyłem wartość pracy W
1
dla natężenia I
1
= 1 A ,U
1
= 7.4 V i t
1
= 503 s i wartość pracy W
2
dla
natężenia I
2
= 1.4 A, U
2
= 10.4 V t2= 246s
W tym celu skorzystałem ze wzoru
W=U*I*t
,
W
1
= 7,4 V*1 A*503 s = 3722,2 J
W
2
= 10,4 V*1,4 A* 246 s = 3581,76 J.
Teraz obliczam mechaniczny równoważnik ciepła dla uzyskanych danych:
J
1
= W
1
/ Q = 3722,2 J / 719,262 cal = 5,175 J / cal
J
2
= W
2
/ Q = 3581,76 J / 719,262 cal = 4,98 J / cal.
Ostateczną wartość mechanicznego równoważnika ciepła ustalam dzięki średniej
arytmetycznej pomiarów, co daje ostatecznie w wyniku 5,0775 J / cal.
5. Ocena błędu pomiarowego
Obliczam złożoną niepewność standardową i w tym celu korzystam z prawa przenoszenia
niepewności maksymalnej.
1. Dla natężenia prądu równego I=1A
ΔJ
1
= 1/719,262 ( 7,4*503*0,08 + 1*503*2,5 + 1*7,4*0,1 + (7,4*1*503*0,1)/5 +
1/719,262 (7,4*1*503*135,4*5*0,01 + 7,4*1*503*0,998*5*0,1 +
7,4*1*503*92,8*5*0,01 + 7,4*1*503*0,94*5*0,1) = 2,36 J/cal
2. Dla natężenia prądu równego I=1.4A
ΔJ
2
= 1/719,262 ( 10,4*246*0,08 + 1,4*246*2,5 + 1,4*10,4*0,1 + (10,4*1,4*246*0,1)/5 +
1/719,262 (10,4*1,4*246*135,4*5*0,01 + 10,4*1,4*246*0,998*5*0,1 +
10,4*1,4*246*92,8*5*0,01 + 10,4*1,4*246*0,94*5*0,1) = 1,67 J/cal
Niepewność pomiarowa wynosi U
c
( J ) = ΔJ/√3
czyli dla pierwszego pomiaru wynosi 1,36
dla drugiego pomiaru wynosi natomiast 0,96 co jest przedstawione w tabeli na 1 stronie
6. Wnioski
Wyznaczony przez mnie błąd średni wartości mechanicznego równoważnika ciepła (5,0775
J/cal) różni się od tablicowej wartości (4.187 J/cal) o 23%.
Jest to niedokładna wartość ponieważ nie jest mi znana dokładna proporcja metali w stopie
mosiądzu z jakiego wykonane jest naczynko kalorymetryczne, jak również nie znany mi jest stopień
izolacji kalorymetru od środowiska zewnętrznego. Wypaczenie wyników pomiaru wprowadza
również brak informacji czym została przymocowana spirala grzewcza do naczynka
kalorymetrycznego ( prawdopodobnie jest to jakiś klej lub żywica ). Błąd przy pomiarze napięcia i
natężenia prądu wynika z faktu iż opornica suwakowa nie trzyma cały czas zadanego oporu.
Najlepsze odwzorowanie dało by umieszczenie elementu grzewczego bezpośrednio w
małym naczynku a dopiero po tym zmierzenie czasu potrzebnego do ogrzania wody o zadaną
temperaturę.
+
∆
⋅
+
+
∆
⋅
+
+
∆
⋅
+
=
∆
t
T
m
c
m
c
IV
V
T
m
c
m
c
It
I
T
m
c
m
c
Vt
k
k
w
w
k
k
w
w
k
k
w
w
δ
δ
δ
)
(
)
(
)
(
( )
( )
=
∆
⋅
+
+
∆
⋅
+
+
∆
⋅
+
+
T
T
m
c
m
c
IVt
m
T
m
c
m
c
T
c
IVt
m
T
m
c
m
c
T
c
IVt
k
k
w
w
k
k
k
w
w
k
w
k
k
w
w
w
2
2
2
2
2
)
(
)
(
)
(
)
(
)
(
δ
δ
δ
δ
δ
∆
⋅
+
∆
⋅
+
∆
⋅
+
∆
⋅
+
∆
⋅
+
∆
⋅
⋅
=
T
T
IVt
m
Q
T
c
IVt
m
Q
T
c
IVt
t
IV
V
It
I
Vt
Q
k
k
w
w
δ
δ
δ
)
(
)
(
1
Wyszukiwarka
Podobne podstrony:
24 - oddane 21.04.2010, Studia, Pracownie, I pracownia, 24 Wyznaczenie mechanicznego równoważnika ci
24 Wyznaczanie mechanicznego równoważnika ciepła
24 - oddane 21.04.2010, Studia, Pracownie, I pracownia, 24 Wyznaczenie mechanicznego równoważnika ci
24 Wyznaczanie mechanicznego równoważnika ciepła
spraw, 24, Wyznaczanie ciepla topnienia lodu
24.WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAYA., Fizyka
24 WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO MIEDZI ORAZ STAŁEJ FARADAYA doc
ISO128 24 lines mechanical
Wyznaczanie współczynnika wnikania ciepła podczas konwekcji wymuszonej gazu w rurze, Laborki - tiś
Wyznaczanie stosunku molowego ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właści
Cw25-2 - Wyznaczenie elektrochemicznego rownowaznika miedzi, PRENTKI PIOTR
DARMOWA ENERGIA Mechaniczny Generator Ciepla
7 Analiza termiczna w zastosowaniu do wyznaczania wykresu równowagi fazowej
2 Mechanizm równowagi
Furmański P Izolacje cieplne, mechanizmy wymiany ciepła, właściwości cieplne i ich pomiary
LABOLATORIUM ELETROMETRIA (WYZNACZANIE WSPÓŁCZYNNIKÓW PRZEJMOWANIA CIEPŁĄ)
Lab 24, MIBM WIP PW, fizyka 2, laborki fiza(2), 24-Wyznaczanie długości fali światła za pomocą siatk
więcej podobnych podstron