
Projekt Fizyka wobec wyzwań XXI w. współfinansowany ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego
PRAKTIKUM Z CHEMII OGÓLNEJ
Dwiczenia laboratoryjne dla studentów I roku kierunku
„Zastosowania fizyki w biologii i medycynie”
Biofizyka molekularna
Projektowanie molekularne i bioinformatyka
Optyka okularowa
Dwiczenie 1 (07.12.09 – 11.12.09)
Właściwości roztworów buforowych
Potencjometryczne pomiary pH
Osoby prowadzące:
mgr Joanna Kowalska, mgr Joanna Krasowska, mgr Dorota Kubacka,
dr Elżbieta Bojarska
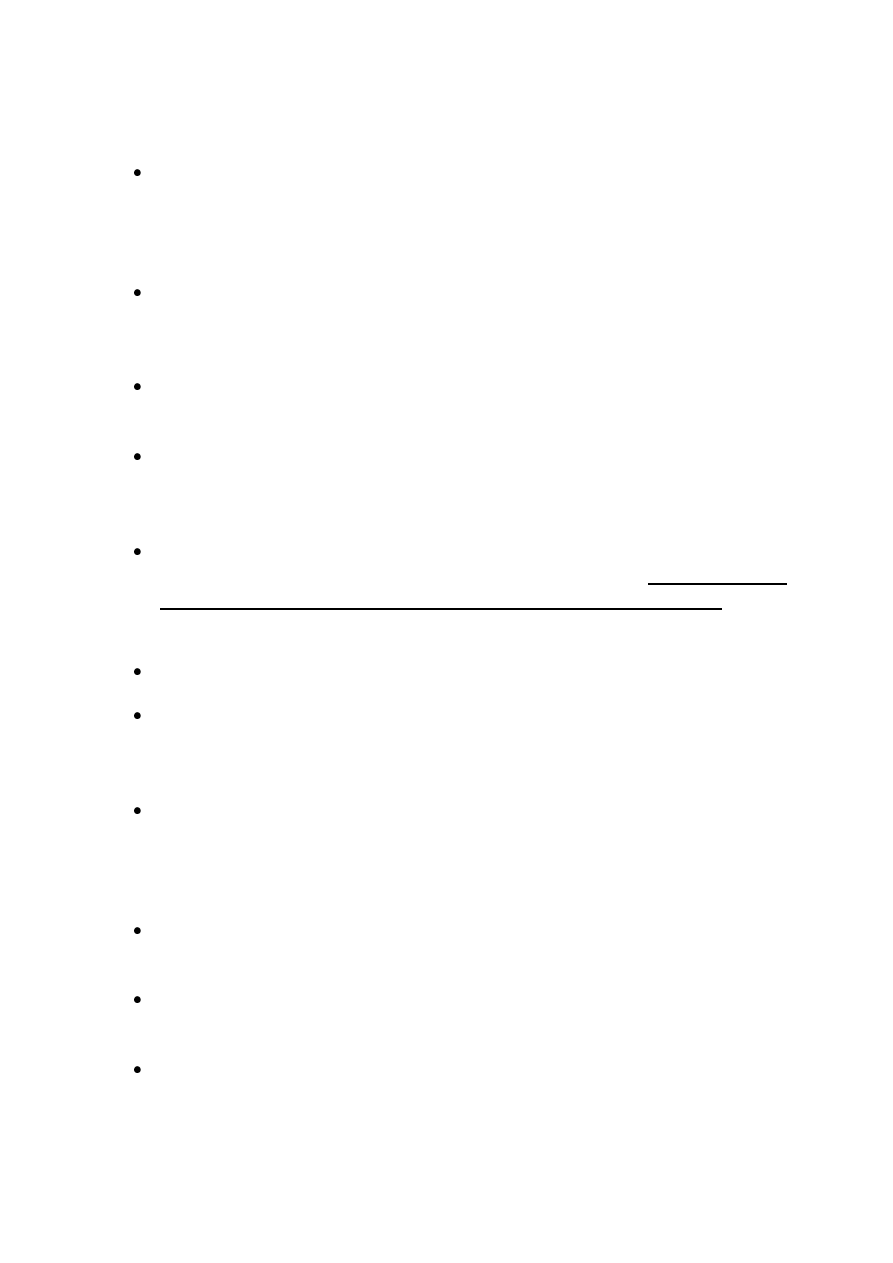
Regulamin pracowni i zasady zaliczania
W ramach „Praktikum z chemii ogólnej” należy zaliczyd 5 dwiczeo. W przypadku
nieobecności należy dwiczenie wykonad w terminie dodatkowym. Przewidziane są
2 terminy dodatkowe: 18.01.2010 w godz. 9.30-12.30 oraz 22.01.2010 w godz.
9.30-12.30.
Wszystkich uczestników pracowni obowiązuje znajomośd zasad BHP w laboratorium
chemicznym i zasad udzielania pierwszej pomocy oraz regulaminu pracowni
(szczegółowe informacje na pierwszych zajęciach)
Na dwiczenia należy przychodzid punktualnie i kooczyd je o wyznaczonej godzinie
(każda pracownia trwa 3 godziny zegarowe)
Warunkiem przystąpienia do części doświadczalnej jest zaliczenie sprawdzianu
wejściowego. Wymagane zagadnienia będą podawane w instrukcji do każdego
dwiczenia.
Praca w laboratorium odbywa się o odzieży ochronnej (obowiązkowo), okularach
oraz rękawiczkach (w przypadku pracy z substancjami żrącymi). Każdy student ma
obowiązek posiadad własny fartuch i przynosid go na każdą pracownię. Okulary
ochronne oraz rękawiczki jednorazowe będą dostępne na pracowni.
W trakcie wykonywania dwiczenia należy prowadzid notatki.
Dwiczenia wykonywane będą pojedynczo lub w grupach 2-osobowych, ale opis
dwiczenia każdy student przygotowuje indywidualnie. Opis należy dostarczyd
w terminie 1 tygodnia od daty wykonania dwiczenia.
Warunkiem zaliczenia każdego dwiczenia jest zaliczenie sprawdzianu wejściowego,
wykonanie zadao zgodnie z instrukcją i poleceniami osoby prowadzącej oraz
przygotowanie opisu. Każda częśd jest osobno punktowana. Ocena koocowa za
dwiczenie zależy od ilości zdobytych punktów.
Studenci obowiązani są do przestrzegania porządku i czystości na stołach
laboratoryjnych, w szafkach, szufladach i lodówkach.
Po zakooczeniu pracy należy umyd naczynia używane w czasie wykonywania
dwiczenia i zostawid porządek na stole laboratoryjnym.
Nieprzestrzeganie obowiązujących zasad BHP oraz regulaminu może spowodowad
usunięcie studenta z pracowni.

Projekt Fizyka wobec wyzwań XXI w. współfinansowany ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego
Wstęp teoretyczny
Roztwory elektrolitów
Cząsteczki elektrolitów ulegają pod wpływem rozpuszczalnika rozpadowi na jony. Proces ten
nazywa się dysocjacją elektrolityczną i jest opisywany za pomocą stopnia dysocjacji (α),
zdefiniowanego jako stosunek ilości cząsteczek zdysocjowanych (N
α
) do ilości cząsteczek
wprowadzonych do roztworu (N)
Stopieo dysocjacji zależy od rodzaju elektrolitu, rodzaju rozpuszczalnika, stężenia oraz
obecności innych substancji w roztworze. Elektrolity mocne są w znacznym stopniu
zdysocjowane (α >90%). Elektrolitami mocnymi są wszystkie dobrze rozpuszczalne sole oraz
kwasy i zasady, w których przeważa jonowy charakter wiązania.
W roztworach słabych elektrolitów (słabych kwasów HA i słabych zasad B), których
dysocjacja przebiega wg równania
HA + H
2
O ↔ H
3
O
+
+ A¯
B + H
2
O ↔ BH +OH¯
znajdują się zarówno jony jak i cząsteczki niezdysocjowane.
Proces dysocjacji słabego kwasu czy słabej zasady opisywany jest ilościowo za pomocą stałej
dysocjacji K
a
W roztworze słabego kwasu HA o stężeniu początkowym c, zdysocjowanego w stopniu α ,
powstaje cα jonów H
3
O
+
i tyle samo anionów A¯. Różnica c – cα określa ilośd kwasu
niezdysocjowanego. Po podstawieniu tych wartości do równania na stałą równowagi
otrzymuje się zależnośd
Aktywnośd elektrolitów
W wodnych roztworach mocnych elektrolitów zachodzi szereg procesów (takich jak
przyciąganie jonów różnoimiennych, tworzenie się par i trójek jonowych, hydratacja), które
powodują, że roztwory te zachowują się tak, jakby ich stężenia były mniejsze od
rzeczywistych. To zmniejszone, efektywne stężenie jonów w roztworze określa się
aktywnością
gdzie c
i
oznacza stężenie molowe i-tego jonu, f
i
współczynnik aktywności.
Wartośd aktywności zależy od stężenia elektrolitu. W miarę rozcieoczania roztworu wartośd
aktywności zbliża się do wartości stężenia. W roztworze nieskooczenie rozcieoczonym obie
wartości są sobie równe.
Aktywnośd określonego typu jonów zależy od obecności wszystkich jonów powstających w
wyniku dysocjacji elektrolitu. Wielkością, która charakteryzuje oddziaływania jonowe w
roztworach elektrolitów jest siła jonowa
gdzie c
i
oznacza stężenie molowe i-tego jonu, a z jego ładunek.
Wartośd współczynnika aktywności dla określonego jonu oblicza się ze wzoru Debye’a-Hückla
w którym A i B oznaczają stałe zależne od temperatury i właściwości rozpuszczalnika, a d
odpowiada średnicy uwodnionego jonu.
Na podstawie pomiarów fizykochemicznych prowadzonych dla roztworów elektrolitów
(potencjały redoks, przewodnictwo), można wyznaczyd jedynie średni współczynnik
aktywności elektrolitu, związany z aktywnościami różnych jonów obecnych w roztworze.

Projekt Fizyka wobec wyzwań XXI w. współfinansowany ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego
Teorie kwasów i zasad
Teoria Arrheniusa
Według teorii Arrheniusa kwasy to substancje, które w roztworach wodnych odszczepiają jon
wodorowy
HA ↔ H
+
+ A¯
Zasadami natomiast są substancje odszczepiające jon wodorotlenowy
BOH ↔ B
+
+ OH¯
Teoria Arrheniusa dobrze tłumaczy zachowanie kwasów i zasad w roztworach wodnych,
zawodzi jednak w przypadku procesów hydrolizy obojętnych soli. Nie tłumaczy również
zachowania niektórych związków w roztworach niewodnych. Przykładem jest mocznik, który
w wodzie nie wykazuje cech kwasu ani zasady, natomiast w ciekłym amoniaku zachowuje się
jak kwas.
Teoria Lowry’ego-Brönsteda
Podstawowym założeniem teorii Lowry’ego-Brönsteda jest to, że proces dysocjacji polega nie
tylko na rozpadzie substancji na jony, ale również na reakcji z cząsteczkami rozpuszczalnika.
Jon wodorowy powstający w wyniku dysocjacji kwasu jest w rzeczywistości hydratowany.
Zachowanie się kwasów w wodzie polega zatem na przekazaniu protonu do cząsteczki wody.
HA + H
2
O ↔ H
3
O
+
+ A¯
W teorii protonowej Lowry’ego-Brönsteda kwasem jest substancja zdolna do oddawania
protonów (donor protonów), a zasadą substancja zdolna do przyłączenia protonów
(akceptor protonów). W wyniku reakcji kwasu z zasadą powstaje sprzężona z nimi para
zasada/kwas
HCl(kwas1) + H
2
O(zasada1) ↔ Cl¯(zasada2) + H
3
O
+
(kwas2)
Mocny kwas wykazuje silne tendencje do oddawania protonów, a sprzężona z nim zasada
posiada słabe właściwości protonoakceptorowe (mocny kwas jest sprzężony ze słabą
zasadą).
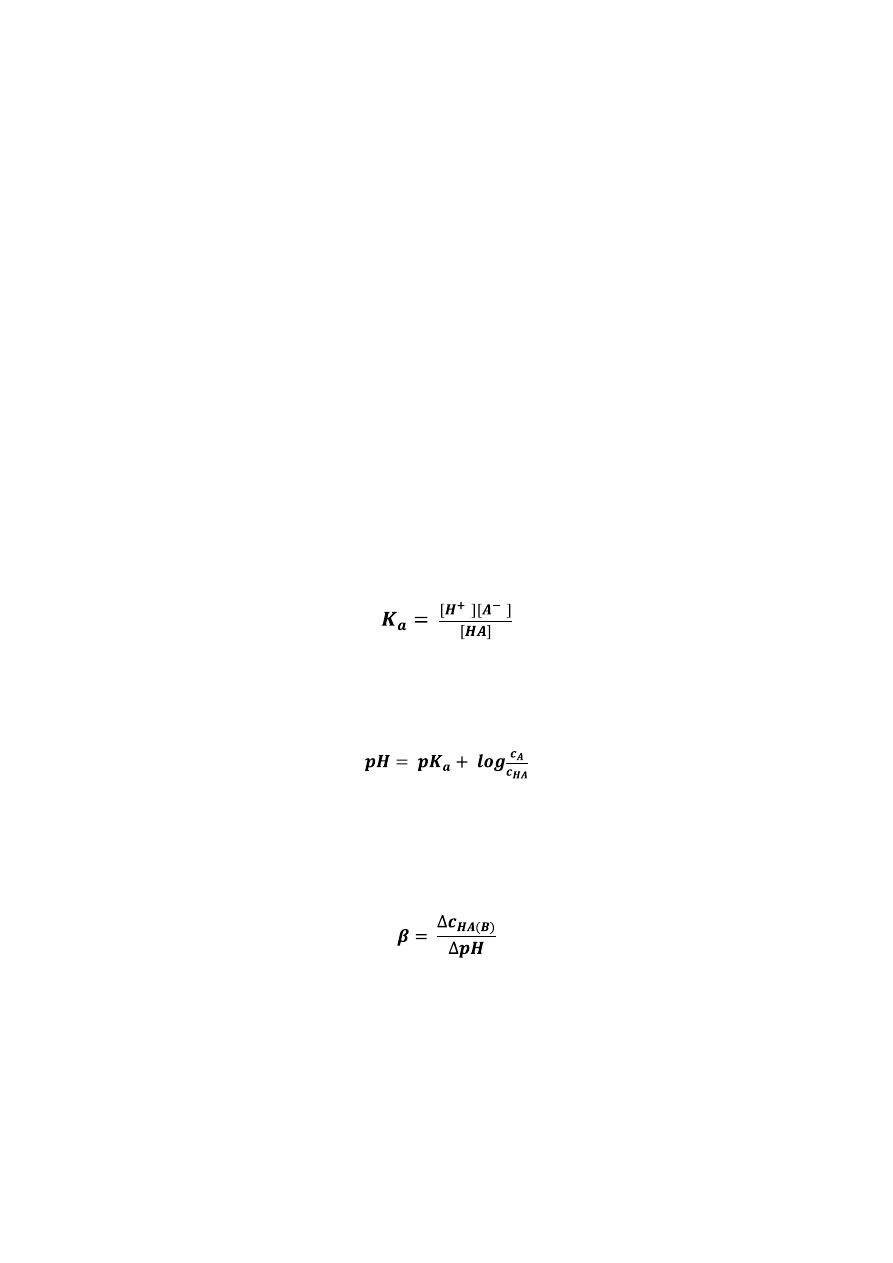
Teoria Lewisa
Kwasem jest każdy akceptor pary elektronowej, a zasadą donor pary elektronowej. Każdy
kwas wg teorii Lowry’ego-Brönsteda jest zarazem kwasem Lewisa, to samo dotyczy zasad.
Teoria Lewisa rozszerza jednak pojęcie kwasu i zasady na związki, których poprzednie teorie
nie uwzględniały, np. cząsteczki nie zawierające protonów: BF
3,
SO
3,
AlCl
3
. Mogą one tworzyd
połączenia z donorami par elektronowych: H
2
O, NH
3
, aniony reszt kwasowych.
H
+
(kwas) + NH
3
(zasada) ↔ NH
4
+
BF
3
(kwas) + F¯(zasada) ↔ BF
4
Roztwory buforowe
Roztworami buforowymi nazywamy roztwory zawierające sprzężony układ kwas/zasada,
o wysokich stężeniach początkowych (0.2 -1 mol/dm
3
). Roztwory buforowe mają zdolnośd
utrzymywania prawie stałej wartości pH przy rozcieoczaniu oraz dodawaniu niewielkiej ilości
stężonego kwasu czy zasady.
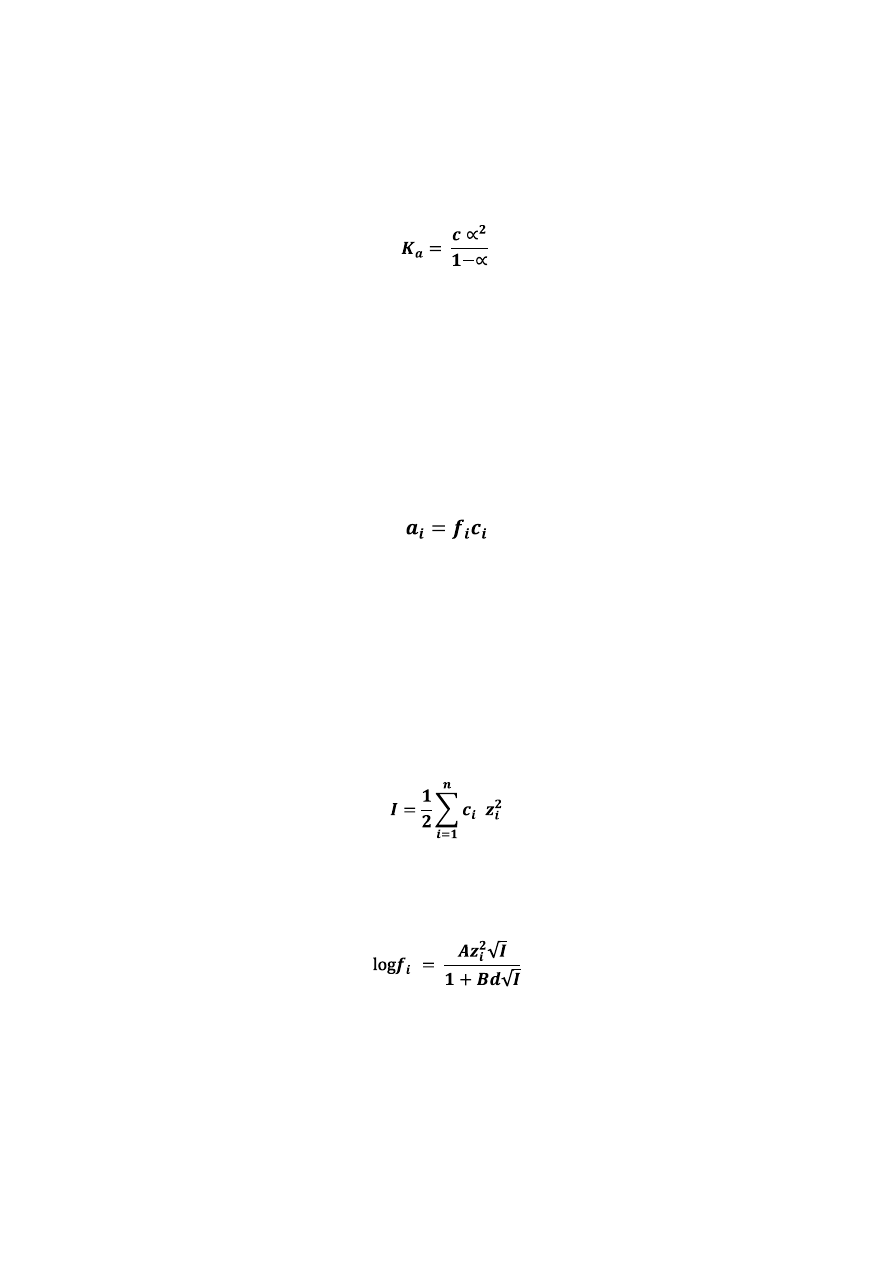
Stan równowagi pomiędzy kwasem i zasadą w układzie buforującym jest określony stałą
dysocjacji słabego kwasu HA
Roztwór buforowy otrzymuje się przez zmieszanie słabego kwasu HA i sprzężonej z nim
zasady A¯ o stężeniach odpowiednio c
HA
oraz c
A
. Po podstawieniu do wzoru na stałą
dysocjacji można obliczyd pH roztworu buforowego
Utrzymywanie stałego pH roztworów buforowych obserwuje się tylko w pewnych granicach.
Ilościową miarą zdolności roztworu buforowego do przeciwdziałania zmianie pH w wyniku
dodania mocnego kwasu czy zasady jest jego pojemnośd buforowa określona jako stosunek
dodanej ilości kwasu lub zasady (w molach) do zmiany pH
Pojemnośd buforowa zależy od wyjściowych stężeo składników. Znaczne rozcieoczanie
roztworu buforowego, chociaż nie wpływa istotnie na zmianę jego pH, jest niekorzystne ze
względu na zmniejszanie pojemności buforowej.
Projekt Fizyka wobec wyzwań XXI w. współfinansowany ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego
Pomiary pH roztworów
W celu dokładnego określenia pH roztworów wykorzystuje się pomiary potencjometryczne
wykonywane za pomocą pH-metrów. Wartośd pH określa się na podstawie pomiaru SEM
ogniwa zbudowanego z dwóch elektrod, z których jedna jest wrażliwa na stężenie jonów
wodorowych. Najczęściej do pomiarów pH używa się elektrody szklanej w kształcie rurki ze
szkła zakooczonej kulistą, cienką membraną szklaną. Wewnątrz elektrody szklanej znajduje
się drut srebrny pokryty warstwa AgCl, zanurzony w 0,1 M roztworze HCl. Potencjał
półogniwa wewnętrznego (Ag│AgCl│HCl jest stały (0,222V). Zmiany potencjału elektrody
szklanej wynikają ze zmian potencjału na granicy faz roztworu i membrany szklanej.
Powierzchniowa warstwa membrany szklanej ulega hydratacji w kontakcie z roztworem.
Przebiegają w niej procesy wymiany jonowej między szkłem a roztworem oraz dyfuzja jonów
wodorowych wewnątrz hydratowej części membrany. Elektrodą odniesienia jest najczęściej
elektroda kalomelowa lub chlorosrebrowa. Budowa tej drugiej jest taka sama jak półogniwa
wewnętrznego elektrody szklanej.
Schemat budowy elektrody do pomiarów pH
SEM ogniwa złożonego z elektrody wskaźnikowej i elektrody odniesienia jest równe różnicy
potencjałów obu elektrod

gdzie E
0
oznacza potencjał standardowy elektrody,
aktywnośd jonów wodorowych,
z liczbę elektronów biorących udział w reakcji elektrodowej, R stałą gazową, F stałą
Faradaya, T temperaturę bezwzględną.
Reakcje hydrolizy
Reakcje hydrolizy są to reakcje między cząsteczkami wody a jonami powstałymi w wyniku
dysocjacji soli. Hydrolizie nie ulegają sole mocnych kwasów i mocnych zasad. Wyróżnia się 3
typy reakcji hydrolizy: kationową, anionową i kationowo-anionową.
Hydrolizie kationowej ulegają sole mocnych kwasów i słabych zasad (odczyn roztworu
kwaśny)
Me
+
+ 2H
2
O ↔ MeOH + H
3
O
+
NH
4
Cl → NH
4
+
+ Cl¯ NH
4
+
+ 2H
2
O → NH
4
OH + H
3
O
+
Hydrolizie anionowej ulegają sole słabych kwasów i mocnych zasad (odczyn roztworu
zasadowy)
R¯ + H
2
O ↔ HR + OH¯
CH
3
COONa → CH
3
COO¯ + Na
+
CH
3
COO¯ + H
2
O ↔ CH
3
COOH + OH¯
Hydrolizie kationowo-anionowej ulegają sole słabych kwasów i słabych zasad (odczyn zależy
od stałych dysocjacji kwasu i zasady)
Me
+
+ R¯ + H
2
O ↔ MeOH + HR
AlClO
3
→ Al
3+
+ 3ClO¯
Al
3+
+ 3ClO¯ + 3 H
2
O ↔ Al(OH)
3
+ 3HClO
Częśd doświadczalna
Cel dwiczenia
Przygotowanie roztworów buforowych, pomiary pH, obliczanie siły jonowej roztworów oraz
współczynników aktywności jonów.

Projekt Fizyka wobec wyzwań XXI w. współfinansowany ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego
Zagadnienia do przygotowania
Dysocjacja elektrolityczna, stała i stopieo dysocjacji, elektrolity mocne i słabe, iloczyn jonowy
wody, siła jonowa roztworu, aktywnośd jonów, teorie kwasów i zasad, definicja pH,
obliczanie pH roztworów kwasów i zasad, potencjometryczny pomiar pH, budowa i zasada
działania elektrody szklanej.
Odczynniki
Słabe kwasy: CH
3
COOH (roztwór o stężeniu 1 mol/dm
3
), Hepes (substancja stała)
Zasady: NaOH (roztwór o stężeniu 1 mol/dm
3
)
Sole: NaCl, CH
3
COONa, HCOONH
4
, NaBO
2
, NH
4
Cl, NaHCO
3
, Na
2
CO
3
, K
2
HPO
4
, KH
2
PO
4
Inne związki: mocznik, imidazol
Przygotowanie roztworów
250 cm
3
roztworu CH
3
COOH, CH
3
COONa, NaHCO
3
, Na
2
CO
3 ,
K
2
HPO
4
, KH
2
PO
4
oraz
Hepes o stężeniu 0,05 mol/dm
3
100 cm
3
roztworu HCOONH
4
o stężeniu 0,1 mol/dm
3
100 cm
3
roztworu NaBO
2
o stężeniu 0,1 mol/dm
3
100 cm
3
roztworu NH
4
Cl o stężeniu 0,1 mol/dm
3
Przygotowanie pH-metru
Przed wykonaniem pomiarów należy dokonad kalibracji pH-metru, zgodnie
z instrukcją lub wskazówkami osoby prowadzącej dwiczenie. Przed każdym
zanurzeniem elektrody do roztworu kalibracyjnego lub roztworu badanego, elektrodę
należy opłukad wodą destylowaną i osuszyd bibułą filtracyjną.
W czasie wykonywania pomiarów potencjometrycznych należy zwracad uwagę, aby
nie uszkodzid membrany szklanej (nie dotykad nią dna ani ścianek naczynia).
Szczególną ostrożnośd należy zachowad przy uruchamianiu mieszadła w naczyniu,
w którym zanurzona jest elektroda.

Wykonanie dwiczenia
Przygotowad bufor octanowy przez zmieszanie roztworu CH
3
COOH i roztworu
CH
3
COONa (bufor węglanowy przez zmieszanie NaHCO
3
i Na
2
CO
3
, bufor fosforanowy
przez zmieszanie K
2
HPO
4
i KH
2
PO
4
). Wykonad pomiary pH. Otrzymane z pomiarów
potencjometrycznych wyniki porównad z obliczonmi wartościami pH.
Rozcieoczyd bufory 10-krotnie. Zmierzyd pH.
Do 50 ml buforu octanowego (węglanowego, fosforanowego) dodad 5 ml 1 M HCl.
Zmierzyd pH. Taką samą ilośd kwasu dodad do 50 ml wody destylowanej i zmierzyd
pH.
Przygotowad roztwór buforowy Hepes o pH 7.5, przez dodawanie porcjami 1 M
roztworu NaOH. Do kolby miarowej o pojemności 100 ml wsypad 0,1 mola stałego
NaCl (mocznika, imidazolu) i uzupełnid buforem Hepes. Ponownie zmierzyd pH.
Obliczyd siłę jonową buforu z NaCl, wyznaczyd współczynnik aktywności jonów
wodorowych.
Zmierzyd pH roztworów soli: HCOONH
4
, NaBO
2
, NH
4
Cl. Napisad reakcje hydrolizy.
Literatura
J. Minczewski, Z. Marczenko, „Chemia analityczna”, Wydawnictwo Naukowe PWN
J. Cygaoski, „ Podstawy metod elektroanalitycznych”, Wydawnictwo WNT
L. Jones, P. Atkins, „Chemia ogólna – cząsteczki, materia, reakcje”, Wydawnictwo
Naukowe PWN
Wyszukiwarka
Podobne podstrony:
Aminy analityka
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
FENOLE analityka
Węglowodory analityka
AT kurs analityka giełdowego 3
Cw 8 Analityka
poprawki analityczna
geometria analityczna
Materialy IV Analityka 2012 Bol leki nienarkot
material obowiazujacy do kolokwiow z chemii analitycznej iiwf 2014
II, rzis analityczny 1A Likpol
LM Pracuj spec Analityk finansowy
Geometria analityczna przyklady
analityka podstawy spektroskopii 2012 2013
więcej podobnych podstron