
1. Laboratorium mikrobiologiczne
Cel ćwiczenia
•
Zapoznanie się z regulaminem ćwiczeń
•
Poznanie podstawowego szkła i sprzętu mikrobiologicznego i sposobów sterylizacji
•
Zapoznanie się rodzajami i sposobem przygotowywania podłoży mikrobiologicznych oraz
metodami hodowli mikroorganizmów
•
Mikroskopy stosowane w badaniach mikrobiologicznych
Podstawowe szkło
•
Probówki bakteriologiczne (probówki Falcone)
•
Płytki (szalki) Petriego
•
Kolby Roux (inne butelki)
•
Kolby Erlenmayera
Sprzęt do szczepienia
•
Igła bakteriologiczna
•
Eza bakteriologiczna
•
Głaszczka Drygalskiego
•
Palnik
Sprzęt do hodowli
•
Termostat
•
Wytrząsarka
Sprzęt do sterylizacji
•
Suszarka do sterylizacji szkła
•
Autoklaw do sterylizacji podłoży
Metody sterylizacji
•
Fizyczne
•
Chemiczne
Metody fizyczne
•
Wysoka temperaturą (sucha - wyżarzanie, opalanie, gorące powietrze i parą wodną -
dekoktacja, pasteryzacja, tyndalizacja, para wodna pod zwiększonym ciśnieniem -
sterylizacja)

•
Promienie elektromagnetyczne: UV, radiacyjne (jonizujące)
•
Sączenie
Metoda chemiczna
•
Sterylizacja gazowa (tlenek etylenu w mieszaninie CO
2
, beta-propiolakton, ozon i chlor,
fluor -woda)
Kontrola sterylizacji
•
Sporotesty (sporal A do autoklawów, sporal S do suszarek np. stericon plus Bioindicator do
autoklawu zawiera przetrwalniki Geobacillus stearothermophilus w fiolce 2 ml). Po
autoklawowaniu ampułki inkubuje się 48 godz. w temp. 60± 2
o
C. Nie wysterylizowane jako
kontrola. Jeśli kolor pozostanie czerwono-fioletowy to sterylizacja poprawna.
Dezynfekcja
•
Środki chemiczne (kwasy, zasady, środki utleniające, alkohole, aldehydy, związki fenoli i
ich pochodne, związki powierzchniowo czynne, jodofory, chloroheksydyna, sole metali
ciężkich)
•
Kontrola skażenia powierzchni i powietrza drobnoustrojami
Zastosowanie podłoży mikrobiologicznych
•
Izolacja
•
Różnicowanie
•
Identyfikacja
•
Namnażanie
•
Określenie właściwości fizjologicznych, biochemicznych i hodowlanych
Rodzaje podłoży ze względu na zawartość składników odżywczych
•
Minimalne
•
Pełne
•
Wzbogacone
Rodzaje podłoży ze względu na skład chemiczny
•
Naturalne
•
Półsyntetyczne
•
Syntetyczne
Rodzaje podłoży ze względu na konsystencję
•
Stałe (zaw. 1,5-2,0% agaru)
•
Półpłynne (0,1-0,7 agaru)
•
Płynne
•
Agar - uniwersalny środek zestalający pożywki mikrobiologiczne (z morskich krasnorostów
Selidum amansi)
•
Żelatyna (produkt hydrolizy kolagenu)
Rodzaje podłoży ze względu na przeznaczenie i zastosowanie
•
Namnażające
•
Wybiórcze
•
Namnażająco-wybiórcze
•
Izolacyjne
•
Różnicujące (identyfikacyjne, diagnostyczne)
•
Podłoża „transportowe"
Metody hodowli
•
Ze względu na rodzaj podłoża:
◦
hodowle płynne
◦
hodowle na podłożu stałym
Hodowle płynne
•
W probówkach
•
W kolbach
•
W butlach
•
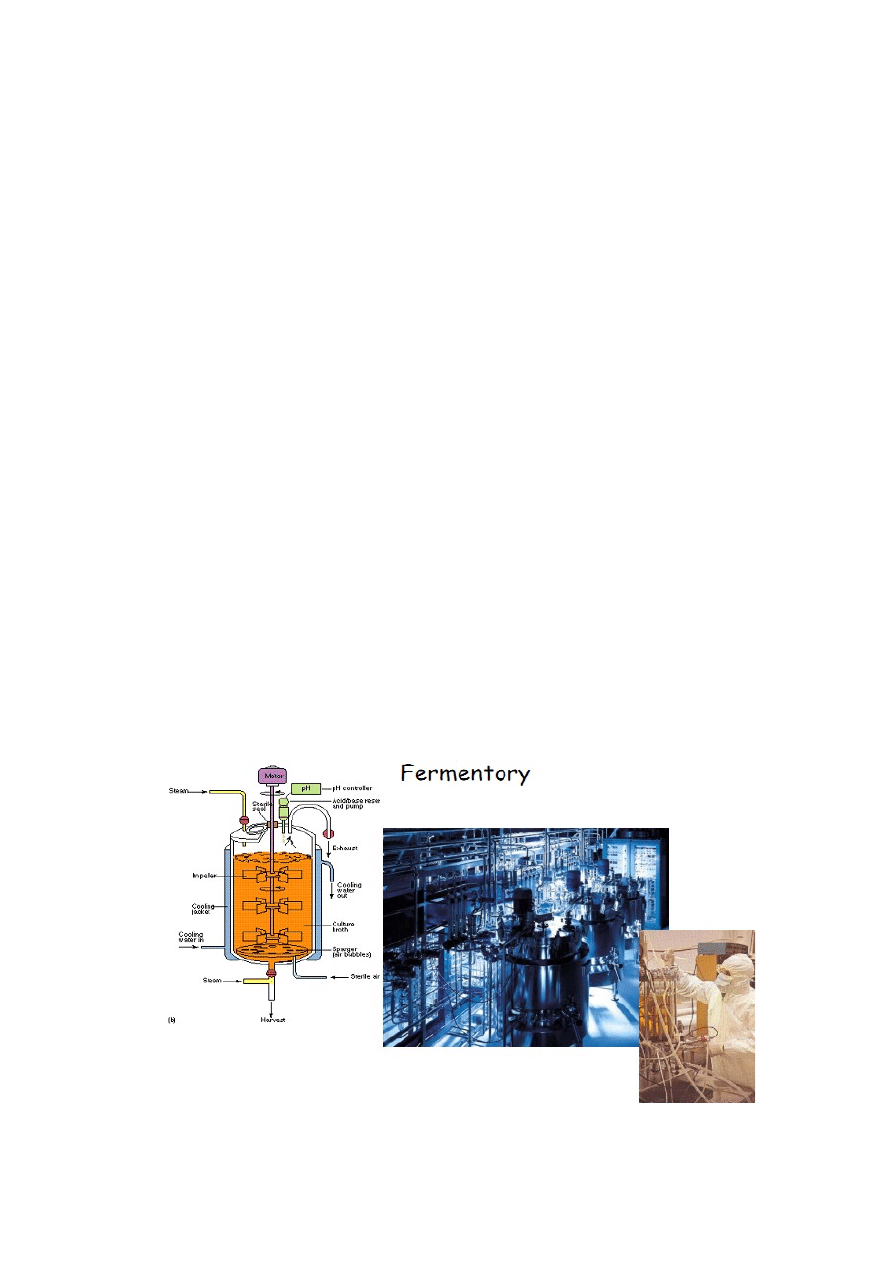
W fermentorach

Hodowle na podłożach stałych
•
Na płytkach Petriego
•
Słupkach
•
Skosach
•
W butlach
Ze względu na czas hodowli oraz dostęp do składników pokarmowych
Hodowle okresowe (zamknięte) - czynniki ograniczające to wyczerpanie składników
pokarmowych, nagromadzenie metabolitów i zmiana równowagi jonowej (głównie pH)
Hodowle otwarte (ciągłe) - ciągła kontrola zużycie substancji odżywczych, przyrost liczby i masy
drobnoustrojów oraz stężenie metabolitów
Hodowle zsynchronizowane - wszystkie osobniki dzielą się jednocześnie (w tym samym czasie)
Ze względu na stosunek bakterii do tlenu
•
Hodowle tlenowców
•
Hodowle beztlenowców
Hodowle tlenowców
•
Hodowle powierzchniowe
•
Hodowle wgłębne (wytrząsarki, fermentory)
Hodowle beztlenowców
•
Metody fizyczne (warstwa oleju parafinowego, słój próżniowy, hodowla w atmosferze gazu
obojętnego, przy użyciu zestawu np. „Gas-Pak")
•
Metody chemiczne (podłoża zawierające substancje chemiczne absorbujące tlen np.
pirogallol, chlorek miedziowy lub związki chemiczne obniżające potencjał oksydo-
redukcyjny np. kwas askorbinowy, siarczyn sodowy)
•
Metody biologiczne - hodowla na tym samym podłożu tlenowca i beztlenowca
Mikroskopy do obserwacji mikrobiologicznych
•
Świetlny
•
Z ciemnym polem widzenia
•
Kontrastowo-fazowy
•
Ultrafioletowy
•
Fluorescencyjny
•
Polaryzacyjno-interferencyjny
•
Elektronowy transmisyjny
•
Skaningowy

Mikroskop świetlny
•
Najważniejsze pojęcia dla mikrobiologa to powiększenie mikroskopu i zdolność rozdzielcza
•
Powiększeniem mikroskopu to stosunek obrazu pozornego A", który widzimy w
mikroskopie do wielkości przedmiotu (iloczyn powiększenia okularu i powiększenia
obiektywu)
•
Zdolność rozdzielcza (najmniejsza odległość pomiędzy dwoma punktami, przy której
widzimy je w mikroskopie oddzielnie)
•
Olejek immersyjny pozwala zwiększyć zdolność rozdzielczą mikroskopu do 0,19
mikrometra zwiększając aperturę liczbową obiektywu (suchy - 0,3 mikrometra, „wodny" -
0,24 mikrometra)
•
Zastosowanie odpowiednich filtrów lub światła UV może zwiększyć zdolność rozdzielczą
do 0,17 mikrometra
Mikroskop z ciemny polem widzenia
•
Pole widzenia ciemne, a obserwowane obiekty - jasne
(kondensor ciemnego pola)
•
Stosowany olejek immersyjny (górna soczewka
kondensora a dolna pow. preparatu)
•
Zdolność rozdzielcza podobna jak w mikroskopie
świetlnym
•
Obserwacje żywych bakterii
Mikroskop kontrastowo-fazowy
•
Bezbarwne obiekty fazowe (przezroczyste) przekształcane
są w obiekty amplitudowe powodujące zmiany natężenia
światła widoczne dla oka przy zastosowaniu płytki
fazowej
•
Umożliwia obserwacje żywych bakterii a w szczególności
ich ruchu (bez wybarwiania)
Mikroskop ultrafioletowy
•
Stosowane są lampy rtęciowo-kwarcowe
•
Poprzez zastosowanie światła UV ( o krótszej fali)
zwiększona została zdolność rozdzielcza do 0,1
mikrometra
Ilustracja 1: krętki
Ilustracja 2: komórki drożdży
Ilustracja 3: dwie kolonie Streptomyces
sp.
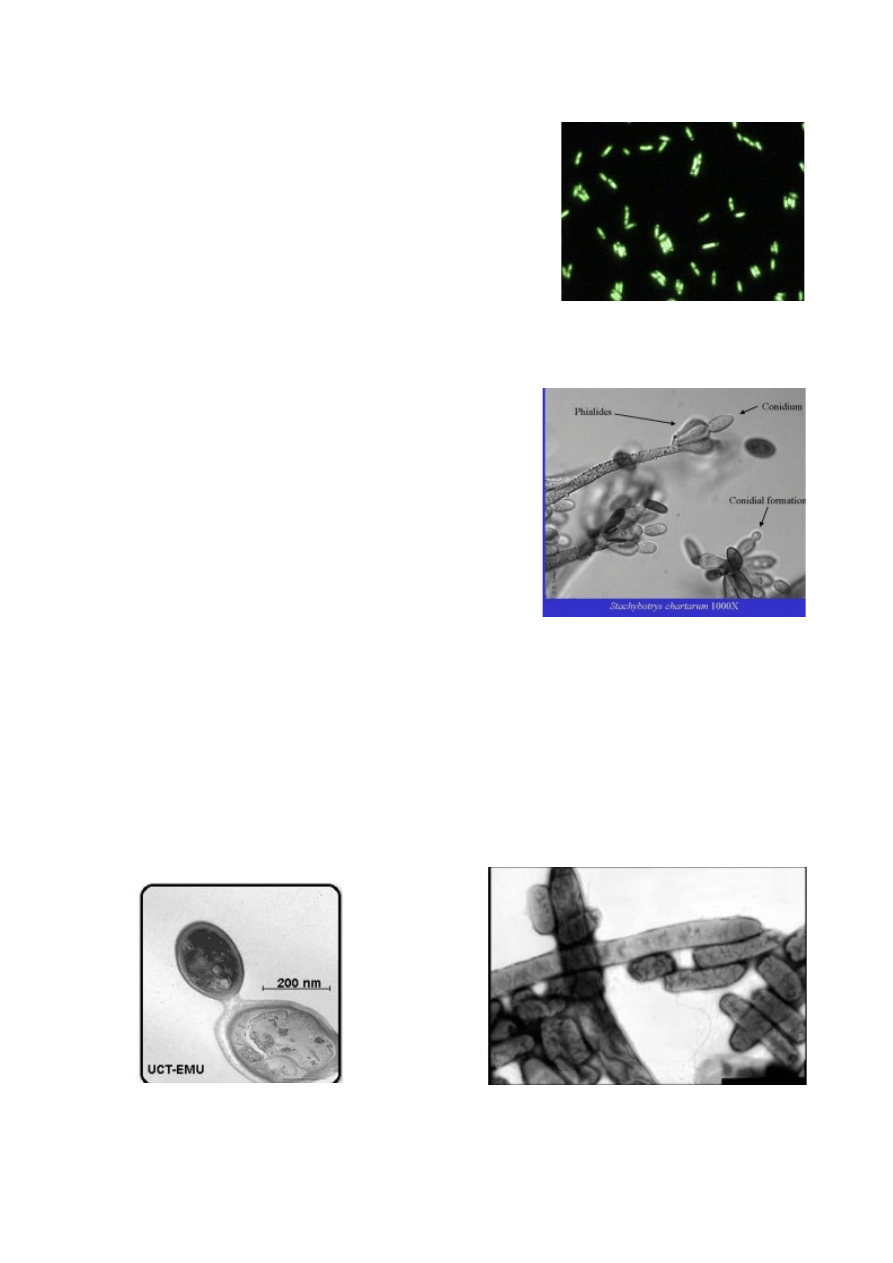
Mikroskop fluorescencyjny (luminescencyjny)
•
Wykorzystywane zjawisko pobudzania świecenia
preparatów oświetlanych promieniami ultrafioletowymi
po wybarwieniu fluorochromami (barwniki wysyłające
światło o długiej fali po wzbudzeniu promieniami UV)
np. erytrozyną, oranżem akrydynowym, rodaminą
Mikroskop polaryzacyjno-interferencyjny
•
Służy do obserwacji przezroczystych i pochłaniających
światło obiektów
•
Zastosowany pryzmat, polaryzator i analizator
•
Oglądany przedmiot robi wrażenie przestrzennego
Inne mikroskopy
•
Mikroskop elektronowy - transmisyjny (wykorzystywane są trzy elektromagnesy i wiązka
elektronów a obraz przekazywany jest na ekran lub kliszę fotograficzną), zdolność
rozdzielcza 4-10 siatki platynowe zamiast szkiełka podstawowego, preparaty bardzo cienkie
do 0,5 mikrometra, obraz trójwymiarowy
•
Mikroskop skaningowy (elektrony przechodzą przez cały preparat a powstały obraz może
być fotografowany lub obserwowany na monitorze) obraz trójwymiarowy, zdolność
rozdzielcza 0,02 mikrometra, obserwacja bakterii i ich penetracji w komórkach gospodarza
Obrazy z mikroskopu transmisyjnego
Ilustracja 4: bakterie z
fluoryzującym na zielono
białkiem
Ilustracja 6: pączkujące
drożdże (przekrój)
Ilustracja 5: Salmonella sp.
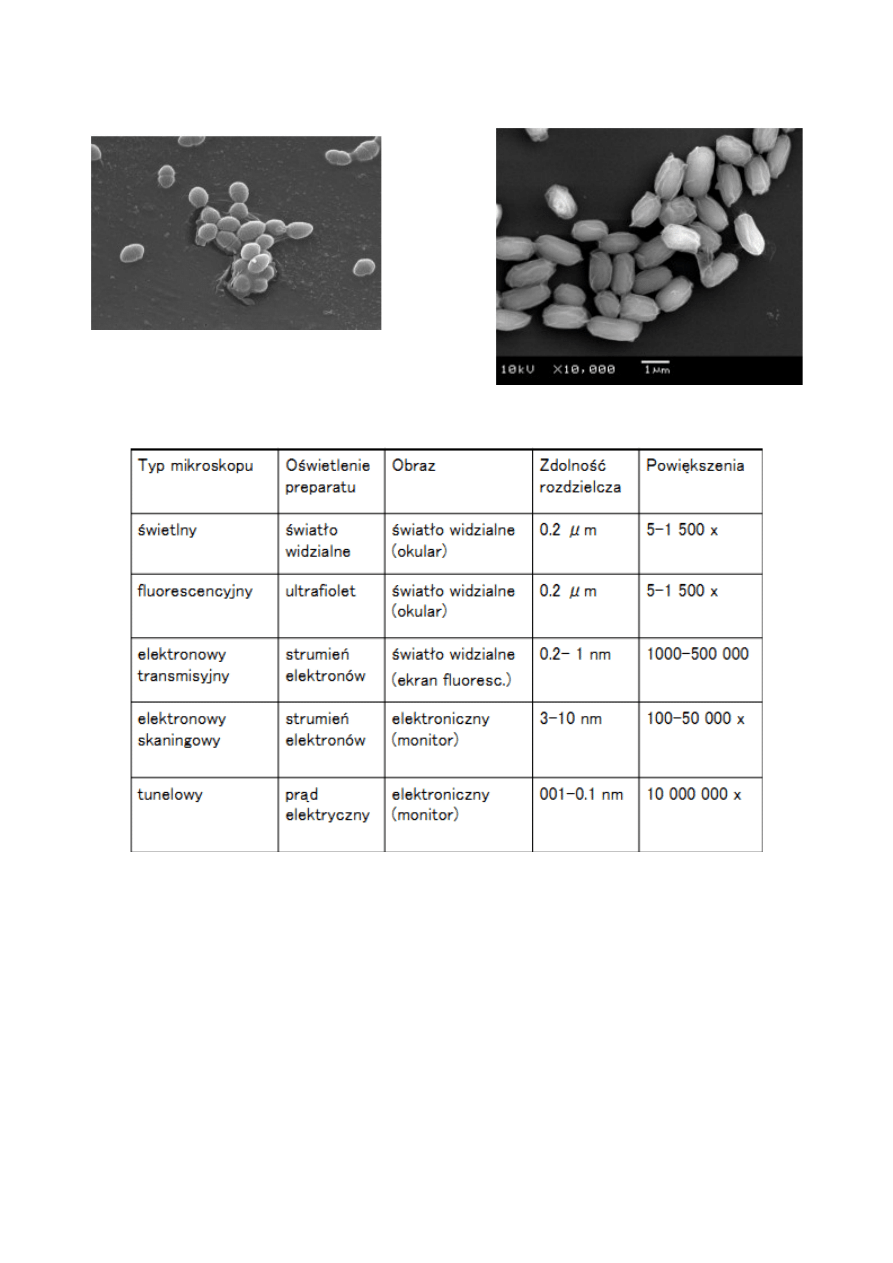
Obraz z mikroskopu skaningowego
Ilustracja 7: Bacillus anthrax
Ilustracja 8: Enterococcus faecalis
Wyszukiwarka
Podobne podstrony:
Sprawozdanie z zajęć laboratoryjnych z mikrobiologii nr 6
Główne zasady obowiązujące w laboratorium mikrobiologicznym, Główne zasady obowiązujące w laboratori
06 Wykonywanie badan mikrobiolo Nieznany
Instrukcja GO 1 LABORATORIUM 20 Nieznany
5 1 13a CCNA1 Laboratorium pl i Nieznany (2)
podstawa EGZAMIN MIKROBIOLOGIA Nieznany
5 CWICZENIA LABORATORYJNE Z SYS Nieznany (2)
JPPO Wstep do laboratorium id 2 Nieznany
wyposazenie laboratorium mikrobiologicznego
laboratorium artykul 2010 01 28 Nieznany
OCENA MIKROBIOLOGICZNA PRODUKTO Nieznany
mikrobiologia zywnosci podstawy pracy w laboratorium
LaboratoriumProcesorySygnaloweW Nieznany
5 2 3a CCNA1 Laboratorium pl id Nieznany (2)
LaboratoriumPodstawAutomatyki D Nieznany
Lab 2 - Podstawowe techniki mikrobiologiczne, Laboratorium 2
więcej podobnych podstron