
Zasady post
ę
powania
diagnostyczno-leczniczego
w osteoporozie
u osób po 20 r.
ż
.
(propozycja)
Post
ę
powanie w osteoporozie
Cz
ęść
2
Dr hab. med. Jerzy Przedlacki
Katedra i Klinika Chorób
Wewn
ę
trznych i Nefrologii
Akademia Medyczna
w Warszawie
Krajowe Centrum Osteoporozy
Warszawa

ISBN: 83-89517-67-8
Nakład 200 egz.
Druk i oprawa:
Zakład Wydawniczo-Poligraficzny Jerzy Krawczyk, 02-830 Warszawa, ul. Gawota 13A
www.drukarz.net

3
Słowo wst
ę
pne
Prof. dr hab. med. Janusz Nauman
Konsultant Krajowy w dziedzinie Endokrynologii
Z wielk
ą przyjemnością przedstawiam Koleżankom i Kolegom opracowane przez dr hab. n.
med. Jerzego Przedlackiego "Zasady post
ępowania w osteoporozie". Opracowanie to uważam
za wa
żne z kilku powodów. Po pierwsze, w miarę jak życie ludzkie ulega wydłużeniu,
osteoporoza staje si
ę coraz większym problemem. Pesymistyczne założenia Światowej
Organizacji Zdrowia przewiduj
ą, że po roku 2015 choroba ta może dotknąć ponad 2 mld ludzi
i u niektórych z nich zale
żne od osteoporozy złamania kości i komplikacje związane z ich
leczeniem b
ędą nie tylko przyczyną trwałego inwalidztwa, ale również śmierci. "Zasady
post
ępowania w osteoporozie" są więc opracowaniem, z którym powinni się zapoznać lekarze
wielu specjalno
ści poczynając od lekarzy podstawowej opieki zdrowotnej, ale również
nefrolodzy, pneumonolodzy, endokrynolodzy i ortopedzi i inni, bowiem nie ma w
ątpliwości,
że coraz więcej naszych chorych będzie miało osteoporozę. Drugą przyczyną, dla której
uwa
żam pracę dr hab. Jerzego Przedlackiego za ważną jest merytoryczna wartość
opracowania. Uwag
ę zwraca znakomicie dobrane piśmiennictwo i wynikająca z wiedzy i
do
świadczenia autora ocena tego, u kogo należy spodziewać się osteoporozy, jak tę chorobę
diagnozowa
ć, jak oceniać wartość poszczególnych badań, jakie są wskazania do leczenia, jak
to leczenie prowadzi
ć i jak kontrolować jego efekty. Czytając opracowanie dr. hab. Jerzego
Przedlackiego zadawałem sobie pytanie, czy ze wszystkimi pogl
ądami Autora się zgadzam.
Otó
ż nie ze wszystkimi. Kontrowersje mogą budzić poglądy, że złamanie kości może być
wskazaniem do przerwania leczenia. Ale kolejnym powodem, dla którego zach
ęcam do
zapoznania si
ę z opracowaniem dr hab. Jerzego Przedlackiego jest sformułowana przez niego
idea,
że Jego opracowanie winno być materiałem do szerokiej dyskusji wszystkich, którzy
zajmuj
ą się osteoporozą i mają własne doświadczenia. Autor zakłada, że konstruktywna
krytyka przedstawionych przez Niego pogl
ądów i własne propozycje dyskutantów powinny
przyczyni
ć się do uzyskania interdyscyplinarnego konsensusu dotyczącego diagnozowania,
leczenia i prognozowania skutków leczenia osteoporozy. Autor ma nadziej
ę, że takie
przedyskutowane i uzgodnione zasady post
ępowania będą mogły być przedmiotem dyskusji z
Ministerstwem Zdrowia i Narodowym. Funduszem Zdrowia, tak aby zarówno lekarz, jak i
przede wszystkim sam chory wiedział nie tylko jak b
ędzie diagnozowany i leczony, ale
równie
ż w jakim stopniu koszty tej diagnostyki i leczenia będą refundowane przez System
Ochrony Zdrowia.
Jeszcze raz zach
ęcam do zapoznania się z opracowanymi przez dr hab. Jerzego Przedlackiego
"Zasadami post
ępowania w osteoporozie". Musze uprzedzić czytelników, że nie jest to
monografia, któr
ą czyta się łatwo i szybko. Jestem jednak przekonany, że wszyscy którzy to
opracowanie przeczytaj
ą powoli, być może "na raty" tak jak ja i kilka razy, będą w bardziej
komfortowej sytuacji wtedy, kiedy trafi do nich chory z osteoporoz
ą. Mój Nauczyciel prof.
Edward Ru
żyłło uczył swoich asystentów, że światły i dobry lekarz powinien zawsze w
jednym r
ęku "mieć" chorego, a w drugim trzymać właściwy podręcznik czy monografię.
My
ślę, że lekarz, który "trzyma" w ręku chorego z osteoporozą może z powodzeniem w
drugim mie
ć opracowanie Kolegi Przedlackiego.
Warszawa 28.08.2005
Prof. dr hab. med. Janusz Nauman

4
Informacja o Autorze
Dr hab. med. Jerzy Przedlacki pracuje od 1980 roku w Katedrze i Klinice
Chorób Wewn
ętrznych i Nefrologii Akademii Medycznej w Warszawie,
od 1988 roku jako adiunkt, od 2004 roku jako zast
ępca kierownika
Kliniki i ordynator cz
ęści oddziału wewnętrznego Kliniki. Od 1994 roku
pracuje w Krajowym Centrum Osteoporozy w Warszawie, od 2005 roku
jako dyrektor ds. medycznych. W 1987 roku obronił doktorat nt.
Scyntygraficznej diagnostyki osteodystrofii nerkowej, a w 2004 otrzymał
habilitacj
ę za pracę dotyczącą Leczenia osteodystrofii nerkowej za
pomoc
ą małych dawek alfakalcydolu. Jest autorem 5 rozdziałów w
podr
ęcznikach, nt. osteoporozy, osteodystrofii nerkowej i ostrej
niewydolno
ści nerek. Jest autorem 71 publikacji medycznych, w tym 12 w czasopismach
zagranicznych. Wi
ększa ich część była poświęcona osteodystrofii nerkowej i osteoporozie. Jest
autorem 109 doniesie
ń zjazdowych, w tym 35 na zjazdach zagranicznych. Sześć doniesień
zjazdowych, których był współautorem, otrzymało wyró
żnienia na krajowych zjazdach
po
święconych osteoporozie. Otrzymał trzy nagrody zbiorowe pierwszego stopnia i jedną drugiego
stopnia przyznane przez Rektora Akademii Medycznej w Warszawie za działalno
ść dotyczącą
zaburze
ń metabolizmu kostnego w osteodystrofii nerkowej. Trzykrotnie przebywał na stypendium
naukowym w Klinice Chorób Wewn
ętrznych Szpitala Uniwersyteckiego w Oulu (Finlandia).
Efektem tego pobytu była pierwsza publikacja na temat badania i leczenia zaburze
ń gęstości kości
w przeddializacyjnym okresie przewlekłej niewydolno
ści nerek (Nephron 1995). W 1994 roku
zorganizował Pracowni
ę Densytometrii przy Akademii Medycznej w Warszawie dzięki
przekazaniu aparatu densytometrycznego przez Polsk
ą Fundację na Rzecz Nauki Polskiej na
podstawie opracowanego przez niego wieloo
środkowego projektu badawczego dotyczącego
zaburze
ń mineralizacji kości u dzieci. W 2005 roku, na podstawie opracowanego przez autora
wniosku, Akademia Medyczna w Warszawie uzyskała
środki finansowe z Komitetu Badań
Naukowych na zakup nowego aparatu densytometrycznego.
Uwagi dotycz
ą
ce opracowania mo
ż
na przesyła
ć
na adres:
Dr hab. med. Jerzy Przedlacki
Katedra i Klinika Chorób Wewn
ętrznych i Nefrologii
Akademia Medyczna w Warszawie
Banacha 1a
02-097 Warszawa
lub
Krajowe Centrum Osteoporozy
ul. Syrokomli 32
03-335 Warszawa
lub
jprzedlacki@amwaw.edu.pl

5
Spis tre
ś
ci
A
Wprowadzenie...................................................................................... 6
B
Zasady
post
ę
powania – wst
ę
p..............................................................10
C
Zasady
post
ę
powania – cz
ęść
główna................................................. 11
1. U
kogo wykonywa
ć
badania w kierunku osteoporozy?.........................11
2.
Jakie badania mog
ą
by
ć
wykonywane w kierunku osteoporozy?..........17
2.1. Badanie densytometryczne ko
ś
ci......................................................... 17
2.1.1. Wskazania do badania densytometrycznego............................. 18
2.1.2. Zalecenia dotycz
ą
ce lokalizacji badania densytometrycznego…21
2.2. Badanie radiologiczne ko
ś
ci................................................................. 21
2.3. Badania ultrad
ź
wi
ę
kowe ko
ś
ci............................................................... 21
2.3.1. Interpretacja wyników badania ultrad
ź
wi
ę
kowego…………….... 23
2.4. Markery metabolizmu kostnego............................................................ 23
2.5. Inne badania......................................................................................... 24
2.5.1. Kiedy wykonywa
ć
kontrolne badania biochemiczne?................ 25
3. Jakie
s
ą
wskazania do leczenia osteoporozy?..................................... 25
4. Jak
leczy
ć
osteoporoz
ę
?....................................................................... 29
4.1. Co jest warunkiem skutecznego leczenia?........................................... 29
4.2.
Jakie leki s
ą
stosowane w leczeniu farmakologicznym?..................... 30
4.3.
Jak długo stosowa
ć
leczenie farmakologiczne?.................................. 34
5. Jak
ocenia
ć
wyniki leczenia?................................................................ 35
5.1. Ocena skuteczno
ś
ci leczenia................................................................35
5.2. Jak interpretowa
ć
kontrolne badanie DXA?........................................ 36
5.3. Wybór metody kontrolnego badania DXA............................................. 37
5.4. Kiedy wykona
ć
kontrolne badanie DXA?............................................. 37
5.4.1. Kiedy wykona
ć
pierwsze kontrolne badanie DXA?..................... 39
5.4.2. Kiedy wykona
ć
kolejne kontrolne badanie DXA?........................40
6. Jak
opisywa
ć
wynik badania densytometrycznego?............................ 41
7.
Podsumowanie......................................................................................42
8. Pi
ś
miennictwo....................................................................................... 43
9. Ryciny................................................................................................... 50
6
Wprowadzenie
W niniejszej pracy przedstawiono propozycj
ę zasad kompleksowego postępowania w
osteoporozie. Propozycja dotyczy wszystkich etapów decyzyjnych, od selekcji pacjentów
wymagaj
ących diagnostyki w kierunku osteoporozy, do oceny skuteczności ich leczenia.
Świadomie nie użyto słowa „standardy”, a jedynie „zasady”, rezerwując określenie „standardy”
dla ostatecznej formy, uzgodnionej przez Towarzystwa zainteresowane problemem osteoporozy,
która b
ędzie mogła być przedstawiona do dyskusji Narodowemu Funduszowi Zdrowia, będąc
podstaw
ą do optymalizacji finansowania działań diagnostyczno-leczniczych w tej chorobie.
Konieczno
ść przedstawienia wspólnej dla wszystkich Towarzystw Osteoporotycznych wersji
„standardów” wydaje si
ę oczywista. Brak wytycznych jest odczuwany jako duży problem wśród
lekarzy zajmuj
ących się osteoporozą.
Nie ulega w
ątpliwości, że opracowanie dotyczące zasad postępowania w osteoporozie wymaga
oparcia poszczególnych decyzji na faktach medycznych, a nie jedynie na opiniach nawet
najwi
ększych autorytetów, co podkreślają przedstawiciele Towarzystw Osteoporotycznych. Tak
te
ż postępowano w niniejszym opracowaniu.
Warto jednak przez chwil
ę zastanowić się nad tym, co jest „faktem medycznym”, a co nim nie
jest. Co do niektórych faktów istnieje pełna zgodno
ść. Ten najprostszy to fakt istnienia
osteoporozy, choroby, która stanowi ryzyko złamania ko
ści. Faktem jest przeciwzłamaniowa
skuteczno
ść np. bisfosfonianów i kilku innych grup lekowych. Faktem jest również obecność
niektórych czynników ryzyka złamania ko
ści, jak np. zaawansowany wiek, czy niekorzystny
wpływ glikokortykosteroidów. Jest jednak cały szereg decyzji, które nie s
ą oparte na faktach
medycznych, a na ustaleniach gremiów decyzyjnych, członków mi
ędzynarodowych Towarzystw
Osteoporotycznych. Przykładem wspólnych ustale
ń, jest np. przyjęcie 10-letniego okresu oceny
ryzyka złamania ko
ści, przyjęcie 10-procentowego indywidualnego ryzyka złamania kości
upowa
żniającego do podjęcia leczenia, przyjęcie oceny ryzyka złamania bliższego końca kości
udowej (b.k.k.u.) za podstaw
ę podejmowania decyzji leczniczych. Wymienione trzy przykłady
zostały zaakceptowane. U podstaw tych decyzji legły wzgl
ędy ekonomiczne i wymagały
konsensusu
środowisk lekarskich zajmujących się osteoporozą. Nie jest jednak wcale oczywiste,
że w każdym kraju, o różnych możliwościach finansowych, przedstawione zasady muszą być
optymalne.
Jednym z elementów dotycz
ących decyzji podejmowanych w czasie kontaktu z pacjentem
chorym na osteoporoz
ę, lub zagrożonym chorobą, jest sposób oceny ryzyka złamania kości. W
obecnej pracy wykorzystano metod
ę jakościowej oceny czynników ryzyka złamania kości przy
podejmowaniu decyzji leczniczych, wprowadzaj
ąc do metody tej pewne modyfikacje. Oparto się
na publikacji opracowanej przez Kanadyjskie Towarzystwo Osteoporotyczne i publikowanej w
CMAJ w 2002 roku.
UWAGA:
Ju
ż po napisaniu opracowania ukazała się publikacja Kanadyjskiego Towarzystwa
Osteoporotycznego zmieniaj
ąca postępowanie w osteoporozie (Siminoski K., Leslie W.D.,
Frame H. et al.: Recommendations for bone mineral density reporting in Canada. Can Assoc
Radiol J, 2005, 56, 178-188). Zasadnicza ró
żnica dotyczy wprowadzenia metody oceny 10-
letniego ryzyka złamania ko
ści na podstawie wyniku badania densytometrycznego kości i
jedynie kilku klinicznych czynników ryzyka złamania ko
ści: wieku, płci, obecności przebytego
złamania niskoenergetycznego ko
ści i stosowania glikokortykosteroidów. Na podstawie
uzyskanych danych podzielono chorych na grupy małego,
średniego i dużego ryzyka złamania
ko
ści. W porównaniu do poprzednich wytycznych ograniczono znacznie liczbę klinicznych
czynników ryzyka złamania ko
ści branych pod uwagę przy kwalifikacji chorych do leczenia.
Artykuł nie podaje jednak informacji dotycz
ących wskazań do wykonania badania
densytometrycznego ko
ści. W obecnej metodzie, jeszcze większą niż poprzednio rolę
7
przyznano badaniu densytometrycznemu ko
ści. Autorzy podkreślają konieczność dalszych
bada
ń nad przydatnością wprowadzonej nowej metody postępowania.
Znaj
ąc ostatnie opinie Kanadyjskiego Towarzystwa Osteoporotycznego, autor obecnego
opracowania nadal uwa
ża, że prosta jakościowa metoda oceny ryzyka złamania kości jest
przydatn
ą metodą w ocenie wskazań do badań i leczenia osteoporozy. W związku z tym, w
obecnym opracowaniu została utrzymana jako
ściowa metoda oceny ryzyka złamania kości.
Dyskusji mo
że podlegać jedynie wybór czynników ryzyka złamania kości, co może być
modyfikowane w miar
ę otrzymywania nowych danych klinicznych.
W ci
ągu ostatnich miesięcy pojawiły się informacje przekazywane przez przedstawicieli
polskich Towarzystw Osteoporotycznych o nowym sposobie oceny ryzyka złamania ko
ści przy
kwalifikacji chorych do leczenia. Nie zmieniona pozostała ocena ryzyka złamania ko
ści w
okresie najbli
ższych 10 lat i 10% indywidualnego ryzyka złamania kości, głównie bliższego
ko
ńca kości udowej, w tym szyjki kości udowej na poziomie 10%, kwalifikującym do leczenia
farmakologicznego. Proponuje si
ę natomiast nowy sposób oceny siły działania poszczególnych
czynników ryzyka złamania ko
ści. Poszczególnym czynnikom ryzyka nadano wartość liczbową
(z dokładno
ścią jednego miejsca po przecinku). Nowością jest również ocena łącznego
oddziaływania wspólnie wyst
ępujących czynników ryzyka. Zamiast dodawania poszczególnych
warto
ści liczbowych, tak jak się to czyni w innych stosowanych metodach półilościowych,
proponuje si
ę mnożenie tych wartości. Z dostępnych tabel odczytuje się przypisane konkretnym
warto
ściom ryzyka względnego złamania kości (RW), ryzyko złamania kości w okresie
najbli
ższych 10 lat. Mnożąc tę wartość przez współczynnik odpowiadający wartości Z-score dla
danego pacjenta, otrzymuje si
ę ostateczną wartość ryzyka złamania kości. Dyskusję na temat
nowej metody przeprowadzono oddzielnie w pierwszej cz
ęści opracowania pt. „Porównanie
półilo
ściowej i jakościowej metody oceny czynników ryzyka złamania kości w osteoporozie” i nie
b
ędzie ona powtarzana w obecnej, drugiej części. Zainteresowanych odsyłam do informacji z
pierwszej cz
ęści.
Podsumowuj
ąc jedynie rozważania, autor chciałby powtórzyć, że nie wykazano uzasadnienia dla
proponowanej, skomplikowanej metody wylicze
ń. Jakościowa metoda, prosta w zastosowaniu
pozwala w wi
ększości przypadków podjąć takie same decyzje lecznicze, jak metoda
półilo
ściowa. W sytuacji rozbieżności decyzyjnych, trudno jest jednoznacznie wykazać
przewag
ę którejś z metod. Obecnie przedstawiono jedynie wnioski z poprzedniego opracowania:
WNIOSKI z pierwszej cz
ęś
ci opracowania:
1.
Analiza metody półilo
ściowej oceny czynników ryzyka złamania kości nie wykazała istotnej
przewagi nad metod
ą jakościową w kwalifikacji do leczenia chorych na osteoporozę.
2.
Metoda jako
ściowa jest znacznie prostsza w zastosowaniu niż metoda półilościowa w
kwalifikacji do leczenia chorych na osteoporoz
ę.
3.
W wi
ększości symulowanych sytuacji klinicznych decyzje lecznicze były takie same, w
niektórych tylko przypadkach ró
żniły się. Część tych różnych decyzji jest trudna do
interpretacji i do pełnej obiektywizacji.
4.
Metoda jako
ściowa przez swą prostotę, a jednocześnie porównywalność wyników
uzyskanych przy jej zastosowaniu do proponowanej obecnie metody półilo
ściowej może być
przydatna w codziennej praktyce, przynajmniej do czasu ostatecznych ustale
ń przez
Towarzystwa Osteoporotyczne.

8
5.
Jaki by nie był ostateczny wybór, ka
żda zaaprobowana metoda musi być weryfikowana w
czasie przez
środowisko lekarzy zajmujących się problemem osteoporozy. Po weryfikacji
metoda mo
że być pozostawiona bez zmian, odrzucona i zastąpiona inną lub zmodyfikowana.
6.
Konieczna jest dalsza merytoryczna dyskusja nad metod
ą oceny ryzyka złamania kości i
kwalifikacji do leczenia farmakologicznego chorych na osteoporoz
ę.
W zwi
ązku z przekonaniem autora o wystarczającej skuteczności metody jakościowej, w
obecnym opracowaniu, uwzgl
ędniono metodę jakościową.
Zasady zostały oparte na publikacjach medycznych dotycz
ących tego zagadnienia oraz na
własnym kilkunastoletnim do
świadczeniu z pracy z pacjentami z osteoporozą w Krajowym
Centrum Osteoporozy. Zasady s
ą uzupełnione licznymi komentarzami uzasadniającymi sposób
podejmowania decyzji.
Zasady s
ą
opartym na podstawach naukowych opracowaniem maj
ą
cym za zadanie
pomóc lekarzom w ich codziennej pracy. Dokument, który ma by
ć
realizowany przez
setki, je
ż
eli nie tysi
ą
ce lekarzy, musi mie
ć
prost
ą
form
ę
. Skomplikowane wyliczenia nie
b
ę
d
ą
realizowane.
Do czasu opracowania przez Towarzystwa Osteoporotyczne wspólnej formy zasad post
ępowania
w osteoporozie, która b
ędzie mogła być przedłożona do dalszych uzgodnień z Narodowym
Funduszem Zdrowia (opracowanie standardów) i zacznie obowi
ązywać jako oficjalny dokument
zobowi
ązujący lekarzy do ścisłego przestrzegania poszczególnych zaleceń, prezentowana
obecnie wersja zasad mo
że służyć jako przewodnik postępowania dla wszystkich lekarzy
zajmuj
ących się problemem osteoporozy.
Zasady post
ępowania w osteoporozie dotyczą wszystkich dorosłych osób od 20 r.ż., a nie tylko
kobiet w okresie pomenopauzalnym.
Uwzgl
ędniono w obecnym opracowaniu decyzje diagnostyczno-lecznicze dotyczące kobiet
przed menopauz
ą i mężczyzn, pomimo braku pełnej wiedzy na ten temat, ponieważ pewne
zasady post
ępowania nie różnią się od tych w okresie pomenopauzalnym u kobiet. Chodzi
przede wszystkim o ocen
ę czynników ryzyka złamania kości. Problemem może być
podejmowanie decyzji leczniczych w młodszej grupie wiekowej, poniewa
ż brak jest danych, co
do wi
ększości leków w tym okresie życia. Zdecydowana większość badań naukowych dotyczyła
kobiet w okresie pomenopauzalnym. Osób młodszych dotyczy problem osteoporozy wtórnej,
spowodowanej pewnymi chorobami i przyjmowanymi lekami. O cz
ęści problemów nie mamy
pełnej wiedzy, nie zwalnia nas to jednak od próby przedstawienia propozycji post
ępowania i w
tych przypadkach.
Podaj
ąc dolną granicę wieku grupy, której dotyczy obecne opracowanie, podkreślono różnice w
post
ępowaniu między osobami dorosłymi, a dziećmi i młodzieżą. Powodem podania konkretnej
granicy wiekowej (20 r.
ż.) jest częste korzystanie z oprogramowania densytometrycznego
aparatów firmy Lunar, gdzie oprogramowanie dla dorosłych dotyczy osób wła
śnie powyżej 20
r.
ż. Dla osób młodszych stosuje się program pediatryczny.
UWAGA:
Nale
ż
y postawi
ć
pytanie, czy jest miejsce na własn
ą
propozycj
ę
post
ę
powania w
osteoporozie? Według niektórych osób aktywnych w dziedzinie osteoporozy, w Polsce
nie ma nawet uzasadnienia dla opracowania własnej, polskiej wersji standardów.
Powinno si
ę
skorzysta
ć
z ogólno
ś
wiatowej propozycji. Poniewa
ż
jest jednak tak wiele
rozbie
ż
no
ś
ci mi
ę
dzy opiniotwórczymi
ś
rodowiskami (patrz np. dyskusja mi
ę
dzy
Kanisem i ISCD:
Lewiecki E.M., Miller P.D., LeibE.S. et al.: Response to „The perspectives of
the International Osteoporosis Foundation on the official position of the International Society

9
for Clinical Densitometry” by John A. Kanis et al. Osteoporos Int, 2005, 16, 579-580
) nie
wydaje si
ę
, aby w najbli
ż
szej przyszło
ś
ci powszechny konsensus mógł nast
ą
pi
ć
. W
zwi
ą
zku z tym autor s
ą
dzi,
ż
e sens takiej pracy istnieje. Sytuacja, kiedy nie s
ą
dost
ę
pne
wskazówki pomagaj
ą
ce post
ę
powa
ć
lekarzom w trudnych sytuacjach, a docieraj
ą
ce z
ró
ż
nych stron informacje s
ą
cz
ę
sto z sob
ą
sprzeczne, nie jest wła
ś
ciwa i utrudnia
podejmowanie decyzji diagnostyczno-leczniczych. Bliskie jest autorowi stanowisko
ISCD dotycz
ą
ce roli autorytetów opiniotwórczych w dziedzinie osteoporozy, które
powinny chcie
ć
wzi
ąć
na siebie ci
ęż
ar podejmowania decyzji w sytuacjach, w których
nauka nie zna do ko
ń
ca optymalnego rozwi
ą
zania. A takich sytuacji w osteoporozie jest
wiele.
Autor opracowania ma równie
ż
ś
wiadomo
ść
,
ż
e proponowanie obecnie prostej,
jako
ś
ciowej metody oceny czynników ryzyka złamania ko
ś
ci i wykorzystania ich w
post
ę
powaniu w osteoporozie nie idzie w kierunku proponowanym przez niektóre
autorytety (patrz Kanis) i mo
ż
e by
ć
postrzegane jako nienowoczesne. D
ąż
no
ść
do
precyzyjnego opisywania rzeczywisto
ś
ci za pomoc
ą
wylicze
ń
matematycznych nie musi
jednak przekłada
ć
si
ę
na wymierne korzy
ś
ci. Autor jest przekonany,
ż
e wyniki symulacji
zaprezentowane w cz
ęś
ci pierwszej opracowania potwierdzaj
ą
te w
ą
tpliwo
ś
ci.
Proponowany schemat post
ę
powania autor traktuje jako form
ę
przewodnika dla lekarzy,
gotow
ą
do wykorzystania do czasu podj
ę
cia wspólnej decyzji przez krajowe
Towarzystwa Osteoporotyczne. To od decyzji lekarzy b
ę
dzie zale
ż
ało, czy b
ę
d
ą
chcieli
skorzysta
ć
z opracowania, a przynajmniej z jego cz
ęś
ci.

10
Zasady postępowania
diagnostyczno-leczniczego w osteoporozie
u osób po 20 r.ż.
(propozycja)
Wstęp
1.
Przedstawiona wersja zasad jest propozycj
ą postępowania w osteoporozie, która po poddaniu
pod publiczn
ą dyskusję powinna stać się wkładem do ostatecznej wersji przygotowanej przez
wszystkie działaj
ące w Polsce Towarzystwa Osteoporotyczne.
2.
Przygotowana ostateczna, wspólna wersja zasad, powinna zosta
ć przedstawiona do oceny innym
środowiskom medycznym, których działalność częściowo przynajmniej dotyczy osteoporozy.
3.
Zasady zostały przygotowane na podstawie dost
ępnych danych medycznych i własnego
do
świadczenia autora. Głównym wzorem, na którym oparto przedstawioną propozycję jest
praca: Brown J.P., CMAJ 2002, 167, Suppl. 10, S1-S24.
4.
Ostateczna forma zasad b
ędzie podlegała okresowej weryfikacji opartej na pojawiających się
nowych danych.
5.
W przypadku pojawienia si
ę wytycznych proponowanych przez międzynarodowe Organizacje
Osteoporotyczne (IOF, NOF, ISCD) stanowiska te b
ędą uwzględniane w kolejnych wersjach
opracowa
ń.
6.
Zasady (ich ostateczna forma) powinny sta
ć się podstawą do podejmowania decyzji
diagnostyczno-leczniczych dla lekarzy zajmuj
ących się osteoporozą.
7.
Ostateczna forma zasad powinna sta
ć się podstawą do rozmów z NFZ w celu ustalenia
optymalnego sposobu finansowania badania i leczenia osteoporozy.
8.
Przestrzeganie zasad (ostatecznej formy) post
ępowania będzie podstawą do finansowania usług
medycznych.
9.
Lekarz lecz
ący chorego z osteoporozą będzie miał prawo odstąpić od przyjętych zasad. Będzie
to musiało by
ć jednak uzasadnione w dokumentacji medycznej. Udokumentowane odstąpienie
od zasad post
ępowania będzie podlegało ocenie płatnika (NFZ). W przypadku rozbieżności
mi
ędzy oceną lekarza a płatnika, wątpliwości rozstrzygnie konsultant ds. osteoporozy (obecnie
funkcji takiej nie ma, istnieje konieczno
ść powołania konsultanta krajowego ds. osteoporozy),
lub konsultant dziedziny spokrewnionej z osteoporoz
ą.
10.
Niezale
żnie od wyników rozmów z NFZ, wypracowane wspólnie zasady pozostaną aktualne.
NFZ ma jedynie wpływ na stopie
ń finansowania procedur.
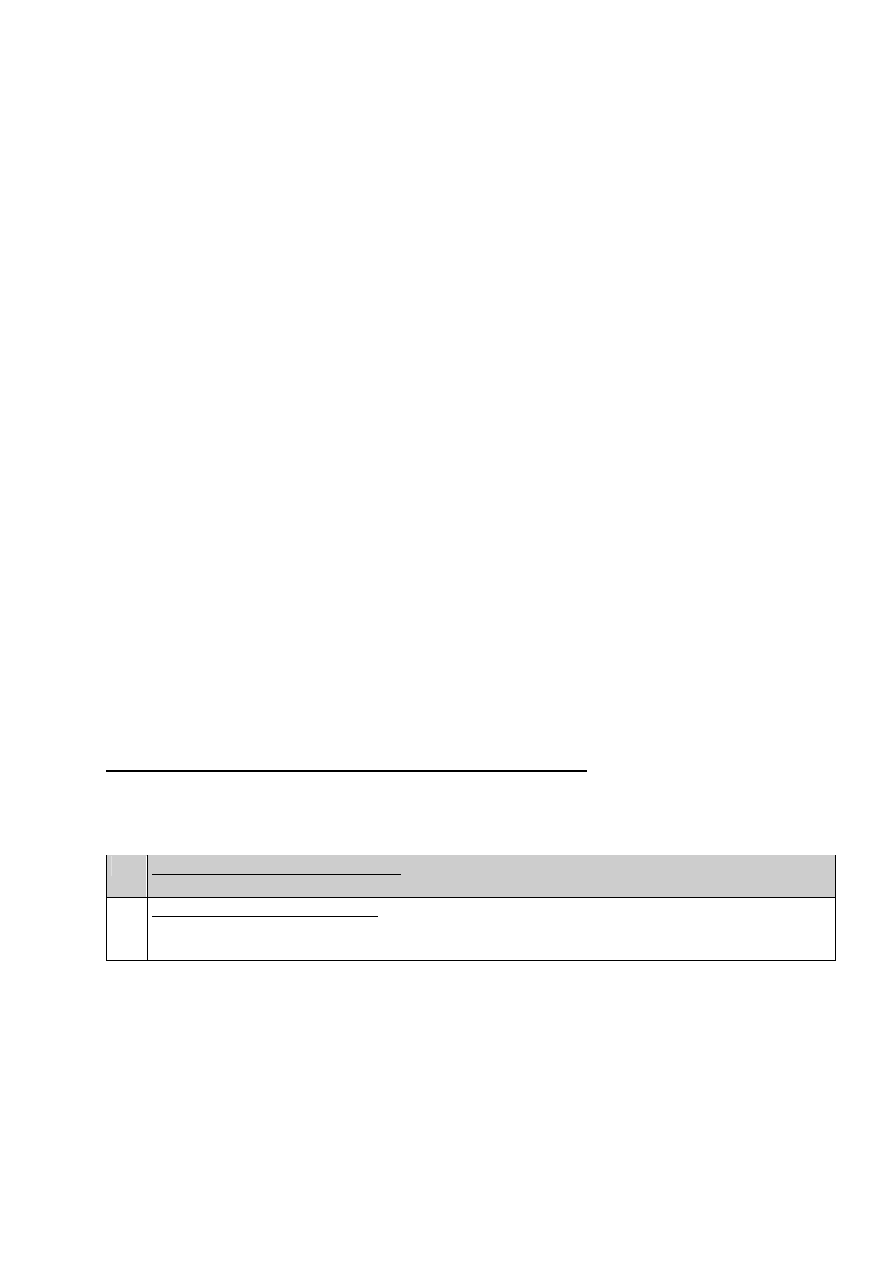
11
Zasady postępowania
diagnostyczno-leczniczego w osteoporozie
u osób po 20 r.ż.
(propozycja)
Część główna
Propozycja post
ępowania w osteoporozie dotyczy również mężczyzn. Brak jest tak szerokiej wiedzy
na temat osteoporozy u m
ężczyzn, jaką mamy na temat kobiet w okresie pomenopauzalnym. Uważa
si
ę, że ryzyko złamania kości oceniane na podstawie badania DXA w zakresie b.k.k.u. czy
kr
ęgosłupa jest takie samo jak u kobiet [1, 2]. Posiadamy też informacje, że niektóre czynniki ryzyka
złamania ko
ści, takie jak przebyte złamanie osteoporotyczne kości, stosowanie
glikokortykosteroidów, czy niska warto
ść wskaźnika masy ciała (BMI), mają podobne znaczenie jak
u kobiet [1]. Alendronian został zarejestrowany do leczenia osteoporozy u m
ężczyzn [3].
Propozycja post
ępowania w osteoporozie dotyczy osób powyżej 20 r.ż.. Podkreślono w ten sposób
ró
żnice w postępowaniu między osobami dorosłymi, a dziećmi i młodzieżą. Powodem podania
konkretnej granicy wiekowej (20 r.
ż.) jest częste korzystanie z oprogramowania
densytometrycznego aparatów firmy Lunar, gdzie oprogramowanie dla dorosłych dotyczy osób od
20 r.
ż.. Dla osób młodszych stosuje się program pediatryczny.
Opracowanie zostało oparte na przedstawionych ni
ż
ej pytaniach:
1. U kogo wykonywa
ć
badania w kierunku osteoporozy?
2. Jakie badania mog
ą
by
ć
wykonywane w kierunku osteoporozy?
3. Jakie s
ą
wskazania do leczenia osteoporozy?
4. Jak leczy
ć
osteoporoz
ę
?
5. Jak ocenia
ć
wyniki leczenia?
1. U kogo wykonywa
ć
badania w kierunku osteoporozy?
Badania w kierunku osteoporozy nale
ż
y wykonywa
ć
u osób zagro
ż
onych
złamaniem ko
ś
ci.
Tab. 1.
A
Bez jawnej klinicznie osteoporozy – celem post
ępowania jest ocena ryzyka złamania kości i
zapobieganie pierwszemu złamaniu
B
Z jawn
ą klinicznie osteoporozą – z przebytym złamaniem kości o charakterze
osteoporotycznym (niskoenergetycznym) - celem post
ępowania jest zapobieganie kolejnym
złamaniom
Komentarz
Leczenie bez bada
ń skriningowych (czy to przy użyciu którejś z metod półilościowych, czy
jako
ściowej) jest z ekonomicznego punktu widzenia nieefektywne [4, 5]. Dla uniknięcia np.
jednego złamania biodra, nale
żałoby leczyć 1285 kobiet [5]. Leczenie jedynie osób z niską
g
ęstością kości obniża koszty uniknięcia 1 złamania biodra o 65%. Ekonomiczna skuteczność
bada
ń skriningowych wzrasta wraz z wiekiem [4].
Podstaw
ą
rozpocz
ę
cia bada
ń
w kierunku osteoporozy i oceny ryzyka złamania ko
ś
ci
jest podejrzenie osteoporozy i zwi
ę
kszonego ryzyka złamania ko
ś
ci na podstawie:
12
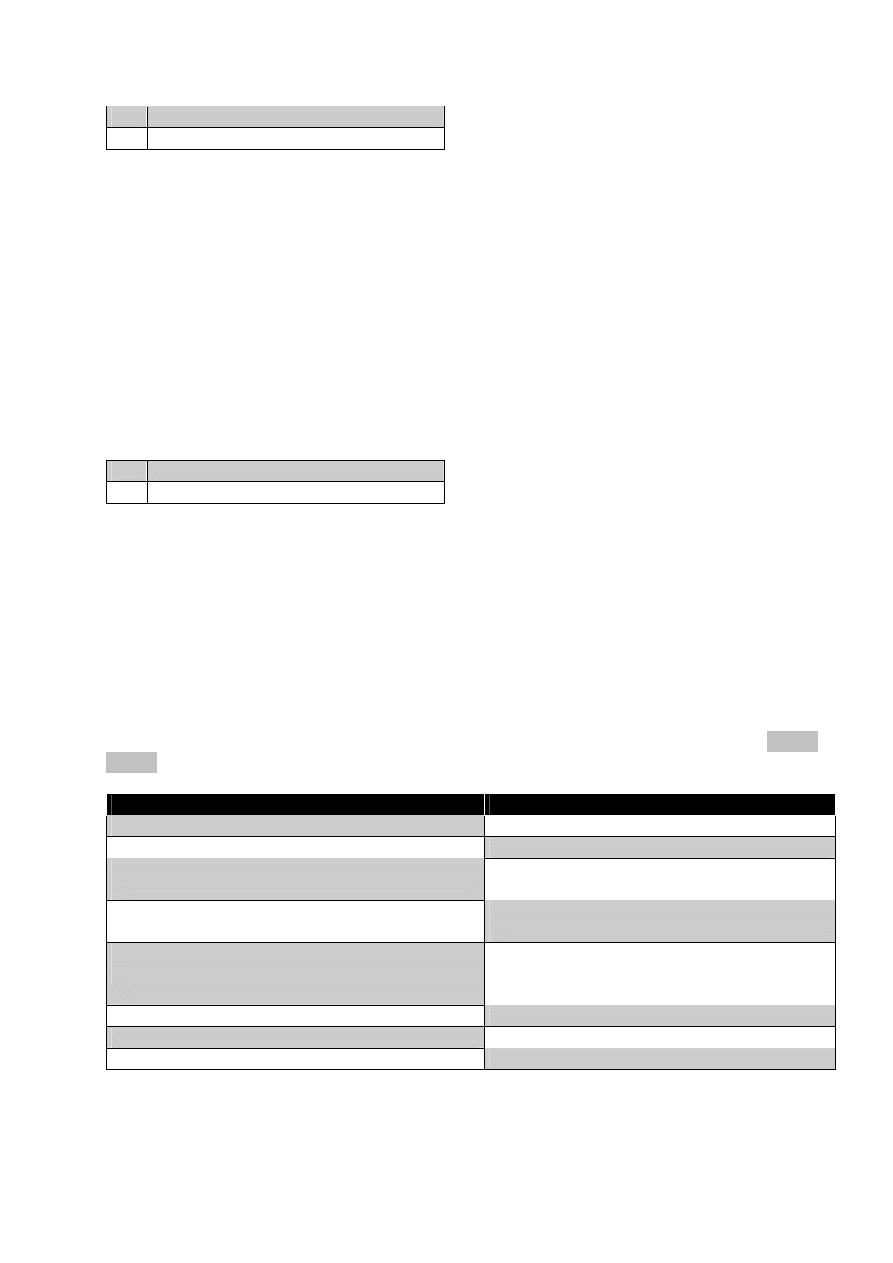
Tab. 2.
A
Badania podmiotowego pacjenta
B
Badania przedmiotowego pacjenta
Komentarz
Nie ma klinicznych, typowych objawów podmiotowych sugeruj
ących rozpoznanie osteoporozy.
Bóle ko
ści, w tym kręgosłupa są najczęściej spowodowane innymi przyczynami, jak np. zmiany
zwyrodnieniowe.
Bóle kr
ęgosłupa w następstwie urazu mogą sugerować złamanie kręgu.
Istotne jest uzyskanie informacji o czynnikach ryzyka osteoporozy i złamania ko
ści (np. choroby,
przyjmowane leki, u
żywki).
Objawy badania przedmiotowego, jak zniekształcenie kr
ęgosłupa, klatki piersiowej, czy
zmniejszenie wzrostu s
ą objawami zaawansowanej chory z przebytymi złamaniami kręgosłupa. Nie
ma wczesnych klinicznych objawów sugeruj
ących rozpoznanie osteoporozy.
Osoby, które wymagaj
ą
zwrócenia uwagi na czynniki ryzyka osteoporozy to:
Tab. 3.
A
Kobiety w okresie pomenopauzalnym
B
M
ężczyźni w wieku >50 r.ż.
Komentarz
Graniczne warto
ści wieku podane jako wskazanie do zwrócenia uwagi na potrzebę
przeprowadzenia bada
ń przesiewowych w kierunku osteoporozy zostały podane za pracą Brown’a
[6]. Chodzi przede wszystkim o kliniczn
ą ocenę stanu zdrowia i pozakliniczne czynniki ryzyka
osteoporozy i złamania ko
ści. Ma to uczulić lekarza i pacjenta na profilaktykę osteoporozy, w tym
eliminacj
ę czynników ryzyka osteoporozy, takich jak np. stosowanie używek. Jest to konieczne
oczywi
ście w każdym wieku. W rozmowach z pacjentem warto posłużyć się również argumentem
zagro
żenia osteoporozą.
Na podstawie badania podmiotowego, przedmiotowego i bada
ń
dodatkowych ustalamy
ryzyko osteoporozy i złamania ko
ś
ci, oceniaj
ą
c czynniki ryzyka, które dzielimy na „du
ż
e” i
„małe”.
Tab. 4.
„Du
ż
e” czynniki ryzyka
„Małe” czynniki ryzyka
Wiek
≥ 65 lat u kobiet
Reumatoidalne zapalenie stawów
Wiek
≥ 70 lat u mężczyzn
Aktualnie rozpoznana nadczynno
ść tarczycy
Przebyte złamanie osteoporotyczne
(niskoenergetyczne)
Przewlekłe leczenie przeciwdrgawkowe, przez
co najmniej pół roku
Złamanie osteoporotyczne b.k.k.u. u rodziców
Przewlekłe stosowanie heparyny, przez co
najmniej pół roku
Leczenie glikokortykosteroidami w dziennej
dawce
≥7,5 mg przez ponad 3 miesiące
Niska poda
ż wapnia w diecie (mniej niż 1
szklanka produktów mlecznych dziennie w
przeszło
ści)
Pierwotna nadczynno
ść przytarczyc
BMI<19
Wczesna menopauza (przed 45 r.
ż.)
Palenie papierosów (
≥20 papierosów dziennie)
Skłonno
ść do upadków
Nadu
żywanie alkoholu
Okre
ślenie „
du
ż
e
” i „
małe
” czynniki ryzyka złamania ko
ści zostało oparte na pracy Brown’a [6].
W tabeli 5. zapo
życzonej częściowo z opracowania Badurskiego [7] przedstawiono porównanie
poszczególnych czynników ryzyka złamania ko
ści wg metody półilościowej i jakościowej. W tabeli

13
prezentowanej w cytowanej pracy uwzgl
ędniono jedynie te czynniki, które są niezależne od wartości
g
ęstości kości.
W metodzie jako
ściowej i dotychczas stosowanych metodach półilościowych, wykorzystuje się
ró
żne czynniki ryzyka złamania kości, niezależnie od ich związku z gęstością kości.
W dost
ępnej literaturze podawanych jest znacznie więcej czynników ryzyka złamania kości.
Wybór zaprezentowany w tabeli 4 jest arbitraln
ą decyzją autora, która uwzględniała m.in.
mo
żliwość oceny poszczególnych czynników w czasie wizyty pacjenta w gabinecie lekarskim, a w
zwi
ązku z tym możliwość ich praktycznego zastosowania.
14
Tab. 5.
Porównanie oc
eny czynników ryzyka
złam
ania ko
ści wg m
etody półilo
ściowej [7] i jako
śc
iowe
j.
Metoda półilo
śc
iowa (punk
towa)
Metoda
jak
oś
ciowa
Kome
ntarz
RW
Mały/Du
ży
1
Przebyte
złam
anie po małym
urazie po
50 r.
ż.
1,7
Du
ży
Bez granicy
wiekowej
W m
etodzie jako
śc
iowej uwzgl
ędniono przebyte złam
anie ko
ści równie
ż
przed 50 r.
ż. Szczególne znaczenie przypisano złam
aniu kr
ęgosłupa i
b.k.k.u.
2
Przebyte
złam
anie b.k.k.u. u rodziców
2,2
Du
ży Istniej
ą roz
b
ie
żne informacje podaj
ące jako cz
ynnik ryzyka złam
anie u
rodziców lub jedynie u matki. Na obecnym
etapie jest to bardziej
fakt
obse
rwacyjny, ni
ż udowodniony w badaniac
h genetycznych
3
Ci
ęż
ar ciała
poni
żej 58 kg
1,8
BMI < 19
Mały
Warto
ść
BM
I mo
że by
ć u
żyta równie
ż u m
ęż
czyzn; przy niskim
ci
ęż
arze
ciała, niskim wzro
ście i prawidłowym
BMI trudno tak
ą sytuacj
ę
zaakceptowa
ć jako czynnik ryzyka
złam
ania ko
ści
4
Aktualne palenie papie
rosów
1,7
Mały
Najcz
ęś
ciej:
≥
20 papie
rosów dz
iennie
5
Niezdolno
ść
do sam
odzielnego wstania
z fotela
2,5
Du
ży
Mo
żna to uzna
ć za prób
ę obiektywnej oceny skłonno
śc
i do upadków
6
Długotrwałe przyjm
owanie
glikokortykoste
roidów
2,3 Du
ży
Powszechnie zaakceptowany okres powy
żej 3 m
iesi
ęcy w dziennej da
wce,
co najm
niej 7,5 m
g
7
Długotrwałe przyjm
owanie leków
przeciwpadaczkowych
2,0
Mały
Brak dokła
dnie powsz
echnie przyj
ętej de
finic
ji „długotrwało
ści”;
propozyc
ja autora - prz
ez co najm
niej ostatnie pół roku z perspe
ktyw
ą
dalszego przyjm
owania
8
Długotrwałe przyjm
owanie leków
sedatywnyc
h i nase
nnych
1,6
Mały
Brak dokładnie powszechnie przyj
ętej definicji „długotrwało
ści”,
propozycja autora - przez co najm
niej
ostatnie pół roku z perspektyw
ą
dalszego przyjm
owania
9
Nadu
żywanie alkoholu
1,7
Mały
Najcz
ęś
cie
j 2 drinki dz
iennie
10 RZS
1,8
Mały
Bez
kom
entarza
11
Przebyta
na
dczynno
ść
tarczycy
1,7
Mały
W wielu pracach badawczych aktualnie trwaj
ąca, jawna klinicznie
12 T
ętno spoc
zynkowe powy
żej 80/m
in
1,7
Nie
uwzgl
ędniono
Za górn
ą war
to
ść
pra
w
idłow
ą przyjm
uje si
ę najcz
ęś
ciej 90/m
in
13
Zły stan z
d
rowia w oce
n
ie wła
snej
pacjenta
1,6
Nie
uwzgl
ędniono
Bardzo subiektywna i z
m
ienna ocena

15
Komentarze do tabeli 5
a)
W metodzie półilo
ściowej [7] nie określono lokalizacji złamania kości. Nie powinno być
w
ątpliwości, co do znaczenia złamania kręgosłupa, czy szyjki kości udowej, ale złamanie palca
r
ęki wątpliwości takie może budzić. Należy jednak przyjąć wszystkie lokalizacje złamania kości
jako istotny czynnik ryzyka kolejnego złamania. Obecno
ść przebytego złamania kręgosłupa i/lub
b.k.k.u., ze wzgl
ędu na swą wagę kliniczną powinno być odmiennie interpretowane przy ustalaniu
wskaza
ń do leczenia, a decyzja o leczeniu farmakologicznym powinna być podjęta niezależnie od
wyniku badania DXA [8].
Dyskusyjna jest granica wieku (50 lat), powy
żej której przebyte złamanie osteoporotyczne kości
odgrywa istotn
ą rolę rokowniczą dla kolejnych złamań. Ponieważ proponowane przez autora
zasady dotycz
ą wszystkich osób po 20 r.ż., a nie tylko okresu pomenopauzalnego, nie została
podana granica wiekowa. Złamanie ko
ści przed 50 r.ż. zostało również uznane za czynnik ryzyka
kolejnego złamania [9]. Chorzy ze złamaniem osteoporotycznym przed 50 r.
ż/przed menopauzą
b
ędą wymagać diagnostyki w kierunku osteoporozy wtórnej.
W
ątpliwość budzi stosunkowo niska wartość RW dla przebytego złamania po małym urazie,
równa warto
ści aktualnego palenia papierosów, czy częstości serca powyżej 80/min.
b)
Problemem mo
że być nie zawsze jednoznaczna ocena charakteru złamania kości – i nazwanie
go złamaniem niskoenergetycznym. Cz
ęsto ocena lekarza jest subiektywna.
Najcz
ęściej funkcjonują dwa określenia złamania osteoporotycznego:
a) jako złamanie jednopoziomowe lub
b) jako złamania po urazie, który w powszechnym odczuciu nie powinien spowodowa
ć złamania.
Oba okre
ślenia nie są bardzo precyzyjne.
W przypadku w
ątpliwości, bezpieczniej jest uznać złamanie za osteoporotyczne i przeprowadzić
badania w kierunku osteoporozy.
c)
W dost
ępnej literaturze medycznej wymieniane czynniki ryzyka złamania kości, dotyczące
chorób i przyjmowanych leków s
ą określane często mało precyzyjnie. W obecnej pracy
zaproponowano uznanie za czynnik ryzyka złamania ko
ści aktualną obecność chorób, przez co
najmniej pół roku. Równie
ż leki będące czynnikiem ryzyka złamania przyjmowane, przez co
najmniej ostatnie pół roku, zostały uznane za istotnie zwi
ększające ryzyko złamania kości. Takie
post
ępowanie jest proponowane w wielu wieloośrodkowych programach badawczych dotyczących
oceny skuteczno
ści leków w osteoporozie.
W tabeli 6. przedstawiono wymieniane przez ró
żnych autorów czynniki ryzyka złamania kości.
16
Tab. 6. Proponowane czynniki ryzyka osteoporozy i złamania ko
ści.
[6]
[7]
[10] [11] [12] [13] [14] [15] [16]
Płe
ć żeńska
X
X
Wiek
X X X X X X
Biała
rasa
X
X
X
Szybka
przemiana
kostna
X
X
Przedwczesna
menopauza
X X
X
Pierwotne lub wtórne zaburzenia
miesi
ączkowania
X
X
Pierwotny lub wtórny
hipogonadyzm u m
ężczyzn
X X
X
Przebyte złamanie
niskoenergetyczne ko
ści
X X X X X X
Przebyte złamanie b.k.k.u.
u rodziców
X X
Przebyte złamanie osteoporotyczne
ko
ści w rodzinie
X
Złamanie ko
ści
u
matki
X X
Skłonno
ść
do
upadków
X
Zaburzenia
widzenia
X X
X
Zaburzenia nerwowo-mi
ęśniowe X X
X
Niesprawno
ść kończyn
dolnych X
Niezdolno
ść do samodzielnego
wstania z fotela
X
Niski ci
ężar
ciała
X X X X X X X
Niski
BMI
X X
Utrata ci
ężaru ciała o ponad 10% od
25 r.
ż.
X
Zespół niedo
żywienia
X X
Zły ogólny stan zdrowia w ocenie
własnej pacjenta
X
T
ętno spoczynkowe powyżej
80/min
X
Długotrwałe
unieruchomienie
X
X
Leczenie
sterydami
X X X X X
Długotrwałe przyjmowanie leków
przeciwpadaczkowych
X
X
Przewlekłe leczenie heparyn
ą
X
Długotrwałe przyjmowanie leków
sedatywnych i nasennych
X
Nieprzyjmowanie estrogenów w
okresie pomenopauzalnym
X X
X
Pierwotna nadczynno
ść przytarczyc
X X
RZS
X X X X X
Przebyta nadczynno
ść
tarczycy
X
Palenie
papierosów
X X X X X X
Nadu
żywanie
alkoholu
X X X X X X
Nadmierne spo
życie
kawy
X
Niedobór witaminy D
X
X
X
Niskie spo
życie wapnia w diecie
X
X
X

17
Poza podanymi w tabeli, wymieniane s
ą następujące inne czynniki ryzyka: choroby zapalne jelit
[17], choroba trzewna [18], mało aktywny tryb
życia [19], cukrzyca typu 2 [20], czynnik
genetyczny [21].
Kawa jest cz
ęsto wymieniana wśród czynników ryzyka osteoporozy. Według niektórych istnieje
zwi
ązek pomiędzy piciem kawy a zwiększonym ryzykiem złamania kości [22]. Według innym
takiego zwi
ązku jednak nie ma [23].
Szereg leków wymienianych jest jako czynniki zwi
ę
kszaj
ą
ce ryzyko osteoporozy.
Najcz
ęściej wśród leków o niekorzystnym wpływie na metabolizm kości wymieniane są:
glikokortykosteroidy [24, 25], heparyna [26, 27], leki przeciwpadaczkowe (fenobarbital, fenytoina,
karbamazepina) [28]. Obni
żenie gęstości kości obserwuje się również po heparynie
niskocz
ąsteczkowej [29, 30]
Spo
śród innych leków wymienia się: warfarynę [31], cyklosporynę [32], medroksyprogesteron
[33], chemioterapeutyki [34].
Tiazydy zmniejszaj
ą utratę masy kostnej [35].
2. Jakie badania mog
ą
by
ć
wykonywane w kierunku osteoporozy?
Tab. 7.
1
Badanie densytometryczne ko
ści
2
Badanie radiologiczne ko
ści
3
Badania ultrad
źwiękowe kości
4
Markery metabolizmu kostnego
5
Inne badania
2.1. Badanie densytometryczne ko
ś
ci
Podstawowym badaniem w kierunku osteoporozy i zwi
ę
kszonego ryzyka złamania ko
ś
ci
jest badanie densytometryczne ko
ś
ci wykonane metod
ą
tzw. „osiow
ą
” w zakresie b.k.k.u.
i/lub kr
ę
gosłupa l
ę
d
ź
wiowego.
Komentarz dotycz
ą
cy znaczenia wyboru lokalizacji badania densytometrycznego
ko
ś
ci
Toczy si
ę dyskusja na temat definicji osteoporozy. Czy podstawą do rozpoznania choroby może być
jedynie wynik badania g
ęstości kości w zakresie b.k.k.u. (T-score ≤-2,5), czy też w zakresie
kr
ęgosłupa lędźwiowego (również T-score ≤-2,5). Według stanowiska WHO, podstawą definicji
osteoporozy, jest wynik badania densytometrycznego b.k.k.u.. Podobne jest stanowisko Narodowego
Instytutu Zdrowia (NIH) i Narodowej Fundacji Osteoporozy (NOF) Stanów Zjednoczonych.
Obni
żony wynik badania gęstości kości w zakresie kręgosłupa lędźwiowego, nawet przy wartości T-
score
≤-2,5 może świadczyć jedynie o zwiększonym ryzyku złamania kości. Akceptuje się również
badanie ko
ści przedramienia w ocenie zwiększonego ryzyka złamania kości.
Analizuj
ąc powyższe stanowiska, nie wydaje się jednak przekonywujące stanowisko pozwalające
rozpozna
ć osteoporozę jako chorobę na podstawie jedynie badania b.k.k.u. i jednoczesne
dopuszczenie do decyzji leczniczych na podstawie badania kr
ęgosłupa lędźwiowego, a nawet kości
przedramienia.
Dopuszczenie obu osiowych bada
ń densytometrycznych (a nawet badania przedramienia) do
diagnostyki ryzyka złamania ko
ści, a skoro do diagnostyki ryzyka złamań kości, to i do
podejmowania na podstawie tych bada
ń decyzji leczniczych, czyni dyskusję na temat definicji
osteoporozy nieco akademick
ą.
Celem obecnego opracowania nie jest jednak dyskusja nad definicj
ą osteoporozy.

18
Preferowanym badaniem w zakresie ko
ś
ci udowej jest badanie szyjki ko
ś
ci udowej
,
poniewa
ż nie we wszystkich aparatach densytometrycznych wykorzystywanych w naszym kraju,
istnieje mo
żliwość badania b.k.k.u..
Preferowan
ą
analiz
ą
badania densytometrycznego w zakresie kr
ę
gosłupa l
ę
d
ź
wiowego jest
analiza kr
ę
gów L
1
-L
4
, chocia
ż wg własnych obserwacji, najczęściej wykonywane jest wciąż
badanie w zakresie kr
ęgów L
2
-L
4
. W pierwszych latach diagnostyki densytometrycznej było to
jedyne zalecane badanie, a definicja densytometryczna osteoporozy dotyczyła wła
śnie tych kręgów.
Obecnie, w wi
ększości badań naukowych oceniających skuteczność leków w leczeniu osteoporozy,
preferowana jest analiza kr
ęgów L
1
-L
4
. Analiz
ę kręgów L
2
-L
4
trudno jednak uzna
ć za błędną.
Nale
ży mieć jedynie świadomość nieco innych wyników badania DXA wyrażonych wartością T-
score analizowanych w ró
żnych fragmentach kręgosłupa.
2.1.1. Wskazaniem do badania densytometrycznego ko
ś
ci s
ą
:
Tab. 8.
A
Obecno
ść, co najmniej jednego „dużego” czynnika ryzyka złamania kości
B
Obecno
ść, co najmniej 2 „małych” czynników ryzyka złamania kości
C
Osteopenia w badaniu Rtg jakiegokolwiek fragmentu szkieletu stwierdzona w czasie badania
wykonanego z jakiegokolwiek powodu
D
Wynik badania ultrad
źwiękowego wyrażony wartością T-score ≤ -2,5 uzyskanego w czasie
badanie przesiewowego
Komentarz dotycz
ą
cy wskaza
ń
do wykonywania bada
ń
densytometrycznych ko
ś
ci
Badanie densytometryczne ko
ści jest podstawowym badaniem w kierunku osteoporozy i oceny
ryzyka złamania ko
ści wg dotychczasowych metod postępowania.
W metodzie półilo
ściowej [7] rola konkretnego wyniku badania DXA jest inna. Podstawowy
nacisk oceny ryzyka złamania ko
ści kładzie się na ocenę klinicznych czynników ryzyka,
wyra
żonych tzw. ryzykiem względnym (RW). Ryzyko to jest inne dla każdego wieku. Przy braku
klinicznych czynników ryzyka, mówi si
ę o tzw. ryzyku populacyjnym. W ryzyku populacyjnym
„ukryta” jest warto
ść T-score wyniku DXA, stąd, co najmniej m.in. im starszy wiek, tym większe
ryzyko złamania ko
ści. Metoda półilościowa wykorzystuje za to wartość Z-score, czego nie ma w
dotychczas stosowanych metodach diagnostycznych.
Strategia proponowana przez Kanisa [13] jest nast
ępująca.
1. Punktem wyj
ścia do wszelkich rozważań jest ocena klinicznych czynników ryzyka złamania
ko
ści dla danej osoby. W przypadku łącznego ryzyka złamania kości przekraczającego próg
uzasadniaj
ący leczenie wynik badania DXA nie wpłynie na naszą decyzję leczniczą i badanie nie
musi by
ć wykonywane. Badanie może być wykonane jedynie dla późniejszej oceny skuteczności
leczenia.
2. U osób z granicznym ryzykiem złamania, wynik badania DXA mo
że istotnie wpłynąć na
decyzje lecznicze i u tych osób s
ą wskazania do badania densytometrycznego.
3. U osób z bardzo niskim ł
ącznym ryzykiem złamania, u których z dużym prawdopodobieństwem
wynik badania DXA nie zmieni decyzji leczniczej i dana osoba nie b
ędzie leczona, nie ma
wskaza
ń do badania DXA.
Podsumowuj
ąc, Kanis sugeruje, że mniejszość pacjentów będzie wymagała badania DXA przy
podejmowaniu decyzji leczniczych [36].
Wykazano,
że pacjenci kwalifikowani do leczenia na podstawie przebytego złamania kości o
charakterze osteoporotycznym, odpowiadali na leczenia za pomoc
ą bisfosfonianów [37]. Pacjenci
ci maj
ą, bowiem najczęściej niską gęstość kości.
Je
żeli jednak badanie DXA ma służyć ocenie skuteczności leczenia, to na początku leczenia
powinno by
ć wykonane u wszystkich chorych.
19
Proponowane s
ą też inne strategie postępowania przy kwalifikacji do badania densytometrycznego
w kierunku osteoporozy.
1.
International Society for Clinical Densitometry (ISCD): kobiety w wieku
≥65, a u młodszych
kobiet w okresie pomenopauzalnym z obecnymi czynnikami ryzyka złamania ko
ści [38].
Dopuszcza si
ę badanie b.k.k.u. i kręgosłupa lędźwiowego.
2.
National Osteoporosis Foundation (NOF): kobiety w wieku
≥65 lat, a u młodszych z obecnym
przynajmniej jednym czynnikiem ryzyka złamania ko
ści [39]. Zaleca się badanie b.k.k.u..
3.
United States Preventive Services Task Force (USPSTF): kobiety w wieku
≥65 lat niezależnie
od obecno
ści czynników ryzyka złamania kości [40]. Badanie skriningowe należy wykonywać
u kobiet w wieku od 60 r.
ż. z obecnym przynajmniej jednym czynnikiem ryzyka złamania
ko
ści.
4.
The American Academy of Family Physicians: kobiety w wieku 40-64 lat, które maj
ą czynniki
ryzyka osteoporozy [41].
5.
Kanadyjskie Towarzystwo Osteoporozy: kobiety w wieku
≥65 lat, obecność, co najmniej
jednego „du
żego” lub dwóch „małych” czynników ryzyka złamania kości [6].
Komentarz dotycz
ą
cy dost
ę
pno
ś
ci densytometrycznych bada
ń
diagnostycznych
Zakres wykonywanych bada
ń densytometrycznych zależy m.in. od dostępności badania. Liczba
densytometrów potrzebnych w diagnostyce osteoporozy w danym kraju zale
ży od zaplanowanej
strategii post
ępowania. Odwrotnie, strategia postępowania zależy jednocześnie od możliwości
diagnostycznych. Przy zało
żeniu prowadzenia badań skriningowych w populacji kobiet w wieku 65
i wi
ęcej lat, w ciągu 10 lat potrzeba 11,2 aparatów na 1 milion mieszkańców [42].
U kobiet w wieku 65 lat i starszych ok. 35% z nich byłoby zakwalifikowanych do leczenia i
wymagałoby kontrolnego badania DXA po 2 latach. Wymaga to dodatkowych ok. 5
densytometrów na 1 milion mieszka
ńców.
Inna strategia zakłada wykonywanie bada
ń jedynie u osób obarczonych obecnością dodatkowych
czynników ryzyka złamania ko
ści.
Przyjmuj
ąc sugerowaną przez Grupę ds. Osteoporozy przy Parlamencie Unii Europejskiej z 10
listopada 2004 liczb
ę aparatów densytometrycznych w przeliczeniu na liczbę mieszkańców jako 10
aparatów na 1 milion mieszka
ńców (dane z 2003 roku mówią o ok. 4 aparatach/1 milion
mieszka
ńców w Polsce), powinniśmy posiadać (wg danych GUS liczba mieszkańców wynosiła
30.06.2004 – 38 180 249 mieszka
ńców):
ok. 380 aparatów densytometrycznych (do bada
ń
„osiowych”)
Nie znaj
ąc pełnej liczby aparatów densytometrycznych w Polsce, należy pamiętać, że nie wszystkie
aparaty s
ą ogólnie dostępne. Przed przystąpieniem do dokładnego określenia strategii postępowania
w Polsce, nale
ży najpierw ustalić dokładny stan posiadania.
Tab. 9. Liczba potencjalnych kandydatów do badania densytometrycznego ko
ści.
Wiek
Liczba kobiet
Liczba m
ęż
czyzn
Ogółem
65-69
896 185
X
896 185
70-74
848 239
567 673
1 415 912
75-79
688 698
372 827
1 061 525
80-84
423 801
189 761
613 562
≥85
239 730
84 038
323 768
Razem
3 096 653
1 214 299
4 310 952
Rocznie przybywa w Polsce (wg danych GUS) ok.80 000 – 100 000 osób w wieku
≥ 65 lat.
Czy sta
ć nas na przebadanie wszystkich kobiet po 65 rż. i mężczyzn po 70 r.ż. w ramach
potencjalnej umowy podpisanej z NFZ, czyli na bezpłatne badania skriningowe?

20
Najprawdopodobniej nie. W jakim zakresie NFZ mo
że finansować badania skriningowe, zależy od
przeznaczonej sumy pieni
ędzy na te badania. Znając możliwości finansowania, Towarzystwa
Osteoporotyczne musz
ą ustalić kryteria kwalifikacji do bezpłatnych badań. Jednocześnie, znając
trudno
ści finansowe państwa, Towarzystwa Osteoporotyczne powinny ustalić minimum
koniecznego finansowania bada
ń w osteoporozie, zapewniając je bezpłatnie dla osób z
najwi
ększym ryzykiem złamania kości. Nie zmienia to postaci rzeczy, że z czysto medycznego
punktu widzenia, badania skriningowe u kobiet w wieku
≥ 65 lat i u mężczyzn w wieku ≥ 70 lat
byłyby wskazane.
Nie wspomniano w wyliczeniach o m
ężczyznach, co w jeszcze większym stopniu zwiększa
zapotrzebowanie na aparaty densytometryczne.
Sta
ć nas najprawdopodobniej na strategię dotyczącą diagnostyki, uwzględniającą poza wiekiem i
odpowiednim wynikiem badania DXA, obecno
ść dodatkowych czynników ryzyka złamania kości.
Liczby te pokazuj
ą, jak trudnym problemem jest diagnostyka i leczenie osteoporozy w Polsce, w
sytuacji, gdy w niektórych województwach (Warmi
ńsko-Mazurskie, Podkarpackie i Opolskie, wg
danych NFZ) nie ma
żadnej Poradni Osteoporotycznej, która leczyłaby osteoporozę w ramach
umowy z NFZ.
Zmniejszenie kosztów bada
ń skriningowych można uzyskać pamiętając, że:
Wskazaniem do badania densytometrycznego ko
ś
ci nie s
ą
:
a) menopauza
b) bóle ko
ści i stawów
Ad. b) Z obserwacji własnych wida
ć, że bóle kości i stawów niezależnie od wieku, bywają powodem
kierowania pacjentów na badanie DXA. Bardziej uzasadnionym badaniem w tych przypadkach jest
badanie Rtg wybranego fragmentu szkieletu. Badanie DXA mo
że być wykonane, ale nie jako
pierwsze badanie rozpoczynaj
ące diagnostykę bólów kości.
Do jakiego wieku wykonywa
ć
badania densytometryczne ko
ś
ci?
Nie ma dokładnych informacji w literaturze odpowiadaj
ących na postawione pytanie. Badania
warto wykonywa
ć tak długo, jak długo wynik tego badania będzie nam przydatny dla
podejmowania decyzji leczniczych. Planuj
ąc np. zlecenie bisfosfonianów i spodziewając się efektu
przeciwzłamaniowego w drugim roku leczenia, powinni
śmy przewidzieć przyjmowanie leku, przez
co najmniej 2 lata. Wskazówk
ą mogą być międzynarodowe, wieloośrodkowe programy badawcze
oceniaj
ące skuteczność leków w leczeniu osteoporozy, w których górną granicą wiekową
kwalifikuj
ącą do wzięcia udziału w badaniach jest najczęściej wiek 80-85 lat.
Na badanie densytometryczne ko
ś
ci powinien kierowa
ć
lekarz.
Cz
ęsto inicjatorem wykonania badań densytometrycznych (mowa o badaniach odpłatnych) jest sam
pacjent. Aktywno
ść pacjenta jest nie do przecenienia, jednak to lekarz powinien zdecydować o
konieczno
ści przeprowadzenia badania (nawet odpłatnego), jak i o jego metodzie. Wykonywane z
inicjatywy pacjenta badania stanowi
ą czasami problem interpretacyjny i wpływają na niesłuszne
decyzje lecznicze. Obserwuje si
ę np., że nieprawidłowy wynik DXA, bez żadnych czynników
ryzyka złamania ko
ści u osoby 50-kilkuletniej bywa „wskazaniem”
do podania bisfosfonianów.
Bior
ąc pod uwagę małą wytrwałość w przyjmowaniu leków, zwłaszcza przez osoby bez jawnych
objawów choroby, decyzj
ę tę trudno uznać za właściwą.

21
2.1.2. Zalecenia dotycz
ą
ce lokalizacji badania densytometrycznego ko
ś
ci
Tab. 10.
A
U kobiet i m
ężczyzn w wieku ≥65 lat badanie w zakresie b.k.k.u.
B
U kobiet i m
ężczyzn w wieku < 65 lat badanie kręgosłupa lędźwiowego w zakresie kręgów
L
1
-L
4
w projekcji AP lub b.k.k.u. – badania uznane s
ą za równoważne.
Uwaga: U osób, u których przewidywane I badanie kontrolne b
ędzie wykonywane w wieku
≥65 lat dla kobiet i ≥70 lat dla mężczyzn wskazane jest wykonanie badania b.k.k.u.
C
W przypadku znanych lekarzowi ogranicze
ń do wykonania badania DXA kręgosłupa
l
ędźwiowego (nasilone zmiany zwyrodnieniowe, niemożność oceny, co najmniej 2 kręgów
kr
ęgosłupa, duże zwapnienia naczyń, głównie aorty, rzutujące się na kręgosłup w czasie
badania, du
że deformacje kręgosłupa) należy wykonać badanie b.k.k.u. niezależnie od
wieku.
D
W przypadku niemo
żności, z jakiegokolwiek powodu, wykonania badania w zakresie
kr
ęgosłupa lędźwiowego i b.k.k.u. (np. w znacznej otyłości), należy wykonać badanie
densytometryczne w zakresie ko
ści przedramienia
E
Badanie b.k.k.u. i przedramienia nale
ży wykonywać po stronie nie dominującej
F
O ostatecznym wyborze lokalizacji badania densytometrycznego decyduje lekarz
Komentarz dotycz
ą
cy wyboru lokalizacji badania densytometrycznego ko
ś
ci
Istniej
ą rozbieżności opinii, co do optymalnej lokalizacji szkieletowej badania DXA. Większość
autorów zaleca wykonywanie bada
ń w zakresie kręgosłupa lędźwiowego i/lub w zakresie b.k.k.u.
Wieloo
środkowe badania oceniając skuteczność bisfosfonianów, leków z grupy SERM i
kalcytoniny oceniały ich skuteczno
ść na podstawie badania kręgosłupa lędźwiowego i b.k.k.u. Wg
niektórych doniesie
ń [43, 44] densytometryczne badania obwodowe (kości przedramienia)
przewiduj
ą ryzyko złamania kości podobnie jak badania centralne (kręgosłup lędźwiowy, b.k.k.u.).
Inne doniesienia sugeruj
ą, że ryzyko złamania najlepiej ocenia badanie DXA wykonane w tym
miejscu, którego ma dotyczy
ć złamanie [45, 46].
Badania obwodowe nie s
ą przydatne w monitorowaniu leczenia [47].
Niektórzy autorzy zalecaj
ą jednoczesne wykonywanie badania kręgosłupa lędźwiowego i b.k.k.u.,
a podstaw
ą dla podejmowania decyzji leczniczych byłby niższy wynik gęstości wyrażony w T-
score. W około 15% przypadków warto
ść BMD może być bowiem inna w różnych miejscach
szkieletu [48, 49]. Z ekonomicznego punktu widzenia badanie w dwóch projekcjach nie zawsze
jest jednak mo
żliwe.
Według m. in. NOF preferowanym miejscem badanie, niezale
żnie od wieku jest badanie b.k.k.u.
[45, 50].
2.2. Badanie radiologiczne ko
ś
ci
Wskazaniem do badania Rtg ko
ś
ci w osteoporozie jest:
Tab. 11.
A
Podejrzenie złamania ko
ści
B
Bóle ko
ści o niejasnej przyczynie
2.3. Badania ultrad
ź
wi
ę
kowe ko
ś
ci
Badania ultrad
ź
wi
ę
kowe nie mog
ą
by
ć
uznane za badanie b
ę
d
ą
ce podstaw
ą
podejmowania decyzji leczniczych w osteoporozie.
Komentarz dotycz
ą
cy przydatno
ś
ci badania ultrad
ź
wi
ę
kowego w diagnostyce
osteoporozy i ryzyka złamania ko
ś
ci
Badanie ultrad
źwiękowe nie mierzy zawartości minerału kostnego lub gęstości kości
bezpo
średnio.
Wykazano,
że badanie to przewiduje ryzyko złamań kości w zakresie biodra u kobiet w okresie
pomenopauzalnym [51] i w okresie przed- i pomenopauzalnym [52], a tak
że w zakresie kręgosłupa
22
u kobiet w okresie przed i pomenopauzalnym [53]. W innych pracach stwierdzono,
że badanie
ultrad
źwiękowe jest, co najmniej tak dobrym badaniem jak ocena klinicznych czynników ryzyka
złamania ko
ści w przewidywaniu ryzyka osteoporozy [54, 55]. Ograniczeniem w stosowaniu tej
metody jest brak akceptacji w rozpoznawaniu osteoporozy na podstawie badania
ultrad
źwiękowego [56, 57]. Nie są ustalone jednak również rekomendacje dotyczące wskazań do
leczenia na podstawie badania ultrad
źwiękowego.
Ze wzgl
ędu na niską precyzję badania i powolne zmiany metabolizmu kostnego w badanych
miejscach, badanie to nie jest bardzo przydatne w ocenie dynamiki zmian g
ęstości kości, w tym
ocenie skuteczno
ści leczenia.
Istotne byłoby oceni
ć przydatność badania ultradźwiękowego jako badania skriningowego w
rozpoznawaniu osteoporozy i ryzyka złamania ko
ści. W jednej z publikacji nie wykazano
ekonomicznej efektywno
ści wykorzystania badania ultradźwiękowego w ustalaniu wskazań do
badania DXA [58].
Badanie USG nie zostało zaliczone do standardów post
ępowania w osteoporozie.
W zwi
ą
zku z powy
ż
szym, najpro
ś
ciej byłoby stwierdzi
ć
,
ż
e nie ma w ogóle miejsca dla
badania ultrad
ź
wi
ę
kowego w diagnostyce osteoporozy.
Pomimo braku akceptacji badania ultrad
ź
wi
ę
kowego jako podstawy decyzji
terapeutycznych, trudno pomin
ąć
jednak fakt obecno
ś
ci tej metody,
jej du
żej mobilności, ze
wzgl
ędu na małe rozmiary sprzętu. W sytuacji bardzo ograniczonego dostępu w wielu rejonach
Polski do bada
ń densytometrycznych, tzw. „osiowych”, dotarcie z badaniem ultradźwiękowym do
najdalszych zak
ątków kraju czyni badanie to atrakcyjnym. Dlatego też, brak efektywności
ekonomicznej badania ultrad
źwiękowego w jednych krajach, nie musi odpowiadać naszej sytuacji.
Konieczna jest jedynie
świadomość pewnych ograniczeń jej przydatności i właściwa interpretacja
wyników.
Dlatego te
ż, należałoby dopuścić wykorzystanie badania ultradźwiękowego, ale tylko w
przesiewowej diagnostyce osteoporozy. Jakie byłoby finansowanie tej metody przez NFZ, byłoby
okre
ślone w czasie rozmów z Towarzystwami Osteoporotycznymi.
Badania ultrad
źwiękowe mogą być wykonane w ramach badań przesiewowych u osób bez
żadnego „dużego” czynnika ryzyka złamania kości, u których występują, co najmniej 2 „małe”
czynniki ryzyka złamania ko
ści.
U osób z obecno
ścią co najmniej 1 „dużego” czynnika ryzyka złamania kości, nie należy
wykonywa
ć badania ultradźwiękowego, ponieważ ostateczna decyzja terapeutyczna wymaga, i tak,
niezale
żnie od wyniku, wykonania badania DXA.
Z punktu widzenia metody jako
ściowej oceny czynników ryzyka złamania kości, badanie
ultrad
źwiękowe byłoby uzasadnione jedynie u kobiet przed 65 r.ż. i u mężczyzn przed 70 r.ż.. Wiek
≥65 lat u kobiet i ≥70 lat u mężczyzn jest „dużym” czynnikiem ryzyka złamania kości.

23
2.3.1. Interpretacja wyników badania ultrad
ź
wi
ę
kowego ko
ś
ci
Tab. 12.
A
Wynik prawidłowy badania ultrad
źwiękowego u kobiet i mężczyzn (T-score ≥-1,0), przy
nieobecno
ści „dużych” czynników ryzyka złamania kości może być uznany za ostateczny i
nie wymaga weryfikacji badaniem DXA
B
Wynik badania ultrad
źwiękowego mieszczący się w granicach wartości T-score od <–1 do >-
2,5, przy nieobecno
ści „dużych” czynników ryzyka złamania kości nie wymaga weryfikacji
badaniem DXA osiowym u kobiet i m
ężczyzn.
C
Wynik badania ultrad
źwiękowego mieszczący się w granicach wartości T-score od <–1 do
>-2,5 przy obecno
ści co najmniej 1 „dużego” czynnika ryzyka złamania kości wymaga
weryfikacji osiowym badaniem DXA u kobiet i m
ężczyzn niezależnie od wieku
D
Wynik badania ultrad
źwiękowego wyrażony wartością T-score ≤-2,5 wymaga weryfikacji
badaniem densytometrycznym metod
ą tzw. osiową, wg zaleceń zawartych w tabeli 10,
niezale
żnie od obecności lub nieobecności „dużych” czynników ryzyka złamania kości u
kobiet i m
ężczyzn
Komentarz
Tre
ść tabeli 12. odnosi się do wyników badań wykonanych nie tylko z nielicznych wskazań
podanych wcze
śniej, ale do wyników wszystkich badań wykonanych przez pacjenta. Autor
wychodzi bowiem z zało
żenia, że nie akceptując nawet badania ultradźwiękowego jako badania
standardowego w diagnostyce osteoporozy, nale
ży zaproponować sposób interpretacji tego wyniku
pacjentom i lekarzom, którzy to badanie wykonali. Jak wspomniano wcze
śniej, metoda jest
dost
ępna, nie została zakazana, a możliwość wykonania badania odpłatnie pozwala wykonać to
badanie wielu osobom, nie obci
ążając budżetu NFZ.
Nie ma uzasadnienia dla wykonania badania ultrad
ź
wi
ę
kowego u osób, u których
wykonano wcze
ś
niej badanie DXA.
2.4. Markery metabolizmu kostnego
Badanie markerów metabolizmu kostnego na obecnym etapie nie mo
ż
e by
ć
uznane za
badanie rutynowo wykonywane ramach diagnostyki osteoporozy.
Komentarz
Badania markerów metabolizmu kostnego nie s
ą wykorzystywane w badaniach skriningowych w
kierunku osteoporozy i w rozpoznawaniu osteoporozy [59] ze wzgl
ędu na ograniczoną swoistość
metody, pomimo
że średnie wartości stężenia markerów metabolizmu kostnego są wyższe u
pacjentów z osteoporoz
ą niż u zdrowych osób. Osteoporoza może wystąpić niezależnie od
nasilenia przemian kostnych. Wg niektórych autorów, wysokie warto
ści stężenia markerów
stanowi
ą czynnik ryzyka osteoporozy i uzasadniają jednak wykonywanie badań [60].
Ocena st
ężenia markerów metabolizmu kostnego może być pomocna w ocenie skuteczności leczenia
farmakologicznego, informuj
ąc o efektach leczenia zanim widoczne to będzie w badaniu DXA.
Badanie markerów metabolizmu kostnego nie jest zalecane w naszym kraju w diagnostyce
osteoporozy jako badanie rutynowe ze wzgl
ę
du na:
a)
bardzo mał
ą dostępność metody
b)
wysoki koszt badania
c)
długi czas oczekiwania na wynik badania
d)
brak jednoznacznych kryteriów dotycz
ących podejmowania decyzji terapeutycznych na
podstawie wyników badania. Chocia
ż zaakceptowana jest ocena skuteczności leczenia
osteoporozy na podstawie obni
żania się stężenia markerów metabolizmu kostnego po 3-6
miesi
ącach leczenia, nie ma jednoznacznych zaleceń dotyczących podejmowania decyzji
terapeutycznych na tej podstawie, zwłaszcza przy braku istotnego obni
żenia stężenia markerów.
Do lekarza nale
ży jednak ostateczna decyzja zastosowania tej metody w diagnostyce osteoporozy.

24
2.5. Inne badania
Nast
ę
puj
ą
ce badania dodatkowe
muszą
by
ć
wykonane w ramach diagnostyki
osteoporozy:
a) morfologia krwi (je
żeli możliwe z rozmazem)
b) OB lub CRP
c) badanie ogólne moczu
d) st
ężenie wapnia w surowicy (jeżeli możliwe wapnia zjonizowanego we krwi).
Komentarz
Badania morfologii, OB lub CRP i badanie ogólne moczu s
ą powszechnie wykonywane przy każdej
ocenie stanu zdrowia chorego. Nieprawidłowe wyniki bada
ń mogą być wskazówką o chorobach
b
ędących przyczyną zaburzeń mineralizacji kości. Przykładem może być np. szpiczak mnogi,
niewydolno
ść nerek.
Badanie wapnia jest najwa
żniejszym badaniem biochemicznym. Najczęściej wystarczające jest
badanie wapnia całkowitego. U chorych z zaburzeniami białkowymi, niewydolno
ścią nerek
przydatne jest oznaczanie st
ężenia wapnia zjonizowanego we krwi. Nie można rozpocząć leczenia
osteoporozy za pomoc
ą wapnia i witaminy D bez znajomości stężenia wapnia. Można bowiem
przeoczy
ć rozpoznanie pierwotnej nadczynności przytarczyc, wymagającej innego leczenia
(najcz
ęściej operacyjnego). Niskie stężenie wapnia jest sygnałem do prowadzenia suplementacji
wapniowej i witamin
ą D przed rozpoczęciem leczenia za pomocą bisfosfonianów. Kontrola stężenia
wapnia w surowicy pozwala unikn
ąć hipo- i hiperkalcemii w czasie leczenia.
Nast
ę
puj
ą
ce badania dodatkowe
mogą
by
ć
wykonane w ramach diagnostyki
osteoporozy:
a) st
ężenie fosforu w surowicy
b) aktywno
ść fosfatazy zasadowej w surowicy
c) wydalanie wapnia w dobowej zbiórce moczu.
Komentarz
St
ężenie fosforu i aktywność fosfatazy zasadowej w surowicy jest u większości pacjentów z
osteoporoz
ą prawidłowe, dlatego trudno uznać to badanie za rutynowe. W przypadku podejrzenia
osteomalacji badania te powinny by
ć wykonane.
Badanie dobowego wydalania wapnia z moczem nie musi by
ć, wg autora, wykonywane rutynowo.
Na podstawie obserwacji wynikaj
ących z wieloośrodkowym badań naukowych oceniających
skuteczno
ść leczenia osteoporozy wydaje się, że ryzyko kamicy nerkowej w trakcie leczenia
wapniem i witamin
ą D jest niewielkie, u osób które wcześniej nie miały rozpoznanej kamicy
nerkowej.
Badanie jest bardziej wskazane u osób, które miały wcze
śniej rozpoznaną kamicę nerkową, lub
szczególnie, gdy maj
ą ją obecnie.
Ocena aktywno
ści resorpcyjnej w kościach na podstawie dobowej kalciurii też nie jest
jednoznaczna. Trudno jest bowiem jednoznacznie ustali
ć, czy obserwowana hiperkalciuria jest
przyczyn
ą osteoporozy, czy jej objawem. Ustępowanie hiperkalciurii w trakcie leczenia
antyresorpcyjnego mo
że sugerować to drugie.
Ocena zmiany kalciurii w trakcie leczenia, jako sposób oceny skuteczno
ści antyresorpcyjnej leczenia
farmakologicznego, wydaje si
ę jednak mało przydatna.

25
Nast
ę
puj
ą
ce badania
muszą uzupełniać
wymienione wcze
ś
niej badania w ramach
diagnostyki osteoporozy wtórnej:
a)
badanie st
ężenie PTH i TSH w surowicy
b)
decyzj
ę o wyborze innych badań podejmuje lekarz prowadzący diagnostykę wg ogólnie
przyj
ętych zasad postępowania dotyczącego danej jednostki chorobowej.
Komentarz
Wymienienie dwóch bada
ń dodatkowych, tj. stężenia PTH i TSH w surowicy, wynika z oceny ich
istotnej roli w rozpoznawaniu przyczyny dla osteoporozy wtórnej, tj. pierwotnej nadczynno
ści
przytarczyc i nadczynno
ści tarczycy.
2.5.1. Kiedy wykonywa
ć
kontrolne badania biochemiczne?
Podstawowym badaniem kontrolnym w czasie leczenia osteoporozy jest oznaczanie st
ężenia
wapnia w surowicy (je
żeli to możliwe wapnia zjonizowanego we krwi) dla optymalizacji dawki
wapnia i witaminy D (w przypadku jej podawania) przede wszystkim w celu unikni
ęcia
hiperkalcemii.
Pierwsze kontrolne badanie powinno by
ć wykonane nie później niż po 3 miesiącach.
Dalsze badania zale
żą od decyzji lekarza leczącego, jednak nie rzadziej niż co 6 miesięcy.
Komentarz
Terminy bada
ń kontrolnych nie są dokładnie określone w literaturze. Oznaczenie kontrolnego
st
ężenia wapnia w surowicy proponuje się czasami znacznie wcześniej, zwłaszcza u chorych z
niewydolno
ścią nerek, gdzie ryzyko hiperkalcemii pociąga za sobą ryzyko pogorszenia czynności
nerek. Dlatego te
ż u tych chorych należy pierwsze badanie kontrolne wapnia wykonać po 2
tygodniach.
Przy prawidłowym pierwszym badaniu st
ężenia fosforu w surowicy, nie ma konieczności
wykonywania kontrolnych bada
ń stężenia fosforu.
Wskazówk
ą dla decyzji o terminach kontrolnych badań mogą być międzynarodowe wieloośrodkowe
badania dotycz
ące oceny skuteczności działania leków w osteoporozie. Najczęściej na początku
leczenia (pierwszy-drugi rok) badania wykonywane s
ą w odstępach 3-miesięcznych, później, co pół
roku. Nie wydaje si
ę, aby w codziennej praktyce, poza indywidualnymi przypadkami, należałoby
wykonywa
ć badania częściej.
3. Jakie s
ą
wskazania do leczenia osteoporozy?
Podstawowym kryterium oceny wskaza
ń
do leczenia farmakologicznego jest ocena
ryzyka złamania ko
ś
ci.
Komentarz dotycz
ą
cy okre
ś
lenia „leczenie farmakologiczne”
Okre
ślenie „leczenie farmakologiczne” zostało użyte w znaczeniu najczęściej stosowanym w
codziennej praktyce. Okre
ślenie te zarezerwowane jest m.in. dla leków antyresorpcyjnych, jak np.
bisfosfoniany, czy leki z grupy SERM. Podawanie wapnia i witaminy D, jest zaliczane do
profilaktyki osteoporozy i cz
ęsto nie jest uznawane za „leczenie”. Leczenie farmakologiczne, bez
prawidłowej suplementacji wapnia i cz
ęsto witaminy D nie jest jednak skuteczne.
Komentarz dotycz
ą
cy oceny ryzyka złamania ko
ś
ci
Proponowane obecnie uwzgl
ędnienie 10-letniego ryzyka złamania kości zostało powszechnie
zaakceptowane. Ze wzgl
ędów ekonomicznych myśli się przede wszystkim o ryzyku dotyczącym
złamania szyjki ko
ści udowej, czy też innych fragmentów b.k.k.u. Przekroczenie 10% ryzyka
złamania ko
ści dla danej osoby w okresie najbliższych 10 lat, jest najczęściej akceptowane jako
wskazanie do rozpocz
ęcia leczenia. Nie znając jednak częstości złamań kości, ani kosztów leczenia

26
złama
ń, jak i kosztów powikłań nieleczonych złamań kości, trudno wypowiadać się nam na temat
ekonomii. Mo
że np. dopiero 15% ryzyko złamania kości uzasadnia leczenie w Polsce? Decyzja o
wyborze tych kryteriów mo
że być różna w różnych krajach, w zależności od miejscowych
warunków ekonomicznych.
Metoda jako
ściowa, jak również proste metody półilościowe stosowane dotychczas, zakładają
obecno
ść pewnych czynników ryzyka złamania kości i nieprawidłowego wyniku badania DXA
(ró
żnie wg różnych autorów) jako podstawy przy podejmowaniu decyzji leczniczych. Autor w
pierwszej cz
ęści opracowania („Porównanie półilościowej i jakościowej metody oceny czynników
ryzyka złamania ko
ści w osteoporozie”) próbował wykazać porównywalną przydatność metody
jako
ściowej i proponowanej obecnie metody półilościowej w ocenie ryzyka złamania kości, a więc i
w kwalifikacji do leczenia.
Metoda jako
ściowa zdała praktyczny egzamin od wielu lat w rozpoznawaniu np. tocznia trzewnego,
reumatoidalnego zapalenia stawów, gor
ączki reumatycznej.
Proponuje si
ę
ró
ż
ne sposoby kalkulacji ryzyka osteoporozy i złamania ko
ś
ci.
1.
The Simple Calculated Osteoporosis Risk Estimation (SCORE) [11]
2.
The Osteoporosis Risk Assessment Instrument (ORAI) [15]
3.
The Age, Body Size, No Estrogen score (ABONE) [16]
Testy SCORE I ORAI były porównywalne z metod
ą proponowana prze z NOF [61]
W tabeli 13. przedstawiono wskazania do leczenia osteoporozy na podstawie wyniku badania
densytometrycznego ko
ści i oceny klinicznych czynników ryzyka złamania kości.

27
Tab. 13.
Wskazania do leczenia farm
akologicznego w osteoporozie.
Cz
y
nniki ry
z
y
ka złamania ko
ś
ci
Wynik DXA
Kliniczne czynniki ryzyka
Wskazania
A
Ka
żdy wynik badania DXA
Przebyte
złam
anie oste
oporotyczne kr
ęgosłupa i b.k.k.u.
Leczenie
A.
Co najmniej 1 „du
ży” czynnik ryzyka zła
m
ania ko
ści
Leczenie
B.
Co najmniej 2 „m
ałe” czynniki ryzyka zła
m
ania ko
ści
Leczenie
B
T-score
<
-2,0 b.k.k.u.
C.
Bez
żadnego „du
że
go” i najwy
żej 1 „m
ałym” czynnikiem
ryzyka
złam
ania k
oś
ci
Bez leczenia/profilaktyka
osteoporoz
y
A.
Co najmniej 1 „du
ży” czynnik ryzyka zła
m
ania ko
ści u kobiety w
wieku <65 lat i m
ęż
czy
zn w wieku < 70 lat
Leczenie
B.
Co najmniej 2 „m
ałe” czynniki ryzyka zła
m
ania ko
ści u kobiety w
wieku <65 lat i m
ęż
czy
zn w wieku < 70 lat
Leczenie
C
T-score
<
-2,0 w kr
ęgosłupie
lę
dź
wiowym
C.
Bez
żadnego „du
że
go” i najwy
żej 1 „m
ałym” czynnikiem
ryzyka
złam
ania k
oś
ci
Bez leczenia/profilaktyka
osteoporoz
y
D
T-score
≥
-2,0 b.k.k.u.
Wszystkie przypadki, poza przebyt
ym
złam
aniem
osteoporotycz
n
ym
kr
ęgosłupa i/lub b.k.k.u.
Bez leczenia/profilaktyka
osteoporoz
y
E
T-score
≥
-2,0 w kr
ęgosłupie
lę
dź
wiowym
Wszystkie przypadki, poza przebyt
ym
złam
aniem
osteoporotycz
n
ym
kr
ęgosłupa i/lub b.k.k.u.
Bez leczenia/profilaktyka
osteoporoz
y
Przy badaniu DXA przedram
ienia decyzje lecznicze jak przy badaniu kr
ęgosłupa
lę
dź
wiowego (patrz wskazania do badani
a przedram
ienia w tab. 10, p. D).
UWAGA
:
Powy
ż
sze zalecenia, uwzgl
ę
dniaj
ą
ce stan klinicz
n
y i wynik
badania den
sytometrycz
nego, zgodni
e z intenc
j
ą
autora, dotycz
ą
wszystkich
dorosłych osób, zarówno kobiet, jak i m
ęż
czyzn.

28
Komentarze dotycz
ą
ce tabeli 13.
1.
Proponuje si
ę, za Delmasem [8] przyjąć przebyte złamanie osteoporotyczne kręgosłupa i
b.k.k.u. za wskazanie do leczenia farmakologicznego, niezale
żnie od wyniku badania DXA.
Pozostałe złamania osteoporotyczne, w tym złamanie Colles’a, uznano za „du
ży” czynnik ryzyka
kolejnego złamania i oceniono przy podejmowaniu decyzji leczniczych, tak jak pozostałe „du
że”
czynniki ryzyka złamania ko
ści, z koniecznością uwzględnienia wyniku badania DXA.
2.
Przesuni
ęto arbitralnie granicę wartości T-score = -2,0 dla podejmowania decyzji leczniczych
zarówno dla badania szyjki ko
ści udowej, jak i kręgosłupa lędźwiowego, biorąc pod uwagę
informacje wskazuj
ące na występowanie złamań osteoporotycznych aż u ok. 55-75% osób bez
spełnienia typowych kryteriów densytometrycznego rozpoznania osteoporozy (T-score
≤-2,5) [10,
62, 63].
Jak dot
ąd IOF proponował stosowanie klasycznej wartości T-score = ≤-2,5, NOF przy
nieobecno
ści klinicznych czynników ryzyka złamania kości T-score = -2,0, a przy obecności
którego
ś z czynników ryzyka, nawet T-score = -1,5. Wszystkie te decyzje, należy sądzić, były
podejmowane równie
ż w arbitralny sposób.
3.
Osoby z wynikiem DXA wyra
żonym wartością T-score = <-2,0, przy obecnym co najwyżej
jednym „małym” czynniku ryzyka złamania ko
ści, nie zostały zakwalifikowane do leczenia
farmakologicznego. Sytuacja ta, przy zastosowaniu metody jako
ściowej, jest tylko hipotetyczna.
Osoba ta nie miała wskaza
ń do badania DXA (bez „dużego” czynnika ryzyka złamania, w domyśle
jest to kobieta przed 65 r.
ż. lub mężczyzna przed 70 r.ż.). Skoro w takiej sytuacji nie uważamy za
wskazane wykonywanie badania DXA, to konsekwentnie, nie widzimy wskaza
ń do leczenia.
4.
Badanie DXA w zakresie przedramienia jest wykonywane jedynie w przypadku niemo
żności
wykonania badania osiowego. B
ędą to tylko bardzo nieliczne przypadki. Nawet, jeżeli decyzje
lecznicze nie s
ą udokumentowane w literaturze, muszą być podejmowane. Jedyne, wg autora,
rozs
ądne rozwiązanie w tej sytuacji, to korzystanie z zaleceń zarezerwowanych dla badań
osiowych.
5.
Z powodu braku jasnych wytycznych dotycz
ących kobiet przed menopauzą i mężczyzn w
ogóle, nale
ży zaproponować jakiś system postępowania. Dopóki nie pojawią się informacje
dotycz
ące konieczności innego postępowania, powinniśmy postępować tak, jak w przypadku
kobiet po menopauzie. Wydaj
ę się, że większym błędem byłoby zaniechanie jakiegokolwiek
post
ępowania, niż próba postępowania wg takich zasad, nawet jeżeli niedoskonałych.
Co do jednego jeste
śmy wszyscy zgodni, że u kobiet przed menopauzą i młodszych mężczyzn (nie
ma ustalonej precyzyjnej granicy wieku) nie ma wskaza
ń do przeprowadzenia badań
skriningowych w kierunku osteoporozy. Ka
żde podejrzenie osteoporozy w tym wieku (np.
przebyte złamanie ko
ści bez dużego urazu) każe podejrzewać osteoporozę wtórną. Z kolei
choroba, czy leki b
ędące potencjalnym ryzykiem osteoporozy, powinno skłaniać nas do
profilaktyki osteoporozy.
Istnieje te
ż zgodność, co do braku konieczności badań przesiewowych u kobiet w okresie
pomenopauzalnym najcz
ęściej aż do wieku 65 lat, przy braku istotnych czynników ryzyka
złamania ko
ści. U mężczyzn ta granica jest przesuwana najczęściej do 70 r.ż.

29
4. Jak leczy
ć
osteoporoz
ę
?
4.1. Co jest warunkiem skutecznego leczenia?
Warunkiem skutecznego leczenia osteoporozy i zapobiegania złamaniu ko
ś
ci jest:
Tab. 14.
A
Eliminacja potencjalnych czynników ryzyka osteoporozy
B
Zapewnienie prawidłowej poda
ży wapnia w łącznej dawce (dieta wraz z uzupełnieniem
wapnia w lekach) ok. 1500 mg/dziennie u m
ężczyzn i kobiet po 50 r.ż.; ok. 1000
mg/dziennie u kobiet i m
ężczyzn przed 50 r.ż.; ok. 1500 mg u kobiet w okresie menopauzy
C
U osób w wieku po 50 r.
ż. podawanie wit. D
3
w dobowej dawce 400-800 j
D
U osób starszych, z przewlekł
ą niewydolnością nerek wskazane jest podawanie aktywnych
metabolitów witaminy D, najcz
ęściej w dawce 0,25-0,5 µg/dz.
E
Poprawa sprawno
ści fizycznej chorego
Powy
ż
sze zalecenia wymagaj
ą
zastosowania niezale
ż
nie od stopnia ryzyka złamania
ko
ś
ci. Wchodz
ą
w zakres profilaktyki osteoporozy.
Komentarz dotycz
ą
cy stosowania leków zawieraj
ą
cych wap
ń
Wła
ściwa podaż wapnia zapobiega utracie masy kostnej u dorosłych. Wykazano to w grupie
kobiet w okresie pomenopauzalnym [64, 65], u starszych kobiet w zakresie b.k.k.u. [66], u
starszych m
ężczyzn [67]. Nie wykazano natomiast wpływu suplementacji wapnia na redukcję
ryzyka złamania ko
ści [68, 69].
Przy
średnim spożyciu wapnia w diecie w Polsce ok. 400 mg/dziennie, zaleca się suplementację
wapnia w ilo
ści 600-800 mg/dziennie.
Zaleca si
ę spożycie ok. 1000 mg wapnia u kobiet w okresie przed menopauzą i u mężczyzn oraz
1500 mg wapnia u kobiet, które nie stosuj
ą estrogenów [70]. Nie należy przekraczać dobowej
dawki wapnia w ilo
ści 2000 mg [71].
Przy podawaniu wapnia w dawce wi
ększej niż 500 mg dziennie, dawka powinna być podzielona
na dwie cz
ęści.
W Polsce najcz
ęściej stosowanym preparatem wapnia jest węglan wapnia, zawierający 40%
elementarnego wapnia.
Zaleca si
ę przyjmowanie węglanu wapnia w czasie posiłków. W stanach achlorhydrii wchłanianie
wapnia jest zmniejszone, st
ąd przyjmowanie leku w czasie posiłku ułatwia wchłanianie.
W przypadku chorych z niedoborem
żelaza i następową niedokrwistością, zaleca się przyjmowanie
wapnia w czasie
śniadania, posiłku o najmniejszej zawartości żelaza. Węglan wapnia, zmniejsza
bowiem istotnie wchłanianie
żelaza z diety [72].
Komentarz dotycz
ą
cy stosowania witaminy D
3
Niedobór witaminy D charakteryzuje si
ę hipokalcemią lub hipofosfatemią. Subkliniczny niedobór
witaminy D jest cz
ęsty i może być przyczyna osteoporozy. Zapasy witaminy D zmniejszają się z
wiekiem [73], szczególnie w czasie zimy. U osób starszych zmniejsza si
ę produkcja endogennej
witaminy D, jak i spo
życie [74]. Jelitowa oporność na działanie kalcytriolu może być również
przyczyn
ą ujemnego bilansu wapniowego u starszych osób [75]. Niedobór witaminy jest częsty
[76]. Rozpoznaje si
ę go, gdy stężenie 25(OH)D
3
jest poni
żej 20 nmol/l. Kobiety w okresie
pomenopauzalnym z niedoborem witaminy D miały ni
ższą gęstość mineralną kości [77, 78].
Trzydzie
ści procent pacjentów ze złamaniem b.k.k.u. miało niedobór witaminy D [79].
Rekomendowana dawka witaminy D u osób w wieku 51-70 lat to 400 j/dziennie, a 600-800 j u
osób starszych.

30
Podawanie witaminy D wymaga jednoczesnej suplementacji wapniowej. Skuteczno
ść witaminy D
jest widoczna szczególnie przy jej niedoborze.
W czasie leczenie witamin
ą D obserwowano wzrost gęstości kości [80].
Wpływ witaminy D na redukcj
ę częstości złamań kości jest opisywany różnie. Opisywano
zmniejszenie cz
ęstości złamań kości [67] oraz brak pozytywnego wpływu na częstość złamań [81].
To drugie stanowisko jest powszechniej przyjmowane.
Podawanie witaminy D mo
że zwiększać siłę mięśniową i zmniejszać ryzyko upadków [82].
Komentarz dotycz
ą
cy stosowania aktywnych metabolitów witaminy D
Starsze osoby s
ą narażone na niedobór witaminy D z powodu mniejszej ekspozycji na światło
słoneczne w porównaniu do osób młodych, zmniejszon
ą syntezę 25(OH)D
3
w skórze i nisk
ą
zawarto
ść witaminy D w diecie [83]. Znaczna grupa osób w starszym wieku, pomimo
prawidłowego st
ężenia witaminy D w surowicy, może być narażona na obniżone stężenie
aktywnej postaci witaminy D w surowicy [84] z powodu zmniejszonej aktywno
ści 1-hydroksylazy
w nerkach [85]. Uzasadnia to stosowanie u osób starszych której
ś z aktywnych postaci witaminy
D, kalcytriolu lub alfakalcydolu.
Kalcyfediol
U chorych z przewlekłymi chorobami w
ątroby w przypadku konieczności podawania witaminy D,
wskazane jest podawanie kalcyfediolu.
Komentarz dotycz
ą
cy znaczenia aktywno
ś
ci fizycznej
Aktywno
ść fizyczna jest istotnym elementem prawidłowego postępowania z chorym na
osteoporoz
ę i zapobiegania złamaniom kości. Pacjenci w starszym wieku z przebytym złamaniem
biodra byli mniej aktywni fizycznie przez całe dorosłe
życie [86]. Wykazano mniejszą liczbę
złama
ń niskoenergetycznych u mężczyzn z większą aktywnością fizyczną [87]. Aktywność
fizyczna u dorosłych zmniejsza ryzyko upadku, a przez to ryzyko złamania ko
ści [88]. Ćwiczenia
u starszych osób musz
ą być indywidualizowane.
Wyniki bada
ń wykazały, że ćwiczenia fizyczne mogą zwiększać masę mięśni i ich siłę oraz
redukowa
ć ryzyko upadków o ok. 25% u starszych osób [89]. Nie jest jednak pewne, czy takie
ćwiczenia zmniejszają ryzyko złamań kości. Różnego rodzaju ćwiczenia fizyczne stymulują
niewielki wzrost g
ęstości kości, co ustępuje po zaprzestaniu ćwiczeń.
W czasie
ćwiczeń fizycznych u osób starszych obserwowano zmniejszenie częstości złamania
biodra, z jednoczesnym jednak zwi
ększeniem częstości złamań typu Colles’a.
4.2. Jakie leki s
ą
stosowane w leczeniu farmakologicznym?
W przypadku spełnienia kryteriów kwalifikacyjnych zawartych w tab. 13, konieczne jest
zastosowanie leczenia farmakologicznego.
Wymienione poni
ż
ej leki s
ą
stosowane w Polsce w leczeniu osteoporozy, a nie w jej
profilaktyce.
W leczeniu farmakologicznym maj
ą
cym na celu zmniejszenie ryzyka złamania ko
ś
ci
(pierwszego i kolejnych) stosujemy:

31
Tab. 15.
A
Bisfosfoniany
Alendronian
Osteoporoza ze złamaniami i bez złama
ń
Risedronian
Osteoporoza ze złamaniami i bez złama
ń
B
Leki z grupy SERM
Raloksyfen
Osteoporoza ze złamaniami i bez złama
ń
C
Ranelinian strontu
Osteoporoza ze złamaniami i bez złama
ń
D
Teriparatide
Osteoporoza ze złamaniami
E
Kalcytonina
Osteoporoza ze złamaniami
F
HTZ
Nieliczne sytuacje
Komentarz dotycz
ą
cy stosowania alendronianu
Alendronian jest skuteczny w zapobieganiu złamaniom kr
ęgosłupa, biodra i złamaniom
pozakr
ęgosłupowym u kobiet w okresie pomenopauzalnym. Zwiększa gęstość kości we
wszystkich badanych fragmentach szkieletu. Alendronian stosowany w poł
ączeniu z estrogenami
lub raloksyfenem w wi
ększym stopniu zwiększa gęstość kości. Nie wykazano jednak zwiększenia
skuteczno
ści przeciwzłamaniowej leku [90].
Tygodniowa dawka leku (70 mg w tabletce) ma podobny wpływ na g
ęstość kości jak forma
codziennej tabletki (po 10 mg) [91, 92]. Nie ma jednak danych na temat porównania
przeciwzłamaniowego efektu tygodniowej formy leku. Skuteczno
ść przeciwzłamaniową leku
wykazano w wielu pracach [93, 94]. Skuteczno
ść leku wykazano u kobiet z przebytym złamaniem
kr
ęgosłupa [93], jak i bez przebytego złamania [95]. Alendronian zwiększa gęstość kości we
wszystkich badanych miejscach szkieletu i istotnie (o 36%) zmniejsza ryzyko złamania kr
ęgosłupa
u kobiet z wyj
ściową wartością T-score <-2,5 [96]. Wykazano zmniejszenie częstości
pozakr
ęgosłupowych złamań w ciągu roku u kobiet w okresie pomenopauzalnym przy T-score < -
2,0 [95]. Alendronian zapobiega utracie masy kostnej u zdrowych kobiet w okresie
pomenopauzalnym, nie wykazano jednak efektu przeciwzłamaniowego u tych kobiet.
Najdłu
ższy opublikowany okres stosowania alendronianu to okres 10 lat [96, 97]. Największy
wzrost g
ęstości kości obserwowano w pierwszych 5 latach. Efekt przeciwzłamaniowy utrzymywał
si
ę przez cały okres leczenia. W grupie pacjentów, u których odstawiono lek po 5 latach
obserwowano stopniowy spadek skuteczno
ści leku oceniany na podstawie gęstości kości i stężenia
markerów metabolizmu kostnego. Sugeruje si
ę możliwość zmniejszenia dawki leku o połowę po 5
latach leczenia. Jest to równie
ż okres, kiedy przy stabilizacji wyników DXA i stanu klinicznego
chorego, mo
żna rozważać przerwanie leczenia. Wg niektórych po odstawieniu leku efekt,
przynajmniej densytometryczny, utrzymuje si
ę jeszcze przez 1 rok.
Komentarz dotycz
ą
cy stosowania risedronianu
Risedronian w dawce 5 mg dziennie jest skuteczny w zapobieganiu złama
ń kręgosłupowych,
biodra i pozakr
ęgosłupowych. W okresie 3-letniego leczenia zmniejsza ryzyko złamania
kr
ęgosłupa o 41-49% i złamań pozakręgosłupowych o 33-39% [98, 99]. Efekt przeciwzłamaniowy
był widoczny ju
ż w pierwszym roku leczenia. Wykazano zmniejszenie ryzyka złamania biodra o
40% u osób z obni
żoną gęstością kości [100]. U osób z przebytym złamaniem kręgosłupa ryzyko
złamania biodra obni
żało się o 60%. Efekt przeciwzłamaniowy jest mniejszy przy gęstości kości
wyra
żonej w T-score powyżej –2,0. Po 7 latach leczenia (najdłuższe publikowane dane) utrzymuje
si
ę wzrost gęstości kości i działanie przeciwzłamaniowe [101]. Risedronian jest obecnie dostępny
równie
ż w postaci tabletek podawanych w jednej dawce na tydzień [102].
Komentarz dotycz
ą
cy stosowania Selektywnych Blokerów Receptora
Estrogenowego (SERM)
Przedstawicielem tej grupy lekowej jest dost
ępny w Polsce raloksyfen. Leki z tej grupy mają
aktywno
ść w tkance kostnej, a nie w układzie rozrodczym [103]. Badania dotyczące osteoporozy
przeprowadzono u kobiet w wieku 45-60 lat. W czasie 2-letniego leczenia obserwowano wzrost

32
g
ęstości kości we wszystkich badanych miejscach szkieletu, niezależnie od dawki leku - 30, 60 i
150 mg dziennie [104]. Podobne wyniki obserwowano w czasie 3-letniego leczenia [105]. W
czasie 3-letniego leczenia kobiet z w okresie pomenopauzalnym (60 i 120 mg dziennie)
obserwowano zmniejszenie ryzyka złamania kr
ęgosłupa, bez wpływu na złamania
pozakr
ęgosłupowe [106]. Po 4 latach leczenia (60 mg dziennie) obserwowano nadal zmniejszenie
ryzyka złamania kr
ęgosłupa [107]. Nadal nie było jednak zmniejszenia ryzyka złamań
pozakr
ęgosłupowych. Zmniejszenie ryzyka złamania pozakręgosłupowego obserwowano jedynie
w grupie kobiet z najci
ęższymi złamaniami kręgosłupa obecnymi przed rozpoczęciem leczenia
[108]. W badaniach porównawczych stwierdzono mniejszy wpływ raloksyfenu (60 mg/dziennie)
na g
ęstość mineralną kości w porównaniu do alendronianu (70 mg/tydzień) [109] i estrogenów
(0,625 mg skoniugowanych estrogenów/dziennie) [110]. Po odstawieniu leku powraca ubytek
masy kostnej [111].
Komentarz dotycz
ą
cy stosowania ranelinianu strontu
W dwa lata trwaj
ącym programie dotyczącym kobiet w okresie pomenopauzalnym, z co najmniej
jednym przebytym złamaniem kr
ęgosłupa obserwowano wzrost gęstości kości w zakresie
kr
ęgosłupa. W drugim roku obserwacji zmniejszyło się ryzyko nowych złamań kręgosłupa w
najwi
ększej stosowanej dawce (2 g/dziennie) [112]. W trzyletnim programie obserwowano wzrost
g
ęstości kości w zakresie kręgosłupa lędźwiowego i szyjce kości udowej oraz redukcję liczby
nowych złama
ń kręgosłupa o 41% [113]. W innym programie, dotyczącym skuteczności
ranelinianu strontu w osteoporozie u kobiet w okresie pomenopauzalnym stwierdzono redukcj
ę
liczby złama
ń kręgosłupa oraz wszystkich złamań pozakręgosłupowych w czasie 3 lat trwania
programu. Stwierdzono jednocze
śnie redukcję liczby złamań biodra u kobiet najbardziej
nara
żonych na ryzyko złamania kości, w wieku ≥74 lat i z wynikiem DXA w zakresie szyjki kości
udowej
≤-3,0 [114].
Komentarz dotycz
ą
cy stosowania teriparatidu
Teriparatide (rekombinowany ludzki parathormon, fragment 1-34 parathormonu) jest lekiem o
anabolicznym działaniu. Jest skutecznym lekiem zwi
ększającym gęstość mineralną kości w
zakresie całego szkieletu [115, 116]. Obserwowano istotne obni
żenie ryzyka złamania kręgosłupa i
złama
ń pozakręgosłupowych [116]. Lek jest podawany podskórnie, został zarejestrowany do
podawania nie dłu
ższego niż 2 lata.
W Polsce istnieje mo
żliwość wystąpienia do NFZ o refundowany zakup leku. Pacjenci z bardzo
zaawansowana osteoporoz
ą, nieskutecznie leczeni innym lekami, mogą być kandydatami do
stosowania tego leku.
Podejmowane s
ą próby podawania teriparatydu w połączeniu z lekami antyresorpcyjnymi, głównie
bisfosfonianami. Nie wykazano przewagi ł
ącznego podawania obu leków [117]. Nie było również
przewagi wcze
śniejszego podawania bisfosfonianu (alendronianu) przed parathormonem nad
skuteczno
ścią samego parathormonu [118]. Mogą być podejmowane próby podawania
bisfosfonianu po parathormonie.
Skuteczno
ść stosowania parathormonu po wcześniejszym leczeniu raloksyfenem i estrogenami była
podobna jak stosowanie samego parathormonu [116].
Komentarz dotycz
ą
cy stosowania kalcytoniny
Kalcytonina jest lekiem drugiego rzutu w leczeniu osteoporozy. W najdłu
żej trwającym programie
badawczym, w czasie 5-letniego leczenia obserwowano zmniejszenie ryzyka złamania kr
ęgosłupa o
36% w grupie chorych otrzymuj
ących 200 j donosowo dziennie [119]. Nie wykazano zmniejszenia
cz
ęstości złamań pozakręgosłupowych. Dawkowanie codzienne leku jest jedynym sposobem
rekomendowanym obecnie przez producenta. Obecnie lek jest coraz rzadziej stosowany w leczeniu
osteoporozy, a najcz
ęściej stosowany sposób dawkowania to przerywane podawanie leku,

33
najcz
ęściej 2-3 miesiące leczenia na przemian z 2-3 miesiącami przerwy. Taki sposób dawkowania
nie został poparty
żadnymi większymi pracami naukowymi. Sposoby innego podawania leku nie
znajduj
ą uzasadnienia, a stosując lek w taki nietypowy sposób, nie jesteśmy nawet w stanie
wykaza
ć jego skuteczności, poza obserwowanym czasami efektem przeciwbólowym.
Lek znajduje obecnie zastosowanie głównie w leczeniu bólu po złamaniu ko
ści [120] i w zespole
Sudecka [121].
Obserwuje si
ę wzrost gęstości kości w zakresie kręgosłupa, bez istotnych zmian w innych
fragmentach szkieletu [119].
Lek bywa stosowany w migrenie [122], bólach fantomowych ko
ńczyn [123], w bólach
pooperacyjnych [121].
Komentarz dotycz
ą
cy stosowania hormonalnej terapii zast
ę
pczej (HTZ)
Kobiety z przedwczesn
ą menopauzą (najczęściej przed 45 r.ż.) mają zwiększone ryzyko
osteoporozy [124]. Przy
śpieszona utrata masy kostnej u kobiet zaczyna się w okresie pojawienia
si
ę nieregularnych miesiączek, i trwa przez 4-5 lat, czasami do 10 lat [125]. HRT w okresie
pomenopauzalnym jest skuteczna w hamowaniu utraty masy kostnej i jej zwi
ększaniu w tym
okresie [126, 127]. Skuteczno
ść przeciwzłamaniowa dotyczy kręgosłupa i kości przedramienia u
kobiet we wczesnym, kilkuletnim okresie pomenopauzalnym [128, 129].
Istotnym problemem ograniczaj
ącym stosowanie HTZ jest zwiększone ryzyko nowotworów sutka
i jajników oraz powikła
ń naczyniowo-sercowych.
Ze wzgl
ędu na ryzyko istotnych powikłań i niewielką skuteczność przeciwzłamaniową,
hormonalna terapia zast
ępcza nie jest obecnie uważana za leczenie pierwszego rzutu w
osteoporozie. Ryzyko objawów ubocznych przewy
ższa spodziewane efekty stosowania HTZ w
osteoporozie.
Jedyn
ą okolicznością uzasadniającą stosowanie HTZ w osteoporozie jest profilaktyka
przeciwzłamaniowa u kobiet w okresie pomenopauzalnym z objawami klimakterycznymi.
Komentarz dotycz
ą
cy stosowania fluorku sodu
Nie jest obecnie zalecany w leczeniu osteoporozy. Nie wykazano redukcji ryzyka złamania
kr
ęgosłupa i złamań pozakręgosłupowych u kobiet w okresie pomenopauzalnym [130], pomimo
wzrostu g
ęstości kości w zakresie kręgosłupa lędźwiowego [131] i szyjki kości udowej [132].
Przedstawione powy
ż
ej leki s
ą
zalecane przede wszystkim w osteoporozie
pomenopauzalnej.
Komentarz dotycz
ą
cy stosowania leków u pacjentów, poza grup
ą
kobiet w okresie
pomenopauzalnym
Przedstawione powy
żej leki są zalecane przede wszystkim u kobiet w okresie pomenopauzalnym.
Wynika to z faktu prowadzenia bada
ń nad tymi lekami przede wszystkim u kobiet w tym okresie.
Czy u kobiet w okresie przed menopauz
ą
, z osteoporoz
ą
wtórn
ą
mo
ż
na stosowa
ć
powy
ż
sze leki?
Zostały przeprowadzone badania dotycz
ące leczenia osteoporozy posterydowej za pomocą
alendronianu i risedronianu.
W innych przypadkach rozpoznania osteoporozy wtórnej, pomimo braku przeprowadzonych bada
ń
sytuacja zmusza nas do podj
ęcia leczenia za pomocą dostępnych leków. Wybór któregoś z
dost
ępnych leków musi zależeć już od decyzji lekarza leczącego.
Czy u m
ęż
czyzn mo
ż
emy stosowa
ć
powy
ż
sze leki?
Alendronian został zarejestrowany do stosowania u m
ężczyzn z osteoporozą [3, 133].

34
Inne leki u m
ęż
czyzn
Testosteron
U m
ężczyzn z hipogonadyzmem pierwotnym i wtórnym obserwowano wzrost gęstości kości w
zakresie kr
ęgosłupa lędźwiowego w czasie leczenia testosteronem [134, 135]. Testosteron jest
skuteczny w podwy
ższaniu gęstości kości, szczególnie u mężczyzn z obniżonym stężeniem
testosteronu przed leczeniem. Prace te były oparte na obserwacjach na niewielkich grupach
m
ężczyzn. Leczenie za pomocą testosteronu nie jest powszechnie stosowane.
Nie ma przekonywuj
ących danych na skuteczność testosteronu u starszych mężczyzn z obniżoną
g
ęstością kości i bez jawnego klinicznie hipogonadyzmu w leczeniu osteoporozy [136].
Propozycj
ę
leczenia w osteoporozie, przy uwzgl
ę
dnieniu obecno
ś
ci czynników ryzyka
złamania ko
ś
ci i wyniku badania densytometrycznego przedstawiono na rycinach 1 i 2
(strona 48 i 49).
Propozycj
ę
wyboru leku w leczeniu osteoporozy pomenopauzalnej przedstawiono na
rycinie 3 (strona 50).
Leczenie farmakologiczne musi by
ć
stosowane wg zalece
ń
producenta.
Komentarz
Autor obserwuje niekiedy stosowanie leków w sposób nie zalecany przez producenta. S
ą to
najcz
ęściej mniejsze dawki leku (podawanie z przerwami). Motywowane jest to najczęściej
wzgl
ędami ekonomicznymi. Oszczędność może być jednak tylko pozorna. Zmniejszenie dawki
leku, a przez to efektów leczniczych mo
że obrócić się przeciw pacjentowi w postaci nie
zabezpieczenia go przed zwi
ększonych ryzykiem złamania kości.
Inaczej ni
ż to było w przypadki kalcytoniny, dawkowanie wymienionych leków jest ściśle ustalone
przez producenta.
4.3. Jak długo stosowa
ć
leczenie farmakologiczne?
Leczenie farmakologiczne u chorego z przebytym złamaniem osteoporotycznym ko
ści jest
stosowane tak długo, jak długo jest skuteczne (patrz p. 5), nie dłu
żej jednak niż najdłuższe
obserwacje danego leku w badaniach klinicznych.
Komentarz
Najdłu
ż
sze opisywane w literaturze stosowanie leków w leczeniu osteoporozy to:
1.
Alendronian – 10 lat [96, 97]
2.
Risedronian – 7 lat [101]
3.
Raloksyfen – 4 lata [107]
4.
Ranelinian strontu – 3 lata [113, 114]
Leczenie farmakologiczne u chorego bez przebytego złamania ko
ś
ci mo
ż
e trwa
ć
krócej,
po czym mo
ż
e by
ć
podj
ę
ta próba odstawienia leku.
Komentarz
Leczenie farmakologiczne u chorego bez przebytego złamania ko
ści może trwać krócej, po czym
mo
że być podjęta próba odstawienia leku. Spośród wymienionych leków problem ten dotyczy
szczególnie bisfosfonianów, poniewa
ż jak dotąd, udokumentowano w literaturze medycznej ich
najdłu
ższe stosowanie.
Na podstawie dost
ępnych danych trudno jest jednoznacznie odpowiedzieć na postawione pytanie.
Mo
żna zaproponować okres 5 lat, po których lek można odstawić, utrzymując pozostałe

35
post
ępowanie, takie jak w profilaktyce osteoporozy. Okres 5 lat został zaproponowany na
podstawie publikowanych materiałów dotycz
ących alendronianu, z których wynika, że w czasie 5
lat lek ten wykazywał najwi
ększą skuteczność przeciwzłamaniową [97]. Rozważa się nawet
zmniejszenie do połowy dawki alendronianu po 5 latach leczenia.
Kiedy wykona
ć
kontrolne badanie DXA po odstawieniu leku?
Okres przerwy w leczeniu bisfosfonianami do podj
ęcia kolejnej decyzji na temat dalszego
post
ępowania może trwać 2 lata. Obserwowano, utrzymywanie się niezmienionej gęstości kości po
jednym roku od odstawienia alendronianu [137]. Ze wzgl
ędów medycznych w okresie 2 lat można,
wi
ęc nie wykonywać badania densytometrycznego kości, ponieważ po roku nie powinniśmy
spodziewa
ć się istotnego obniżenia gęstości kości. Ze względów psychologicznych, może być to
trudne do zaakceptowania dla pacjenta, dlatego te
ż w większości przypadków wykonamy
kontrolne badanie najprawdopodobniej po jednym roku.
Wskazaniem do ponownego zlecenia leku b
ędzie istotne obniżenie gęstości kości w kontrolnym
badaniu DXA.
W przypadku pozostałych leków, kontrolne badanie powinno by
ć wykonane po jednym roku,
poniewa
ż po ich odstawieniu nie utrzymuje się działanie wpływające na gęstość kości, tak jak przy
stosowaniu raloksyfenu [111] lub brak jest danych na ten temat.
W przypadku leczenia uznanego za nieskuteczne (patrz p. 5), nale
ż
y zaleci
ć
podawanie
leku z innej grupy lekowej.
5. Jak ocenia
ć
wyniki leczenia?
5.1. Ocena skuteczno
ś
ci leczenia polega na ocenie:
Tab. 16.
A
Stanu klinicznego
B
Wyników badania DXA
5.1.A. Ocena stanu klinicznego:
a)
Nieobecno
ść złamania kości w danym okresie leczenia nie jest wystarczającym dowodem na
skuteczno
ść leczenia.
b)
Wyst
ąpienie złamania kości w pierwszym roku leczenia nie jest wystarczającym dowodem na
brak skuteczno
ści przeciwzłamaniowej leku.
c)
Wyst
ąpienie złamania osteoporotycznego w drugim roku leczenia sugeruje brak skuteczności
przeciwłamaniowej leku.
Komentarze dotycz
ą
ce oceny stanu klinicznego
Ad. a)
Nieobecno
ść złamania kości, chociaż bardzo ważna, nie jest wystarczającym dowodem na
skuteczno
ść leczenia farmakologicznego. Byłoby tak w przypadku corocznego występowania
złama
ń u chorych z osteoporozą. Nieobecność złamania może wynikać również ze świadomego
unikania przez chorego urazów.
Ad. b)
Wi
ększość leków stosowanych w leczeniu osteoporozy wykazuje swoje
przeciwzłamaniowe działanie od drugiego roku podawania. Skuteczno
ść risedronianu w zakresie
redukcji liczby złama
ń pozakręgosłupowych [138] i złamań kręgosłupa [139] opisywano już w
pierwszych 6 miesi
ącach stosowania leku. W przypadku więc risedronianu, wystąpienie nowego
złamania ko
ści w drugim półroczu leczenia mogłoby sugerować brak skuteczności leku. Przed
36
podj
ęciem jednak ostatecznej decyzji o zmianie leku wskazana byłaby ocena prawidłowości w
stosowaniu leku i leczeniu towarzysz
ącym.
Ad. c)
Przed ostateczn
ą oceną skuteczności leku konieczna jest ocena prawidłowego stosowania
zaleconych leków, weryfikacja rozpoznania z uwzgl
ędnieniem nie rozpoznanej wcześniej
osteoporozy wtórnej.
5.1.B. Ocena skuteczno
ś
ci leczenia polega głównie na ocenie wyników badania
DXA.
5.2. Jak interpretowa
ć
kontrolne badanie DXA?
Wynik badania mo
żna uznać za istotnie różny od poprzedniego (niższy lub wyższy), kiedy różnica
jest wi
ększa od najmniejszej istotnej zmiany dla danego fragmentu szkieletu.
Przy ró
żnicy wyników mniejszej lub równej najmniejszej istotnej zmianie wynik kontrolny
nale
ży uznać za niezmieniony.
Komentarz dotycz
ą
cy oceny najmniejszej istotnej zmiany wyniku badania
densytometrycznego ko
ś
ci
Warunkiem prawidłowej interpretacji kontrolnych wyników DXA jest znajomo
ść najmniejszego
bł
ędu metody (LSC – the least significant change), aby uniknąć nieprawidłowej interpretacji zmian
wyników. W przypadku nieposiadania przez dan
ą pracownię obliczonych wartości najmniejszej
istotnej zmiany, upowa
żnione Towarzystwa powinny zarekomendować wartości LSC dla każdego
fragmentu szkieletu.
Tab. 17. Najmniejsza istotna zmiana wyniku uzyskana w Pracowni Densytometrycznej Akademii
Medycznej w Warszawie przy u
życiu aparatu Lunar DPX-L:
Bł
ą
d pomiaru
LSC
Rekomendowane
LSC
Kr
ę
gosłup L
2
-L
4
*
0,88
2,51
3,0
Szyjka ko
ś
ci udowej
1,90
5,39
6,0
Kr
ę
tarz
2,35
6,76
7,0
Trójk
ą
t Warda
4,09
11,61
12,0
Trzon ko
ś
ci promieniowej
1,26
3,13
4,0
Cz
ęść
ultradystalna ko
ś
ci
promieniowej
2,70 7,66 8,0
* LSC oznaczano dla L
2
-L
4
.
Nie wyliczono LSC dla badania całego szkieletu.
Liczbowa warto
ść rekomendowanego LSC została wyrównana do równych wartości
(wygodniejszych w u
życiu) „w górę”, a nie „w dół”, ponieważ z dużym prawdopodobieństwem
mo
żna przyjąć, że błąd pomiaru w codziennej praktyce będzie raczej większy, a nie mniejszy niż
uzyskany w czasie bada
ń nastawionych wyłącznie na oznaczenie LSC.
Je
żeli inne pracownie densytometryczne nie będą dysponowały wyliczonym LSC dla innych
aparatów DXA, to w codziennej praktyce powinny znale
źć zastosowanie wyliczenia dla aparatu
Lunar.
Wzór na wyliczenie LSC [140]:
LSC = CV% x 2 x 1,41 gdzie CV jest współczynnikiem wariancji

37
Zmian
ę gęstości kości w zakresie danego fragmentu szkieletu należy liczyć jako procent zmiany
(obni
żenia albo podwyższenia) gęstości w porównaniu do wartości wyjściowej, a nie jako różnicę
punktów procentowych.
Wzór na wyliczenie zmiany g
ęstości kości:
Przy wzro
ście gęstości kości:
BMD (w g/cm
2
) kontrolnego badania - BMD (w g/cm
2
) badania pierwszego
(%)
BMD (w g/cm
2
) badania pierwszego
(o uzyskany % wzrosła g
ęstość kości)
Przy obni
żeniu gęstości kości:
BMD (w g/cm
2
) badania pierwszego - BMD (w g/cm
2
) badania kontrolnego
(%)
BMD (w g/cm
2
) badania pierwszego
(o uzyskany % obni
żyła się gęstość kości)
(Dla ułatwienia oblicze
ń odejmujemy niższą wartość gęstości kości od wyższej).
W przypadku wykonania kontrolnego badania tym samym albo takim samym aparatem (w tej
samej projekcji), zmian
ę wyników obliczamy wg podanych wzorów.
W przypadku wykonania kontrolnego badania w tej samej projekcji, ale innym aparatem
przedstawione wzory nie mog
ą być wykorzystane.
Post
ępowanie polega w tych przypadkach na porównaniu obecnej wartości procentowej do
warto
ści procentowej dla osób młodych i obliczeniu różnicy punktów procentowych. Uzyskaną
ró
żnicę należy również odnieść do najmniejszej istotnej zmiany. Tak uzyskany wynik jest
obarczony du
żym błędem, a decyzja terapeutyczna podjęta na jego podstawie może być
niewła
ściwa.
5.3. Wybór metody kontrolnego badania DXA:
Tab. 18.
A
Badanie kontrolne musi by
ć wykonane w tym samym fragmencie szkieletu, co badanie
poprzednie
B
Za optymalne rozwi
ązanie należy przyjąć wykonanie kontrolnego badania DXA tym samym
aparatem densytometrycznym
C
Je
żeli nie jest to możliwe, należy wykonać kontrolne badanie przy użyciu takiego samego
aparatu
D
Je
żeli nie jest to możliwe, należy wykonać badanie innym aparatem
E
Je
żeli pierwsze badanie było wykonane w projekcji nie zalecanej (badanie kręgosłupa
l
ędźwiowego u osoby w wieku ≥65 lat), to optymalnym postępowaniem jest wykonanie
badania DXA w zakresie kr
ęgosłupa lędźwiowego (dla porównania z badaniem
poprzednim) i jednoczesne badanie b.k.k.u., tak aby w przyszło
ści móc wykonywać jedynie
badanie b.k.k.u.

38
Badanie densytometryczne ko
ści promieniowej może być wykorzystane do oceny skuteczności
leczenia jedynie w przypadku braku mo
żliwości wykonania badania b.k.k.u. (tylko w takich
przypadkach powinno by
ć wykonywane).
5.4. Kiedy wykona
ć
kontrolne badanie DXA?
Kontrolne badania densytometryczne powinno by
ć wykonywać tylko u tych osób, u których
wyst
ępują czynniki powodujące utratę masy kostnej, jak np. stosowanie glikokortykosteroidów,
czy w przypadku pierwotnej nadczynno
ści przytarczyc, a także dla oceny efektów leczenia
farmakologicznego. Najcz
ęściej powinien to być okres co 2-3 lata.
Komentarz
W literaturze medycznej podaje si
ę różne propozycje terminów wykonywania kontrolnych badań
densytometrycznych ko
ści.
1. Badanie densytometryczne ko
ści może być wykonane po 1 roku leczenia. W przypadku braku
skuteczno
ści leczenia, należy ocenić sposób przyjmowania leków i ew. szukać przyczyny dla
osteoporozy wtórnej [141]. Wg niektórych autorów, nale
ży poczekać kolejny rok na następny
kontrolny wynik badania [142].
2. Badanie mo
że być wykonane po 2 latach leczenia. Stwierdzono, że u pacjentów przyjmujących
alendronian w dawce 5 mg/dziennie, pomimo spadku g
ęstości kości w zakresie biodra w
pierwszym roku o 4%, w drugim roku wi
ększość chorych miała istotny wzrost gęstości kości [141].
3. Inna propozycja post
ępowania dotyczy łącznej kontroli badania DXA i markerów metabolizmu
kostnego [32]. Badanie st
ężenia markerów było powtarzane po pół roku leczenia. W przypadku
spadku st
ężenia markerów (NTX w moczu o >50% i CTX w surowicy o >30%) wynik ten był
dowodem na skuteczno
ść leków i badanie DXA mogło być powtórzone po 2 latach leczenia [143].
4. Kolejna propozycja zakłada brak konieczno
ści powtarzania badania DXA. Autorzy tej metody
zakładaj
ą brak skutecznej propozycji zamiany nieskutecznej terapii na inną. Zakłada również, że w
przypadku odstawienia leku utrata masy kostnej b
ędzie większa, niż przy pozostawieniu nawet
nieskutecznego leku.
39
5.4.1. Kiedy wykona
ć
pierwsze kontrolne badanie DXA?
Tab. 19.
A
Leczenie osteoporozy z przebytym osteoporotycznym
złamaniem ko
ści kręgosłupa i b.k.k.u. niezależnie od wieku
chorego i płci
Po 1 roku leczenia
B
Leczenie osteoporozy z przebytym osteoporotycznym
złamaniem ko
ści poza kręgosłupem i b.k.k.u. niezależnie od
wieku chorego i płci
Po 2 latach leczenia
C
Leczenie osteoporozy bez przebytego osteoporotycznego
złamania ko
ści niezależnie od wieku chorego i płci
Po 2 latach leczenia
D
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
<
65
lat i m
ężczyzn w wieku
<
70 lat bez czynników ryzyka
złamania ko
ści
Po 3 latach
E
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
<
65
lat i m
ężczyzn w wieku
<
70 lat z czynnikami ryzyka
złamania ko
ści
Po 2 latach
F
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
≥65
lat i m
ężczyzn w wieku ≥70 lat bez czynników ryzyka
złamania ko
ści
Bez kontrolnego badania
G
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
≥65
lat i m
ężczyzn w wieku ≥70 lat z obecnymi czynnikami
ryzyka złamania ko
ści
Po 2 latach
H
Prawidłowy wynik DXA u kobiet w wieku
≥65 lat i
m
ężczyzn w wieku ≥70 lat
Bez badania kontrolnego
I
Prawidłowy wynik DXA u kobiet w wieku <65 lat i
m
ężczyzn w wieku <70 lat
Kontrola po 3 latach
Komentarz
Przy podejmowaniu decyzji o kontrolnym badaniu DXA bierzemy pod uwag
ę względy;
a) medyczne
b) ekonomiczne
c) „psychologiczne”.
ad.a)
Ze wzgl
ędu na stosunkowo dużą wartość LSC w badaniu szyjki kości udowej i najczęściej
mniejsze roczne zmiany g
ęstości kości b.k.k.u., kontrolne badanie powinno być wykonane nie
wcze
śniej niż po dwóch latach leczenia z medycznego punktu widzenia.
ad.b)
Wzgl
ędy ekonomiczne każą wykonać kontrolne badanie raczej po dwóch latach, ale brak
pewnych danych na ten temat.
ad.c)
Ze wzgl
ędu na długi okres dwóch lat oczekiwania przez pacjenta na ocenę efektów leczenia,
okres jednego roku wydaje si
ę bardziej optymalny. Wybór 1 roku na wykonanie badania
kontrolnego u osób z najbardziej zaawansowan
ą osteoporozą uwzględniał głównie aspekt
„psychologiczny”, co mo
że mieć duże znaczenie dla motywowania chorych do leczenia. Należy
jednocze
śnie podejrzewać, że w najbardziej zaawansowanej osteoporozie, objawiającej się
przebytym złamaniem ko
ści o istotnym znaczeniu klinicznym, istnieje największe ryzyko
szybkiej przemiany kostnej i znacznie nasilonej resorpcji i ryzyko uchwytnych w badaniu DXA
zmian g
ęstości kości już w czasie jednego roku.
40
Komentarz dotycz
ą
cy kontrolnego badania densytometrycznego przy pierwszym
prawidłowym wyniku u kobiet w wieku <65 lat i m
ęż
czyzn w wieku <70 lat
Dla pełnej oceny ryzyka i dynamiki choroby wskazane byłoby wykonanie zawsze 2 bada
ń w
okre
ślonych przedziałach czasowych, w tym przypadku 3 lata. Jest to decyzja arbitralna, a dokładna
analiza ekonomiczna mo
że tego nie potwierdzić.
5.4.2. Kiedy wykona
ć
kolejne kontrolne badanie DXA?
Tab. 20.
A
Leczenie osteoporozy z przebytym osteoporotycznym
złamaniem ko
ści niezależnie od wieku chorego i płci
Badanie co 2 lata w trakcie
leczenia
B
Leczenie osteoporozy bez przebytego osteoporotycznego
złamania ko
ści niezależnie od wieku chorego i płci
Badanie co 2 lata w trakcie
leczenia
C
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
<
65
lat i m
ężczyzn w wieku
<
70 lat, bez istotnego obni
żenia
wyniku DXA w I kontrolnym badaniu
Bez kolejnych bada
ń
kontrolnych
D
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
<
65
lat i m
ężczyzn w wieku
<
70 lat, z istotnym obni
żeniem
wyniku DXA w I kontrolnym badaniu, ale nadal w zakresie
osteopenii
Kontrolne badanie po 2 latach
E
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
<
65
lat i m
ężczyzn w wieku
<
70 lat, z istotnym obni
żenia
wyniku DXA w I kontrolnym badaniu, w zakresie
osteoporozy
Kontrolne badanie po 1 roku
F
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
≥65 lat i mężczyzn w wieku ≥70 lat, bez istotnego
obni
żenie wyniku DXA
Bez kontrolnego badania
G
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
≥65 lat i mężczyzn w wieku ≥70 lat, z istotnym obniżenia
wyniku DXA w I kontrolnym badaniu, ale nadal w
zakresie osteopenii
Bez kontrolnego badania
H
Profilaktyka osteoporozy (osteopenia) u kobiet w wieku
≥65 lat i mężczyzn w wieku ≥70 lat, z istotnym obniżenia
wyniku DXA w I kontrolnym badaniu, w zakresie
osteoporozy
Kontrolne badanie po 1 roku
I
Prawidłowy kontrolny wynik DXA u kobiet w wieku <65
r.
ż. i u mężczyzn w wieku <70 lat z pierwszym wynikiem
prawidłowym
Bez dalszych bada
ń
Komentarz
W przypadku pozytywnej oceny pierwszego kontrolnego badania densytometrycznego nie ma
wskaza
ń do częstszych, niż co dwa lata badań densytometrycznych. Jest to arbitralna propozycja
autora.
W przypadku obni
żenia wyniku badania DXA w pierwszym roku leczenia, należy rozważyć
pomimo wszystko utrzymanie dotychczasowego leczenia, poniewa
ż w drugim roku, u części
chorych obserwuje si
ę wzrost gęstości kości. Ta zmiana wyników, jest wg niektórych powodem do
niewykonywania pierwszego kontrolnego badania DXA po roku leczenia. Jak wspomniano wy
żej,
brano tu jednak pod uwag
ę „czynnik psychologiczny”.

41
6. Jak opisywa
ć
badanie densytometryczne?
Opis badania jest przeznaczony przede wszystkim dla lekarza lecz
ącego osteoporozę.
W opisie badania DXA powinny znale
źć się następujące informacje:
a) warto
ść bezwzględna gęstości kości (w g/cm
2
)
b) warto
ść T-score
c) warto
ść Z-score
d) mo
że być podana wartość wyrażona w % normy wiekowej i w odniesieniu do młodych zdrowych
osób
e) Interpretacja wyniku badania (propozycje opisów):
-
przy badaniu szyjki ko
ści udowej i T-score ≤-2,5 - rozpoznanie „osteoporoza”
-
przy badaniu kr
ęgosłupa lędźwiowego i T-score ≤-2,5 - „wynik badania sugeruje rozpoznanie
osteoporozy”
-
przy badaniu ko
ści promieniowej i T-score ≤-2,5
„Obni
żenie gęstości kości w zakresie kości promieniowej. Dla pełnej oceny gęstości kości i
podj
ęcia decyzji dotyczącej dalszego postępowania, konieczne wykonanie badania DXA w
zakresie szyjki/biodra/kr
ęgosłupa” (nie stosować określenia „osteoporoza”).
Uwaga ta nie dotyczy osób, które z jakiegokolwiek powodu nie mogły mie
ć wykonanego
badania metod
ą osiową.
-
przy wszystkich badaniach i T-score >-2,5 i < -1,0 - „osteopenia” lub „cechy osteopenii”
-
przy wszystkich badaniach i T-score
≥-1 - „wynik gęstości kości prawidłowy”.
f) w przypadku kontrolnego badania informacja o zmianie g
ęstości kości wyrażona w procentach
zmiany g
ęstości w porównaniu do wartości wyjściowej (a nie w punktach procentowych).
W przypadku wykonywania badania DXA innym rodzajem aparatu nie istnieje mo
żliwość
porównania warto
ści bezwzględnych gęstości kości. Należy porównać jedynie wartości T-score,
lub, co prostsze, warto
ści wyrażonej w procentach wartości szczytowej masy kostnej. Różnica
punktów procentowych mo
że nam określić zmianę wyniku gęstości kości w pewnym
przybli
żeniu.
g) Przy warto
ści T-score <-2,0 - sugestia konieczności wykonania badań dodatkowych przed
podj
ęciem ostatecznej decyzji o leczeniu.
h) Sugestie dalszego post
ępowania:
-
czy konieczne kontrolne badanie densytometryczne i kiedy
-
czy konieczne leczenie (bez podawania sposobu leczenia)
-
czy konieczna profilaktyka osteoporozy (bez podawania sposobu profilaktyki).
i) w przypadku warto
ści Z-score<-2,0 w zakresie b.k.k.u. i/lub kręgosłupa lędźwiowego wskazana
informacja o „podejrzeniu osteoporozy wtórnej”.
Komentarz
Na podstawie definicji WHO, do rozpoznania osteoporozy upowa
żnia jedynie wynik badania
DXA w zakresie szyjki ko
ści udowej. Propozycja użycia określenia „sugeruje rozpoznanie
osteoporozy” dla zmian w zakresie kr
ęgosłupa lędźwiowego (T-score ≤-2,5) wynika z przekonania
o istotnym klinicznym znaczeniu badania DXA kr
ęgosłupa lędźwiowego w rozpoznaniu
zwi
ększonego ryzyka złamania kości, szczególnie kręgosłupa. A zwiększone ryzyko złamania
ko
ści to właśnie osteoporoza. Dla pacjentów i części lekarzy, nie używanie słowa „osteoporoza” w
diagnostyce densytometrycznej przy badaniu kr
ęgosłupa może być niezrozumiałe. Badanie DXA
kr
ęgosłupa lędźwiowego, jest obok badania b.k.k.u. od lat najpowszechniej wykonywanym
badaniem densytometrycznym. Pomimo podobnego rozumowania, które mo
żna przeprowadzić w
odniesieniu do pozostałych lokalizacji badania DXA, autor we wszystkich pozostałych
przypadkach proponuje u
żywać określenia „obniżona gęstość kości”.

42
7. Podsumowanie
1.
Zaprezentowana propozycja post
ępowania w osteoporozie charakteryzuje się:
a.
przedstawieniem propozycji post
ępowania na całym etapie diagnostyczno-leczniczym u
chorego z osteoporoz
ą – od pierwszego kontaktu z lekarzem do oceny skuteczności leczenia
b.
prostot
ą
c.
uwzgl
ędnieniem w podejmowaniu decyzji kobiet po 20 r.ż., a przed okresem menopauzy
d.
uwzgl
ędnieniem w podejmowaniu decyzji mężczyzn.
2.
Do czasu wypracowania przez działaj
ące w Polsce Towarzystwa Osteoporotyczne wspólnej
wersji standardów, zaakceptowanej nast
ępnie przez NFZ, zaprezentowana obecnie wersja
zasad post
ępowania w osteoporozie, może służyć jako pomoc lekarzom w codziennej praktyce
dotycz
ącej pacjenta z osteoporozą lub nią zagrożonego.
3.
Do czasu wypracowania przez działaj
ące w Polsce Towarzystwa Osteoporotyczne wspólnej
wersji standardów, zaakceptowanej nast
ępnie przez NFZ, wskazana jest dalsza merytoryczna
dyskusja nad prezentowanym projektem i wszystkimi innymi dost
ępnymi projektami.

43
8. Pi
ś
miennictwo:
1.
Kanis J.A., Johnell O., Oden A. et al.: Diagnosis of osteoporosis and fracture threshold in
men. Calcif Tissue Int, 2001, 69, 218.
2.
O’Neill T.W., Lunt M., Silman A.J. et al.: The relationship between bone density and incident
vertebral fracture in men and women. J Bone Miner Res, 2002, 17, 2214.
3.
Orwoll E., Ettinger M., Weiss S. et al.: Alendronate treatment of osteoporosis in men. N Engl J
Med, 2000, 343, 604.
4.
Ankjaer-Jensen A., Johnell O.: Prevention of osteoporosis: cost effectiveness of different
pharmaceutical treatments. Osteoporos Int, 1996, 6, 265.
5.
Visentin P., Ciravegna R., Fabris F.: Estimating the cost per avoided hip fracture by
osteoporosis treatment in Italy. Maturitas, 1997, 26, 185.
6.
Brown J.P., Josse R.G.: 2002 clinical practice guidelines for the diagnosis and management of
osteoporosis in Canada. CMAJ 2002, 167 (Suppl 10), S1.
7.
Badurski J.E.: Aktualne mo
żliwości oraz wymogi diagnostyki i leczenia osteoporozy
pomenopauzalnej. Polska Fundacja Osteoporozy, Biuletyn Informacyjny, Nr 5/2005.
8.
Delmas P.D.: Treatment of postmenopausal osteoporosis. Lancet, 2002, 359, 2018.
9.
Wu F., Mason B., Horne A., et al.: Fractures between the ages of 20 and 50 years increase
women’s risk of subsequent fractures. Arch Intern Med, 2002, 162, 33.
10.
Burger H., de Laet C.E.D.H., van Daele P.L.A. et al.: Risk factors for increased bone loss in an
elderly population. Am J Epidemiol, 1998, 147, 871.
11.
Cadarette S.M., Jaglal S.B., Kreiger N. et al.: Development and validation of the Osteoporosis
Risk Assessment Instrument to facilitate selection of women for bone densitometry. CMAJ,
2000, 162, 1289 (za: Rosen H.N., Basow D.S.: Screening for osteoporosis,
www.uptodate.com).
12.
Czerwi
ński E.: Zasady rozpoznawania osteoporozy. Medycyna po Dyplomie, 2005, 14, 141.
13.
Kanis J.A., Borgstrom F., De Laet C. et al.: Assessment of fracture risk. Osteoporos Int, 2005,
16, 581.
14.
Kanis J.A.: Diagnosis of osteoporosis and assessment of fracture risk. Lancet, 2002, 359,
1929.
15.
Lydick E., Cook K., Turpin J. et al.: Development and validation of a simple questionnaire to
facilitate identification of women likely to have low bone density. Am J Manag Care, 1998, 4,
37 (za: Rosen H.N., Basow D.S.: Screening for osteoporosis, www.uptodate.com).
16.
Weinstein L., Ullery B.: Identification of at-risk women for osteoporosis screening. Am J
Obstet Gynecol, 2000, 183, 547.
17.
Bernstein C.N., Blanchard J.F., Leslie W. et al.: The incidence of fracture among patients with
inflammatory bowel disease. A population-based cohort study. Ann Intern Med, 2000, 1333,
795.
18.
Cellier C., Flobert C., Cormier C. et al.: Severe osteopenia in symptom-free adults with a
childhood diagnosis of coeliac disease (letter). Lancet, 2000, 3555, 806.
19.
Gregg E.W., Cauley J.A., Seeley D.G. et al.: Physical activity and osteoporotic fracture risk in
older women. Study of Osteoporotic Fracture Research Group. Ann Intern Med, 1998, 157,
1892.
20.
Schwartz A.V., Sellmeyer D.E., Ensrud K.E. et al.: Older women with diabetes have an
increased risk of fracture: a prospective study. J Clin Endocrinol Metab, 2001, 86, 32.
21.
Schett G., Kiechl S., Redlich K. et al.: Soluble RANKL and risk of nontraumatic fracture.
JAMA, 2004, 291, 1108.
22.
Cummings S.R., Nevitt M.C., Browner W.S. et al.: Risk factors for hip fracture in white
women. N Engl J Med, 1995, 332, 767.

44
23.
Llooyd T., Rollings N., Eggli D.F. et al.: Dietary caffeine intake and bone status of
postmenopausal women. Am J Clin Nutr, 1997, 65, 1826.
24.
Reid I.R., Heap S.W.: Determinants of vertebral mineral density in patients receiving long-
term glucocorticoid therapy. Arch Intern Med, 1990, 150, 2545.
25.
Buckley L.M., Leib E.S., Cartularo K.S. et al.: Effects of low dose corticosteroids on the bone
mineral density of patients with rheumatoid arthritis. J Rheumatol, 1995, 22, 1055.
26.
Barbour L.A., Kick S.D., Steiner J.F. et al.: A prospective study of heparin-induced
osteoporosis in pregnancy. Am J Obstet Gynecol, 1994, 170, 862.
27.
Dahlman T.C.: Osteoporotic fractures and the recurrence of thromboembolism during
pregnancy and the puerperium in 184 women undergoing thromboprophylaxis with heparin.
Am J Obstet Gynecol, 1993, 168, 1265.
28.
Farhat G., Yamout B., Mikati M.A. et al.: Effect of antileptic drugs on bone density in
ambulatory patients. Neurology, 2002, 58, 1348.
29.
Monreal M., Lafoz E., Olive A. et al.: Comparison of subcutaneous unfractionated heparin
with low molecular weight heparin (Fragmin) in patients with venous thromboembolism and
contraindications to coumarin. Thromb Haemost, 1994, 71, 7.
30.
Wawrzy
ńska L., Przedlacki J., Hajduk B. et al.: Low-molecular-weight heparins,
acenocoumarol and bone density. Haemostasis, 2001, 31, 69.
31.
Fiore C.E., Tamburino C., Foti R. et al.: Reduced axial bone mineral content in patients taking
an oral anticoagulant. South Med J, 1990, 83, 538.
32.
Guanabens N., Pares A., Navasa M. et al.: Cyclosporin A increases the biochemical markers of
bone remodeling in primary biliary cirrhosis. J Hepatol, 1994, 21, 24.
33.
Cundy T., Farquhar C.M., Cornish J. et al.: Short-term effects of high dose oral
medroxyprogesterone acetate on bone density in premenopausal women. J Clin Endocrinol
Metab, 1996, 81, 1014.
34.
Pfeilschifter J., Diel I.J.: Osteoporosis due to cancer treatment: pathogenesis and management.
J Clin Oncol, 2000, 18, 1570.
35.
Cauley J.A., Cummings S.R., Seeley D.G. et al.: Effects of thiazide diuretic therapy on bone
mass, fractures, and falls. Ann Intern Med, 1993, 118, 666.
36.
Johansson H., Oden A., Johnell O. et al.: Optimization of BMD measurements to identify high
risk groups for treatment – a test analysis. J Bone Miner Res, 2004, 19, 906.
37.
Kanis J.A., Barton I.P., Johnell O.: Risedronate decreases fracture risk in patients selected
solely on the basis of prior vertebral fracture. Osteoporos Int, 2005, 16, 475.
38.
Lewiecki E.M., Watts N.B., McClung M.R. et al.: Official positions of the international society
for clinical densitometry. J Clin Endocrinol Metab, 2004, 89, 3651.
39.
National Osteoporosis Foundation. Physisian’s Guide to Prevention and Treatment of
Osteoporosis (za: Rosen H.N., Basow D.S.: Screening for osteoporosis, www.uptodate.com).
40.
U.S. Preventive Services Task Force. Guide to Clinical Preventive Services. Third Ed. (za:
Rosen H.N., Basow D.S.: Screening for osteoporosis, www.uptodate.com).
41.
American Academy of Family Physician. Age charts for periodic health examination.
American Academy of Family Physicians, Kansas City, MO, 1994 (za: Rosen H.N., Basow
D.S.: Screening for osteoporosis. www.uptodate.com).
42.
Kanis J.A., Johnell O.: Requirements for DXA for the management of osteoporosis in Europe.
Osteoporos Int, 2005, 16, 229.
43.
Black D.M., Cummings S.R., Genant H.K. et al.: Axial and appendicular bone density predict
fractures in older women. J Bone Miner Res, 1992, 7, 633.
44.
Suris E.S., Miller P.D., Barett-Connor E. et al.: Identification and fracture outcomes of
undiagnosed low bone mineral density in postmenopausal women: results from the national
Osteoporosis Risk Assessment. JAMA, 2001, 286, 2815.

45
45.
Cummings S.R., Black D.: Bone mass measurements and risk of fracture in caucasian women:
A review of findings from prospective studies. Am J Med, 1995, 98(Suppl 2A), 24.
46.
Melton L.J. III, Atkinson E.J., O’Fallon W.M. et al.: Long-term fracture prediction by bone
mineral assessed at different skeletal sites. J Bone Miner Res, 1993, 8, 1277.
47.
Bouxsein M., Parker R.A., Greenspan S.L.: Forearm bone mineral densitometry can not be
used to monitor improvements in hip and spine bone density after 2,5 years of alendronate
therapy. Bone, 1998, 23, 312.
48.
Davis J.W., Ross P.D., Wasnich R.D. et al.: Evidence for both generalized and regional low
bone mass among elderly women. J Bone Miner Res, 1994, 9, 305.
49.
Eastell R., Wahner H.W., O’Fallon W.M. et al.: Unequal decrease in bone density of lumbar
spine and ultradistal radius in Colles’ and vertebral fracture syndromes. J Clin Invest, 1989,
83, 168.
50.
Filyton J.P.: New guidelines for the prevention and treatment of osteoporosis. National
Osteoporosis Foundation. Med Health R I, 1999, 82, 110.
51.
Bauer D.C., Gluer C.C., Cauley J.A. et al.: Broadband ultrasound attenuation predicts
fractures strongly and independently of densitometry in older women. Arch Intern Med, 1997,
157, 629.
52.
Khaw K.T., Reeve J., Luben R. et al.: Prediction of total and hip fracture risk in men and
women by quantitative ultrasound of the calceaneous: EPIC-Norfol prospective population
study. Lancet, 2004, 363, 197.
53.
Gluer C.C., Eastell R., Reid D.M. et al.: Association of five quantitative ultrasound devices and
bone densitometry with osteoporotic vertebral fractures in a population-based sample: The
OPUS study. J Bone Miner Res, 2004, 19, 782.
54.
Hodson J., Marsh J.: Quantitative ultrasound and risk factor enquiry as predictors of
postmenopausal osteoporosis: comparative study in primary care. BMJ, 2003, 326, 1250.
55.
Stewart A., Reid D.M.: Quantitative ultrasound or clinical risk factors - which best identifies
women at risk of osteoporosis? Br J Radiol, 2000, 73, 165.
56.
Diez-Perez A., Marin F., Vila J. et al.: Evaluation of calcaneal quantitative ultrasound in a
primary care settings as a screening tool for osteoporosis in postmenopausal women. J Clin
Densitom, 2003, 6, 237.
57.
Varney L.F., Parker R.A., Vincelette A. et al.: Classification of osteoporosis and osteopenia in
postmenopausal women is dependent on site-specific analysis. J Clin Densitom, 1999, 2, 275.
58.
Marin F., Lopez-Bastida J., Diez-Perez A. et al.: Bone mineral density referral for dual-energy
X-ray absorptiometry using quantitative ultrasound as a prescreening tool in postmenopausal
women from the general population: a cost-effectiveness analysis. Calcif Tissue Int, 2004, 74,
277.
59.
McLaren A.M., Hordon L.D., Bird H.A. et al.: Urinary excretion of pyridinium crosslinks of
collagen in patients with osteoporosis and the effects of bone fracture. Ann Rheum Dis, 1992,
51, 648.
60.
Hansen M.A., Overgaard K., Riis B.J. et al.: Role of peak bone mass and bone loss in
postmenopausal osteoporosis: 12 year study. BMJ, 1991, 303, 961.
61.
Cadarette S.M., Jaglal S.B., Murray T.M. et al.: Evaluation of decision rules for referring
women for bone densitometry by dual-energy x-ray absorptiometry. JAMA, 2001, 286, 57.
62.
Badurski J.E., Nowak N.A., Lis J. i wsp.: Epidemiologia osteoporozy u kobiet w aglomeracji
Białegostoku (BOS): G
ęstość kości a złamania. Postępy Osteoartrologii, 2003, 14, 1.
63.
Wainwriht S.A. et al.: A large proportion of fractures in postmenopausal women occur with
baseline bone mineral density T-score > -2.5. J Bone Miner Res, 2001, 16, 155.
64.
Dawson-Hughes B., Dallal G.E., Krall E.A. et al.: A controlled trial of the effect of calcium
supplementation on bone density in postmenopausal women. N Engl J Med, 1990, 323, 878.

46
65.
Reid I.R., Ames R.W., Evans M.C. et al.: Effect of calcium supplementation on bone loss in
postmenopausal women. N Engl J Med, 1993, 328, 460.
66.
Storm D., Eslin R., Porter E.S. et al.: Calcium supplementation prevents seasonal bone loss
and changes in biochemical markers of bone turnover in elderly New England women: a
randomized placebo-controlled trial. J Clin Endocrinol Metab, 1998, 83, 3817.
67.
Dawson-Hughes B., Harris S.S., Krall E.A. et al.: Effect of calcium and vitamin D
supplementation on bone density in men and women 65 years of age or older. N Engl J Med,
1997, 337, 670.
68.
Cumming R.G., Cummings S.R., Nevitt M.C. I. et al.: Calcium intake and fracture risk: results
from the Study of Osteoporotic Fractures. Am J Epidemiol, 1997, 145, 926.
69.
Owusus W., Willett W.C., Feskanich D. et al.: Calcium intake and the incidence of forearm
and hip fractures among men. J Nutr, 1997, 127, 1782.
70.
NIH Consensus Development Panel on Optimal Calcium Intake. Optimal calcium intake.
JAMA, 1994, 272, 1942.
71.
Whiting S.J., Wood R.J.: Adverse effects of high-calcium diets in humans. Nutr Rev, 1997, 55,
1.
72.
Cook J.D., Dassenko S.A., Whittaker P.: Calcium supplementation: effect on iron absorption.
Am J Clin Nutr, 1991, 53, 106.
73.
Tsai K.S., Wahner H.W., Offord K.P. et al.: Effect of aging on vitamin D stores and bone
density in women. Calcif Tissue Int, 1987, 40, 241.
74.
MacLauhghlin J., Holick M.F.: Aging decreases the capacity of human skin to produce vitamin
D3. J Clin Invest, 1985, 6, 1536.
75.
Pattanaungkul S., Riggs B.L., Yergey A.L. et al.: Relationship of intestinal calcium absorption
to 1,25-dihydroxyvitamin D [1,25(OH)
2
D] levels in young versus elderly women: evidence for
age-related intestinal resistance to 1,25(OH)2D action. J Clin Endocrinol Metab, 2000, 85,
4023.
76.
Thomas M.K., Lloyd-Jones D.M., Thandhani R.I. et al.: Hypovitaminosis D in medical
inpatients. N Eng J Med, 1998, 338, 777.
77.
Bischoff-Ferrari H.A., Dietrich T., Orav E.J. et al.: Positive association between 25-
hydroxyvitamin D levels and bone mineral density: a population-based study of younger and
older adults. Am J Med, 2004, 116, 634.
78.
Villareal D.T., Civitelli R., Chines A. et al.: Subclinical vitamin D deficiency in
postmenopausal women with low vertebral bone mass. J Clin Endocrinol Metab, 1991, 72, 628.
79.
Aaron J.E., Gallgher J.C., Anderson J. et al.: Frequency of osteomalacia and osteoporosis in
fractures of proximal femur. Lancet, 1974, 1, 229.
80.
Chapuy M.C., Arlot M.E., Duboeuf F. et al.: Vitamin D3 and calcium to prevent hip fractures
in elderly women. N Eng J Med, 1992, 327, 1637.
81.
The Record Trial Group. Oral vitamin D3 and calcium for secondary prevention of low-trauma
fractures in elderly people (Randomized Evaluation of Calcium Or vitamin D, RECORD): a
randomized placebo-controlled trial. Lancet, 2005, 365, 1621.
82.
Bischoff-Ferrari H.A., Stacheli H.B., Dick W. et al.: Effects of vitamin D and calcium
supplementation on falls: a randomized controlled trial. J Bone Miner Res, 2003, 18, 343.
83.
Holic M.F.: Vitamin D and the skin. Photobiology, physiology and therapeutic efficacy. J Bone
Miner Res, 1990, 5, 313.
84.
Tsai K.S., Health III H., Kumar R. et al.: Impaired vitamin D metabolism with aging in women.
Possible role in pathogenesis of senile osteoporosis. J Clin Invest, 1984, 73, 1668.
85.
Slovik D.M., Adams J.S., Neer R.M. et al.: Deficient production of 1,25-dihydroxyvitamin D in
elderly osteoporotic patients. N Engl J Med, 1981, 305, 372.
86.
Cooper C., Wickham C., Coggon D.: Sedentary work in middle life and fracture of the
proximal femur. Br J Ind Med, 1990, 47, 69.

47
87.
Joakimsen R.M., Fonnebo V., Magus J.H. et al.: The Trompo Study: physical activity and the
incidence of fractures in a middle-age population. J Bone Miner Res, 2000, 15, 710.
88.
Close J., Ellis M., Hooper R. et al.: Prevention of falls in the elderly trial (PROFET): a
randomised controlled trial. Lancet, 1999, 353, 93.
89.
Taaffe D.R., Duret C., Wheeler S. et al.: Once-weekly resistance exercise improves muscle
strength and neuromuscular performance in older adults. J Am Geriatr Soc, 1999, 47, 1208.
90.
Lindsay R., Cosman F., Lobo R.A. et al.: Addition of alendronate to ongoing hormone
repalacement therapy in the treatment of osteoporosis: a randomized, controlled clinical trial.
J Clin Endocrinol Metab, 1999, 84, 3076.
91.
Greenspan S.L., Bone G. 3rd, Schnitzer T.J. et al.: Two-year results of once-weekly
administration of alendronate 70 mg for the treatment of postmenopausal osteoporosis. J Bone
Miner Res, 2002, 17, 1988.
92.
Schnitzer T., Bone H.G., Crepaldi G. et al.: Therapeutic equivalence of alendronate 70 mg
once-weekly and alendronate 10 mg daily in the treatment of osteoporosis. Aging, 2000, 12, 1.
93.
Black D.M., Cummings S.R., Karpf D.B. et al.: Randomised trial of effect of alendronate on
risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial
Research Group. Lancet, 1996, 348, 1535.
94.
Pols H.A.P., Felsenberg D., Hanley D.A. et al.: A multinational, placebo-controlled,
randomized study of the effects of alendronate on bone density and fracture risk in
postemenopausal women with low bone mass: Results of the FOSIT Study. Osteoporos Int,
1999, 9, 461.
95.
Cummings S.R., Black D.M., Thompson D.E. et al.: Effect of alendronate on risk of fracture in
women with low bone density but without vertebral fractures: results from the Fracture
Intervention Trial. JAMA, 1998, 280, 2077.
96.
Bone H.G., Hosking D., Devogelaer J.P. et al.: Ten years experience with alendronate for
osteoporosis in postmenopausal women. N Engl J Med, 2004, 350, 1189.
97.
Ensrud K.E., Barret-Connor E.L., Schwartz A. et al.: Randomized trial of effect of alendronate
continuation versus discontinuation in women with low BMD: results from the Fracture
Intervention Trial long-term extension. J Bone Miner Res, 2004, 19, 1259.
98.
Harris S.T., Watts N.B., Genant H.K. et al.: Effects of risedronate treatment on vertebral and
nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled
trial. Vertebral Efficacy With Risedronate Therapy (VERT) Study Group. JAMA, 1999, 282,
1344.
99.
Reginster J.Y., Minne H.W., Sorensen O.H. et al.: Randomized trial of the effects of
risedronate on vertebral fractures in women with established postmenopausal osteoporosis.
Osteoporos Int, 2000, 11, 83.
100.
McClung M.R., Geusens P., Miller P.D. et al.: Effects of risedronate on the risk of hip fracture
in elderly women. N Engl J Med, 2001, 344, 333.
101.
Mellstrom D.D., Sorensen O.H., Goemaere S. et al.: Seven years of treatment with risedronate
in women with postmenopausal osteoporosis.
Calcif Tissue Int, 2004, 75, 462.
102.
Harris S.T., Watts N.B., Li Z. et al.: Two-year efficacy and tolerability of risedronate once a
week for the treatment of women with postmenopausal osteoporosis. Curr Med Res Opin,
2004, 20, 757.
103.
Khovidhunkit W., Shoback D.M.: Clinical effects of raloxifene hydrochloride in women. Ann
Intern Med, 1999, 130, 431.
104.
Delmas P.D., Bjarnason N.H., Mitlak B.H. et al.: Effects of raloxifene on bone mineral density,
serum cholesterol concentration, and uterine endometrium in postmenopausal women. N Engl
J Med, 1997, 337, 1641.
105.
Johnston C.C. Jr, Bjarnason N.H., Cohen F.J. et al.: Long-term effects of raloxifene on bone
mineral density, bone turnover, and serum lipid levels in early postmenopausal women: three-

48
year data from 2 double-blind, randomized, placebo-controlled trials. Arch Intern Med, 2000,
160, 3444.
106.
Ettinger B., Black D.M., Mitlak B.H. et al.: Reduction of vertebral fracture risk in
postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year
randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators.
JAMA, 1999, 282, 637.
107.
Delmas P.D., Ensrud K.E., Adachi J.D. et al.: Efficacy of raloxifene on vertebral fracture risk
reduction in postmenopausal women with osteoporosis: four-year results from a randomized
clinical trial. J Clin Endiocrinol Metab, 2002, 87, 3609.
108.
Delmas P.D., Genant H.K., Crans G.G. et al.: Severity of prevalent vertebral fractures and the
risk of subsequent vertebral and nonvertebral fractures: results from the MORE trial. Bone,
2003, 33, 522.
109.
Johnell O., Scheele W.H., Lu Y. et al.: Additive effects of raloxifene and alendronate on bone
density and biochemical markers of bone remodeling in postmenopausal women with
osteoporosis. J Clin Endocrinol Metab, 2002, 87, 985.
110.
Prestwood K.M., Gunness M., Muchmore D.B. et al.: A comparison of the effects of raloxifene
and estrogen on bone in postmenopausal women. J Clin Endocrinol Metab, 2000, 85, 2197.
111.
Neele S.J., Evertz R., De Valk-De R. et al.: Effect of 1 year of discontinuation of raloxifene or
estrogen therapy on bone mineral density after 5 years of treatment in healthy postmenopausal
women. Bone, 2002, 30, 599.
112.
Meunier P.J., Slosman D.O., Delmas P.D. et al.: Strontium ranelate: dose-dependent effects in
established postmenopausal vertebral osteoporosis – a 2-year randomized placebo controlled
trial. J Clin Endocrinol Metab, 2002, 87, 2060.
113.
Meunier P.J., Roux C., Seeman E. et al.: The effects of strontium ranelate on the risk of
vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med, 2004, 350, 459.
114.
Reginster J.Y., Seeman E., De Vernejoul M.C. et al.: Strontium ranelate reduces the risk of
nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral
Osteoporosis (TROPOS) study. J Clin Endocrinol Metab, 2005, 90, 2816.
115.
Cosman R., Lindsay R.: Therapeutic potential of parathyroid hormone. Curr Osteoporos Rep,
2004, 2, 5.
116.
Neer R.M., Arnaud C.D., Zanchetta J.R. et al.: Effect of parathyroid hormone (1-34) on
fractures and bone mineral density in post-menopausal women with osteoporosis. N Engl J
Med, 2001, 344, 1434.
117.
Black D.M., Greenspan S.L., Ensrud K.E. et al.: The effects of parathyroid hormone and
alendronate alone or in combination in postmenopausal osteoporosis. N Engl J Med, 2003,
349, 1207.
118.
Finkelstein J.S., Hayes A., Hunzelman J.L. et al.: The effects of parathyroid hormone,
alendronate, or both in men with osteoporosis. N Engl J Med, 2003, 349, 1216.
119.
Chestnut C.H. III, Silverman S., Andriano K. et al.: A randomized trial of nasal spray salmon
calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of
osteoporotic fractures study. PROOF Study Group. Am J Med, 2000, 109, 267.
120.
Gennari C.: Analgesic effect of calcitonin in osteoporosis. Bone, 2002, 30, Suppl. 5, 67.
121.
Appelboom T.: Calcitonin in reflex sympathetic dystrophy syndrome and other conditions.
Bone, 2002, 30, Suppl. 5, 84.
122.
Micieli G., Cavallini A., Martignoni E. et al.: Effectiveness of salmon calcitonin nasal spray
preparation in migraine treatment. Headache, 1988, 28,196.
123.
Jaeger H.: Calcitonin in phantom limb pain: a double-blind study. Pain, 1992, 48, 21.
124.
Cummings S.R., Kelsey J.L., Nevitt M.C. et al.: Epidemiology of osteoporosis and
osteoporotic fractures. Epidemiol Rev, 1985, 7, 178.

49
125.
Okano H., Mizunama H., Soda M. et al.: The long term effect of menopause on
postemenopausal bone loss in Japanese women: results from a prospective study. J Bone
Miner Res, 1998, 13, 303.
126.
Copper C., Stakkestad J.A., Radowicki S. et al.: Matrix delivery transdermal 17beta-estradiol
for the prevention of bone loss in postmenopausal women. Osteoporos Int, 1999, 9, 358.
127.
Recker R.R., Davies K.M., Dowd R.M. et al.: The effect of low-dose continuous estrogen and
progesterone therapy with calcium and vitamin D on bone in elderly women. A randomized,
controlled trial. Ann Intern Med, 1999, 130, 897.
128.
Lufkin E.G., Wahner H.W., O’Fallon W.M. et al.: Treatment of postemenopausal osteoporosis
with transdermal estrogen. Ann Intern Med, 1992, 117, 1, 128.
129.
Writing Group for the Women’s Initiative Investigators. Risk and benefits of estrogen plus
progestin in healthy postmenopausal women: principal results from the Women’s Health
Initiative Randomized Controlled Trial. JAMA, 2002, 288, 321.
130.
Meunier P.J., Sebert J.L., Reginster J.Y. et al.: Fluoride salts are no better at preventing new
vertebral fractures than calcium-vitamin D in postmenopausal osteoporosis: the FAVO Study.
Osteoporos Int, 1998, 8, 4.
131.
Gambacciani M., Sopinetti A., Taponeco F. et al.: Treatment of postmenopausal vertebral
osteopenia with monofluorophosphate: a long-term calcium-controlled study. Osteoporos Int,
1995, 5, 467.
132.
Riggs B.L., Hodgson S.F., O’Fallon W.M. et al.: Effect of fluoride treatment on the fracture
rate in postmenopausal women with osteoporosis. N Engl J Med, 1990, 322, 802.
133.
Ringe J.D., Faber H., Dorst A.: Alendronate treatment of established primary osteoporosis in
men: results of a 2-year prospective study. J Clin Endocrinol Metab, 2001, 86, 5252.
134.
Katznelson L., Finkelstein J.S., Schoenfeeeld D.A. et al.: Increase in bone density and lean
body mass during testosterone administration in men with acquired hypogonadism. J Clin
Endocrinol Metab, 1996, 81, 4358.
135.
Behre H.M., Kliesch S., Leifke F. et al.: Long-term effect of testosterone therapy on bone
mineral density in hypogonadal men. J Clin Endocrinol Metab, 1997, 82, 2386.
136.
Snyder P.J., Peachey H., Hannoush P. et al.: Effect of testosterone treatment on bone mineral
density in men over 65 years of age. J Clin Endocrinol Metab, 1999, 84, 1966.
137.
Greenspan S.L., Emkey R.D., Bone H.G. et al.: Significant differential effects of alendronate,
estrogen, or combination therapy on the rate of bone loss after discontinuation of treatment of
postmenopausal osteoporosis. A randomized, double-blind, placebo-controlled trial. Ann
Intern Med, 2002, 137, 875.
138.
Harrington J.T., Ste-Marie L.G., Brandi M.L. et al.: Risedronate rapidly reduces the risk for
nonvertebral fractures in women with postmenopausal osteoporosis. Calcif Tissue Int, 2004,
74, 129.
139.
Roux C., Seeman E., Eastell R. et al.: Efficacy of risedronate on clinical vertebral fractures
within six months. Curr Med Res Opin, 2004, 20, 433.
140.
Gluer C-C., Blake G., Lu Y. et al.: Accurate assessment of precision errors: How to measure
the reproducibility of bone densitometry techniques. Osteoporos Int, 1995, 5, 262.
141.
Lewiecki E.M.: Nonresponders to osteoporosis therapy. J Clin Densitom, 2003, 6, 307.
142.
Cummings S.R., Palermo L., Browner W. et al.: Monitoring osteoporosis therapy with bone
densitometry. Misleading changes and regression to the mean. JAMA, 2000, 283, 1318.
143.
Rosen H.N., Moses A.C., Garber J. et al.: Utility of biochemical markers of bone turnover in
the follow-up of patients with bisphosphonates. Calcif Tissue Int, 1998, 63, 363.
50
Kobiet
y
< 65 lat
> 65 lat
<
-2,
0
> -2
,0
<
-2,
0
> -2
,0
1 D
Płe
ć
Wie
k
DXA
Cz. ry
zy
ka
2 M
0
2 M
1 D
0
2 M
0
1 D
2 M
1 D
0
Decy
zje
TA
K
TA
K
NI
E
TA
K
NI
E
NI
E
TA
K
NI
E
TA
K
NI
E
NI
E
NI
E
Dec
y
z
je leczni
cze u kobiet
na
podsta
w
ie
w
y
niku badania DX
A
b.k.
k.u.
i obecno
ś
ci cz
y
n
ników
ry
z
y
k
a
złamania ko
ś
ci
.
TA
K
T-scor
e
1
D
u
ż
y; 2
M
ałe
;
0
-bez
Ry
c
. 1
Złam
a
n
ie
osteo
p
o
rot
ycz
n
e
kręgo
sł
up
a
i b.
k
.k.
u
.
Ka
ż
dy
wyn
ik
Ka
ż
dy
wi
e
k
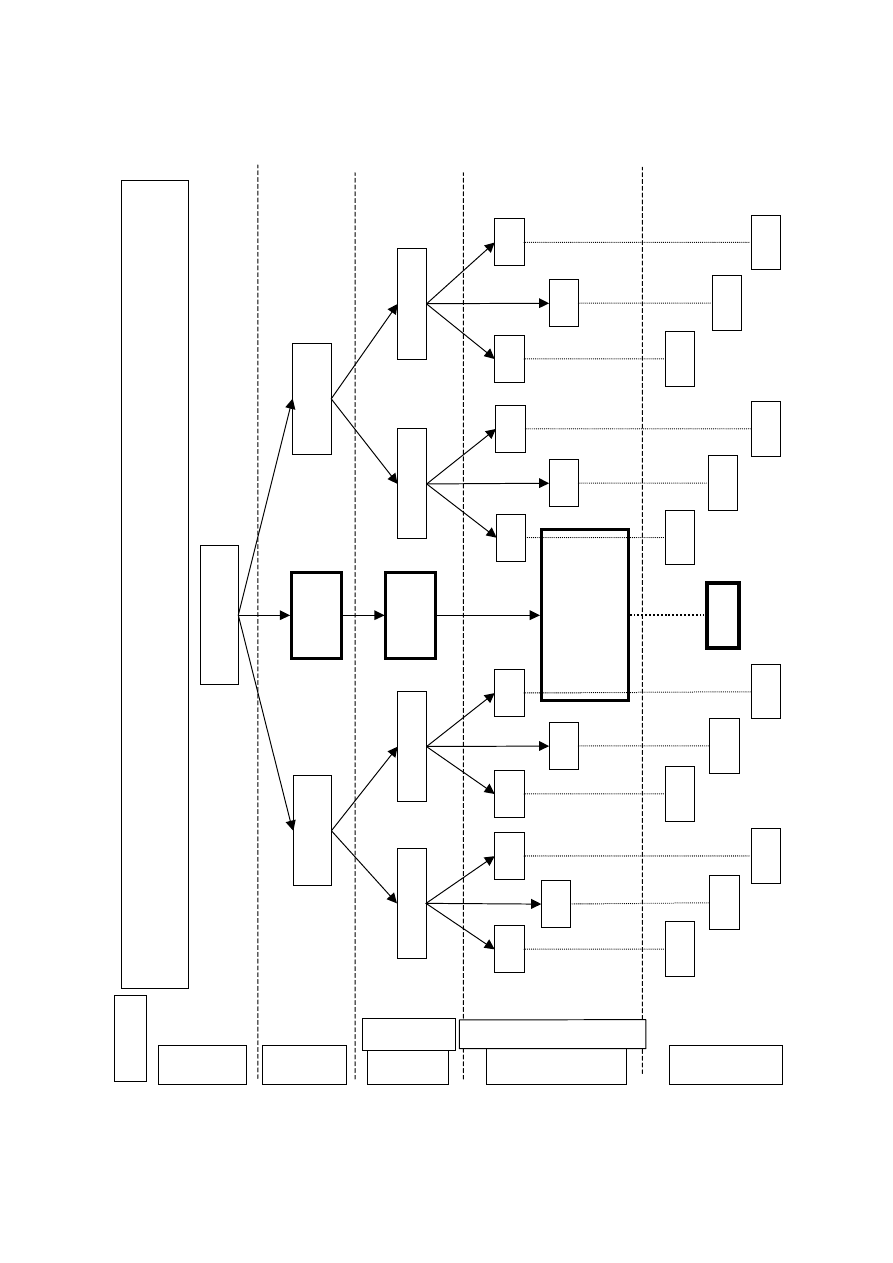
51
M
ęż
czy
ź
ni
< 70 lat
> 70
lat
<
-2
,0
> -2
,0
<
-2
,0
> -2
,0
1 D
Płe
ć
Wie
k
DXA
Cz. ry
zy
ka
2 M
0
2 M
1 D
0
2 M
0
1 D
2 M
1 D
0
Decy
zje
TA
K
TA
K
NI
E
TA
K
NI
E
NI
E
TA
K
NI
E
TA
K
NI
E
NI
E
NI
E
Dec
y
zje lecznicze u m
ęż
cz
y
z
n na podsta
w
ie
w
y
niku badania DX
A
b.k.k.u. i obecno
ś
ci cz
y
n
nikó
w
ry
z
y
ka złamania ko
ś
ci.
TA
K
T-scor
e
1
D
u
ż
y; 2
M
ałe
;
0
-be
z
Ry
c
. 2
Z
ła
manie
o
s
te
opo
ro
ty
cz
ne
k
ręgos
łup
a
i b.k.k
.u.
Ka
ż
dy
wy
n
ik
Ka
ż
dy
wi
e
k
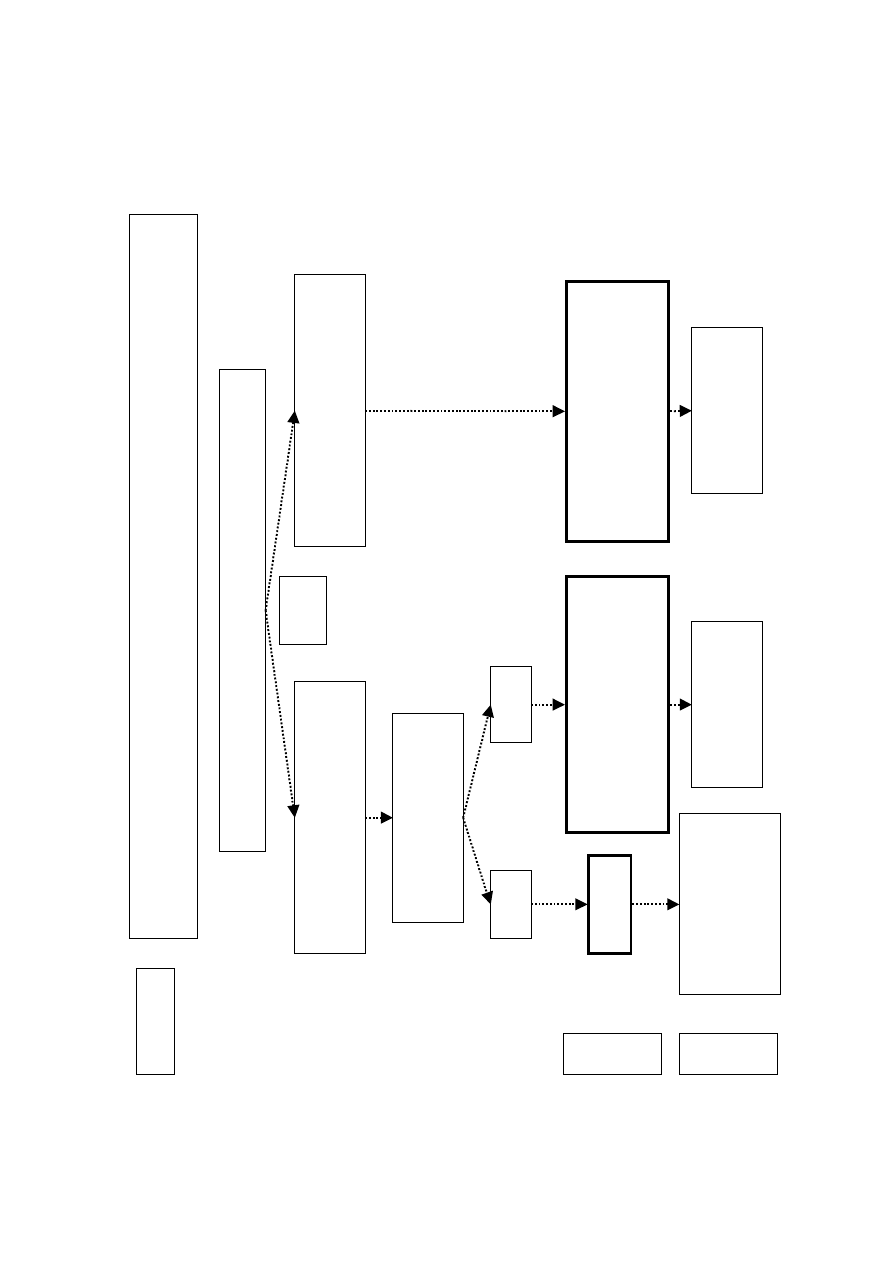
52
Lecz
eni
e ost
e
o
p
o
ro
z
y
pom
eno
pa
uzal
ne
j
Po
st
ępowa
n
ie
nief
ar
ma
ko
lo
g
ic
zne
B
ez zł
am
an
ia
os
te
op
or
ot
yc
z
n
e
g
o
Z
e
zł
am
an
ie
m
os
te
op
or
ot
yc
z
n
ym
Obj
a
wy
n
aczy
n
io
ru
c
h
o
w
e
Ta
k
Nie
HT
Z
Bisf
o
sf
o
nia
n
y
Ra
ne
linia
n
str
o
n
tu
SE
RM
Bisf
o
sf
o
nia
n
y
SE
RM
Ka
lc
y
to
n
ina
Ka
lc
y
to
n
ina
HT
Z
Bisf
o
sf
o
nia
n
y
Ra
ne
linia
n
str
o
ntu
SE
RM
K
a
lc
y
to
n
ina
HT
Z
I rzut
II rzut
+
Ry
c
. 3
Wyszukiwarka
Podobne podstrony:
Osteoporoza diagnostyka i leczenie
Postepowanie w osteoporozie - podsumowanie, Ratownictwo medyczne, Ortopedia
Postępowanie zapobiegawcze i diagnostyczne w przypadku zakażenia HIV i zachorowania na AIDS Obowiązu
Osteoporosis ľ diagnosis and treatment
DIAGNOSTYKA, PROFILAKTYKA I LECZENIE OSTEOPOROZY 2
Postępowanie diagnostyczno profilaktyczno lecznicze w atopowym zapaleniu skóry
POSTEPOWANIE DIAGNOSTYCZNE--4 no we, Diagnostyka...Ronikier wyk, agi i iwonki materiały
POSTĘPY W DIAGNOSTYCE I TERAPII UDARÓW NIEDOKRWIENNYCH MÓZGU
Osteoporoza, Osteoporoza (dawna nazwa zrzeszotnienie kości) - stan chorobowy charakteryzujący się po
DIAGNOSTYKA, PROFILAKTYKA I LECZENIE OSTEOPOROZY 3
NIE ZGRANE DZIECKO ZABURZENIA P DIAGNOZA I POSTePOWANIE Kranowi
Ginekologia W2 03 03 2014 diagnostyka i postępowanie ratunkowe w przemocy seksualnej
opis testow do badaniqa organiki, Psychologia UŚ, Semestr VIII, PZ Klniczna - Podstawy klinicznej di
więcej podobnych podstron