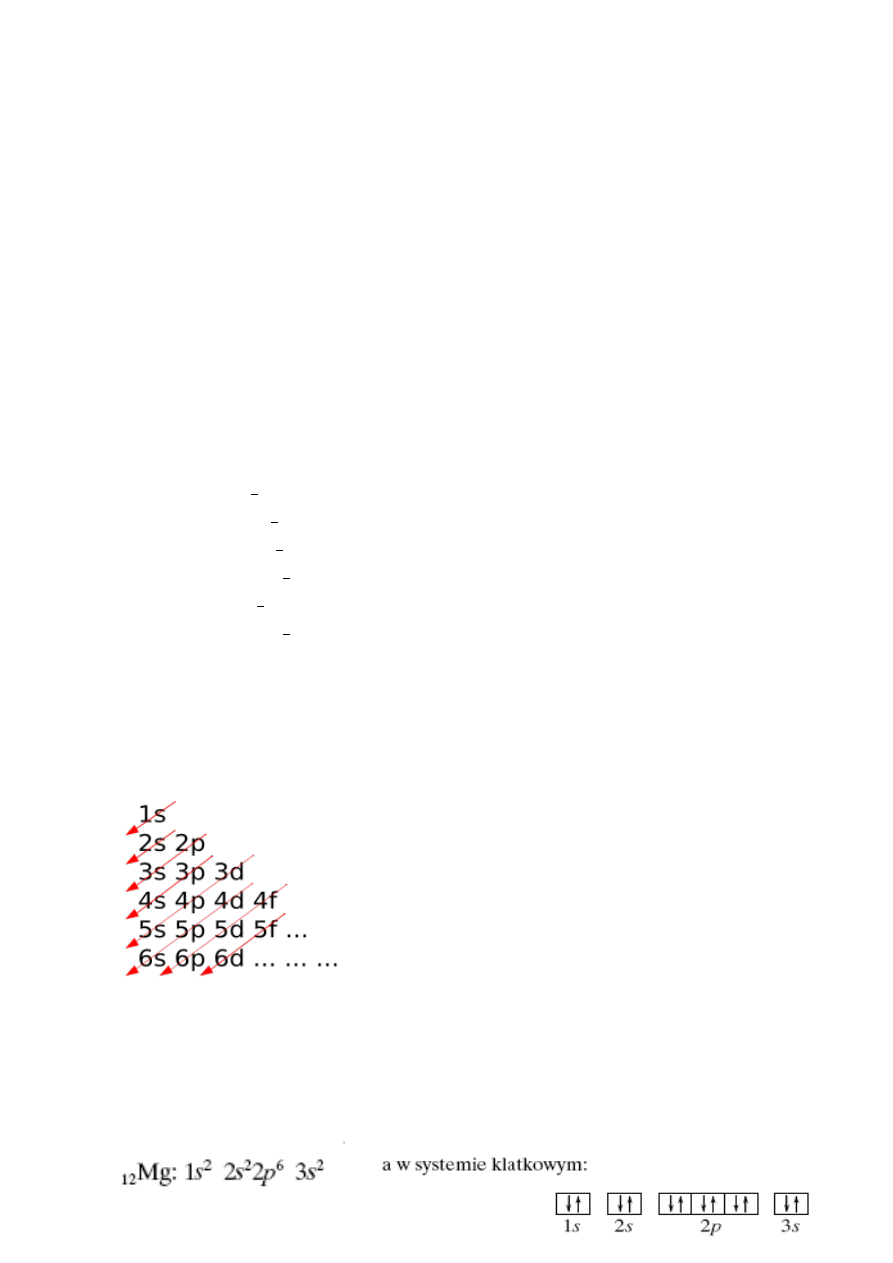
Chemia opracowanie
1. Budowa materii: pierwiastki, liczba atomowa, masowa, konfiguracja elektronowa,
orbitale.
Obecnie materia dzieli się na trzy stany skupienia:
Gazy
Ciecze
Ciało stałe
Niesklasyfikowane są plazma i ciekły kryształ, gdyż posiadają właściwości więcej niż jednego stanu
skupienia. Zaś ciała stałe dzielą się na amorficzne i krystaliczne.
Atomy składają się z protonów (p) i neutronów (n) (nukleonów) umieszczonych w jądrze i elektronów
(e) krążących wokół jądra.
𝑋
𝑍
𝐴
A – liczba masowa neutrony +protony
Z – liczba protonów/elektronów
A-Z neutronów
Cząsteczkami, z których składają się nukleony i elektrony są kwarki, istnieje sześć rodzajów kwarków:
Up +
2
3
Down −
1
3
Charm +
2
3
Strange −
1
3
Top +
2
3
Bottom −
1
3
Proton składa się z dwóch kwarków górnych i jednego dolnego, suma ich ładunków daje +1. Neutron
składa się z jednego kwarka górnego i dwóch dolnych, suma ładunków = 0.
Pierwiastek to inaczej substancja prosta, jego atomy zachowują te same właściwości. Inaczej
substancja, która zawiera jednakową ilość protonów w jądrze.
Powłokę elektronową tworzą elektrony krążące w tej samej odległości wokół jądra. Powłok może być
maksymalnie 7. Ilość elektronów na każdej powłoce określa wzór 2n
2
., Czyli na pierwszej powłoce
mogą być 2 elektrony, a na 7 aż 98 elektronów. Poniżej kolejność zapełniania powłok elektronowych
wraz z podpowłokami. Podpowłoki powstają wskutek dużej ilości elektronów na
powłoce. Oddziałują one na siebie wzajemnie odpychająco, powodując
rozszczepienie powłok, na podpowłoki. Orbital to część podpowłoki, na której
jest największe prawdopodobieństwo znalezienia elektronu. Wg reguły
Hunda najpierw zapełnia się orbitale tak, by elektrony były na nich
niesparowane, elektrony te posiadają wtedy jednakową orientację
spinu, dzieje się tak, gdyż elektrony starają wybierać stan kwantowy
o najniższej energii. Następnie wg zakazu Pauli’ego, gdy na jednym
orbitalu pojawią się dwa elektrony, muszą mieć one przeciwny
spin. ↑ - spin zgodny z ruchem wskazówek zegara, ↓ - odwrotny.
Ilość orbitali na podpowłokach:
s – jeden orbital, ma kształt sfery,
p – trzy, mają kształt 8 nabitej na oś
d – pięć, mają kształty 8 i pierścienia wokół środka (dziwne bajery)
f – siedem,
itd.
Przykłady konfiguracji elektronowej z uwzględnieniem wszystkich zasad:
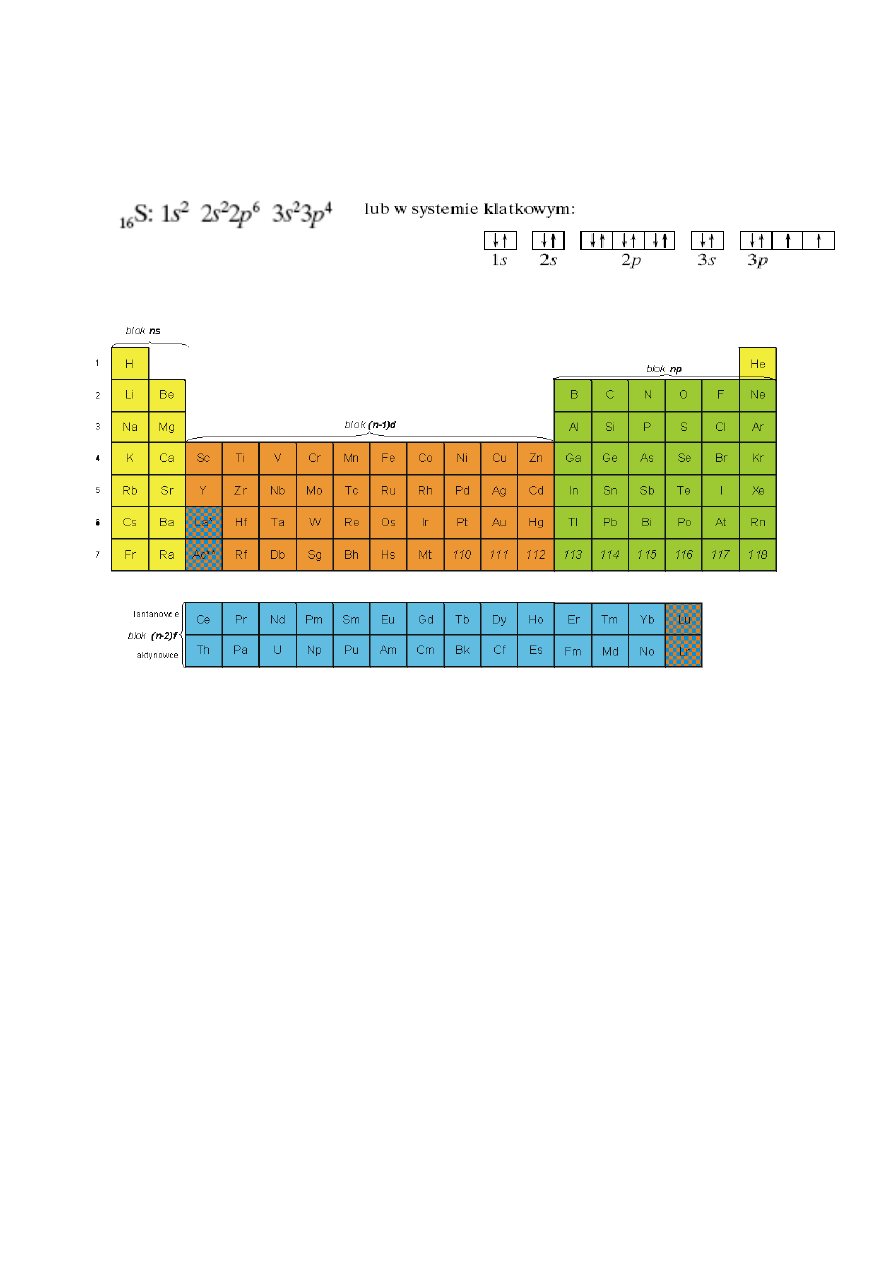
2. Układ okresowy, struktura, grupy pierwiastków, izotopy, roztwory, mieszaniny, związki.
W grupach głównych wszystkie elektrony z powłoki walencyjnej zajmują orbitale typu: s i p, w
grupach pobocznych orbitale: s i d, a w grupie lantanowców i aktynowców orbitale: s, d i f. Jest to
podstawą do podzielenia układu okresowego na bloki: s i p (grupy główne), d (grupy poboczne) oraz f
(lantanowce i aktynowce). W większości współczesnych, graficznych przedstawień układu
okresowego grupy główne są rozdzielone za drugą grupą całym blokiem d, a blok f jest "wyciągnięty"
pod połączone bloki s, p i d. Pierwiastki danego okresu mają tę samą liczbę powłok elektronowych.
Pierwiastki należące do tej samej grupy charakteryzują się tą samą liczbą elektronów walencyjnych, a
w konsekwencji podobnymi właściwościami chemicznymi.
Izotop – odmiana pierwiastka o innej liczbie neutronów, może posiadać inne właściwości fizyczne i
chemiczne. Najbardziej znanymi izotopami, są izotopy wodoru, tzn. prot, deuter i tryt. Deuter ma
zdolność spowalniania neutronów, używa się go do tworzenia ciężkiej wody D
,2O, która
z kolei jest
używana w elektrowniach jądrowych. Tryt używany jest, jako wskaźnik wieku. Ze względu na różnicę
mas atomowych izotopów danego pierwiastka, zmieniać się mogą też właściwości fizyczne i
chemiczne. Izotopy promieniotwórcze znajdują zastosowanie w wielu dziedzinach techniki, a nawet
medycyny. Izotopy z grubsza dzielą się na:
Trwałe – nie ulegają samorzutnie przemianie na inne pierwiastki,
Nietrwałe – ulegają samorzutnej przemianie na izotopy innych pierwiastków,
wydzielając promieniowanie γ i E
k
Substancje chemiczne:
Proste - pierwiastki
Złożone:

o Związki chemiczne – powstaje w wyniku połączenia się substancji prostych
jakimkolwiek wiązaniem chemicznym, ma inne właściwości od swoich
składników, sumaryczny ładunek musi wynosić 0
o Mieszaniny – zwykłe wymieszanie dwóch lub więcej substancji,
Jednorodne – nierozróżnialne składniki gołym okiem, utracenie części
właściwości, np. woda z solą.
Niejednorodne – rozróżnialne składniki, łatwe oddzielanie,
zachowanie większości właściwości składników.
Roztwór – mieszanina jednorodna. Składa się z rozpuszczalnika i substancji rozpuszczanej. Rodzaje:
Właściwy – roztwór jednofazowy o bardzo małych cząsteczkach
Koloidalny – roztwór dwufazowy, składa się z fazy ciągłej i fazy rozproszonej,
zawieszonej w ośrodku, nierozpuszczalnej w nim.
Rozpuszczalność jest to maksymalna liczba gramów substancji, którą można rozpuścić w 100 g
rozpuszczalnika w danej temperaturze, aby otrzymać roztwór nasycony. Zależy od temperatury,
ciśnienia, rozpuszczalnika i substancji rozpuszczanej.
Roztwór nasycony – taki, w którym w danej temperaturze nie można już więcej rozpuścić danej
substancji.
Roztwór nienasycony – taki, w którym można.
3. Wiązania (oddziaływania) chemiczne, mechanizm.
1. Rodzaje wiązań w ciałach stałych:
Jonowe (heteropolarne) – polega na przekształcaniu się dwóch atomów w kation i
anion a następnie na elektrostatycznym przyciąganiu się różnoimiennych ładunków.
Jeden z atomów – później anion oddaje część swoich elektronów walencyjnych
drugiemu atomowi – później kationowi, by ten mógł utworzyć oktet elektronowy.
Najczęściej kationem zostaje metal, anionem niemetal. Zachodzi, gdy różnica
elektroujemności jest większa niż 1,7. Ze względu na różnicę ładunku (+ i -) oba
atomy się przyciągają.
Kowalencyjne (homopolarne) – występuje pomiędzy atomami o średniej różnicy
elektroujemności (0-0,4) i zarazem o wysokiej elektroujemności. Polega na
uwspólnieniu pary(bądź par) elektronów, które krążą, jako chmura elektronowa
wokół obu jąder atomowych. Istnieje wiązanie kowalencyjne niespolaryzowane i
spolaryzowane. To pierwsze występuje, gdy łączą się te same pierwiastki niemetalu.
O
2
. Zaś spolaryzowane powstaje, gdy łączą się różne pierwiastki, powoduje to
powstawanie dipoli z połączonych pierwiastków,
Metaliczne – powstaje między pierwiastkami metali, których różnica
elektroujemności wynosi maks. 0,4. Polega na oderwaniu się elektronów
walencyjnych od atomu i powstawanie kationów, wokół których znajduje się gaz
elektronowy z oderwanych elektronów, elektrony walencyjne mogą się swobodnie
poruszać wokół kationów, powoduje to powstanie pasma przewodnictwa,
Międzycząsteczkowe (siły van der Walsa) – najsłabsze wiązania, sąsiednie cząsteczki
indukują w sobie dipole elektryczne, co staje się źródłem słabego przyciągania
między tymi cząsteczkami. Dokładniej: niesymetrycznie rozstawienie cząsteczek
powoduje w nich strony „bardziej dodatnie” i „bardziej ujemne”.
Wiązanie wodorowe dwie cząsteczki/jony połączone są jonem wodorowym;
Szczególne znaczenie ma wiązanie –O–H---O–; Pełni szczególną rolę w utrzymaniu
białek i kwasów nukleinowych.
Wiązanie sigma – wszystkie wiązania powstające w wyniku czołowego nakładania się
orbitali nazywa się wiązaniami sigma (najbardziej prawdopodobne występowanie
elektronu pokrywa się z osią łączącą oba elektrony).
Oktet elektronowy – konfiguracja elektronów walencyjnych, jaką posiadają gazy szlachetne. W
wiązaniach atomy dążą do tej konfiguracji, gdyż jest ona najtrwalsza, wynika to z korzystnego
zapełnienia orbitali s i p.
Wiązanie koordynacyjne – wyjątkowy przypadek wiązania kowalencyjnego, gdy uwspólniona para
elektronów pochodzi od jednego atomu: NH
4
Cl.
4. Stany skupienia materii, wielkości, prawa.
Trzema podstawowymi stanami skupienia są:
Gaz
Ciecz
Ciało stałe.
Dyfuzja - Jest to proces rozprzestrzeniania się
cząsteczek
w
danym
ośrodku,
będący
konsekwencją chaotycznych zderzeń cząsteczek.
Gazy – substancje bez określonego kształtu i
objętości. Przyjmują te właściwości od naczynia, w
którym się znajdują.
Ciecz – zachowują własną objętość, lecz przyjmują
kształt naczynia, w którym się znajdują. Ciecze charakteryzuje lepkość i napięcie powierzchniowe.
Lepkość to opór przeciwdziałający płynięciu. Napięcie powierzchniowe cieczy określa działającą na jej
powierzchnię siłę. Powierzchnia cieczy jest gładka, ponieważ siły międzycząsteczkowe wciągają
cząsteczki do wewnątrz.
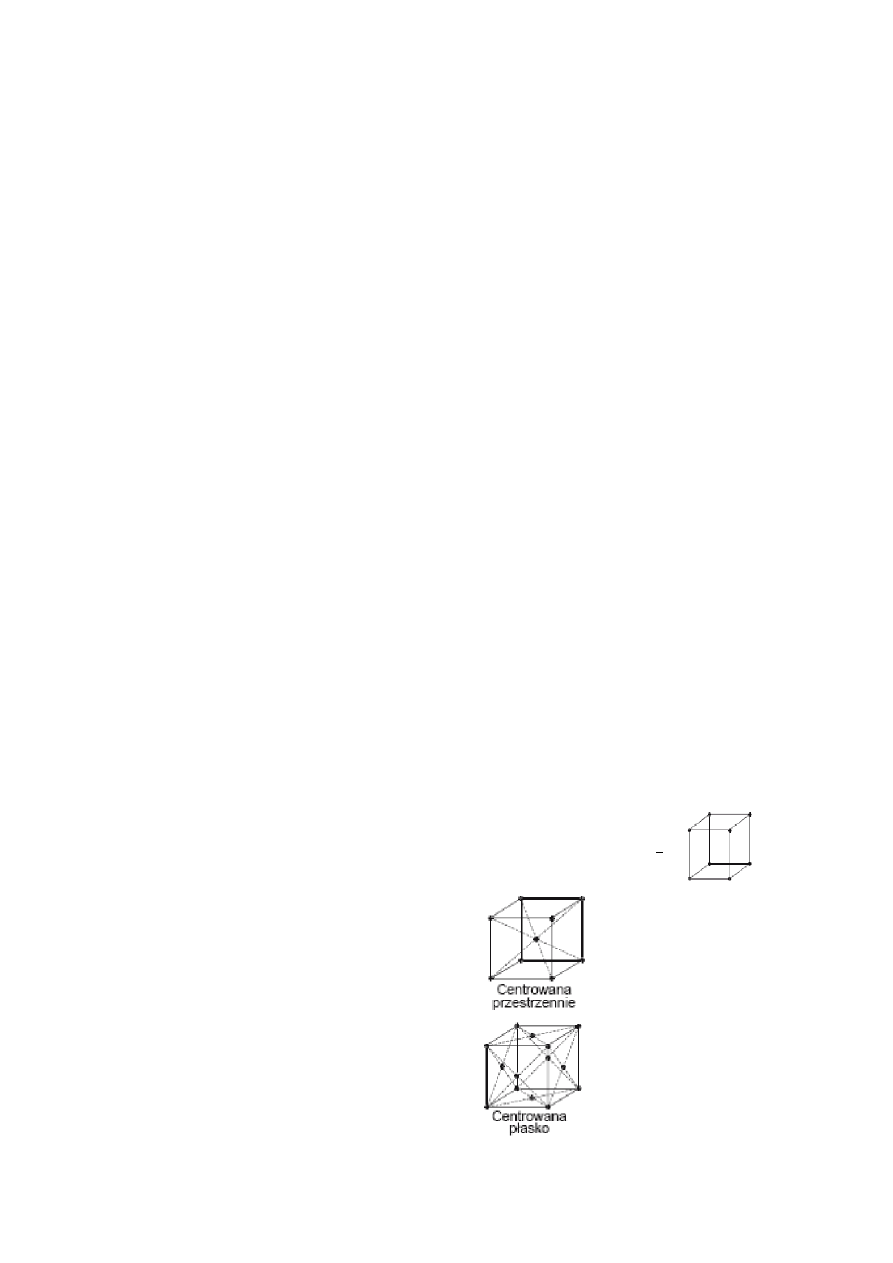
Ciała stałe dzielą się na krystaliczne i amorficzne. Istnieją trzy podstawowe komórki elementarne, wg,
których układa się większość kryształów:
A1 – regularna, płasko centrowana,
A2 – regularna, przestrzennie centrowana,
A3 – heksagonalna, zwarta.
Między cząsteczkami metali występuje wiązanie metaliczne. Ruchliwość elektronów walencyjnych
warunkuje takie właściwości metalu, jak:
Połysk,
Kowalność,
Ciągliwość,
Przewodnictwo elektryczne.
Klasyfikacja materiałów wg oporności:
1. Izolator,
2. Przewodnik metaliczny,
3. Półprzewodnik,
4. Nadprzewodnik.
5. Teoria pasmowa, stopy.
Teoria pasmowa dotyczy zasadniczo dwóch poziomów energetycznych atomów w ciele stałym:
najbardziej zewnętrznego poziomu obsadzonego elektronem i najbliższego mu poziomu
wzbudzonego. Poziomy te pod wpływem oddziaływania pól elektrostatycznych pozostałych atomów
ulegają rozszczepieniu na dużą liczbę blisko położonych poziomów tworzących pasma energetyczne:
walencyjne i przewodnictwa. W ramach pasma elektrony poruszają się swobodnie dzięki małym
różnicom energii pomiędzy tworzącymi je poziomami. Na każdym poziomie tworzącym pasmo mogą
być 2 elektrony.
Półprzewodnik – substancja, której przewodność może być zmieniana za pomocą różnych sposobów,
do domieszek, po naświetlenie. Istnieją następujące typy półprzewodników:
Półprzewodnik samoistny – monokryształ półprzewodnika, którego materiał jest
idealnie czysty, bez zamieszek, w temperaturze ok. 300K część elektronów przechodzi
do pasma przewodnictwa pozostawiając nieobsadzone miejsca w paśmie
walencyjnym, miejsca te będą zajmowane przez elektrony z niższych pasm, gdy
dostarczy się im energię.
Półprzewodnik typu n – jego działanie polega na wprowadzenie do kryształu
półprzewodnika (krzemu IV) zanieczyszczeń w postaci pięciowartościowych
pierwiastków. Powoduje to powstanie jednego wolnego elektronu, który przejdzie do
pasma przewodnictwa półprzewodnika. Tworzy to w paśmie przewodnictwa pasmo
donorowe – złożone właśnie z tych elektronów, są one wtedy nośnikiem ładunku w
półprzewodniku.
Półprzewodnik typu p – polega na wprowadzeniu do kryształu półprzewodnika
(krzemu IV) zanieczyszczeń w postaci trójwartościowych pierwiastków. Oznacza to, że
będzie brakowało czwartego elektronu do uzupełnienia wiązań. Powstaje dodatkowy
poziom energetyczny zwany akceptorowym położony nad lub w walencyjnym
poziomie. Poziom ten wiąże elektrony znajdujące się w paśmie walencyjnym, w
którym brakuje po jednym elektronie na każdy atom domieszki, są to tak zwane
dziury elektronowe, które zdolne są do przewodzenia prądu.
Stop – mieszanina dwóch lub więcej metali, lub metalu z innym pierwiastkiem. Stopy dzielą się na:
Stop jednofazowy – atomy są rozmieszczone równomiernie, substancja rozpuszczana
nie przekracza granicznej rozpuszczalności,
Stop wielofazowy – atomy są rozmieszczone nierównomiernie.
Inny podział:
Stop substytucyjny – część atomów głównego składnika stopu w sieci krystalicznej
zostaje zastąpiona atomami domieszki, muszą to być atomy wystarczająco duże.
Stop międzywęzłowe – atomy domieszki muszę być wystarczająco małe, by zmieścić
się między wiązaniami metalu.
6. Krystalografia, alotropia.
Komórka elementarna – jest to najmniejsza jednostka, z której można zbudować kryształ, poprzez
dodawanie jej (powielanie) w trzech prostopadłych kierunkach. Komórka elementarna powtarza się
we wszystkich trzech kierunkach, tworząc zamkniętą sieć przestrzenną, której główną cechą jest
symetria. Komórka elementarna ma zawsze kształt równoległościanu. Poprzez translacje komórki
elementarnej o wektory będące całkowitymi wielokrotnościami wektorów sieci krystalicznej
otrzymuje się całą sieć krystaliczną kryształu. Podstawowe rodzaje komórek
elementarnych:
Komórka prosta, na jedną komórkę przypada jeden atom, po
1
8
atomu w każdym narożu
Komórka centrowana przestrzennie:
Komórka centrowana płasko:
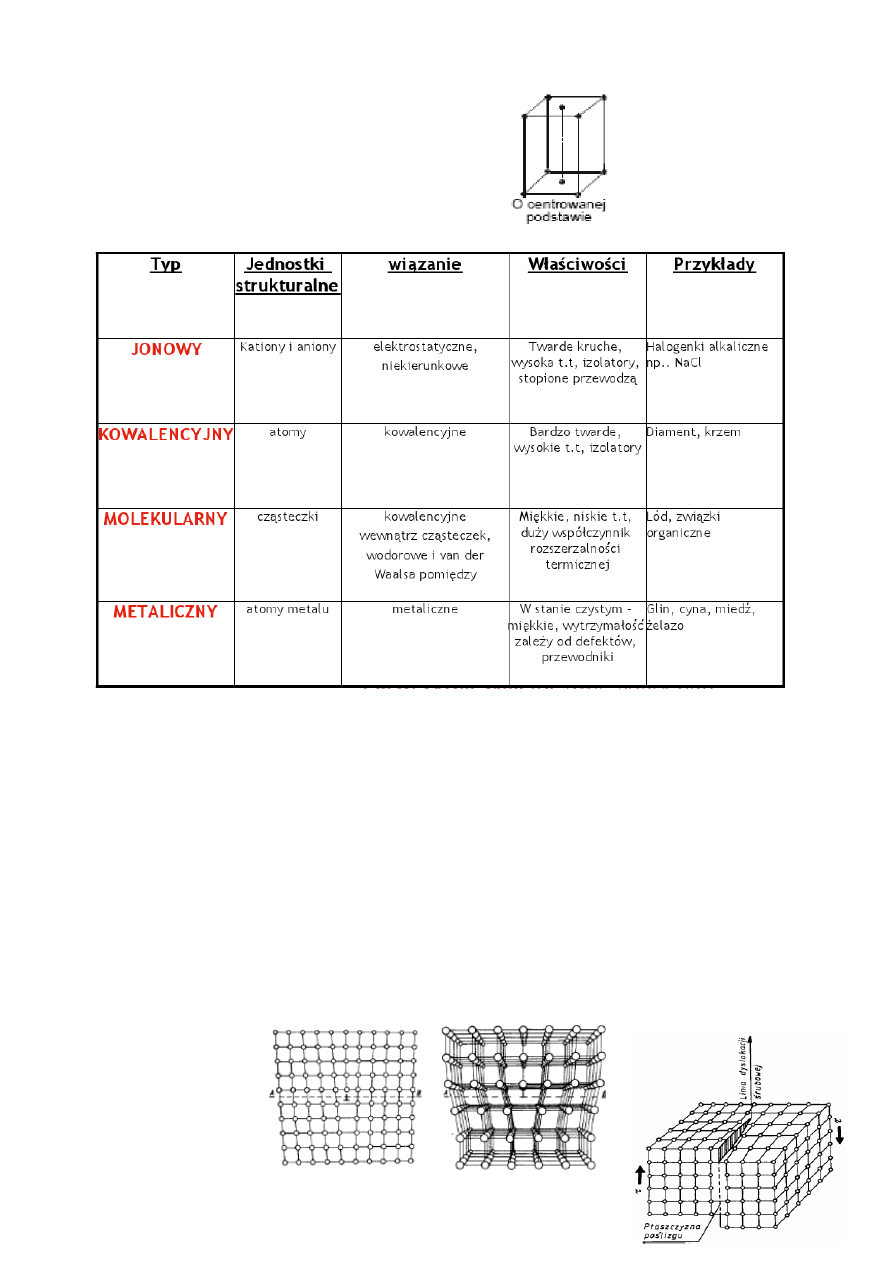
Komórka o centrowanej podstawie:
Rodzaje kryształów ze względu na wiązania:
Kryształy kowalencyjne:
Atomy przyjmują stabilną konfigurację elektronową odpowiedniego gazu
szlachetnego.
Np. diament, gdzie każdy atom C jest otoczony 4 innymi ułożonymi w kształcie
czworościanu.
Defekty sieci krystalicznej dzielą się w zasadzie na dwie grupy:
Punktowe,
o Wakans – brak atomu w węźle sieci,
o Obcy atom w sieci,
o Atom międzywęzłowy.
o Defekt Schotky’ego – atom tworzy wakans i wywędrowuje na zewnątrz
o Defekt Frenkla – atom wtrącony jest tak duży, że powoduje rozsunięcie
innych atomów na odległości większe, niż zwykle.
Liniowe:
o Dyslokacja krawędziowa – wywołuje ją obecność dodatkowej półpłaszczyzny
w sieci, powodującej wydłużenie się sieci:
o Dyslokacja śrubowa - wyznaczająca granicę między
przesuniętą i nieprzesuniętą częścią kryształu.
Granica ta przebiega równolegle do kierunku
poślizgu a nie prostopadle, jak to ma miejsce w
przypadku dyslokacji krawędziowej.
Alotropia – nazywamy występowanie tego samego pierwiastka lub związku w postaci dwóch lub kilku
odmian krystalicznych, a odmiany te nazywamy alotropowymi. Przemiany alotropowe zachodzą przy
stałych temperaturach i towarzyszy im wydzielanie lub pochłanianie utajonego ciepła przemiany (w
zależności od kierunku jej zachodzenia). Najważniejszymi odmianami alotropowymi są odmiany
alotropowe węgla:
Diament – wiązania kowalencyjne, najtwardszy naturalny materiał, izolator.
Grafit – płaskie pierścienie heksagonalne połączone kowalencyjnie, przewodnik
elektryczny.
Fuleren – każda cząsteczka zawiera parzystą liczbę atomów węgla i jego struktura
składa się z 12 pierścieni pięciokątnych i m sześciokątnych m= (n-20)/2
7. Chemia organiczna, węglowodory, polimery, paliwa, izomeria.
Węglowodory:
Najprostsze związki organiczne, zawierające tylko atomy węgla i wodoru.
Jest ich bardzo dużo ze względu na mnogość sposobów łączenia się atomów węgla między
sobą.
Dzielimy je na następujące grupy:
Alifatyczne – łańcuchowe, nie zawierają pierścieni,
Aromatyczne – zawierają pierścień benzenowy:
o Nasycone – alifatyczne, bez wiązań wielokrotnych,
o Nienasycone – zawierają przynajmniej jedno wiązanie wielokrotne.
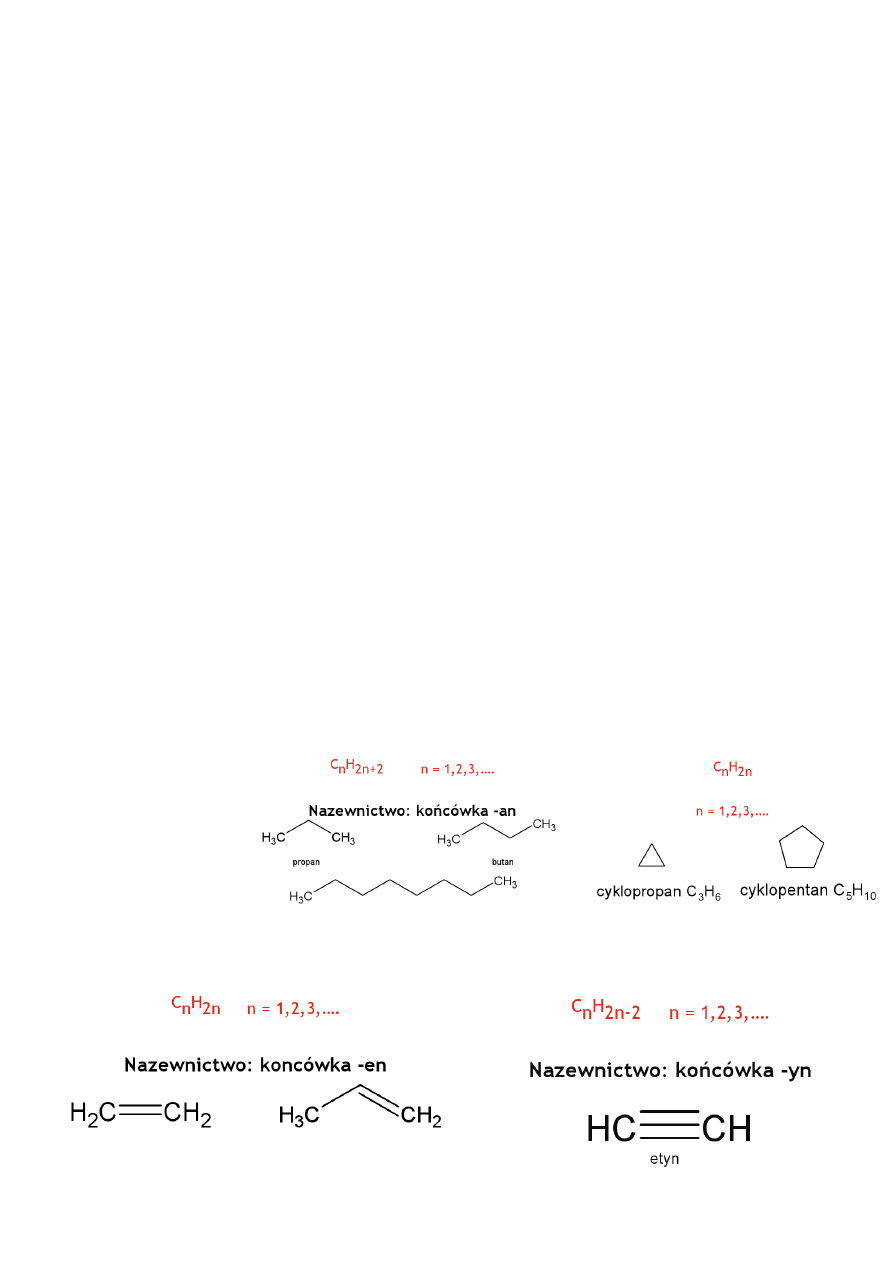
Podstawowe nazwy:
1.
Metan
Alkany
Cykloalkany
2.
Etan
3.
Propan
4.
Butan
5.
Pentan
6.
Heksan
7.
Heptan
8.
Oktan
9.
Nonan
10.
Dekan
Alkeny
Alkiny

Węglowodorami występującymi w przyrodzie są gaz ziemny, węgiel i ropa naftowa. Ich głównym
wykorzystaniem jest pozyskiwanie z nich energii. Węgiel występuje w kilku rodzajach: torf, węgiel
kamienny, węgiel brunatny, antracyt.
Gaz ziemny – jest mieszaniną lekkich alkanów, głównym jego składnikiem jest metan, następnie etan,
propan, butan, mały odsetek wyższych alkanów i azot. Jest gazem kopalnianym pochodzenia
organicznego, gromadzi się w skorupie ziemskiej, czasem występuje z ropą i naftą.
Torf – skała osadowa powstała z obumarłych szczątek roślinnych na terenach bagiennych. Pierwsza
obumarła warstwa zostaje pochłonięta przez bagno i jest prasowana i pokrywana przez kolejne
warstwy. Następnie po usunięciu większości tlenu powstaje torf.
Węgiel brunatny – efekt tej samej przemiany, co torf, po dłuższym okresie czasu. Zawartość węgla
62%-75%.
Węgiel kamienny – dalszy efekt. Od 75%-97%.
Antracyt – najsilniej przeobrażona postać węgla, najwyższa zawartość, największa kaloryczność,
najtrudniejszy do wykopania.
Piroliza – proces rozkładu termicznego substancji, w którym poddaje się ją działaniu wysokich
temperatur bez dostępu tlenu i innych czynników utleniających. Zwykle związki poddawane temu
procesowi rozkładają się na mniejsze, o mniejszej masie cząsteczkowej.
Pirolizie poddaje się węgiel, wynikiem tego działania są(z jednej tony węgla):
330m
3
gazu koksowniczego (20%),
Koks 650kg (65%),
Smoła węglowa 42kg (5%),
Woda pogazowa (10%), wykorzystuje się ją do tworzenia nawozów.
Rafinacja – proces przekształcania ropy naftowej w bardziej użyteczne produkty, składa się ona z:
Destylacji frakcyjnej – rozdzielenie składników ropy ze względu na ich temperatury wrzenia.
Skrapla się po kolei odpowiednie składniki, utrzymując pozostałe w postaci gazowej.
Krakingu – zrywanie wiązań między węglami, w tym procesie dłuższe łańcuchy alkanów
rozpadają się na krótsze alkanów i alkenów. Przeprowadza się go z użyciem wysokiej
temperatury, bądź katalizatora.
Reforming – proces otrzymywania benzyny z lżejszych frakcji przez rozbicie prostych
łańcuchów alkanów i przebudowanie ich w łańcuchy rozgałęzione.
Frakcja – mieszanina cieczy o podobnych temperaturach wrzenia. Lekkie frakcje maja niskie
temperatury wrzenia i krótkie łańcuchy węglowodorowe.
Składniki, jakie otrzymuje się z ropy naftowej to:
Benzyna – ciekła frakcja ropy naftowej o temperaturze wrzenia 40°C-150°C. Składa się z
alkanów zawierających 5-12 atomów węgla.
Nafta – ciekła frakcja ropy naftowej powstała po destylacji frakcyjnej. Składa się z alkanów
zawierających od 9 do 15 atomów węgla i wrze w przedziale temperatur 150°C – 250°C.
On – ciekła frakcja ropy naftowej powstała po destylacji frakcyjnej. Składa się z alkanów
zawierających od 12 do 25 atomów węgla i ma temperaturę wrzenia wyższą niż 250°C.
Mazut – olej pozostały po destylacji frakcyjnej, składa się z łańcuchów zawierających nawet
40 atomów węgla, wrze w 350°C.
Inne rodzaje węgla:
Węgiel drzewny – lekka czarna substancja wytwarzana w procesie suchej destylacji z drewna.
Izomery – związki o tym samym wzorze cząsteczkowym, lecz innym strukturalnym.
Polimery – związki o budowie łańcuchowej, których cząsteczki zbudowane są z połączonych ze sobą
elementów, tzw. merów.
Homopolimer – polimer utworzony z jednego typu
Monomerów.
Kopolimer – polimer utworzony z dwóch lub więcej
Różnych monomerów.
8. Spektroskopia, absorpcja i emisja światła, zjawiska optyczne.
Spektroskopia – nauka o powstawaniu i interpretacji widm powstających w wyniku oddziaływań
wszelkich rodzajów promieniowania materię. Oddziaływania te powodują zmianę energii
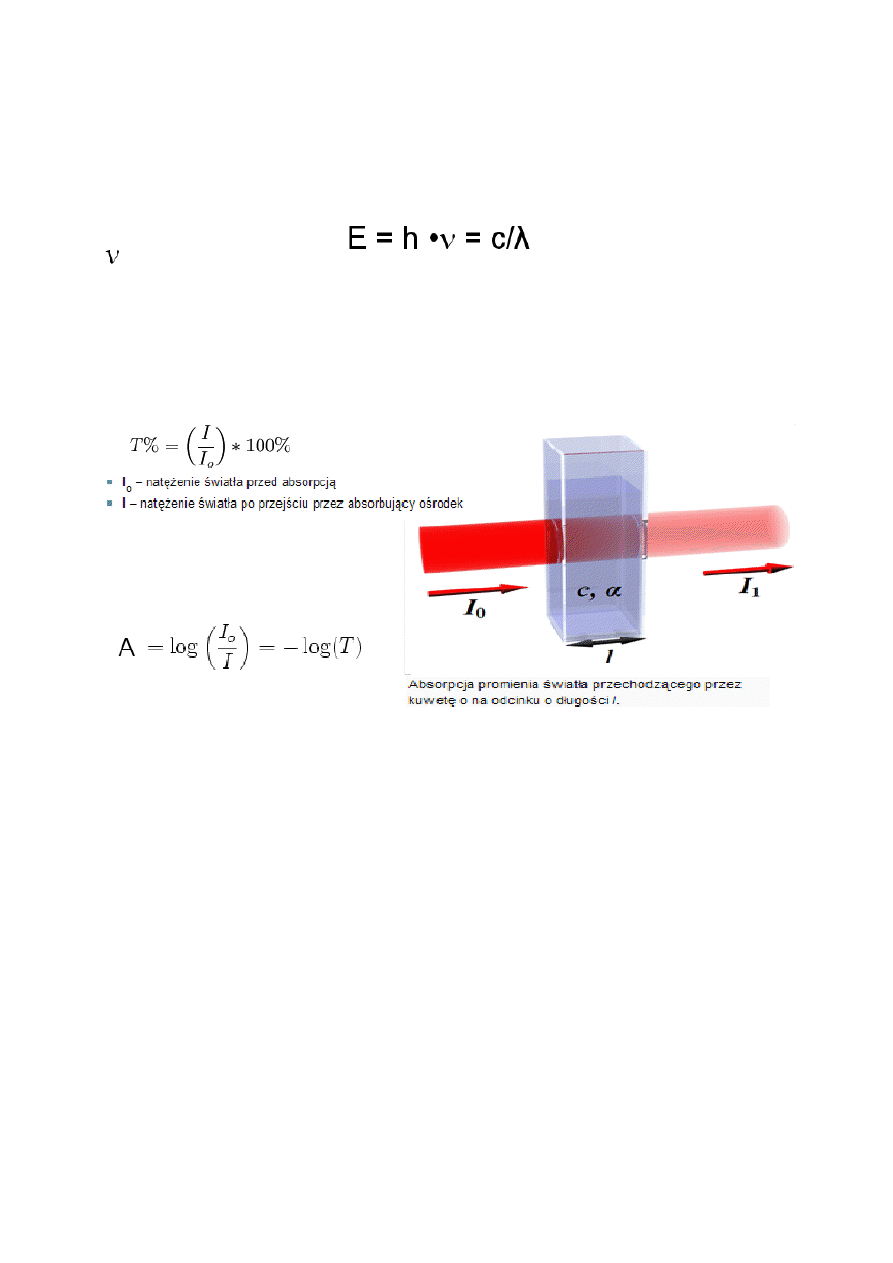
wewnętrznej ciała. Zgodnie z zasadą zachowania energii:
E –zmiana energii
h – stała Plancka
- częstotliwość
c – prędkość światła
λ – długość fali promieniowania.
Cząsteczka może przyjmować tylko ściśle określone poziomy energetyczne a ich zmiana związana jest
z pochłanianiem lub emitowaniem danego kwantu (porcji) energii. Pochłanianie przez materię
kwantu energii związane jest z absorpcją fali elektromagnetycznej. Oddanie zaabsorbowanej energii
związane jest z emisją energii na dwa sposoby.
Ilościową miarą wielkości absorpcji jest są TRANSMITANCJA i ABSORBANCJA promieniowania.
Absorpcja – proces pochłaniania promieniowania elektromagnetycznego. Absorbancja to część
pochłoniętego promieniowania, a transmitancja część przepuszczonego.
Rozszczepienie światła białego – rozproszenie to jest związane z różną prędkością rozchodzenia się
promieni świetlnych o różnych barwach. Fioletowy „najszybszy”, czerwony „najwolniejszy”.
Powoduje to różny współczynnik załamania się światła i różnym kątem załamania.
Rozpraszanie światła – dzieli się na dwa rodzaje:
Sprężyste – bez zmiany częstotliwości światła,
Niesprężyste – ze zmianą częstotliwości światła.
Jest to zjawisko, w którym następuje zmiana kierunku rozchodzenia się światła. Związane jest z
naturą falową światła. Fala świetlna elektromagnetyczna, oddziałuje z materią, która zostaje
wzbudzona do drgań wypromieniowując falę świetlną rozproszoną.
Efekt Tyndalla – zjawisko rozpraszania światła przez koloid. Polega ono na przepuszczaniu przez
roztwór koloidalny wiązki światła, która wskutek uginania się promieni na cząstkach fazy
rozproszonej, staje się widoczna, jako tzw. stożek Tyndalla (światło w lesie przez drzewa).
Wyszukiwarka
Podobne podstrony:
Chemia opracowanie
chemia opracowanie id 112613 Nieznany
egzamin chemia opracowanie
chemia - opracowane pytania, chemia
CHEMIA OPRACOWANA
chemia opracowana, Pwr ZIP, I sem, chemia
Chemia opracowanie 3
semestr 1 opracowanie pyt egz, CHEMIA OPRACOWANA2003
Kolokwium chemia opracowane pytania
chemia opracowanie od wszystkich, Mechatronika, Chemia
Chemia - opracowania 2, PWr, Chemia, Chemia - poprzednie kolokwia i rozwiązania
Chemia opracowane wyklady 2
chemia opracowanie
Chemia opracowania 1
chemia opracowanie pytań z poczty (1)
II koło chemia opracowane
CHEMIA OPRACOWANIE PYTAŃ WERSJA OSTATECZNA
Egzamin chemia opracowane pytania1
Chemia opracowanie
więcej podobnych podstron