
1. DEFINICJE:
a) MASA ATOMOWA -
jest to masa atomu wyrażona w atomowych jednostkach masy (u)
b)
WARTOŚĆ FORMALNA - to liczba wiązań chemicznych utworzonych przez atom
danego pierwiastka w cząsteczce związku chemicznego
c) ATOM - j
est to najmniejsza część pierwiastka chemicznego zachowująca jego własności.
Atom składa się z jądra o dodatnim ładunku elektrycznym, w którym skupiona jest prawie
cała masa atomu i otaczających jądro elektronów o ładunkach ujemnych
d) KWASY, ZASADY I SOLE WG ARRHENIUSA - Kwasami nazywamy elekt
rolity które
ulegają całkowicie lub częściowo dysocjacji na kationy Wodoru i aniony reszty kwasowej
.Zasadami nazywamy wodorotlenki które dysocjują na kationy metali i aniony wodorów. Sole
są to elektrolity które dysocjują na kationy metali i reszty kwasowe
e) HYDROLIZA -
jest to proces rozkładu substancji pod wpływem wody(popatrzcie
sobie na przykładowe reakcje )
f) ZAKAZ PAULIEGO -
Dwa elektrony mogą zajmować ten sam orbital tylko wówczas gdy
ich spiny s
ą przeciwne (zorientowane w przeciwnych kierunkach)
W atomie nie mog
ą istnieć dwa elektrony, których stan kwantowy nie różniłby się
przynajmniej jedną liczbą kwantową.
2. ROZPISAĆ DYSOCJACJĘ ELEKTROLITYCZNĄ:
To rozpad elektrolitów na jony (kationy i aniony) pod wpływem wody lub innych
rozpuszczalników. Wystarczyło przepisać mniej więcej na jakie jony co się rozpada.
3. WZORY SUMARYCZNE OKSOKWASÓW I KWASÓW BEZTLENOWYCH
Kwasy beztlenowe:
* kwas solny (HCl)
* kwas fluorowodorowy (HF)
* kwas bromowodorowy (HBr)
* kwas jodowodorowy (HI)
* siarkowodór rozpuszczony w wodzie - H2S
* kwas selenowodorowy (H2Se)
Oksokwasy:
* HNO3 kwas azotowy(V)
* HClO4 kwas chlorowy(VII)
* H2SO4 kwas siarkowy(VI)
4. ZAPISAĆ STOPNIE UTLENIANIA DANYCH PIERWIASTKÓW:
Podstawowe reguły do obliczania stopnia utlenienia [Zapamiętać i samemu resztę rozkminić]
* stopień utlenienia pierwiastków w stanie wolnym wynosi zero, niezależnie od tego, czy
substancja występuje w postaci pojedynczych atomów, czy w postaci cząsteczek, np. Fe0,
N20, O0, O20, O30;
* suma stopni utlenienia wszystkich atomów w cząsteczce obojętnej równa jest zero, a w
jonie złożonym równa jest jego ładunkowi;
* stopień utlenienia pierwiastka w jonie prostym jest równy ładunkowi jonu, np. Pb2+ →
(+2), Ag+ → (+1), Pb4+ → (+4), Cl– → (–1),
* stopień utlenienia fluoru we wszystkich związkach wynosi –1;
* stopień utlenienia wodoru w związkach jest równy +1, z wyjątkiem wodorków metali, w
których wynosi on –1, np. NaH;

* stopień utlenienia tlenu w związkach wynosi –2, z wyjątkiem fluorków tlenu, w których
wynosi +2 (OF
2
) lub +1 (O
2
F
2
) oraz związków zawierających wiązania tlen-tlen, np. w
nadtlenkach (st. utl. -
1), ponadtlenkach (st. utl. −½) i ozonkach (st. utl. -⅓);
* metale zazwyczaj przyjmują dodatnie stopnie utlenienia;
* pierwiastki pierwszych dwóch grup głównych występują wyłącznie na jednym stopniu
utlenienia, i tak dla grupy 1 (litowce) na +1, grupy 2 (berylowce) na +2.
5. PODAĆ NAZWY PODANYCH WZORAMI SUBSTANCJI:
Mniej więcej wg poniższych zasad:
a) TLENKI -
Aby nadać tlenkowi nazwę przy użyciu tego systemu używamy słowa tlenek
oraz podajemy nazwę pierwiastka tworzącego dany tlenek (jeśli to potrzebne wraz z
wartościowością lub stopniem utlenienia).
* CO
2
– tlenek węgla(IV)
* CO
– tlenek węgla(II)
* Na
2
O
– tlenek sodu
* Fe
2
O
3
– tlenek żelaza(III)
* FeO
– tlenek żelaza(II)
* CaO
– tlenek wapnia
b) WODOROTLENKI
–
wodorotlenek [ pierwiastek w D ] ( wart. lub su. )
* NaOH
– wodorotlenek sodu (jedyny)
* Ca(OH)
2
– wodorotlenek wapnia (jedyny)
* Al(OH)
3
– wodorotlenek glinu (jedyny)
* Fe(OH)
2
– wodorotlenek żelaza(II) lub wodorotlenek żelaza(+2)
* Fe(OH)
3
– wodorotlenek żelaza(III) lub wodorotlenek żelaza(+3)
* Cu(OH)
2
– wodorotlenek miedzi(II)
Wodorotlenki rozpuszczalne w wodzie podlegają także (niezalecanemu) nazewnictwu:
'zasada [ pierwiastek-temat ]-'owa
* NaOH
– zasada sodowa
* KOH
– zasada potasowa
c) KWASY
–
=> Beztlenowe
kwas [ pierwiastek w mianowniku ]owodorowy
* HCl
– kwas chlorowodorowy (solny)
* HBr
– kwas bromowodorowy
* H
2
S
– kwas siarkowodorowy
* HI
– kwas jodowodorowy
* HCN
– kwas cyjanowodorowy (pruski)
* HF
– kwas fluorowodorowy
=> Tlenowe
kwas [ pierwiastek-temat ]owy( wart. lub su. )
* H
2
SO
4
– kwas siarkowy(VI) (nazwa półsystematyczna: kwas siarkowy)
* H
2
SO
3
– kwas siarkowy(IV) (nazwa półsystematyczna: kwas siarkawy)
* HNO
3
– kwas azotowy(V) (nazwa półsystematyczna: kwas azotowy)
* HNO
2
– kwas azotowy(III) (nazwa półsystematyczna: kwas azotawy)
* H
3
PO
4
– kwas fosforowy(V) (nazwa półsystematyczna: kwas fosforowy lub kwas
ortofosforowy)
* HMnO
4
– kwas manganowy(VII) (nazwa półsystematyczna: kwas nadmanganowy)

* H
2
CO
3
– kwas węglowy
* H
3
BO
3
– kwas borowy (nazwa zwyczajowa: kwas borny)
d) SOLE
–
Zasady ogólne dla soli
[ reszta kwasowa ]( wart. lub su. ) [ kation w D ]( wart. lub su. )
* NaCl
– chlorek sodu
* FeSO
4
– siarczan(VI) żelaza(II) (nazwa półsystematyczna: siarczan żelaza(II); dawn.
siarczan żelazawy)
* Fe
2
(SO
3
)
3
– siarczan(IV) żelaza(III) (nazwa półsystematyczna: siarczyn żelaza(III); dawn.
siarczyn żelazowy)
* KMnO
4
– manganian(VII) potasu (nazwa półsystematyczna: nadmanganian potasu)
* (COO)
2
Ca
– szczawian wapnia
=> Sole mieszane
[ reszta kwasowa 1 ][- lub _][ reszta kwasowa 2 ][- lub _][ itd. ]
[ kation 1 ][- lub i][ kation 2 ][- lub i][ itd. ]
* NaKSO
4
–
siarczan(VI) potasu-sodu lub
siarczan(VI) potasu i sodu lub
siarczan(+6) potasu-sodu lub
siarczan(+6) potasu i sodu lub
(tradycyjnie: siarczan potasowo-sodowy)
* AlCl(SO
4
)
–
chlorek-siarczan(VI) glinu lub
chlorek siarczan(VI) glinu lub
chlorek-siarczan(+6) glinu lub
chlorek siarczan(+6) glinu
* AlNa(SO
4
)(SO
3
)
– np. siarczan(IV)-siarczan(VI) glinu-sodu
=> Hydroksosole
* (CaOH)Cl
– chlorek wodorotlenek wapnia
* [Sn(OH)
2
]Br(NO
3
)
– azotan(V)-bromek-diwodorotlenek cyny(IV)
=> Wodorosole
* NaH
2
PO
4
– diwodorofosforan(V) sodu
* FeIICuIISO
4
(H
2
PO
4
)
2
– siarczan(VI)-diwodorofosforan(V) miedzi(II)-żelaza(II)
e) WODORKI
– Wodorki niemetali wg najnowszych zaleceń IUPAC należy nazywać od
pierwiastka niemetalu z końcówką -an oraz ewentualnym przedrostkiem oznaczającym ilość
atomów wodoru:
* PH
3
– fosfan (wodorek fosforu, fosforowodór, fosforiak)
* NH
3
– azan (wodorek azotu, azotowodór, amoniak)
* H
2
O
– oksydan (tlenek wodoru, tlenowodór, woda)
* H
2
S
– sulfan (siarczek wodoru, siarkowodór)
* AsH
3
– arsan (wodorek arsenu, arsenowodór, arseniak, arsyna)
Dla wodorków metali używamy słowa wodorek i dodajemy nazwę pierwiastka oraz, jeśli to
konieczne, również jego wartościowość lub stopień utlenienia:
* NaH
– wodorek sodu
* CaH
2
– wodorek wapnia

* FeH
3
– wodorek żelaza(III)
* SnH
4
– wodorek cyny(+4)
6. NAPISAĆ RÓWNANIA REAKCJI:
Reakcja syntezy
– polega na łączeniu się dwu lub więcej pierwiastków względnie
cząsteczek w związki chemiczne
A + B → AB
2H
2
+ O2 → 2H
2
O
H
2
+ S → H
2
S (siarkowodór)
SO
2
+ H
2
O → H
2
SO
3
Reakcja analizy
– dotyczy reakcji, w wyniku których z jednej substancji tworzą się dwie lub
więcej substancji prostszych.
AB → A + B
2HgO → 2Hg + O
2
Na
2
CO
3
→ Na
2
O + CO
2
Reakcja wymiany
– polega na zastąpieniu jonów lub atomów tworzących substraty w wyniku
reakcji chemicznych
AB + C → AC + B
Zn + H
2
SO
4
→ ZnSO
4
+ H
2
CuSO
4
+ Fe → FeSO
4
+ Cu
Reakcja wymiany podwójnej
AB + CD → AD + CB
2NaOH + H
2
SO
4
→ Na
2
SO
4
+ 2H
2
O
BaCl
2
+ H
2
SO
4
→ BaSO
4
+ 2HCl
7
. DOBIERANIE WSPÓŁCZYNNIKÓW – klasyczne zadanie, zawsze strona lewa ma się
równać prawej.
8. WYPISAĆ PIERWIASTKI DANYCH BLOKÓW:
a) BLOK S
– H, Li, Na, K, Rb, Cs, Fr, Be, Mg, Ca, Sr, Ba, Ra, He,
b) BLOK P
– B, C, N, O, F, Ne, Al, Si, P, S, Cl, Ar, Ga, Ge, As, Se, Br, Kr, In, Sn, Sb, Te, I,
Xe, Tl, Pb, Bi, Po, At, Rn, Uuq
c) BLOK D
– Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd,
La, Hf, Ta, W, Re, Os, Pt, Au, Hg, Ac, Rf, Db, Sg, Bh, Hs, Mt, Uun, Uuu, Uub
d) BLOK F
– Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Th, Pa, U, Np, Pu,
Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr,
9. OPISAC
A-
liczba masowa to wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w
jądrze
Z-
liczba atomowa (liczba porządkowa) określa, ile protonów znajduje się w jądrze danego
atomu.
Jest także równa liczbie elektronów niezjonizowanego atomu.
E-symbol pierwiastka
10. OBLICZANIE pH:
pH = -log [H+]
pOH = -log [OH-]
pH + pOH = 14

[H
+
] = 10
-pH
[OH
-
] = 10
–pOH
11. REAKCJE REDOKS:
Reakcje utleniania i redukcji (redox)
– reakcje, podczas których następuje zmiana stopni
utlenienia pierwiastków na skutek wymiany elektronów pomiędzy substancją utleniająca
(utleniaczem
– Utl) i redukcją (reduktorem – red).
Reduktor (elektronator) oddaje elektrony (jest donorem elektronów). Reduktor, oddając
elektrony, utlenia się (ulega dezelektronacji)
Red
– ze- → Ut
z -
liczba oddanych elektronów
Utleniczach (dezelektronator) pobiera elektrony (jest akceptorem el
ektronów). Utleniacz,
pobierając elektrony, redukuje się (ulega elektronacji)
Utl + ze-
→ Red
Np. tlen, fluorowce, ozon, manganian (VII) potasu
Dobieranie współczynników stechiometrycznych w równaniach reakcji redoks.
Aby dobrać współczynniki stechiometryczne należy:
1)
obliczyć stopień utlenienia pierwiastków występujących w reakcji
2)
ustalić utleniacz i reduktor reakcji
3)
zapisać reakcje połówkowe dla utleniacza i reduktora
4)
dokonać bilansu elektronów oddanych i pobranych
5)
dobrać pozostałe współczynniki zgodnie z prawem zachowania masy i ładunku w
reakcjach połówkowych
6)
nanieść otrzymane współczynniki stechiometryczne z reakcji połówkowych do reakcji
wyjściowej
7)
Stopnie utleniania w jonach złożonych
Suma stopni utlen
ienia wszystkich atomów w jonie złożonym jest równa ładunkowi tego jonu
8)
Stopnie utlenienia w cząsteczkach związków
Suma stopni utlenienia wszystkich atomów w cząsteczce i związku jonowym jest równa zero.
12. STĘŻENIA PROCENTOWE I PRZELICZANIE:
O stężeniach procentowych Cp1 i Cp2 w celu uzyskania roztworu stężeniu Cpz, gdzie Cp1>
Cpz>Cp2
m1/m2 = Cpz
– Cp2 / Cp1 – Cpz
m1
– masa roztworu o stężeniu Cp1
m2
– masa roztworu o stężeniu Cp2
M1
M2
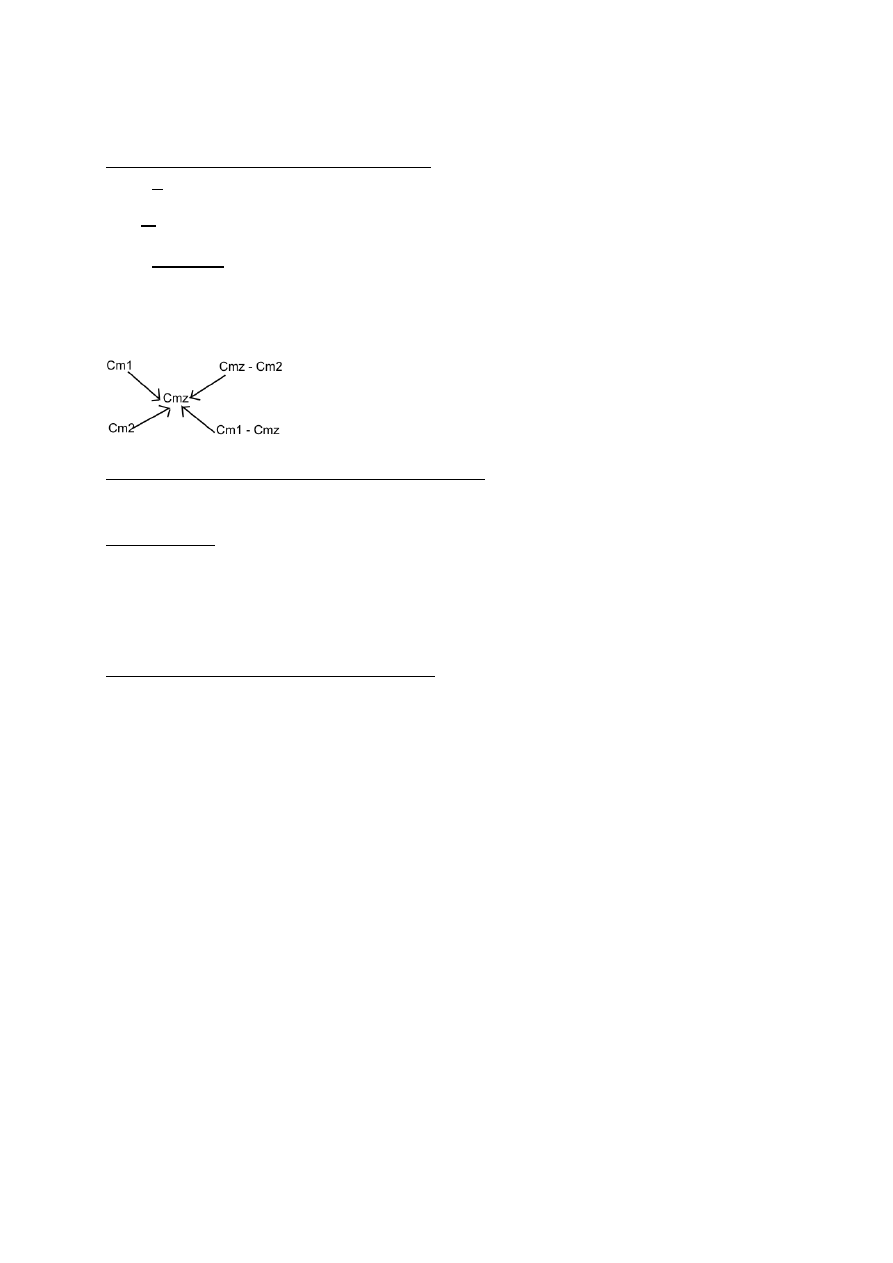
13. STĘŻENIA MOLOWE I PRZELICZANIE:
O stężeniach molowych Cm1 i Cm2 w celu uzyskania roztworu o stężeniu Cmz, gdzie
Cm1>Cmz>Cm2
V1/V2 = Cmz
– Cm2 / Cm1 – Cmz
14. NAPISAĆ WZÓR PODANYCH SUBSTANCJI – improwizacja w tworzeniu wzorów z
nazw
15. pH WODY:
W czystej wodzie [H+] = [OH-] = 1*10-7
pH = 7 r obojętny
pH >7 alkaliczny
pH <7 kwaśny
16. SCHARAKTERYZOWAĆ PIERWIASTKI:
=> WAPŃ
Do najpospolitszych pierwiastków 2 grupy, najczęściej spotykanych w przyrodzie nalezą
wapń i magnez, występujące w postaci następujących związków:
• wapieni CaCO
3
• magnezytów, których głównym składnikiem jest MgCO
3
• dolomitu MgCO
3
xCaCO
3
• siarczanu wapniowego CaSO
4
• fosforanu wapniowego Ca
3
(PO
4
)
2
• chlorku wapniowego 2
Głównym źródłem jonów wapnia w wodach podziemnych są procesy wietrzenia
chemicznego powszechnie występujących minerałów skał osadowych zawierających wapń:
kalcytu i aragonitu CaCO
3
, dolomitu CaMg(CO
3
)
2
, gipsu CaSO
4
x2H
2
O i anhydrytu CaSO
4
. W
rejonach gdzie występują skały wapienne,w jaskiniach obserwuje się zjawisko tworzenia
oryginalnych form skalnych tzw. stalaktytów i stalagmitów. Przyczyną tego procesu jest
zjawisko erozji, które polega na powolnym rozpuszczaniu skał wapiennych z utworzeniem
dobrze rozpuszczalnego wodorowęglanu wapnia. Dwutlenek węgla (CO
2
) pochodzi z
atmosfery. Z wodnego roztworu Ca(HCO
3
)
2
wolno ściekającego po ścianach jaskiń, po
częściowym odparowaniu wody wytrąca się osad CaCO
3
, tworząc naciek.
M1
M2

=> MAGNEZ
M
agnez jest pierwiastkiem zbliżonym pod względem chemicznym do wapnia. Aktywnie
uczestniczy on również w biologicznym obiegu substancji, Charakteryzuje się jednak
niższym niż wapń współczynnikiem pochłaniania biologicznego.
Migracja wodna magnezu przebiega nieco inaczej niż wapnia. Związane jest to m.in. z
mniejszym rozmiarem jonów Mg
2+
niż Ca
2+
i tworzeniem jonów uwodnionych. Magnez
wstępujący w wodach podziemnych jest głównie pochodzenia mineralnego. Może się tam
dostawać w wyniku wietrzenia wielu minerałów skał krystalicznych, np. oliwinów, piroksenów,
amfiboli, ciemnych mik, a ponadto chlorytów, serpetynów, magnezytów i innych. Magnez
dostarczany jest w wyniku wietrzenia i jest rozpras
zany podczas migracji wodnej, częściowo
może być także zużywany w procesach dolomityzacji skał bądź wychwytywany przez rośliny.
Większych ilości magnezu do wód podziemnych dostarczać mogą minerały skał osadowych.
Głównie dolomit CaMg(CO
3
)
2
. Jest on bardzie
j odporny na wietrzenie niż kalcyt, jednak
obecność agresywnego CO2 może przyspieszyć proces rozpuszczania, doprowadzając do
wód jony Mg
2+
i Ca
2+
. Powstaje wówczas typ wód wodorowęglanowo – wapniowo –
magnezowych.
Najwięcej magnezu może występować w wodach ługujących łatwo
rozpuszczalne siarczanowe i chlorkowe sole magnezu.
=>
SÓD
Sód jest najpospolitszym pierwiastkiem wśród metali alkalicznych. Sód występuje
powszechnie w minerałach skał krystalicznych, z których najważniejszy jest skaleń sodowy –
albit (NaAlSi
3
O
8
), oraz rzadziej, w łatwo rozpuszczalnych solach w skałach osadowych.
Znacznie większe ilości sodu dostają się do wód podziemnych w wyniku ługowania
osadowych złóż soli, głównie halitu (NaCl). Wody podziemne mogą być także wzbogacone w
sód dzięki procesom wymiany jonowej.
=> POTAS
Potas jest pierwiastkiem zbliżonym pod względem właściwości chemicznych do sodu,
występującym w litosferze w podobnych ilościach. Rozpuszczalność soli potasowych:
kainitu, sylwinu, karnalitu, polihalitu i in. jest wyższa niż halitu. Niemniej, głównie ze względu
na silną adsorpcję przez minerały ilaste oraz pobór przez rośliny, potas wyraźnie ustępuje
ilościowo sodowi w wodach.
Stosunkowo duże zawartości potasu w wodach podziemnych mogą być związane z
lokalnymi wystąpieniami ewaporatów, gdzie zawartość tego pierwiastka w złożu solnym
może osiągać 20-50% ogólnej liczby kationów. Potas uważany jest za jeden z pierwiastków
urodzaju., stosowany jest w wielu nawozach mineralnych. Intensywne nawożenie nawozami
organicznymi również może podwyższyć zawartość jonów K+ w wodach gruntowych.
Podobnie jak sód, potas może się również dostawać do wód podziemnych w wyniku
zanieczyszczeń bytowych, gospodarczych czy też przemysłowych.
=> ŻELAZO
W zewnętrznej skorupie ziemskiej zawartość żelaza ocenia się na około 5%, rdzeń skorupy
ziemskiej prawdopodobnie zawiera głównie Fe i Ni. Powszechnie występuje w wielu
minerałach skałotwórczych. Bierze ono czynny udział w obiegu pierwiastków w środowisku
jako pierwiastek cykliczny. Pierwotnym źródłem żelaza w wodach podziemnych są liczne
minerały skał magmowych, takie jak: oliwiny, pirokseny, amfibole, biotyt, magnetyt czy tez
piryt. Żelazo powszechnie również występuje w minerałach skał osadowych, np. w pirytach i
markasytach, syderytach oraz tlenkach i wodorotlenkach (hematyt, meghemit, goethyt,

ferrihydryt). Wietrzejące krzemiany, siarczki i węglany dostarczają do wód podziemnych
znacznych ilości żelaza.
Ługowanie żelaza z utworów wodonośnych i przeprowadzanie go do wód podziemnych jest
złożonym, skomplikowanym procesem o rożnym przebiegu zależnym od całokształtu
warunków.
Proc
esy powodujące ługowanie związków Fe ze skał :
Hydratacja
Hydroliza
Oddziaływanie CO
2
, SO
4
2-
, OH-, H+
Powstawanie kompleksów: żelazoorganicznych; połączenia Fe z substancją ilastą
Sorpcja powierzchniowa
Oddziaływanie mikroorganizmów
=> TLEN
jest gazem bezbarwnym, bez zapachu, nietoksycznym,
nieco cięższym od powietrza.
Zawartość tlenu w atmosferze, wodach i skorupie ziemskiej (do 16km głębokości) stanowi
prawie 50% ich składu chemicznego. Główne ilości tlenu występują w przyrodzie w postaci
związanej. Na przykład woda zawiera ok. 89% tlenu, piasek – 53% a organizm ludzki pok
65%. występuje w dwóch odmianach alotropowych – O
2
tlen i O
3
ozon.
Ozon O
3
jest niebieskim gazem, o większej gęstości od powietrza. Ma zapach powietrza po
burzy. W stanie wolnym występuje w atmosferze, powstaje w górnych warstwach atmosfery
pod wpływem promieniowania ultrafioletowego w wyniku rozpadu cząsteczek O
2
pod
wpływem światła i dalszego łączenia się ich.
Ozon otrzymuje się następująco:
•
przepuszczanie przez tlen wyładować elektrycznych
•
naświetlanie tlenu promieniami nadfioletowymi
•
reakcje chemiczne, w których wydziela się tlen, np. rozkład H
2
O
2
•
działanie fluoru na wodę
Zastosowanie
Tlen
– ze względu na niska cenę i łatwa dostępność jest jednym z najszerzej stosowanych
utleniaczy w przemyśle (np. przemysł hutniczy). Ponadto tlen jest wykorzystywany, w
palnikach do cięcia i spawania metali, jako utleniacz w paliwach rakietowych, czy w
medycynie.
Świat zwierząt – tlen wdychany przez człowieka z atmosfery jest wiązany w płucach z
hemoglobiną krwi i przekazywany do poszczególnych komórek, które zużywają go w
procesie oddychania komórki. W czasie tego procesu węglowodany (cukry) utleniają się w
celu dostarczenia energii niezbędnej do zapewnienia działalności życiowej komórek.
Środowisko wodne – rozpuszczony w wodzie tlen jest potrzebny roślinom żyjącym w wozie
oraz do życia zwierząt. Z chwila, gdy stężenie rozpuszczonego tlenu zostanie obniżone
poniżej wartości dopuszczalnej, życie roślin i zwierząt zamiera, a w warunkach beztlenowych
powstają związki o właściwościach toksycznych, a woda zaczyna cuchnąć.
Wody podziemne
– najwyższe stężenia tlenu obserwujemy w wodach występujących płytko,
jest on bowiem prawie wyłącznie pochodzenia atmosferycznego. Przy infiltracji wód przez
glebę następuje ich zubożenie w tlen. Gaz ten jest zużywany w procesach glebowych,
głównie przy mikrobiologicznym rozkładzie materii organicznej. Zawartość rozpuszczonego
tlenu w wodach gruntowych wynosi najczęściej poniżej 10mg/L.

=> KRZEM
Udział krzemu w budowie skorupy ziemskiej oceniany jest na 26,03%. W przyrodzie
wys
tępuje w postaci różnych związków, głównie krzemianów i glinokrzemianów, a także w
postaci wolnego dwutlenku krzemu SiO
2
. Związki krzemowe wchodzą w skład piasku, gliny,
większość skał i minerałów. Ze znanych postaci występowania SiO
2
, należy wymienić
kwarc.
Jest to pierwiastek biogenny, nieodzowny w rozwoju życia organicznego, występujący w
szczątkach organicznych, intensywnie wychwytywany z morskich i lądowych wód
powierzchniowych przez niektóre organizmy, budujące szkielety krzemionkowe, np.
okrzemki, g
ąbki. Źródłem krzemu w wodach podziemnych jest rozpuszczanie minerałów –
form SiO
2
(kwarcu, chalcedonu) oraz wietrzenie pierwotnych i wtórnych krzemianów. W
warunkach naturalnych przeobrażenia pierwotnych krzemianów zachodzić mogą
wielostopniowo.
=> GLIN
Jednym z najbardziej rozpowszechnionych w przyrodzie metali 13 grupy jest glin. Stanowi
on 7,28% ogólnej masy pierwiastków wchodzących w skład skorupy ziemskiej zajmując
trzecie miejsce po tlenie i krzemie, a pierwsze spośród metali. Glin występuje w przyrodzie
jedynie w postaci różnych połączeń z innymi pierwiastkami, głównie jako składnik
glinokrzemianów i tlenku glinowego. Rozpuszcza się dobrze w kwasie solnym dając chlorek
glinowy AlCl
3
, słabiej w rozcieńczonym kwasie siarkowym, tworząc siarczan (VI) gliny
Al2(SO
4
)
3
.
Glin jest metalem reaktywnym, silnie ogrzewany spala się gwałtownie w powietrzu czy tlenie.
Pył glinowy tworzy z powietrzem mieszaninę wybuchową. Jednak w zwykłych warunkach glin
szy
bko pokrywa się cienka, wytrzymałą warstwą tlenku glinowego, która chroni metal przed
dalszą korozją.
Glin, mimo że jest bardzo rozpowszechniony w litosferze, jest jednak mało ruchliwy w
hydrosferze. Jego rozpuszczalność w wodach różnych środowisk wynika z właściwości
amfoterycznych. Główna zmienną kierującą uruchamianiem glinu do wód jest odczyn
środowiska. Największą rozpuszczalność glin osiąga w wodach środowisk silnie kwaśnych
(np. w obszarach aktywnego wulkanizmu, strefach utleniania złóż siarczków) i silnie
zasadowych (w otoczeniu jezior alkalicznych, strefach rozpuszczania produktów
niskociśnieniowego, termicznego metamorfizmu skał węglanowych).
17. OPISAĆ I NARYSOWAĆ ORBITALE:
Orbital atomowy - funkcja falow
a opisująca stan elektoronu w atomie. Jest to przestrzeń ,w
której prawdopodobieństwo znalezienia elektoronu jest największe.
Orbital typu s -
powłoka o głównej licznie kantowej n=1 składa się z jednego typu orbitalu 1s

tworzącego kulistą powłokę K.
Orbital typu p -
elektrony w powłoce n=2 mogą mieć wartość l.pobocznej 1=0 i 1 tzn oprócz
orbitali typu s pojawiają sie orbitale typu p.
Orbital typu d i f - poziom n=3 obejmuje podpoziomy s, p ,d
18. HPLC:
Klasyczna chromatografia cieczowa polega na stosowaniu kolumn szklanych, k
tóre wypełnia
się sorbentem i rozpuszczalnikiem. Do kolumny wprowadza się badaną próbkę zawierająca
kilka składników i przepuszczając przez kolumnę rozpuszczalnik eluuje się z kolumny na
poszczególne składniki. Składniki występujące w wycieku z kolumny oznacza się właściwa
dla nich metodą, np. spektrofotometryczną, polagraficzną i in. czasami zwiększa się
przepływ rozpuszczalnika przez kolumnę, stosując podwyższone ciśnienie. Klasyczna
chromatografia cieczowa charakteryzująca się niską sprawnością kolumny i długim czasem
rozdziału, ma ograniczoną użyteczność.
Dopiero zastosowanie wypełnienia o bardzo drobnym uziarnieniu (2-10 mikrom), pomp
wymuszających przepływ fazy ruchomej pod dużym ciśnieniem oraz krótkich kolumn o
długości do 250 mm, radykalnie poprawiło sprawność i szybkość rozdzielania...
Zestaw HPCL składa się z:
• pompy (dla utrzymania wysokiego ciśnienia cieczy)
• dozownika l;ub auto – samplera (doprowadzającego badaną próbkę do systemu)
• detektora (analizator próbki)
• skomputeryzowanego systemu obróbki danych lub rejestratora (zapisywanie
chromatogramu)
Jak działa kolumna chromatograficzna?
Dlaczego ulegają rozdzieleniu?
Żółte lubią ruchomą fazę i poruszają się szybko jako pierwsze
Czerwone lubią fazę stacjonarna i dlatego poruszają się powoli
Niebieskie lubią stacjonarna najbardziej i dlatego poruszają się najwolniej
Detektory
– służą do oznaczania stężeń substancji zawartych w rozpuszczalniku w
momencie opuszczania kolumny chromatograficznej. Rozróżnia się dwa typy detektorów:
mierzące sumaryczne właściwości cieszy i mierzące właściwości rozpuszczonej substancji.
EC
– elektrochemiczne – mierzy prąd z elektrody roboczej (węgiel szklisty, Pt, Au) przy
odpowiednim potencjale
• bardziej czuła niż fluorymetria
• wadami są: łatwość zanieczyszczenia elektrody oraz duża czułość na zmianę natężenia
przepływ i temperaturę
• wymaga wysokiej czystości rozpuszczalników oraz częstej kalibracji
MS
– spektrometr mas – mierzy stosunek masy do ładunku jonu {m/z} – pozwala na
identyfikację właściwych składników – masa molekularna/fragmentacja
Zastosowanie
Przydatność chromatografii cieczowej jest obecnie porównywalna do użyteczności
chromatografii
gazowej. Chromatografia cieczowa jest szczególnie przydatna do rozdzielania
związków, których bez rozkładu nie można przeprowadzić w stan gazowy. Pozwala ona na
rozdzielenie związków o bliskich sobie masach cząsteczkowych od ok 100 do kilku mln.
Metoda nad
aje się do identyfikacji i ilościowego oznaczania wielu związków organicznych w
wodach i skałach osadowych. Wykazuje ona wiele zalew w oznaczaniu wielopierścieniowych
węglowodorów aromatycznych, pestycydów, aldehydów, substancji powierzchniowo
czynnych, węglowodorów, fenoli, estrów ftalowych i innych związków.
19. ANIONY W GRUPIE ALKALICZNEJ
!!! nie do końca wiem o co chodzi, prawdopodobnie to jest to !!!
=> ANALIZA ANIONÓW
Podział anionów na grupy analityczne, przy którym to podziale stosuje się różne kryteria.
Najprostsz
y sposób podziału (Wprowadzony przez Bunsena) polega na różnicy
rozpuszczalności soli, srebra i baru w wodzie oraz HNO
3
i obejmuje 7 grup analitycznych:
I.
grupę analityczną reprezentuje jon chlorkowy (Cl¯). Aniony tej grupy tworzą w z jonami Ag
+
osady rozpuszczalne w wodzie i HNO
3
, natomiast w reakcji z jonami Ba
2+
powstają produkty
dobrze rozpuszczalne w wodzie.
II
grupę analityczną tworzą jony octanowe CH3COO¯ i azotanowy (III) (NO
2
). Jony Ag
+
wytrącają ze stężonych roztworów zawierających aniony tej grupy białe osady łatwo
rozpuszczalne w HNO
3
. Jony Ba
2+
z anionami tej grupy tworzą sole bardzo dobrze
rozpuszczalne w wodzie.
III.
grupa analityczna reprezentuje anion węglanowy ( CO
3
2-
). Zarówno z jonami Ag
+
jak i Ba
2+
tworzą trudno rozpuszczalne w wodzie osady o barwie białej, które rozpadają się do HNO
3
.
IV.
W skład tej grupy analitycznej wchodzi anion fosforanowy ( PO
4
3-
)
V. Aniony z tej grupy to aniony azotanowe (V) NO
3
-
VI. grupa aniony siarczanowe (IV) SO
3
2-
VII. grupa aniony siarczanowe (VI) SO
4
2-
=> ANALIZA KATIONÓW
Obejmuje 5 grup analitycznych i jest oparta na różnicach rozpuszczalności chlorków,
siarczków. Do roztworu dodaje się odpowiedni odczynnik grupowy. Jeśli nastąpiło strącenie
osadu, oznacza to że jakieś kationy z danej grupy są obecne w roztworze.
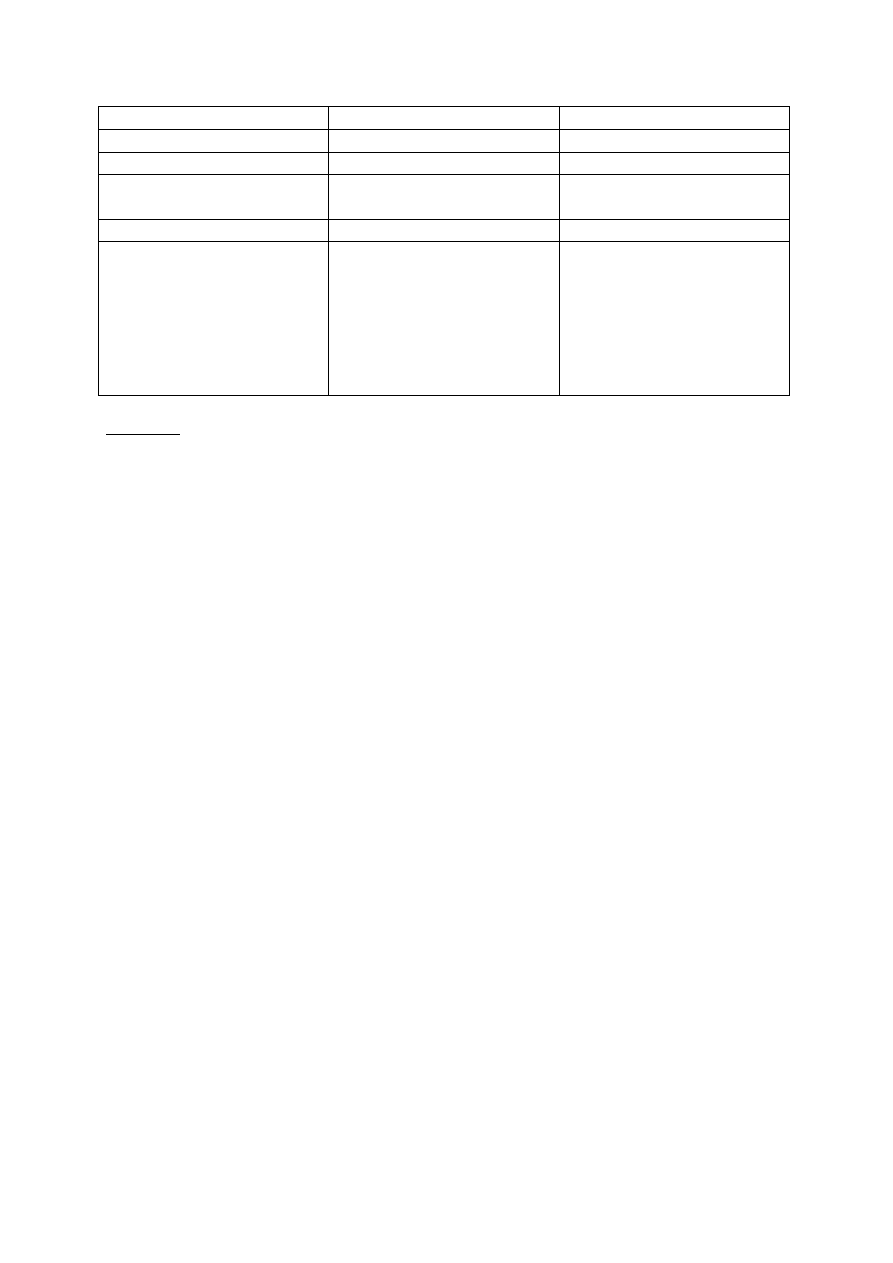
Grupa analityczna
Odczynnik grupowy
Kationy
I
2 molowy HCl
Ag
+
, Pb
2+
, Hg
2
2+
II
H
2
SO
4
lub (NH
4
)
2
CO
3
Pb
2+
, Sn
2+
, Co
2+
III
H
2
S w środowisku 0,3 mol
HCL
Hg
2+
,Bi
3+
, Cu
2+
, Cd
2+
, Sn
2+
,
Sn
4+
, As
3+
, As
6+
IV
(NH
4
)
2
CO
3
Ba
2+
, Sr
2+
, Ca
2+
V
Brak(ponieważ większość
soli tych kationów są dobrze
rozpuszczalne w wodzie, co
stwarza problemy z ich
identyfikacją z powodu małej
ilości reakcji
charakterystycznych.)
Na
+
, K
+
, NH
4
+
, Mg
2
+
20. ChZT
– czyli ogólna powtorka skryptów lub modlitwa o dobrą pamięć z ćwików
Wyszukiwarka
Podobne podstrony:
Egzamin chemia opracowane pytania1
Opracowanie egzamin chemia, AGH, AGH
opracowane pytania egzaminacyjne chemia
zagadnienia opracowane na egzamin 2 chemia srodow ściąci, chemia środowiska
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Chemia fizyczna teoria
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
Chemia Egzamin chemia
egzamin z sorbentów opracowanie pytań 1 2 JM
Chemia opracowanie
chemia opracowanie id 112613 Nieznany
Egzamin Chemia organiczna zestawy 1 8
Egzamin licencjacki Opracowane pytania finanse i rachunkowość collegium mazowia
Egzamin GPS opracowane zagadnie Nieznany
chemia - opracowane pytania, chemia
Chemia opracowanie 2
więcej podobnych podstron