
Wyk
łady z chemii
dla studentów Wydzia
łu Inżynierii Lądowej i Geodezji
Wojskowej Akademii Technicznej
Prowadz
ący:
Dr hab. in
ż. Andrzej Sadkowski, profesor W.A.T.
Wydzia
ł Nowych Technologii i Chemii.
Wyk
ład 6.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

2
Reakcje:
A + B
AB
synteza
analiza (rozk
ład)
AB
A + B
AB + C
AC + B
wymiana pojedyncza
wymiana podwójna
AB + CD
AC + BD
Mo
że im towarzyszyć (lub nie) zmiana stopnia utlenienia reagentów.
Je
śli następuje zmiana stopnia utlenienia – reakcja jest typu redox (redukcji-
utleniania).
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

3
W chemii organicznej pospolite s
ą reakcje przyłączania do podwójnego
wi
ązania.
Np. uwodornienie, chlorowanie itp.
Protoliza: reakcje przeniesienia protonu:
NH
3
H
NH
4
HC
CH HCl H
2
C CH Cl
H
2
O
H
H
3
O
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

4
Klasyczna teoria kwasów i zasad (teoria Arrheniusa) :
Kwasy to substancje dysocjuj
ące w elektrolicie z uwolnieniem jonu
wodorowego (protonu):
H
2
SO
4
H
HSO
4
HSO
4
H
SO
4
2
Zasady to substancje dysocjuj
ące w elektrolicie z uwolnieniem jonu
wodorotlenowego:
NH
4
OH NH
4
OH
NaOH
Na
OH
HCl
H
Cl
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

5
Wed
ług teorii Broensteda:
kwas
proton + zasada
Np.: woda, wg tej teorii pe
łni podwójną rolę, zarówno kwasu jak i zasady.
HCl
H
Cl
kwas
zasada
H
2
O
H
H
3
O
H
3
O
H
H
2
O
Kwas
zasada
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

6
Protoliza wyst
ępuje w reakcjach:
a) Zoboj
ętniania
b) Podstawienia i
c) Hydrolizy.
Ad a) Zoboj
ętnianie:
OH
H
3
O
2
H
2
O
NaOH
HCl
NaCl
H
2
O
Ca
OH
2
H
2
CO
3
CaCO
3
2
H
2
O
Wi
ązanie zaprawy wapiennej
Ca
OH
2
2 HNO
3
4
H
2
O
Ca
NO
3
2
.4
H
2
O
2
H
2
O
Wykwity saletry wapiennej na murach
2 NaOH
H
2
SiO
3
Na
2
SiO
3
2
H
2
O
Reakcja alkali-krzemianowa korozji betonu.
Typowe, np. miareczkowanie w laboratorium
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

7
Podstawienie, np. wypieranie s
łabego kwasu z jego soli przez mocniejszy kwas:
Ad b)
CaCO
3
H
2
SO
4
H
2
O
CaSO
4
.2
H
2
O
CO
2
Rozk
ład kamienia lub spoiwa wapiennego na skutek „kwaśnych deszczów”.
Tworzy si
ę gips.
CaCO
3
2 HCl CaCl
2
H
2
O
CO
2
Próba na obecno
ść węglanów: po dodaniu HCl wydzielają się pęcherzyki CO2.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

8
Ad c)
Hydroliza (protoliza) soli: reakcja z wod
ą soli słabego kwasu lub słabej zasady. W
wyniku tej reakcji powstaje mocniejszy kwas lub zasada, roztwór przybiera odczyn
kwa
śny lub zasadowy.
KX
H
2
O
HX KOH
K – kation, X – anion
Zale
żnie od tego czy sól była mocnego
kwasu czy mocnej zasady, w wyniku
hydrolizy roztwór staje si
ę kwaśny lub
zasadowy.
Ca
2
SiO
4
2
H
2
O
CaSiO
3
.
H
2
O
Ca
OH
2
Reakcja zachodzi w trakcie wi
ązania cementu portlandzkiego. Tworzy
si
ę odczyn zasadowy (Ca(OH)
2
jest mocniejsz
ą zasada niż H
2
SiO
3
jest
kwasem)
Ca
2
SiO
4
CaSiO
3
.CaO
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

9
FeSO
4
+ 2 H
2
O
Fe(OH)
2
+ H
2
SO
4
(H
2
SO
4
– silny kwas, Fe(OH)
2
– s
łaba
zasada, wypada w postaci osadu)
Reakcja zachodzi w trakcie korozji
żelaza. Daje odczyn kwaśny.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

10
Reakcje utleniania i redukcji (redox):
Oddanie elektronu przez atom pierwiastka nazywamy jego utlenieniem.
Towarzyszy temu podwy
ższenie wartościowości.
Przy
łączenie elektronu przez atom pierwiastka nazywamy jego redukcją.
Towarzyszy temu obni
żenie wartościowości.
Obie reakcje utleniania i redukcji zachodz
ą zwykle w parze. Jeden
reagent utlenia si
ę kosztem drugiego. Dlatego para takich reakcji
okre
ślana jest skrótowo reakcją redox (reduction + oxidation).
Przyk
łady:
4 Al + 3 O
2
2 Al
2
O
3
Al ulega utlenieniu, O
2
ulega redukcji.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

11
Reagenty wyj
ściowe maja wartościowość (stopień utlenienia) 0. W produkcie
Al
2
O
3
atom Al Jest na stopniu utlenienia +3, O jest na stopniu utlenienia -2.
Suma
ładunków cząsteczki obojętnej musi być równa zeru!
4 Al
0
3
O
2
0
4 Al
2
3
O
3
2
Jest to reakcja pasywacji aluminium, której ten bardzo reaktywny
metal zawdzi
ęcza swoją trwałość w atmosferze ziemskiej. Utlenianie
metalu jest tu procesem korzystnym dla jego zastosowa
ń
praktycznych.
2 Fe
0
O
2
0
2
Fe
2
O
2
4 Fe
0
3
O
2
0
2 Fe
2
3
O
3
2
Reakcje utlenienia
żelaza do
stopnia utlenienia +2 i +3 (dawniej
mówi
ło się: tlenek żelazawy i
żelazowy)
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
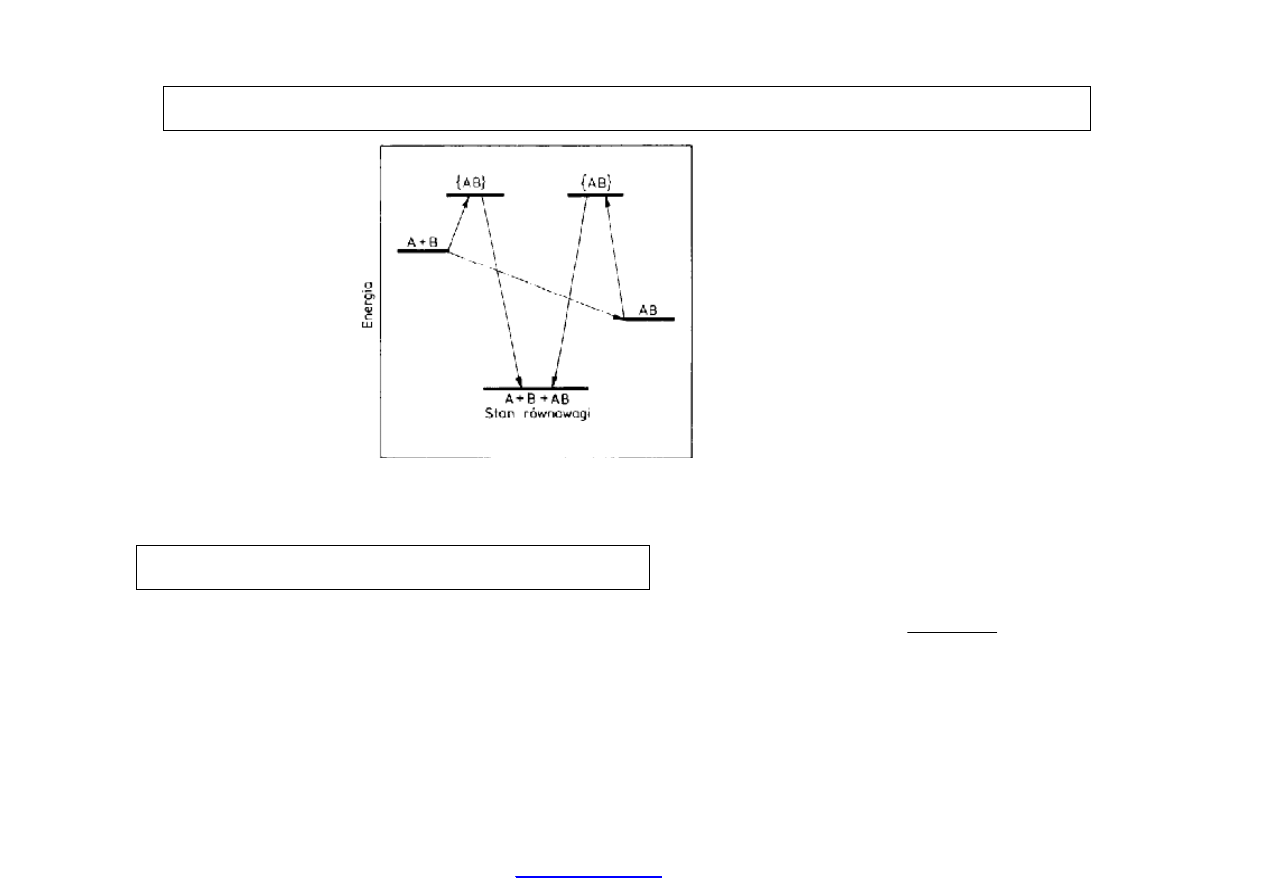
12
Termodynamika (Energetyka) chemiczna:
Schemat uk
ładu reakcyjnego A + B
AB z udziałem kompleksu aktywnego {AB}
Prawo dzia
łania mas i stała równowagi:
K
c
C
c
c
D
d
c
A
a
c
B
b
a A
b B
c C
d D
Sta
ła równowagi odnosi się do reakcji w układach jednorodnych
(homogennych, wszystkie st
ężenia są zmienne) i w układach niejednorodnych
(heterogennych, niektóre st
ężenia są stałe = 1)
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

13
Przyk
ład: stała równowagi dysocjacji czystej wody:
H
2
O
H
OH
c
H
c
OH
10
7
mol
dm
3
C
H2O
n
V
m
M
1 dm
3
1000
g
18
g
mol
1 dm
3
55, 6 mol
dm
3
K
c
c
H
C
OH
C
H2O
K
c
10
7
mol
dm
3
2
55.6 mol
dm
3
1.8 10
16
mol
dm
3
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
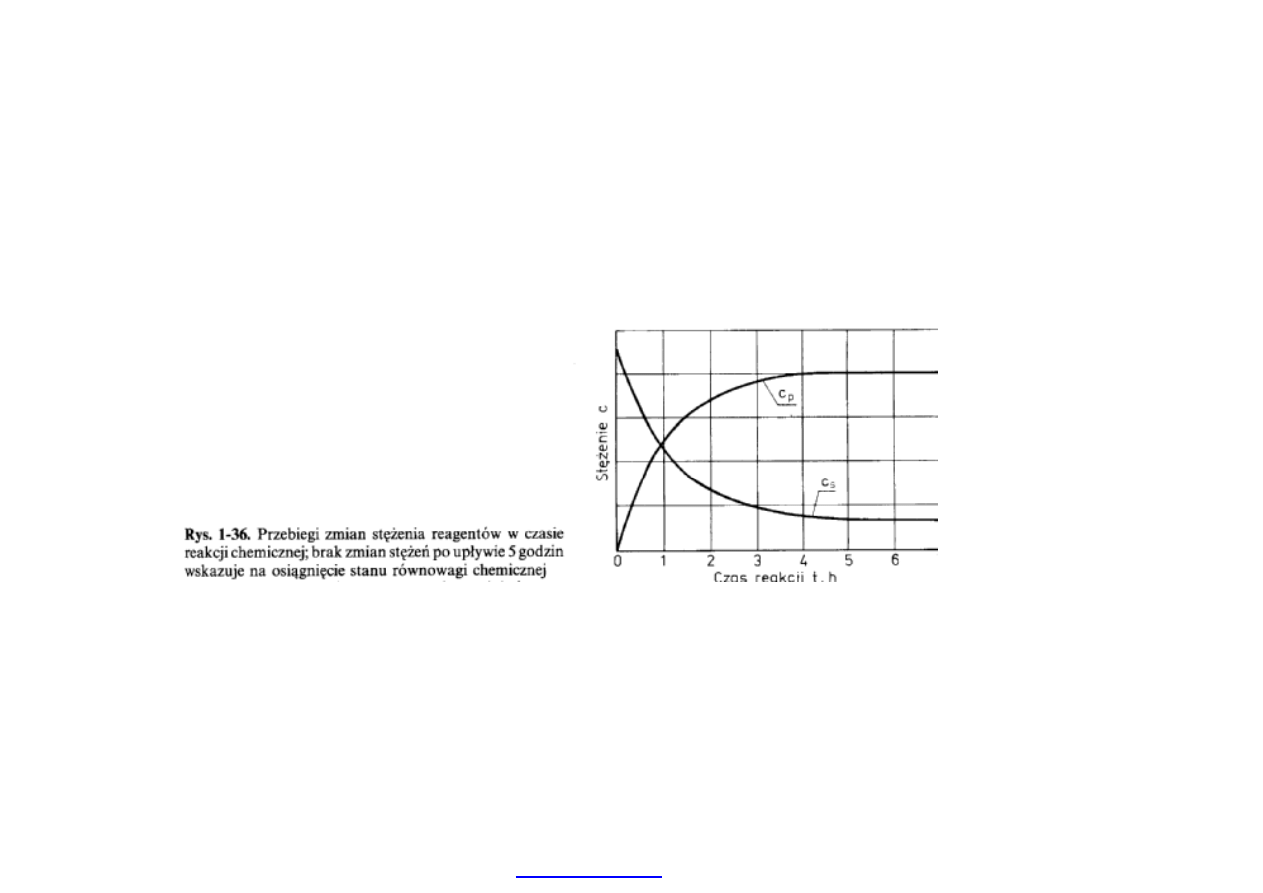
14
Warto
ści stężeń wchodzące w stałą równowago to stężenia
równowagowe, po doj
ściu reakcji do końca (poniższy rysunek).
Temu stanowi odpowiada minimum energetyczne.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

15
Zale
żność stałej równowagi od temperatury:
lnK
T
p
Q
p
R T
2
Zale
żność stałej równowagi od ciśnienia:
lnK
p
T
V
R T
Reakcje egzotermiczne – przebiegaj
ą z oddaniem ciepła (uwolnieniem
energii), tj. zmniejszaj
ą energię układu reagującego.
Reakcje endotermiczne – przebiegaj
ą z pochłonięciem ciepła
(powi
ększają energię układu reagującego)
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

16
Równowaga w uk
ładach niejednorodnych. Np.:
CaCO
3
CaO
CO
2
K
p
p
CaO
p
CO2
p
CaCO3
1
p
CO2
1
p
CO2
Regu
ła przekory Le Chatelier’a :
Ka
żdy układ w stanie równowagi poddany działaniu czynnika zewnętrznego
naruszaj
ącego ten stan równowagi, reaguje w sposób prowadzący do
zmniejszenia tego dzia
łania.
W szczególno
ści, zmiany temperatury, ciśnienia i stężeń reagentów w stanie
równowagi prowadz
ą do reakcji „niwelującej” te zmiany.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
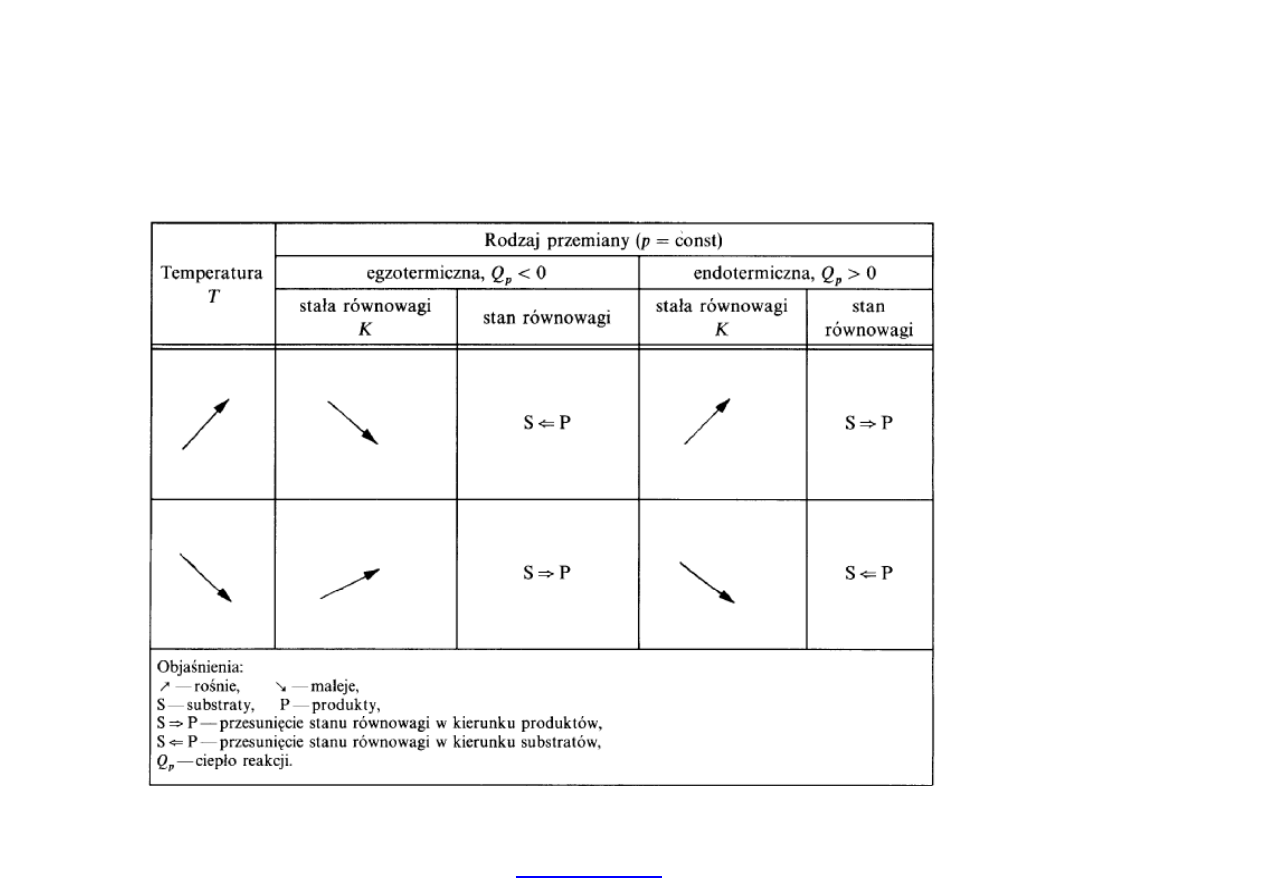
17
Wp
ływ zmian temperatury na stan równowagi:
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
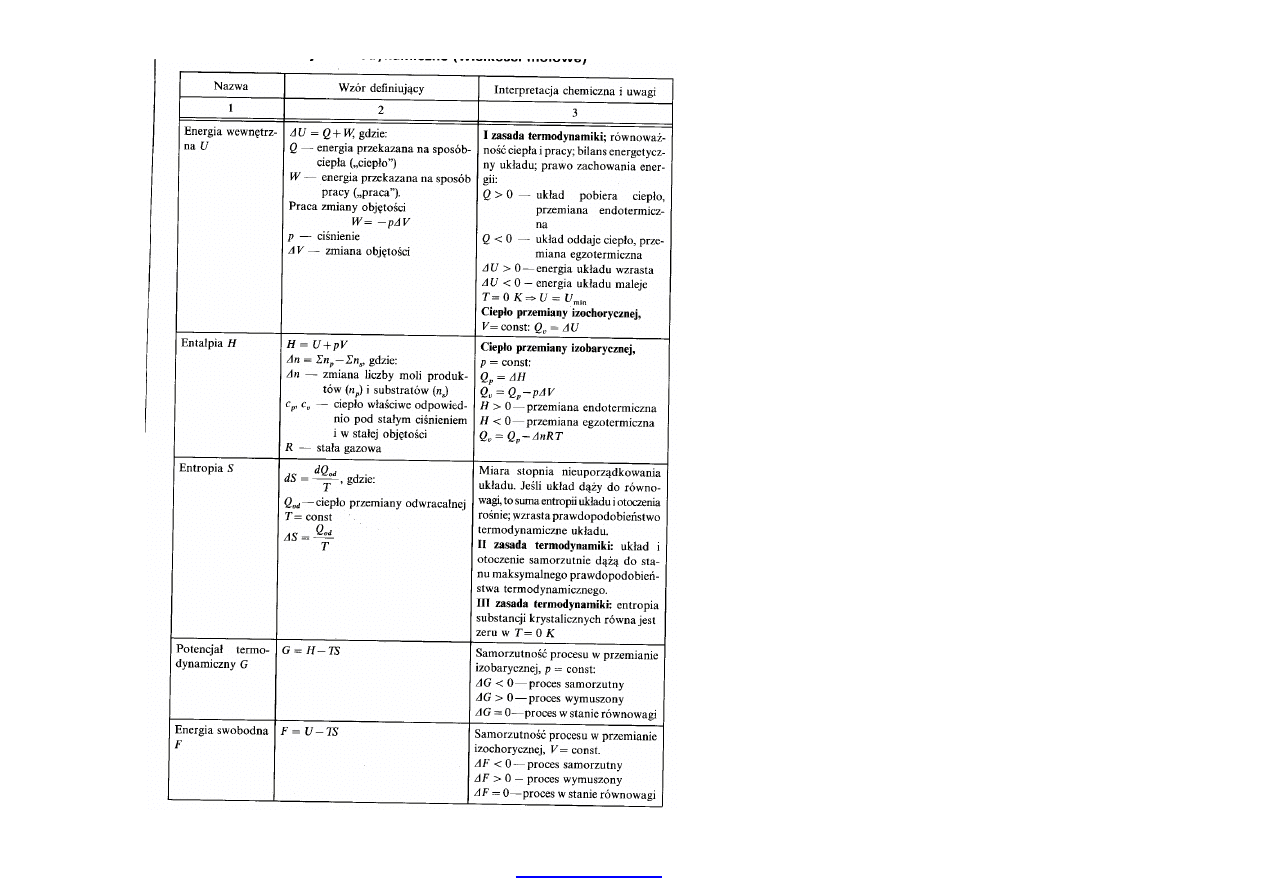
18
Podstawowe funkcje
termodynamiczne w
odniesieniu do 1 mola
reagenta.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

19
Prawa termodynamiki:
I. W uk
ładzie izolowanym (bez wymiany masy i energii z otoczeniem)
energia pozostaje sta
ła. Energia wewnętrzna U może być zmieniana na
sposób ciep
ła i na sposób pracy: ΔU = q + w. Wartości ciepła i pracy
dodane przez otoczenie do uk
ładu uważa się za dodatnie. Odebrane – za
ujemne.
II. W procesach bez wymiany ciep
ła z otoczeniem entropia może tylko być
sta
ła (procesy odwracalne) lub rosnąć (procesy nieodwracalne). Entropia
jest funkcj
ą stanu:
S
q
rev
T
q
rev
– ciep
ło dostarczone w procesie odwracalnym, T
temperatura Kelvina
III. Entropia idealnego kryszta
łu dąży do zera ze spadkiem temperatury Kelvina
do zera. S
łuży do wyznaczania bezwzględnych wartości entropii substancji.
Wychodz
ąc z II prawa termodynamiki definiujemy termodynamiczne
funkcje stanu, w
śród nich najważniejszą: swobodną entalpię Gibbsa:
G = H – T S = U + p V – T S.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

20
a A
b B
c C
d D
Dla reakcji:
Zapis (stechiometryczny) równania reakcji ma wygodn
ą postać:
0
c C
d D
a A
b B
A, B, C, D - symbole reprezentuj
ące wzory chemiczne reagentów.
c, d, -a, -b to wspó
łczynniki stechiometryczne poszczególnych reagentów
(liczba cz
ąsteczek biorących udział w reakcji „ + ” dla produktów, „ - ” dla
substratów).
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

21
Np. spalanie CO do CO
2
:
2 CO (g) + O
2
(g)
2 CO
2
(g)
Piszemy w postaci:
0 = 2 CO
2 (g)
- 2 CO
(g)
- O
2 (g)
Wa
żną wielkością jest tu zmiana liczby cząsteczek w reakcji, zwłaszcza
gazowych:
Δn
g
= -1
I w ogólno
ści:
0
J
n
J
J
J - to symbol reagenta, substratu lub produktu reakcji,
n
J
–wspó
łczynnik stechiometryczny tego reagenta, dodatni dla produktu,
ujemny dla substratu.
0 po lewej stronie wynika z prawa zachowania masy (ilo
ści substancji) w
reakcjach chemicznych.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

22
Wzór
jest pomocny przy pisaniu wzorów bilansu energii
swobodnej
Δ
r
U, entalpii
Δ
r
H , entropii Δ
r
S i swobodnej entalpii (energii) Gibbsa
Δ
r
G reakcji:
0
J
n
J
J
r
U
J
n
J
U
m,J
r
H
J
n
J
H
m,J
r
G
J
n
J
G
m,J
J
n
J
J
r
S
J
n
J
S
m,J
Po lewej strony nie s
ą już zera, tylko
warto
ści funkcji termodynamicznej (U, H,
S, G) reakcji, tj. zmiana tej funkcji w
wyniku zaj
ścia reakcji jeden raz.
U
m
, H
m
, S
m
, G
m
to wielko
ści molowe
funkcji termodynamicznych
Wszystkie te wielko
ści z indeksem
0
(U
0
, H
0
, S
0
, G
0
) to warto
ści funkcji
termodynamicznych w warunkach standardowych (ci
śnienie 1 bar a temperatura
„dana”, tj. dowolna). W tablicach termochemicznych podaje si
ę te wartości dla
T=298K. Dla przeliczenia na inn
ą temperaturę potrzebne są dodatkowo wartości
pojemno
ści cieplnych.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

23
Dla pierwiastków (w postaci trwa
łej w warunkach otoczenia)
J/mol
W rezultacie, dla zwi
ązków chemicznych wartości tych funkcji
termodynamicznych s
ą równe wartościom funkcji (energii wewnętrznej,
entalpii, swobodnej entalpii Gibbsa) tworzenia zwi
ązków z pierwiastków.
Na przyk
ład dla reakcji spalania węgla w postaci grafitu:
C
graf
+ O
2
(g)
CO
2
(g)
ΔH
0
r
=
ΔH
0
sp
= -393,5 kJ
Jest ciep
łem (entalpią) spalania grafitu, ciepłem (entalpią) tworzenia CO
2
i
molow
ą entalpią CO
2
.
U
m
0
H
m
0
G
m
0
0
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

24
Prawo Hessa:
Efekt energetyczny (energia wewn
ętrzna = q
V
, entalpia = q
p
) danej reakcji
jest sum
ą efektów dla oddzielnych reakcji, z których można złożyć daną
reakcj
ę.
Np. entalpi
ę tworzenia metanu przez uwodornienie węgla w postaci grafitu
C
(graf)
+ 2 H
2
(g)
CH
4
(g)
ΔH
298
= ?
liczymy ze znajomo
ści entalpii (ciepeł) spalania wszystkich reagentów:
a) CH
4
(g) + 2O
2
(g)
CO
2
(g) + 2H
2
O(l)
ΔH
298
= -890,35 kJ
b) H
2
(g) + 1/2O
2
(g)
H
2
O(l)
ΔH
298
= -285,84 kJ
c) C(
graf
) + O
2
(g)
CO
2
(g)
ΔH
298
= -393,51 kJ
--------------------------------------------------------------------------------------------------------------------------------
Reakcj
ę spalania grafitu można złożyć algebraicznie z powyższych reakcji
spalania:
-(a) + 2 (b) + (c): C
(graf)
+ 2 H
2
(g)
CH
4
(g)
ΔH
298
= -74,84 kJ
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

25
Prawo Kirchoffa:
H
T
2
H
T
1
T1
T2
C
P
T
Zale
żność entalpii dowolnej substancji od temperatury wyraża się wzorem:
C
p
– pojemno
ść cieplna pod stałym
cienieniem.
H
T
2
H
T
1
T1
T2
C
P
T
Podobnie zale
żność entalpii dowolnej reakcji od temperatury wyraża się
wzorem:
Δ C
p
– pojemno
ść cieplna reakcji
pod sta
łym cienieniem.
Pojemno
ść cieplna reakcji składa się z pojemności cieplnych reagentów zupełnie
podobnie jak entalpia, energia wewn
ętrzna i swobodna entalpia Gibbsa reakcji
sk
łada się z udziałów reagentów (równanie stechiometryczne).
C
P
n
pr
C
P
produkty
n
substr
C
P
substraty
J
n
J
C
P
J
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
Wyszukiwarka
Podobne podstrony:
NO6 RLC MOSTKI, Mrn6tabele, WYDZIA˙ ELEKTRONIKI
no6 pusz rolski id 320553 Nieznany
NO6 RLC MOSTKI, MR6 OPR, LABORATORIUM PODSTAW MIERNICTWA
NO6 RLC MOSTKI, thom6, WYDZIAŁ ELEKTRONIKI
no6 kopocinski
NO6 RLC MOSTKI, LABMIER6, Damian grupa 2
NO6 RLC MOSTKI, MRN6, WYDZIA˙ ELEKTRONIKI
NO6 RLC MOSTKI, lab mier6, Pomiar pierwszy
Federal law no6
No6
Chopin Reger Etude No4 after Etude, Op25 No6
KONSPEKT LEKCJI Z PILKI NO6
WTC1 BWV851 Prelude No6
bwv1012 1 prelude cello suite no6 (j s bach classical guitar)
No6 DaysintheWestBlock
No6 Beyond
więcej podobnych podstron