1
Funkcje falowe w atomie wodoru
Wartości przyjmowane przez liczby kwantowe
n,
llll, m
mają wpływ na postać funkcji falowej
)
,
,
(
)
,
,
(
)
,
,
(
ϕ
θ
ϕ
θ
r
r
z
y
x
n,l,m
Ψ
=
Ψ
=
Ψ
)
,
(
Y
)
(
R
)
,
,
(
ϕ
θ
ϕ
θ
l,m
n,l
n,l,m
r
r
⋅
=
Ψ
Funkcja
, która spełnia równanie Schrödingera, nosi nazwę
ORBITALU
ORBITAL ATOMU WODORU
= Funkcja falowa elektronu
w atomie wodoru
Orbitale atomu wodoru (1)
Poboczna liczba kwantowa
ma oznaczenia literowe:
l
l
l
l
0
1
2
3
4
s
s
harp
p
p
rincipal
d
d
iffuse
f
f
unda-
mental
g
Uwaga! Nie kryje się za tym żaden głęboki sens, to
jest po prostu sposób na łatwiejsze pamiętanie ...
Orbitale atomu wodoru (2)
• Orbital 1s: n=1, llll=0, m=0
)
,
(
Y
)
(
R
)
,
,
(
)
,
,
(
00
10
100
100
ϕ
θ
ϕ
θ
⋅
=
Ψ
=
Ψ
r
r
z
y
x
a
h
m e
pm
o
e
0
2
2
52 9
=
=
ε
π
,
0
1
2
3
4
5
r/a
0
r
2
R
2
1 s
Część radialna, R
1,0
(r)
E
1
= -13,6 eV
)
exp(
2
)
(
0
2
/
3
0
a
r
a
r
R
−
⋅
=
−
• Część kątowa
Y(θ,φ)
Orbitale atomu wodoru (3)
ns
1s
wykres łączy punkty o
jednakowej wartości
funkcji kątowej, czyli
jednakowej gęstości
prawdopodobieństwa
znalezienia elektonu
π
ϕ
θ
4
1
)
,
(
=
Y
Orbitale atomu wodoru (4)
•
Orbital 2s: n=2, l=0, m=0
)
,
(
Y
)
(
R
)
,
,
(
)
,
,
(
00
20
200
200
ϕ
θ
ϕ
θ
⋅
=
Ψ
=
Ψ
r
r
z
y
x
0
5
10
r/a
0
r
2
R
2
2 s
E
2
= -3,4 eV
Część radialna, R
2,0
(r)
( )
)
exp(
1
2
1
)
(
0
0
2
2
/
3
0
a
r
a
r
a
r
R
−
⋅
−
⋅
=
−
Orbitale atomu wodoru (5)
ns
2s
E
2
= -3,4 eV
π
ϕ
θ
4
1
)
,
(
=
Y
• Część kątowa
Y(θ,φ)
2
0
5
10
15
r/a
0
r
2
R
2
2 p
Orbitale atomu wodoru (6)
Orbitale 2p: n=2, l=1, m=0, ±1
Ψ
210
(x,y,z), Ψ
211
(x,y,z), Ψ
21,-1
(x,y,z) ; R
21
(r)
E
2
= -3,4 eV
Część radialna, R
2,1
(r)
( )
0
2
0
1
,
2
exp
6
2
1
)
(
a
r
r
a
r
R
−
⋅
⋅
=
Orbitale atomu wodoru (7)
)
,
(
Y
),
,
(
Y
),
,
(
Y
1
1
11
10
ϕ
θ
ϕ
θ
ϕ
θ
E
2
= -3,4 eV
θ
ϕ
θ
π
cos
)
,
(
4
3
0
,
1
=
Y
2p
z
ϕ
θ
ϕ
θ
π
cos
sin
)
,
(
4
3
1
,
1
=
Y
2p
x
ϕ
θ
ϕ
θ
π
sin
sin
)
,
(
4
3
1
,
1
=
−
Y
2p
y
θ
θ
ϕ
θ
ϕ
cos
sin
sin
sin
cos
⋅
=
⋅
⋅
=
⋅
⋅
=
r
z
r
y
r
x
M
M
M
Orbitale atomu wodoru (8)
orbitale np (np. 2p)
m = 0
m = 1
m = -1
płaszczyzna
węzłowa
xy
płaszczyzna
węzłowa
yz
płaszczyzna
węzłowa
xz
x
y
z
np
z
x
y
z
np
x
x
y
z np
y
Orbitale atomu wodoru (9)
)
,
(
Y
)
(
R
)
,
,
(
)
,
,
(
00
30
300
300
ϕ
θ
ϕ
θ
⋅
=
Ψ
=
Ψ
r
r
z
y
x
•
Orbital 3s: n=3, l=0, m=0
0
5
10
15
20
25
r/a
0
r
2
R
2
3 s
E
3
= -1,5 eV
Część kątowa
jest taka sama
dla wszystkich
orbitali ns
Część radialna, R
3,0
(r)
[
]
( )
0
2
0
2
0
2
3
3
9
2
0
3
9
2
0
,
3
exp
2
3
)
(
a
r
a
r
a
r
a
r
R
−
⋅
+
−
=
−
Orbitale atomu wodoru (10)
Orbitale 3p: n=3, l=1, m=0, ±1
Ψ
310
(x,y,z), Ψ
311
(x,y,z), Ψ
31,-1
(x,y,z) ; R
31
(r)
3p
z
, 3p
x
, 3p
y
0
5
10
15
20
25
r/a
0
r
2
R
2
3 p
Część radialna, R
3,1
(r)
Część kątowa
jest taka sama
dla wszystkich
orbitali np
E
3
= -1,5 eV
[
]
( )
0
0
2
5
3
3
0
6
27
4
1
,
3
exp
2
)
(
a
r
a
r
a
r
R
−
⋅
−
=
−
Orbitale atomu wodoru (11)
Orbitale 3d: n=3, l=2, m=0, ±1, ±2
Ψ
320
(x,y,z), Ψ
321
(x,y,z), Ψ
32,-1
(x,y,z), Ψ
322
(x,y,z),
Ψ
32,-2
(x,y,z) ; R
32
(r)
0
5
10
15
20
25
r/a
0
r
2
R
2
3 d
Część radialna, R
3,2
(r)
E
3
= -1,5 eV
( )
0
2
7
3
2
0
30
81
1
2
,
3
exp
)
(
a
r
r
a
r
R
−
⋅
⋅
=
−
3
2
2
2
3
,
3
,
3
,
3
,
3
z
y
x
yz
xz
xy
d
d
d
d
d
−
Orbitale atomu wodoru (12)
część kątowa orbitali 3d
( )
]
1
cos
3
[
,
2
16
45
0
,
2
−
=
θ
ϕ
θ
π
Y
)
3
(
2
z
d
( )
ϕ
θ
ϕ
θ
π
cos
2
sin
,
16
45
1
,
2
⋅
=
Y
)
3
(
xz
d
( )
ϕ
θ
ϕ
θ
π
sin
2
sin
,
16
45
1
,
2
⋅
=
−
Y
)
3
(
yz
d
( )
ϕ
θ
ϕ
θ
π
2
cos
2
sin
,
16
45
2
,
2
⋅
=
Y
)
3
(
2
2
y
x
d
−
( )
ϕ
θ
ϕ
θ
π
2
sin
2
sin
,
16
45
2
,
2
⋅
=
−
Y
)
3
(
xy
d
Orbitale atomu wodoru (13)
część kątowa orbitali 3d
x
z
y
xz
d
3
x
z
y
xy
d
3
x
z
y
yz
d
3
x
z
y
2
2
3
y
x
d
−
x
z
y
2
3
z
d
Orbitale atomu wodoru (14)
część radialna
0
1
2
3
4
5
r/a
0
r
2
R
2
1 s
0
5
10
r/a
0
r
2
R
2
2 s
0
5
10
15
20
25
r/a
0
r
2
R
2
3 s
0
5
10
15
r/a
0
r
2
R
2
2 p
0
5
10
15
20
25
r/a
0
r
2
R
2
3 p
0
5
10
15
20
25
r/a
0
r
2
R
2
3 d
liczba maksimów części radialnej
orbitalu wynosi zawsze n-l;
wysokość maksimów rośnie z r
Orbitale atomu wodoru (15)
część kątowa
ns
x
y
z
np
z
x
y
z
np
x
x
y
z
np
y
płaszczyzna xz
płaszczyzna xy,
na osiach
płaszczyzna xy
płaszczyzna yz
oś z,
w płaszczyźnie xy
Orbitale atomu wodoru
o
Nie oczekuję uczenia się wzorów poszczególnych
funkcji na pamięć – jest to wręcz niewskazane;
o
Oczekuję zapamiętania:
→
jak wygląda atom wodoru i równanie Schrödingera dla
atomu wodoru, i jak się je rozwiązuje (ogólnie);
→
co to są liczby kwantowe i skąd się wzięły, jakie
wielkości są kwantowane;
→
jaki jest związek orbitali z zestawem związanych z nimi
liczb kwantowych;
→
jak wyglądają wykresy części radialnej i kątowej dla
orbitali ns, np i nd (także dla różnych n, czyli kombinacji
n, llll, m);
Jony wodoropodobne
....
,
,
,
,
5
4
3
+
+
+
+
+
+
C
B
Be
Li
He
T
p
m
=
2
2
jak w atomie
wodoru
V
= −
⋅
Z
e
r
o
2
1
4
πε
gdzie Z - liczba
protonów w
jądrze
E
m
e
const
e
o
= −
=
π
ε
Z
2
4
2
2 h n
n
2
2
'
Wyniki:
orbitale jak w atomie wodoru,
energia uwzglednia wyższy ładunek jądra
M, M
z
, s, m
s
jak w atomie wodoru
4
Model atomu wodoru
a rzeczywistość
Doświadczalna weryfikacja wyników
Doświadczalna weryfikacja wyników
Doświadczalna weryfikacja wyników
Doświadczalna weryfikacja wyników
uzyskanych przez mechanikę kwantową
uzyskanych przez mechanikę kwantową
uzyskanych przez mechanikę kwantową
uzyskanych przez mechanikę kwantową
dla atomu wodoru
dla atomu wodoru
dla atomu wodoru
dla atomu wodoru
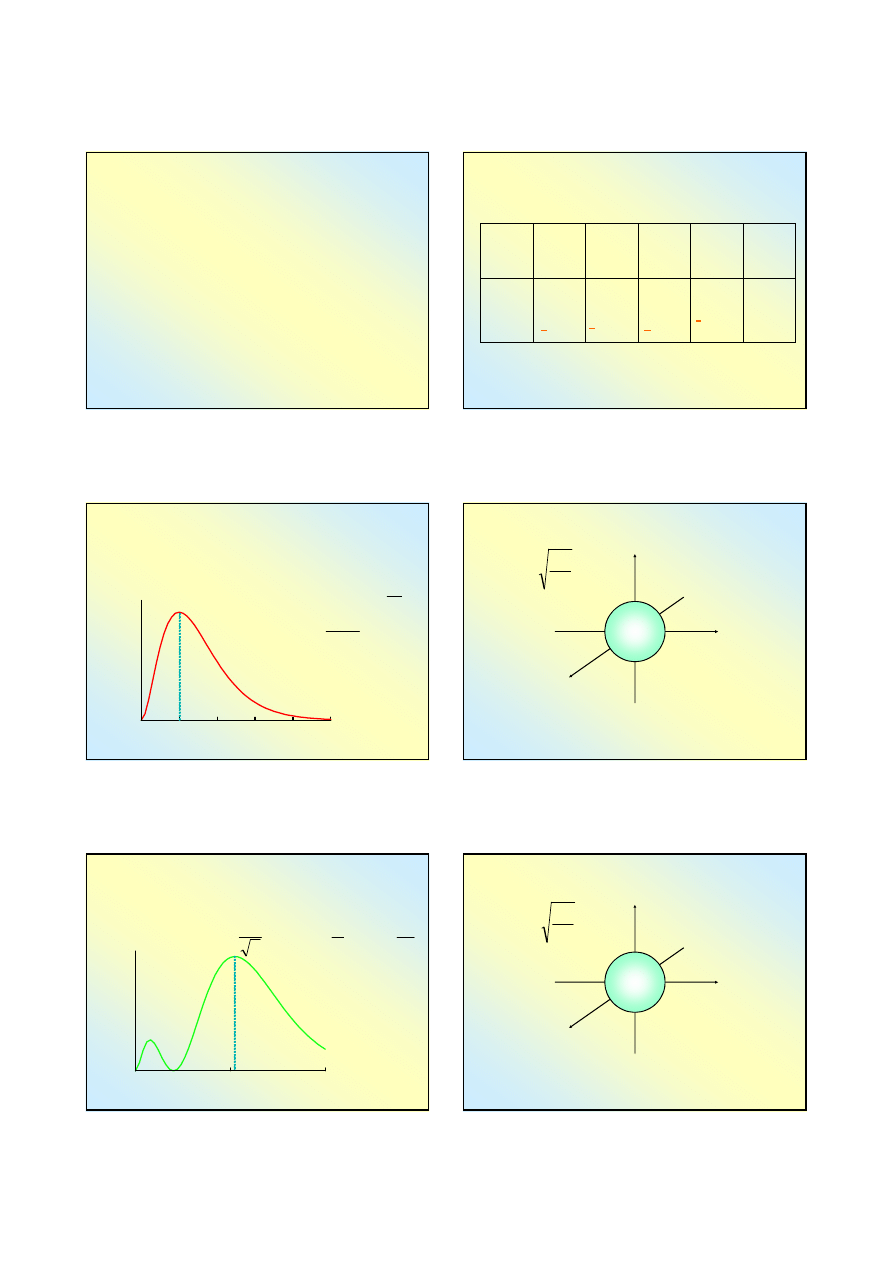
Spektroskopia
Spektroskopia jest działem fizyki, który zajmuje się
pomiarem (spektrometria) i interpretacją widm
promieniowania różnych substancji;
Spektroskopia emisyjna – widma promieniowania otrzymuje
się wzbudzając substancję (np. termicznie albo w łuku
elektrycznym) i mierzy się otrzymane promieniowanie w
funkcji długości fali (częstotliwości);
Spektroskopia absorbcyjna – substancję poddaje się
działaniu promieniowania obejmującego cały zakres (np.
widzialnego, UV, IR) i bada się, co zostało pochłonięte przez
badaną substancję w funkcji długości fali (częstotliwości);
Spektroskopia opiera się na założeniu Plancka E=h•ν, czyli,
że pochłaniana (emitowana) jest tylko taka energia, która
odpowiada własnym energiom substancji (różnicą poziomów
energii).
Spektroskopia absorbcyjna
monochromator
substancja
badana
źródło
promieniowania
analizator
natężenia
prom.
analizator
natężenia
prom.
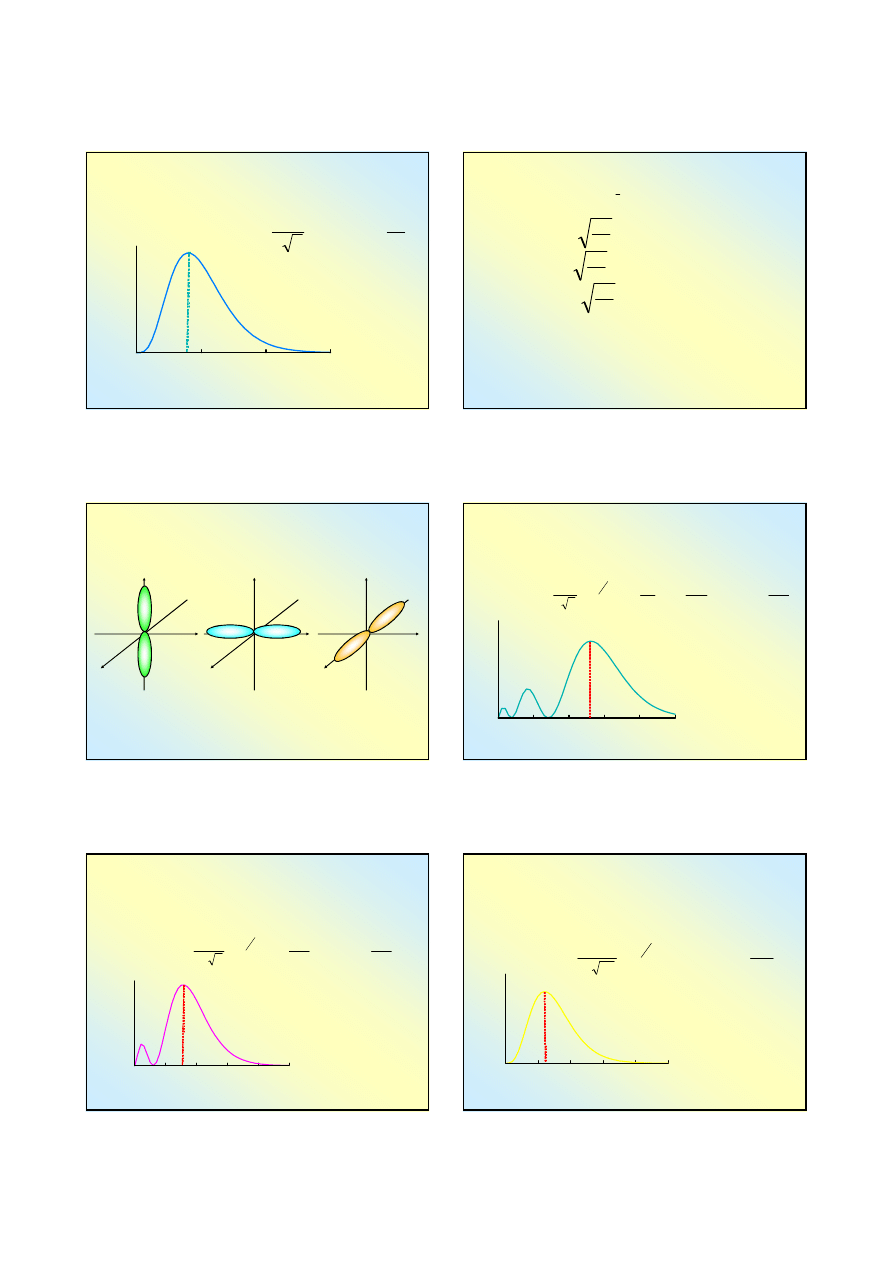
Widmo emisyjne i absorpcyjne
widmo emisyjne
ν→
widmo absorbcyjne
ν→
Weryfikacja modelu
energia elektronu w atomie wodoru
Widmo emisyjne wodoru składa się z serii:
gdzie:
n
- jest numerem kolejnej serii i najniższego
poziomu w danej serii
q
- jest numerem wyższego poziomu
R
H
- stałą Rydberga
−
=
=
−
−
2
2
1
1
q
n
R
h
E
H
n
q
n
q
ν
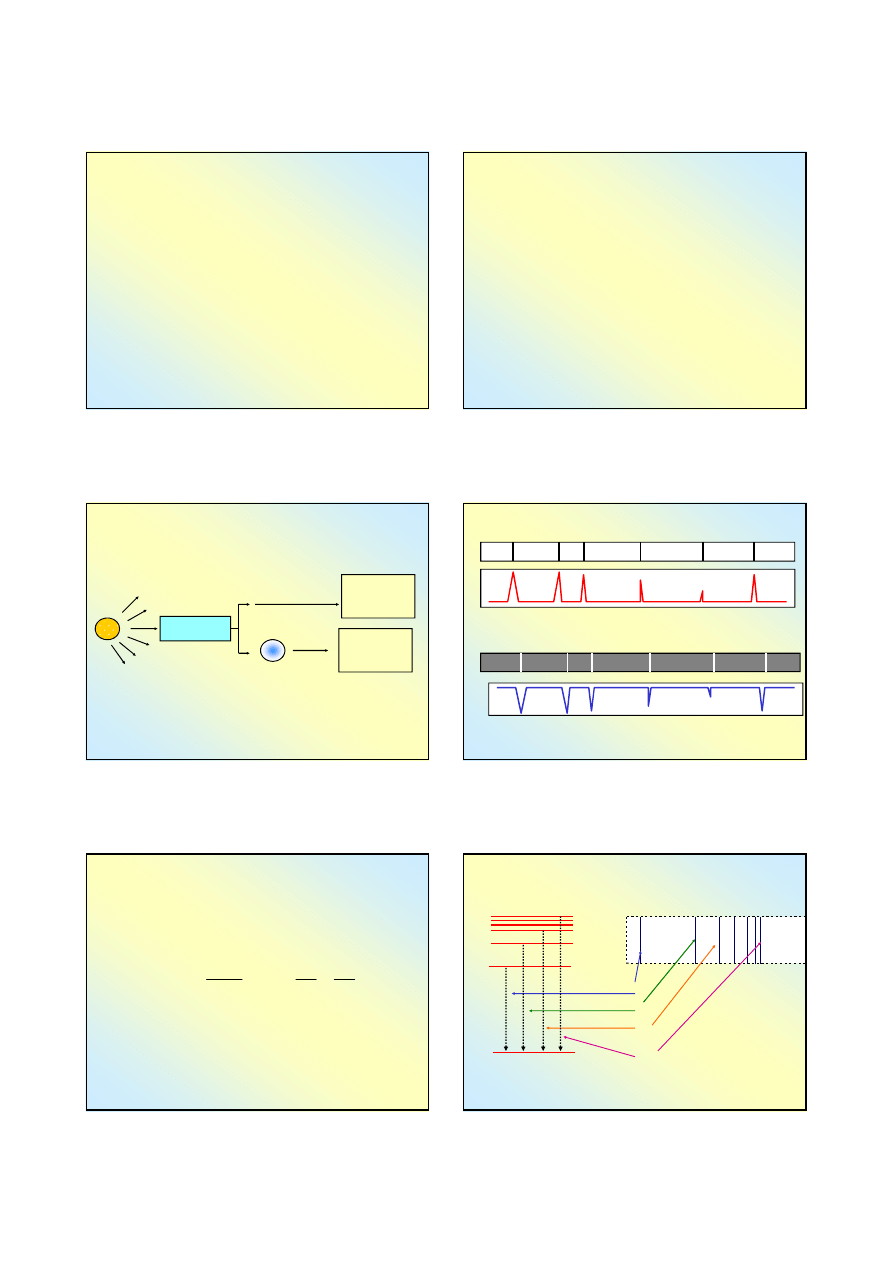
Poziomy energetyczne w atomie
a widmo promieniowania wodoru
n = 3
n = 4
n = 7
n = 1
n = 2
Poziomy energetyczne elektronu w atomie wodoru,
wynikające z rozwiązania równania Schrödingera
E
1
E
2
E
3
E
4
E
7
21
1
2
1
E
E
E
h
∆
=
−
=
ν
31
1
3
2
E
E
E
h
∆
=
−
=
ν
41
1
4
3
E
E
E
h
∆
=
−
=
ν
71
1
7
6
E
E
E
h
∆
=
−
=
ν
7
4
3
2
1
ν
ν
ν
ν
ν
h
h
h
h
h
→
hv
5
Degeneracja energii w atomie wodoru
Jeśli jednej wartości energii odpowiada kilka funkcji
własnych (orbitali), to mówimy, że ten poziom jest
zdegenerowany:
1s
1
2s
2p
x
2p
y
2p
z
4
3s
3p
x
3p
y
3p
z
xy
d
3
2
2
3
y
x
d
−
2
3
z
d
xz
d
3
yz
d
3
9
dla n=4 jest 1+3+5+
7
=
16 funkcji
dla n=5 jest 1+3+5+7+
9
=
25 funkcji
dla dowolnego n jest 1+3+5+7+
9...
=
n
2
funkcji
Degeneracja energii w atomie wodoru
E
E
E
E
E
E
E
E
E
E
E
E
E
E
s
s
p
p
p
s
p
p
p
d
d
d
d
d
x
y
z
x
y
z
xy
xz
yz
z
x
y
1
2
2
2
2
3
3
3
3
3
3
3
3
3
2
2
2
<
=
=
=
<
=
=
=
=
=
=
=
=
−
Cofnięcie degeneracji może zachodzić (częściowo
lub całkowicie) w silnym polu :
- elektrycznym (efekt Starka)
- magnetycznym (efekt Zeemana)
Cofnięcie degeneracji można obserwować w widmie
emisyjnym lub absorpcyjnym
E
E
E
E
E
E
E
E
E
E
E
E
E
E
s
s
p
p
p
s
p
p
p
d
d
d
d
d
x
y
z
x
y
z
xy
xz
yz
z
x
y
1
2
2
2
2
3
3
3
3
3
3
3
3
3
2
2
2
<
<
=
=
<
<
=
=
<
=
=
=
=
−
Cofnięcie degeneracji =
rozszczepienie poziomów energii
2s
3s
3p
x
3p
y
3p
z
1s
1
2p
x
2p
y
2p
z
3
xy
d
3
2
2
3
y
x
d
−
2
3
z
d
xz
d
3
yz
d
3
5
Jeśli elektron w atomie wodoru posiada najniższą
możliwą energię, to jego stan opisuje orbital 1s
Nawet poziomy 1s, 2s, .. mogą być
rozszczepione !
1s
w polu elektrycznym
i magnetycznym
Elektron zachowuje sie tak, jakby posiadał
„wewnętrzny moment pędu”
Ta właściwość elektronu nosi nazwę
spinu
(Dirac 1928)
Wartość spinu dla elektronu wynosi zawsze 1/2
s
m
s
=
= − +
1
2
1
2
1
2
,
Stan elektronu w atomie wodoru
Do określenia stanu elektronu w atomie wodoru
niezbędna jest znajomość 4 liczb (bo spin jest stały) -
n, l, m i m
s
W stanie podstawowym (minimum energii) stan
elektronu w atomie wodoru określa orbital 1s
(n=1, l=0, m=0, s=1/2, m
s
=±1/2)
spinowa
funkcja
-
orbital
-
)
,
,
(
,
,
s
s,m
m
l
n
z
y
x
σ
+
Ψ
l
spinorbita
-
)
,
,
(
,
,
,
,
,
,
(x,y,z)
z
y
x
s
s
m
s
m
l
n
s,m
m
l
n
Φ
=
⋅
Ψ
σ
Wyszukiwarka
Podobne podstrony:
cwiczenie 14 id 125164 Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
B 14 id 74811 Nieznany (2)
A, TEST 14 id 49148 Nieznany (2)
IMG 14 id 210953 Nieznany
Cwiczenia nr 13 (z 14) id 98681 Nieznany
IMG 14 id 211039 Nieznany
Egzamin 14 id 151512 Nieznany
aud6 14 id 72057 Nieznany (2)
IMG 14 id 211113 Nieznany
IMG 14 id 211100 Nieznany
Obliczenia 14 id 327535 Nieznany
IMG 14 id 211055 Nieznany
cwiczenie9b am 13 14 id 125935 Nieznany
Cwiczenia nr 12 (z 14) id 98680 Nieznany
projekt 14 id 397725 Nieznany
cwiczenie10a am 13 14 id 125803 Nieznany
IMG 14 id 211077 Nieznany
więcej podobnych podstron