Wykład 5
1
Doskonalenie cech produkcyjnych
mikroorganizmów o znaczeniu przemysłowym
Mikrobiologia Przemysłowa
1
Doskonalenie cech produkcyjnych
mikroorganizmów
Izolaty A B C D
5 etapów selekcji
mikroorganizmu
producenckiego
Zysk w korelacji z wydajnością
bioproduktu
z litra hodowli
Koszty
na litr
hodowli
2
Wykład 5
2
Doskonalenie cech produkcyjnych
mikroorganizmów
Procesy biotechnologiczne z zastosowaniem mikroorganizmów wyizolowanych
bezpośrednio ze środowiska naturalnego na ogół przebiegają z wydajnością
niewystarczającą, aby ich użycie na skalę przemysłową było opłacalne
ekonomicznie
Aby wykorzystać potencjał biotechnologiczny tych mikroorganizmów, przeprowadza
się modyfikację ich genotypu prowadzącą do uzyskania szczepów
produkcyjnych mogących znaleźć zastosowanie w przemyśle
3
Doskonalenie cech
produkcyjnych mikroorganizmu
Dziki izolat wybrany na
drodze selekcji
Mikroorganizm
udoskonalony in vitro
TRENING
POTENCJAŁU
Kowalski przed
Kowalski po
Analogia
Założenie – natura nie wykorzystuje
pełnego potencjału biotechnologicznego
organizmu producenckiego tak jak przeciętny
„Kowalski”
nie wykorzystuje
pełnego
potencjału własnego organizmu
4
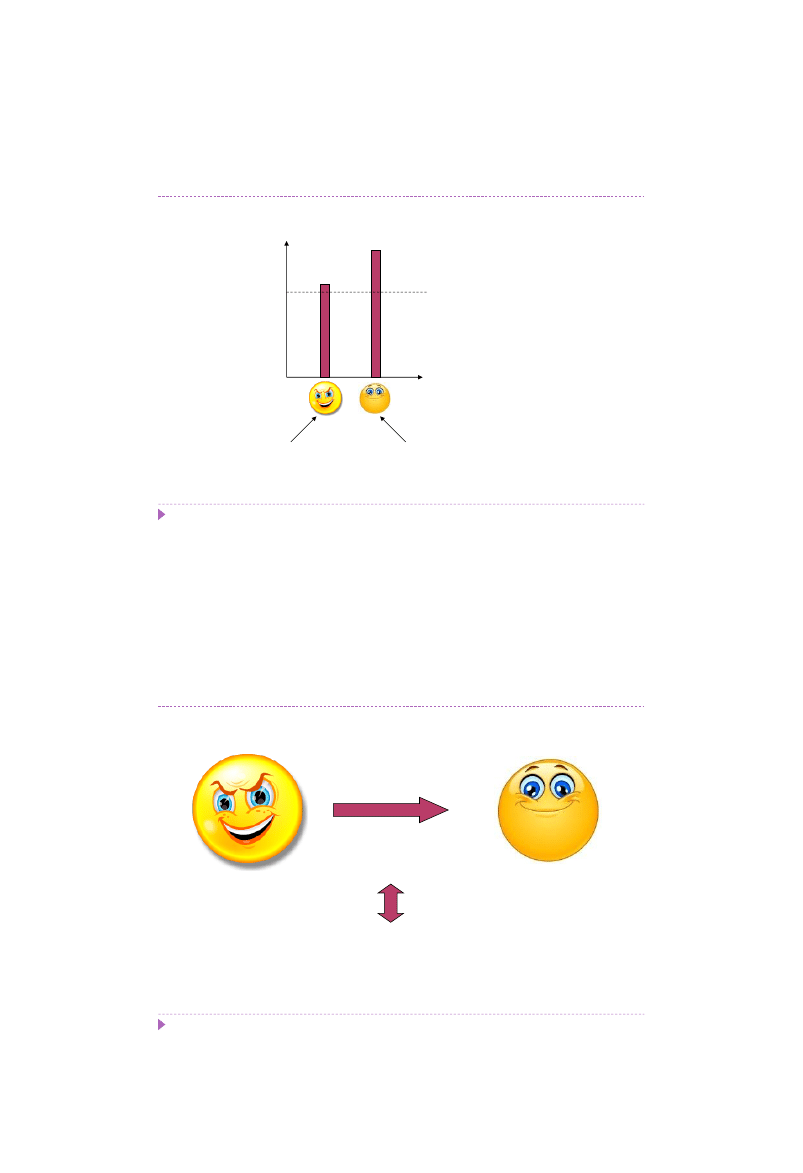
Wykład 5
3
Co ma przynieść doskonalenie?
Koszty
na litr
hodowli
Zysk w korelacji z wydajnością
bioproduktu
z litra hodowli
Szczep dziki
Szczep zmodyfikowany
5
Którędy wiedzie droga?
Doskonalenie cech
produkcyjnych mikroorganizmu
MODYFIKACJA INFORMACJI
GENETYCZNEJ ZAWARTEJ W DNA
Mutageneza
Szczep Dziki = Szczep Natywny
Mutant
6

Wykład 5
4
Doskonalenie cech produkcyjnych
mikroorganizmów – wybór metody
Metody klasyczne
• mutageneza indukowana in vivo,
• selekcja
• adaptacja
• hybrydyzacja naturalna
• fuzja protoplastów komórek szczepów pochodzących od genetycznie
różniących się przodków.
Metody wykorzystujące techniki inżynierii
genetycznej
METODY
MODYFIKACJI DNA
7
Mutageneza.

Wykład 5
5
Mutageneza
Mutageneza - proces prowadzący do powstania mutanta
Mutant – mikroorganizm różniący się genotypem od komórek szczepu
macierzystego
zmiany
genotypowe w komórkach mutanta muszą być
trwałe
dziedziczone
przez komórki potomne
ich obecność musi nadawać szczepowi mutanta właściwości fenotypowe
różniące
go od
szczepu macierzystego
Mutacja – trwała zmiana w sekwencji DNA, która jest przekazywana komórkom
potomnym
Zmiana premutacyjna – zmiana w sekwencji DNA, która może być usunięta w
procesie replikacji
9
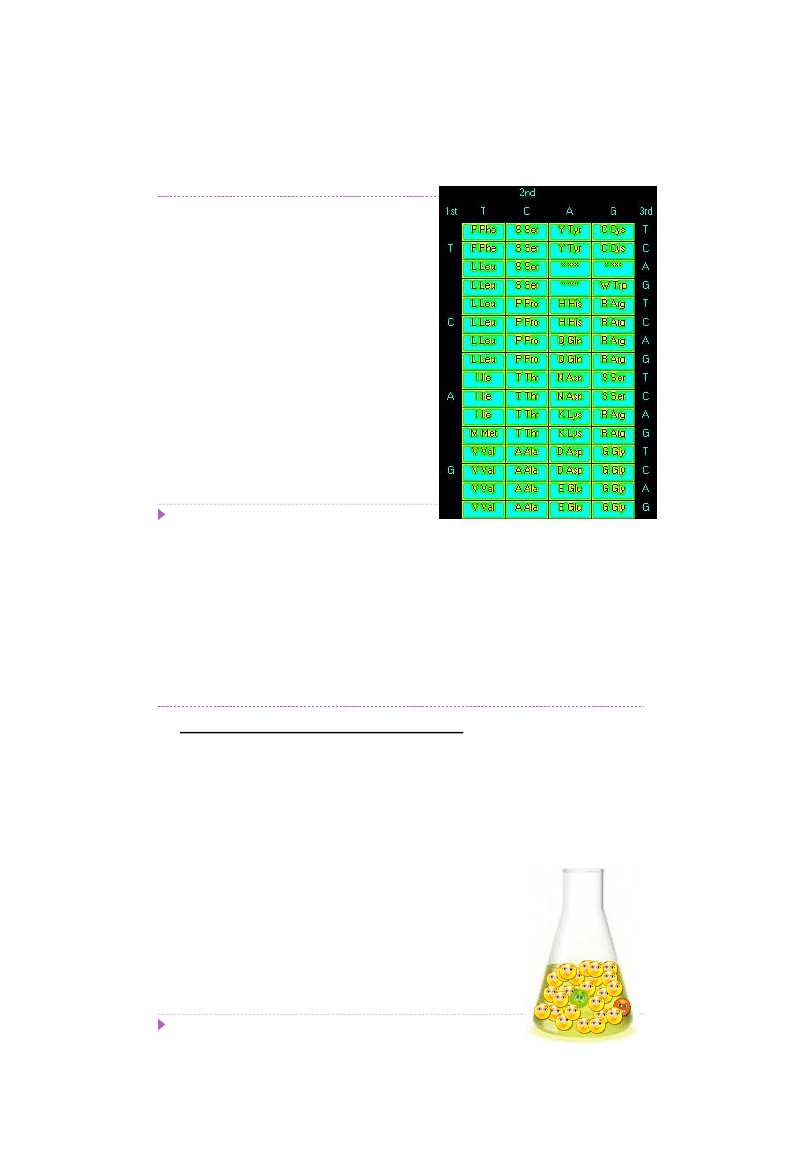
Substytucje
Delecje
Insercje
Modyfikacje zasad azotowych
Typy mutacji
10
Wykład 5
6
Typy mutacji
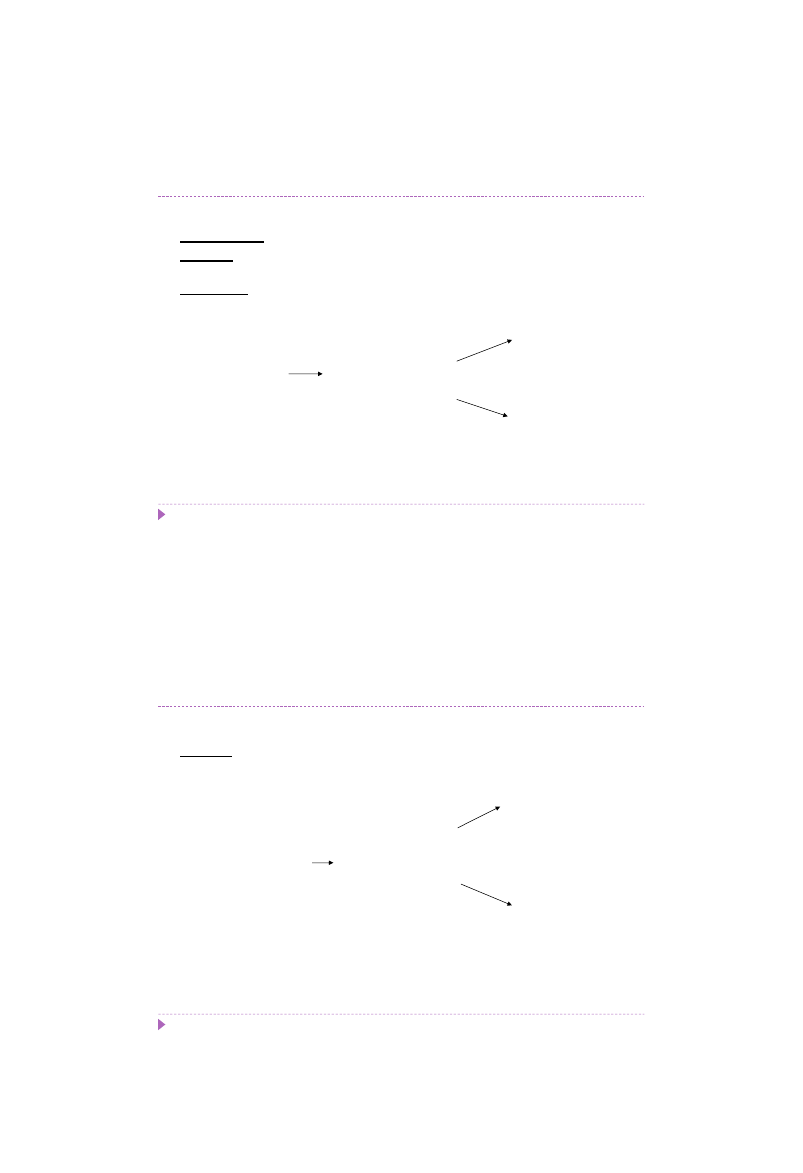
Substytucja – zmiana jednej pary zasad na inną
tranzycja (A↔G; T↔C) – zmiana jednej puryny na inną purynę lub zmiana jednej
pirymidyny na inną pirymidynę
transwersja (A↔T; C↔G) – zmiana pirymidyny na purynę lub puryny na pirymidynę
5’ ACGTAACG 3’
3’ TGCATTGC 5’
5’ ACGTAACG 3’ 5’ ACGTAACG 3’
3’ TGCATTGC 5’ 3’ TGCAT
C
GC 5’
3’ TGCA
C
TGC 5’
5’ ACGT
G
ACG 3’
zmiana premutacyjna
mutacja
11
Typy mutacji
Delecja - usunięcie jednej lub większej liczby par zasad
5’ CCGAAAAACGC 3’
3’ GGCTTTTTGCG 5’
A
5’ CCGA
A
AAACGC 3’ 5’ CCGA AAACGC 3’
3’ GGCTTTTTGCG 5’ 3’ GGCT TTTGCG 5’
3’ GGCTTTTGCG 5’
5’ CCGAAAACGC 3’
zmiana premutacyjna
mutacja
12

Wykład 5
7
Typy mutacji
Insercja – wstawienie jednej lub większej liczby par zasad
5’ CCGAAAAACGC 3’
3’ GGCTTTTTGCG 5’
5’ CCGAAAAACGC 3’ 5’ CCGAA AAACGC 3’
3’ GGCTTTTTGCG 5’ 3’ GGCTT TTTGCG 5’
T
3’ GGCTT
T
TTTGCG 5’
5’ CCGAAAAAACGC 3’
zmiana premutacyjna
mutacja
13
Modyfikacje zasad azotowych w DNA:
Deaminacja cytozyny – powoduje
powstanie uracylu
, nie zwiększa poziomu
mutacji spontanicznych
Metylacja cytozyny – powoduje
powstanie 5-metylocytozyny
, nie zwiększa
poziomu mutacji spontanicznych
Deaminacja 5-metylocytozyny – powoduje
powstanie tyminy
i po replikacji
mutację GC → AT
Typy mutacji
14
Wykład 5
8
Skutki mutacji
Mutacje punktowe
zmiana pojedynczego aminokwasu w sekwencji
białka
brak zmian sekwencji aminokwasowej białka
przedwczesna terminacja translacji
Delecje lub insercje
przesunięcie ramki odczytu
wstawienie
lub
usunięcie
pojedynczego
aminokwasu w sekwencji białka
15
Mutageneza
Mutageneza spontaniczna (samorzutna) –
proces powstawania mutacji
zachodzący niezależnie od określonych czynników zewnętrznych
błędy popełniane w czasie replikacji DNA
błędy powstające w wyniku samorzutnych modyfikacji chemicznych zasad DNA
Błędy takie nie są częste ze względu na zdolności korekcyjne polimeraz, jak również
dzięki działającemu po replikacji systemowi naprawy niedopasowanych
nukleotydów (MMR – mismatch repair).
Częstość mutagenezy spontanicznej
bakteriofag T4 – 10
-7
Escherichia coli – 10
-9
Drosophila melanogaster – 10
-10
16

Wykład 5
9
W praktyce częstość mutagenezy spontanicznej jest zbyt mała
żeby wykorzystywać to zjawisko do kreowania mutantów in vitro
Stąd w laboratorium przeprowadzamy tak zwaną mutagenezę
indukowaną
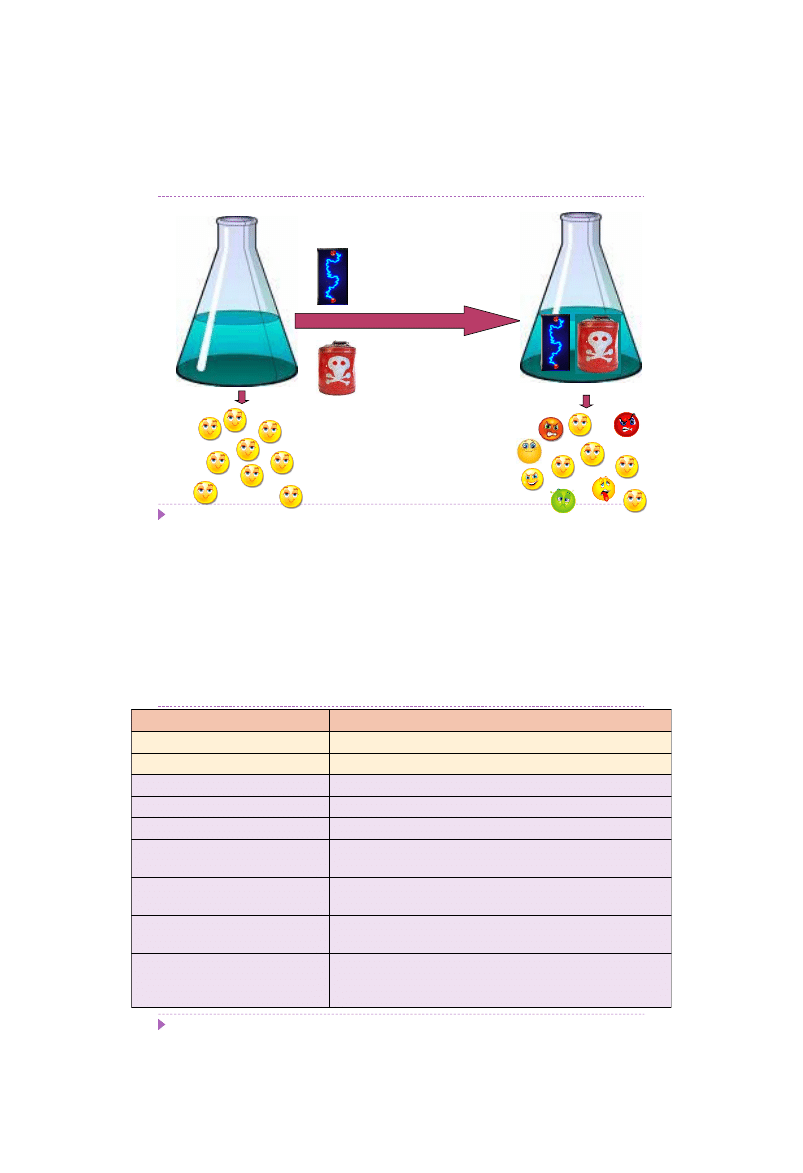
Mutageneza indukowana
17
Mutageneza indukowana
Mutageneza indukowana – proces powstawania mutacji na skutek
działania zewnętrznych czynników fizycznych lub chemicznych
(mutagenów)
Typy mutacji indukowanych
mutacje punktowe (substytucje, modyfikacje zasad azotowych)
delecje
insercje
Powstałe komórki mutantów różnią się genotypowo i fenotypowo
od komórek szczepu macierzystego oraz wzajemnie od siebie
18
Wykład 5
10
Mutageneza indukowana
CZYNNIKI MUTAGENNE
Fizyczne
Chemiczne
19
Czyniki chemiczne i fizyczne wykorzystywane w
doskonaleniu mikroorganizmów na drodze mutagenezy
Czynnik mutagenny
Sposób działania
Promieniowanie UV
powstanie dimerów pirymidynowych
Promieniowanie X
pęknięcia jedno- i dwuniciowego DNA
5-bromouracyl
analog tyminy, tworzy pary z guaniną – tranzycje pary AT↔GC
2-aminopuryna
analog adeniny, tworzy pary z cytozyną
Hydroksyloamina
hydroksylacja cytozyny, pochodna tworzy pary z adeniną
N-metylo-N’-nitro-N-nitrozoguanidyna synteza metyloguaniny podczas replikacji, powoduje tranzycje i
inne typy mutacji
Metanosulfonian metylowy
Metanosulfonian etylowy
alkilacja puryn i pirymidyn
Oranż akrydyny
interkalacja pomiędzy zasady w DNA, powoduje błędy replikacji i
mutacje typu insercja lub delecja
Kwas azotowy (III)
deaminacja adeniny, hipoksantyna tworzy pary z cytozyną
deaminacja guaniny, ksantyna tworzy pary z cytozyną
deaminacja cytozyny, uracyl tworzy pary z adeniną
20

Wykład 5
11
Długość fali ok. 260 nm – najbardziej absorbowane przez kwasy nukleinowe
powstawanie dimerów pirymidynowych tj. głównie TT, ale też TC i CC, w
jednoniciowym DNA oraz w RNA dochodzi też do hydratacji cytozyny i uracylu.
wysokie dawki (tysiące ergów na milimetr kwadratowy) prowadzą do powstania
wiązań - krzyżowych połączeń (cross-links) między dwiema nićmi DNA.
przy naświetlaniu promieniami o nieco dłuższej fali (280 nm), pochłanianymi głównie
przez białka, dochodzi do tworzenia wiązań pomiędzy tymi ostatnimi a DNA.
Promieniowanie UV
21
powstanie dimerów uniemożliwia replikację i transkrypcję mRNA
zmiany te powodują mutacje typu transwersje i tranzycje
powstają w podłożu duże zmiany, w wyniku których pojawiają się wolne rodniki (np.
[OH] itd.) oraz związki niestałe o charakterze nadtlenków. Związki te działają
utleniająco na inne składniki zawarte w środowisku, a ponadto i przede wszystkim,
podobnie jak wszelkie substancje utleniające, wywierają wpływ toksyczny na
komórki.
Promieniowanie UV
22

Wykład 5
12
naprawie podlegają tylko pewne typy uszkodzeń, np. dimery pirymidyn. Ponieważ
są one jednak odpowiedzialne za większość śmiertelnych efektów promieniowania,
te mechanizmy naprawy uszkodzeń odgrywają dużą rolę.
fotoreaktywacja usuwa u Escherichia coli najwyżej 50-80% uszkodzeń. Pozostałe,
nie usuwane przez fotoreaktywację, są przypuszczalnie związane z innymi
zmianami w komórce niż dimeryzacja pirymidyn.
promienie UV wykazują właściwości bójcze w stosunku do mikroorganizmów,
które nie są zdolne do usuwania uszkodzeń, bądź ilość zmian jest zbyt duża.
Promieniowanie UV
23
Promieniowanie X lub gamma
Wysoka energia powodująca jonizację cząsteczek przez wybicie elektronów
Powstające wolne rodniki reagują z zasadami azotowymi prowadząc do rozerwania
nici DNA jednej (uszkodzenia możliwe do naprawienia) lub obu (uszkodzenia
letalne)
Promieniowanie jonizujące
24

Wykład 5
13
Antymetabolity przypominające puryny i pirymidyny
Po włączeniu do łańcucha wykazują skłonność do tworzenia pary z błędnie
dobraną zasadą purynową lub pirymidynową
5-bromouracyl, 5-bromodeoksyurydyna, 2-aminopuryna
Analogi zasad
25
Czynniki chemiczne
Modyfikują zasady azotowe w DNA
Powstają błędy podczas replikacji w wyniku błędnego parowania zasad
Mutacje punktowe
26

Wykład 5
14
Związki alkilujące
Alkilacja zasad azotowych wywołana obecnością grup metylowych, etylowych i
innych występujących w tych związkach
Podstawienie właściwej zasady inną, opuszczenie lub dodanie nukleotydu
Metylo- i etylometanosulfonian (MMS i EMS)
Dietylo i dimetylosiarczan (DES i DMS)
Iperyt
N-metylo-N’-nitro-N-nitrozoguanidyna (MNNG)
27
Barwniki akrydynowe
Interkalacja pomiędzy sąsiednie pary zasad w dwuniciowym DNA
Podczas replikacji następuje wstawienie lub utrata dodatkowego nukleotydu
Oranż akrydyny
28

Wykład 5
15
Etapy mutagenizacji
Dodanie mutagenu do hodowli i jego penetracja do komórki
Oddziaływanie na DNA (niestabilne zmiany pierwotne)
Procesy naprawcze (rewersja mutacji lub zmiany wtórne)
Stabilizacja mutacji umożliwiająca utrzymanie mutacji w kolejnych pokoleniach
Zmiany biochemiczne i ujawnienie się fenotypowe mutacji
29
1
– mutacje pierwotne
2
– mechanizm naprawczy;
odtworzenie stanu
pierwotnego
3
– mechanizm naprawczy;
mutacje wtórne
4
– śmierć komórki
5
– śmierć komórki
6
– namnażanie
zmutowanych komórek
Kierunki i skutki zmian genotypu w wyniku mutagenezy
Mutageneza indukowana
Dawka mutagenu
zbyt duża dawka czynnika mutagennego prowadzić może do śmierci wszystkich
komórek szczepu macierzystego poddanych jego działaniu
duże dawki czynnika mutagennego prowadzą do uszkodzenia DNA w wielu
miejscach genomu
mutacje pożądane mogą być maskowane przez mutacje niekorzystne
optymalna dawka mutagenu powoduje efekt letalny u max 90% komórek
poddawanych mutagenezie
Wielkość dawki czynnika mutagennego zależy od:
właściwości szczepu poddawanego mutagenezie
warunków hodowli
wieku hodowli
30
Wykład 5
16
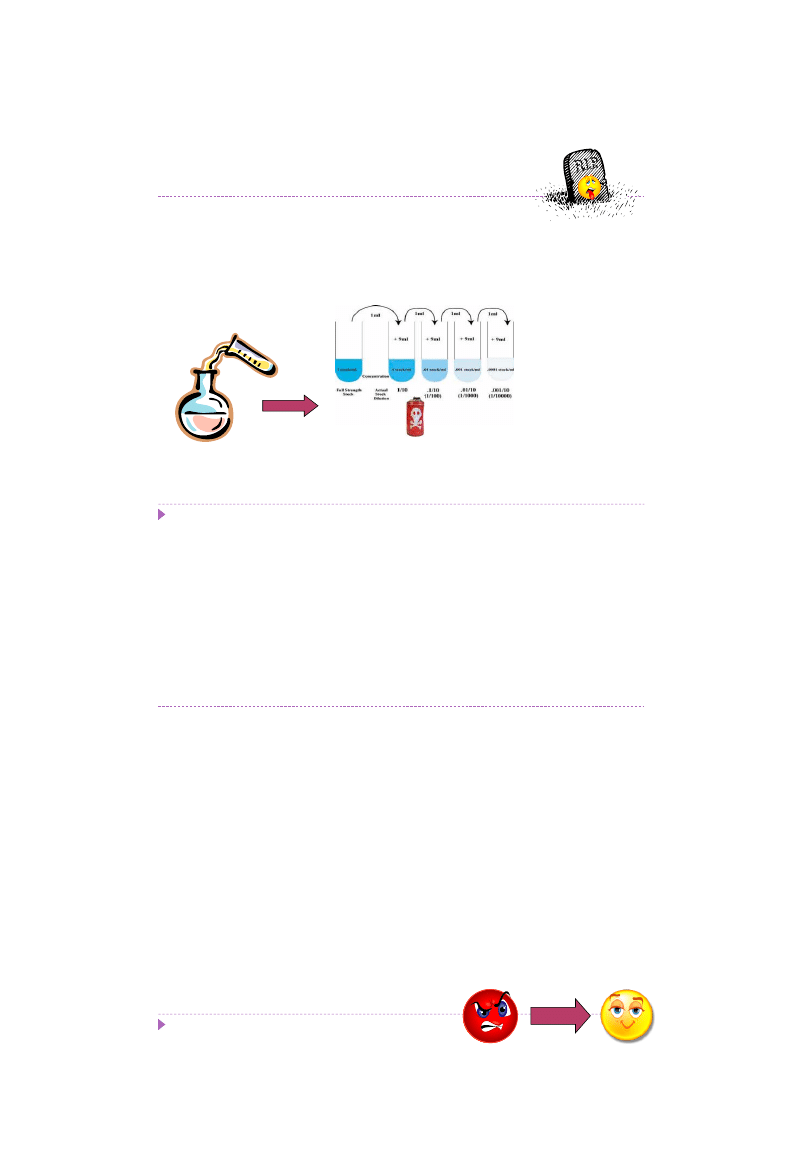
Efekt letalny
- Dla każdego badanego szczepu mikroorganizmu dawkę czynnika mutagennego
należy wyznaczyć empirycznie
Mutageneza indukowana
Np. Seryjne rozcieńczenia czynnika
mutagennego
31
Mutageneza indukowana
Rewersja mutacji - proces usunięcia mutacji powstałych w niektórych
komórkach mikroorganizmu pod wpływem działania czynnika mutagennego
Rewersja mutacji zachodzi na drodze działania mechanizmów
naprawczych takich jak np.
fotoreaktywacja, reaktywacja rekombinacyjna
.
Efektem rewersji mutacji jest
przywrócenie wyjściowego genotypu
mikroorganizmu
Rewersja
mutacji
32

Wykład 5
17
Mutageneza indukowana
Mechanizmy naprawcze:
Niemutagenne
wolne od błędów poreperacyjnych
fotoreaktywacja, wycinanie uszkodzonych fragmentów, resynteza
DNA oraz rekombinacja
Mutagenne
pojawiają się wtórne, trwałe błędy w DNA
mechanizm SOS indukowany przy zatrzymaniu replikacji DNA
uszkodzenia poreperacyjne są głównym źródłem mutantów
33
Rewersja mutacji
Fotoreaktywacja - rozszczepienie dimerów poprzez
fotoliazę
– enzym aktywny w
świetle widzialnym (320 – 370 nm), efektem jest przywrócenie do stanu pierwotnego
Reaktywacja ciemna – przebiega bez udziału światła –
kompleks
specyficznych
nukleaz usuwa dimery
powstałe podczas naświetlania,
przerwa
w łańcuchu
wypełniana
jest przez
polimerazę DNA I
, a fragmenty są scalane przez
ligazę
34

Wykład 5
18
Rewersja mutacji
Reaktywacja rekombinacyjna lub poreplikacyjna – powstanie przerw w
miejscach wystąpienia dimerów podczas syntezy nowej nici, duża dawka
promieniowania doprowadza do powstania wielu przerw w nici DNA
W wyniku wielokrotnego procesu rekombinacji następuje usunięcie przerw, ale
reperacja DNA nie jest bezbłędna.
Uważa się, że naprawa rekombinacyjna jest głównym źródłem mutacji
indukowanych przez promieniowanie UV.
Najczęściej mutacje te są wynikiem podstawienia zasad lub delecji i
przesunięcia ramki odczytu.
35
Promieniowanie UV (254-265 nm)
Zalety
Wysoka częstotliwość powstawania mutacji w stosunku do efektu letalnego
Dostępność i łatwość użycia źródła promieniowania
Łatwość dozowania dawek
moc lampy
odległość od zawiesiny komórek
czas działania
Łatwość odtwarzania warunków mutagenezy
Możliwość wywołania mutacji w rosnących komórkach wegetatywnych i
sporach
36
Wykład 5
19
Promieniowanie UV (254-265 nm)
Sposób postępowania
przygotować zawiesinę komórek w soli fizjologicznej lub pożywce wzrostowej (10
5
–
10
6
komórek /ml); wysokość warstwy zawiesiny nie powinna przekraczać kilku mm
lampę UV umieścić kilkadziesiąt cm nad zawiesiną komórek
prowadzić mutagenezę przez kilka minut
wysiać zawiesinę w postaci murawy na szalki Petriego z podłożem wzrostowym
inkubować w ciemności
37
Selekcja mutantów
Szczep dziki z
aktywnością
proteolityczną
Płytki z agarem
mlecznym
Mutageneza indukowana
38

Wykład 5
20
Typy mutantów
Opornościowe
Auksotroficzne
Kataboliczne
Temperaturozależne
Regulatorowe
39
Selekcja mutantów
Mutanty opornościowe
oporne na inhibitory, antybiotyki lub bakteriofagi
bezpośredni posiew na podłoże zawierające czynnik toksyczny
metoda replik
metoda płytek gradientowych
Mutanty auksotroficzne
Niezdolne do syntezy witamin, aminokwasów, kwasów nukleinowych lub innych
składników budulcowych komórki
bezpośredni posiew na podłoże zawierające śladowe ilości składników, których
komórki nie potrafią syntetyzować
metoda pośrednia – metoda replik
40
Wykład 5
21
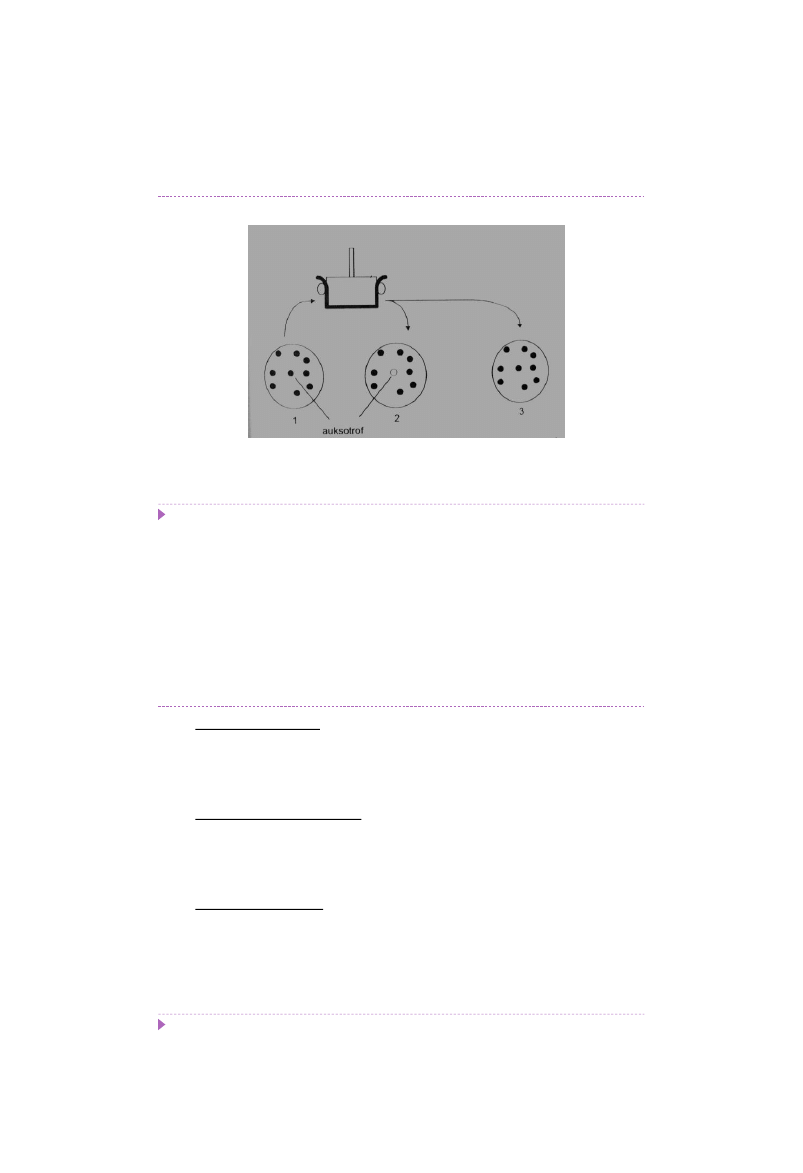
Selekcja mutantów auksotroficznych
- metoda replik
1, 3 – podłoże kompleksowe; 2 – podłoże minimalne
41
Selekcja mutantów
Mutanty kataboliczne
defekt w enzymatycznych szlakach metabolicznych
bezpośredni posiew na podłoże z dodatkiem wskaźnika
Mutanty temperaturozależne
Temperaturooporne i temperaturowrażliwe
Inkubacja w odpowiedniej temperaturze
Mutanty regulatorowe
Zmienna szybkość syntezy jednego lub kilku enzymów metabolicznych
Hodowla ciągłą w warunkach ograniczania wzrostu z małym stężeniem
substratu, selekcja w obecności antymetabolitów hamujących wzrost komórek
niezmienionych
42
Wykład 5
22
Mutageneza indukowana = „Genetycy
strzelają Pan Bóg kule nosi”
CEL
Efekt uboczny nalotu
Efekt uboczny nalotu
CEL NALOTU
43
Mutageneza indukowana = „Genetycy
strzelają Pan Bóg kule nosi”
DNA
Produkcja
energii
komórkowej
Produkcja
białek
Mechanizmy
naprawcze
DNA
MUTACJE
44
Wykład 5
23
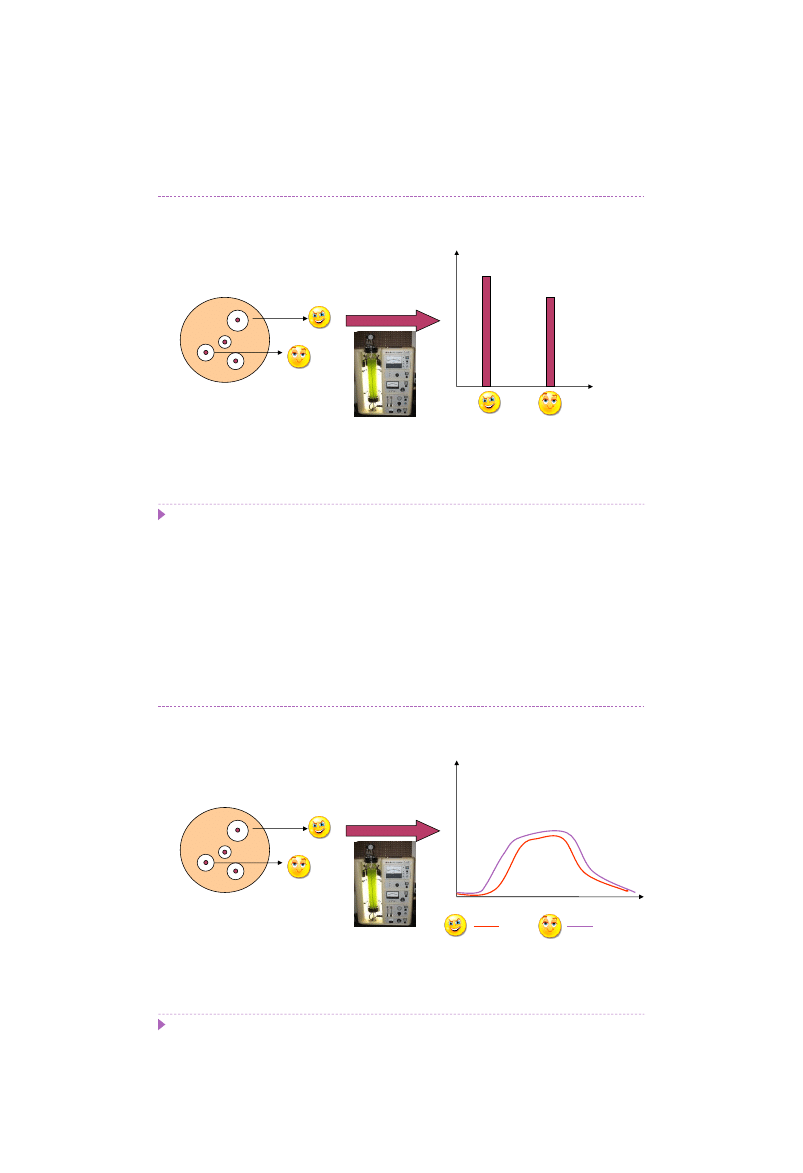
Selekcja mutantów dla zawansowanych
Proteaza [aktywność]
Mutant Szczep Dziki
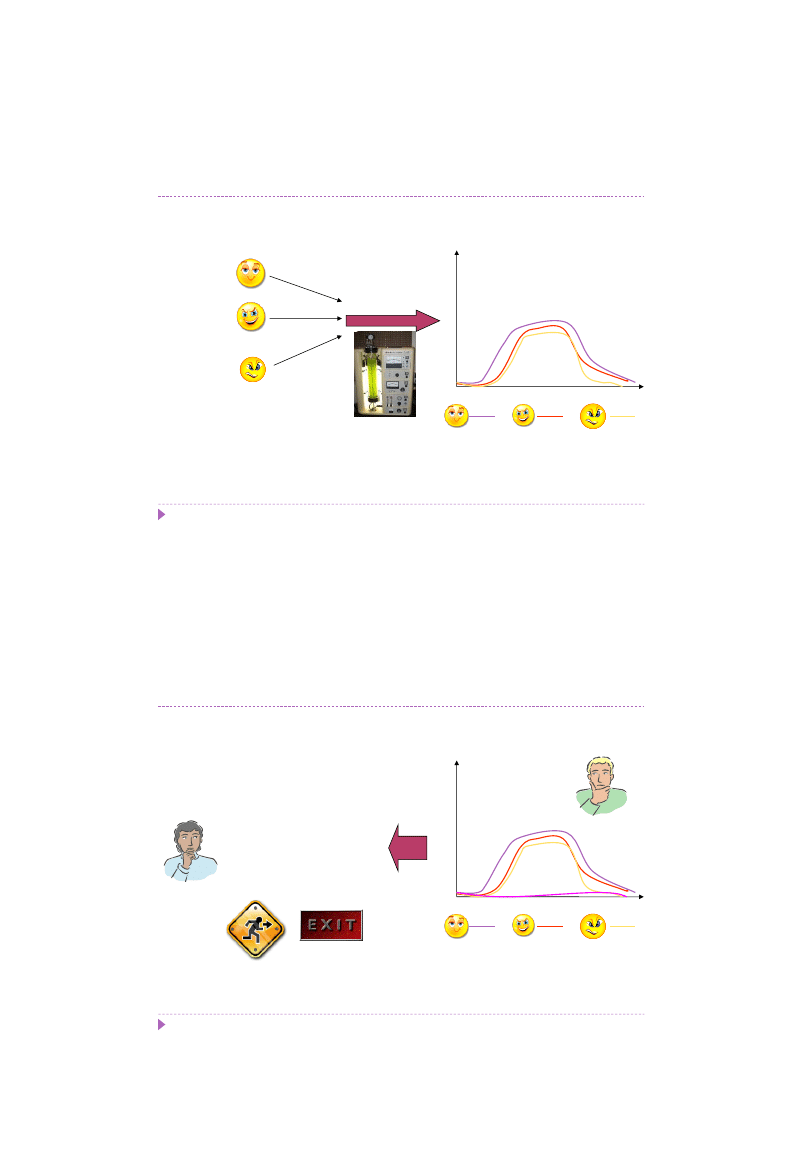
Testy produkcyjne w bioreaktorze na podłożu hodowlanym wskazują na
sukces
.
Tyle czy na pewno?
Hodowla
45
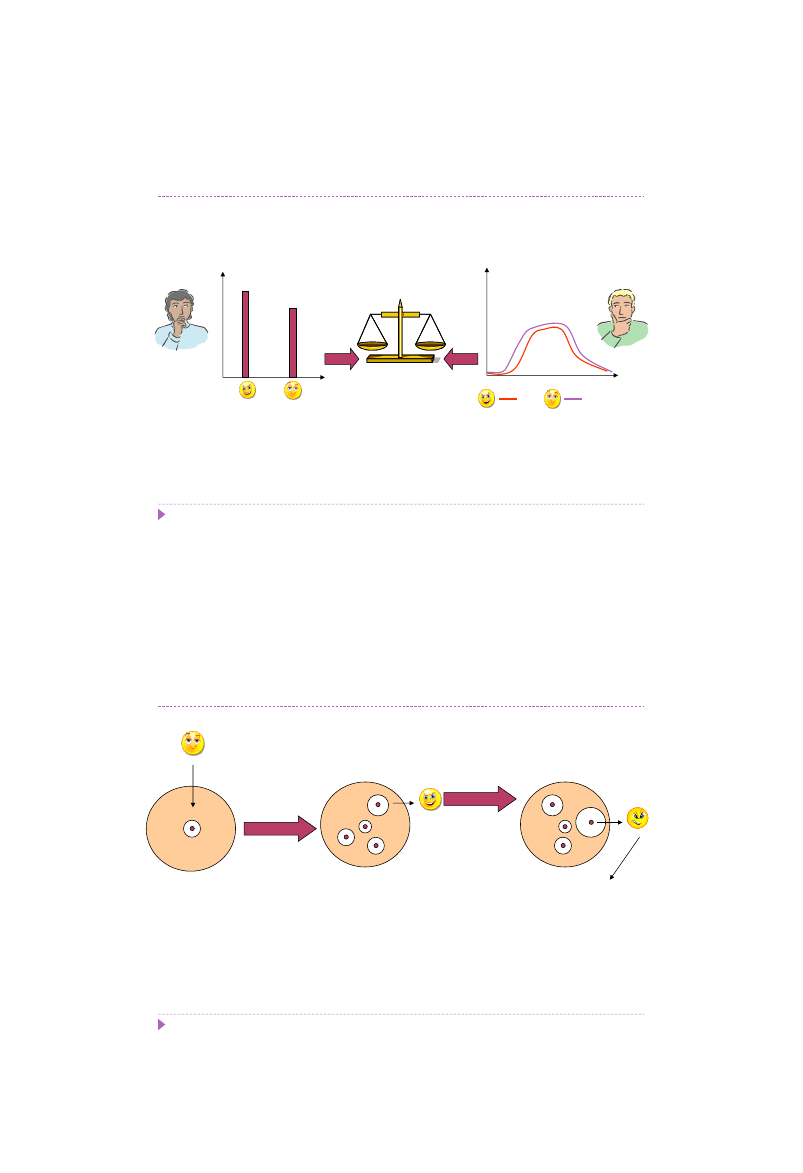
Wzrost hodowli [liczba komórek]
Mutant Szczep Dziki
Niekoniecznie
sukces
- mutant adaptuje się trudniej niż szczep dziki na podłożu
wzrostowym
Czas
Hodowla
Selekcja mutantów dla zawansowanych
46
Wykład 5
24
Wniosek
Zysk = Strata
47
Mutageneza indukowana dla zawansowanych
Płytki z agarem
mlecznym
Mutageneza
indukowana 1
cykl
Mutageneza
indukowana 2
cykl
Testy
Produkcyjne
• Z reguły wykonuje się 3 cykle MI i TP
• Więcej nie ma sensu bo występuje nasilenie efektu letalnego wskutek
gromadzenia się w genomie „szkodliwych mutacji”
48
Wykład 5
25
Selekcja mutantów dla zawansowanych
Wzrost hodowli [liczba komórek]
Czas
Mutant 1
generacja
Hodowla
Szczep
dziki
Mutant 2
generacja
49
Wzrost hodowli [liczba komórek]
Czas
No dobrze ale jak uzyskać
szczep który z jednej
strony produkuje więcej
proteazy niż szczep dziki
ale zachowuje jego
parametry wzrostowe na
pożywce hodowlanej?
Selekcja mutantów dla zawansowanych
50
Mutant 1
generacja
Szczep
dziki
Mutant 2
generacja
Wyszukiwarka
Podobne podstrony:
MP 4 Pozyskiwanie szczepów mikroorganizmów o znaczeniu przemysłowym cz 2a
MP 3 Pozyskiwanie szczepów mikroorganizmów o znaczeniu przemysłowym cz 1a
Pozyskiwanie szczepów mikroorganizmów o znaczeniu przemysłowym
MP 7 Metody przechowywania szczepów mikroorganizmów przemysłowych
MIKROORGANIZMY UŻYTECZNE PRZEMYSŁOWO
Klasa II, Zasady żywienia - Podział na grupy produktów spożywczych i ich charakterystyka cz. 2
Ochrona własności przemysłowej cz 4
Ochrona własności przemysłowej cz 5
4 Zmiany cech produktow podczas Nieznany
Jidoka sposób na doskonalenie jakości i produktywności
przemys� cz 4
przemys� cz 3
UEFA A KONSPEKT nauczanie i doskonalenie przenoszenia środka, Treningi od J, Trener G cz. 1, marek g
Doskonalenie procesów produkcyjnych [Huber]
Kompleksowe produktywne utrzymanie zakładów przemysłowych TPM
Doskonalenie szczepów produkcyjnych Mutagenizacja promieniami UV?kterii z gatunku?cillus lichenifor
więcej podobnych podstron