
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Przemysław Śmietana
Gospodarowanie zasobami ryb i raków
632[01].Z2.02
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr inż. Sławomir Keszka
dr inż. Marcin Biernaczyk
Opracowanie redakcyjne:
dr inż. Przemysław Śmietana
Konsultacja:
mgr inż. Andrzej Zych
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 632[01].Z2.02,
„Gospodarowanie zasobami ryb i raków” zawartego w modułowym programie nauczania dla
zawodu rybak śródlądowy.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Materiał nauczania
7
4.1. Gatunki ryb. Ryby drapieżne i spokojnego żeru
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające 14
4.1.3. Ćwiczenia 15
4.1.4. Sprawdzian postępów 15
4.2. Raki
16
4.2.1. Materiał nauczania
16
4.2.2. Pytania sprawdzające 20
4.2.3. Ćwiczenia 20
4.2.4. Sprawdzian postępów 22
4.3. Eksploatacja rybacka
23
4.3.1. Materiał nauczania
23
4.3.2. Pytania sprawdzające 26
4.3.3. Ćwiczenia 27
4.3.4. Sprawdzian postępów 28
4.4. Rodzaje połowów
29
4.4.1. Materiał nauczania
29
4.4.2. Pytania sprawdzające 31
4.4.3. Ćwiczenia 32
4.4.4. Sprawdzian postępów 34
4.5. Zarybianie
35
4.5.1. Materiał nauczania
35
4.5.2. Pytania sprawdzające 37
4.5.3. Ćwiczenia 37
4.5.4. Sprawdzian postępów 38
4.6. Ochrona ryb i raków
39
4.6.1. Materiał nauczania
39
4.6.2. Pytania sprawdzające 42
4.6.3. Ćwiczenia 42
4.5.4. Sprawdzian postępów 43
5.
Sprawdzian osiągnięć
44
6. Literatura
48

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1.
WPROWADZENIE
Drogi Uczniu poradnik będzie Ci pomocny w przyswajaniu podstawowej wiedzy
i umiejętności o gospodarowaniu zasobami ryb i raków.
W poradniku zamieszczono:
−
wymagania wstępne, wykaz umiejętności, jakie powinieneś mieć już ukształtowane, abyś bez
problemów mógł korzystać z poradnika,
−
cele kształcenia, wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania, zestaw podstawowych wiadomości teoretycznych niezbędnych do
opanowania treści jednostki modułowej,
−
zestaw pytań przydatny do sprawdzenia, czy już opanowałeś podane treści,
−
ćwiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian osiągnięć, przykładowy zestaw zadań i pytań. Pozytywny wynik sprawdzianu
potwierdzi, że dobrze pracowałeś podczas lekcji i że nabrałeś wiedzy i umiejętności z zakresu
tej jednostki modułowej,
−
literaturę.
Poradnik ten ma służyć opanowaniu podstawowej wiedzy umiejętności niezbędnych do
gospodarowania zasobami ryb i raków Zawiera podstawowe informacje dotyczące gatunków ryb
i raków występujących w wodach Polski sposobów ich rozpoznawania. Znajdziesz o sposobie
oceny eksploatacji rybackiej. Zapoznasz się z podstawami planowania odłowów i ochrony
gatunków ryb i raków..
Materiał nauczania został podzielony na sześć części, których kolejność umożliwi Ci
stopniowe zdobywanie nowych wiadomości i umiejętności związanych z zakresem tematycznym
niniejszego poradnika. Przykładowe ćwiczenia pozwolą Ci zrozumieć i przyswoić wiedzę
w praktyce. Na końcu każdego tematu znajdują się pytania sprawdzające. Pozwolą Ci one
zweryfikować Twoją wiedzę. Jeżeli okaże się, że czegoś jeszcze nie pamiętasz lub nie rozumiesz,
zawsze możesz wrócić do rozdziału „Materiał nauczania” i tam znajdziesz odpowiedź na pytania,
które sprawiły Ci kłopot.
Przykładowy sprawdzian osiągnięć może okazać się świetnym treningiem przed
zaplanowanym przez nauczyciela sprawdzianem, a część teoretyczna pozwoli Ci sprawdzić Twoje
umiejętności z zakresu gospodarowania zasobami ryb i raków”. W razie jakichkolwiek
wątpliwości zwróć się o pomoc do nauczyciela.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
632[01].Z2.04
Obsługiwanie narzędzi
i technika połowów
632[01].Z2.05
Wykonywanie połowów
ryb i raków
632[01].Z2.06
Wykonywanie zabiegów
rybackich
632[01].Z2.03
Podstawy żeglugi
śródlądowej. Pływanie
łodzią
632[01].Z2.02
Gospodarowanie
zasobami ryb i raków
632[01].Z2.01
Charakteryzowanie wód
śródlądowych
632[01].Z2
Rybactwo w wodach
otwartych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu nauczania jednostki modułowej „Gospodarowanie
zasobami ryb i raków” powinieneś, umieć:
−
omawiać plan budowy ciała ryby,
−
wykonywać proste pomiary przy pomocy linijki,
−
charakteryzować podstawy połowu ryb przy użyciu różnych narzędzi połowu,
−
charakteryzować podstawy rozrodu ryb
−
obsługiwać komputer jako narzędzie pracy,
−
wskazywać źródła informacji,
−
korzystać z różnych źródeł informacji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś, umieć:
−
scharakteryzować ważniejsze gatunki ryb,
−
określić sposoby gospodarowania cennymi gatunkami ryb,
−
objaśnić znaczenie ochrony ryb i raków,
−
określić wymiary i okresy ochronne ryb i raków,
−
posłużyć się przepisami o ochronie gatunkowej,
−
ocenić znaczenie ekologiczne różnych gatunków ryb,
−
objaśnić podstawowe elementy biologii raków,
−
określić okresy połowu określonych gatunków,
−
ocenić wpływ wędkarskiego wykorzystania wód na populacje ryb,
−
prowadzić dokumentację dotyczącą połowów i zarybień.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁY NAUCZANIA
4.1. Gatunki ryb. Ryby drapieżne i spokojnego żeru
4.1.1. Materiał nauczania
Ryby występujące w wodach śródlądowych Polski należą do kilku grup tak zwanych
systematycznych do których poszczególne gatunki zostały zaklasyfikowane między innymi na
podstawie cech zewnętrznych. W poradniku tym podajemy skrócony opis przedstawicieli
poszczególnych grup – rodzin. Najliczniejszą rodziną ryb w Polsce jest rodzina ryb karpiowatych.
Oprócz tej rodziny opisujemy przedstawicieli ryb z rodzin: okoniowatych, łososiowatych w tym
podrodziny głąbielowatych, szczupakowatych, węgorzowatych, sumowatych. Rozróżnianie
poszczególnych gatunków ryb polega na wykorzystaniu różnic w wyglądzie ryby. Dużą rolę
w oznaczeniu gatunków odgrywa kształt i ubarwienie ciała, kształt, budowa i barwa płetw, kształt
i położenie pyska a także rodzaj okrywy ciała np. typ łusek. Niżej podajemy opis podstawowych
gatunków ryb należących do tych rodzin.
Ryby karpiowate
Karp – Jest jedną z najważniejszych ryb hodowlanych. Karp występuje również w wodach
otwartych jako efekt zarybień.
Posiada mocny tułów o płaskiej stronie brzusznej. Ubarwienie ciała – żółtobrunatne do
ciemnobrunatnego – zależne od odmiany oraz warunków środowiskowych.
Otwór gębowy końcowy z grubymi wargami i czterema wąsikami – dwa małe, na górnej wardze,
i dwa większe, w kącikach pyska, wysuwalne górne szczęki.
Płetwa grzbietowa pojedyncza, długa, początek przypada w najwyższym punkcie grzbietu przed
nasadą płetwy brzusznej, koniec sięga nasady płetwy odbytowej, płetwa ogonowa nieco
zaokrąglona, słabo wcięta, krótka płetwa odbytowa.
Odżywia się drobnymi zwierzętami wodnymi, owadami i ślimakami. W czasie żeru wydaje
odgłosy przypominające mlaskanie. Bardzo ostrożny i płochliwy. Może żyć ponad 20 lat. Ryba
bardzo płodna, na 1 kg masy ciała samicy przypada średnio 100–200 tys. ziaren ikry. W wodach
polskich nie odbywa naturalnego tarła, z powodu zbyt niskiej temperatury wody. Odmiany
hodowlane są wyższe, grubsze i bardziej odporne na choroby. W Polsce stanowi połowę
odławianych ryb słodkowodnych. Na świecie odławia się ok. 200 tys. ton karpia rocznie. Przez
wędkarzy uważany za rybę waleczną i przebiegłą.
Na skutek hodowli, której początki notowano we wschodniej Europie ok. XII i XIII w. oraz
introdukcji został rozprzestrzeniony na terenie niemal całego świata. W warunkach naturalnych
przebywa w wodach stojących lub wolno płynących. Występuje niemal we wszystkich strefach
klimatycznych. Siedliskiem karpia są stawy, jeziora nizinne, w cieplejszych okresach występują
w płytkich przybrzeżnych wodach, natomiast w chłodniejszych przy dnie. Często gatunek
uważany za cenny.
Lin – Ciało lina jest pokryte drobnymi łuskami, mocno osadzonymi w śluzowatej skórze. Płetwy
charakterystycznie zaokrąglone. Otwór gębowy poziomy. W kącikach znajduje się po jednym
krótkim i miękkim wąsiku.
Osiąga długość 70cm i wagę 6kg (Węgry, Rumunia). Żywi się drobnymi zwierzętami dennymi.
Aktywniejszy nocą. Zimę spędza zagrzebany w mule.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Tarło rozpoczyna w połowie czerwca. Samica składa około 300 tys. jaj na 0,5 kg. swej wagi
przylepiając je do roślin wodnych. Młode wylęgają się po 3 dniach. Dojrzałość płciową osiągają
po 3 – 4 latach.
Żyje w niezbyt głębokich, mulistych i obficie porośniętych wodach rzek i jezior. Hodowany
w gospodarstwach stawowych. Występuje w całej Europie prócz Islandii, północnej Szkocji,
Skandynawii, Dalmacji, Grecji, Krymu. W Azji spotykany na Syberii. Spotykany w wodach
słonawych, np. w zlewisku Bałtyku. Hodowlana odmiana, zwana złotym linem jest w naszym
klimacie bardzo popularną rybą ozdobną, często spotykaną w przydomowych oczkach wodnych
i stawkach. Gatunek uważany za cenny.
Karaś pospolity – ciało bardzo mocno wygrzbiecone i krótkie, pokryte dużymi, równo ułożonymi
łuskami. Płetwa grzbietowa bardzo długa, sięga niemal do nasady trzona ogonowego. Jej górna
krawędź jest wypukła, a ostatni twardy promień piłkowany. Ostatni twardy promień płetwy
odbytowej jest także drobno piłkowany. Głowa nieduża, otwór gębowy mały, znajduje się na
końcu pyska ustawiony nieco skośnie ku górze. Zęby gardłowe ustawione są w jednym szeregu.
Grzbiet i boki brunatno złociste z zielonkawym połyskiem. Płetwy piersiowe i brzuszne przy
nasadzie są lekko zaczerwienione. Karasie są bardzo odporne na niską zawartość tlenu w wodzie.
Małe i płytkie zbiorniki wodne (starorzecza, glinianki, torfianki). W Polsce jest spotykany we
wszystkich nizinnych wodach śródlądowych, stojących i wolno płynących, w miejscach
o porośniętym podłożu. Przebywa niedaleko brzegów, przy miękkim i mulistym dnie. Niewielkie
jego ilości są hodowane w gospodarstwach stawowych. Występowanie: Cała Europa za wyjątkiem
Francji, Szwajcarii, Włoch i zlewiska Oceanu Lodowatego. A także w dorzeczach większych rzek
syberyjskich.
Rozmiary: Przeciętnie dorasta do długości 12–30 cm, a rzadko do 50 cm i osiąga ciężar 0,2–0,5 kg.
W dużych jeziorach trafiają się osobniki znacznie większe.
Pokarm stanowią drobne bezkręgowce wodne, żyjące w mulistym dnie lub w jego pobliżu oraz
rośliny.
Tarło karasia trwa od maja do lipca. Samica średniej wielkości składa kilkakrotnie ok. 200 000 jaj
na płytkich miejscach, porośniętych wodnymi roślinami, do których się przykleja.
Ma niewielkie znaczenie gospodarcze (mimo, że jego mięso jest bardzo smaczne), ponieważ
rośnie bardzo powoli i chociaż często występuje w wielkich ilościach, to jest bardzo małych
rozmiarów i wówczas rybacy traktują go jako chwast rybny.
Leszcz – gatunek bytujący w głębokich wodach stojących, zasobnych w osady mułowe, o czym
świadczy jego kształt ciała (wydatny brzuch i grzbiet, co dowodzi dużej zwrotności ryby
w płaszczyznach pionowych) i ryjkowaty pyszczek (leszcz żywi się pokarmem zalegającym
w mule. Pysk bez wąsików. Dzięki właściwościom swojego aparatu gębowego jest w stanie
zasysać muł, a następnie wypluwać go i wyszukiwać cząstki pokarmu). Żyje w stadach: gromadnie
odbywa tarło, zespołowo żeruje, a zimuje w wielkich zgromadzeniach. Stada rzeczne nie są jednak
tak liczne jak te jeziorne. Ryba jest gatunkiem ciepłolubnym; ma wysokie wymagania cieplne
w czasie rozrodu. Temperatura tarła wynosi 13–18°C, wylęg zdrowych larw odbywa się w temp.
19–22°C. Optymalna temperatura żeru to 17–23°C.
W przeciętnie ciepłym roku sezon leszczowy w rzece zaczyna się po tarle, trwa od czerwca do
początku września. Kulminacja przypada w lipcu i pierwszej połowie sierpnia. Osiąga przeciętnie
do 4-5 kg wagi, choć zdarzają się sztuki nawet 7-kilowe.
Krąp – ryba często mylona z leszczem. Różni się jednak od niego mniejszą ilością promieni
miękkich w płetwach: grzbietowej i odbytowej oraz mniejszą ilością łusek w linii bocznej. Dorasta
przeciętnie do 30 cm (maks. 36 cm) i 0,5 kg wagi (maks. 1 kg). Żywi się bezkręgowcami, larwami
owadów i roślinami. Ze względu na niewielkie rozmiary ciała raczej niepożądana w gospodarce

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
rybackiej. Konkuruje o pokarm z leszczem dlatego często uważana za szkodnika. Z tego powodu
nie posiada ani wymiaru ani okresu ochronnego.
Występuje w wodach całej Europy. Preferuje nizinne, wolno płynące rzeki lub jeziora.
Płoć – ciało krótkie, wysoko wygrzbiecone, bocznie ściśnięte, w wodach ubogich w pokarm
bardziej wysmukłe. Głowa krótka, szczęka górna nieco wysunięta przed mały, końcowo położony
otwór gębowy. Płetwy piersiowe najdłuższymi promieniami sięgają nasad płetw brzusznych.
Grzbiet ciemnobrązowy lub szaroczarny z niebieskawym lub zielonkawym połyskiem, boki
jasnosrebrzyste, brzuch biały. Płetwa grzbietowa i ogonowa są szare z czerwonawym odcieniem,
inne płetwy czerwonawe. Tęczówka oka czerwona.
Zjada zarówno pokarm roślinny jak i zwierzęcy. Rodzaje pokarmu i żerowiska zmienia
kilkakrotnie. Narybek żywi się planktonem skorupiakowym na płyciznach; roczniaki przechodzą
na pokarm denny – skorupiaki, mniejsze larwy owadów oraz glony i inne rośliny. Przy długości
około 20 cm płoć zaczyna odżywiać się mięczakami, głównie racicznicami.
Samice osiągają dojrzałość płciową w 3–4 roku życia przy długości około 10 cm, samce o rok
wcześniej. Tarło odbywa się zazwyczaj na przełomie kwietnia i maja przy temperaturze 15–16
stopni C. Ikra ginie przy temperaturze poniżej 8 stopni C. Składana jest ona na różnym podłożu,
zazwyczaj są to rośliny podwodne, stare liście i łodygi trzcin; z ich braku mogą to być kamienie.
Ikra trzyma się podłoża dzięki specjalnym kosmkom. Samica o długości 10cm składa około 2500
ziaren ikry. Wylęg następuje po upływie około 12 dni. Po około 20 dniach wylęg napełnia pęcherz
pławny i rozpoczyna aktywne życie. Ciało pokrywa się łuską przy długości około 5cm. Płoć rośnie
wolno, w wieku 10 lat osiąga długość 22 cm. Żyje do 15–18 lat. W warunkach naturalnych często
krzyżuje się z leszczem, krąpiem, wzdręgą, kleniem i ukleją. Żyją w stadach, żerują gromadnie.
Ryby płochliwe i bardzo ostrożne. Osiągają: 30–40 maksymalnie 50 cm długości, 0,5–2 kg wagi.
Niektóre z płoci żerują w morzu, a trą się w wodach słodkich – jest to anadromiczna forma płoci
występująca w Bałtyku. Stanowi pokarm dla szczupaków, sandaczy, sumów oraz boleni.
Występuje w całej Europie z wyjątkiem Półwyspu Iberyjskiego, zlewiska Adriatyku, Grecji oraz
północnej Skandynawii, na wschodzie sięga daleko w głąb Azji. Występuje we wszystkich wodach
słodkich w Polsce (w rzekach i w jeziorach, z wyjątkiem górskich), także w wodach
przybrzeżnych Bałtyku.
W niektórych regionach posiada dość duże znaczenie gospodarcze. Chętnie poławiana na wędkę
na spławik i grunt.
Wzdręga – ryba z rodziny karpiowatych, często mylona z płocią. Od płoci różni ją:
−
płetwa grzbietowa przesunięta za linię płetw brzusznych
−
otwór gębowy wyraźnie skierowany ku górze
−
jaskrawoczerwone ubarwienie płetw
−
żółto-złota łuska u dorosłych osobników.
Jest to gatunek spokojnego żeru bardzie związany ze strefą przypowierzchniową niż płoć.
W sprzyjających warunkach dorasta do 40 cm i ponad 1 kg.
Wzdręga bywa również nazywana krasnopiórką.
Wody całej Europy. Preferuje nizinne, wolno płynące rzeki lub jeziora.
Ukleja – Ciało wydłużone, spłaszczone bocznie. Łuski delikatne, łatwo odpadające,
o intensywnym, srebrzystym ubarwieniu. Ukleja żyje zazwyczaj gromadnie, żywi się planktonem
oraz owadami i ich larwami. Tarło odbywa w strefie przybrzeżnej jezior lub w rzekach,
w odcinkach płytkich, o kamienistym dnie, od maja do czerwca. Samica składa od 3000 do 10 000
jaj. Osiąga 10–20 cm długości oraz 10–40 g wagi.
−
jest naturalnym pokarmem wielu gatunków ryb drapieżnych,
−
bywa stosowana przez wędkarzy jako naturalna przynęta,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
−
poławiana masowo w celach konsumpcyjnych,
−
srebrzyste łuski uklei stanowiły do niedawna surowiec do pozyskania guaniny, tzw. „essence
d'Orient”, używanej do wyrobu masy perłowej oraz sztucznych pereł (dla uzyskania 1 kg
guaniny przerabiano ok. 4 t uklei).
Do ryb karpiowatych o większym znaczeniu w rzekach należą: drapieżny boleń, kleń, jaź, certa,
brzana, świnka.
Ryby okoniowate
Okoń – ma duży pysk, który zdolny jest do dużego rozwarcia. Szczęki pokryte drobniutkim
ząbkami. Ciało spłaszczone bocznie, u dużych osobników wyraźnie wygrzbiecone.
Charakterystyczne ubarwienie zwykle ciemno zielonkawo-oliwkowy grzbiet i zielonkawe boki. Na
tułowiu i trzonie ogonowym równomiernie rozmieszczone z ciemne pionowe smugi (6–7)
zwężające się od grzbietu ku stronie brzusznej. Łuski koloru srebrnego, drobne i głęboko
umiejscowione. Ich charakterystyczne ząbkowane krawędzie nadają rybie szorstkość w dotyku.
Jeden z najpospolitszych w Polsce gatunków, występujący w większości zbiorników słodkowodnych
oraz w przybrzeżnych wodach Bałtyku. Dorasta do 50 cm długości (średnio 25–30 cm), waga do
3 kg (najczęściej nie przekracza 1 kg). Odżywia się bezkręgowcami wodnymi w miarę wzrostu
przechodzi na coraz bardziej drapieżny tryb życia. Żywi się wówczas rybami i rakami. Ze względu
na dużą płodność i żarłoczność czasami jest uważany za szkodnika. Odławiany z uwagi na smaczne
mięso. W Polsce nie podlegał ochronie, co przyczyniło się do stałego zmniejszania jego populacji.
Od 2006 roku w Polsce wprowadzono wymiary ochronne.
Jazgarz – ciało ma lekko wygrzbiecone, barwy zielonkowatej, usiane licznymi plamkami
ciemnobrązowymi, linia boczna wyraźna. Płetwę grzbietową rozpiętą ma na ostrych promieniach.
Osiąga przeciętnie 15–20 cm długości (maksymalnie 25 cm). Żywi się głównie bezkręgowcami,
ikrą, oraz wylęgiem ryb. dość odporny na zanieczyszczenia wody. Występuje w jeziorach
i wodach płynących od Francji po wschodnią Syberię. Niewielkie znaczenie gospodarcze. Przez
rybaków i wędkarzy traktowana jako rybi chwast ze względu na swoją żarłoczność przy
niewielkich rozmiarach ciała jakie maksymalnie osiąga.
Sandacz – gatunek drapieżnych, słodkowodnych ryb z rodziny okoniowatych. Ciało krępe,
wydłużone, szczupakowate, z szarobrązowym lub szarozielonym grzbietem, boki
srebrzystozielone pokryte ciemnymi, poprzecznymi smugami. Na płetwie grzbietowej i ogonowej
ciemne, regularnie rozmieszczone plamki. Pysk długi, spiczasty z szerokim otworem gębowym.
Podobny do okonia zwłaszcza młode osobniki. Ma jednak smuklejsze ciało niż okoń, więcej
pasków na ciele i charakterystyczne wystające z górnej szczęki zęby przypominające psie kły.
Dorasta do 1,3 m, osiągając do 23 kg. Przeciętna masa odławianych sandaczy wynosi 3–5 kg. Jest
to ryba drapieżna, żywiąca się drobnymi rybkami, jak np. świnką, jazgarzem i ukleją oraz małym
okoniem. Tarło sandacza trwa od maja do czerwca. Samica składa wtedy od 200 000 do 900 000
jaj na płyciznach o piaszczystym lub żwirowatym dnie. Dorosłe ryby strzegą rozwijających się jaj
przed niszczeniem przez inne ryby drapieżne. Spotykany na głębokościach od 2–30 m. W Polsce
występuje na obszarze całego kraju. Zamieszkuje duże, czyste zbiorniki zlewiska Morza
Bałtyckiego, Kaspijskiego i Czarnego.Ważna ryba użytkowa o smacznym mięsie. Czasami
hodowany w stawach rybnych. Gatunek uważany za cenny
Ryby szczupakowate
Szczupak – gatunek posiadający ciało silnie wydłużone i z boków nieco spłaszczone. Pokrywają
je drobne łuski, zachodzące także na pokrywy skrzelowe. Linia boczna jest bardzo wyraźna

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
i przebiega bez załamań od ogona do pokryw skrzelowych. Płetwa grzbietowa jest cofnięta ku
tyłowi ciała, prawie do nasady trzona ogonowego. Płetwa ogonowa jest duża i symetrycznie, dość
głęboko wycięta. Głowa jest wielka i wydłużona, z dużą paszczą, spłaszczoną poziomo. Jest ona
uzbrojona w liczne, ostre zęby zakrzywione do tyłu. Szczupak dorasta do długości 1,5 m i osiąga
ciężar 24 kg i więcej. Jest to gatunek żyjący we wszystkich typach wód śródlądowych i słonawych.
Tarło szczupaka odbywa się w okresie roztopów wiosennych, często na płytkich, zalanych łąkach
i trwa od marca do kwietnia. Samica składa od 3000 do ponad 200 000 jaj, które przylepiają się do
roślin i przedmiotów podwodnych. Młode szczupaki żywią się planktonem, lecz bardzo prędko
przechodzą na drapieżny tryb życia. Znany jest także kanibalizm tego gatunku.
Szczupaki zwykle kryją się wśród roślin wodnych. Drapieżnik polujący z zasadzki rzuca się na
ofiarę gwałtownie i pożera. Jest to świetny pływak, poruszający się błyskawicznymi ruchami ciała,
lecz na małe odległości. Gatunek ten jest szeroko rozprzestrzeniony w wodach śródlądowych
i słonawych na całej półkuli północnej. Znaczenie gospodarcze szczupaka, zwłaszcza w rybactwie
śródlądowym, jest duże. Czasami gatunek uważany za cenny.
Ryby sumowate
Sum – największa ryba słodkowodna Europy. Osiąga długość ponad 2 m i wagę ponad 100 kg
(maksymalnie 5 m i wagę 306 kg)[1]. Ciało długie pozbawione łusek, głowa duża, otwór gębowy
duży silnie uzębiony. Nad górną szczęką znajdują się dwa długie, a pod dolną cztery krótkie wąsy.
Płetwa grzbietowa jest silnie zredukowana, posiada tylko 3–5 promieni, natomiast płetwa
odbytowa jest bardzo długa i sięga prawie do zaokrąglonej płetwy ogonowej. Ogon bardzo długi,
stanowi 3/5 długości ciała. Oczy małe, nozdrza zakończone krótkimi mięsistymi rurkami.
Ubarwienie zależy od środowiska. Grzbiet jest ciemny lub prawie czarny, czasem z zielonkawym,
niebieskawym lub brązowawym odcieniem. Boki ciemnożółtawobiałe z wyraźnym
szarobrązowym marmurkowym wzorem, brzuch szarobiały z ciemnymi nieregularnymi plamami.
Czasami występują czerwonookie osobniki albinotyczne. Dożywa ponad 30 lat.
Występuje głównie w rzekach i zbiornikach zaporowych, w jeziorach sporadycznie. Aktywny
zazwyczaj po zmroku, dzień spędza leżąc nieruchomo na dnie w głębokich miejscach o spokojnym
przepływie. Jest samotnikiem, chociaż czasem żeruje w grupach. Jest wybitnie ciepłolubny. Zimą
nie żeruje.
Wybitny drapieżnik. Poluje na ryby różnych gatunków, jest kanibalem. Wbrew pozorom
większość zdobyczy to niewielkie rybki o długości kilkunastu centymetrów.
Dojrzałość płciową osiąga w wieku 3–6 lat. Tarło odbywa się w czerwcu, czasem w lipcu
w temperaturze około 20°C. Ikra składana jest na roślinach, samica buduje gniazdo i składa do
niego około 500 tys. ziaren ikry, której pilnuje samiec. Wylęg następuje po 3–4 dniach. Okres
larwalny kończy się po około 21 dniach. W siódmym roku życia sum osiąga metr długości,
a w wieku 15 lat mierzy około 150 cm. Żyje około 30 lat.
Największe znaczenie gospodarcze posiada w rejonie Morza Czarnego. Wędkarze łowią go
przede wszystkim na żywca lub martwą rybkę, z gruntu lub na spławik oraz na spinning. Czasami
gatunek uważany za cenny.
Ryby łososiowate podrodziny głąbielowatych
Sielawa – ciało bocznie spłaszczone, oczy duże, otwór gębowy stosunkowo mały. Na pierwszym
łuku skrzelowym od wewnętrznej strony występują wyrostki filtracyjne. Ich liczba jest pomocna
w określaniu odmian sielawy. Zwykle jest ich od 36 do 52. Grzbiet od brązowego przez
ciemnoszary do niebieskawego, boki srebrzyste. Gatunek ten tworzy wiele odmian które są
identyfikowane przez liczbę wyrostków filtracyjnych. Osiąga długość przeciętnie około 30 cm,
maksymalnie 45 cm. Masa ciała maksymalnie ok. 1kg. Występuje głównie w jeziorach w zlewisku

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Morza Bałtyckiego, oraz w dorzeczu górnej Wołgi w Anglii, Szkocji i jeziorze Waginer
w Bawarii. W Polsce częsta w czystych i chłodnych jeziorach. Dojrzałość płciową osiąga w 2–3
roku życia. Tarło odbywa od listopada do grudnia. Samica składa od 2–20 tys. jajeczek. Narybek
przebywa w powierzchniowych warstwach wody.
W ciągu dnia przebywa w ławicach w wodach pelagialnych (otwartej toni), na głębokości 20–30 m,
a o zmierzchu żeruje bliżej powierzchni. Żywi się planktonem.
Białe mięso sielawy jest smaczne i wysoko cenione. Poławiana gospodarczo. Gatunek uważany za
cenny.
Sieja – ciało śledziowate, zależnie od lokalnej rasy mniej lub bardziej wysmukłe. Głowa mała,
o spiczastym, często nawet wyciągniętym w kształcie nosa pysku. Łuski większe niż
u łososiowatych, linia boczna pełna. Wąsko wycięty otwór gębowy sięga do przedniej krawędzi
oka; w zależności od rasy ma on położenie końcowe bądź dolne. Na pierwszym łuku skrzelowym
25–39 (najczęściej 30–34) długich, gęsto osadzonych wyrostków filtracyjnych. Gatunek ten
tworzy wiele odmian (form), które są identyfikowane przez liczbę tych wyrostków. Grzbiet
niebieskawozielony do ciemnozielonego. Boki i brzuch białe lub srebrzyście lśniące. W jeziorach
ubogich w pokarm występują karłowate formy osiągające długość 10–20 cm, średnia długość
wynosi 30–50 cm, maksymalnie około 60 cm. Dane historyczne o siei z jeziora Miedwie koło
Szczecina mówią o osobnikach o masie 12 kg
W jeziorach odżywiają się głównie skorupiakami, przemieszczającymi się ku powierzchni wody
larwami owadów i ich poczwarkami. Także wylęgiem ryb i ich ikrą. W płytkich jeziorach
i rzekach zjadają również organizmy denne.
Forma wędrowna (np.: w Bałtyku), wchodzi na tarło do zalewów i dolnego biegu rzek. Pora tarła,
zależnie od typu wód, bardzo różna, najczęściej jednak od września do grudnia. Również
populacje zamieszkujące jeziora podejmować mogą wędrówki tarłowe do wpadających do nich
rzek. Z drugiej strony sieja z Jeziora Bodeńskiego trze się około połowy grudnia w strefie wolnej
wody na dużych głębokościach. Z syberyjskich rzek znane są osiadłe, karłowate formy tego
gatunku. Gatunki te są blisko ze sobą spokrewnione i zaliczane są tzw. fauny zimnolubnej,
pochodzenia arktycznego. Ich występowanie w naszych wodach związane jest z ostatnią epoką
lodową – zlodowaceniem bałtyckim. Po cofnięciu się lodowca, na terenach uwolnionych od
skorupy lodowej, utworzyły się jeziora. W najgłębszych, mających pierwotnie połączenie
z morzem osiedliła się sielawa i sieja. Zbiorników z naturalnym występowaniem sielawy i siei jest
w Polsce niewiele. Na przełomie XIX i XX wieku ryby te żyły w nielicznych jeziorach
położonych głównie w północnych rejonach kraju, w tym także w jeziorze Wigry. Gatunek
uważany za cenny.
Ryby łososiowate
Łosoś – ma łuski drobne, mocno osadzone. Linia boczna dobrze widoczna. Na linii grzbietu
występuje mała, czerwonawo szarawa płetwa tłuszczowa (charakterystyczna dla łososiowatych).
Głowa z wielką i silnie uzębioną paszczą. Podczas okresu tarła samce zmieniają ubarwienie na
czerwonawe, a żuchwa przybiera kształt haka. Młode posiadają na bokach ciemne i czerwone
plamki. Osobniki dorosłe posiadają nieregularne czarne plamy na górnej połowie ciała. Dorastają
do rozmiarów 150 cm i 24 kg. Według ustnych przekazów łososie z populacji drawskiej (zwane
również królewskimi) osiągały 150 cm i aż 46 kg wagi. Łosoś jest rybą drapieżną, początkowo
żywi się skorupiakami planktonowymi i larwami owadów, później mniejszymi rybami oraz
skorupiakami.
Typowa ryba anadromiczna tzn. wędrująca na czas rozrodu z mórz do rzek. W czasie tej wędrówki
łososie kierują się zapachem wody w miejscu, w którym przyszły na świat. W trakcie
przekraczania granicy wód słodkich i słonych dokonują się w ich organizmach zmiany

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
biochemiczne i fizjologiczne. W trakcie wędrówki nie pobierają pokarmu. Tarło odbywa się
jesienią, w zimnej , dobrze natlenionej wodzie o silnym prądzie. Ikra w liczbie do 30 000 ziaren (o
średnicy 4–7 mm) jest składana do jamek wygrzebanych przez samicę w piaszczystym lub
kamienistym dnie. Larwy wykluwają się wiosną. Maja one długość około 2 cm. Okres resorbcji
woreczka żółciowego trwa około 40 dni. Po tarle wiele osobników ginie. Osobniki młode spędzają
w rzekach 2–3 lata, następnie wędrują do morza, przybierają wtedy barwę szarozieloną na
grzbiecie i srebrzystobiałą na bokach i brzuchu (tzw. stadium smolt). W morzu spędzają kolejne
2–3 lata, po czym wracają do tej samej rzeki na tarło.
Ostatnie dzikie tarlaki łososia obserwowano w Drawie w 1985, ostatnie łososie w stadium par
złowiono w 1987. W 1995 rozpoczęto program restytucji łososia w polskich rzekach, materiał
zarybieniowy pozyskano z łotewskiej rzeki Dźwiny. W 1997 stwierdzono w Drawie obecność
gniazd tarłowych. Mimo sukcesu, obecny w polskich rzekach łosoś nadal jest gatunkiem
zagrożonym wyginięciem, znaczącą poprawę sytuacji może zapewnić jedynie dalsza wyraźna
poprawa jakości wód, udrożnienie rzek, udostępnienie tarlisk, racjonalna polityka rybacka oraz
walka z kłusownictwem. Gatunek uważany za cenny.
Troć wędrowna — anadromiczna ryba wędrowna, należąca do tego samego gatunku co pstrąg
potokowy. Jest w zasadzie jego wędrowną formą. Bardzo podobna do łososia. W porównaniu
z łososiem ma bardziej krępe ciało i większą głowę. Grzbiet jest szarawy lub brązowawy, boki
jaśniejsze a brzuch srebrzysty. Głowa boki i grzbiet są pokryte licznymi czarnymi plamkami które
w czasie tarła mają żółtą obwódkę. Płetwa tłuszczowa czerwono obrzeżona. W okresie tarła
u samców pojawiają się czerwone plamki na bokach i przybierają one charakterystyczną
miedzianobrązową barwę ciała. Młode osobniki maja ciemne poprzeczne prążkowanie i czerwone
plamki na ciele.
Osiąga długość ponad 1 m, 30 kg wagi.
Wędrówki tarłowe odbywają się zazwyczaj od lipca do jesieni. Troć nie podejmuje tak dalekich
wędrówek jak łosoś. Tarło odbywa się od listopada do marca w podobny sposób jak u łososia.
Smolty spływają do mórz przy długości 10–20 cm. Gatunek uważany za cenny.
Ryby węgorzowate
Węgorz – ubarwienie najczęściej ciemne, czasem niemal całkowicie czarne, spód srebrzysty lub
żółtawo białawy. Skóra węgorza pokryta jest grubą warstwą śluzu. Łuski są drobne, elipsoidalne,
głęboko osadzone. Nie posiada płetw brzusznych.
W rzekach i jeziorach Europy Zachodniej i Środkowej, w południowo-wschodniej i środkowej
części Oceanu Atlantyckiego i we wszystkich morzach europejskich.
Osiąga od 100 do 150 cm długości. Samce są mniejsze od samic i osiągają długość od 50 do 70 cm
(tzw. sznurówki). Największy węgorz złowiony dotąd w Polsce ważył 6, 8 kg (w Anglii 5,5 kg).
Żywi się głównie fauną denną (bezkręgowce) i drobnymi rybami, potrafi połykać zdobycz
stosunkowo dużych rozmiarów. Jest zawziętym prześladowcą raków podczas linienia.
Węgorz jest aktywny nocą. Przed osiągnięciem dojrzałości płciowej żyją w wodach śródlądowych
– samice w głębi lądu, samce w zasięgu wód słonawych. Dorosłe osobniki wędrują z wód słodkich
do morza (wędrówka katadromiczna).
Spływ węgorzy podejmujących wędrówkę rozrodczą zaczyna się wiosną i trwa do jesieni. Dostają
się do Morza Sargassowego i tam na głębokości 400–1000 metrów odbywają tarło. Osobniki
dorosłe po tarle giną. Larwy węgorza, zwane leptocefalami, unoszone są przez Prąd Zatokowy
(Golfstrom) w kierunku wschodnim i po upływie 2–3 lat docierają do przybrzeżnych wód
europejskich, skąd następnie wpływają do rzek, głównie na terytoriach Francji i Anglii. W czasie
wędrówki leptocefale rosną, aż osiągną ok. 7 cm długości. W wodach słodkich przebywają
zazwyczaj od 6 do 10 lat, niektóre osobniki nawet do 20-tu. Gatunek uważany za cenny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Większość zbiorników użytkowanych rybacko z ekologicznego punktu widzenia jest
ekosystemem wodnym. Ekosystem składa się z zespołu czynników środowiskowych zwanych
biotopem i zespołu organizmów żywych zwanych biocenozą. Ryby w zbiorniku wodnym stanowią
część biocenozy i noszą nazwę ichtiofauny. Rolę ekologiczną poszczególnych gatunków ryb
wyznacza głównie rodzaj zjadanego pokarmu oraz sposób jego zdobywania. W zasadzie każdy
gatunek specjalizuje się trochę odmiennym sposobie żerowania czyli zajmuje odmienna niszę
pokarmową.
Z rybackiego punktu widzenia przedstawicieli ichtiofauny można zaliczyć do dwu grup:
ryb spokojnego żeru i ryb drapieżnych.
Ryby spokojnego żery to ryby roślinożerne takie jak np. amur czy tołpyga oraz wszystkożerne
z przewagą pokarmu zwierzęcego takie jak większość karpiowatych (np. karp, lin, płoć, leszcz,
krąp, wzdręga).
Ryby spokojnego żeru z reguły systematycznie przeszukują różne strefy zbiornika w poszukiwaniu
pokarmu. Ryby spokojnego żeru żerujące w toni wodnej to głównie tołpyga, sielawa, sieja, żywią
się organizmami unoszącymi się w toni wody. Ryby spokojnego żeru żerujące przy dnie to np.
karp , lin czy leszcz, które zbierają z dna różne organizmy bytujące na dnie lub w nim ukryte. I tak
na przykład bardzo podobne do siebie gatunki jakim są płoć i wzdręga choć należą do grupy ryb
spokojnego żeru to wzdręga bardziej niż płoć związana jest z przypowierzchniową strefą
zbiorników i ma większe preferencje do drapieżnego trybu życia.
Ryby drapieżne zasadniczo odżywiają się innymi gatunkami ryb i nierzadko przedstawicielami
własnego gatunku. Do ryb drapieżnych zalicza się (szczupaka, sandacza, węgorza, suma, bolenia,
okonia, pstrąga, troć wędrowną, łososia).
Gatunki ryb żerując wpływają ograniczająco na liczebność organizmów którymi się żywią.
I tak ryby spokojnego żeru nie dopuszczają od zbytniej liczebności organizmów dennych (np.
ślimaków), ryby drapieżne redukują liczebność ryb spokojnego żeru. Gospodarując rybacko należy
pamiętać o istotnej roli poszczególnych grup ryb w ekosystemie. Nieracjonalna gospodarka
zasobami żywymi może spowodować, że w zbiorniku najlepsze warunki znajdzie gatunek
niepożądany i on nadmiernie się rozmnażając zacznie eliminować cenne gatunki ryb.
Taki efekt można zauważyć w przypadku przełowienia drapieżników np. szczupaka.
Należy pamiętać że zasady ekologicznego przepływu energii przez ekosystemy warunkują
dziesięciokrotnie mniejszą liczebność drapieżników niż liczebność potencjalnych ofiar (ryb
spokojnego żeru) i to tylko wówczas, gdy ofiary i drapieżniki mają podobne rozmiary. Gdy
drapieżniki są znacznie większe niż ofiary jest ich zwykle jeszcze mniej.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie elementy budowy ryby pomocne są w rozróżnianiu gatunków?
2.
Jakie gatunki należą do karpiowatych,?
3.
Jakie gatunki należą do okoniowatych?
4.
Jakie gatunki należą do sumowatych, szczupakowatych, węgorzowatych?
5.
Jakie gatunki należą do łososiowatych i głąbielowatych?
6.
Jakie gatunki ryb są rybami spokojnego żeru?
7.
Jakie gatunki ryb są drapieżnikami?
8.
Jakie gatunki ryb najczęściej zaliczane są do gatunków cennych?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
4.1.3. Ćwiczenia
Ćwiczenie 1
Przyjrzyj się dokładnie preparatom ryb. Na podstawie opanowanych wiadomości i atlasów ryb
określ ich gatunek i zaklasyfikuj do rodziny, podaj rodzaj pokarmu określ ją jako rybę spokojnego
żeru lub jako drapieżnika. Wyniki wpisz do tabeli:
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w materiałach nauczania, atlasie lub kluczu gatunek ryby o cechach
odpowiadających preparatowi,
2)
wpisać nazwę gatunkową w kolumnę 1 tabeli,
3)
wpisać w kolumnę 2 tabeli cechy charakterystyczne gatunku,
4)
wpisać w kolumnę 3 rodzinę do której należy dany gatunek,
5)
z wyżej wymienionego źródła wypisać rodzaj pokarmu danego gatunku i wpisać w kolumnę 4,
6)
określić jaki typ żeru reprezentuje dany gatunek i wpisać w kolumnę 5.
Lp.
Gatunek ryby
Cechy
charakterystyczne-
umożliwiające
rozpoznanie
Rodzina Pokarm Żerowanie
1
2
3 4 5
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
Wyposażenie stanowiska pracy:
−
preparaty poszczególnych gatunków ryb (ew. świeże okazy),
−
atlasy i klucze do oznaczania ryb,
−
literatura wymieniana w części 6 poradnika.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
rozpoznać podstawowe gatunki ryb?
!
!
2)
zaklasyfikować je do odpowiednich rodzin?
!
!
3)
określić skład ich pokarmu?
!
!
4)
dokonać klasyfikacji względem sposobu żerowania?
!
!
5)
wymienić gatunki uznawane za cenne?
!
!
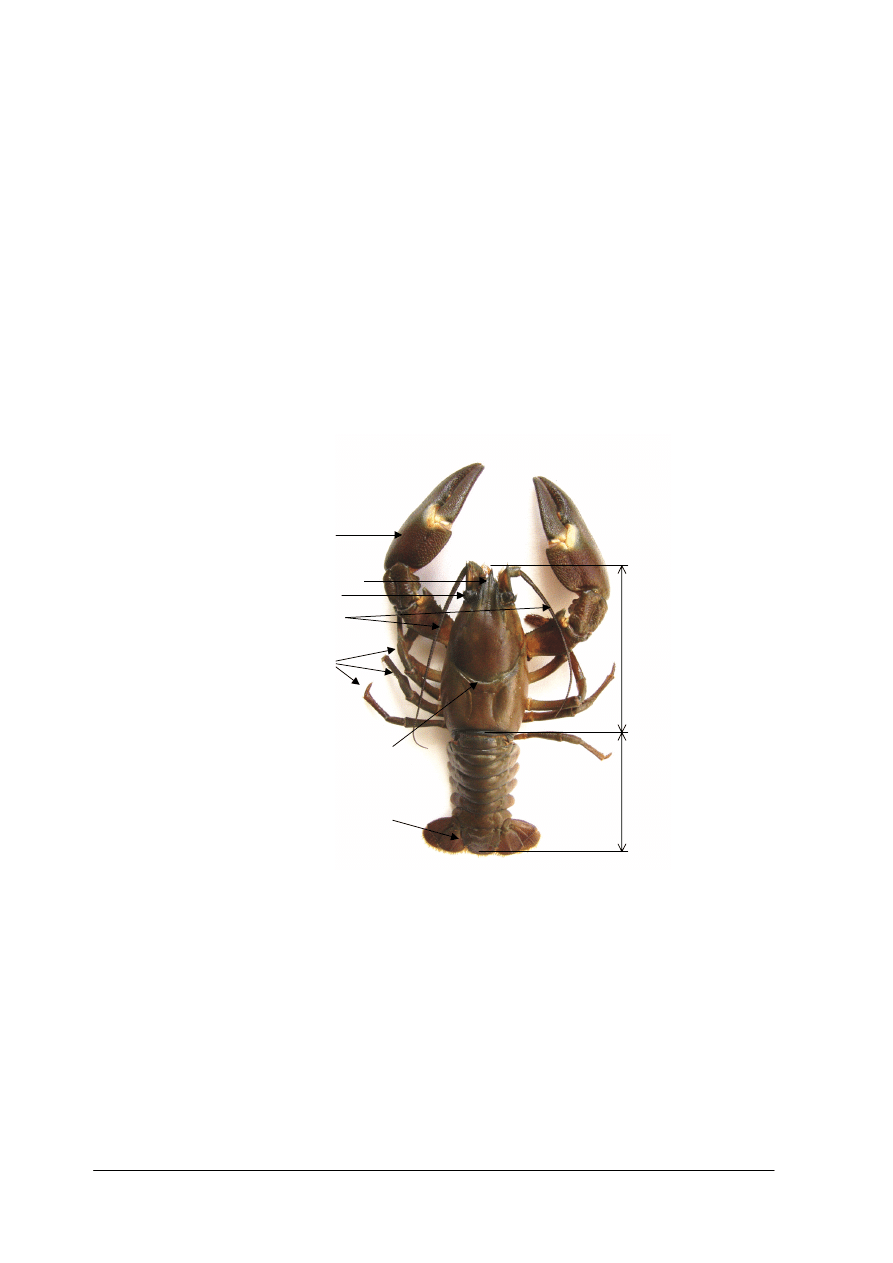
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
4.2. Raki
4.2.1. Materiał nauczania
Raki słodkowodne są organizmami zakwalifikowanymi systematycznie do gromady
skorupiaków i rzędu dziesięcionogów. Nazwa skorupiaki wskazuje, że ciało tych zwierząt pokryte
jest pancerzem zbudowanym z substancji zwanej chityną, która wysycona jest związkami wapnia
(węglanem i fosforanem wapnia) nadającej pancerzowi odpowiednią twardość.
Są to organizmy posiadające specyficzną i bardzo charakterystyczną budowę ciała powodującą
że odróżnienie raków od innych organizmów wodnych nie nastręcza żadnych problemów.
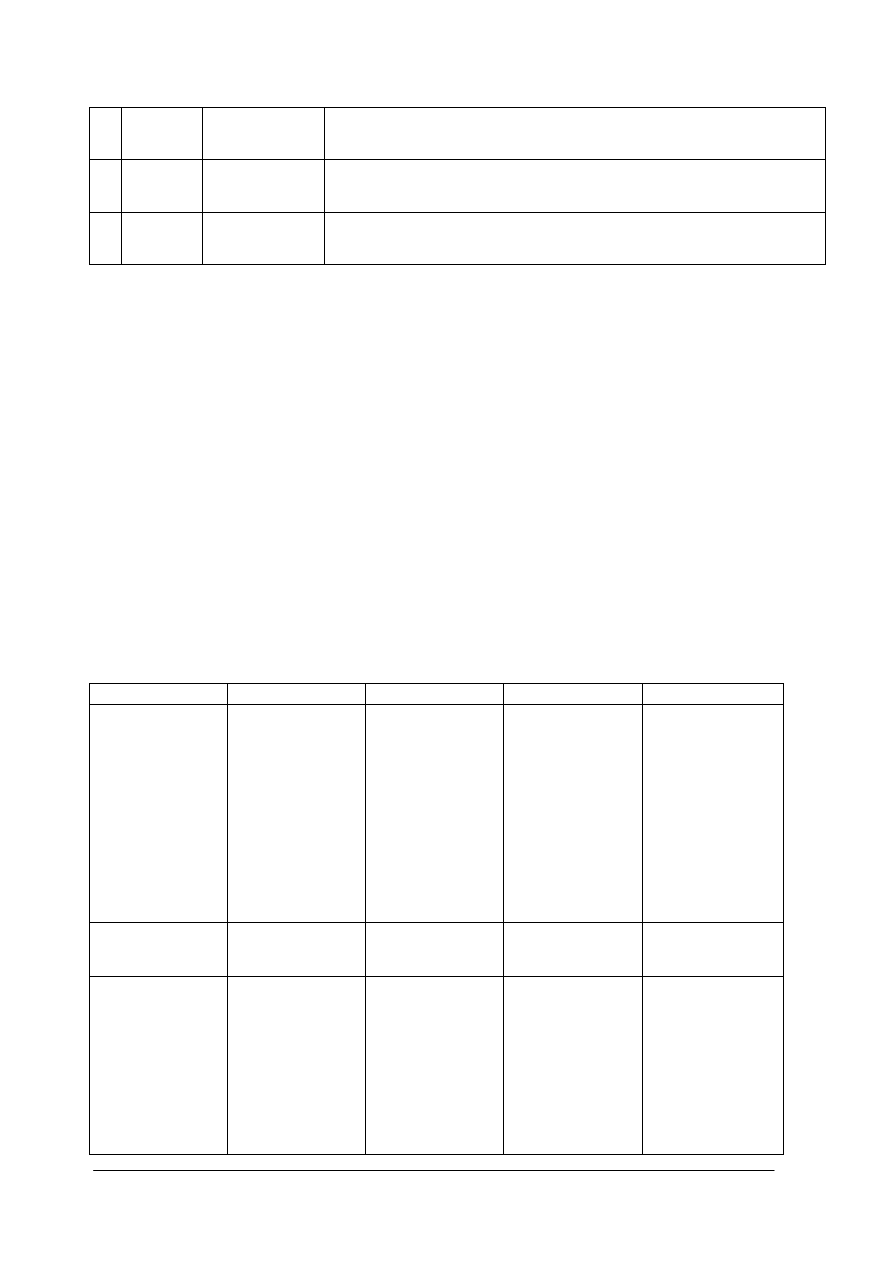
Raki charakteryzują się budową ciała złożoną z zasadniczo dwóch części: przedniej
głowotułowia oraz tylnej odwłoka. (rysunek poniżej)
ODWŁOK
GŁOWOTUŁÓW
telson
bruzda karkowa
odnóża kroczne
czułki II pary
rostrum (dziób)
szczypce
oko
Rys. 1. Schemat budowy raka na przykładzie raka sygnałowego
Głowotułów zbudowany z dwu części wyraźnie zrośniętych w miejscu zwanym bruzdą
karkową. Powyżej tej bruzdy znajduje się głowa raka zakończona charakterystycznym „dziobem”
zwanym rostrum. Na przedłużeniu jego krawędzi znajdują się uwypuklenia pancerza zwane
listwami zaocznymi.
Poniżej bruzdy karkowej znajduje się tułowiowa część głowotułowia. Charakterystyczną cechą
głowotułowia są dwie wzdłużne łukowato wygięte bruzdy.
Odwłok raka czasami potocznie zwany ogonem lub szyjką rakową ma budowę segmentową.
Odwłok składa się z sześciu segmentów z których każdy pokryty jest osobnymi płytkami
pancerza. Dzięki temu odwłok zachowuje ruchomość w płaszczyźnie pionowej. Rak może odwłok

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
prostować i powijać pod siebie. Ostatni segment odwłoka najwyraźniej różni się od pozostałych
ma bowiem postać dwuczłonowej płytki stanowiącej środkową część wachlarzowatej płetwy
zwanej telsonem. Płetwa ta złożona jest z czterech dodatkowych płytek (po dwie z każdej strony).
Całość tworzy charakterystyczny pięcioczęściowy wachlarz, który pełni rolę wiosła podczas
pływania raka.
Z racji przynależności do dziesięcionogów rak posiada 5 par odnóży krocznych wyrastających
z spodniej części głowotułowia. Pierwsza para tych odnóży zakończona jest charakterystycznymi
szczypcami (kleszczami). Dwie kolejne pary na zakończeniach posiadają również szczypce z tym
że są one bardzo małe. Kolejne dwie pary zakończone są stożkowato. Do chodzenia zasadniczo
rak używa czterech par kończyn. Odnóża odwłokowe są dużo mniejsze i widoczne zasadniczo od
spodniej części ciała raka. U samców odnóża tułowiowe dwóch pierwszych członów odwłoka
przekształcone są w charakterystyczny narząd kopulacyjny. U samic brak tych odnóży umożliwia
łatwą identyfikację płci raków.
Odnóża ostatniego segmentu tworzą charakterystyczne opisane wyżej płytki telsonu. Pozostałe
odnóża tułowiowe mają dwugałezistą budowę. Wspomagają pływanie, ruch wody omywającej
raka ułatwiający oddychanie, a u samic są miejscem zaczepu jaj i młodych raczków tuż po wylęgu.
Odnóża części głowowej raków przekształcone są w czułki I i II pary. Czułki drugiej pary mają
postać charakterystycznych witek – „wąsów” raka i tworzą trójkątne łuski widoczne pod oczami
raka. Pozostałe odnóża głowowe wchodzą w skład stosunkowo skomplikowanego aparatu
gębowego tworząc szczęki, żuwaczki i szczękonóża.
Raki bytują w różnego typu wodach słodkowodnych w tym płynących: od małych
strumyczków do wielkich rzek oraz stojących takich jak torfianki, glinianki, stawy jeziora
i zbiorniki zaporowe, a nawet słonawe wody Zatoki Gdańskiej Morza Bałtyckiego.
Oddychają skrzelami mającymi pierzastą budowę i dzięki stosunkowo dużej sztywności skrzel
raki mogą przez pewien czas (kilka dni) oddychać powietrzem atmosferycznym. Zasadniczo
jednak oddychają tlenem rozpuszczonym w wodzie omywającej ich skrzela. Ruch wody
przepływającej pod głowotułowiem od strony odwłoka wywołany jest ruchami przekształconej
części odnóża głowowego.
Wzrost raków związany jest z cyklicznie powtarzającym się procesem zwanym linieniem.
Podczas linienia rak zrzuca stary pancerz i do momentu stwardnienia nowego zwiększa swoje
rozmiary ciała. W trakcie linienia raki przez pewien czas (kilka – kilkadziesiąt godzin) nie mogą
się poruszać i są całkowicie bezbronne. Miękki pancerz powoli wysyca się wapniem i fosforanami
które na czas linienia częściowo magazynowane są w postaci dwóch półkolistych tworów zwanych
gastrolitami lub potocznie „raczymi oczami”. Znajdują się one wewnątrz ciała raka tuż nad
wyściółką chitynową żołądka. Po jaj zrzuceniu w trakcie linienia gastrolity wpadają do żołądka
i są trawione.
Raki są organizmami wszystkożernymi z racji łatwości zdobycia pokarmu dominującym jest
pokarm roślinny. Na pokarm pochodzenia zwierzęcego składają się głownie nieruchliwe
organizmy denne takie jak ślimaki czy larwy owadów, żywią się również martwymi organizmami,
jest również kanibalem. Przewód pokarmowy prawie całkowicie wyścielony chityną składa się
z dwuczęściowego żołądka z którego pierwsza część spełnia funkcję żującą a druga trawiącą.
Z żołądka wychodzi długie jelito biegnące prze cały odwłok kończące się otworem odbytowym na
spodniej części środkowej płytki telsonu. Tylko w krótkim początkowym fragmencie jelita brak
wyściółki chitynowej i dlatego tylko tu zjedzony i strawiony pokarm może być wchłaniany.
Układ rozrodczy u samic składa się z jajnika zawierającego liczne jaja o wyglądzie żółtawych
granulek. Znajduje się on w głowotułowiu tuż przy odwłoku. U samców w tym miejscu znajduje
się białe jądro z dwoma długimi nitkowatymi spiralnie zwiniętymi nasieniowodami.
W okresie godowym samiec chwyta samicę szczypcami u nasady jej szczypcie odwraca na
stroną brzuszną do góry i przytwierdza części głowotułowia białe przecinkowate pakiety
plemników zwane spermatoforami. Po zaplemnieniu samica składa jaja przez otwory płciowe

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
u nasady III pary odnóży. Jajo przesuwane jest rynienką pomiędzy odnóżami krocznymi
w kierunku odwłoka. Wówczas jajo jest zapładniane. Następnie jajo pokrywane jest twardniejącą
w wodzie substancją z tzw. gruczołów cementowych i przytwierdzane od odnóży odwłokowych.
W zależności od gatunku i wieku raka samica składa od kilkudziesięciu do kilkuset jaj. Przez
pewien okras (do kilku tygodni do kilku miesięcy) samica nosi jaja przytwierdzone do odwłoka
zapewniając im ochronę i odpowiednie natlenienie ruchami odnóży tułowiowych. Po tym okresie
z jaj wylęgają się małe raczki które wyglądem przypominają osobniki dorosłe. Po około dwóch
tygodniach małe raczki odczepiają się od odwłoka samicy i zaczynają samodzielne życie.
W wodach otwartych Polski występują cztery gatunki raków. Dwa uznawane są za rodzime to
znaczy stanowiące naturalny składnik fauny wód. Dwa pozostałe zostały sprowadzone przez
człowieka z kontynentu Ameryki Północnej i jako te o nienaturalnym pochodzeniu są niepożądane
w wodach otwartych Polski.
Gatunki raków
Rak szlachetny – występował na obszarze całej Polski z wyjątkiem wysokich gór. Obecnie
gatunek zanikający. Żyje w wodach płynących (strumienie mniejsze rzeki) oraz stojących głownie
jeziora. Bardzo wymagający pod względem czystości środowiska i temperatury wody. Optymalnie
od 10 do 12 stopni nie więcej niż 20. Dorasta do ponad 25 cm przekraczając masę 250 g. Żyje
ponad 20 lat. Do godów przystępuje w końcu października. Samica składa do 400 jaj, które nosi
przytwierdzone do odwłoka przez około pół roku. Małe raczki wylęgają się w czerwcu – lipcu.
Dojrzałość płciową osiągają w trzecim (samice) lub czwartym (roku ) życia.
Rak błotny – gatunek wschodnioeuropejski o biologii zbliżonej do raka szlachetnego. Jest
jednak gatunkiem bardziej ciepłolubnym i tolerującym niższe koncentracje tlenu w wodzie
i niewielkie zanieczyszczenia. Dorastać może do 25 cm jednak ma zwykle niższą masę niż rak
szlachetny podobnych rozmiarów ze względu na delikatniejszą budowę szczypiec. Rozród
podobny jak u raka szlachetnego, samice cechują się jednak nieco wyższą płodnością do 650 jaj.
Gatunek zagrożony wyginięciem.
Rak pręgowaty – gatunek północnoamerykański. Sprowadzony i wpuszczony do wód
europejskich pod konie XIX wieku. Miał on zastąpić raka szlachetnego zdziesiątkowanego
chorobą „dżumą raczą”. Jest to gatunek odporny na tę chorobę, jednocześnie może ją przenosić. Ze
względu na małe rozmiary (max. 12 cm) i trudną łowność okazał się nieatrakcyjny gospodarczo.
Przystosował się do warunków europejskich stając się gatunkiem ekspansywnym –
powiększającym swój zasięg występowania i wypierającym gatunki takie jak rak szlachetny czy
błotny. Obecnie najpospolitszy i najliczniejszy gatunek raka w Polsce. Ma małe wymagania
odnośnie stanu środowiska, może występować w wodach zanieczyszczonych i o podwyższonej
temperaturze.
Jest gatunkiem krótkowiecznym (4–6 lat) szybko rosnącym i dojrzewającym płciowo
(w drugim roku życia). Do godów przystępuje na jesieni już we wrześniu i kontynuuje je do końca
kwietnia. Samica składa jaja dopiero w połowie maja i nosie je zaledwie przez około 4–5 tygodni.
Gatunek bardzo płodny do 400 przy relatywnie niewielkich rozmiarach ciała.
Rak sygnałowy – gatunek północnoamerykański. Sprowadzony i wpuszczony do wód
szwedzkich w początku lat 60 ubiegłego stulecia. Tak samo jak rak pręgowaty miał
zrekompensować straty gospodarcze spowodowane spadkiem odłowów raka szlachetnego.
Gatunek odporny i przenoszący „dżumę raczą”. Toleruje niewielkie zanieczyszczenia wód
i podwyższoną jej temperaturę. Do Polski sprowadzony w początku lat 70 XX wieku.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
Atrakcyjny kulinarnie ze względu na osiąganie dużych rozmiarów ciała (samce ponad 18 cm)
oraz posiadanie masywnych szczypiec. Do godów przystępuje w końcu września. Samica nosi jaja
do początku maja. Bardzo płodny – ponad 500 jaj na samicę, szybko osiąga dojrzałość płciową
czasami już w drugim roku życia. Charakteryzuje się szybkim wzrostem i dużą agresywnością.
Wypiera raka szlachetnego w przypadku wspólnego występowania. W Polsce zwiększa swój
zasięg występowania.
Przystąpienie do chowu czy hodowli raków wymaga podstawowej umiejętności
rozpoznawanie raków. Prezentowana niżej tabela prezentuje najważniejsze cechy pozwalające na
rozróżnienie gatunków.
Tabela 1. Najważniejsze cechy pozwalające na rozróżnienie gatunków raka
Cecha
Rak
szlachetny
Rak błotny
Rak
pręgowaty
Rak sygnałowy
Szczypce – barwa
Spodnia część
czerwona (od
pomarańczowej do
ciemno wiśniowej)
Spodnia część jasno
cielisto szara
Spodnia część jasno
cielisto szara lub
szara czarno
przydymionym
końcem palców
szczypiec
z pomarańczowym
szczytem
Spodnia część czerwona
(od pomarańczowej do
ciemno wiśniowej.
U nasady ruchomego
palca szczypców (kciuka)
biała plama.
Barwa ciała
Brązowo-brunatna z
odcieniem
wiśniowym lub
zielonym.
Możliwe osobniki
całkowicie
niebieskie
Brązowo-brunatna
z odcieniem
pomarańczowym lub
zielonym
Brązowo-brunatna z
charakterystycznymi
brunatno-
wiśnowymi plamami
na odwłoku
tworzącymi
charakterystyczny
wzór.
Brązowo-brunatna
z odcieniem wiśniowym
lub zielonym.
Możliwe osobniki
całkowicie niebieskie.
Biała plama u nasady
kciuka szczypiec.
Szczypce – kształt
Masywne.
Wewnętrzne
krawędzie
zamkniętych
szczypiec nie
przylegają do siebie
tworząc wyraźną
szczelinę
Mniej masywne niż
o szlachetnego z
wyraźnie
wydłużonymi
palcami.
Wewnętrzne
krawędzie
zamkniętych
szczypiec szczelnie
przylegają do siebie.
Stosukowo drobne.
Wewnętrzne
krawędzie
zamkniętych
szczypiec szczelnie
przylegają do siebie.
Bardzo masywne.
Zewnętrzna krawędź
nieruchomego palca
owalnie wykrojona.
Wewnętrzne krawędzie
zamkniętych szczypiec
nie przylegają do siebie
tworząc wyraźną
szczelinę
Głowotułów
Gładki. Pojedynczy
drobny kolec po
bokach przy
bruździe karkowej
Pokryty drobnymi
kolcami na całej
powierzchni.
Gładki z wyraźną
grupą kolców po
bokach głowowej
części („na
policzkach”)
Całkowicie gładki bez
żadnych kolców.
Inne
charakterystyczne
Rostrum
rynienkowate bez
żeberka środkowego.
U samców na
odnóżach III pary
kolcowaty wyrostek

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1.
Dlaczego raki są skorupiakami należącymi do grupy dziesięcionogów?
2.
Jak ogólnie zbudowane jest ciało raka?
3.
Jak wygląda wzrost i rozród raków?
4.
Ile jest gatunków raków w wodach otwartych Polski?
5.
Jak scharakteryzowałbyś gatunki raków występujące w wodach Polski?
6.
Jak rozpoznać poszczególne gatunki raków?
4.2.3 Ćwiczenia
Ćwiczenie 1
Przyjrzyj się dokładnie zdjęciom i wysuszonym wylinkom raków. Na podstawie opanowanych
wiadomości i obserwacji narysuj uproszczony rysunek raka posługując się formami prostokąta,
trapezu, trójkąta, linii i łuku. Zwróć uwagę na prawidłową liczbę kończyn i segmentów
odwłokowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenia, powinieneś:
1)
zaznaczyć na kratkowanym papierze proporcje podstawowych elementów budowy ciała raka,
2)
narysować uproszczony rysunek ciała raka,
3)
wskazać strzałkami na własnym rysunku poszczególne znane Ci części ciała raka.
Wyposażenie stanowiska pracy:
−
preparaty poszczególnych gatunków raków (ew. zdjęcia okazów),
−
atlasy i klucze do oznaczania raków,
−
papier kratkowany, linijka, ołówek,
−
literatura wymieniana w części 6 poradnika.
Ćwiczenie 2
Przyjrzyj się dokładnie preparatom raków. Na podstawie opanowanych wiadomości i atlasów
raków określ ich gatunek i opisz cechy na podstawie których dokonałeś oznaczenia.
Wyniki wpisz do tabeli.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w materiałach nauczania, atlasie lub kluczu gatunek raka o cechach odpowiadających
preparatowi Oznaczenie preparatu, zdjęcia, rysunku wpisać w kolumnę 2 tabeli,
2)
wpisać nazwę gatunkową w kolumnę 3 tabeli,
3)
wpisać w kolumnę 4 tabeli cechy charakterystyczne gatunku,
Lp. Oznaczenie
preparatu,
wylinki,
zdjęcia
Gatunek raka
Cechy charakterystyczne –
umożliwiające rozpoznanie
1.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
2.
3.
4.
Wyposażenie stanowiska pracy:
−
preparaty poszczególnych gatunków raków (ew. zdjęcia lub rysunki)
−
atlasy i klucze do oznaczania raków
−
literatura wymieniana w części 6 poradnika.
Ćwiczenie 3
Na podstawie posiadanych wiadomości wypełnij następującą tabelę skreślając niewłaściwe
informacje.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w materiałach nauczania, atlasie lub kluczu gatunek raka informacji
o poszczególnych cechach gatunków raków występujących w Polsce,
2)
dokonać odpowiednich wyborów pozostawiając odpowiednią informację w każdej kratce
tabeli,
3)
umieć argumentować dokonany wybór,
4)
porównać swoją tabelę z tabelami kolegów.
Cecha
Rak szlachetny
Rak błotny
Rak pręgowaty
Rak sygnałowy
Wymagania
środowiskowe
•
Zimnolubny
•
Ciepłolubny
•
Tolerujący
wyższe
temperatury
•
Duża czystość
wód
•
Umiarkowana
czystość wód
•
Wody
zanieczyszczone
•
Zimnolubny
•
Ciepłolubny
•
Tolerujący
wyższe
temperatury
•
Duża czystość
wód
•
Umiarkowana
czystość wód
•
Wody
zanieczyszczone
•
Zimnolubny
•
Ciepłolubny
•
Tolerujący
wyższe
temperatury
•
Duża czystość
wód
•
Umiarkowana
czystość wód
•
Wody
zanieczyszczone
•
Zimnolubny
•
Ciepłolubny
•
Tolerujący wyższe
temperatury
•
Duża czystość
wód
•
Umiarkowana
czystość wód
•
Wody
zanieczyszczone
Tempo wzrostu
•
Szybkie
•
Wolne
•
Szybkie
•
Wolne
•
Szybkie
•
Wolne
•
Szybkie
•
Wolne
Osiągane rozmiary
ciała/ budowa
szczypiec
•
Niewielkie/
szczypce małe
•
Duże/ szczypce
bardzo masywne
•
Duże/ szczypce
delikatniejszej
budowy
•
Duże/ Szczypce
masywne
•
Niewielkie/
szczypce małe
•
Duże/ szczypce
bardzo masywne
•
Duże/ szczypce
delikatniejszej
budowy
•
Duże/ Szczypce
masywne
•
Niewielkie/
szczypce małe
•
Duże/ szczypce
bardzo masywne
•
Duże/ szczypce
delikatniejszej
budowy
•
Duże/ Szczypce
masywne
•
Niewielkie/
szczypce małe
•
Duże/ szczypce
bardzo masywne
•
Duże/ szczypce
delikatniejszej
budowy
•
Duże/ Szczypce
masywne

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Głowotułów
•
Gładki bez
kolców
•
Gładki z jednym
małym kolcem
przy bruździe
karkowej
•
Pokryty kolcami
•
Gładki z grupą
kolców na
policzku
•
Gładki bez
kolców
•
Gładki z jednym
małym kolcem
przy bruździe
karkowej
•
Pokryty kolcami
•
Gładki z grupą
kolców na
policzku
•
Gładki bez
kolców
•
Gładki z jednym
małym kolcem
przy bruździe
karkowej
•
Pokryty kolcami
•
Gładki z grupą
kolców na
policzku
•
Gładki bez kolców
•
Gładki z jednym
małym kolcem
przy bruździe
karkowej
•
Pokryty kolcami
•
Gładki z grupą
kolców na
policzku
Dojrzałość płciowa
•
późno
•
wcześnie
•
późno
•
wcześnie
•
późno
•
wcześnie
•
późno
•
wcześnie
Barwa spodniej
części szczypiec
•
czerwona
•
czerwona z białą
plamą u nasady
palca
•
cielistoszara z
czarną końcówką
palców i
pomarańczowym
szczytem
•
cielistoszara
•
czerwona
•
czerwona z białą
plamą u nasady
palca
•
cielistoszara z
czarną końcówką
palców i
pomarańczowym
szczytem
•
cielistoszara
•
czerwona
•
czerwona z białą
plamą u nasady
palca
•
cielistoszara z
czarną końcówką
palców i
pomarańczowym
szczytem
•
cielistoszara
•
czerwona
•
czerwona z białą
plamą u nasady
palca
•
cielistoszara
z czarną końcówką
palców
i pomarańczowym
szczytem
•
cielistoszara
Gatunek rodzimy
•
tak
•
nie
•
tak
•
nie
•
tak
•
nie
•
tak
•
nie
Zagrożony
wyginięciem
•
tak
•
nie
•
tak
•
nie
•
tak
•
nie
•
tak
•
nie
Wyposażenie stanowiska pracy:
−
wysuszone wylinki, zdjęcia raków,
−
literatura zgodna z punktem 6 poradnika.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
opisać podstawową budowę raka?
!
!
2)
opisać podstawy biologii raka?
!
!
3)
rozpoznać gatunki raków słodkowodnych Polski?
!
!
4)
opisać gatunki raków słodkowodnych Polski?
!
!

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
4.3. Eksploatacja rybacka
4.3.1. Materiał nauczania
Eksploatacja rybacka oznacza zespół zabiegów, metod i czynności stosowanych w celu
wyłowienia ryb przy pomocy odpowiednich narzędzi lub urządzeń.
Eksploatacja rybacka zawsze wiąże się z niebezpieczeństwem odłowienia nadmiernej ilości
ryb, co może mieć niekorzystny wpływ na ciągłość produkcji, a nawet trwałość występowania
danego gatunku w zbiorniku i w efekcie prowadzić do załamania się jego połowów. Podstawą
racjonalnej eksploatacji jest wiedza na temat czynników mogących ograniczać liczebność i tempo
wzrostu eksploatowanych populacji ryb.
Każdy łowiony gatunek ryb stanowi w danym zbiorniku populację czyli grupę osobników tego
samego gatunku. Podstawową cechą każdej populacji (w tym także ryb) jest liczebność wyrażana
w rybactwie jako masa w stosunku do powierzchni (kg ryb na 1 ha). Inne cechy populacji, które
mają wpływ na wielkość spodziewanych odłowów to: struktura wiekowa populacji (udział
osobników w różnym wieku), tempo wzrostu populacji (zdolność populacji do odnawianie
liczebności), tempo wzrostu masy i długości ciała przeciętnego osobnika w populacji.
Odpowiednia eksploatacja populacji danego gatunku ryb powinna zapewnić utrzymanie wyżej
wymienionych cech eksploatowanej populacji na optymalnym poziomie. Znaczy to, że właściwie
prowadzona eksploatacja powinna zapewnić stale przewidywalną wielkość odłowów przez
maksymalnie długi czas.
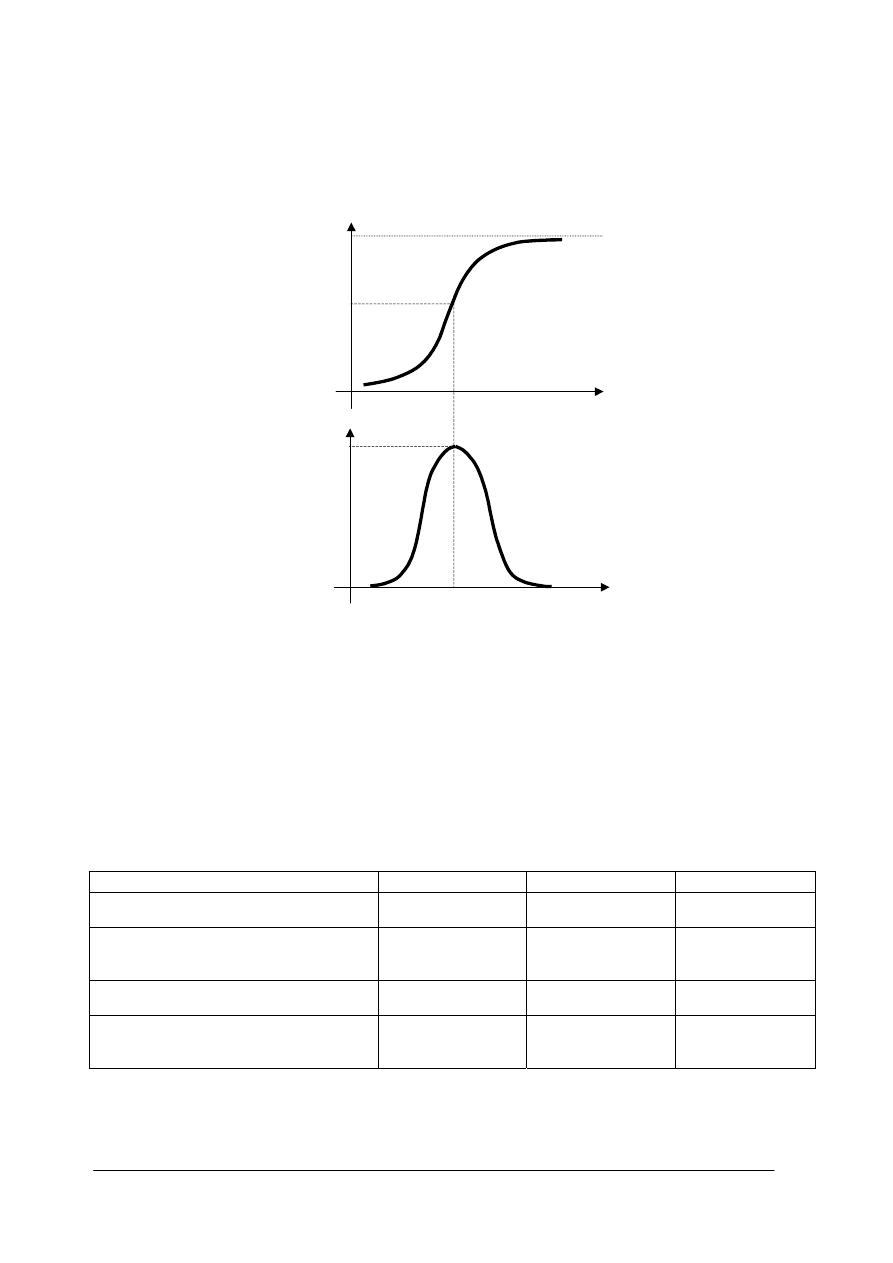
Na rysunku 1 A. przedstawiono schemat ilustrujący wzrost populacji ryb w warunkach
naturalnych. Krzywa reprezentująca ten wzrost przypomina literę „S”. Najbardziej
charakterystyczną cechą takiego wzrostu jest to, że w każdym zbiorniku może utrzymać się
ograniczona liczba ryb. Liczebność ta jest określona różnymi czynnikami takimi jak na przykład
ilość dostępnego pokarmu w zbiorniku. Maksymalną liczebność ryb, jaka może utrzymać się
w zbiorniku nazwać możemy pojemnością ekologiczną (K) zbiornika względem danego gatunku.
Rysunek 1 B przedstawia tempo wzrostu populacji jakie występuje przy liczebności ryb
w zbiorniku przedstawionej na rysunku 1A. Z analizy tych rysunków widać, że gdy liczebność ryb
w zbiorniku osiąga wartość graniczną (L) to wówczas tempo wzrostu ryb ma wartość maksymalną.
Przy tej liczebności ryb warunki bytowania są bowiem optymalne. Jeżeli jednak liczebność ryb
w zbiorniku wzrasta to wskutek wzrostu zagęszczenia pogarszają się warunki bytowania ryb, a to
spowalnia tempo wzrostu ich liczebności.
Przy liczebnościach bliskich wartości K, tempo wzrostu jest również bliskie zeru. Tempo
wzrostu maleje również gdy liczebności ryb w zbiorniku maleją poniżej wartości L. Przyczyną
takiego spadku liczebności poniżej tej wartości L jest zwykle eksploatacja.
Dlatego racjonalna eksploatacja powinna utrzymywać liczebność ryb na poziomie leżącym
pomiędzy wartościami: graniczną L i wartością pojemności ekologicznej K.
Utrzymywanie populacji na poziomie liczebności bliskich wartości K wiąże się niskim
poziomem odłowów i niezbyt korzystną strukturą wiekową w populacji. W takiej sytuacji bowiem
w populacji dominują osobniki przerośnięte o słabym tempie wzrostu.
Utrzymywanie populacji na poziomie poniżej wartości granicznej L, oznacza wystąpienie
pogłębiających się symptomów przełowienia. Mamy wówczas do czynienia z systematycznym
spadkiem wielkości odłowów w kolejnych latach spowodowany malejącym tempem „odradzania”
się populacji.
Omówienie tych zależności, ma na celu ogólne nakreślenie mechanizmu warunkującego
prawidłową eksploatację zasobów. W praktyce jednak bardzo trudno a nawet niemożliwym jest
ustalenie dokładnych wartości pojemności ekologicznych dla poszczególnych gatunków ryb czy
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
też liczebności granicznych. Ich wielkości są zmienne w uzależnieniu od zbiornika, gatunku
i nawet sezonu. Dodatkowo ich dokładne ustalenie wymagałoby kosztownych badań naukowych.
Tempo wzrostu populacji
(tempo odtwarzania liczebności ryb)
Liczebność
populacji
Czas
K = pojemność ekologiczna zbiornika = maksymalna liczebność populacji
Liczebność graniczna - L
Czas
Maksymalne tempo
wzrostu populacji - ∆L
Rys. 1. Tempo wzrostu populacji ryb
W rybactwie racjonalny poziom eksploatacji rybackiej ustalić można na podstawie analizy
eksploatacji rybackiej i jej efektów.
Analiza ta powinna składać się z trzech umownych etapów:
−
analizy połowów ryb
−
analizy intensywności połowów
−
analizy efektywności połowów.
Podstawą takiej analizy jest analiza połowów, którą sporządza się na bazie materiałów
obejmujących okres co najmniej 10 lat.
Schemat takiej analizy przedstawia tabela:
Połowy ryb
Wyniki
Tendencje
Rozkład
Ogólne
(całkowita wielkość połowu)
W grupach gatunków
(wielkości odłowów wyodrębnionych grup
gatunków np.: wyborowe i małocenne)
W poszczególnych gatunkach
W asortymentach poszczególnych gatunków
(wielkości odłowów wyodrębnionych grup
wielkościowych danego gatunku)
Wyniki – wielkości połowów dla poszczególnych lat w kg/ha oraz ich średnie wartości za dany
okres. W miarę możliwości wyniki takie należy porównać z wynikami uzyskanymi z podobnych
jezior.
a)
b)

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Tendencje – wskazanie zmiany (wzrost, spadek, gwałtowne załamanie się połowów) jakie mogą
nastąpić w ogólnych połowach. Wyrażane w formie graficznej lub matematycznej np. średniego
rocznego spadku połowów w kg/ha
Rozkład – uwzględnienie wielkości połowów w skali poszczególnych sezonów. Celem
uwzględnienia rozkładu połowów jest unikniecie błędów interpretacyjnych wynikających
z porównań wielkości odłowu tego samego gatunku łowionego w różnych porach roku. Taki błąd
popełnimy jeżeli na przykład porównamy wynik odłowy jesienno-zimowego z jednego roku
z wynikami odłowu wiosenno-letniego następnego roku.
Ogólnie w wyniku zastosowania powyższej analizy można spotkać się z czterem
zasadniczymi trendami ujawniającymi się w połowach ryb określonego gatunku i jego
asortymentów:
A – wzrost połowów określonego gatunku ryb postępuje wraz ze wzrostem wszystkich
poławianych asortymentów. Świadczy to zazwyczaj o wzroście zagęszczenia populacji danego
gatunku w jeziorze
B – spadek połowów ryb danego gatunku jest spowodowany spadkiem obydwu asortymentów.
Stan taki świadczy o spadku zagęszczenia – liczebności poławianego gatunku.
C – wzrost połowu ryb określonego gatunku postępuje wraz ze wzrostem udziału jednego
asortymentu i spadku innych. W przypadku gdy wzrost dotyczy asortymentów „lekkich” tzn.
mniejszych ryb, świadczyć to może o odmładzaniu się populacji. Gdy stwierdza się zjawisko
odwrotne oznacza to że populacja się starzeje.
D – spadek połowów ryb określonego gatunku postępuje wraz ze spadkiem udziału jednego
asortymentu i wzrostem jednego z pozostałych. W przypadku spadek pozyskania jednego
asortymentu przewyższa wzrost pozostałych dotyczy asortymentów „lekkich” tzn. mniejszych ryb,
świadczyć stąd połowy spadają. Stan taki świadczy o pogłębiającym się spadku zagęszczenia –
liczebności poławianego gatunku.
Analiza intensywności eksploatacji pozwala na określenia jaki nakład rybacki został poniesiony
na pozyskanie ryb z danego zbiornika. Wielkość nakładu rybackiego wyraża się w jednostkach
mocy (jm) obliczonych dla większości narzędzi połowowych stosowanych w polskich warunkach.
Wartości te przedstawia tabela:
Narzędzie połowu
Moc połowowa
(jm)
Przywłoka uklejowa
Niewód stynkowy
Przywłoka
Obstawa leszczowa
Słęp (drygawica)
Wonton
Żak kanałowy
Mieroża
Żak
Racznik
100 haków węgorzowych
360
360
360
175
14
9,6
3,5
1,9
1,2
0,3
3,2
W celu obliczenia intensywności eksploatacji rybackiej należy wyliczyć poprzez pomnożenie
mocy połowowej danego narzędzia przez liczbę dni jego stosowania. Otrzymany wynik należy
następnie podzielić przez powierzchnie jeziora.
Np. stosowanie przywłoki przez 10 dni w 100 hektarowym jeziorze daje wynik:
360 jm * 10 dni /100ha = 36 jm/ha
Analizę intensywności rybackiej należy oprzeć o schemat przedstawiony w tabeli:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Intensywność eksploatacji
Wyniki Tendencje Rozkład
Ogólnej
(wszystkimi narzędziami połowu)
W grupach narzędzi
(np. stawne, ciągnione)
W poszczególnymi narzędziami
Poszczególnych gatunków ryb
Z tej analizy można uzyskać informacje o intensywności rybackiej ukierunkowanej na
poszczególne gatunki i zweryfikować zasadność stosowania konkretnych narzędzi połowu.
Analiza efektywności rybackiej polega na porównaniu wyników analiz zarówno połowów jak
i intensywności eksploatacji rybackiej. Efektywność rybacka wyrażana jest w jednostkach (kg/jm).
Najprościej jest obliczyć wskaźnik efektywności eksploatacji poprzez podzielenie rocznego
połowu ryb przez stosowaną w danym roku intensywność eksploatacji.
Wyniki obliczenia wskaźnik ogólnej eksploatacji można porównać z danymi zamieszczonymi
w tabeli wnioskowania o zagęszczeniu poławianej populacji ryb:
Tabela 2. Schemat wnioskowania o zagęszczeniu poławianej populacji ryb
Ocena zagęszczenia populacji ryb
Wskaźnik ogólnej efektywności eksploatacji (kg/jm)
Intensywność
eksploatacji
(jm/ha)
<0,5 <0,5–0,8
0,8–1,2 1,2–1,5 >1,5
<20 wybitnie
małe
bardzo małe
małe
przeciętne duże
20–30 bardzo
małe małe przeciętne duże bardzo
duże
>30 małe
przeciętne duże bardzo
duże wybitnie
duże
Przy wnioskowaniu o zmianach zagęszczeń należy pamiętać, że przełowienie populacji ryb jest
ściśle skorelowane ze spadkiem wskaźnika efektywności rybackiej.
Analiza eksploatacji rybackiej powinna wskazywać na zmiany w obrębie gatunków:
−
bezwzględnie popieranych i cennych (niebezpieczeństwo przełowienia) np.: siej, sielawa
−
bezwzględnie ograniczane (niebezpieczeństwo niedołowienia – przegęszczenia)np. jazgarz, krąp.
−
gatunki częściowo popierane i ograniczane (niebezpieczeństwo niedołowienia –
przegęszczenia) np. duże osobniki szczupaka
−
gatunki warunkowo popierane i ograniczane (konieczność kontrolowania zagęszczenia
w zależności od potrzeb) np. szczupak, okoń.
W wyniku ukierunkowanej analizy eksploatacji rybackiej stosuje się odpowiednie działania
mające na celu wspieranie gatunków cennych poprzez: ograniczenie odłowów, wspieranie rozrodu
i zarybienia oraz zwiększenie presji rybackiej na gatunki niepożądane.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak eksploatacja rybacka może wpływać na populację ryb?
2.
Jakie elementy składają się na analizę eksploatacji rybackiej?
3.
Jak analizuje się wielkości połowów?
4.
Co to jest intensywność eksploatacji jak się ją oblicza i w jakich jednostkach?
5.
Co to jest efektywność eksploatacji jak się ją oblicza i w jakich jednostkach?
6.
Jakie zmiany w obrębie gatunków powinna wskazywać przeprowadzona analiza eksploatacji
rybackiej?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
4.3.3. Ćwiczenia
Ćwiczenie 1
Określ zagęszczenie poławianej populacji gatunku w jeziorach A i B na podstawie
wieloletnich zestawień opisujących wydajność połowów i intensywność eksploatacji. Oblicz
efektywność eksploatacji w poszczególnych latach i jeziorach. Oblicz wartości średnie:
wydajności połowów, intensywności połowów oraz efektywności eksploatacji. Te dwie wartości
przyrównaj do danych w tabeli pt.: Schemat wnioskowania o zagęszczeniu poławianej populacji
ryb. Oprócz określenia zagęszczenia dokonaj porównań eksploatacji rybackiej na tych dwóch
jeziorach. Jakie wnioski na przyszłość mogą wynikać z tych analiz.
Jezioro A
Rok gospodarczy
(lata)
Wydajność połowów
(kg/ha)
Intensywność eksploatacji
(jm/ha)
Efektywność eksploatacji
(kg/jm)
1980
1981
1982
1983
1984
1985
1986
1987
1988
1989
23,50
19,0
14,23
23,50
26,94
25,13
18,2
24,19
25,01
17,56
35,13
25,11
19,11
32,98
34,32
26,53
22,35
24,23
31,21
27,89
Średnia
Jezioro B
Rok gospodarczy
(lata)
Wydajność połowów
(kg/ha)
Intensywność eksploatacji
(jm/ha)
Efektywność eksploatacji
(kg/jm)
1980
1981
1982
1983
1984
1985
1986
1987
1988
1989
13,5
5,24
3,23
7,13
4,24
3,97
7,48
16,36
14,24
6,56
10,12
7,11
5,11
9,98
6,32
5,91
6,24
18,23
19,21
15,89
Średnia
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wyszukać w materiałach dydaktycznych informacji o sposobie obliczania wskaźnika
efektywności eksploatacji,
2)
wpisać obliczone wartości w odpowiednie miejsca w tabeli,
3)
obliczyć wartości średnie wydajności połowów, intensywność eksploatacji i efektywność
eksploatacji dodając wszystkie wartości z poszczególnych kolumn i dzieląc przez 10,
4)
wpisać wartości średnie do ostatniego wiersza w tabeli,
5)
wartości intensywność eksploatacji i efektywność przyrównać do danych w tabeli pt.:
„Schemat wnioskowania o zagęszczeniu poławianej populacji ryb” zamieszczonej
w materiałach nauczania,
6)
odczytać ocenę zagęszczenia eksploatowanej populacji,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
7)
krótko pisemnie określić charakterystykę intensywności eksploatacji jezior A i B wiedząc, że
średnia wartość tego parametru dla polskich jezior wynosi 25 jm/ha,
8)
krótko pisemnie określić charakterystykę efektywności eksploatacji jezior A i B wiedząc, że
średnia wartość tego parametru dla polskich jezior wynosi 1 kg/ha,
9)
krótko pisemnie określić zalecenia odnośnie przyszłej eksploatacji rybackiej na jeziorach A
i B.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
literatura wymieniana w części 6 poradnika.
4.3.4. Sprawdzian postępów
Tak
Nie
Czy potrafisz:
1)
przewidzieć jak eksploatacja rybacka może wpływać na populację
ryb?
2)
skompletować dane potrzebne do analizy rybackiej ?
3)
obliczyć wskaźnik intensywności eksploatacji?
4)
obliczyć wskaźnik efektywności eksploatacji?
5)
dokonać analizy eksploatacji rybackiej na podstawie znajomości
wartości wskaźników intensywności i efektywności eksploatacji?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
4.4. Rodzaje połowów
4.4.1. Materiał nauczania
Połowy ryb w poszczególnych zbiornikach, czy ich grupach można przeprowadzić poprzez
zastosowanie następujących sposobów:
−
połowy stałe polegające na systematycznej i równomiernej eksploatacji w trakcie całego roku
z zastosowaniem różnorodnego sprzętu połowowego w dostosowaniu do gatunków ryb
cennych gospodarczo,
−
połowy okresowe przeprowadzane wiosną, latem i w okresie jesienno-zimowym.
Połowy wiosenne rozpoczynają się w czasie wiosennych roztopów wraz z ustąpieniem
pokrywy lodowej ze zbiorników. Mogą trwać do połowy maja. Charakterystyczne dla połowów
wiosennych jest stosowanie przywłok w celu maksymalnego wykorzystania tarłowych skupisk
szczupaka i okonia oraz wiosennego ciągu węgorza. Ważniejszymi zadaniami połowów
wiosennych jest ograniczenie liczebności niepożądanych gatunków zwłaszcza drapieżników.
Z drugiej strony polowy wiosenne można wykorzystać do pozyskania tarlaków sztucznego tarła
np. szczupaka.
W trakcie połowów wiosennych ryby w tym okresie koncentrujące się przy brzegach
w trzcinach np. leszcz czy wzdręga odławia się obstawami i drygawicami. W okresie wiosennym
możliwy jest odłów płoci w trakcie koncentracji tarłowych.
Połowy letnie dokonywane są w pełni sezonu wegetacyjnego oraz w wodzie o najwyższej
w skali roku temperaturze. Okres połowów letnich w uzależnieniu od szybkości nagrzewania się
wody w zbiorniku zaczyna się od połowy – końca maja. W tym okresie nie powinno używać się
sprzętu ciągnionego. Stosowanie ciągnionych narzędzi połowu może niszczyć biocenozy dna
i powodować duże straty narybku i ikry ryb odbywających spóźnione tarło. Z tego powodu zaleca
się stosować narzędzia stawne. W okresie tym szczególnie intensywnie odławia się sielawę,
leszcza, szczupaka, karpia lina i węgorza.
Połowy jesienno-zimowe zaczynają się we wrześniu i trwają do chwili wiosennych roztopów
Realizuje się je przede wszystkim narzędziami ciągnionymi z równoczesnym użyciem obstaw,
słępów i drygawic. W zbiornikach występowania siei i sielawy w tym okresie odławia się tarlaki
w celu pozyskania materiału zarybieniowego. Wykonuje się odłowy ryb wypuszczanych później
do innych zbiorników (przerzuty), a także prowadzi intensywne odłowy gatunków niepożądanych
tzw. odłowy odchwaszczające.
Na początku tego okresu dobre efekty uzyskuje się poławiając mierożami wzdłuż stoku ławicy
przybrzeżnej. Dobre wyniki odłowu węgorza podczas jesiennego ciągu uzyskuje się przez
stosowanie kozaków i przestaw węgorzowych. W jeziorach typu leszczowego największe
znaczenie w tym okresie mają połowy pod lodem prowadzone głownie w toniach niewodowych
(leszcz). W okresie zimowy gdy jest to niezbędne trzeba stosować odłowy w czasie przyduchy ryb.
Odłowy te zaczyna się natychmiast po stwierdzeniu objawów przyduchy za pomocą sprzętu
stawnego. Nie wolno stosować sprzętu ciągnionego, który powoduje wzrost deficytów tlenowych
w zbiorniku.
Planowe wykorzystanie okresu połowowego w skali roku daje gwarancję racjonalnej
eksploatacji i rytmu produkcji.
Wytyczne do planowania odłowu ryb w okresie wiosennym i letnim w zbiorniku typu
leszczowego i linowo-szczupakowego w procentach odłowu w stosunku do planu rocznego,
przedstawia tabela:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Gatunek ryby
Typ leszczowy
Typ linowo-szczupakowy
sielawa
szczupak
sandacz
węgorz
leszcz
lin
karaś
okoń, jazgarz
płoć ukleja
inne
30
20
40
10
10
25
5
10
6
50–60
45
20
50
4
50
65
35
30
50
5
15
5
10
5
7
25
40
10
60
45
8
Udział masy towarowej w
stosunku do globalnego planu
rocznego
10 19 12 24
Specyficznym rodzajem odłowu są połowy ekspedycyjne stosowane w zbiornikach znacznie
oddalonych od siedziby użytkownika. Czas ich trwania ogranicza się do kilku dni w roku. W celu
uzyskania dobrych wyników odłowy powinny być prowadzone bardzo intensywnie
z równoczesnym użyciem sprzętu ciągnionego i stawnego.
Każdy połów powinien być ewidencjonowany poprzez sporządzenie protokołu połowów ryb
i raków. Wzór takiego protokołu z objaśnieniami przedstawiony jest poniżej rys. 2 (objaśnienia)
i 3 (wzór).
Protokół wypełnia osoba uprawnione do rybactwa najlepiej wykonująca dany odłów.
Rys. 2. Objaśnienia
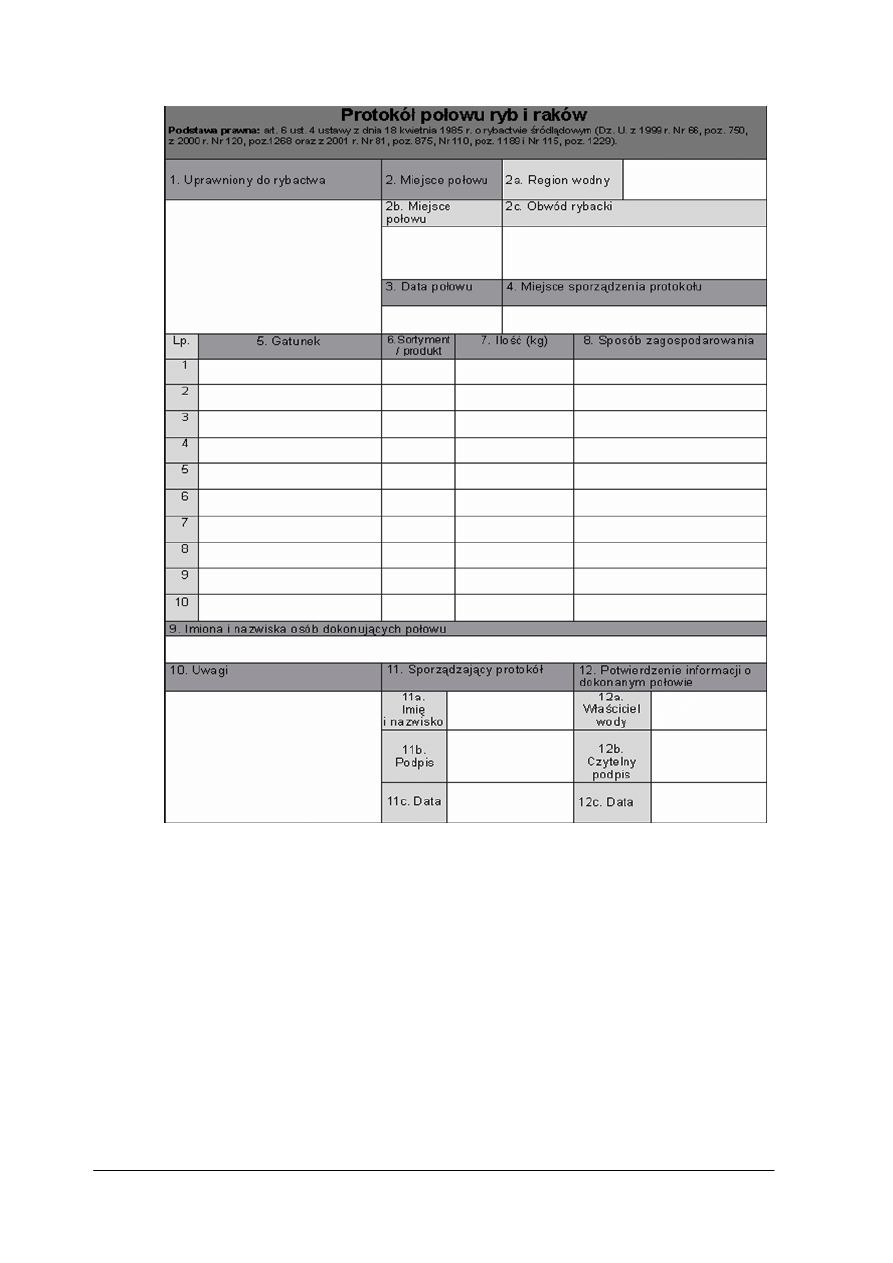
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Rys. 3. Wzór
Formę takiego protokołu warunkują wymogi art. 6 ustawy z dnia 18 kwietnia 1985 roku
o rybactwie śródlądowym oraz rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia
30 września 2003 roku w sprawie dokumentacji prowadzonej przez uprawnionego do rybactwa
(Dz. U. Nr 180, poz. 1766, z późniejszymi zmianami).
Protokół taki sporządzony dla celów optymalizacji eksploatacji rybackiej w sposób opisany
wyżej powinien być poszerzony o możliwość wpisu rodzaju narzędzia połowu i czasu
prowadzenia odłowu.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1.
Co to jest protokół połowu ryb i raków?
2.
Kto wypełnia protokół połowu ryb i raków?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
3.
Jakie dane trzeba posiadać aby wypełnić protokół połowu ryb i raków?
4.
Do czego służy protokół połowu ryb i raków?
4.4.3 Ćwiczenia
Ćwiczenie 1
Dokonano szacunkowej oceny połowu pochodzącego z narzędzi stawnych podniesionych
04.09.2007 roku w jeziorze Głębokim. Wyniki zanotowano i przedstawiają się one następująco:
Gatunek ryby
sielawa – 12 sztuk
szczupak – 23 kg
sandacz – 2 kg/1 sztuka
węgorz – 8,5 kg
leszcz – 45 kg
karaś- 30 sztuk
okoń, jazgarz 8kg (okoń ok. 30%)
płoć 4-5 kg
rak pręgowaty 85 sztuk
Łowiący:
Daniel Janiak
Jan Nowak
Tadeusz Kowalski
StanisławRybak
Wypełnij protokół połowu ryb i raków.
Dane dotyczące miejsca połowu otrzymasz od Nauczyciela. Wszystkie ryby z wyjątkiem
jazgarza i karasia zostały przeznaczone do sprzedaży. Zastanów się nad możliwością ich
wykorzystania.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeczytać objaśnienia do protokołu przedstawione na rysunku,
2)
wypełnić protokół połowu ryb i raków,
3)
zastanowić się na możliwościami wykorzystania – przeznaczenia ryb nie przeznaczonych do
konsumpcji zwłaszcza jazgarza,
4)
uważaj co zrobisz z rakiem pręgowatym (raków tych, jako przedstawicieli gatunku obcego, po
złowieniu w myśl rozporządzenia Ministra Rolnictwa i Rozwoju Wsi z dnia 12 listopada 2001 r.
w sprawie połowu ryb oraz warunków chowu, hodowli i połowu innych organizmów żyjących
w wodzie, nie wolno wpuścić z powrotem do zbiornika.
Wyposażenie stanowiska pracy:
−
formularze protokółu połowu ryb i raków,
−
literatura wymieniana w części 6 poradnika.
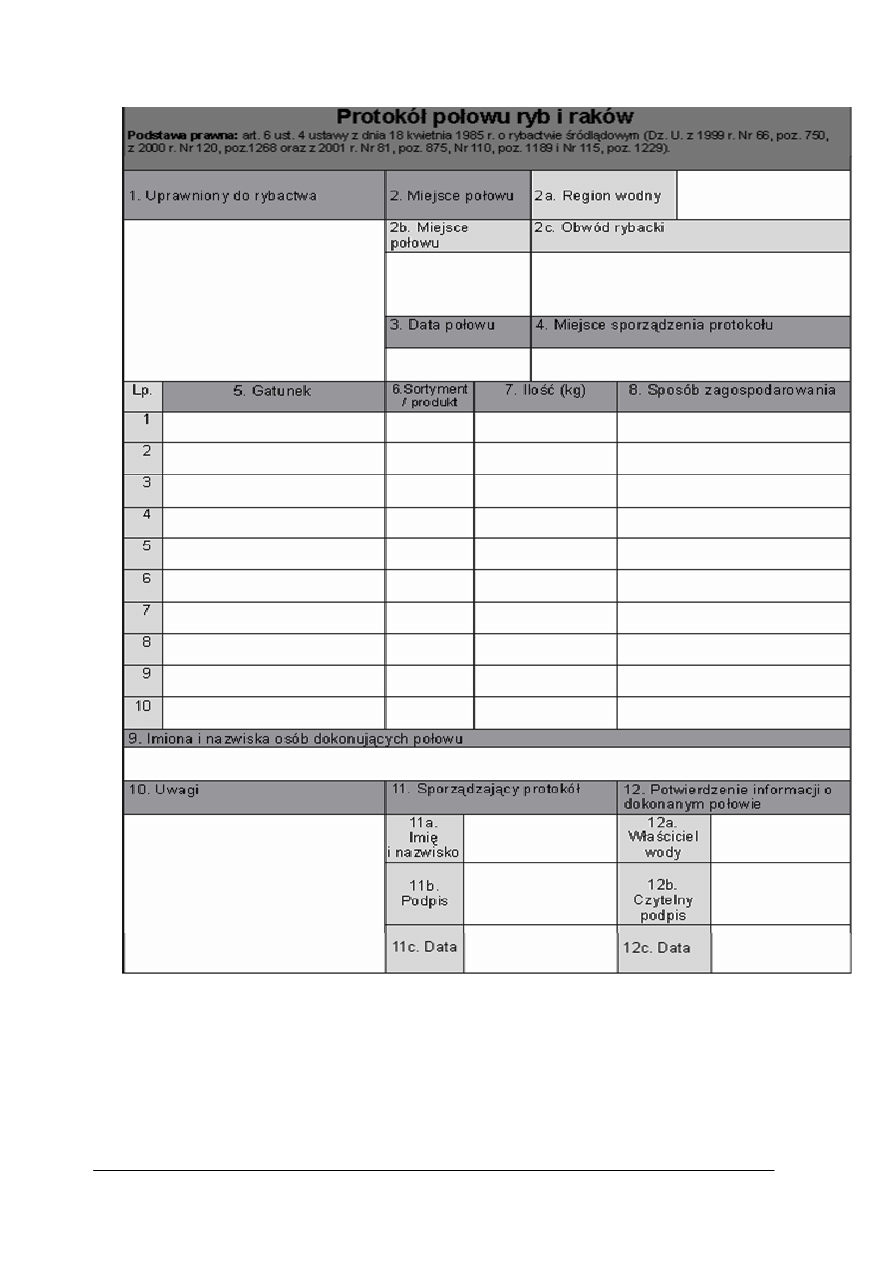
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Ćwiczenie 2
Zapoznaj się z podstawami użytkowymi programu typu Aquarius służącego do
komputerowego ewidencjonowanie odłowów i zarybień zaraczeń.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
uważnie słuchać i notować polecenia Nauczyciela,
2)
spróbować przeprowadzić pełen proces wpisywania swoich danych do bazy danych programu
ewidencjonowania odłowów np. Aquarius,
3)
wydrukować sporządzony protokół.
Wyposażenie stanowiska pracy:
−
komputer z zainstalowaną demonstracyjną wersją profesjonalnego programu
ewidencjonowania odłowów np. Aquarius oraz drukarka,
−
literatura wymieniana w części 6 poradnika.
4.4.4. Sprawdzian postępów
Tak
Nie
Czy potrafisz:
1)
określić trzy podstawowe okresy połowów i ich charakterystykę ?
2)
określić zarys planu odłowów?
3)
wypełnić protokół połowu ryb i raków?
4)
określić cel sporządzania protokołu połowu ryb i raków?
5)
określić okresy połowu określonych gatunków ryb?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
4.5. Zarybianie
4.5.1. Materiał nauczania
Jednym z zabiegów umożliwiającym eksploatację gatunków cennych na wysokim poziomie
czy nawet zachowanie ich populacji jest zarybianie. Zabieg ten polega na sztucznym
podwyższeniu przeżywalności ryb w początkowym okresie życia poprzez przetrzymywanie
w warunkach kontrolowanych. Uzyskaną w ten sposób duża liczebność materiału w postaci
narybku, rzadziej ikry wprowadza się do zbiornika przeznaczenia.
Poprzez zarybianie można również wpływać na zmianę proporcji ilościowych poszczególnych
gatunków ryb w zbiorniku i uzyskać efekt większej wydajności ogólnej poprzez pełniejsze
wykorzystanie nisz pokarmowych występujących w zbiorniku. Zwyżkę taka można osiągnąć
wspomagając równolegle rozród np.:
−
sandacza, leszcza, węgorza;
−
szczupaka, lina, płoci i węgorza,
−
sielawy, leszcza i węgorza,
−
sielawy, siei i węgorza,
−
raka, płoci, lina,
−
raka, leszcza, szczupaka,
−
karasia, lina, karpia.
Metody pozyskiwania tarlaków, inkubacji ikry i podchowu narybku różnych gatunków ryb
opisany jest w innej części tego poradnika. Jest to proces czasochłonny i wiąże się z ponoszeniem
kosztów. Z tych między innymi powodów istotną jest umiejętność określenia wielkości zarybień.
Jednym ze sposobów obliczania ilości potrzebnego materiału zarybieniowego jest wzór Arnolda
i Moszewicza, który ma postać:
W
Y
O
P
N
•
•
=
gdzie:
N – liczebność obsady (szt.)
P – przyrost wydajności (kg/ha)
O – powierzchnia zarybianego zbiornika
W – przewidywana masa jednostkowa ryby obsadowej (kg)
Y – gospodarczy współczynnik przeżycia (konieczna liczba ryb (narybku) wprowadzonych aby
odłowić jedną rybę konsumpcyjną)
Zasadą jest aby materiał zarybieniowy najlepiej genetycznie odpowiadał populacji pierwotnie
zasiedlającą zbiornik. Jeżeli nie ma możliwości zdobycia takiego materiału, wówczas powinno się
stosować materiał pochodzący ze zbiornika o najbardziej zbliżonych warunkach siedliskowych.
Zarybianie gatunkami obcymi rodzimej ichtiofaunie jest prawnie zabronione.
Materiał zarybieniowy przeznaczony do wypuszczenia musi posiadać świadectwo zdrowia
wydane przez Powiatowego Lekarza Weterynarii właściwego dla miejsca pochodzenia materiału.
Przeprowadzenie samego zabiegu zarybienia powinno przebiegać zgodnie z wymogami sztuki.
Oznacza to aby maksymalnie obniżyć prawdopodobieństwo śmierci narybku w momencie
wpuszczania do zbiornika lub tuż po. Narybek musi być odpowiednio zaadoptowany do warunków

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
termicznych panujących w zbiorniku wpuszczenia oraz wprowadzany w sposób stwarzający mu na
przykład, optymalny dostęp do pokarmu czy kryjówek.
Tak samo jak polowy, zarybienia powinny być ewidencjonowane poprzez sporządzenie
protokołu zarybień. Formę takiego protokołu wraz z objaśnieniami przedstawia rysunek 4.
Rys. 4. Protokół zarybień

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
4.5.2. Pytania sprawdzające
Odpowiadając na pytania sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jaki jest cel zarybień
2.
Jakie gatunki ryb można równolegle wspierać poprzez zarybianie?
3.
Jak oblicza się ilość potrzebnego materiału zarybieniowego?
4.
Co to jest protokół zarybień?
5.
Jakimi danymi trzeba dysponować aby wypełnić protokół zarybień i zaraczeń?
4.5.3 Ćwiczenia
Ćwiczenie 1
Oblicz ilości materiału zarybieniowego potrzebnego do wspomożenia rozrodu ryb w jeziorze
Głębokie, typu sielawowego, o powierzchni 100 ha, zakładając przyrost wydajności rybackiej
jeziora o 2 kg z hektara dla wszystkich pożądanych gatunków ryb. Wylęgarnia w Górsku oferuje
następujący materiał:
Gatunek Masa
jednostkowa
Współczynnik
przeżycia
Sieja
Sielawa
Szczupak
Sandacz
Karp
0,2 g
0,1g
3 g
1,5 g
1 g
150
200
20
50
20
* Wylęgarnia sprzedaje materiał razem ze świadectwem zdrowia wydanym przez Powiatowego Lekarza Weterynarii
w Bytowie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
znaleźć w materiałach dydaktycznych informacje na temat gatunków których rozród może być
równolegle wspierany,
2)
dokonać decyzji którymi gatunki ryb powinno się zarybić dane jezioro,
3)
obliczyć wymaganą ilość materiału zarybieniowego stosując odpowiedni wzór zamieszczony
w materiałach nauczania,
4)
napisać zapytanie o dostępność wyliczonej ilości materiału w dowolnej wylęgarni.
Wyposażenie stanowiska pracy:
−
kalkulator,
−
literatura wymieniana w części 6 poradnika.
Ćwiczenie 2
Zakładając że zakupiono cały potrzebny materiał zarybieniowy i wpuszczono go do jeziora
Głębokiego, sporządź protokół zarybienia.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
znaleźć w materiałach dydaktycznych objaśnienia do protokołu zarybień.
2)
wypełnić formularz protokołu zarybień

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
Wyposażenie stanowiska pracy:
−
formularze protokółu zarybień,
−
literatura wymieniana w części 6 poradnika.
4.5.4. Sprawdzian postępów
Tak
Nie
Czy potrafisz:
1)
określić gatunki ryb można równolegle wspierać poprzez zarybianie?
2)
obliczyć ilość potrzebnego materiału zarybieniowego?
3)
wypełnić protokół zarybień?
4)
określić cel sporządzania protokołu zarybień?
5)
określić niezbędne wymagania przeprowadzenia zarybień?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
4.6. Ochrona ryb i raków
4.6.1. Materiał nauczania
Ochrona ryb i raków jak wskazuje praktyka powinna być zbieżna z zasadami racjonalnej
gospodarki. Ochrona bowiem oparta na samych nakazach i zakazach ujętych w aktach prawnych
nie jest w pełni skutecznym sposobem na ratowanie gatunków zagrożonych wyginięciem.
W Polsce na mocy rozporządzenia Ministra Ochrony Środowiska, Zasobów Naturalnych
i Leśnictwa z dnia 6 stycznia 1995 r. w sprawie ochrony gatunkowej zwierząt na podstawie art. 27
ust. 3 ustawy z dnia 16 października 1991 r. o ochronie przyrody (Dz. U. Nr 114, poz. 492, z 1992 r.
Nr 54, poz. 254 i z 1994 r. Nr 89, poz. 415) za gatunki podlegające całkowitej ochronie uznano
następujące ryby:
jesiotr zachodni (Acipenser sturio),
parposz (Alosa fallax),
alosa (Alosa alosa),
łosoś (Salmo salar) – poza obszarem Morza Bałtyckiego, wód przymorskich, ujść rzecznych do
Morza Bałtyckiego oraz rzek: Drwęcy, Drawy i Wisły od Włocławka do ujścia,
strzeble (Phoxinus) – 2 gatunki,
kiełb Kesslera (Gobio kessleri),
kiełb białopłetwy (Gobio albipinnatus),
piekielnica (Alburnoides bipunctatus),
ciosa (Pelecus cultratus) – poza obszarem wód Zalewu Wiślanego,
różanka (Rhodeus sericeus),
śliz (Nemachilus barbatulus),
koza (Cobitis taenia),
koza złotawa (Cobitis aurata),
piskorz (Misgurnus fossilis),
pocierniec (Spinachia spinachia),
iglicznia (Syngnathus typhle),
babka mała (Pomatoschistus minutus),
babka piaskowa (Pomatoschistus microps),
kur rogacz (Myoxocephalus quadricornis),
głowacz pręgopłetwy (Cottus poecilopus),
dennik (Liparis liparis)
Całkowita ochrona gatunkowa oznacza całkowity zakaz ich połowu a także posiadania
martwych osobników lub ich jakichkolwiek fragmentów. Połów możliwy jest jedynie w przypadku
posiadania specjalnej zgody wydanej przez Ministra Środowiska.
Gatunki raków; rak szlachetny oraz rak błotny są obiektami częściowej ochrony. Oznacza że
odłów ich możliwy jest bez pozwolenia jedynie ze zbiorników będących obiektami hodowlanymi.
No odłów z pozostałych zbiorników wymagana jest zgoda właściwego dla tego zbiornika organu
władzy terenowej. Zgodę takiej udziela zwykle Wojewódzki Konserwator Przyrody
z upoważnienia Wojewody.
Jako formę ochrony należy uznać ograniczenia prawne w hodowli gatunków obcych,
introdukowanych czy aklimatyzowanych.
Przykładowo takimi gatunkami są raki amerykański i sygnałowy. Raków tych po złowieniu
w myśl rozporządzenia Ministra Rolnictwa i Rozwoju Wsi z dnia 12 listopada 2001 r. w sprawie
połowu ryb oraz warunków chowu, hodowli i połowu innych organizmów żyjących w wodzie, nie
wolno wpuścić z powrotem do zbiornika. Tak samo chów lub hodowla innych niż ryby i raki
organizmów żyjących w wodzie z gatunków obcych rodzimej florze i faunie prowadzić wolno
w budynkach, w których:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
1.
woda po wprowadzeniu do urządzeń służących do chowu lub hodowli tych organizmów
wodnych znajduje się w obiegu zamkniętym,
2.
urządzenia doprowadzające i odprowadzające wodę oraz urządzenia służące do chowu lub
hodowli uniemożliwiają wydostanie się tych organizmów wodnych i ich form rozwojowych do
innych wód,
3.
woda odprowadzana z urządzeń, o których mowa w pkt 1, poddawana jest ciągłej ekspozycji
promieniowania ultrafioletowego, nie mniejszego niż 30 000 mWs/cm
2
.
4.
Drogi prowadzące do budynków, o których mowa w ust. 1, powinny być wyposażone w śluzy
dezynfekcyjne.
Wymiar i okres ochronny
Działaniem ochronnym w stosunku do organizmów, których liczebność populacji może być
niebezpiecznie obniżona poprzez eksploatację, jest wprowadzanie narzędzi prawnych mających na
celu takową eksploatację ograniczyć. Do tych narzędzi należy: wymiar i okres ochronny.
Wymiar ochronny – określona przepisami długość złowionego organizmu, poniżej której musi
być ona z powrotem wypuszczona do wody. Długość ryby mierzona jest od początku pyska do
końca najdłuższego promienia płetwy ogonowej. Za rybę niewymiarową uważa się osobnika
mającego długość mniejszą niż obowiązujący dla gatunku wymiar ochronny.
W przypadku raków długość osobników mierzy się od czubka rostrum (dzioba) do tylnej krawędzi
telsonu.
Okres ochronny – ustalony przepisami okres, podczas którego nie łowić danego gatunku
organizmu wodnego. Osobniki w tym okresie złowione przypadkowo powinny być natychmiast
wypuszczane do wody. Prawdopodobieństwo przypadkowego łowienia gatunków w okresie
ochronnym powinno być minimalizowane poprzez odpowiednio dobrany sprzęt połowowy,
metodę połowu czy unikanie łowienia w miejscach koncentracji gatunków znajdujących się
w okresie ochronnym.
Zwykle okresy ochronne obejmują okres rozmnażania się danego gatunku. Każdy gatunek ma
odpowiednio ustalony okres ochronny.
Wymiary i okresy ochronne wyznaczone rozporządzeniem Ministra Rolnictwa i Rozwoju Wsi
z dnia 12 listopada 2001 r. w sprawie połowu ryb oraz warunków chowu, hodowli i połowu innych
organizmów żyjących w wodzie prezentuje poniższa tabela:
Gatunek
Wymiar
ochronny
Okres ochronny
Wody
Boleń
40 cm
Brak
Całego kraju
Brzana karpacka
20 cm
15.03.–15.07
Całego kraju
Brzana
40 cm
01.01.–30.06
Całego kraju
Brzanka
20 cm
Brak
Całego kraju
Certa 30
cm
01.01.–30.11
Całego
kraju
Głowacica
70 cm
01.03.–31.05
Całego kraju
Jaź
25 cm
Brak
Całego kraju
Jelec
15 cm
Brak
Całego kraju
Karp
30 cm
Brak
PZW
Kleń
25 cm
Brak
Całego kraju
Leszcz
40 cm
Brak
PZW
Lin
25 cm
Brak
Całego kraju
Lipień
30 cm
01.03.–31.05
Całego kraju
Łosoś atlantycki
35 cm
01.10.–31.12
Całego kraju
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
Miętus
30 cm
01.12.–29.02
Całego kraju
Okoń
17 cm
Brak
PZW
Płoć
20 cm
Brak
PZW
Pstrąg potokowy
30 cm
01.09.–31.12
Całego kraju
Pstrąg tęczowy
40 cm
Brak
Urzędu morskiego
Rozpiór, Siniec
25 cm
Brak
Całego kraju
Sandacz
45 cm
01.10.–31.05.
Całego kraju
Sapa, Klepiec
25 cm
01.04.–31.05.
Całego kraju
Sieja pospolita
35 cm
15.10.–31.12.
Całego kraju
Sielawa
18 cm
15.10.–31.12.
Całego kraju
Sum
70 cm
01.11.–30.06
Całego kraju
Szczupak
45 cm
01.01.–30.04
Całego kraju
Świnka
25 cm
01.01.–15.05
Całego kraju
Troć jeziorowa
50 cm
Brak
Całego kraju
Troć wędrowna
35 cm
01.09.–31.01.
Całego kraju
Węgorz europejski
40 cm
Brak
Całego kraju
Wzdręga
15 cm
Brak
Całego kraju
Rak błotny
10 cm
15.10.–15.03 samce
15.10.–31.07 samice
Całego kraju
Rak szlachetny
10 cm samce
12 cm samice
15.10.–15.03 samce
15.10.–31.07 samice
Całego kraju
Poprzez regulacje wymiarem ochronnym rybacki użytkownik wód może wpływać na
skuteczniejszą rekrutację w obrębie danych gatunków zwiększając w ten sposób zarówno szansę
przystąpienia do rozrodu większej liczbie osobników. Wymiar ochronny o wysokiej wartości ma
także zapewnić szansę wielokrotnego przystąpienia do rozrodu chronionej w ten sposób ryby.
Dlatego na części zbiorników w naszym kraju użytkownicy rybaccy wprowadzają ustalone
przez siebie wymiary ochronne i limity połowowe. Obowiązujące są one przede wszystkim dla
wędkarzy. W tabeli wyżej podano również (w niektórych wypadkach) wymiary ochronne ustalone
przez Polski Związek Wędkarski i obowiązujące wędkarzy łowiących ryby na wodach rybacko
użytkowanych przez PZW.
Wędkarstwo jest formą rekreacji której główną atrakcją jest połów ryb przy użyciu wędki.
Z tego powodu podstawowym walorem wędkarstwa powinien być bezpośredni kontakt z przyrodą
oraz satysfakcja płynąca z faktu stawania się coraz to bardziej efektywnym łowcą.
Pozyskanie ryb w celach kulinarnych powinno mieć tu drugorzędne znaczenie.
Praktyka dominująca w naszym kraju wskazuje jednak, że przeważająca większość połowu
wędkarskich zabierana jest przez wędkarzy. W świetle tego wędkarstwo należy traktować jako
ważny udział w całkowitej eksploatacji zasobów ryb w zbiorniku.
Zasadniczo presja wędkarska jest zależna od zasobności zbiornika. Im większe połowy wędkarskie
tym większa liczba wędkarzy częściej prowadzących połowy. Dlatego stosunkowo szybko
wydajność takich łowisk spada jeśli nie zastosuje się odpowiednich mechanizmów
ograniczających presję. Praktyka wskazuje, że najskuteczniejszymi są mechanizmy finansowe
uzależniające wielkość połowu zabranego przez wędkarza z rosnącymi konsekwencjami
ekonomicznymi dla wędkarza. Dodatkowo wędkarstwo jest stosunkowo selektywny sposobem
eksploatacji ryb w zbiorniku ukierunkowanym na odłowienia największych osobników.
Najszybciej wynik przełowienia wędkarskiego da się zaobserwować po spadku liczby
drapieżników zwłaszcza szczupaka. Dlatego w przypadku limitów wędkarskiego połowu dla ryb
drapieżnych ustala się w sztukach łowionych na dobę i to uwzględniając wszystkie gatunki
drapieżników. Najbardziej restrykcyjnym limitem wędkarskim jest obarczony połów głowacicy
(1 sztuka na tydzień).
Potencjalnie duża presja wędkarstwa wskazuje na konieczność kontrolowania tej presji na
bieżąco. Podstawowym sposobem jej kontrolowania jest wprowadzenie licencji na odłów ryb
uwzględniających sposób i czas połowu. Wskazanym jest również powiązanie prawa do połowów
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
wędkarskich z obowiązkiem prowadzenia prostej ewidencji połowów przez wędkarzy. Ich
późniejsza analiza powinna uwzględniać jednak ich zwykle niewielką reprezentatywność. Stąd
najskuteczniejszym sposobem oceny stopnia presji wędkarskiej jest systematyczna kontrola łowisk
i prowadzenie własnej ewidencji.
4.6.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie są rodzaje ochrony gatunkowej?
2.
Jakie gatunki ryb są objęte całkowitą ochrona gatunkową (wymienić 5)?
3.
Jakie gatunki raków są objęte częściową ochrona gatunkową?
4.
Które gatunki raków nie są objęte ochroną i dlaczego?
5.
Jak planować eksploatację aby nie wejść w konflikt z Prawem o Ochronie przyrody?
6.
Jakie akty prawne mówiąc o ochronie ryb i raków?
4.6.3. Ćwiczenia
Ćwiczenie 1
Zdecyduj co należy zrobić z organizmami które złowiono:
1) narzędziami stawnymi w jeziorze dnia 02.12.2006 roku.
Gatunek ryby
Decyzja (zabrać/wypuścić)
sielawa – 8 sztuk
szczupak – 2 kg/15sztuk
sandacz – 4 kg/4 sztuki
węgorz – 8,5 kg/6sztuk
leszcz – 45 kg
karaś- 30 sztuk
okoń, 8kg
płoć 5 kg
miętus 1 sztuka
rak pręgowaty 35 sztuk
2) narzędziami stawnymi w rzece dnia 15.09.2006 roku
Gatunek ryby
Decyzja (zabrać/wypuścić)
Pstrąg potokowy – 2,5 kg 8 sztuk
Troć wędrowna – 12kg/5 sztuk
sandacz – 4 kg/4 sztuki
węgorz – 8,5 kg/6sztuk
leszcz –5 kg
okoń, 1kg
płoć 2 kg
miętus 1 sztuka
rak szlachetny 5 sztuk (samce)
3) zdecyduj czy wędkarz, którego skontrolowano dnia 10.04.2007 złamał prawo, jeżeli w jego
sadzu stwierdzono połów składający się z:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
Gatunek ryby
Decyzja czy naruszył prawo (tak/nie)
Okoń 3 sztuki (20, 22,23 cm)
Jazgarz 10 sztuk (jeden osobnik poniżej 10 cm)
Leszcz 2 sztuki (30, 35 cm)
płoć 2 sztuki (20, 21 cm)
rak błotny 1 sztuka 18 cm (samiec)
Ocena końcowa
Złamał prawo/ Nie złamał prawa
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zapoznać się z wymiarami i okresami ochronnymi poszczególnych gatunków ryb i raków,
2)
zapoznać się z limitami ilościowymi poszczególnych gatunków ryb i raków,
3)
wpisać decyzję w poszczególnych wierszach kolumny 2
4)
porównać tabele z tabelami kolegów.
Wyposażenie stanowiska pracy:
−
literatura wymieniana w części 6 poradnika.
4.6.4. Sprawdzian postępów
Tak
Nie
Czy potrafisz:
1)
wymienić gatunki chronionych ryb (5)?
2)
wymienić gatunki częściowo chronionych raków?
3)
podać wymiary ochronne podstawowych gatunków ryb?
4)
podać wymiary ochronne dla gatunków raków?
5)
określić pojecie okresu ochronnego?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
5.
SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Test pisemny zawiera 20 zadań i sprawdza Twoje wiadomości z zakresu prowadzenia
wychowu innych organizmów wodnych.
5.
Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi. Wskaż tylko jedną odpowiedź
prawidłową. W przypadku pomyłki należy błędną odpowiedź skreślić i zaznaczyć kółkiem
odpowiedź prawidłową.
6.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7.
Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie na
później i wróć do niego, gdy zostanie Ci wolny czas.
8.
Na rozwiązanie testu pisemnego masz 45 minut.
Powodzenia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
ZESTAW ZADAŃ TESTOWYCH
1.
Który zestaw gatunków złożony jest z samych ryb spokojnego żeru
a)
karp, ukleja, leszcz.
b)
płoć, wzdręga, szczupak.
c)
karp, płoć, węgorz.
d)
łosoś, sum, lin.
2.
Jaka ryba jest typowym drapieżnikiem
a)
wzdręga.
b)
płoć.
c)
sielawa.
d)
troć wędrowna.
3.
Ile gatunków raków stwierdzono w polskich wodach
a)
2.
b)
3.
c)
4.
d)
7.
4.
Jaki to gatunek raka, który posiada, gładki głowotułów z małym kolcem przy bruździe
karkowej, szczypce czerwone na spodniej stronie
a)
rak sygnałowy.
b)
rak szlachetny.
c)
rak błotny.
d)
rak pręgowaty.
5.
Jaki to gatunek raka, który posiada, gładki głowotułów z kolcami na policzku, na odwłoku
wzór z brunatnych plam
a)
rak sygnałowy.
b)
rak szlachetny.
c)
rak błotny.
d)
rak pręgowaty.
6.
Co określa termin pojemność ekologiczna środowiska w badaniach populacyjnych
a)
maksymalną liczbę organizmów, która może trwale przeżyć w danym środowisku.
b)
podatność zbiornika na zanieczyszczenia.
c)
poziom czystości wód w jeziorze.
d)
minimalną liczebność populacji ryb gwarantującą przeżycie gatunku w zbiorniku.
7.
Jeżeli populacja osiągnie liczebność graniczną to jej tempo wzrostu jest
a)
najmniejsze z możliwych.
b)
największe z możliwych.
c)
całkowicie zahamowane.
d)
całkowicie niezależne od liczebności.
8.
Co to jest rybacka wydajność połowowa
a)
średnia masa ryb łowiona z 1 hektara powierzchni zbiornika w ciągu roku.
b)
całkowita masa ryb złowiona w czasie ostatnich 10 lat.
c)
całkowita liczebność ryb złowiona w czasie ostatnich 10 lat.
d)
średnia mas ryb złowiona w ciągu jednego roku.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
9.
Jaki rodzaj narzędzi połowu nie jest zalecany podczas połowów latem i dlaczego
a)
stawny, bo szybko zarasta glonami.
b)
ciągniony, bo ryby szybko uciekają i są niełowne.
c)
stawny, bo łatwo jest tracony w skutek kradzieży.
d)
ciągniony, bo niszczy biocenozę dna zbiornika.
10.
Sielawę łowi się w grudniu, ponieważ
a)
ma najwyższą jakość mięsa.
b)
najłatwiej ją złowić.
c)
pozyskuje się tarlaki.
d)
stanowi istotny obiekt połowów odchwaszczających.
11.
Protokół połowu ryb i raków służy
a)
zabezpieczeniu ryb przed kradzieżą.
b)
udokumentowaniu stwierdzonej kradzieży ryb i raków.
c)
ewidencjonowaniu połowów.
d)
sprawozdaniu kolejności przebiegu prac połowowych.
12.
Odłowy redukujące okonia, najlepiej zaplanować
a)
jesienią podczas tarła gatunku.
b)
wczesną wiosną podczas koncentracji tarłowych.
c)
zimą podczas zimowania gatunku.
d)
latem podczas koncentracji żerowiskowych.
13.
Jakimi gatunkami można zarybiać (zaraczać) równolegle
a)
szczupak i sandacz.
b)
leszcz i krąp.
c)
sieja i sielawa.
d)
węgorz i rak szlachetny.
14.
Ilość potrzebnego materiału zarybieniowego najbardziej zależy od
a)
temperatury wody w zbiorniku.
b)
wielkości spodziewanego wzrostu wydajności rybackiej.
c)
spadku spodziewanej wydajności rybackiej gatunków obojętnych.
d)
długości sezonu wegetacyjnego.
15.
Zdrowotność narybku użytego do zarybień musi potwierdzić wydając stosowne świadectwo
a)
właściciel wylęgarni.
b)
dowolny lekarz weterynarii.
c)
Powiatowy Lekarz Weterynarii.
d)
specjalista ichtiolog.
16.
Protokół zarybień i zaraczeń służy
a)
zabezpieczeniu narybku przed kradzieżą w czasie transportu.
b)
do udokumentowania stwierdzonej kradzieży narybku i raczków w czasie transportu.
c)
do ewidencjonowania zarybień i zaraczeń.
d)
do ograniczania populacji gatunków mało wartościowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
17.
Jaki gatunek ryby objęty jest całkowitą ochroną?
a)
pstrąg tęczowy.
b)
stynka.
c)
jesiotr zachodni.
d)
kiełb.
18.
Jakie pary gatunków raków składają się wyłącznie z gatunków częściowo chronionych?
a)
szlachetny i pręgowaty.
b)
szlachetny i błotny.
c)
błotny i sygnałowy.
d)
sygnałowy i szlachetny.
19.
Co zrobić z rakiem pręgowatym o długości 10 cm, złowionym przed 15 marca
a)
koniecznie natychmiast wypuścić do wody.
b)
można, ale nie trzeba wpuścić z powrotem do wody.
c)
nie wolno wpuszczać z powrotem do wody.
d)
sprawdzić płeć, samicę wypuścić.
20.
Co to jest wymiar ochronny
a)
minimalna długość ryby lub raka zapewniająca przeżycie w zbiorniku.
b)
długość ryby lub raka, poniżej, której organizm powinien być traktowany jak gatunek
chroniony.
c)
długość maksymalna osiągana przez ryby lub raka w danym zbiorniku.
d)
długość po osiągnięciu, której ryba lub rak odstrasza wszystkie drapieżniki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
KARTA ODPOWIEDZI
Imię i nazwisko ...........................................................................................................................
Gospodarowanie zasobami ryb i raków
Zakreśl poprawną odpowiedź.
Nr
zadania
Warianty odpowiedzi
Punkty
1 a b c d
2 a b c d
3 a b c d
4 a b c d
5 a b c d
6 a b c d
7 a b c d
8 a b c d
9 a b c d
10 a b c d
11 a b c d
12 a b c d
13 a b c d
14 a b c d
15 a b c d
16 a b c d
17 a b c d
18 a b c d
19 a b c d
20 a b c d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
6.
LITERATURA
1.
Brylińska M.: Ryby słodkowodne Polski. Wyd. PWN, Warszawa 2000
2.
Gondko K.: Raki. Praca zbiorowa. PWN, Warszawa 1992
3.
Gajewski Z., Terlecki W.: Raki. PWRiL, Warszawa 1956
4.
Guziur J.: Rybactwo w małych zbiornikach śródlądowych. PWRiL, Warszawa 1991
5.
Jańczak J. (red.): Atlas jezior Polski. Tom I, II, III. IMiGW, Bogucki Wydawnictwo
Naukowe, 1997
6.
Kossakowski J.: Raki. PWRiL, Warszawa 1966
7.
Filipiak J., Trzebiatowski R., Sadowski J.: Rybactwo. Przewodnik do ćwiczeń Wydawnictwo
Akademii Rolniczej w Szczecinie 1996
8.
Holdich D.M.(red): Biology of Freshwater Crayfish, Blackwell Science Home Page. 2002
9.
Krebs Ch. Ekologia. PWN, Warszawa 1987
10.
Krzywosz T.: Chów raka sygnałowego. Wydawnictwo Instytutu Rybactwa Śródlądowego,
Olsztyn 1995
11.
Mamcarz A.: Ćwiczenia z rybactwa jeziorowego i rzecznego. Skrypt ART, Olsztyn 1994
12.
Mastyński J.: Gospodarka rybacka i możliwości produkcyjne wybranych zbiorników
zaporowych Polski. Roczniki AR Poznań, Nr 146. 1985
13.
Mastyński J., Andrzejewski W.: Cechy morfometryczne i rozpoznawanie
raków
występujących w Polsce. Wydawnictwo Akademii Rolniczej w Poznaniu. 2001
14.
Opuszyński K.: Podstawy biologii ryb. PWRiL,Warszawa 1981
15.
Pöckl M., Holdich D.M., Pennerstorfer J.: Identifying native and alien crayfish species in
Europe. Product of European Project Craynet 2006
16.
Szczerbowski J.A.: Rybactwo jeziorowe i rzeczne. PWRiL, Warszawa 1985
17.
Szczerbowski J.A.: Rybactwo Śródlądowe. Wydawnictwo IRS, Olsztyn 1993
18.
Pierożyński J.: Rak. PWRiL 1951
19.
Rudnicki A. (red.): Poradnik rybaka jeziorowego. PWRiL, Warszawa 1957
20.
Rudnicki A.,Waluta J., Waluś T.: Rybactwo jeziorowe. PWRiL, Warszawa 1971
21.
Strużyński W., Śmietana P.: Ochrona rodzimych raków wobec zagrożeń związanych
z rozprzestrzenianiem się obcych gatunków. Przegląd Rybacki 6:1998
22.
Śmietana P.: Nasze raki. Przegląd Rybacki 2, 1999
23.
Strużynski W., Śmietana P.: On the distribution of Crayfish in Poland. Freshwater Crayfish,
12, 1999
24.
Załachowski W.: Szczupak. PWRiL. Warszawa. 1973
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 12 listopada 2001 r. w sprawie połowu
ryb oraz warunków chowu, hodowli i połowu innych organizmów żyjących w wodzie.
Ustawa z dnia 18 lipca 2001 r., Prawo wodne. (Dz. U. Nr 115, poz. 1229 z późniejszymi
zmianami)
Ustawa z dnia 18 kwietnia 1985 roku o rybactwie śródlądowym. (Dz. U. 1985, nr 21, poz. 91)
Ustawa z dnia 21 grudnia 2000 roku o żegludze śródlądowej (Dz. U. 2001, nr 5, poz. 43)
Czasopisma:
–
Komunikaty Rybackie,
–
Przegląd Rybacki.
Wyszukiwarka
Podobne podstrony:
GOSPODAROWANIE ZASOBAMI NATURALNYMI ZIEMI I
gospodarowanie zasobami ludzkimi, UCZELNIA, Gospodarowanie kapitałem ludzkim
agrobiznes gospodarka zasobami (28 stron) icw6ah4fbw2wb7ma7to6ql5t7mgmxrzvsqxwqxa ICW6AH4FBW2WB7MA
gospodarka zasobami
Omówienie prezentacji RZGW Warszawa, Geologia GZMiW UAM 2010-2013, III rok, Gospodarowanie zasobami
GZL - gospodarowanie zasobami ludzkimi, etyka(3)
GOSPODAROWANIE ZASOBAMI NATURALNYMI ZIEMI III
Kadry i gospodarka zasobami ludzkimi, Zarządzanie zasobami ludzkimi
Gospodarowanie zasobami ludzkimi jest funkcją kierowniczą, Studia, STUDIA PRACE ŚCIĄGI SKRYPTY
15 Gospodarowanie zasobami pracy, Ekonomika
GOSPODAROWANIE ZASOBAMI NATURALNYMI ZIEMI IV
GOSPODAROWANIE ZASOBAMI NATURALNYMI ZIEMI II
EKONOMIKA GOSPODAROWANIA ZASOBAMI PRACY (1)
GOSPODAROWANIE ZASOBAMI NATURALNYMI ZIEMI V
GOSPODAROWANIE ZASOBAMI NATURALNYMI ZIEMI I
14 Gospodarowanie zasobami finansowymi
Gospodarowanie zasobami ludzkimi systemy płac
Metoda określania syntetycznego wskaźnika efektów gospodarowania zasobami przyrodniczymi, ludzkimi i
więcej podobnych podstron