
1 |
S t r o n a
Lidia Chomicz i Marcin Woźniak, gr.1
Uniwersytet Gdański
Pracownia Chemii Fizycznej
Ćwiczenie 2
Polaryzowalność cząsteczki. Moment dipolowy.
Prowadząca zajęcia:
dr Agnieszka
Wróblewska
Data wykonania:
Ocena:
30.11.2006 r.
1) Wyznaczenie pojemności czynnej i biernej kondensatora.
Zmierzyliśmy pojemność pustego kondensatora i kondensatora wypełnionego rozpuszczalnikiem:
C
0
=44 pF - pojemność pustego kondensatora
C=75 pF - pojemność kondensatora wypełnionego cykloheksanem
Znając dodatkowo względną stałą dielektryczną cykloheksanu (ε
r
=2,023), wyznaczyliśmy
pojemność czynną (C
c
) oraz bierną (C
b
) kondensatora:
]
[
3
,
30
1
0
pF
C
C
C
r
c
]
[
7
,
13
0
pF
C
C
C
c
b
2) Wyznaczenie stałych dielektrycznych poszczególnych roztworów nitrobenzenu w
cykloheksanie.
Zmierzyliśmy pojemność elektryczną kondensatora po napełnieniu go badanymi roztworami.
(Dane dotyczące tych roztworów i pojemności C
x
zamieściliśmy w tabeli 1.)
Na podstawie tych danych obliczyliśmy stałe dielektryczne (ε
x
) badanych roztworów w oparciu o
poniższy wzór:
1
c
x
x
C
C
C
Otrzymane wyniki opisuje tabela 1.
3) Obliczenia dotyczące polaryzacji właściwej.
Aby wyznaczyć polaryzację właściwą poszczególnych roztworów, obliczyliśmy kolejno (wszystkie
wyniki obliczeń – tabela 1):
a) Ułamki molowe nitrobenzenu i cykloheksanu, korzystając ze wzoru (np. dla nitrobenzenu):
c
n
n
n
n
n
n
X
, gdzie:
X
n
– ułamek molowy nitrobenzenu
n
n
– liczba moli nitrobenzenu w badanym roztworze
n
c
– liczba moli cykloheksanu w badanym roztworze
2 |
S t r o n a
b) Gęstość poszczególnych roztworów – w oparciu o zasadę addytywności gęstości:
c
c
n
n
X
d
X
d
d
, gdzie:
d – gęstość roztworu
d
n
=1203,3 [kg/m
3
] – gęstość nitrobenzenu
d
c
=778,6 [kg/m
3
] – gęstość cykloheksanu
c) Wtedy polaryzację właściwą p – ze wzoru:
kg
m
d
p
x
x
3
1
2
1
4) Wyznaczenie całkowitej polaryzacji molowej P.
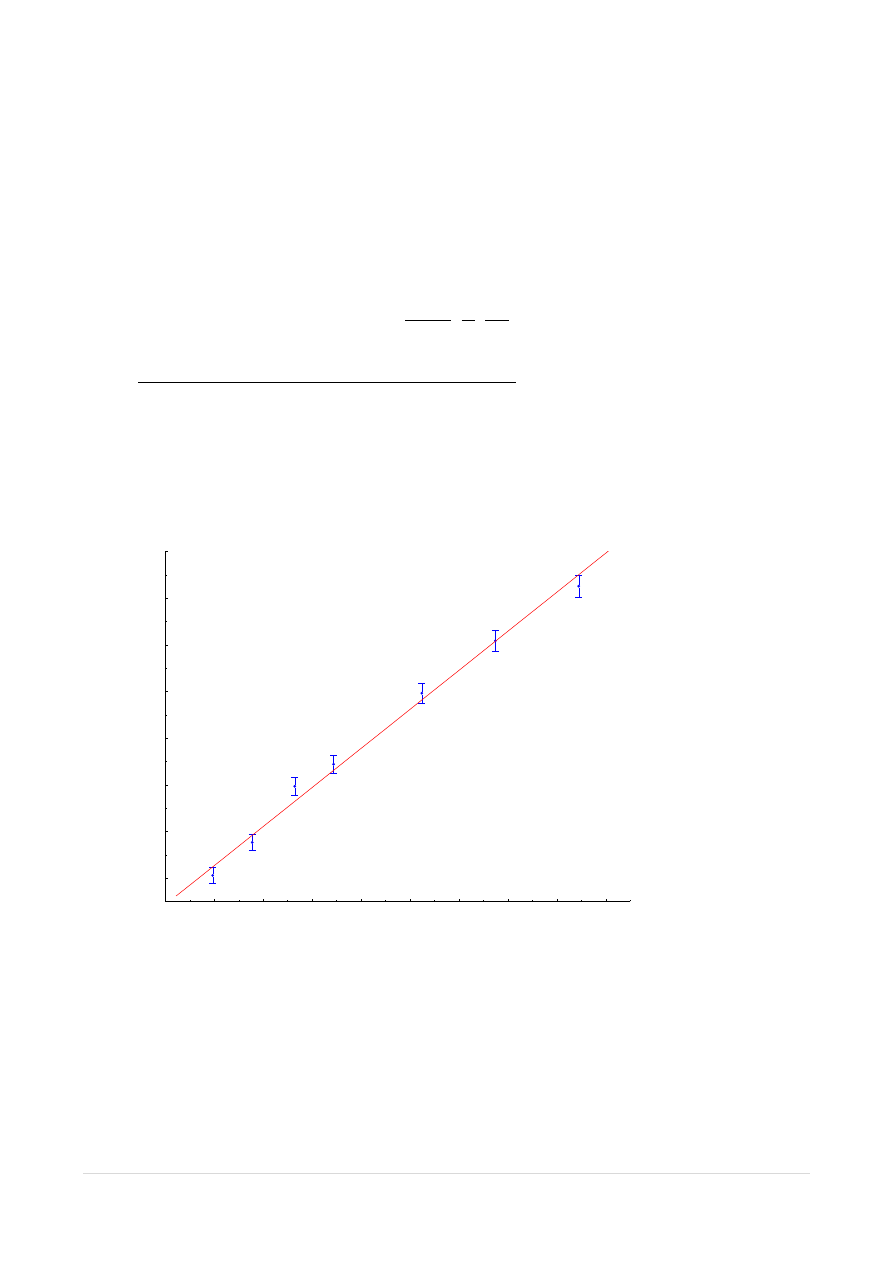
Sporządziliśmy wykres zależności polaryzacji właściwej od ułamka molowego nitrobenzenu
(wykres 1).
0,000
0,005
0,010
0,015
0,020
0,025
0,030
0,035
0,040
0,045
0,00034
0,00036
0,00038
0,00040
0,00042
0,00044
0,00046
0,00048
Regresja liniowa
Y = A*X+B
Parametr
Błąd
A
0,00335
1,43514E-4
B
3,28623E-4
3,1551E-6
R
0,99544
Wykres 1. Zależność polaryzacji p od ułamka molowego X
p
[
m
3
/k
g
]
X
3 |
S t r o n a
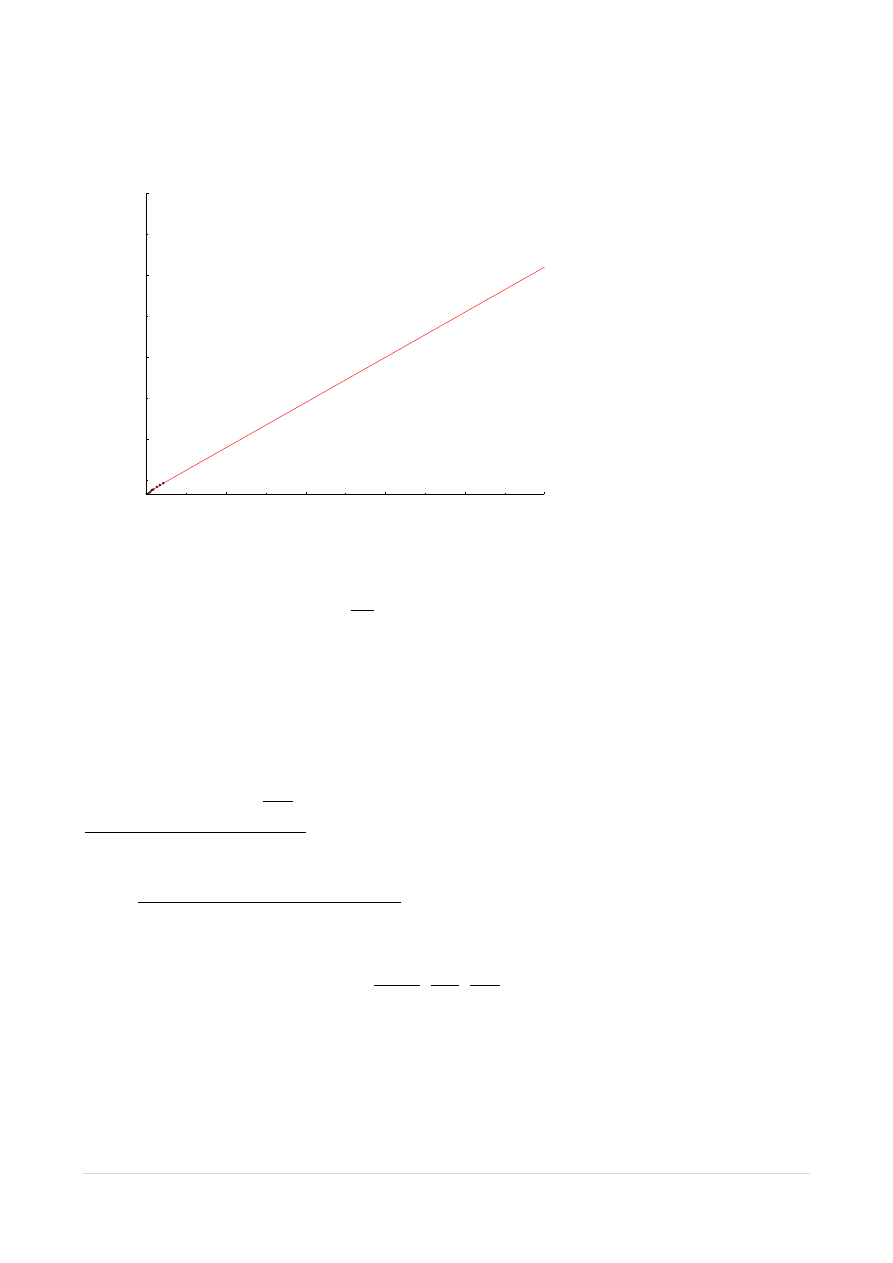
Następnie ekstrapolowaliśmy go do wartości X
n
=1, co pokazuje wykres 2.
0,0
0,2
0,4
0,6
0,8
1,0
0,001
0,002
0,003
0,004
Wykres 2. Zależność polaryzacji p od ułamka molowego X - ekstrapolacja do X=1
p
[
m
3
/k
g
]
X
Z wykresu 2 odczytaliśmy wartość polaryzacji właściwej czystego nitrobenzenu:
kg
m
X
p
n
3
)
000100
,
0
003094
,
0
(
)
1
(
Dzięki temu mogliśmy obliczyć wartość całkowitej polaryzacji molowej, korzystając ze wzoru:
P=p*M
n
, gdzie M
n
=0,123113 [kg/mol] – masa molowa nitrobenzenu,
Stąd P=38,09*10
-5
[m
3
/mol]
Natomiast niepewność
)
1
(
n
n
X
p
M
P
; zatem
mol
m
P
/
10
23
,
1
3
5
Ostatecznie:
mol
m
P
3
5
10
23
,
1
09
.
38
5) Refrakcja molowa nitrobenzenu.
Refrakcję molową R
D
obliczyliśmy ze wzoru:
mol
m
d
M
n
n
R
n
n
D
3
2
2
2
1
, gdzie:
n=1,552 – współczynnik załamania światła dla nitrobenzenu (zbadany przy
pomocy refraktometru)
Stąd:
R
D
=3,269*10
-5
[m
3
/mol]
4 |
S t r o n a
Natomiast niepewność obliczyliśmy metodą różniczki zupełnej i otrzymaliśmy, że:
mol
m
d
M
n
n
R
n
n
D
3
2
2
2
6
, a stąd:
mol
m
R
D
3
5
10
005
,
0
Zatem:
mol
m
R
D
3
5
10
005
,
0
269
,
3
6) Wyznaczenie momentu dipolowego nitrobenzenu.
Na podstawie obliczonych dotąd wartości R
D
, P, przyjmując temperaturę otoczenia T=293 K, oraz
znając wartości stałych:
N=6,0238*10
23
[1/mol] – stała Avogadro
ε
0
=8,854*10
-12
[F/m] – bezwzględna stała dielektryczna próżni
k=1,38*10
-23
[J/K] – stała Boltzmanna
mogliśmy obliczyć wartość momentu dipolowego:
Cm
N
kT
R
P
D
0
0
9
)
(
Stąd μ
0
=13,65*10
-30
[Cm]=4,09[D].
Natomiast niepewność liczyliśmy znaną już metodą, otrzymując wzór:
m
C
R
P
R
P
N
kT
D
D
)
(
9
2
1
0
0
Zgodnie z tym:
D
m
C
01
,
0
10
02
,
0
30
0
Zatem ostatecznie:
m
C
30
0
10
02
,
0
65
,
13
oraz
D
01
,
0
09
,
4
0
7) Zestawienie wyników:
mol
m
P
3
5
10
23
,
1
09
.
38
mol
m
R
D
3
5
10
005
,
0
269
,
3
m
C
30
0
10
02
,
0
65
,
13
oraz
D
01
,
0
09
,
4
0

5 |
S t r o n a
8) Wnioski:
Celem doświadczenia było wyznaczenie momentu dipolowego nitrobenzenu. Porównując
otrzymaną wartość momentu dipolowego z wartością tablicową, która wynosi 4,3D, widzimy, że
obie wartości nie odbiegają znacząco od siebie (4,88% błędu względnego). Zatem nasz wynik
możemy uznać za wysoce prawdopodobny. Te niewielkie różnice można tłumaczyć m.in.:
tzw. błędem eksperymentatora – czyli niewykluczonym brakiem odpowiedniej precyzji przy
wykonywaniu doświadczenia, np. przy sporządzaniu badanych później roztworów
dokładności pomiarowej użytej aparatury (zarówno szkła laboratoryjnego, jak i
kondensatora i refraktometru)
możliwymi zanieczyszczeniami używanych odczynników i sprzętu pomiarowego
nieco inną, niż tablicowa, temperaturą pomiaru.
Wyszukiwarka
Podobne podstrony:
glowne momenty centralne id 562 Nieznany
moment bezwladnosci id 306930 Nieznany
3 momenty id 33866 Nieznany (2)
MOMENTY I SILY BRZEGOWE id 3069 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron