IMMUNOLOGIA – PRELEKCJA 2
Nixon.SUM@gmail.com
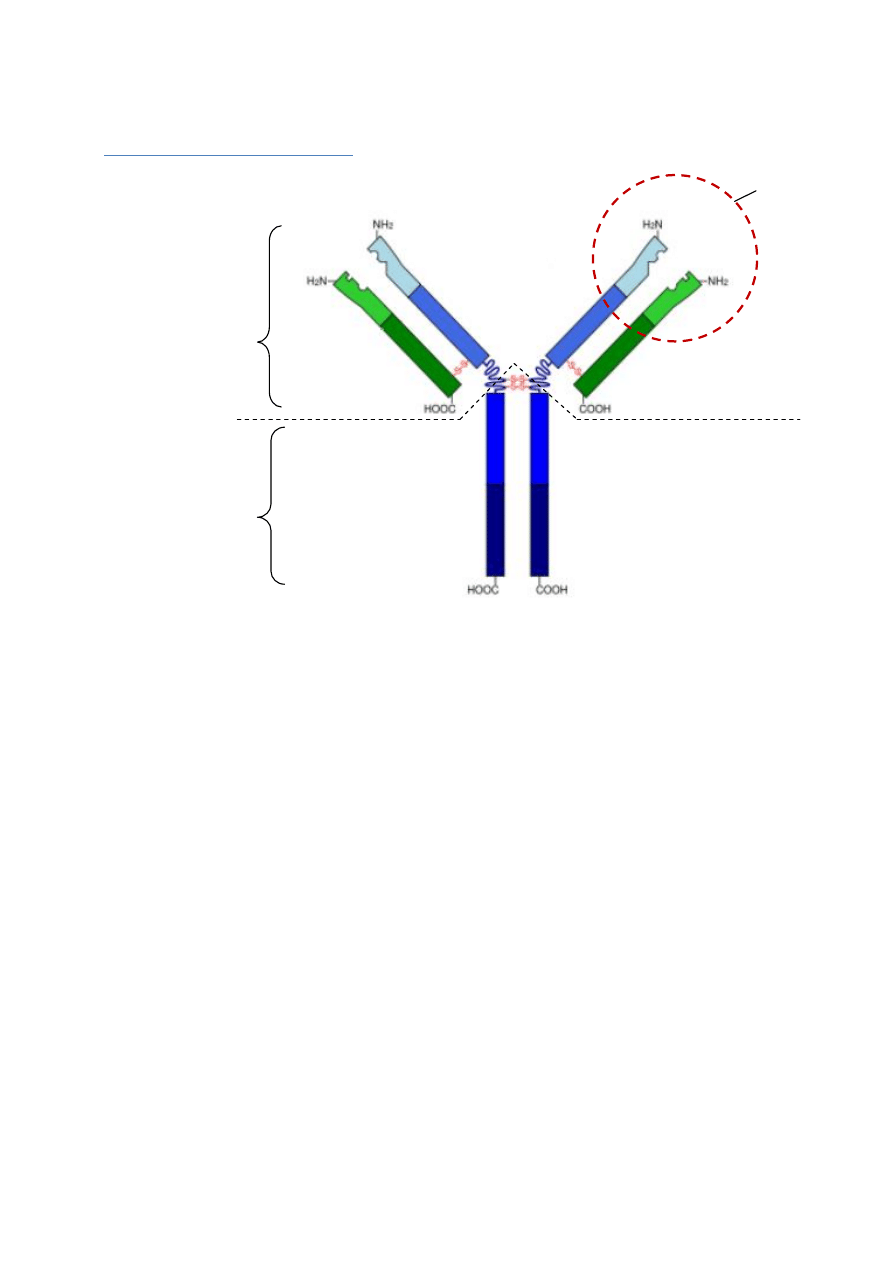
Budowa immunoglobulin
część zmienna
V
H
C
H
1
V
L
Fragment
Fab
C
L
papaina
(powstaje Fab+Fab+Fc)
C
H
2
Fragment
Fc
C
H
3
1. Ig są zbudowane z:
- 2 łańcuchów ciężkich (
H-heavy, zaznaczone na niebiesko
)
Występują w pięciu postaciach różniących się budową:
α (alfa), δ (delta), ε (epsilon), γ (gamma), μ (mi)
dzięki temu możemy wyróżnić pięć klas immunoglobulin (IgA,D,E,G,M)
drobne różnice łańcucha ciężkiego w obrębie tej samej klasy pozwalają nam
rozróżnić podklasy (np. IgG1, IgG2, IgG3, IgG4 )
- 2 łańcuchów lekkich (
L-light, zaznaczone na zielono
)
Występują w dwóch postaciach: typu κ (kappa) lub typu λ (lambda)
2. W łańcuchach lekkich i ciężkich można wyróżnić:
- część zmienna (V) każdego łańcucha składa się z:
- 3 regionów hiperzmiennych
- zwane inaczej CDR – regiony determinujące dopasowanie
- determinują swoistość przeciwciał (wiążą antygeny)
- 4 regionów zrębowych (frame regions – FR) – przylegają do hiperzmiennych
- części stałe (C)
- łańcuch lekki ma jedną domenę w części stałej (C
L
)
- łańcuchy ciężkie posiadają różną ilość domen w części stałej: C
H
1, C
H
2…
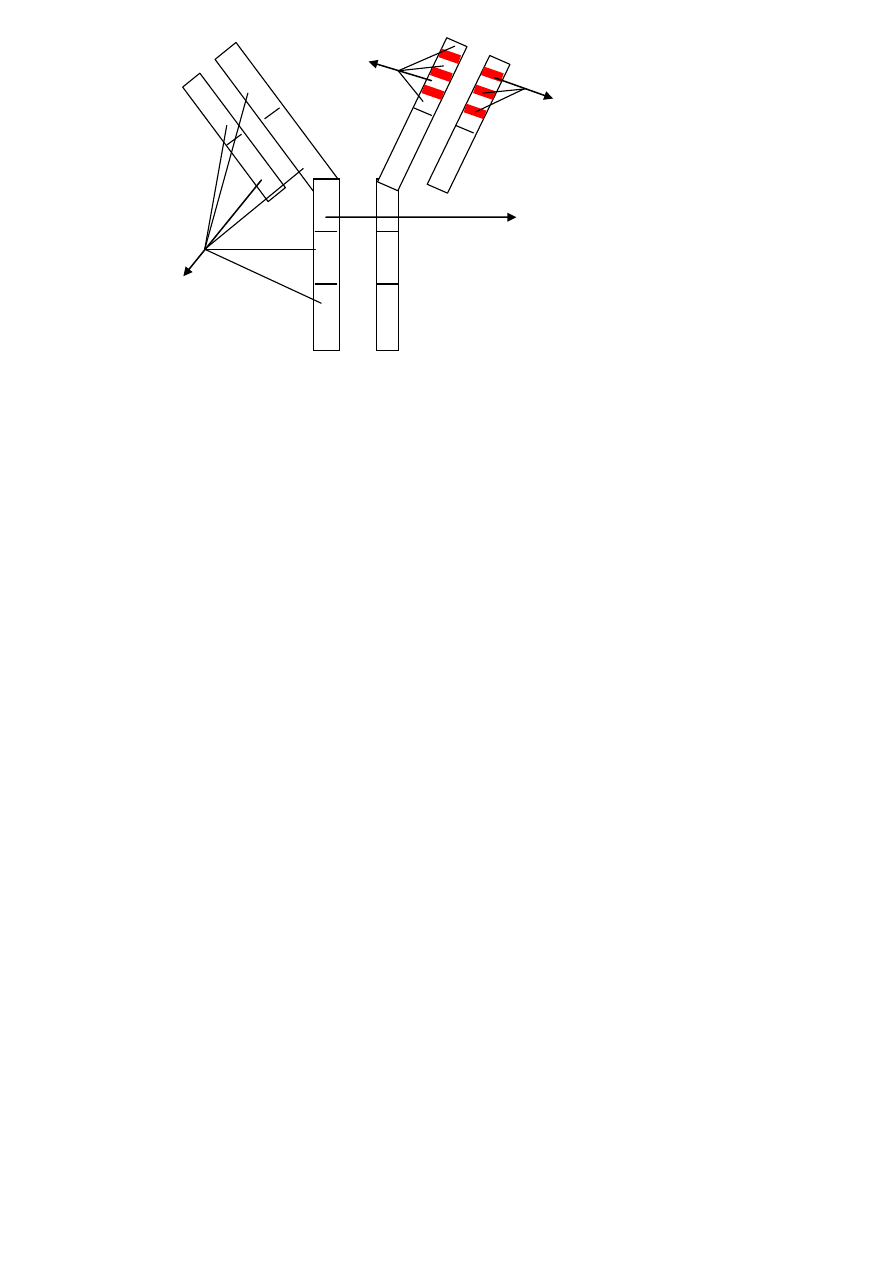
FR
V
H
CDR 1,2,3
V
L
C
H
1
C
L
H
Region zawiasowy
C
H
2
domeny
C
H
3
*domena = obszar homologiczny
- 110 aminokwasowa sekwencja + pętle 60 aminokwasów zamknięte mostkami S-S
- V
H
i C
H
– domeny łańcucha ciężkiego
- V
L
i C
L
– domeny łańcucha lekkiego
Części stałe w IgA,G,D zawierają po 3 domeny
Części stałe w IgE i IgM zawierają po 4 domeny (dodatkowa domena zamiast regionu zawiasowego)
Łańcuch Lekki = VL + CL
Łańcuch Ciężki:
α
= V
H
+ C
H
1 + zawias + C
H
2 + C
H
3 + ogonek
IgA
γ
= V
H
+ C
H
1 + zawias + C
H
2 + C
H
3
IgG
δ
= V
H
+ C
H
1 + zawias + C
H
2 + C
H
3 + ogonek
IgD
ε
= V
H
+ C
H
1 + C
H
2 + C
H
3 + C
H
4
IgE
μ
= V
H
+ C
H
1 + C
H
2 + C
H
3 + C
H
4 + ogonek
IgM
W IgA i IgM występuje ogonek który umożliwia im tworzenie form polimerycznych
3. W wyniku trawienia papainą przeciwciało można również podzielić na
- fragment Fab (Fragment Antigen Binding)
- zawiera miejsca wiążące antygen (paratop)
- paratop jest idealnie dopasowany do epitopu
- fragment Fc – (Fragment Cristallizable)
- krystalizujący
- zawiera odcinki odpowiedzialne za aktywacje dopełniacza
- pełni funkcje efektorowe i transportowe
- fragment zawiasowy H
- w pobliżu miejsca trawienia
- zawiera wiązania dwusiarczkowe (3-11) które łączą oba łańcuchy ciężkie
- pozwala na ustawienia fragmentów Fab pod różnym kątem
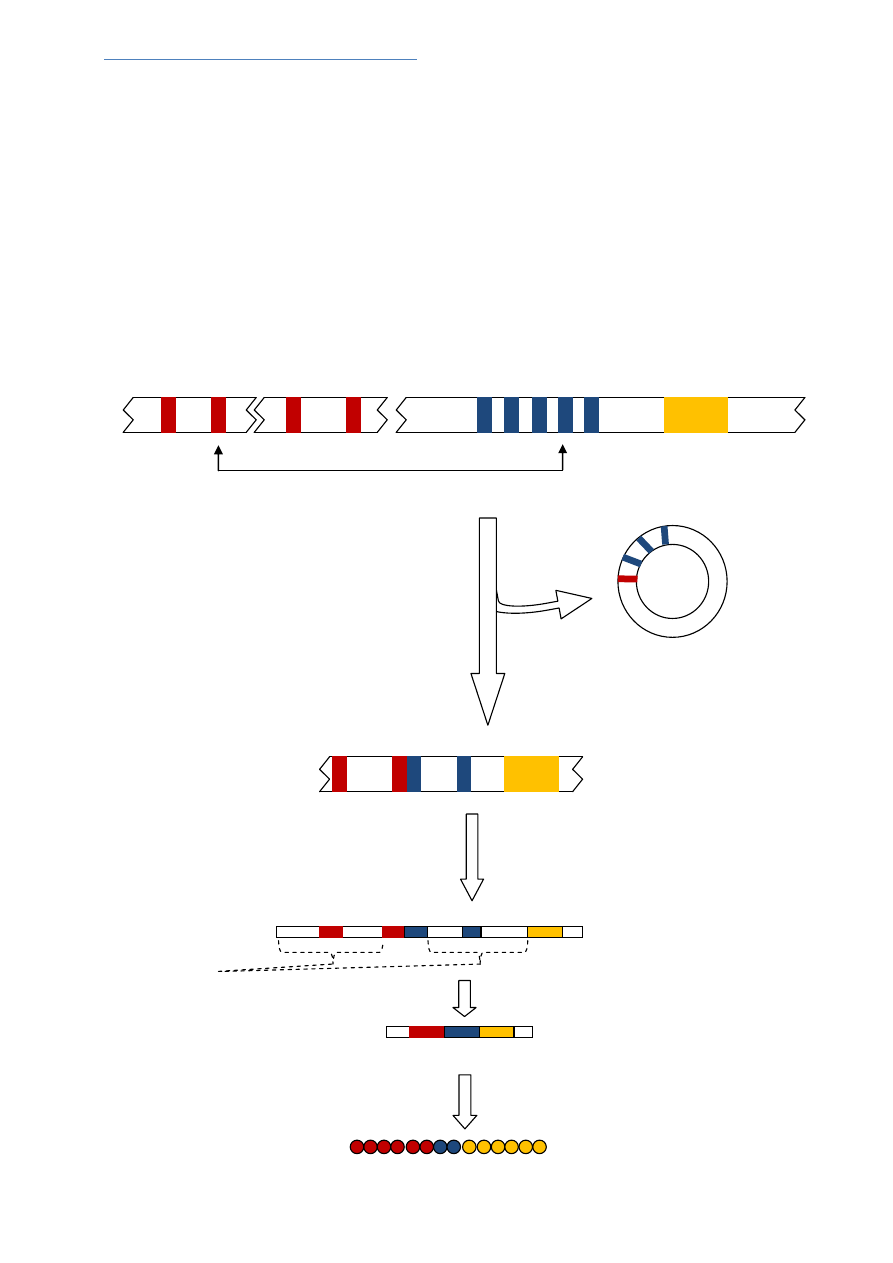
BIOSYNTEZA PRZECIWCIAŁ
1) ŁAŃCUCH LEKKI
Chromosom 2 - Locus łańcucha lekkiego kappa
- zawiera 40 genów dla V łańcucha lekkiego
- 5 genów kodujących J
- pojedynczy odcinek kodujący fragment stały (C) łańcucha lekkego
Chromosom 22 – Locus łańcucha lekkiego lambda
- 30 genów V
- 4 geny J
- 4 geny C
LOCUS ŁAŃCUCHA LAMBDA
V
1
V
2
……. V
39
V
40
J
1
J
2
J
3
J
4
J
5
C
REKOMBINACJA GENÓW
Pojedynczy gen V (np.V
2
) zostaje
Przyłączony do genu J (np.J
4
), tworząc
W ten sposób pełny region VJ.
DNA znajdujące się między V
2
i J
4
zostaje
Usunięte w formie cyrkularnej
V
1
V
2
J
4
J
5
C
TRANSKRYPCJA
V
2
J
4
C
Pre-mRNA
SPLICING
mRNA
V
2
J
4
C
TRANSLACJA
łańcuch białka
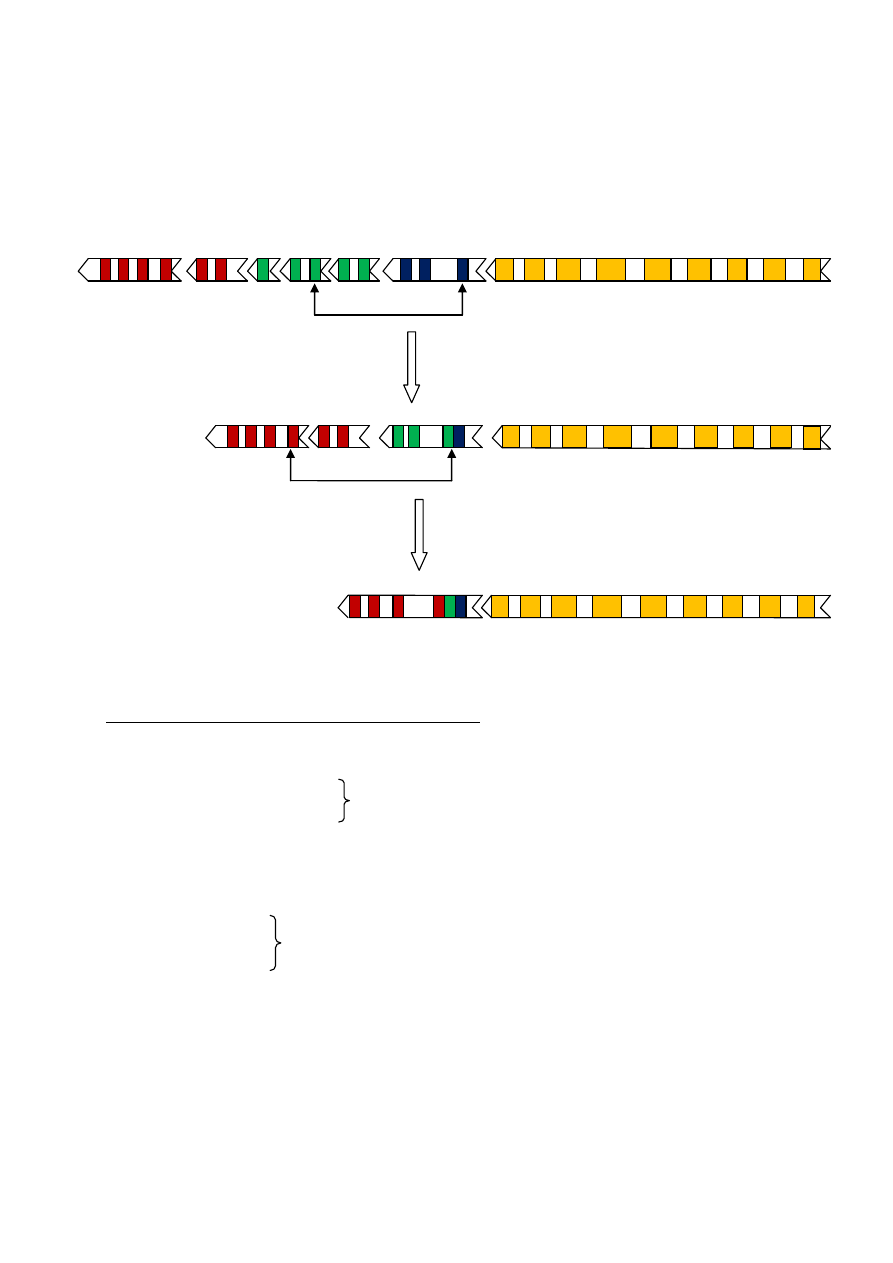
2) ŁAŃCUCH CIĘŻKI
Locus na chromosomie 14
Oprócz genów V
H
które kodują reszty aminokwasowe od 1-94 i segmentów J
H
kodujących reszty od 98-113,
ten odcinek chromosomu zawiera odmienny zestaw segmentów kodujących reszty od 95-97. Te segmenty są
oznaczone literą D (D-diversity, zmienność)
V
1
…….V
4
……… V
51
D
1
…. D
8
D
9 ………
D
27
J
1
J
2
….. J6
C
μ
C
δ
C
γ3
C
γ1
C
α1
C
γ2
C
γ4
C
ε
C
α
REARANŻACJA: POŁĄCZENIE D-J
REARANŻACJA: POŁĄCZENIE V-DJ
KOMBINATORYKA SEGMENTÓW
1) Lańcuch Lekkie
a. kappa
- 40 segmentów V
- 5 segmentów J 40x5 = 200 różnych genów Vκ
b. lambda = co najmniej 120 łańcuchów
c. razem 320 różnych łańcuchów
2) Łańcuchy ciężkie
- 51 V
- 27 D
8262 kompletnych genów V
H
- 6 J
3) Możliwość połączenia każdego z 320 łańcuchów lekkich z 8262 łańcuchami H daje potencjalną
liczbę 2,6x10
6
przeciwciał o różnej swoistości
4) Dodatkowo mogą wystąpić mutacje somatyczne co zwiększa liczbę do ok. 2,6 x 10
7
-10
8
ZMIANA KLAS
Pierwsze Ig wytwarzane przez limfocyty B w trakcie rozwoju osobniczego należą do klasy IgM. Później
pojawiają się IgD i obie klasy umiejscawiają się w błonie limfocytów, jako ich receptory. Na tym etapie
różnicowania (faza G0 cyklu) limf. B mają receptory IgM oraz IgD posiadające identyczne części zmienne a
więc identyczną swoistość. Po złączeniu ze swoistym antygenem limfocyt wchodzi w fazę G1 i ze
współudziałem czynników uwalnianych przez limfocyt T proliferuje i uwalnia wolne przeciwciała.
Początkowo IgM, później IgG i inne, z zachowaniem tej samej swoistości.
W jaki sposób dochodzi do wytwarzania różnych klas przeciwciał o tej samej swoistości? Okazało się ze
geny dla części stałych łańcuchów ciężkich leżą w odpowiedniej kolejności:
μ
---
δ
---
γ3
---
γ1
---
α1
---
γ2
---
γ4
---
ε
---
α2
1) Pobudzony antygenem limfocyt B prezentuje go (przy udziale MHCII) limfocytowi T
2) Następuje ekspresja glikoproteiny CD40L na limfocytach T która jest ligandem dla CD40 limf. B
3) W tym samym czasie cząsteczka CD80 limfocytu B łączy się z CD28 na limf. T
4) Następuje wytwarzanie interleukin przez limfocyt T
5) Przekazanie sygnału dla limfocytu B przy udziale:
a. Interleukin
b. Bezpośrednio przez CD40L i CD40
Te dwa sygnały umożliwiają limfocytowi B zmianę klasy z IgM na inną, w zależności jaki czynnik wydzieli
limofocyt
TGF-β
IL-4
TGF-β
IL-10 INF-γ IL-13
IL-10
μ
δ
γ3
γ1
α1
γ2
γ4
ε
α2
IL
CD28 CD80
LIMF. T
TCR
MHCII
LIMF. B
CD40L CD40
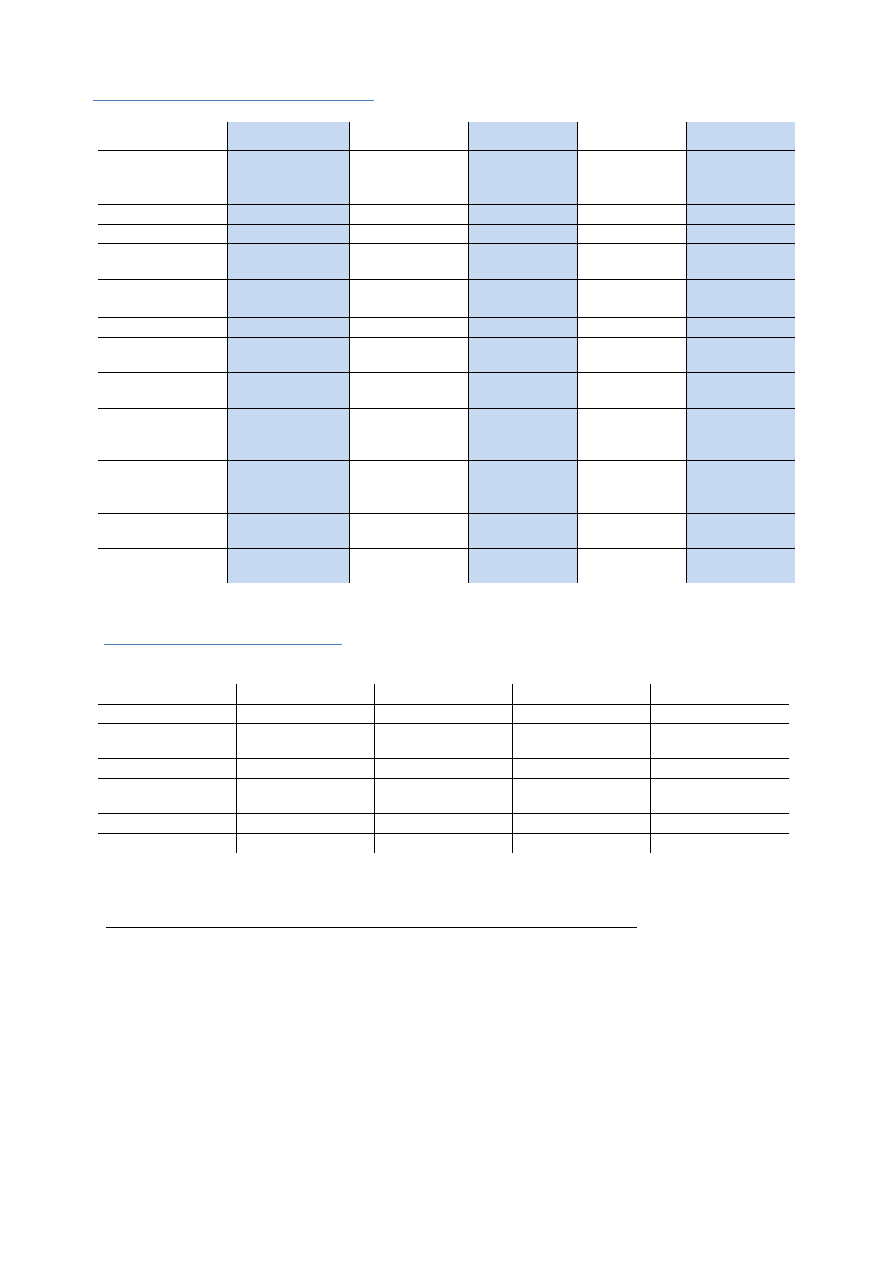
Właściwości immunoglobulin
IgG
IgA
IgM
IgD
IgE
Liczba cz. cztero
łańcuchowych
1
1,2
S-IgA (secretory)
5
1
1
Łańcuch ciężki
γ
α
μ
δ
ε
Łańcuch lekki
κ lub λ
κ lub λ
κ lub λ
κ lub λ
κ lub λ
Wartościowość
dla antygenu
2
2,4
2,10,12
2
2
Stężenie w
surowicy
8-16 mg/ml
1-4,4 mg.ml
0,5-2 mg/ml
0-0,04 mg/ml
5*10^-9
mg/ml
% Ig surowicy
80
13
6
0-1
0,002
Wiązanie
dopełniacza
+
-
+++
-
-
Przechodzenie
przez łożysko
++
-
-
-
-
Wiązanie z kom.
tucznymi i
neutrofilami
-
-
-
-
+
Wiązanie z
monocytami i
makrofagami
++
-
-
-
-
Czas półtrwania
(dni)
23
5,5
5,1
2,8
2
Występowanie w
mleku
+
+
0-ślad
-
-
Właściwości podklas IgG
IgG1
IgG2
IgG3
IgG4
% całkowitego IgG
43-75
16-48
1,7-7,5
0,8-11,7
Przechodzenie
przez łożysko
+
+
+
+
Ag białkowe
++
+/-
++
+/-
Ag
polisacahrydowe
+
++
(-)
(-)
Alergeny
+
(-)
(-)
+
Akt dopełniacza
++
+
+++
(-)
Łączenie się IgG z docelowymi komórkami poprzez receptor dla fragmentu Fc (Fcγ R)
Fcγ RI (CD64): monocyty, makrofagi, neutrofile, kom. dendrytyczne
Fcγ RII (CD32): monocyty, makrofagi, neutrofile, eozynofile, trombocyty, limf. B, kom.
dendrytyczne, kom. endotelialne
Fcγ RIII (CD16): neutrofile, eozynofile, makrofagi, komórki NK, limf. T

Markery antygenowe immunoglobulin – umożliwiają klasyfikację
Izotypy – występowanie Ig z uwzględnieniem zróżnicowania w budowie łańcuchów ciężkich i
lekkich, umożliwiające podział na klasy i typy.
Allotypy – występowanie różnic w obrębie części stałych łańcuchów ciężkich i lekkich (głównie
ciężkich) różnych aminokwasów w określonych pozycjach łańcucha peptydowego.
Idiotypy – występowanie różnic w obrębie części zmiennych łańcuchów ciężkich i lekkich.
Przeciwciała monoklonalne
Przeciwciała monoklonalne to przeciwciała o tym samym izo-, allo- oraz idiotypie, produkowane przez ten
sam klon limfocytów B i plazmocytów. Możemy dzięki nim otrzymywać w dużych ilościach przeciwciała o
dużej swoistości. W tym celu immunizujemy zwierzę, np. mysz danym antygenem, po czym łączymy jej
limfocyty B z komórką szpiczaka (nowotworu pochodzącego z szeregu rozwojowego limfocytów B), w
której brak HGRPTazy. Zachodzi fuzja tych dwóch komórek, wskutek czego otrzymujemy hybrydy –
komórki hybridoma. Następnie oczyszczamy hybrydę z komórek szpiczaka stosując medium HAS
(hipoksantyna-aminopterydyna-tymidyna) przez co zabijamy komórki nowotworowe – hybrydy mają
HGPRTazę dzięki czemu przeżywają. Następnie przeprowadzamy testy swoistości wobec antygenu
przeciwko któremu dane próbki komórek hybridoma produkują przeciwciała. Po uzyskaniu odpowiednio
swoistego klonu możemy go namnażać in vitro bądź in vivo. Limfocyt B określa swoistość hybrydy,
natomiast szpiczak jako „motor napędowy” nadaje jej „nieśmiertelność” i dostarcza rybosomów i aparatu
Golgiego niezbędnego do syntezy białek.
Zastosowanie przeciwciał monokolonalnych
:
diagnostyka mikrobiologiczna chorób zakaźnych, nowotworów, białaczek, chłoniaków, chorób
autoimmunologicznych
immunotoksyny (Ig+toksyna zabijająca komórke np. raka)
o
rycyna i dyfterotoksyna (wystarczy 1 cz. żeby zniszczyć komórke)
oznaczanie stężeń białek i leków w płynach ustrojowych
typowanie tkanek i krwi
ocena układu odpornościowego
oznaczanie stężenia hormonów
terapia – uwaga na HAMA – human anti-mouse antibodies, p/ciała wytwarzane przez nasz organizm
przeciwko białkom pochodzącym bądź co bądź z mysich komórek
o np. OKT 3 – skierowane przeciw CD3 limfocytów T – niszczenie LimfT - immunosupresja
Preparaty immunoglobulinowe:
ludzkie
obcogatunkowe
chimerowe – 33% mysie (od strony Fab) + 67% ludzkie
humanizowane, 5-10% mysie (od strony Fab), reszta ludzka
Stosowane preparaty immunoglobulinowe:
Ig ludzkie nieswoiste – od osób nieimmunizowanych (zlewanie surowicy od minimum 1000
dawców i pobieranie z niej przeciwciał) – leczenie pierwotnych i wtórnych niedoborów
odpornościowych typu humoralnego, zakażeń bakteryjnych i wirusowych zagrażających życiu,
profilaktyka WZW typu A i odry.
Ig ludzkie swoiste (o wysokiej zawartości przeciwciał) – przeciw HBV (antygen HBSPa), VZV
(odra, półpasiec), wirusowi kleszczowego zapalenia mózgu, wirusowi wścieklizny, CMV
(cytomegalia), toksynie tężcowej, Ig anty Rh
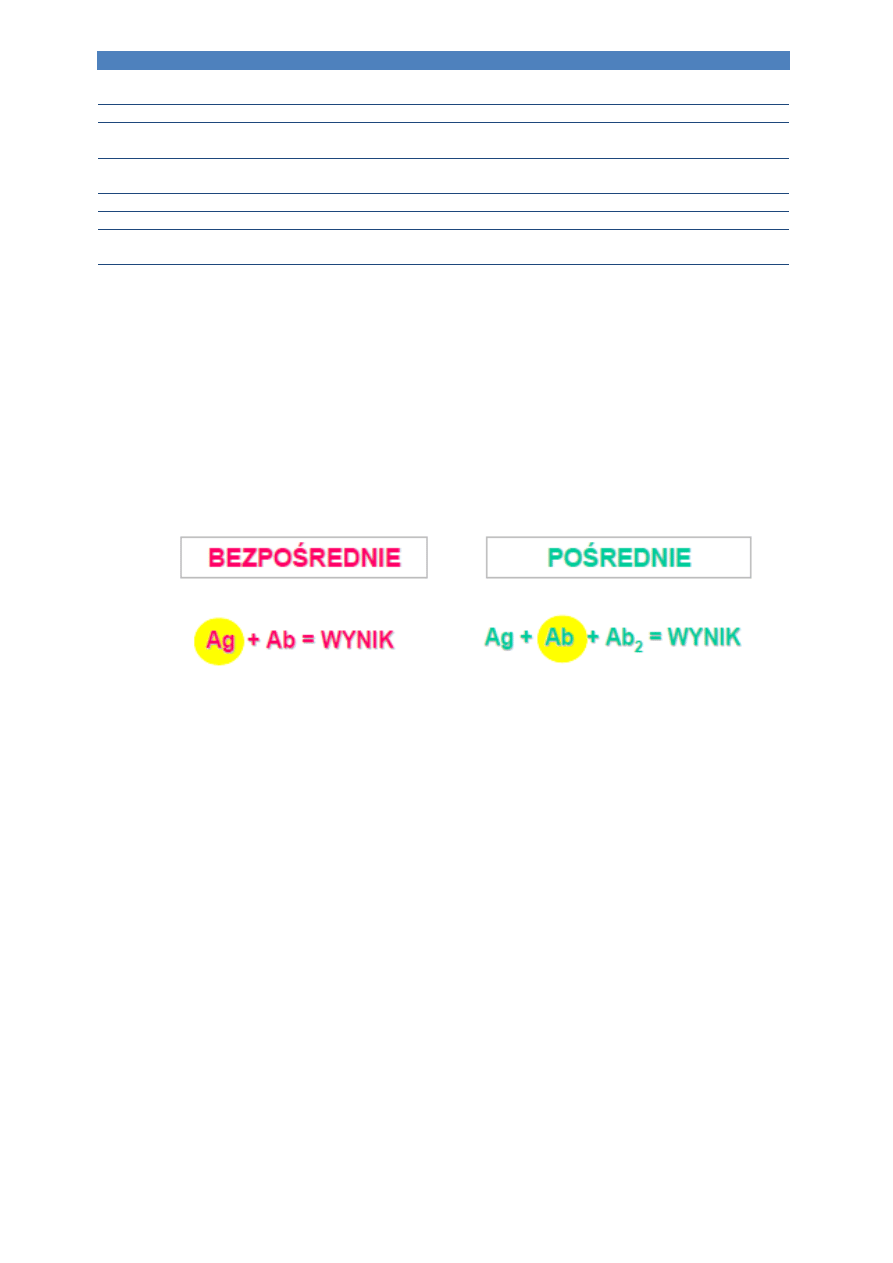
Immunoglobulina
Skład
Wskazania
anty TNF-alfa
chimerowe
terapia RZS, choroby Crohna,
colitis ulcerosa
anty HER 2
humanizowane
terapia raka piersi z przerzutami
przeciwko receptorowi aktywnych
płytek krwi (GP IIb/IIIa)
chimerowe
terapia i profilaktyka ostrych
stanów niedokrwiennych serca
przeciwko receptorowi CD20
humanizowane
leczenie chłoniaków pochodzących
z limfocytów B
anty CD 52
humanizowane
przewlekła białaczka limfocytarna
anty IgE
humanizowane
nadwrażliwość typu I
przeciwko receptorowi CD25 (IL-
2R)
humanizowane
profilaktyka ostrego odrzucenia
przeszczepu
anty CTLA4
humanizowane
terapia RZS, melanoma
Testy Immunologiczne
Istnieje wiele odmian testów immunologicznych
• wszystkie polegają na zajściu reakcji wiązania się antygenu ze swoistymi
(rozpoznającymi go) przeciwciałami,
• różnią się natomiast sposobem wykrywania tej reakcji.
Testy immunologiczne bezpośrednie
wykrywają określony antygen przy
pomocy znakowanych przeciwciał.
Antygeny wirusowe czy bakteryjne
występują jednak często w ustroju w
bardzo niewielkiej ilości, która
znalazła by się poniżej progu detekcji.
Z tego względu często stosuje się testy
immunologiczne pośrednie wykrywające
immunoglobuliny, które uprzednio
związały się ze swoistym antygenem.
Testy immunologiczne pośrednie
wykrywają immunoglobuliny, które uprzednio
związały się ze swoistym antygenem.
Opierają się one na na założeniu, że jeśli
organizm kręgowca zetknął się z konkretnym
antygenem, to w surowicy tego organizmu
będą się znajdywały swoiste wobec tego
antygenu przeciwciała. Ponieważ
immunoglobuliny jako takie mają właściwości
immunogenne (wywołują odpowiedź
immunologiczną), można uzyskać swoiste
przeciwciała skierowane wobec
immunoglobulin innego gatunku.
Charakteryzują się większą czułością, gdyż
wykorzystują naturalną zdolność układu
immunologicznego - amplifikację sygnału, jaki
dociera do układu immunologicznego w
postaci antygenu.
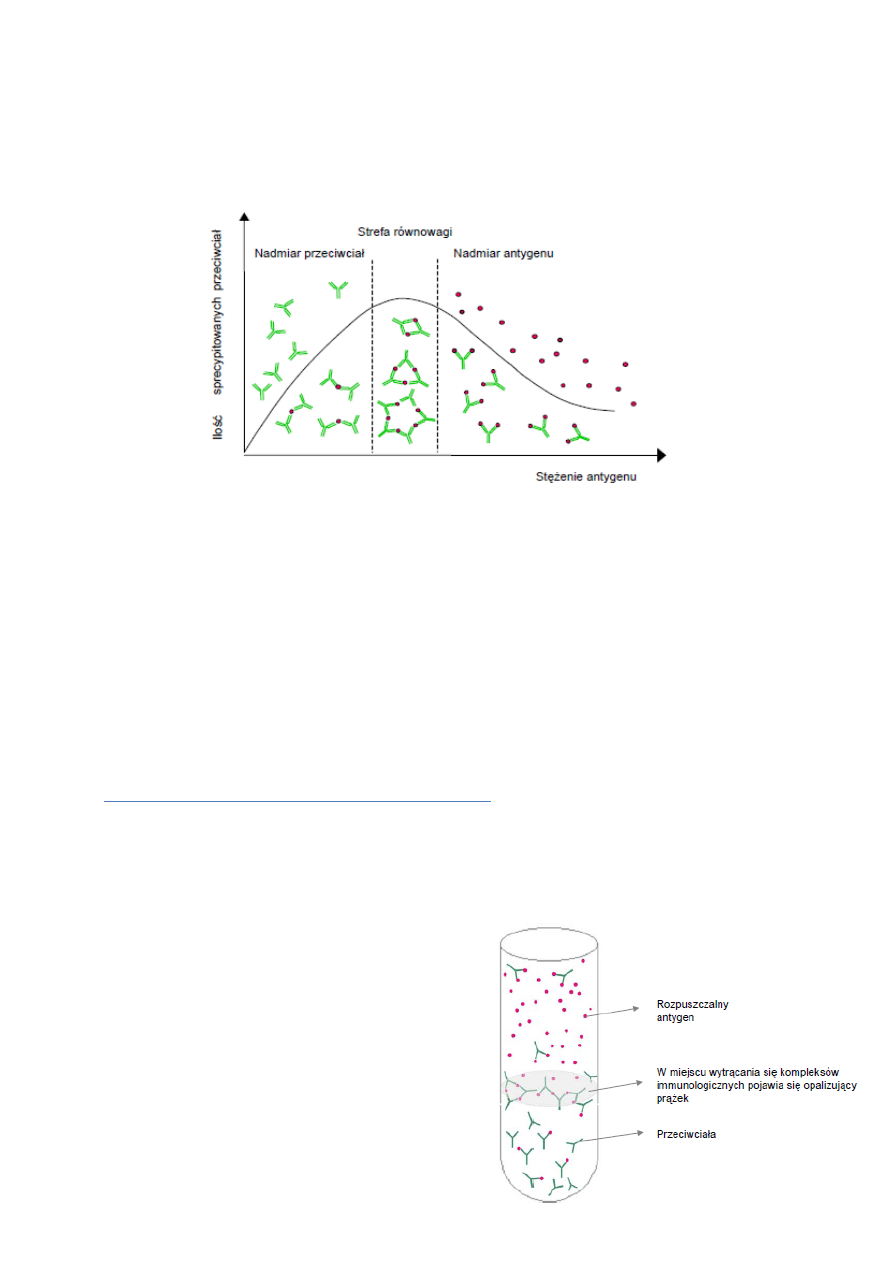
Odczyn precypitacji
Jest to odczyn w którym antygen jest w postaci rozpuszczonej, w przeciwieństwie do aglutynacji gdzie jest
upostaciowiony. Charakteryzuje go mniejsza czułość niż aglutynację. Wymaga udziału wielowartościowego
antygenu i co najmniej dwuwartościowego przeciwciała tak jak w aglutynacji. Musi być także zachowany
odpowiedni stosunek antygen:przeciwciało, ponieważ reakcja najlepiej zachodzi w strefie ekwiwalencji
ilościowej ich stężeń. W strefie nadmiaru antygenu bądź przeciwciała tworzą się rozpuszczalne kompleksy
immunologiczne.
Podział precypitacji:
W środowisku płynnym – USR, VDRL stosowane w screeningu kiły (nie musi być swoisty, ale
czuły, bowiem dodatni wynik zawsze weryfikujemy).
W środowisku półpłynnym (w żelu)
o
Immunodyfuzja podwójna
o Immunodyfuzja pojedyncza
o Immunoelektroforeza
Western-blot
Nefelometria
Turbidymetria
Percypitacja w środowisku płynnym
Metody te są głównie jakościowe. Zalicza się do nich np. wykrywanie antygenów Baccillus antracis
(wąglik) w skórach i innych tkankach zwierzęcych – tzw. odczyn Ascoliego. Antygen jest ekstrahowany z
tkanki, po czym przeprowadza się reakcję surowicy odpornościowej z roztworem zawierającym antygen.
Powstanie pierścienia precypitacyjnego oznacza wynik dodatni.
Odczyny nieswoiste – USR, VDRL – stosujemy w
screeningowej serodiagnostyce kiły. Poszukiwanym
antygenem są reaginy kiłowe. Są to tzw. odczyny
kłaczkujące. Ponieważ jest to metoda screeningowa,
aby potwierdzić wynik pozytywny musimy w następnej
kolejności przeprowadzić swoisty test TPHA.
Precypitacja w żelu
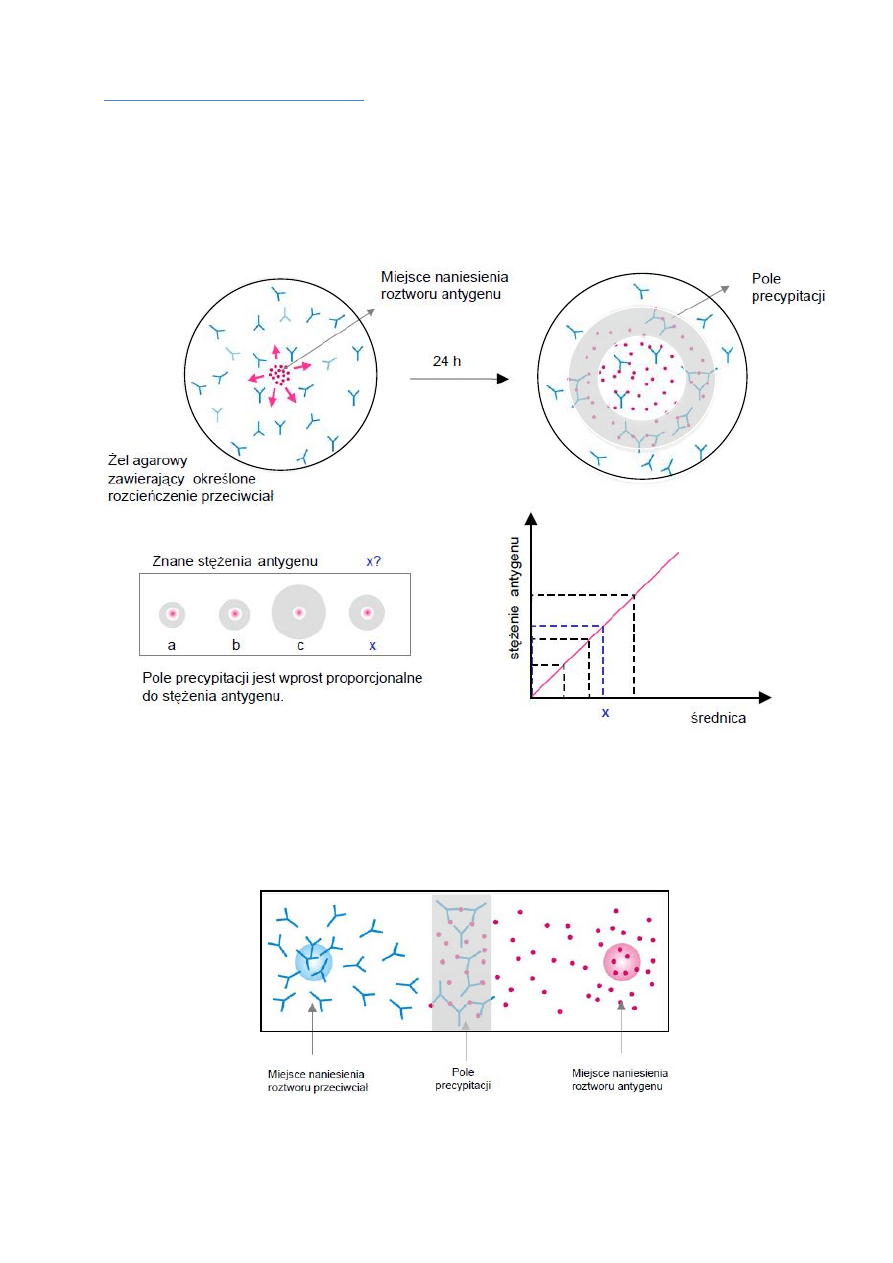
Immunodyfuzja pojedyncza - reakcja dyfuzji radialnej wg Manciniego
- służy do ilościowej oceny antygenu
- przeciwciała unieruchomione są w żelu agarowym, antygen dyfunduje
- metoda ta znalazła zastosowanie w ilościowym oznaczaniu stężenia immunoglobulin w surowicy, a także
składników dopełniacza (C3, C4) oraz niektórych białek ostrej fazy (transferyna, laktoferyna).
Reakcja podwójnej dyfuzji wg Ouchterlony’ego
- dyfundują cząsteczki antygenu i przeciwciała
- Jest to metoda pozwalająca określić stopień pokrewieństwa antygenów
test Elecka – służy do badania toksyczności maczugowca błonicy - nie wszystkie szczepy tej bakterii są
toksyczne. Przeciwciało przeciwko toksynie maczugowca umieszczamy na bibułce filtracyjnej, a prostopadle
do niego nanosimy bakterie. Tworzenie „wąsów precypitacyjnych” oznacza że dany szczep jest toksyczny.

Immunoelektroforeza
Jest to metoda jakościowa i półilościowa, oceniamy łuki precypitacyjne, prowadzimy ją na szkiełku
pokrytym żelem. Po wycięciu otworów dla surowic (badanej i kontrolnej) najpierw zachodzi elektroforeza
białek, a po niej wycinamy rowki do których dodajemy przeciwciała – zachodzi immunoprecypitacja. Po
wybarwieniu interpretujemy wynik.
Immunoelektroforeza wg Grabara jest metodą półilościową, pozwalającą na diagnozę hiper-, nipo- bądź
agammaglobulinemii. Stosujemy tu surowicę badaną i kontrolną wg. powyższego opisu. Aby zdiagnozować
w/w gammapatie porównujemy obraz prawidłowej surowicy kontrolnej oraz surowicy pacjenta.
Immunoelektroforeza służy także diagnozowaniu szpiczaka mnogiego, gdzie za pomocą swoistych
przeciwciał wykrywamy i identyfikujemy białko monoklonalne, używając jako odniesienia odpowiedniego
wzorca.
surowica kontrolna
rowek z przeciwciałami
surowica badana

Western-blot
Metoda ta służy do wykrywania antygenu i przeciwciała, częściej przeciwciała
1) Elektroforeza próbki na żelu poliakryloamidowym z SDS
2) Rozdzielone białka przenosimy (przez odciśnięcie – ang. Blotting) na filtr nitrocelulozowy, na
którym białko ma lepsze warunki do reakcji z przeciwciałem (przeciwciało jest fabrycznie
naniesione na nitrocelulozę w formie pasków)
3) Powstały kompleks antygen-przeciwciało wykrywamy przemywając go drugim przeciwciałem,
specyficznym dla pierwszego, które dodatkowo jest znakowane radioaktywnie (albo enzymatycznie)
4) Uwidocznienie reakcji na kliszy rentgenowskiej - autoradiogram
Wykrywamy głównie
1) HCV
2) HIV – screeningowo wykonujemy test metodą ELISA obarczony sporym błędem pomiarowym
(wyniki fałszywie dodatnie), Western-blot służy potwierdzeniu wyniku. Często używa się
sonifikowanego (rozbitego ultradźwiękami) wirusa, którego fragmenty służą jako wzorcowe
antygeny „wyłapujące” przeciwciała w surowicy krwi. Powstałe kompleksy immunologiczne
wykrywamy surowicą antyglobulinową sprzężoną z enzymem – oznaczamy stężenie produktu
reakcji enzymatycznej.
3) Techniką tą możemy także wykrywać antygen, co zostało wykorzystane w diagnostyce zakażenia
prionami w BSE. Zasada metody polega na denaturacji białek proteazami, na które wrażliwy jest
nawet obecny fizjologicznie w komórkach prion. Trawieniu nie podlegają jedynie priony
chorobotwórcze, które następnie wykrywane są za pomocą swoistych przeciwciał.
4) Zastosowanie także w diagnostyce boreliozy a także zakażenia Helicobacter pylori, jedynego
bakteryjnego karcynogenu klasy I – rozłożone elektroforetycznie antygeny H. pylori (w tym CAK-2)
wiążą się ze swoistymi przeciwciałami.
Nefelometria
Jest to metoda ilościowego oznaczania białek polegająca na pomiarze natężenia światła rozproszonego w
roztworze zawierającym kompleksy immunologiczne. Zaletą metody jest łatwość i krótki czas wykonania.
Zastosowanie diagnostyczne: oznaczanie immunoglobulin (G, A, M), składowych dopełniacza (C3, C4),
białek ostrej fazy (alfa1-IP, ceruloplazmina, CRP), albuminy.
Turbidymetria
Jest to metoda ilościowego oznaczania białek polegająca na pomiarze spadku natężenia światła po przejściu
przez zawiesinę zawierającą kompleksy immunologiczne. Zastosowanie diagnostyczne: oznaczanie
immunoglobulin, składowych dopełniacza, białek ostrej fazy.
Wyszukiwarka
Podobne podstrony:
Testy immunologiczne
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
ćw1-metody izolacji Ig-wysalanie, immunologia, ćwiczenia
Testy immunologiczne i zjawisko?gocytozy
Budowa atomu testy chemia liceum, chemia liceum
HIVb28.02-BUDOWA DREWNA, Hospitacje dydaktyka
7. PATOMORFOLOGIA KOLO 7 2007.2008 (16.02.2008), patomorfologia TESTY
02 Budowa linii elektroenergetycznych
Budowa wyrazów, Testy i sprawdziany
Ćw 2 Testy immunoenzymatyczne wer 2
2011.02.26 - KPZPN, Testy, testy sędziowskie
HIVa27.02-BUDOWA DREWNA, Hospitacje dydaktyka
2011.07.02 - ŁZPN - 4 liga, Testy, testy sędziowskie
2010 testy immunolgiczne
3.02 Budowa i czynnosci neuronu
więcej podobnych podstron