
B. Oleś
1
Jeśli temperatura układu T
U
jest wyższa od temperatury
otoczenia T
O
, to układ oddaje ciepło do otoczenia aż do
ustalenia się między nimi równowagi termodynamicznej.
Jeśli temperatura układu T
U
jest niższa od temperatury
otoczenia T
O
, to układ pobiera ciepło od otoczenia aż do
ustalenia się równowagi termodynamicznej.
Ciepło Q jest energią przekazywaną między
układem a jego otoczeniem na skutek
istniejącej między nimi różnicy temperatur.
Q
T
O
T
O
T
U
T
U
Q
Wykład 12 Wydz.Chemii PK, 2009/10
Jednostką ciepła jest dżul: [Q]=1J.
Do określenia wartości energetycznej żywności
stosuje się kalorie: 1cal = 4,1860 J.
1.4. Ciepło

B. Oleś
2
Po dostarczeniu ciału o masie m ciepła Q jego temperatura zmienia
się od T
1
do T
2
:
),
(
1
2
T
T
cm
T
cm
Q
gdzie c jest
ciepłem właściwym:
,
1
dt
dQ
m
c
W przypadku zmiany stanu skupienia ciała (np. parowanie, skraplanie,
krzepnięcie itd.) dostarczona (lub oddana) ilość ciepła nie wiąże się
ze zmianą temperatury.
Ciepło właściwe może być zmierzone pod stałym
ciśnieniem p lub przy zachowaniu stałej objętości ciała.
Wartości te są różne!
,
przem
m
c
Q
Np. w stanie gazowym cząsteczki mają większą energię i
swobodę ruchu. Dostarczona w procesie parowania energia
idzie na rozerwanie wiązań międzycząsteczkowych.
Ilość ciepła, którą trzeba przekazać jednostkowej masie
substancji, aby uległa przemianie fazowej, nosi nazwę
ciepła przemiany
c
przem
:
Wykład 12 Wydz.Chemii PK, 2009/10
Zmienia się natomiast struktura ciała.

B. Oleś
3
Jako układ weźmy gaz zamknięty w
cylindrze zamkniętym ruchomym tłokiem.
Gaz wywiera na tłok siłę, która jest skutkiem
ciśnienia gazu i równoważy ciężar tłoka.
Ścianki cylindra wykonane są z izolatora
cieplnego, natomiast jego dno jest w
kontakcie termicznym ze zbiornikiem ciepła.
Stan początkowy układu charakteryzują parametry:
ciśnienie, objętość i temperatura
0
0
0
,
,
T
V
p
Przemianą termodynamiczną
(procesem termodynamicznym)
nazywamy działania, które wywołają zmianę tych parametrów.
Może ona nastąpić podczas wymiany ciepła między układem a
otoczeniem lub wykonywania pracy nad układem lub przez układ.
1.5. Praca w procesach termodynamicznych
Usuńmy kilka orzechów obciążających tłok.
Wykład 12 Wydz.Chemii PK, 2009/10
B. Oleś
4
Gaz przesunie tłok i jeśli przemieszczenie jest bardzo małe,
możemy przyjąć, że siła z jaką gaz działa na tłok o polu
powierzchni S, jest stała.
ds
F
Praca wykonana przez gaz:
,
dV
p
ds
S
p
r
d
F
dW
(dV- zmiana objętości gazu).
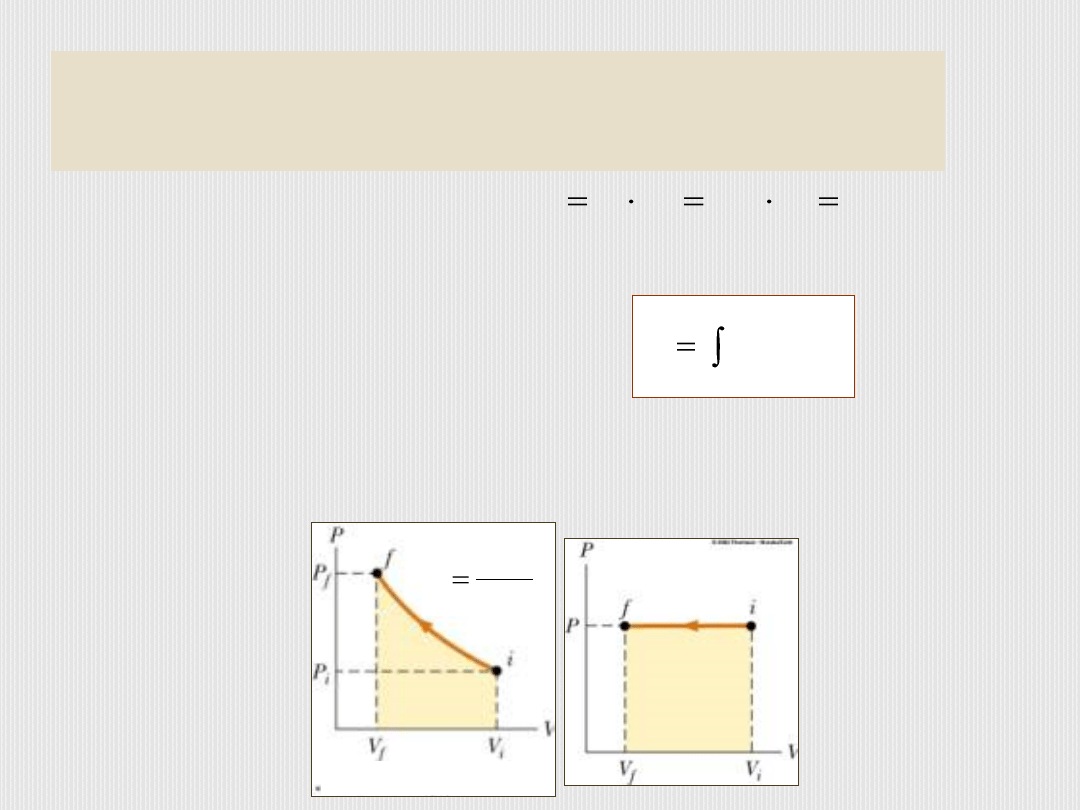
Całkowita praca wykonana przez gaz:
.
)
(
0
k
V
V
dV
V
p
W
Z obserwacji wiemy, że zmianie objętości gazu może towarzyszyć
zmiana temperatury i ciśnienia. Musimy zatem wiedzieć, jak ciśnienie
w danym przemianie zależy od objętości, p=p(V).
,
V
NkT
p
p=const
Wykład 12 Wydz.Chemii PK, 2009/10
Sprężanie gazu w stałej
temperaturze – praca
wykonana nad gazem
jest równa polu
powierzchni pod
wykresem p(V)
Sprężanie gazu pod
stałym ciśnieniem –
praca wykonana nad
gazem jest równa
polu powierzchni
pod wykresem p(V)
B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
5
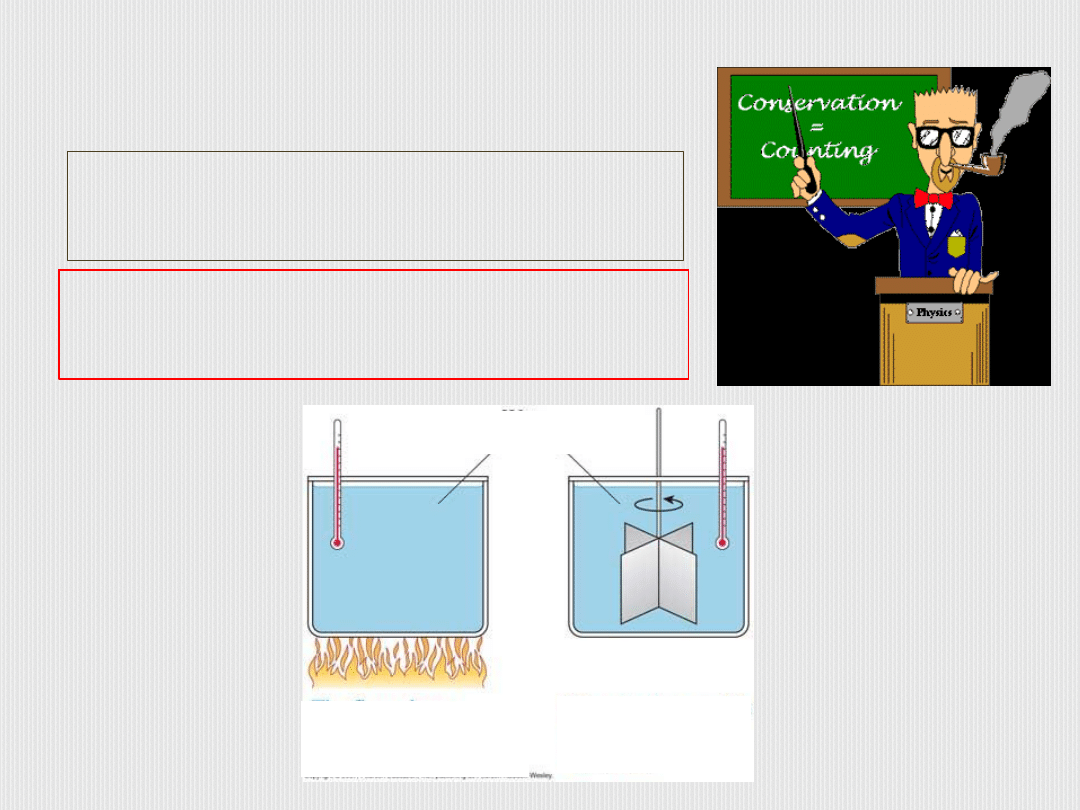
Ciepło to energia przekazywana przez jedno
ciało drugiemu w wyniku różnicy temperatur
między tymi ciałami.
Praca to energia przekazywana przez jedno
ciało drugiemu za pośrednictwem sił
działających między tymi ciałami.
Zapami
ę
taj
Płomienie
dostarczają
ciepła
Mieszadło
wykonuje
pracę
woda

B. Oleś
6
1.6. Pierwsza zasada termodynamiki
Energia wewnętrzna
ciała U jest równa sumie energii ruchu
termicznego cząsteczek, energii potencjalnej oddziaływań
międzycząsteczkowych oraz energii wewnątrzcząsteczkowej.
Obliczając energię wewnętrzną nie uwzględniamy energii
kinetycznej układu jako całości oraz energii potencjalnej w
zewnętrznych polach, np. grawitacyjnym
.
Zmiana energii wewnętrznej U przy przechodzeniu z jednego stanu do
drugiego nie zależy od przemiany i osiąganych stanów pośrednich i
jest zawsze różnicą wartości U w stanach końcowym i początkowym.
Zmiana energii wewnętrznej układu może zachodzić przez
przekazanie ciepła lub wykonanie pracy, albo przez jedno i drugie.
Energia wewnętrzna gazu jest funkcją temperatury U=U(T).
Ilość wykonywanej pracy W i pobieranego (oddawanego) ciepła Q
zależą od rodzaju przemiany, ale energia wewnętrzna U nie.
Mówimy, że U jest
funkcją stanu
.
Wykład 12 Wydz.Chemii PK, 2009/10

B. Oleś
7
Każda z występujących we wzorze wielkości
może być dodatnia, ujemna lub równa zeru.
Gdy ciało pobiera ciepło z otoczenia, to d’Q>0, gdy oddaje
d’Q<0, gdy nie ma wymiany ciepła z otoczeniem, d’Q=0.
Gdy gaz wykonuje pracę i jego objętość wzrasta, to d’W>0, gdy
praca jest wykonywana nad gazem i jego objętość maleje d’Q<0,
gdy objętość gazu nie ulega zmianie, d’W=0.
Możemy powiedzieć, że energia wewnętrzna układu
wzrasta, jeżeli układ pobiera ciepło i kiedy praca jest
wykonywana nad gazem,
maleje, kiedy układ wykonuje pracę i oddaje ciepło.
,
'
'
W
d
Q
d
dU
Pierwsza zasada termodynamiki
mówi o sposobie zmiany energii
wewnętrznej:
Wykład 12 Wydz.Chemii PK, 2009/10
Symbole d’Q oraz d’W oznaczają, że nie mamy do czynienia z
różniczkami zupełnymi Q i W ( w przeciwieństwie do dU, będącej różniczką
zupełną).
Wartości pracy i i ilości ciepła zależą od sposobu przejścia układu z
jednego stanu do drugiego (dla U nie). Nie ma sensu mówić np. o pracy
w stanie początkowym lub końcowym, a tym samym o przyroście pracy!

B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
8
1.7. Mechanizmy przekazywania ciepła
Istnieją trzy mechanizmy przekazu energii w postaci ciepła:
przewodnictwo,
konwekcja,
promieniowanie .
http://apollo.lsc.vsc.edu/classes/met130/notes/chapter2/graphi
cs/pan2.psd.gif
konwekcja
promieniowanie
promieniowanie
przewodnictwo
Przewodnictwo cieplne
polega na
przekazywaniu nadmiaru energii
kinetycznej pomiędzy cząsteczkami
ośrodka o wyższej temperaturze a
cząsteczkami ośrodka o niższej
temperaturze.
Im wyższa temperatura ciała,
tym większa jest amplituda i
energia drgań jego cząsteczek.
Szybkość przepływu ciepła w płytce o grubości l jest wprost
proporcjonalna do pola powierzchni S i do różnicy temperatur
przypadającej na jednostkę grubości T/ l:
,
l
T
kS
t
Q
k – współczynnik cieplnego przewodnictwa
właściwego (przewodnictwo właściwe).
Ten proces odgrywa rolę przede
wszystkim w ciałach stałych,
chociaż zachodzi również w
cieczach i gazach.

B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
9
Dobre przewodniki ciepła posiadają
współczynniki k o dużych wartościach.
Karta graficzna z
radiatorem
odprowadzającym ciepło –
radiator wykonany z
dobrego przewodnika
ciepła, np.
miedzi,
k=
401W/(m K
)
W budownictwie stosuje się materiały o małych wartościach k – złe
przewodniki ciepła, aby zapewnić dobrą izolację termiczną budynku.
Straty ciepła w źle
izolowanym budynku można
wyeliminować docieplając go
np. wełną mineralną o
k
=0,043W/(m K)

B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
10
http://www.physics.arizona.edu/~thews/reu/Convect
ion.bmp
Konwekcja
(unoszenie) - materia podgrzana
przez kontakt z gorącym ciałem zmniejsza
swoją gęstość (jej objętość bowiem wzrasta
na skutek rozszerzalności termicznej!) i
przemieszcza się ku górze dzięki sile
wyporu, częściowo mieszając się z wyższymi
chłodniejszymi warstwami.
Konwekcja jest ważnym mechanizmem
przenoszenia energii wewnętrznej w cieczach i
gazach.
Chłodne
powietrze
Nagrzany grunt
Prądy
konwekcyjne
B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
11
http://www.phys.unsw.edu.au/~jw/graphics/Joecool.GIF
Wymiana energii w postaci ciepła między
ciałami może zachodzić za pośrednictwem fal
elektromagnetycznych. Mamy wówczas do
czynienia z
promieniowaniem cieplnym
.
W takim przekazie ciepła nie jest potrzebny żaden
ośrodek, może on zachodzić również w próżni, np.
pomiędzy Słońcem a Ziemią.
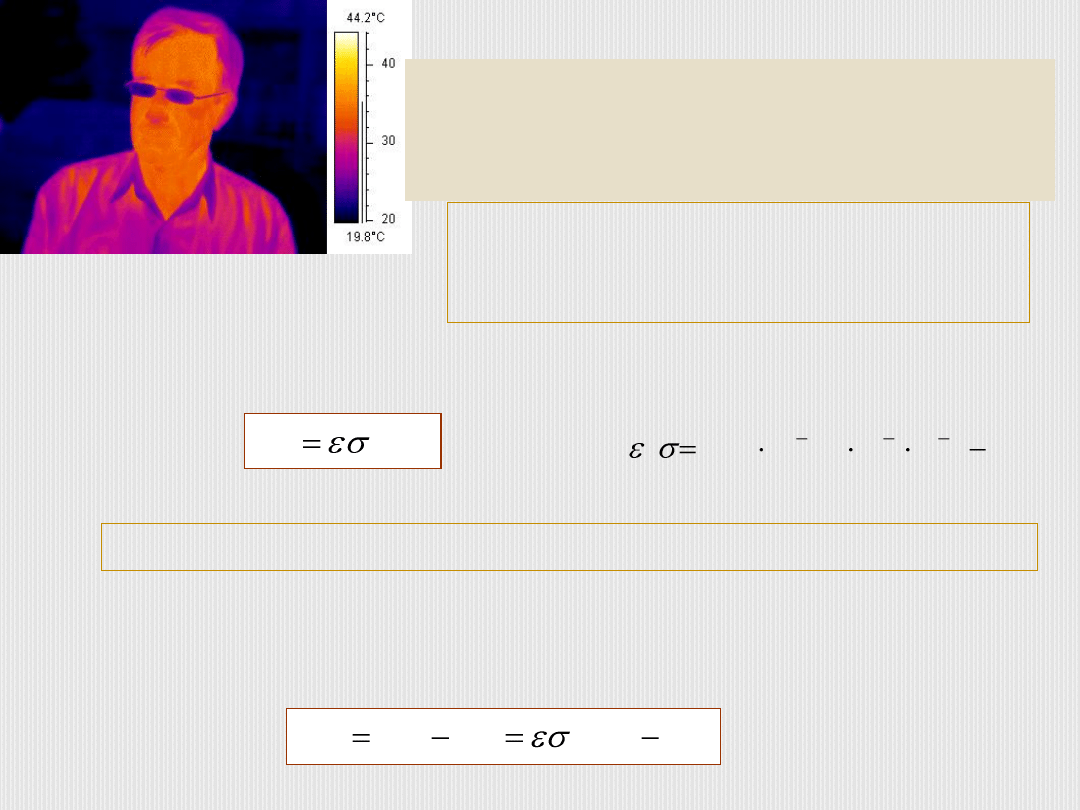
Moc promieniowania emitowanego przez ciało w postaci fal elektromagnetycznych
jest wprost proporcjonalna do jego pola powierzchni S, temperatury T
4
:
,
4
T
S
P
em
to odpowiednio zdolność emisyjna powierzchni ciała oraz stała Stefana-Boltzmanna.
Z powyższego wzoru widać, że każde ciało emituje
promieniowanie cieplne.
Ciała również absorbują moc promieniowania z otoczenia o temperaturze T
o
.
Wypadkowa moc charakteryzująca wymianę energii z otoczeniem w postaci
promieniowania cieplnego wynosi:
4
2
8
K
m
W
10
67
,
5
,
gdzie
).
(
4
4
T
T
S
P
P
P
o
em
abs
wyp
Ciało ludzkie emituje
gównie fale z zakresu
podczerwieni

B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
12
Ciała o temperaturze ok. 800
o
C widzimy jako czerwono
żarzące się, więc oprócz fal z zakresu poczerwieni
wypromieniowują również światło widzialne. Im wyższa
temperatura ciała, tym więcej emituje światła widzialnego.

B. Oleś
13
Zachodzące samorzutnie w przyrodzie procesy są
przemianami
nieodwracalnymi
, tj. przebiegającymi tylko w jednym kierunku,
który nie może ulec zmianie za pomocą niewielkich zmian w
otoczeniu.
Rozlane mleko nie wpłynie z powrotem do
kubka, a rozbite jajko nie „wskoczy” do
skorupki.
Miarą nieuporządkowania jest
entropia S układu
i jej zmiana
S wyznacza kierunek przemiany nieodwracalnej .
W wyniku przemiany nieodwracalnej zachodzącej w układzie
zamkniętym entropia S tego układu wzrasta.
Zmiana entropii
:
,
'
)
(
)
(
0
B
A
k
T
Q
d
A
S
B
S
S
gdzie A i B oznaczają stany układu.
1.8. Entropia i przemiany nieodwracalne
Procesy w przyrodzie zachodzą od stanów mniej prawdopodobnych
do stanów bardziej prawdopodobnych, przy czym im większy chaos i
brak uporządkowania, tym stan jest bardziej prawdopodobny.
S
0
S
k
Wykład 12 Wydz.Chemii PK, 2009/10

B. Oleś
14
Wydział Entropii
Wykład 12 Wydz.Chemii PK, 2009/10
B. Oleś
15
Entropia jest
funkcją stanu
, podobnie jak energia wewnętrzna U.
Zmiana entropii S nie zależy od przemiany łączącej dwa stany.
W celu obliczenia S można przemianę nieodwracalną zastąpić
przemianą odwracalną łączącą dwa stany A i B.
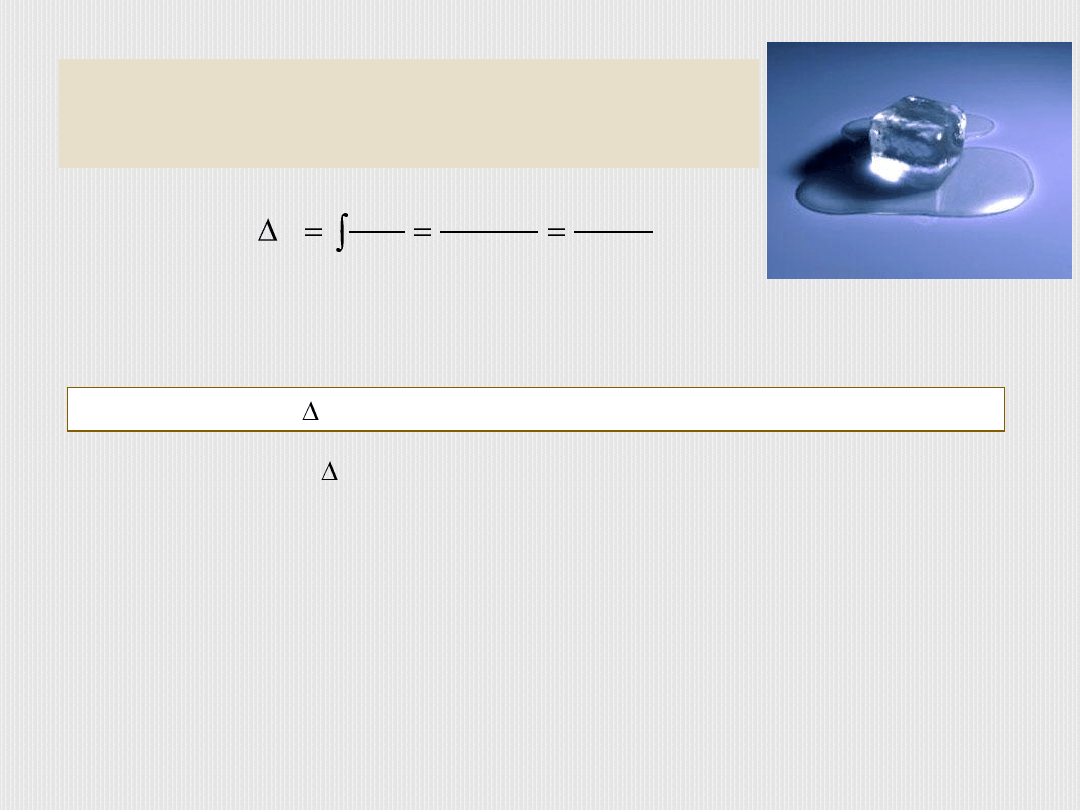
Np. do stopienia kawałka lodu o masie m trzeba
dostarczyć ciepła Q=c
przem
m. Topnienie zachodzi
przy stałej temperaturze T=273K, więc wzrost S:
.
273
'
top
przem
K
m
c
T
m
c
T
Q
d
S
B
A
Wykład 12 Wydz.Chemii PK, 2009/10

B. Oleś
16
Druga zasada termodynamiki
:
Jeżeli przemiana zachodzi w układzie zamkniętym, to entropia układu
wzrasta i nie zmienia się w przypadku przemiany odwracalnej.
Entropia nigdy nie maleje:
S
0
Silnikiem cieplnym
nazywamy urządzenie,
które pobiera ciepło z otoczenia i wykonuje
użyteczną pracę.
Działanie silników oparte jest na powtarzającym się cyklu przemian
termodynamicznych, którym poddana jest substancja robocza.
W idealnym silniku procesy są odwracalne i nie zachodzą straty
energii. Jego przykładem jest
silnik Carnota
, w którym substancja
roboczą jest gaz idealny.
Chcemy obliczyć
sprawność silnika
:
|
|
|
|
pobrane
uzyteczna
Q
W
1.9. Druga zasada termodynamiki
Wykład 12 Wydz.Chemii PK, 2009/10
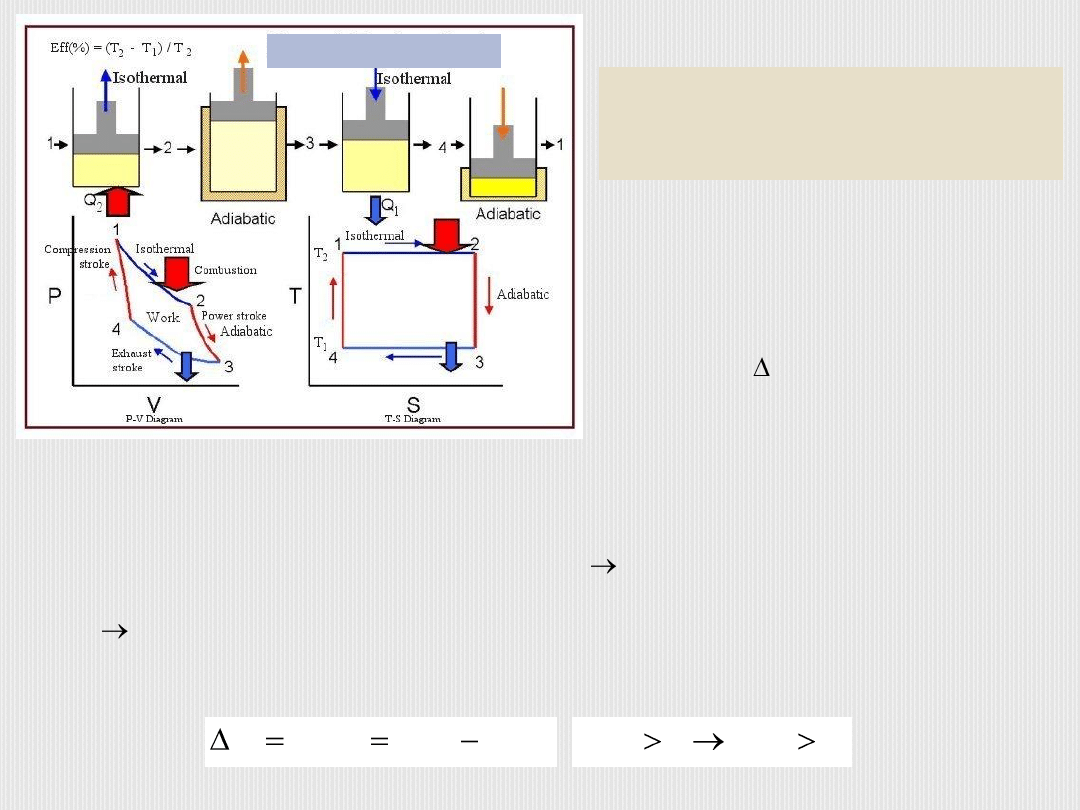
B. Oleś
17
Cykl Carnota składa się z dwóch
przemian izotermicznych
i dwóch
adiabatycznych
, którym podlega gaz doskonały (ciało robocze).
Podczas izotermicznego rozprężania (A B) gaz pobiera ciepło Q
1
ze
źródła ciepła o temperaturze T
1
, a podczas izotermicznego sprężania
(C
D) gaz oddaje ciepło Q
2
chłodnicy o temperaturze T
2
.
Z pierwszej zasady termodynamiki zastosowanej do gazu w całym
cyklu:
,
0
,
0
calk
calk
W
Q
U
,
0
0
calk
calk
Q
W
Cykl Carnota
Wykład 12 Wydz.Chemii PK, 2009/10
Przemiana izotermiczna
gazu
zachodzi przy stałej temperaturze,
T=const.
Jeśli układ nie wymienia ciepła z
otoczeniem Q=0, mamy do
czynienia z
przemianą
adiabatyczną
.
Proces cykliczny
to taki, w którym
układ wymieniając ciepło i
wykonując pracę, powraca do swego
stanu początkowego.
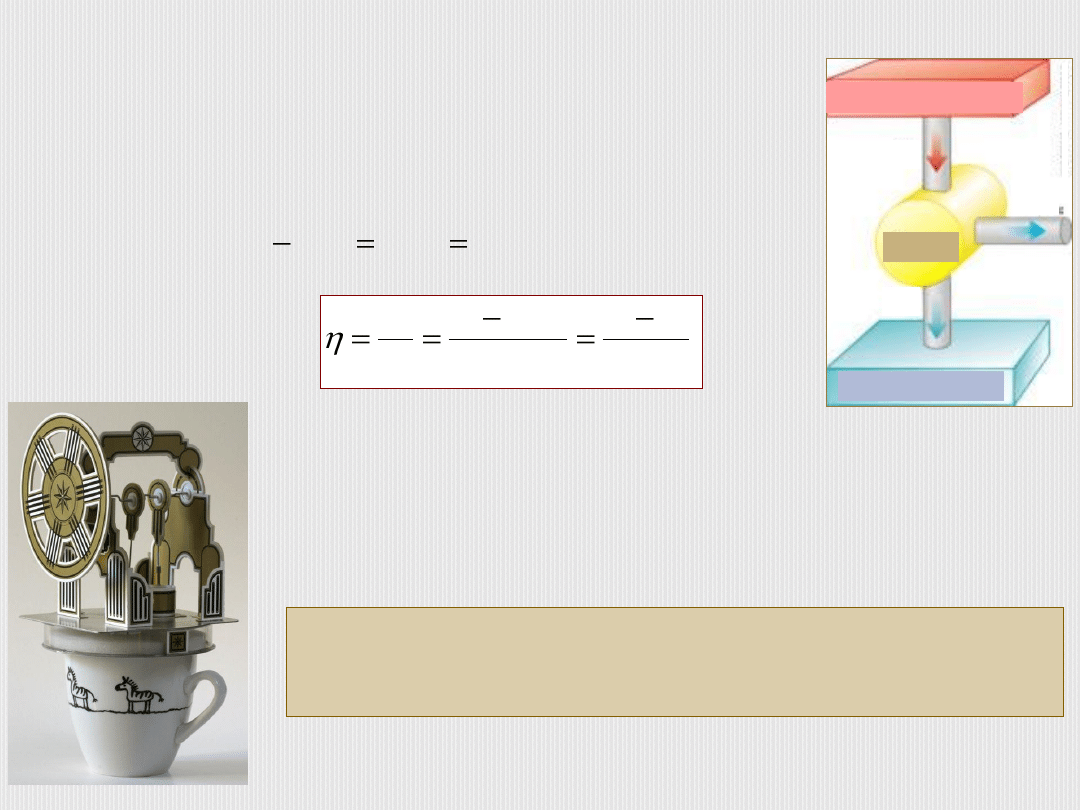
B. Oleś
18
Gaz wykonał pracę kosztem pobranego ciepła i nie całe
ciepło pobrane ze źródła zostało zamienione na pracę:
,
|
|
calk
2
1
W
W
Q
Q
.
|
|
1
2
1
1
2
1
1
T
T
T
Q
Q
Q
Q
W
Sprawności silników rzeczywistych są mniejsze.
Niemożliwe jest zbudowanie takiej maszyny, która
pobierałaby ciepło od jednego zbiornika i zamieniałaby
go całkowicie na pracę.
Inne sformułowanie drugiej zasady:
Zbiornik ciepła
chłodnica
silnik
Q
2
Q
1
W
Wykład 12 Wydz.Chemii PK, 2009/10
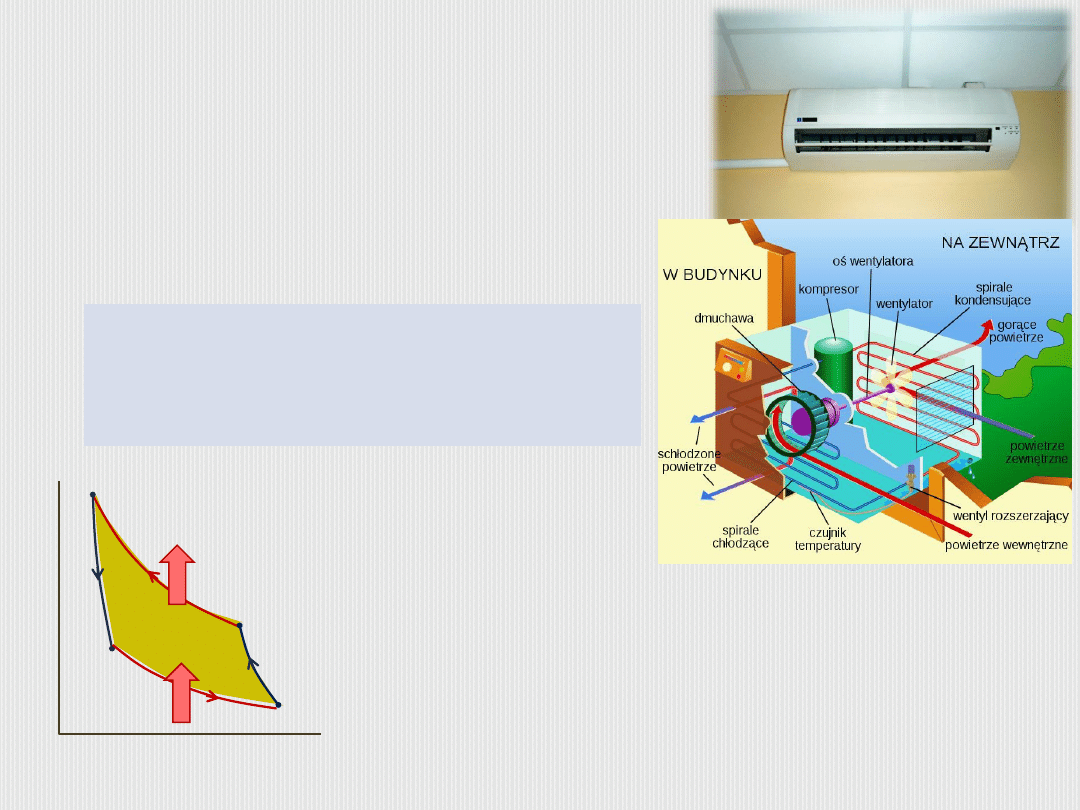
B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10 19
1.10. Jak działa chłodziarka ?
W chłodziarce, zasilana prądem elektrycznym sprężarka
wykonuje pracę, aby spowodować przepływ energii od
zbiornika o niższej temperaturze (komora chłodziarki) do
zbiornika o wyższej temperaturze (otoczenie).
W idealnej chłodziarce Carnota nie ma
rozpraszania energii, a wszystkie
procesy są odwracalne. Chłodziarka ta
jest odwróceniem silnika Carnota.
Substancja robocza zostaje poddana przemianie
cyklicznej: pobiera ze zbiornika o niższej tempera-
turze ciepło Q
2
i oddaje w postaci ciepła do zbiornika
o wyższej temperaturze Q
1
. Nad substancją roboczą
chłodziarki jest wykonana praca W (przez zewnętrz-
ne urządzenie).
p
V
W
T
1
T
2
T
1
> T
2
Q
1
Q
2
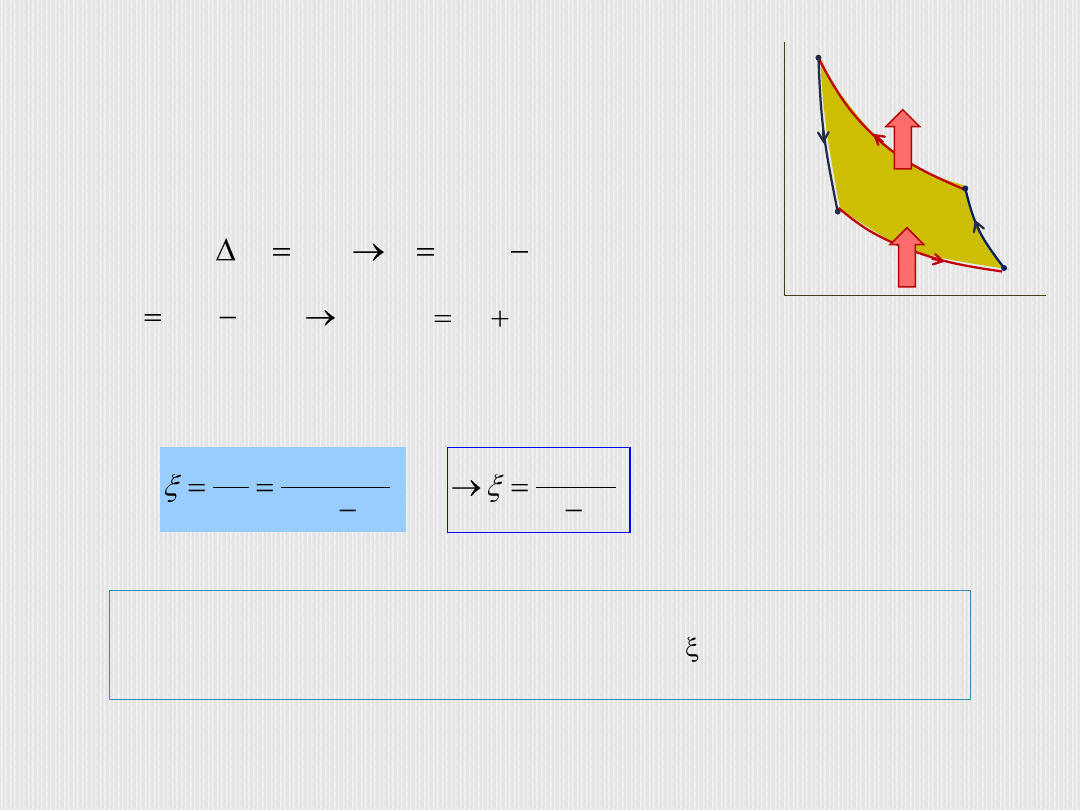
B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
20
Na przemianę cykliczną składają się dwie
przemiany izotermiczne i dwie adiabatyczne.
Sprawność chłodziarki, czyli skuteczność chłodzenia:
,
|
|
2
1
2
2
Q
Q
Q
W
Q
p
V
W
T
1
T
2
T
1
> T
2
Q
1
Q
2
2
1
|
|
Q
W
Q
.
2
1
2
T
T
T
Zauważmy, że skuteczność chłodziarki jest tym większa, im
mniejsza jest różnica temperatur oraz że może być większe
od 1 (dla lodówek ok. 5, klimatyzatorów ok.2,5).
Zmiana energii wewnętrznej w jednym cyklu:
,
0
,
0
calk
calk
W
Q
U
,
|
|
2
1
calk
Q
Q
Q

B. Oleś
Wykład 12 Wydz.Chemii PK, 2009/10
21
Dlaczego nie można zbudować idealnej chłodziarki, która
nie wymagałaby wykonywania pracy W?
W trakcie pełnego cyklu zmiana entropii substancji roboczej S
jest równa 0 (entropia jest funkcją stanu!)
Ale zmianie ulegają entropie zbiorników:
,
|
|
1
T
Q
S
Z
,
|
|
2
T
Q
S
C
zimnego
ciepłego
Zmiana entropii całego układu zamkniętego: chłodziarka +
zbiorniki cieplne wychodzi zatem ujemna!
,
0
|
|
|
|
1
2
T
Q
T
Q
S
U
A to jest sprzeczne z drugą zasadą termodynamiki!
Nie można przeprowadzić ciągu procesów, których jedynym
rezultatem byłoby oddanie energii w postaci ciepła przez
ciało chłodniejsze ciału cieplejszemu.
Wyszukiwarka
Podobne podstrony:
wykład 12 pamięć
Socjologia wyklad 12 Organizacja i zarzadzanie
Wykład 12(3)
Wykład 12
Wykład 12 Zarządzanie sprzedażą
Wykład 12 1
wyklad 12
Wyklad 1 12
wyklad 12 MNE
wykład 12
ZARZ SRODOWISKIEM wyklad 12
wykład 7 12
Wyklad 12 ppt
OPI wyklad 12 wersja 20080227 p Nieznany
Biochemia TZ wyklad 12 integracja metabolizmu low
więcej podobnych podstron