
Prof. dr hab. inż. Lech Chmurzyński
BLOK TEMATYCZNY
XII
DYSOCJACJA
ELEKTROLITYCZNA.
ELEKTROLITY

Według Svante Arrhenius'a (1887) procesowi
rozpuszczania wielu substancji towarzyszy rozpad
(dysocjacja) tej substancji na elektrycznie naładowane
produkty, czyli jony. Cząstki naładowane - jony - przewodzą
prąd elektryczny, a więc ich obecność można stwierdzić
mierząc
przewodnictwo elektryczne roztworu.
Mierząc przewodnictwa elektryczne roztworów
różnych substancji można je sklasyfikować w dwóch
podstawowych grupach:
1.
substancje tworzące roztwory przewodzące prąd -
elektrolity
2.
substancje nie przewodzące prądu po rozpuszczeniu -
nieelektrolity.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
HCl + H
2
O H
3
O
+
+ Cl
-
HCl + NH
3
NH
4
+
+ Cl
-
H
2
O + H
2
O H
3
O
+
+ OH
-
NH
3
+ NH
3
NH
4
+
+ NH
2
-
Mechanizm dysocjacji elektrolitów właściwych
E
k
= RT/2 = 300 cal/mol.
Ogólny podział elektrolitów:
1) elektrolity właściwe
- substancje zbudowane z jonów niezależnie
od stanu skupienia
2) elektrolity potencjalne
- substancje wytwarzające jony w reakcji
z rozpuszczalnikiem (a więc w stanie stałym nie przewodzą
prądu elektrycznego):

Solwatacja (hydratacja)
jonów polega on na
uporządkowaniu cząsteczek rozpuszczalnika wokół jonów
wskutek oddziaływania energetycznego i przestrzennego.
1.
Suma algebraiczna obu wartości (U + H
solw
) jest równa
obserwowa-
nemu (molowemu) ciepłu rozpuszczania.
Przyjmuje ono na ogół wartości małe (dodatnie lub
ujemne), np. dla
halogenków alkalicznych w zakresie –15 – +10 kcal/mol.
2.
Wartości ujemne ciepła rozpuszczania mogą być
wyjaśnione w
oparciu o fakt, że deficyty energii są kompensowane
przez wzrost
entropii układu substancja rozpuszczana –
rozpuszczalnik wskutek
czego zmiana entalpii swobodnej układu:
G = H - TS
jest wartością ujemną (oznacza to samorzutność
zachodzącego pro-
cesu).
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
Etapy procesu dysocjacji
1.
zbliżenie przeciwnie naładowanych biegunów dipoli
rozpuszczalnika
do jonu
2.
oddzielenie jonu od struktury sieci krystalicznej
połączone z solwa-
tacją.
Liczba koordynacyjna
– liczba cząsteczek rozpuszczalnika
otaczają-cych jon (inaczej liczba solwatacji (hydratacji).
Ogólnie:
solwatacja jonów – oddziaływania jonów z
rozpuszczalnikiem.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
Rozpuszczalniki polarne
– cząsteczki których
posiadają trwałe momenty dipolowe. Makroskopową
miarą polarności jest jego względna przenikalność
elektryczna ( - stała elektryczna). Woda ( = 80,6)
należy do najbardziej polarnych rozpuszczalników.
Solwatacja jonów
– elektrostatyczne oddziaływania
jonów z dipolami rozpuszczalnika. Skutkiem tych
samych
oddziaływań
jest
określona
orientacja
cząsteczek rozpuszczalnika wokół kationów i anionów.
Jest tzw. I przybliżenie: (jon – dipol trwały).
Wpływ właściwości rozpuszczalnika
na proces solwatacji
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
Podkreśleniem ogromnej roli oddziaływań jon –
rozpuszczalnik
jest
istnienie
grupy
elektrolitów
potencjalnych. W stanie czystym substancje te mają
budowę cząsteczkową (stan stały, ciekły lub gazowy), a
nie jonową i dopiero wskutek oddziaływań z
rozpuszczalnikiem ulega jonizacji polegającej na
całkowitym przesunięciu pary elektronowej w kierunku
atomu bardziej elektroujemnego (tzw. kontaktowej
pary jonowej), a dopiero potem solwatacji i dysocjacji
na jony:
Para jonowa nie bierze udziału w przewodnictwie
elektrycznym roztworu.
KA
jonizacja
K
+
A
- dysocjacja
K
+
A
+
-
para
jonowa
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

Oddziaływanie
jonów
z
rozpuszczalnikiem
(solwatacja) mają znacznie większy wpływ na
właściwości
roztworów
niż
oddziaływania
międzyjonowe. Solwatacja decyduje o właściwoś-ciach
roztworów elektrolitów, podczas gdy oddziaływania
mię-dzyjonowe właściwości te modulują.
Przykładowo:
Ciepło hydratacji NaCl wynosi 184,2 kcal/mol
gdy ciepło rozcieńczania tej substancji (odpowiadające
przejściu od roz-tworu o stężeniu 0.1 M do roztworu
nieskończenie rozcieńczo-nego) wynosi 0,08 kcal/mol.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
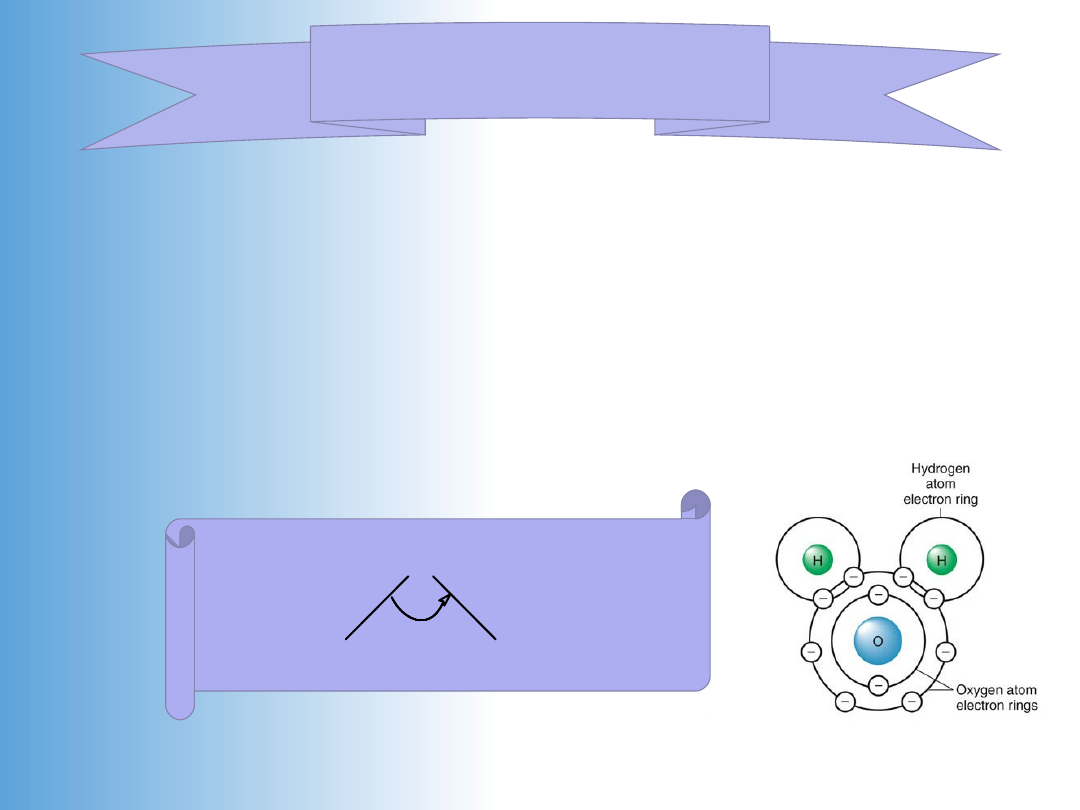
Podstawowe cechy wody jako rozpuszczalnika:
1.
jest
rozpuszczalnikiem
najbardziej
rozpowszechnionym w
przyrodzie
2.
wybitnie sprzyja jonizacji (duże ).
1.
struktura izolowanej cząsteczki wody
(model Bernala
i
Fowlera)
= 1.86 D (równy sumie wektorowej momentów
wiązań)
O
H
H
105o
0,97
0,97
A
A
o
o
+0,32e
+0,32e
o
o
-0,64eo
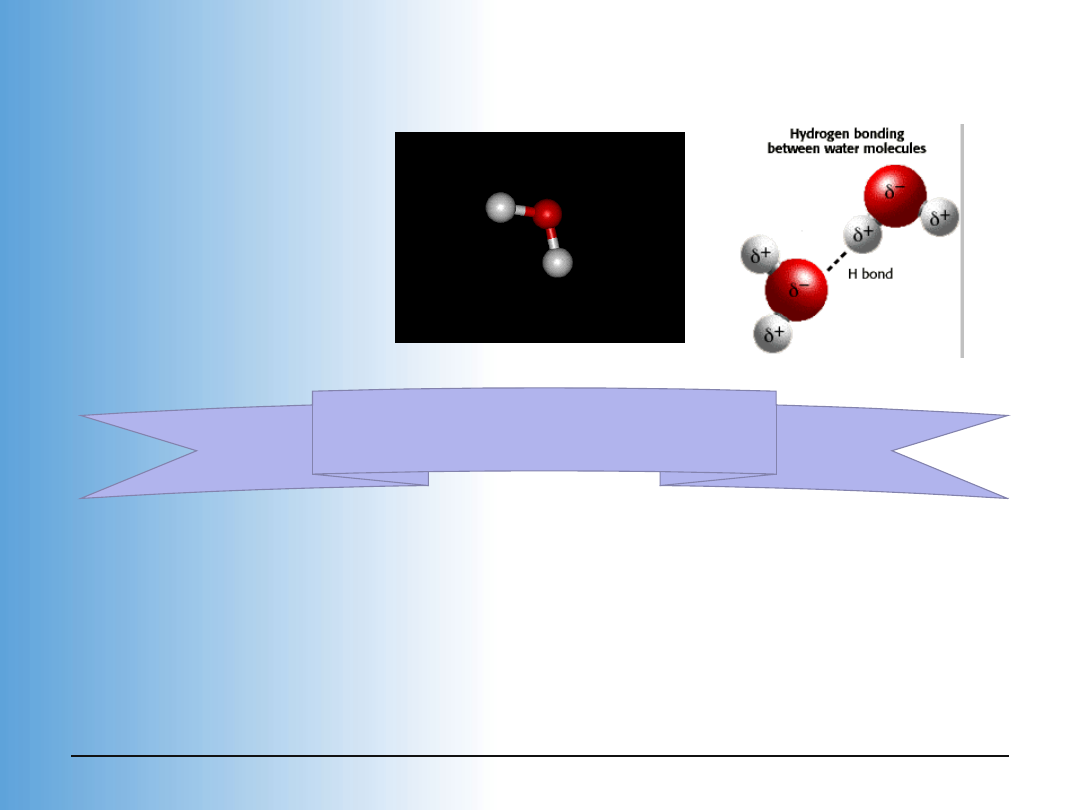
Woda i jej struktura
Uwzględniając tzw.
promienie van der waalsowskie
atomów tlenu i wodoru:
r
vdw
tlenu = 1.4 Å
r
vdw
wodoru = 1.2 Å
Tworzy kilka odmian polimorficznych. Odmiana trwała
w warunkach normalnych nosi nazwę lodu I:
- układ heksagonalny
- koordynacja tetraedryczna (każdy atom tlenu
znajduje się
w tetraedrycznym otoczeniu 4 innych atomu tlenu).
Woda w stanie stałym
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

1.
Struktura lodu I wykazuje istnienie dużych wolnych
przestrzeni „dziur” w sieci krystalicznej, a zatem
struktura lodu I jest bardzo luźna, daleka od
najgęściej upakowanej.
2.
Odległość między sąsiednimi atomami tlenu wynosi
2,76Å, podczas gdy odległość ta liczona jako suma
długości wiązania OH w izolowanej cząsteczce wody i
promieni van der Waalsa powinna wynosić 3,57Å.
Wskazuje to na obecność wiązań wodorowych, o
energii E
H2O
= 5kcal/mol, które są czynnikiem
stabilizującym strukturę I wody.
3.
Entropia wody stałej w temperaturze 0 K jest
większa od 0 (w przybliżeniu 2 cal/mol). Jest to dowód
na niecałkowicie uporządkowaną strukturę - każdy
proton ma dwa możliwe położenia równowagi
(różniące się nieznacznie energią).
HB
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

1.
Anomalne zmiany gęstości wody: w temp. topnienia
gęstość wody (0.99987 g/cm
3
) jest o około 8% większa
od gęstości lodu i wzrasta do temp. 4
o
C, a następnie
maleje ze wzrostem temperatury. Spowodowane to jest
tym, że w temp. topnienia zerwaniu ulega zaledwie ok.
15% wiązań wodorowych. Następnie wraz ze wzrostem
temperatury liczba tych wiązań przypadających na
jedną cząsteczkę wody szybko maleje.
2.
Lepkość wody zmniejsza się (zamiast zwiększać) wraz ze
wzrostem ciśnienia.
3.
Woda posiada (w porównaniu z innymi wodorkami, np.
NH
3
, HF, H
2
S) wysoką temperaturę topnienia oraz
wrzenia jak również duże ciepła topnienia i parowania.
Wniosek
:
:
Woda jest cieczą zasocjowaną - posiada strukturę quasi-
krystaliczną.
Woda ciekła - ciecz osobliwa
Ciepło solwatacji
– ciepło odpowiadająca przejściu:
elektrolit gazowy
w stanie standardowym
roztwór w stanie
standardowym
ciekły
rozpuszczalnik
Wyznaczanie ciepeł solwatacji
czyli jest to zmiana entalpii będąca skutkiem przeniesienia
1 mola elektrolitu z nieskończenie rozcieńczonej fazy
gazowej do nieskończenie rozcieńczonego roztworu w
danym
rozpuszczalniku.
Dla elektrolitu MX jest to ciepło procesu:
M
+
(g) + X
-
(g) + L(c) M
+
(r) + X
-
(r);
H
s
gdzie:
L - oznacza cząsteczkę rozpuszczalnika.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
Ciepeł solwatacji nie można wyznaczyć bezpośrednio.
Można je wyzna-czyć z ciepeł dwóch innych procesów:
1.
procesu rozpuszczania soli w nieskończenie dużej ilości
rozpuszczalnika:
MX(s) + L(c) M
+
(r) + X
-
(r);
H
r
2.
procesu przeprowadzenia 1 mola krystalicznej soli
nieoddziaływują-
ce na siebie jony gazowe
MX(s) M
+
(g) + X
-
(g); H
k
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

Proces solwatacji otrzymuje się przez odjęcie procesu (2)
od procesu (1). A więc na podstawie prawa Hessa:
H
s
= H
r
- H
k
gdzie:
H
r
–
pierwsze ciepło rozpuszczania - można wyznaczyć
kalorymetrycznie
H
k
= -U
(energia sieci krystalicznej) - wyznaczalna z cyklu Borna
- Habera
Ciepła solwatacji (hydratacji) są wielkościami addytywnymi
tzn. składają się addytywnie z udziałów poszczególnych
jonów. Można to sprawdzić np. tworząc różnice dla dwóch
soli o wspólnym jonie:
(H
LiCl
- H
LiF
)= (H
NaCl
- H
NaF
) lub
(H
KCl
- H
NaCl
)= (H
KBr
- H
NaBr
).
Z zależności tych nie można jednak wyznaczyć udziałów
poszczególnych jonów w wartości H solwatacji (hydratacji)
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

Model Borna obliczania ciepeł hydratacji poszczególnych
jonów
Założenia modelowe:
1)
jon jest sztywną naładowaną kulką
2)
rozpuszczalnik jest ośrodkiem ciągłym
charakteryzującym się wzglę-
dną przenikalnością elektryczną, której wartość nie ulega
zmianie pod
wpływem jonów
3)
oddziaływanie między jonem a rozpuszczalnikiem ma
wyłącznie cha-
rakter elektrostatyczny:
]
)
T
(
T
1
1
[
r
Z
e
z
N
H
)
1
1
(
r
Z
e
z
N
G
p
2
j
o
2
j
A
s
j
o
2
j
A
s
2
2

Równanie Borna posiada ono bardzo przybliżony charakter.
Wynika z niego, że ciepło solwatacji (hydratacji) co do
wartości bezwzględnej powinno być tym większe im wyższa
wartość jonu, im mniejszy jego promień i im wyższa
względna przenikalność elektryczna rozpuszczal-nika.
Ponadto stwierdzono, że wartości eksperymentalne są
zawsze większe od obliczonych.
Przyczyny odstępstw
:
1)
jony nie są sztywnymi kulkami, a ich promienie w
roztworze nie
muszą być takie same jak w krysztale
2)
rozpuszczalnik nie jest ośrodkiem ciągłym, lecz ma
strukturę czą-
steczkową
3)
względna przenikalność elektryczna w pobliżu jonów,
gdzie wystę-
puje bardzo silne pole elektryczne ulega zmniejszeniu
(wysycanie
elektryczne)
4)
obok oddziaływań elektrostatycznych występują siły
bliskiego za-
sięgu.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

STRUKTURA OTOCZEK SOLWATACYJNYCH
JONÓW
W roztworach wodnych wyróżniamy trzy strefy:
1)
strefa unieruchomionych i zorientowanych
odpowiednimi dipolami cząsteczek wody
2)
strefa zniszczonej struktury rozpuszczalnika
(struktury quasi-krystalicznej wody)
3)
strefa normalnej, uporządkowanej ale
spolaryzowanej struktury rozpuszczalnika
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
Proton (H
+
) nie może istnieć w roztworze jako jon
swobodny (bar-
dzo mały promień przy jednostkowym ładunku, co
determinuje
bardzo duży potencjał jonowy).
Dowody istnienia jonu hydroniowego w roztworach
ubogich w
wodę lub uwodnionych kwasów w stanie stałym:
1) Hantzsch
- woda i amoniak są elektrolitami tego
samego typu w
bezwodnym H
2
SO
4
(i 2) czyli elektrolitami
binarnymi prawie
całkowicie zdysocjowanymi
NH
3
+ H
2
SO
4
NH
4
+
+ HSO
4
-
H
2
O + H
2
SO
4
H
3
O
+
+ HSO
4
-
HYDRATACJA JONU WODOROWEGO

2.
badania roztworów HBr w ciekłym SO
2
a)
rozpuszczalność wody w ciekłym SO
2
znikomo mała
b)
w obecności HBr rozpuszczalność równa ilości moli HBr,
a
powstały roztwór dobrze przewodzi prąd elektryczny, a
jednocześnie wiadomo, że
roztwór HBr w SO
2
prądu nie
przewodzi
; stąd:
HBr + H
2
O H
3
O
+
+ Br
-
3.
badania spektroskopowe uwodnionych kwasów; np.
NMR
monohydratów HClO
4
i HNO
3
udowodniły strukturę typu:
H
3
O
+
ClO
4
+
.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii
Z drugiej jednak strony stwierdzono brak obecności w
widmach
oscylacyjnych (IR) stężonych wodnych roztworów
kwasów pasm
charakterystycznych, które można by przypisać jonowi
H
3
O+, co
może oznaczać:
1.
brak tego indywiduum
2.
zbyt mała kinetyczna trwałość (niedostatecznie
długi czas
życia)
Nadmiarowy proton w kompleksie H
9
O
4
+
nie jest
związany z jedną cząsteczką wody, lecz bardzo szybko
przeskakuje od jednej cząsteczki do drugiej.
O
H
H
H
O
O
O
H
H
H
H
H
H

Istnieje
szereg
dowodów
eksperymentalnych
(pośrednich) potwierdzających istnienienie takiego jonu,
ale brak dowodów bezspornych; np.:
1.
Ekstrakcja kwasów z roztworów wodnych za pomocą
rozpu-
szczalników organicznych (etery, ketony itp. ). Z każdym
protonem
do fazy organicznej przechodzą 4 cząsteczki wody.
2.
Spektroskopia masowa: podczas jonizacji pary wodnej
głównym
kationem jest H
9
O
4
+
3.
Funkcja Hammeta.
NAJNOWSZY MODEL JONU HYDRONIOWEGO
(ZUNDELA)
Zundel: H
5
O
2
+
(IR) - kwas polistyrenowy
Ogólnie
: umowność modelu jonu hydroniowego.
Prof. dr hab. inż. Lech Chmurzyński – Uniwersytet Gdański - Wydział Chemii

Tytuł kolejnego wykładu:
WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW. MODEL
CHMURY JONOWEJ DEBYE’A – HUCKEL’A. ELEKTROLITY
SŁABE. MIESZANINY ELEKTROLITÓW
Prof. dr hab. inż. Lech Chmurzyński
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
wykład 12 pamięć
Socjologia wyklad 12 Organizacja i zarzadzanie
Wykład 12(3)
Wykład 12
Wykład 12 Zarządzanie sprzedażą
wyklad 12
Wyklad 1 12
wyklad 12 MNE
wykład 12
ZARZ SRODOWISKIEM wyklad 12
wykład 7 12
Wyklad 12 ppt
OPI wyklad 12 wersja 20080227 p Nieznany
Biochemia TZ wyklad 12 integracja metabolizmu low
Metodologia - wykład 5.12.2010 - dr Cyrański, Metodologia nauk społecznych
więcej podobnych podstron