Chemia organiczna – chemia związków węgla
Synteza pierwszego organicznego związku (mocznika) 1828 r.
Hybrydyzacja atomów węgla:
sp
3
, sp
2
, sp
Typy wiązań;
σ
(wiązanie pojedyncze),
π
(podwójne i potrójne)
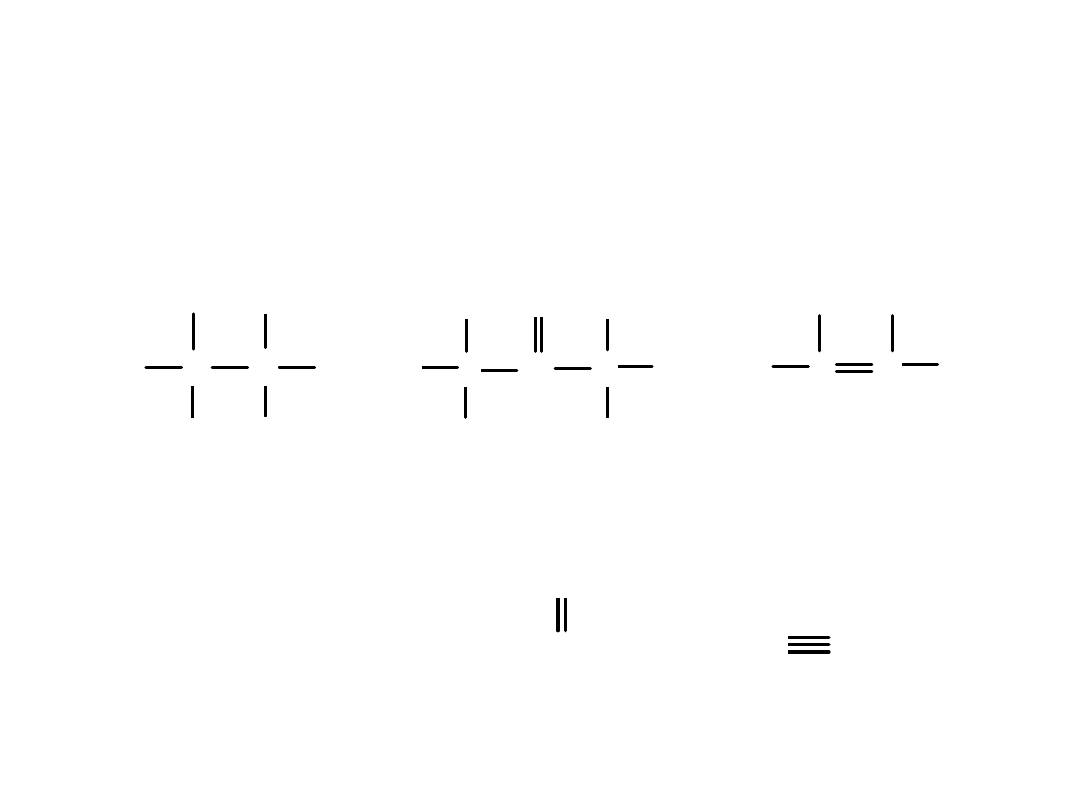
Budowę cząsteczek przedstawia się za pomocą
wzorów strukturalnych
np.:
C
C
H
H
H
H
H
H
C
C
C
H
H
H
H
H
H
O
C
C
H
H
H
H
etan
aceton
etylen
lub
uproszczonych wzorów strukturalnych
np.:
HC
CH
CH
3
CH
2
CH
3
CH
3
CCH
3
O
propan
aceton
acetylen

Węglowodory
– najprostsze związki organiczne składające się z atomów
węgla i wodoru:
Węglowodory
nasycone
(łańcuchowe i cykliczne)- zawierają tylko wiązania
pojedyncze σ
Nienasycone
(łańcuchowe i cykliczne) – zawierają co najmniej jedno wiązanie
wielokrotne
Aromatyczne
– benzen i jego wielopierścieniowe analogi
Alkany
(inaczej parafiny) – węglowodory nasycone o wzorze
C
n
H
2n+2
Alkany nierozgałęzione tworzą
szereg homologiczny
, w którym każdy kolejny
człon ma łańcuch dłuższy o jedną grupę CH
2
od członu poprzedniego:
CH
4
– metan
C
6
H
14
- heksan
C
2
H
6
– etan
C
7
H
16
- heptan
C
3
H
8
– propan
C
8
H
18
- oktan
C
4
H
10
– butan
C
9
H
20
- nonan
C
5
H
12
– pentan
C
10
H
22
– dekan

Alkany mogą mieć łańcuchy rozgałęzione zaczynając od alkanu C
4
H
10
.
CH
3
CH
2
CH
2
CH
3
CH
3
CHCH
3
CH
3
n-butan 2-metylopropan(izobutan)
Izomery są to związki o takim samym składzie ale o innej budowie
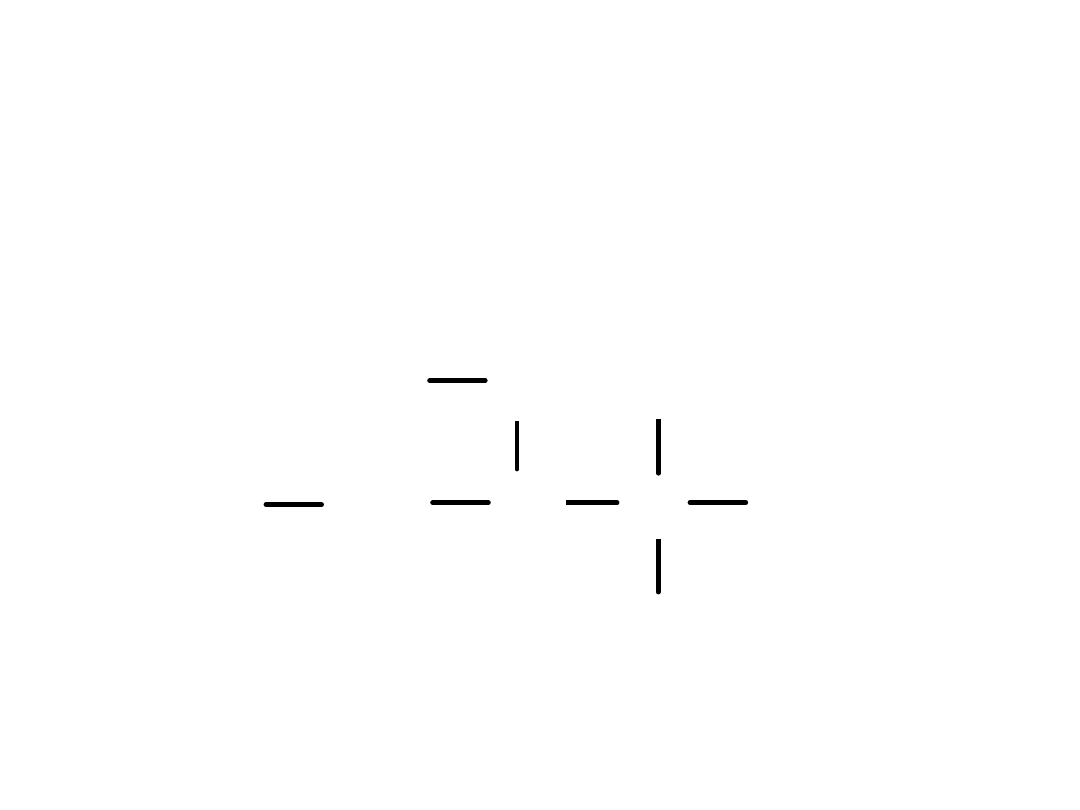
Atomy węgla w łańcuchu określa się jako pierwszorzędowe, drugorzędowe,
trzeciorzędowe lub czwartorzędowe, w zależności od tego z iloma innymi
atomami węgla są połączone:
Pierwszorzędowy
– atom węgla łączy się tylko z jednym atomem węgla
Drugorzędowy
– łączy się z dwoma atomami węgla
Trzeciorzędowy
- z trzema
Czwartorzędowy
– z czterema atomami węgla
CH
3
CH
2
CH
CH
3
CH
3
CH
2
H
3
C
C
CH
3
I-rz
II-rz
III-rz
IV-rz
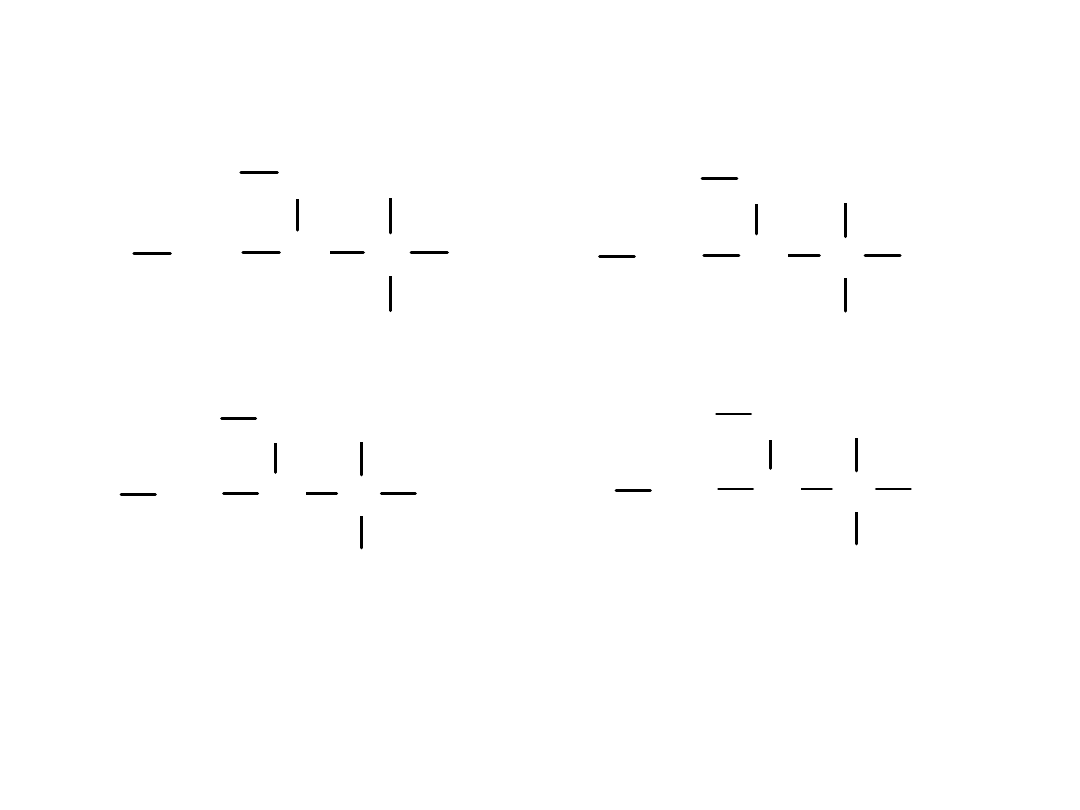
Nazewnictwo alkanów:
1. Znajdź najdłuższy łańcuch węglowy
2. Zacznij numerować od końca najbliższego pierwszemu rozgałęzieniu
CH
3
CH
2
CH
CH
3
CH
3
CH
2
H
3
C
C
CH
3
1
2
3
4
5
1
2
3
4
5
CH
3
CH
2
CH
CH
3
CH
3
CH
2
H
3
C
C
CH
3
1
2
3
4
5
CH
3
CH
2
CH
CH
3
CH
3
CH
2
H
3
C
C
CH
3
3-etylo- 2,2-dimetylopentan
dobrze
1
2
3
4
5
CH
3
CH
2
CH
CH
3
CH
3
CH
2
H
3
C
C
CH
3
3-etylo-4,4-dimetylopentan
Źle!!!
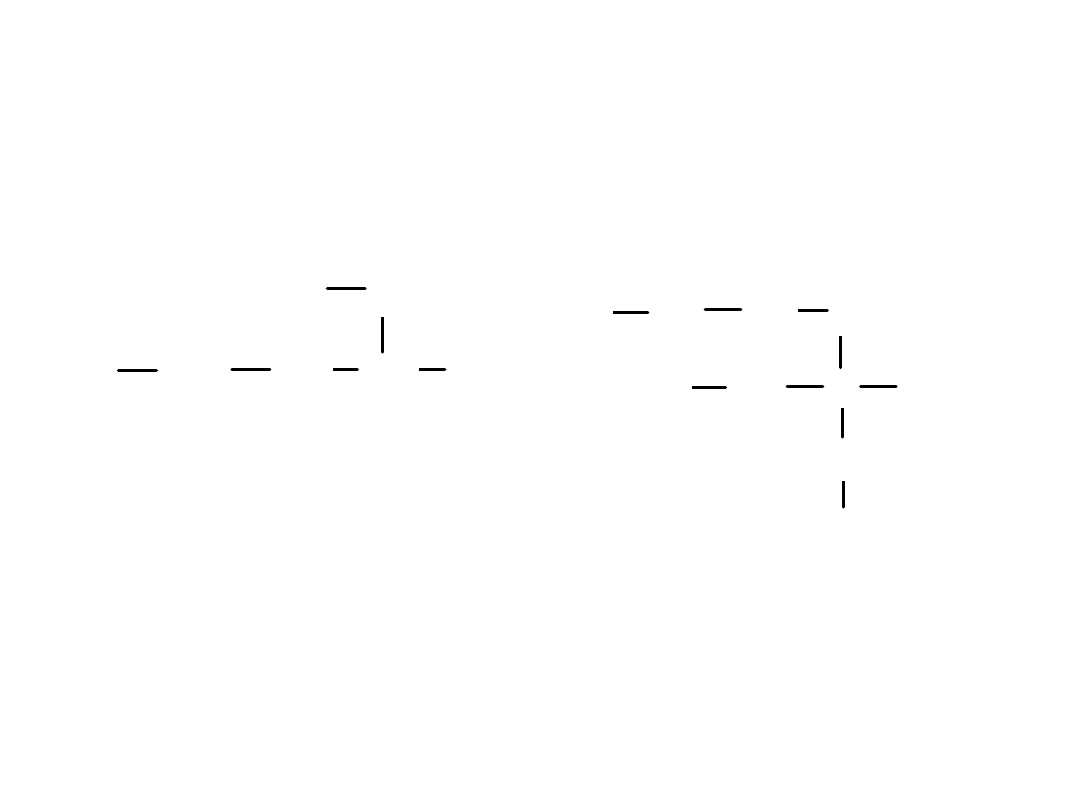
Mimo wielu możliwości wyboru najdłuższego łańcucha jest tylko jedna
poprawna nazwa związku.
Grupy alkilowe przyłączone do łańcucha głównego wymienia się
w
kolejności alfabetycznej
.
3-metyloheksan
1
2
3
4
5
CH
3
CH
2
CH
2
CH
3
CH
2
H
3
C
CH
6
1
2
3
4
5
CH
3
CH
2
CH
3
CH
2
C
6
CH
3
CH
2
CH
2
CH
3
CH
2
7
3-etylo-3-metyloheptan

Źródła naturalne alkanów:
Gaz ziemny
– metan, etan, propan, butan
Ropa naftowa
– składa się z setek alkanów głównie nierozgałęzionych,
a także cykloalkanów, węglowodorów aromatycznych i innych
związków zawierających tlen, azot i siarkę.
Benzyna
– składa się z węglowodorów alifatycznych (alkanów) C
5
-C
12
.
Posiada dodatek węglowodorów aromatycznych i eterów w celu polepszenia
liczby oktanowej.

Reakcje alkanów:
Związki mało reaktywne. Nie reagują ze stężonymi kwasami i zasadami.
Nie ulegają utlenieniu pod wpływem dichromianów ani nadmanganianu potasu.
Przyczyną małej reaktywności jest duża energia i mała polarność wiązań C-H i C-C.
Spalanie (utlenianie)
C
n
H
2n+2
+ O
2
(nadmiar) nCO
2
+ (n+1)H
2
O + ΔH(ciepło spalania)
Reakcje z fluorowcami
(substytucja rodnikowa)
Alkan + F
2
bardzo gwałtowna reakcja, także w temperaturze pokojowej
i w ciemności
Alkan + Cl
2
, Br
2
wymagana podwyższona temperatura lub naświetlanie UV (hν)
Alkan + I
2
reakcja nie biegnie
Chlorowanie metanu:
Cl
2
, hν lub Δt Cl
2
, hν lub Δt Cl
2
, hν lub Δt Cl
2
,
hν lub Δt
CH
4
--------------> CH
3
Cl ------------> CH
2
Cl
2
--------------> CHCl
3
-------------->CCl
4
-HCl -HCl -HCl
-HCl
chlorometan dichlorometan chloroform
tetrachlorometan

Rodnikowy mechanizm reakcji:
(Rodnik – atom lub cząsteczka zawierająca niesparowany elektron)
Etap 1
: inicjowanie łańcucha reakcji – dysocjacja cząsteczki chloru na 2 atomy
pod wpływem promieniowania UV lub temperatury
hν
Cl—Cl 2 Cl•
Etap 2
: wzrost łańcucha – atom chloru atakuje cząsteczkę metanu odrywając
od niej atom wodoru co prowadzi do utworzenia cząsteczki HCl
oraz rodnika metylowego
H
3
C—H + Cl• H
3
C• + HCl
etap najwolniejszy
Atak rodnika metylowego na cząsteczkę chloru i oderwanie od niej atomu chloru.
Tworzy się chlorometan i odtwarza atom chloru zdolny do reagowania z następną
cząsteczką metanu:
H
3
C• + Cl—Cl H
3
C—Cl + Cl•
Etap 3
: przerywanie łańcucha reakcji (terminacja)
Cl• + Cl• Cl–Cl
H
3
C• + Cl• H
3
CCl
H
3
C• + •CH
3
H
3
C–CH
3
Reakcje chlorowania alkanów są
nieselektywne
tzn atomy wodoru podstawiane są
przypadkowo przez atomy chloru.
W reakcji 1 mola
propanu
z 1 molem chloru każdy z 8 protonów może być
podstawiony atomem chloru.
C
C
C
H
H
H
H
H
H
H
H
C
C
C
H
H
H
H
H
H
H
Cl
H
C
C
C
H
H
H
H
H
H
Cl
+
Są 2 rodzaje protonów w propanie:
6 czerwonych
związanych z węglem
I-rzędowym
2 zielone
związane węglem II-rzęd.
Dlatego stosunek molowy produktów:
1-chloropropan:2-chloropropan
= 3:1
Cykloalkany C
n
H
2n
CH
2
CH
2
CH
2
CH
2
H
2
C
H
2
C
H
2
C
H
2
C
H
2
C
H
2
C
H
2
C
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
cyklopropan
cyklobutan
cyklopentan
cykloheksan
Pierścienie
cyklopropanu
i
cyklobutanu
są płaskie.
Cyklopentan
ma postać koperty.
Cykloheksan
występuje w konformacji krzesłowej (najtrwalsza),
łódkowej, skręconej łódki, półkrzesła
.
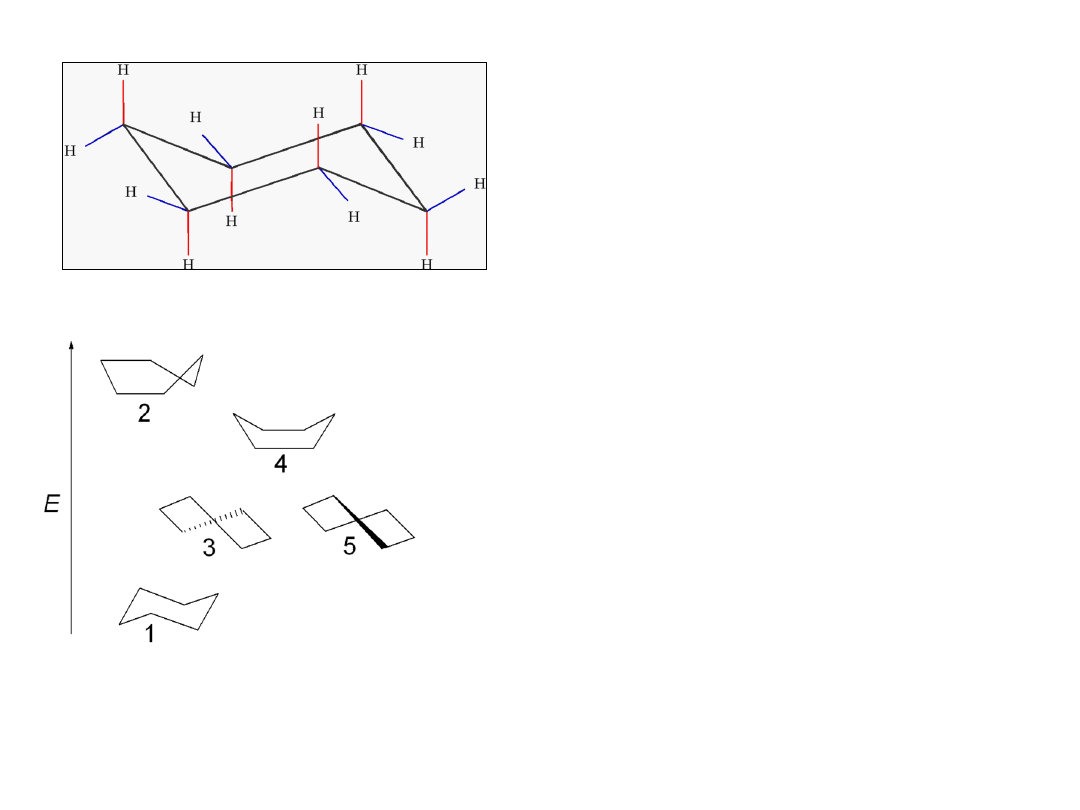
konformacja krzesłowa cykloheksanu;
kolor
czerwony
: wiązania C-H aksjalne;
kolor
niebieski
: wiązania ekwatorialne
Konformacje
pierścienia cykloheksanu
uszeregowane w zależności od energii
(oś pionowa)
1– krzesło
2 – pół-krzesło
3 – skręcona łódka
4 – łódka
5 – skręcona łódka
Konformacja krzesłowa ma najniższą energię,
dlatego jest najtrwalsza.
Konformery
mogą przekształcać się jeden w drugi
bez reakcji chemicznej.
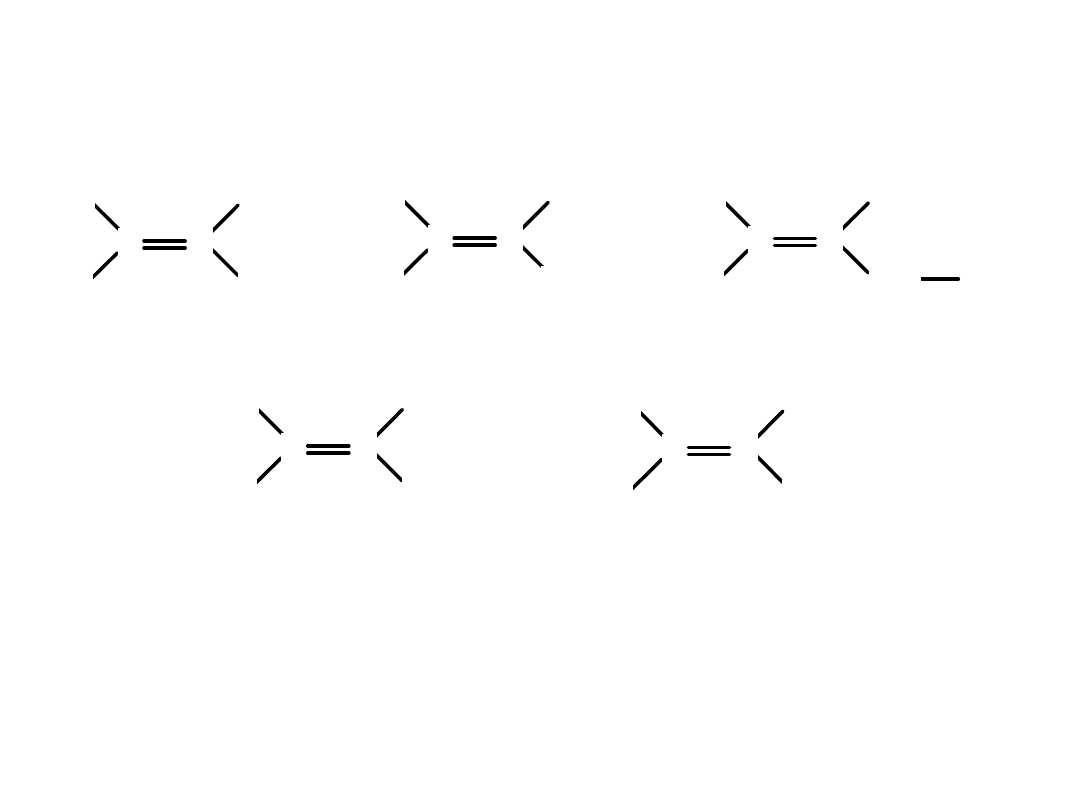
Węglowodory nienasycone – alkeny i alkiny
Alkeny (olefiny) – z jednym wiązaniem podwójnym C
n
H
2n
Alkiny – z jednym wiązaniem potrójnym C
n
H
2n-2
C
C
H
H
H
H
C
C
H
H
H
CH
3
C
C
H
H
H
CH
2
CH
3
Eten (etylen)
Propen (propylen)
But-1-en
C
C
H
H
CH
3
H
3
C
C
C
H
H
CH
3
H
3
C
Izomeria cis-trans
Cis –podstawniki leżą po tej samej stronie wiązania podwójnego
Trans - podstawniki leżą po przeciwnej stronie wiązania podwójnego
cis-but-2-en
trans-but-2-en
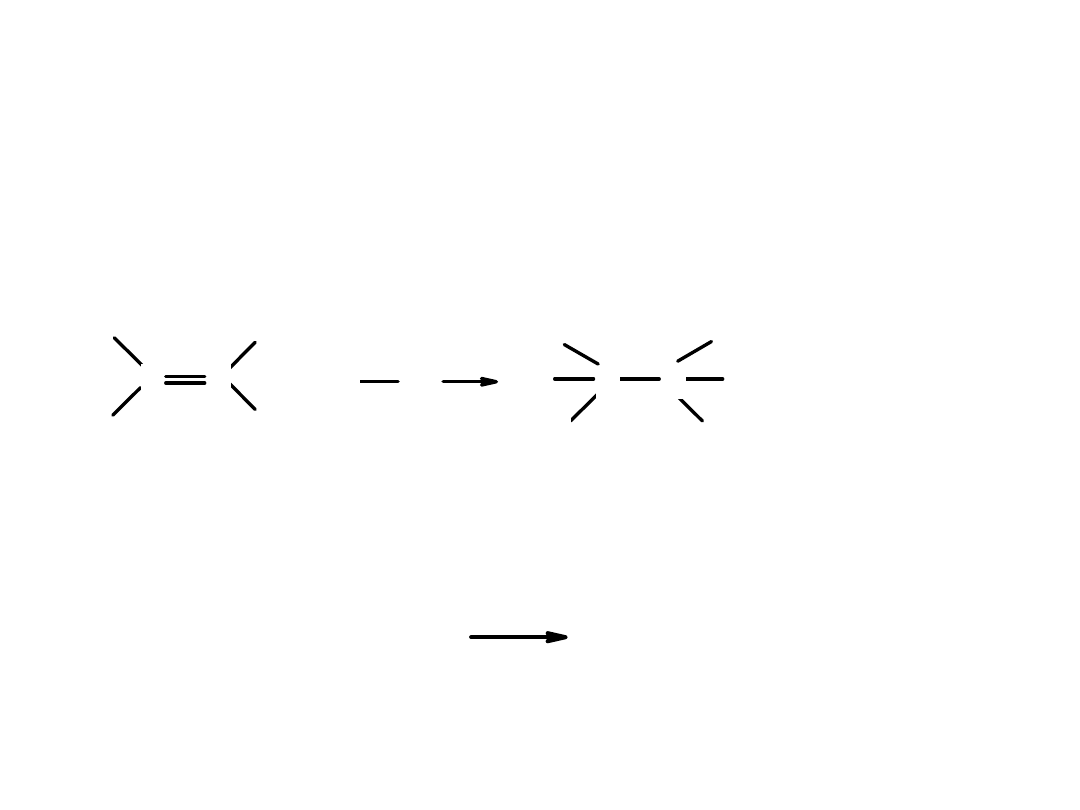
Buten może występować w postaci
3 izomerów
: but-1-en, cis-but-2-en, trans-but-2-en.
Izomery są różnymi związkami, mają różne właściwości np. temp. topnienia i wrzenia.
Nie można ich przekształcić jeden w drugi bez reakcji chemicznej.
Nazwy alkenów: z końcówką
–en
Reakcja alkenów:
1. Przyłączenie (addycja)
X
Y
+
C
C
C
C
Y
X
Przykłady addycji:
Uwodornienie
– przyłączenie do wiązania podwójnego cząsteczki wodoru
CH
3
CH=CHCH
3
CH
3
CH
2
CH
2
CH
3
H
2
Pt

Przyłączanie halogenowodorów i wody
Przyłączanie następuje według
reguły Markownikowa
-proton przyłączy się do tego atomu węgla w substracie, przy którym
znajduje się więcej atomów wodoru.
Inaczej: „bogaty” w wodory atom węgla będzie miał jeszcze więcej wodoru.
H
H
3
C
CH
CH
Br
CH
3
CH
3
CH=CHCH
3
+ HBr
W reakcji but-1-enu z HCl lub HBr tworzy się 2-chlorobutan (2-bromobutan) zgodnie
z regułą Markownikowa. 1-Chlorobutan (1-bromobutan) nie tworzy się.
H
3
C-CH
2
-CH=CH
2
+ HCl H
3
C-CH
2
-CH
Cl
-CH
3
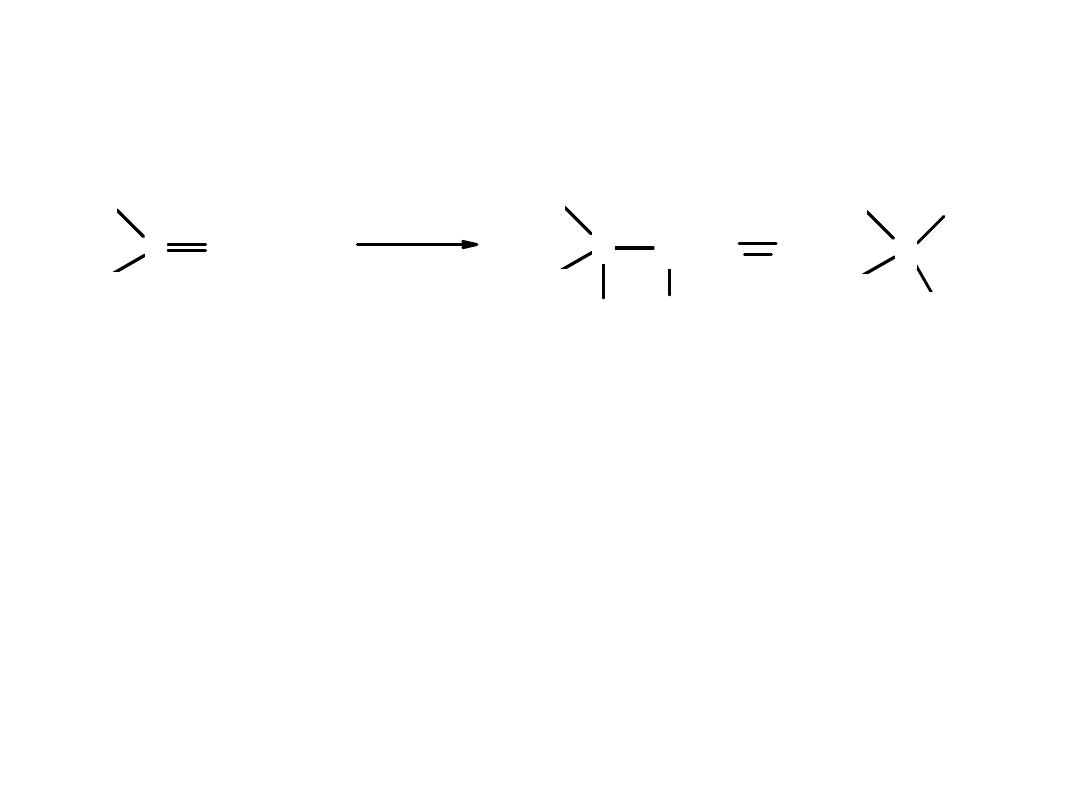
Przyłączenie
cząsteczki wody
do podwójnego wiązania:
Przyłączenie cząsteczki wody zachodzi
zgodnie z regułą Markownikowa
.
Grupa OH przyłącza się do węgla wyżej rzędowego a wodór do węgla,
przy którym jest więcej wodorów.
C
CH
2
H
3
C
H
3
C
CH
3
C
H
3
C
H
3
C
OH
2-metylo-prop-1-en
alkohol tert-butylowy
katalizator: kwas
+ H
2
O
H
+
C
CH
2
H
3
C
H
3
C
OH
H
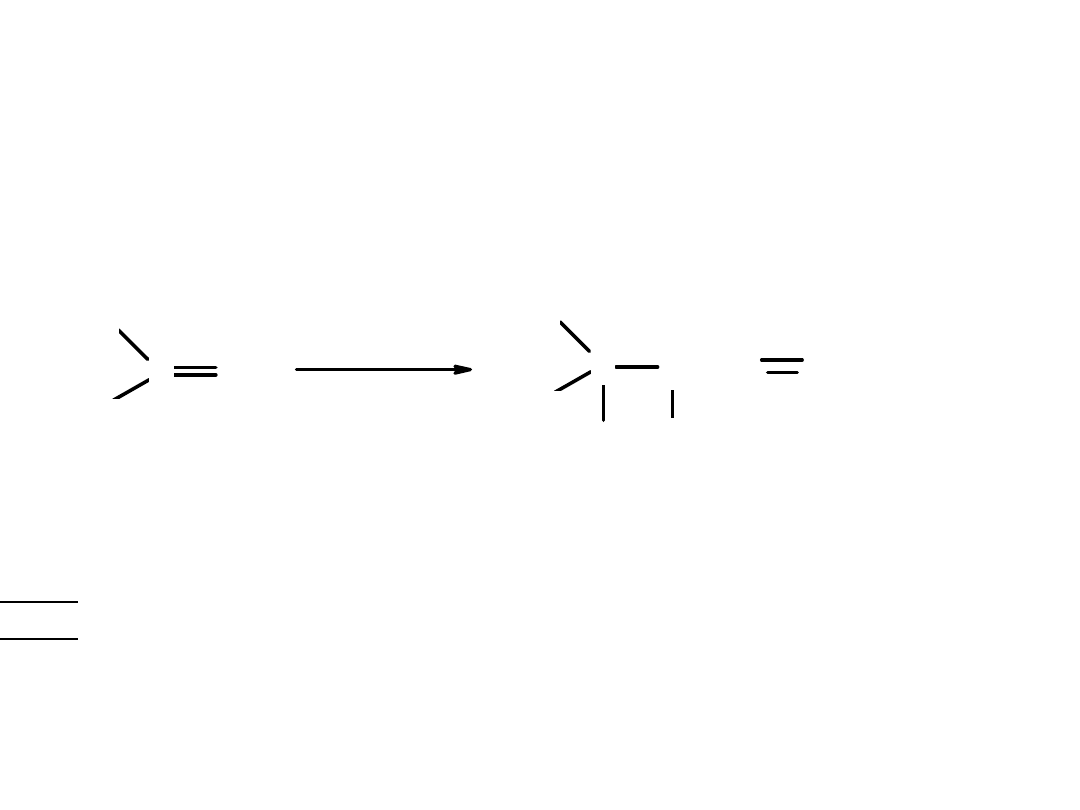
Przyłączenie Cl
2
lub Br
2
do podwójnego wiązania:
H
3
C-CH
2
-CH=CH
2
+ Cl
2
H
3
C-CH
2
-CH
Cl
-CH
2
Cl
Borowodorowanie
- przyłączenie cząsteczki wody
niezgodnie z regułą Markownikowa
2-metylopropan-1-ol
Alkohol izobutylowy
C
CH
2
H
3
C
H
3
C
1. BH
3
2. H
2
O/H
+
(CH
3
)
2
CHCH
2
OH
C
CH
2
H
3
C
H
3
C
H
OH
1 etap: utworzenie kompleksu z triwodorkiem boru BH
3
2 etap: reakcja kompleksu z wodą w obecności kwasu

Alkiny
Alkiny
– węglowodory łańcuchowe z jednym wiązaniem potrójnym.
Wzór sumaryczny C
n
H
2n-2
Acetylen (etyn), H-C≡C-H cząsteczka liniowa, Hybrydyzacja atomów węgla: sp
W porównaniu z etanem i etylenem, acetylen jest związkiem reaktywnym.
Otrzymywanie
:
CaC
2
+ 2 H
2
O HC≡CH + Ca(OH)
2
CaC
2
węglik wapnia, inaczej karbid otrzymywany w reakcji spiekania
CaO z koksem (C).
Reaktywność
:
Rozkłada się wybuchowo pod ciśnieniem wyższym niż 1,5 MPa (ok 15 atm).
Pali się w powietrzu silnie kopcącym płomieniem:
temp.
HC≡CH 2C + H
2
H
2
+ ½ O
2
H
2
O
Sumarycznie: HC≡CH + ½ O
2
2C + H
2
O
Pełne spalanie acetylenu wymaga dużego nadmiaru powietrza:
HC≡CH + 5/2 O
2
2 CO
2
+ H
2
O
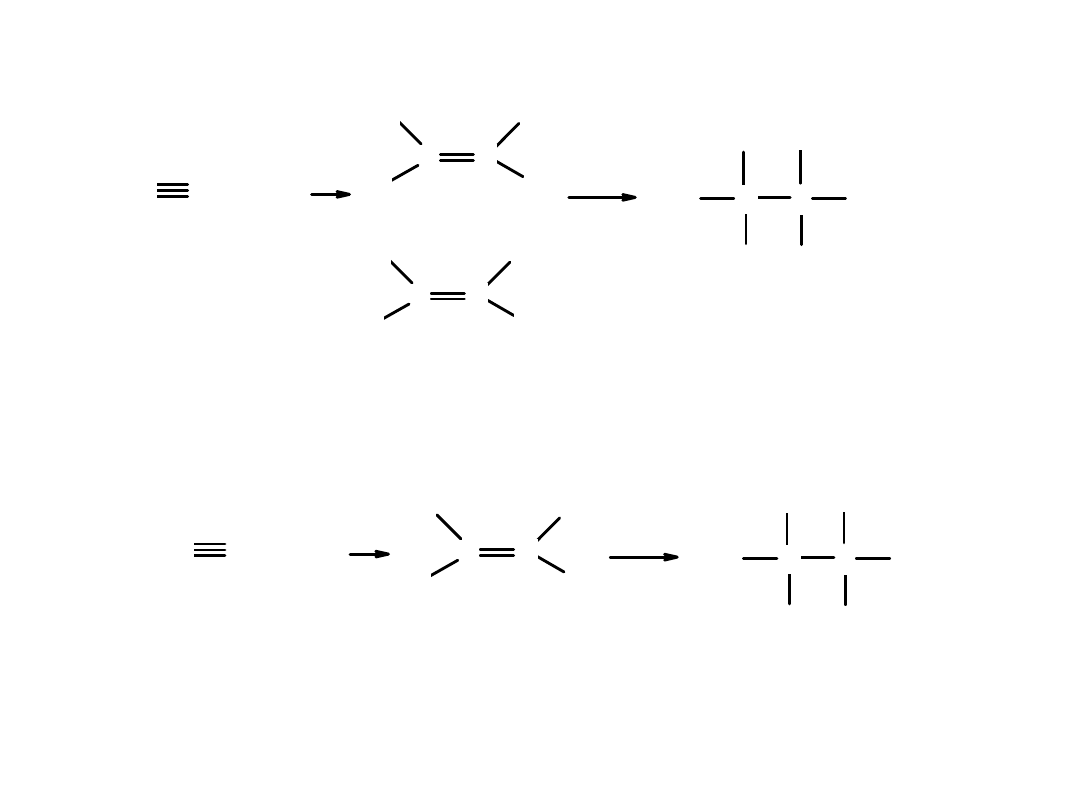
C
C
H
H
Br
Br
HC
CH + Br
2
C
C
Br
Br
Br
Br
H
H
C
C
H
H
Br
Br
trans
cis
Br
2
1,2-dibromoetan
1,1,2,2-tetrabromoetan
Przyłączanie wodoru:
H
H
H
2
HC
CH + H
2
C
C
H
H
kat.
kat.
C
C
H
H
H
H
H
H
etylen
etan
kat. = Ni lub Pt
Przyłączanie bromu do wiązania potrójnego
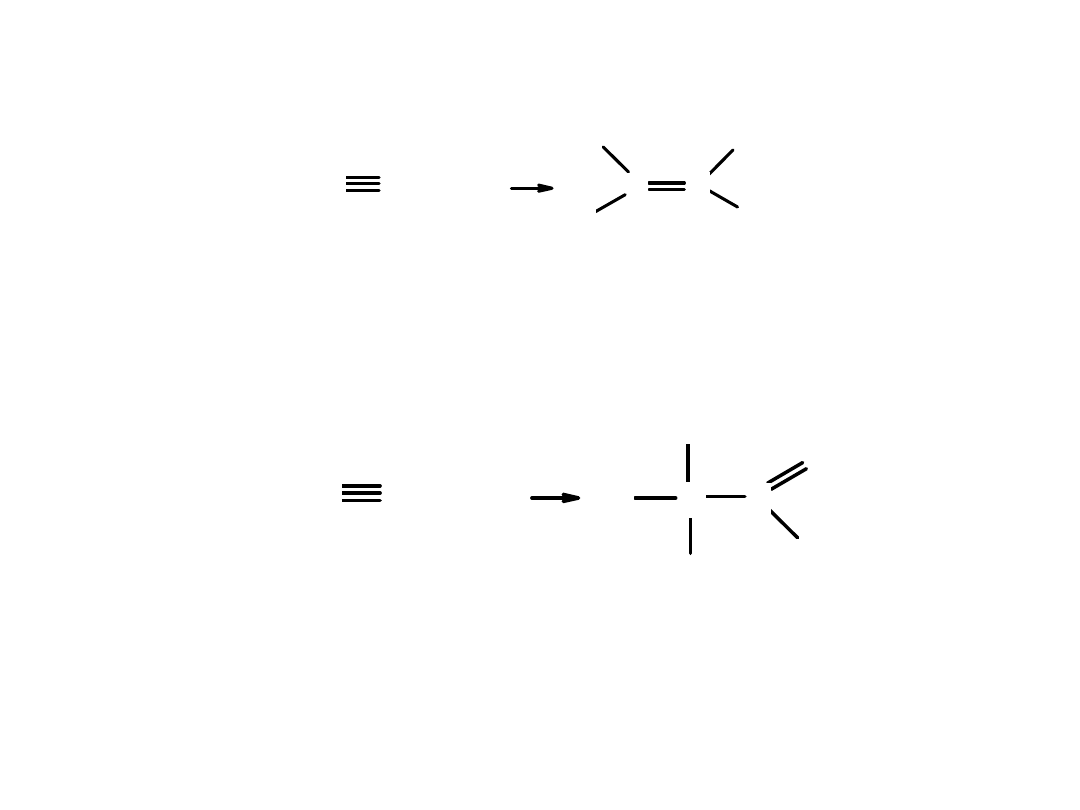
Przyłączanie chlorowodoru HCl:
H
H
HC
CH + HCl
C
C
H
Cl
chloroeten (chlorek winylu)
Chlorek winylu
– surowiec do otrzymywania tworzywa sztucznego
– poli(chlorku winylu) (PCV)
Reakcje o znaczeniu przemysłowym
Przyłączanie wody:
Aldehyd octowy
– ważny półprodukt w przemyśle organicznym
kat.
C
C
H
H
H
H
aldehyd octowy
HC
CH + H
2
O
O
kat = HgSO
4
+ H
2
SO
4
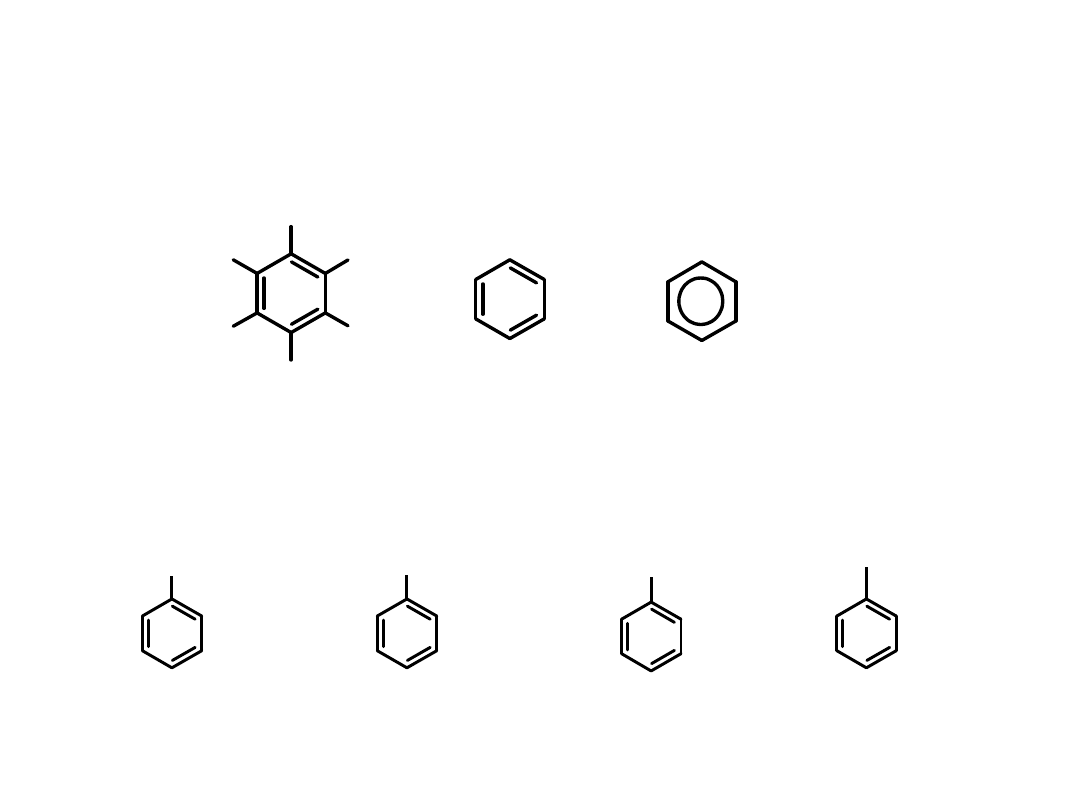
Węglowodory aromatyczne (benzen)
H
H
H
H
H
H
Sposoby przedstawienia cząsteczki benzenu
CH
3
NO
2
CH
2
CH
3
Cl
toluen
nitrobenzen
etylobenzen
chlorobenzen
Benzen odkryto w 1825 roku. Cykliczna budowa benzenu została zaproponowana
przez Kekule w 1865 r.
Szereg homologiczny acetylenu
:
HC≡CH etyn HC≡C-CH
3
propyn
HC≡C-CH
2
-CH
3
1-butyn CH
3
-C≡C-CH
3
2-butyn
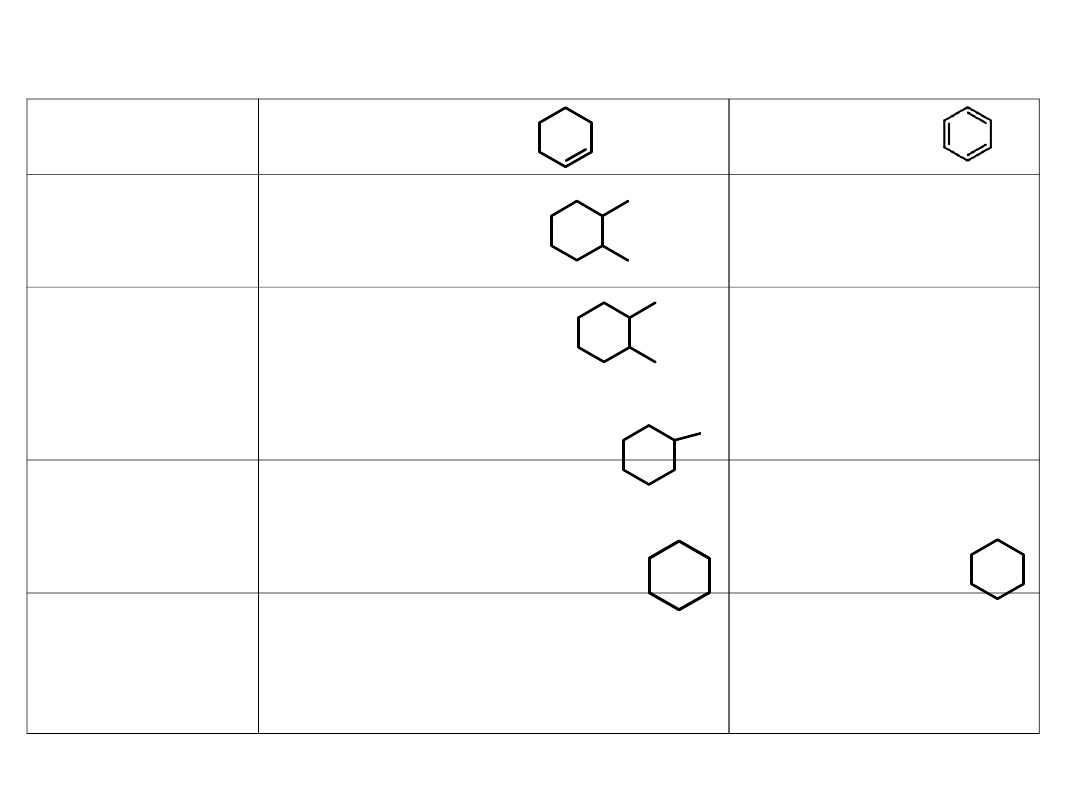
Własności benzenu są inne niż własności cyklicznych alkenów
odczynnik
Cykloheksen
Benzen
Wodny
roztwór
KMnO
4
Utlenienie w niskiej
temperaturze
do diolu
Reakcja
nie
zachodzi
Roztwór
bromu
w polarnym
rozpuszczalni
ku
Przyłączenie cząsteczki
bromu do podwójnego
wiązania
Reakcja
nie
zachodzi
Bromowodór
HBr
Przyłączenie HBr
do podwójnego wiązania.
Powstaje bromocykloheksan
Reakcja
nie
zachodzi
Wodór
+
metal
przejściowy
Ni, małe nadciśnienie, temp.
pokojowa,
Powstaje cykloheksan.
Ni, 150-250
o
C
150 atm,
Powstaje
cykloheksan
.
OH
OH
Br
Br
Br
Wniosek: wiązania między atomami węgla w benzenie są bardzo trwałe.
Właściwości cząsteczki benzenu:
Jest płaska, atomy węgla tworzą pierścień o kształcie sześciokąta foremnego
Wszystkie wiązania C-C mają jednakową długość
Wszystkie wiązania C-H mają jednakową długość, co oznacza, że w
cząsteczce
znajduje się 6 zdelokalizowanych elektronów
na wiążących orbitalach typu π
a nie 3 podwójne wiązania.
Związki aromatyczne są to substancje, których cząsteczki mają budowę
Pierścieniową (cykliczną) i zawierają wiązanie zdelokalizowane, łączące wszystkie
atomy tworzące pierścień.
Związek jest aromatyczny, jeżeli ilość zdelokalizowanych elektronów π wynosi
4n+2 (
reguła Hückla
).
Dla benzenu n = 1 (6 zdelokalizowanych elektronów)
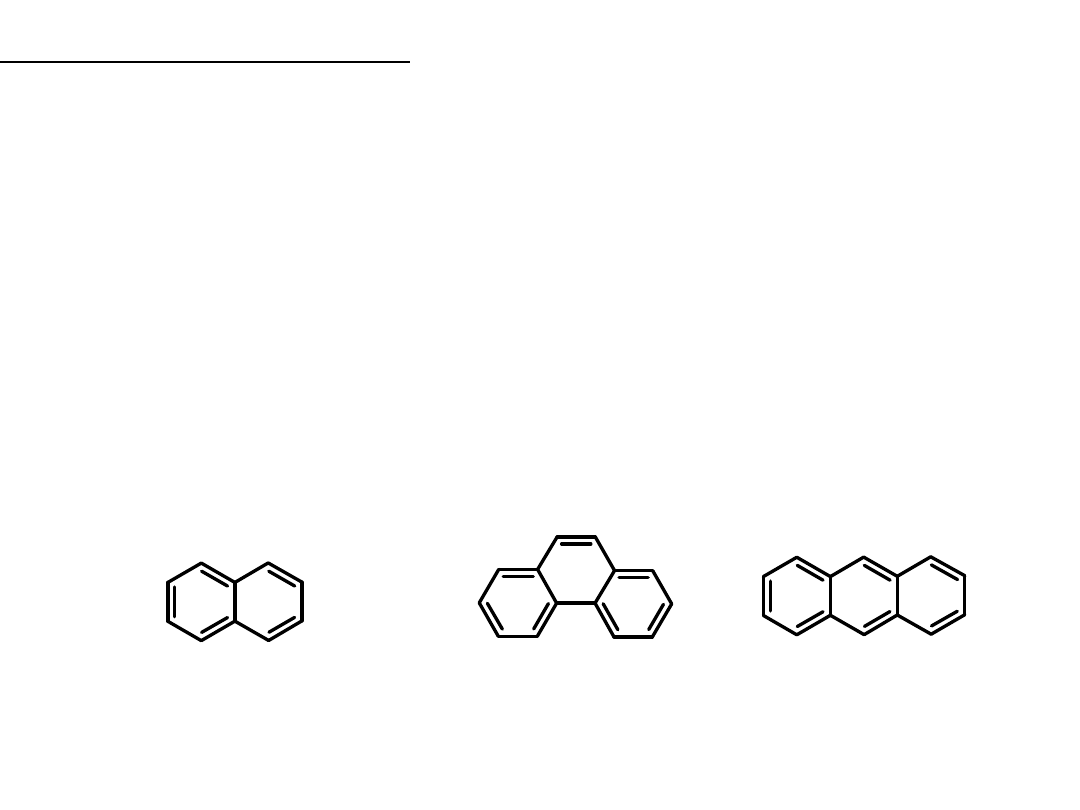
Inne związki aromatyczne:
Naftalen, 10 e π, n = 2 fenantren, 14 e, n = 3
antracen, 14 e, n = 3
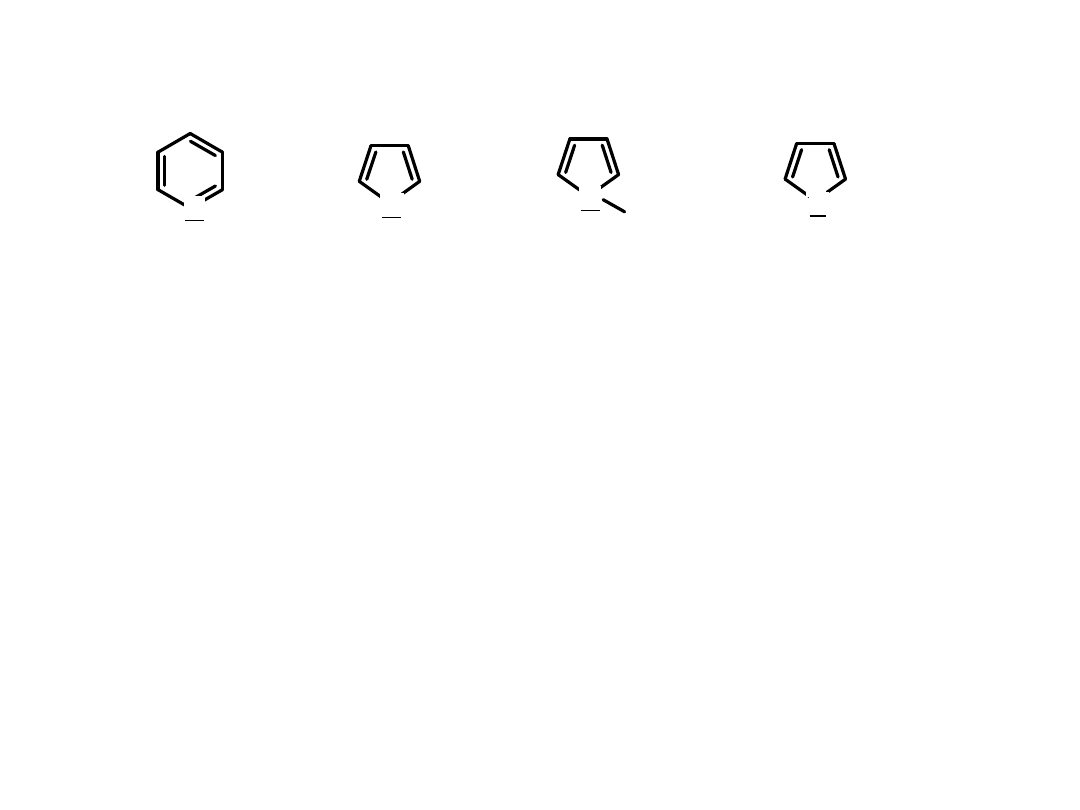
Inne związki aromatyczne, nie będące pochodnymi benzenu:
N
H
N
O
--
S
--
Pirydyna furan pirol tiofen
6 elektronów π, n = 2
Pochodzenie związków aromatycznych
:
1. W procesie
koksowania węgla
(wygrzewanie węgla w beztlenowej atmosferze)
otrzymuje się koks, gaz koksowniczy i smołę pogazową. W smole pogazowej
znajdują się: benzen, toluen, ksyleny, naftalen, antracen, fenantren.
2.
Reforming katalityczny w procesie przeróbki ropy naftowej
. Nasycone
węglowodory cykliczne i łańcuchowe w warunkach: 560
o
C, 20 atm, katalizator,
ulegają reakcjom odwodornienia, cyklizacji i izomeryzacji dając związki
aromatyczne.
Reakcja charakterystyczna dla związków aromatycznych:
Reakcja substytucji
(podstawienia)
elektrofilowej
. Polega na podstawieniu atomu
wodoru innym podstawnikiem.
Przykłady substytucji elektrofilowej:
Halogenowanie (chlorowanie lub bromowanie)
Br
+ Br
2
FeBr
3
+ HBr
W odróżnieniu od podobnej reakcji, której ulegają alkany, reakcja benzenu
z bromem może zachodzić w ciemności, ale wymaga użycia katalizatora.
Przyczyną jest odmienny mechanizm tych reakcji.
Elektrofil – cząstka obdarzona ładunkiem dodatnim a więc „
lubiąca elektrony
”
W reakcji chlorowania elektrofilem jest
Cl
+
, w reakcji bromowania
Br
+
.
Elektrofil tworzy się pod wpływem katalizatora.
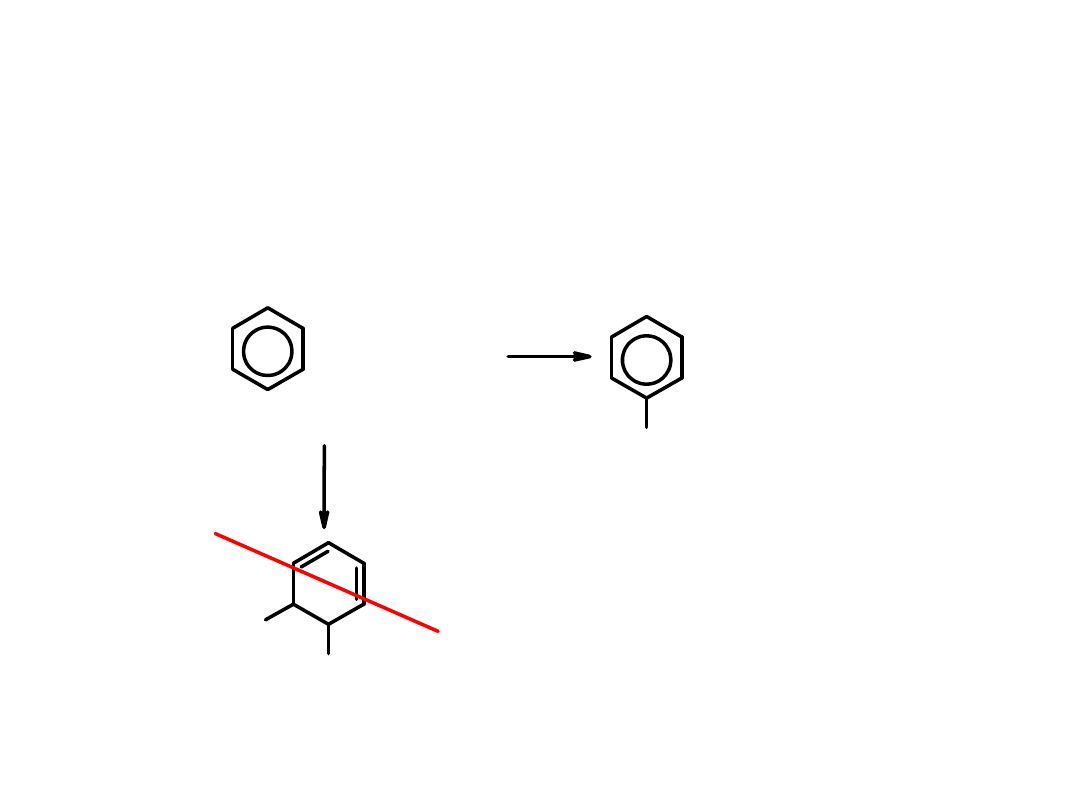
W alkenach następuje przyłączenie Br
2
do podwójnego wiązania,
natomiast w benzenie takie przyłączenie nie następuje. Zamiast tego następuje
oderwanie protonu
w postaci HBr, co prowadzi do powstania produktu
aromatycznego.
Zostaje zachowany korzystny energetycznie
aromatyczny układ 6 zdelokalizowanych elektronów
.
Br
Br
Br
+ Br
+
+ Br-
+ HBr
nie zachodzi
FeBr
3
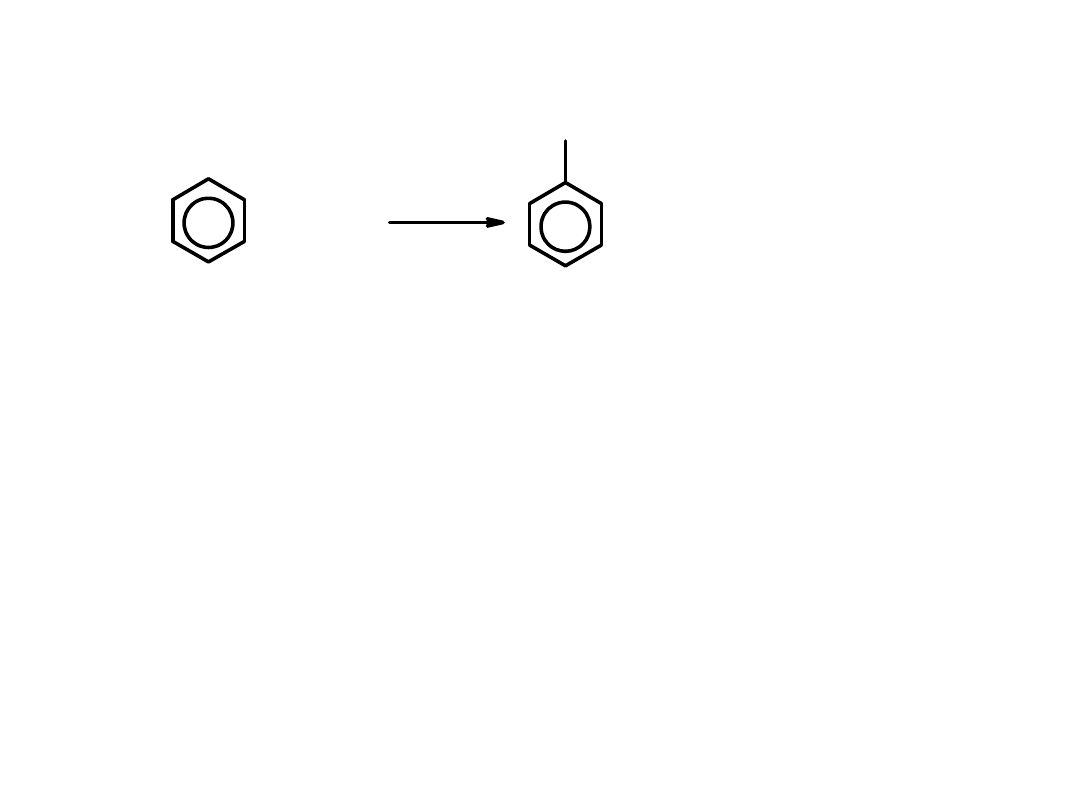
Reakcja nitrowania
benzenu:
+ HNO
3
H
2
SO
4
NO
2
+ H
2
O
Elektrofilem w tej reakcji jest
jon nitroniowy NO
2
+
,
który powstaje w reakcji
stężonego kwasu azotowego ze stężonym kwasem siarkowym
HNO
3
+ 2 H
2
SO
4
NO
2
+
+ 2 HOSO
3
¯ + H
3
O
+
nitrobenzen
Reakcja sulfonowania
benzenu:
S
O
OH
O
SO
3
kwas benzenosulfonowy
SO
3
- dymiacy kwas siarkowy - oleum - roztwor SO
3
w 100%
kwasie siarkowym
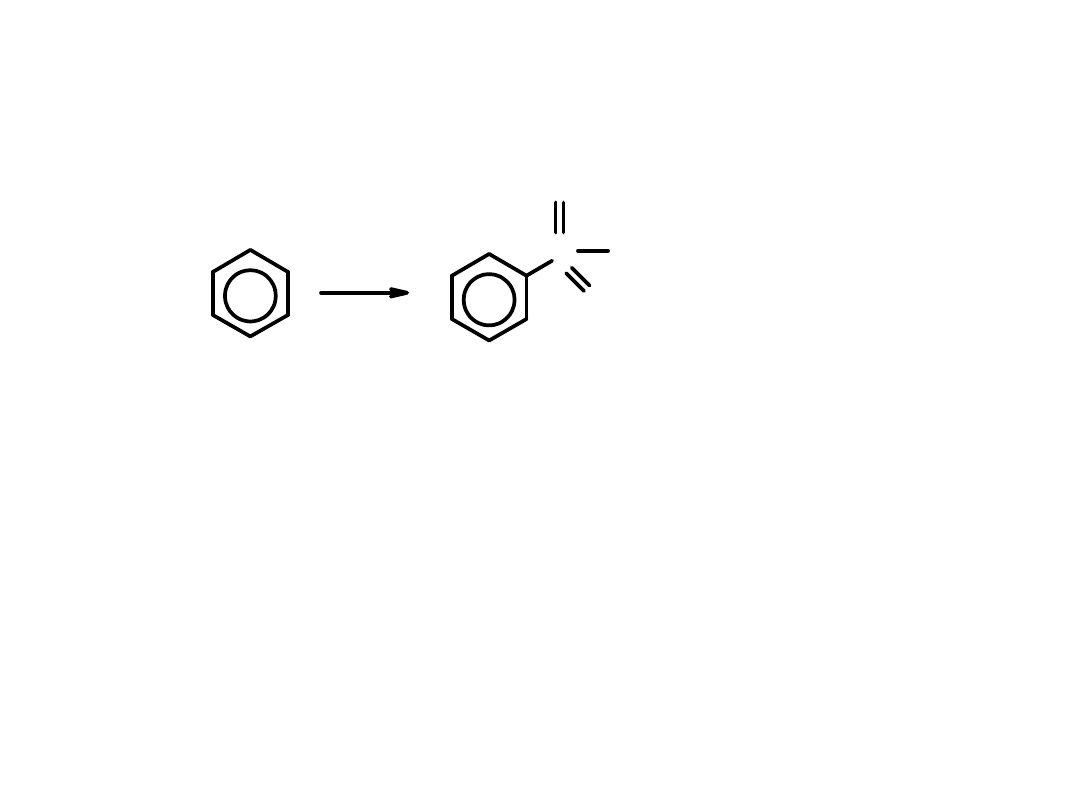
Reakcja alkilowania Friedla-Craftsa
:
+ CH
3
CH
2
Cl
CH
2
CH
3
kat.
katalizator: AlCl
3
, lub FeCl
3
, lub ZnCl
2
Elektrofilem jest kation CH
3
CH
2
+
, który powstaje w reakcji:
CH
3
CH
2
Cl + AlCl
3
CH
3
CH
2
+
+ AlCl
4
¯
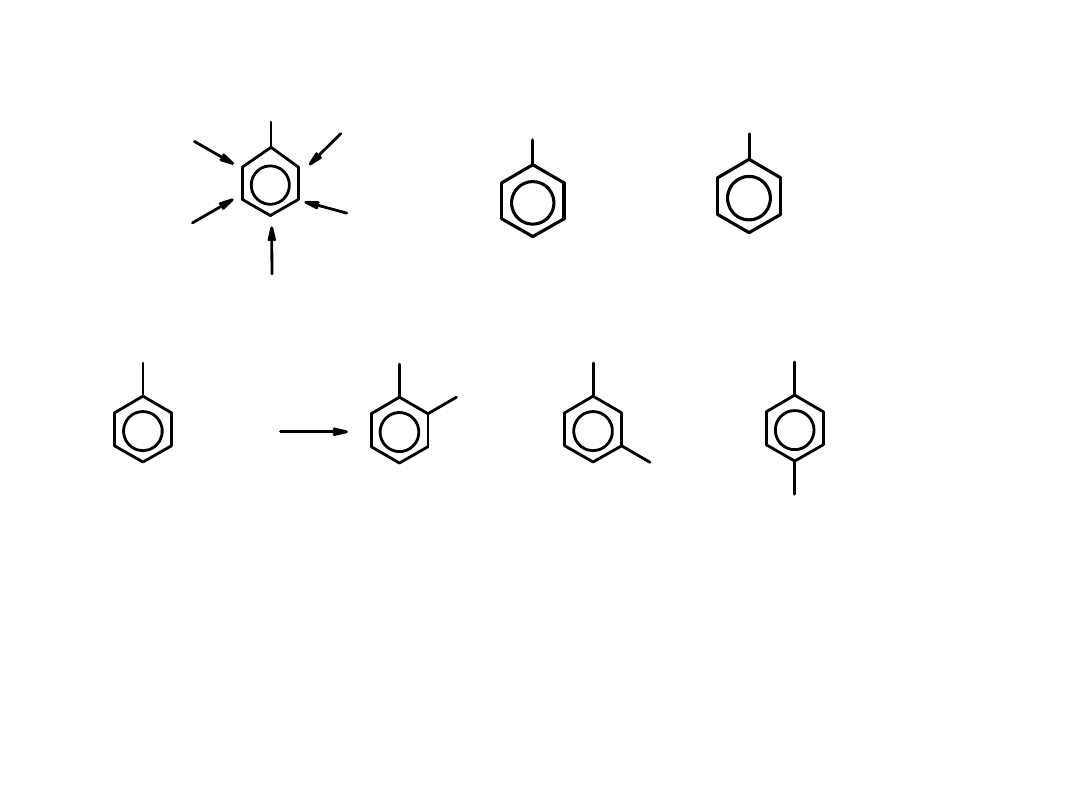
Reakcje pochodnych benzenu – podstawniki I i II rodzaju
X
orto
orto
meta
meta
para
CH
3
+ HNO
3
H
2
SO
4
CH
3
NO
2
NO
2
NO
2
CH
3
CH
3
+
+
+ H
2
O
2-nitrotoluen
o-nitrotoluen
3-nitrotoluen
m-nitrotoluen
4-nitrotoluen
p-nitrotoluen
Główny produkt
X
1
2
3
4
5
6
X
1
2
3
4
5
6
śladowe ilości
główny produkt
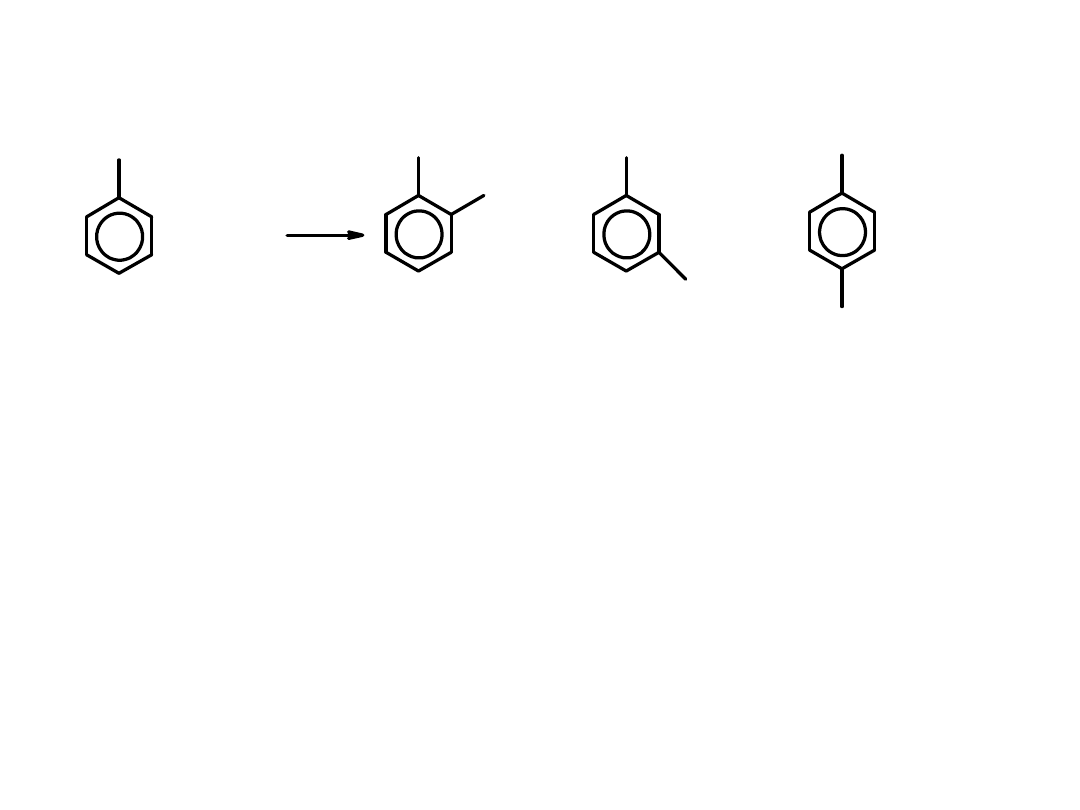
NO
2
+ CH
3
Cl
AlCl
3
NO
2
NO
2
NO
2
CH
3
CH
3
CH
3
+
+
+
HCl
o-nitrotoluen
2-nitrotoluen
m-nitrotoluen
3- nitrotoluen
p-nitrotoluen
4-nitrotoluen
Śladowe ilości
główny produkt
śladowe ilości

Efekty kierujące w reakcjach elektrofilowego podstawienia aromatycznego:
Grupa metylowa
CH
3
jest podstawnikiem
I rodzaju
i kieruje inne podstawniki
w pozycje orto- i para- w pierścieniu benzenowym.
Grupa nitrowa
NO
2
jest podstawnikiem
II rodzaju
i kieruje inne podstawniki
w pozycję meta-.
Podstawnikami I rodzaju
(kierującymi w pozycje orto- i para- są grupy
elektronodonorowe:
grupy alkilowe (CH
3
, CH
3
CH
2
), hydroksylowa OH, aminowa NH
2
.
Podstawnikami II rodzaju
(kierującymi w pozycję meta-) są grupy
elektronoakceptorowe:
grupa nitrowa NO
2
, chlorowa Cl, karboksylowa COOH, sulfonowa SO
3
H
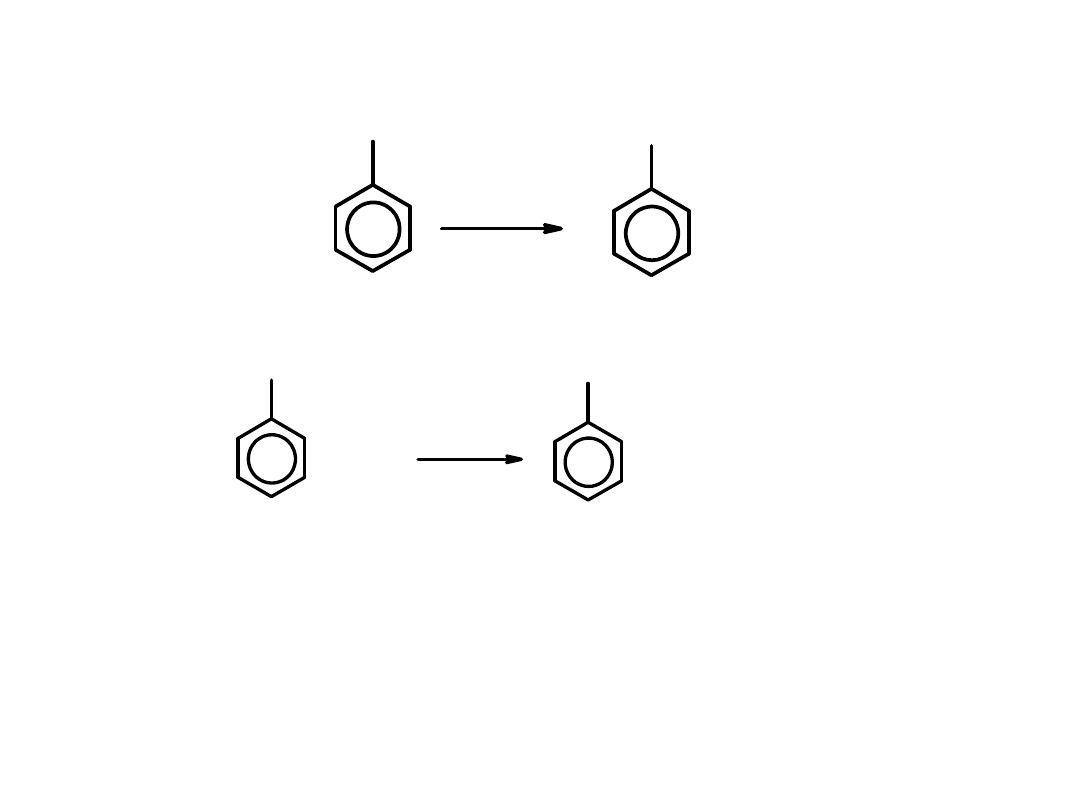
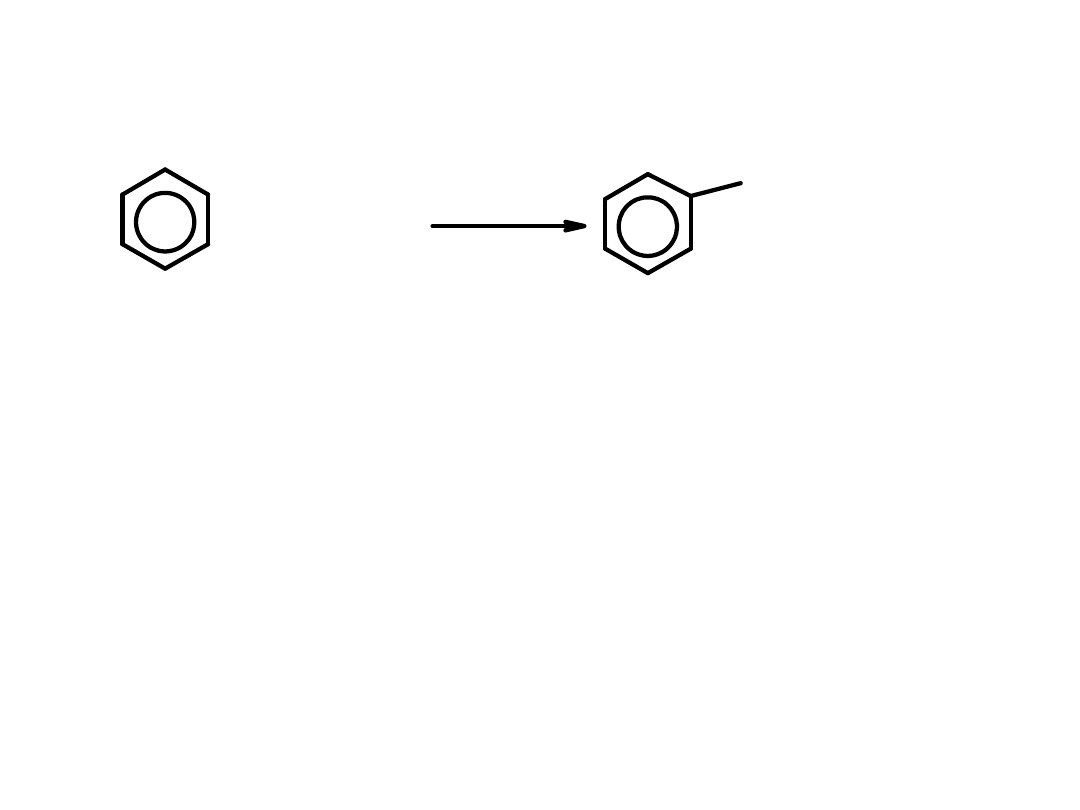
Reakcje w łańcuchach bocznych związków alkilobenzenowych
CH
3
KMnO
4
100
o
C
COOH
Toluen łatwo ulega reakcji utlenienia
do kwasu benzoesowego.
CH
3
+ Cl
2
swiatlo
CH
2
Cl
+ HCl
chlorek benzylu
Łańcuch alkilowy węglowodorów alifatyczno-aromatycznych ulega reakcji
rodnikowego chlorowania
na świetle.
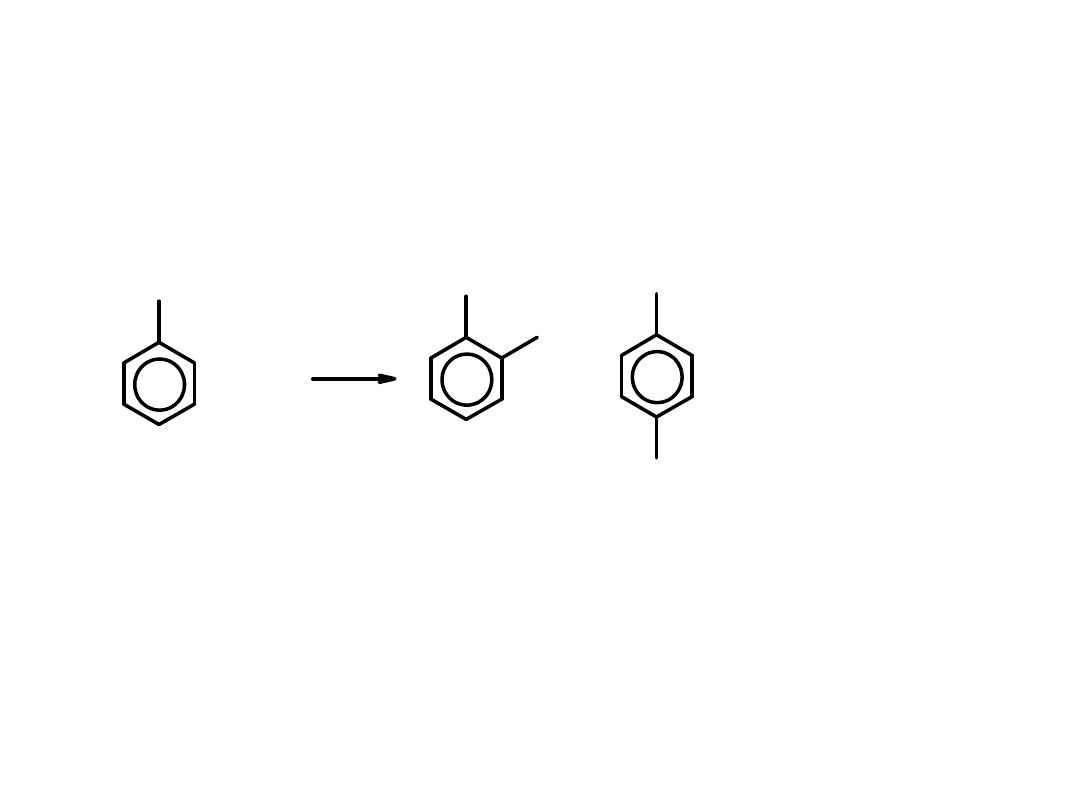
Ta sama reakcja w obecności katalizatora (FeCl
3
) prowadzi do
mieszaniny o- i p-chlorotoluenu.
CH
3
+ Cl
2
FeCl
3
CH
3
CH
3
Cl
Cl
+
+
HCl
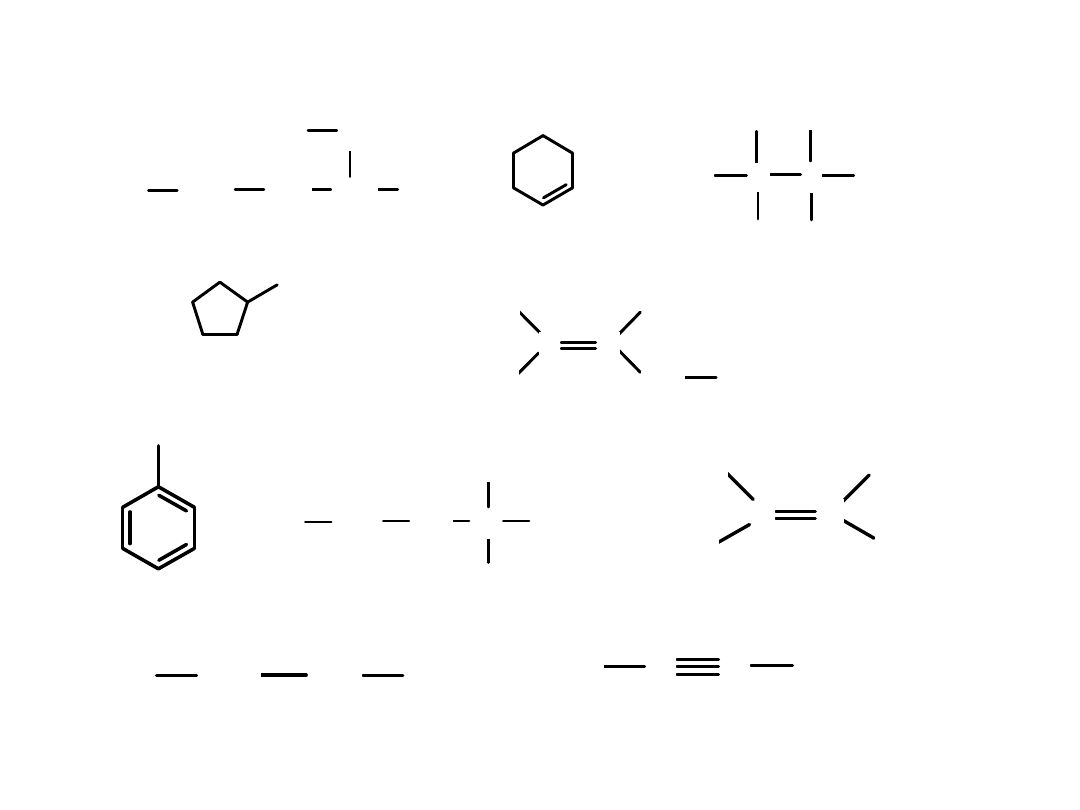
Zadania:
1. Podaj nazwy związków:
CH
3
CH
2
CH
2
CH
3
CH
2
H
3
C
CH
CH
3
C
C
Br
Br
Br
Br
H
H
C
C
H
H
H
CH
2
CH
3
Cl
CH
3
CH
2
CH
3
CH
3
CH
2
C
CH
3
C
C
H
H
Br
Br
CH
2
CH
2
Cl
Cl
H
C
C
CH
3

Zadanie 2. Narysuj wzory związków:
But-1-yn
2,4,6-tribromotoluen
2-chloropropan
3-metylopentan
2,3-dimetyloheksan
4-metylotoluen
1,4-dimetylobenzen
2,2-dichloropropan
Metylocykloheksan
2,3-dichloro-cis-but-2-en
2-metylo nitrobenzen
Etylobenzen
Zadanie3. Otrzymać z benzenu m-nitrotoluen
Zadanie 4. Otrzymać z benzenu o-nitrotoluen i p-nitrotoluen
Zadanie 5: Otrzymać z benzenu chlorek benzylu
Zadanie 6: Jak ze skały wapiennej i węgla kamiennego otrzymać acetylen (etyn)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
wykład 12 pamięć
Socjologia wyklad 12 Organizacja i zarzadzanie
Wykład 12(3)
Wykład 12
Wykład 12 Zarządzanie sprzedażą
Wykład 12 1
Wyklad 1 12
wyklad 12 MNE
wykład 12
ZARZ SRODOWISKIEM wyklad 12
wykład 7 12
Wyklad 12 ppt
OPI wyklad 12 wersja 20080227 p Nieznany
Biochemia TZ wyklad 12 integracja metabolizmu low
Metodologia - wykład 5.12.2010 - dr Cyrański, Metodologia nauk społecznych
więcej podobnych podstron