CIEPŁO WŁAŚCIWE
Na pewno wielu z Was, spojrzawszy na tytuł tego artykułu, tylko wzruszy ramionami:
a co w tym ciekawego? Tak, jest taka wielkość, potrzebna do obliczenia ciepła potrzebnego
do nagrzania takiego czy innego ciała. W technice jest to oczywiście ważne i dlatego znaleźli
się ludzie, którzy potracili mnóstwo czasu mierząc ciepło właściwe najróżniejszych
materiałów (pomiary takie nie są w zasadzie takie trudne – również w szkolnym gabinecie
fizycznym istnieją kalorymetry i rozwiązuje się zadania dotyczące obliczania ciepła
właściwego). Następnie zestawiono tablice, w których wartości ciepła właściwego zawsze
można odnaleźć i nic więcej nie można tu wymyślić.
A jednak…
Jeśli przejrzymy najpoważniejsze naukowe czasopisma, to wciąż będziemy spotykać
prace, w których bada się ciepło właściwe i niekoniecznie nowych syntetyków, ale zupełnie
zwykłych materiałów, tylko że w niezwykłych warunkach. O co tu chodzi? Dlaczego w epoce
laserów, fizyki cząstek elementarnych, mikroelektroniki, syntezy termojądrowej, itp., fizycy
nie przestają interesować się takim, wydawałoby się, rutynowym pomiarem?
Rzecz w tym, że ciepło właściwe jest mocno związane z budową materii i dynamiką
ruchu cząstek. Nierzadko pomiary ciepła właściwego pozwalają coś niecoś wnioskować o
budowie substancji i naturze zjawiska, podczas gdy najbardziej wyrafinowane współczesne
metody są bezradne.
Aby przekonać się naocznie o takim związku, nie trzeba daleko szukać przykładów.
Popatrzcie na rysunek 1:
rys. 1
0
1
2
3
4
250
200
150
100
50
0
50
100
t [
o
C]
c [
J
/
g*K
]
4,1
4,2
4,3
0
50
100
t [
o
C]
c
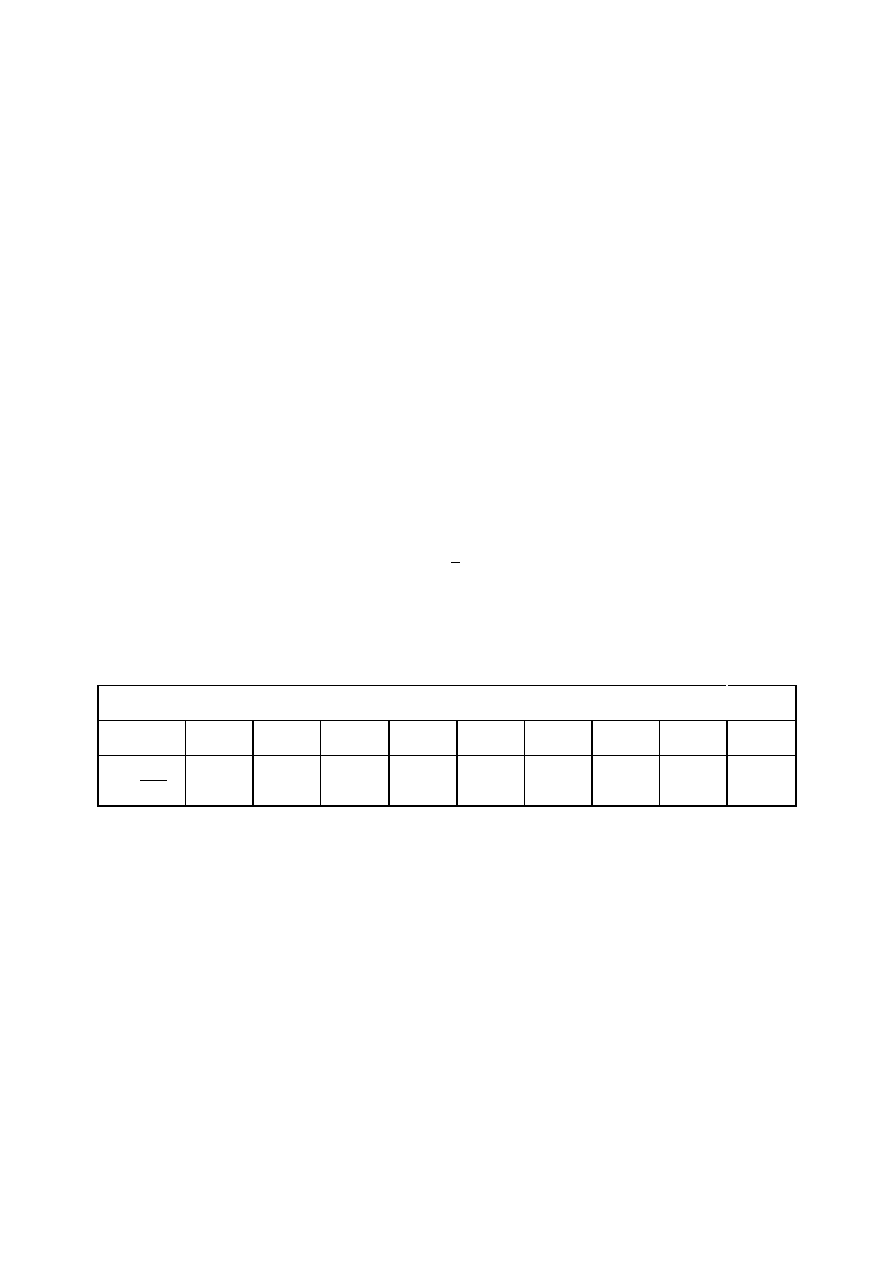
tak zmienia się ciepło właściwe zwykłej wody przy zmianach temperatury. Na pewno
pierwsza sprawa, jaka rzuca się tu w oczy, to skok przy 0°C tj. przy temperaturze przejścia
wody z jednego stanu skupienia w drugi. Ale to nie wszystko: i w fazie stałej i w ciekłej
ciepło właściwe w skomplikowany sposób zależy od temperatury. I to dla wody, która jeszcze
nie tak dawno służyła za wzorzec ciepła właściwego!
Współczesna nauka potrafi wyjaśnić, co się dzieje z wodą, ale my sobie na razie
możemy to podarować. Lepiej zacząć od przypadku najprostszego – od gazu doskonałego.
GAZ DOSKONAŁY
Ściśle mówiąc, nagłówek nie jest zupełnie właściwy, ponieważ chodzi tu o gazy
realnie istniejące, a doskonałe tylko w jednym sensie: spełniają w temp. pokojowej równanie:
pV
NkT
i energia ruchu postępowego cząsteczki gazu wynosi:
3
2
p
E
kT
(oznaczenia podstawowe)
Wypiszmy z tablic wartości ciepła właściwego dla stałej objętości (c
V
) zmierzone dla
niektórych gazów (tab. 1).
c
V
gazów w temperaturze pokojowej
tab. 1
gaz
He
Ar
Xe
H
2
N
2
O
2
CO
2
NH
3
CH
4
gK
J
C
V
3,15
0,31
0,096
10,26
0,74
0,66
0,65
1,62
1,68
na pierwszy rzut oka trudno jest dostrzec w tych liczbach jakąś prawidłowość. Nie będziemy
się tym przejmować, ale postaramy się przedstawić te liczby w nieco innej postaci. Istotne jest
to, że jeden gram różnych gazów zawiera różną liczbę cząsteczek. A podana wyżej zależność
na E
p
podpowiada, że należałoby porównywać wartości w odniesieniu do jednej cząsteczki.
Nietrudno przeliczyć wartości z tabelki. Przypomnijmy, że mol dowolnej substancji zawiera
tę samą liczbę cząsteczek –
23
10
02
,
6
x
(jest to N
A
– stała Avogadra).
Ciepło właściwe odniesione do jednego mola – czyli tzw. ciepło molowe – można łatwo
obliczyć
µ
µ
V
C
C
=
(μ – masa molowa)
Wynika stąd, że ciepło właściwe przepadające na jedną cząsteczkę wynosi:

A
V
cz
N
C
C
µ
=
Wielkość ta jest bardzo mała i dlatego wygodniej będzie nam porównywać między sobą
wartości
cz
cz
c
c
k
8
(łatwo zauważyć, że wielkości c′
cz
są bezwymiarowe)
Wyznaczamy wartości c′
cz
dla gazów z tabelki 1. i popatrzmy co otrzymaliśmy (tab.2):
c′
cz
gazów
tab. 2
gaz
He
Ar
Xe
H
2
N
2
O
2
CO
2
NH
3
CH
4
cz
c
1,50
1,50
1,50
2,45
2,49
2,53
3,42
3,30
3,23
Od razu daje się zauważyć, że dla wszystkich gazów 1atomowych c′
cz
jest takie samo
i równe
3
2
(inaczej:
3
2
cz
c
k
).
Ale przecież czynnik
3
2
figuruje już w zależności na E
p
. Ponieważ ciepło właściwe
E
T
c
,
więc otrzymamy:
3
3
2
2
T
cz
T
k
k c
.
Otrzymujemy więc ważny wniosek: w przypadku helu, argonu i neonu, całe
dostarczone ciepło bez reszty przekształca się w energię ruchu postępowego atomów.
Można sobie wyobrazić, że atomy mogą się jeszcze obracać, ale, jak widać, na energię
tego ruchu nie starcza dostarczanego ciepła, i żadnego ciepła właściwego związanego z tym
ruchem nie ma.
Przypomnijmy jeszcze, że wniosek ten słuszny jest tylko dla temperaturach
pokojowych (tab. 1 i 2).
W bardzo wysokich temperaturach (tysiące stopni) to wszystko nie jest już takie
proste, i, jak pokazują doświadczenia oraz teoria, takie obroty mogą się wzbudzić. Ale na
razie nie będziemy sobie tym utrudniać życia.
I bez tego powstają pytania co do ciepła właściwego gazów 2 i 3atomowych. Dla
tych gazów ciepło właściwe jest wyższe niż w 1atomowych. Jest interesujące, że nadwyżka
ciepła właściwego w przypadku gazów 2atomowych przypadająca na 1 atom wynosi ½ k. W
przypadku wieloatomowych gazów sytuacja jest bardziej złożona: odpowiednie udziału
wynoszą ~0,65k/atom dla CO
2
i ~0,34k/atom dla CH
4
. A więc, jak widać, sprawa nie jest taka
prosta.
Podejdźmy do tego problemu z innej strony – popatrzmy, jakie różne typy ruchu mogą
wykonywać cząsteczki. Cząsteczkę dwuatomową można przedstawić jak na rys. 2a – atomy
połączone sprężynką.
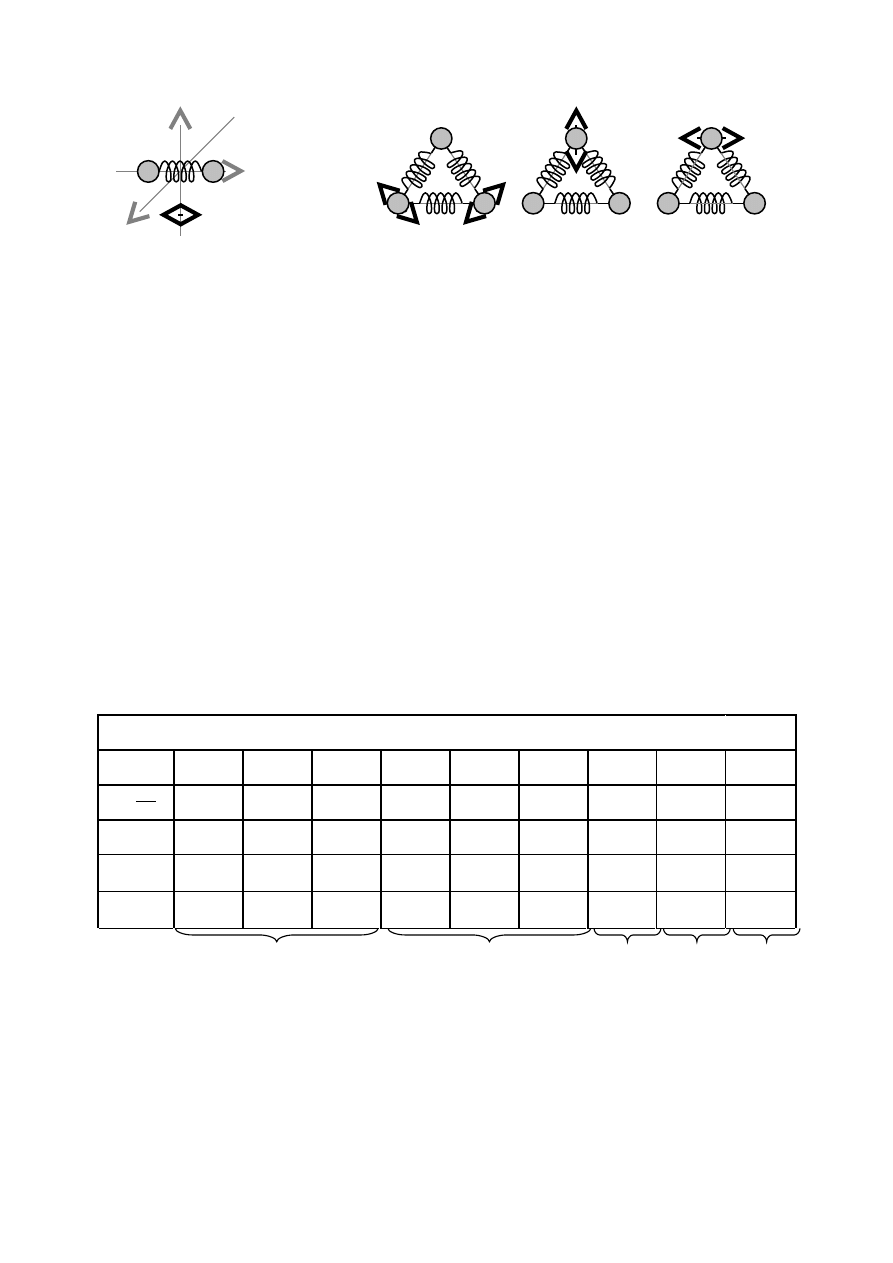
rys. 2a
rys. 2b
Ruch postępowy cząsteczki może być opisany jako uch jej środka masy w układzie
trzech wzajemnie prostopadłych osi X, Y i Z.
Cząsteczkę można obracać wokół osi Y i Z, prostopadłych do sprężynki. Obrót
cząsteczki wokół osi X, przechodzącej wzdłuż sprężynki, należy prawdopodobnie wyłączyć –
jest to w istocie to samo, co obrót każdego z atomów wokół własnej osi, a jak to już przed
chwilą widzieliśmy na przykładzie gazów jednoatomowych, ciepło nie jest w to
zaangażowane. I, w końcu, same atomy mogą drgać naprzeciw siebie.
I tak, dla cząsteczek dwuatomowych, możliwych typów ruchu (tzw. stopni swobody),
łącznie z ruchem postępowym wzdłuż osi X, Y i Z, jest sześć.
Dla cząsteczek trzyatomowych istnieje dziewięć, ponieważ można ją już obracać
wokół trzech osi oraz istnieją trzy możliwe typy drgań (rys. 2b).
Jeśli cząsteczka zbudowana jest z n atomów (
3
n
) to rozrysowanie tego jest już
trudne, ale istnieje prosta reguła, pozwalająca określić liczbę stopni swobody: całkowita ich
liczba, włączając ruch postępowy i obrotowy, jest równa ilości współrzędnych atomów
tworzących cząsteczkę, czyli 3n.
Posługując się tą regułą, wyliczmy ilość możliwych typów ruchu dla różnych
cząsteczek gazu i, pamiętając o trzech stopniach swobody przypadających na ruch postępowy,
dołączmy do tabeli 2. jeszcze dwie rubryki (tab. 3):
tab. 3
gaz
He
Ar
Xe
H
2
N
2
O
2
CO
2
NH
3
CH
4
J
g K
V
c � �
� �
g
3,15
0,31
0,096
10,26
0,74
0,66
0,65
1,62
1,68
cz
cp
1,50
1,50
1,50
2,45
2,49
2,53
3,42
3,30
3,23
Ilość
obrotów
0
0
0
2
2
2
3
3
3
Ilość
drgań
0
0
0
1
1
1
3
6
9
1 at.
2 at.
3 at.
4 at.
5 at.
Przypatrzmy się teraz gazom wieloatomowym: CO
2
, NH
3
i CH
4
. Każdą z tych
cząsteczek można obracać wokół 3 osi, ale liczba możliwych typów drgań jest zróżnicowana:
dla CO
2
– trzy, dla NH
3
– sześć, a dla CH
4
– aż dziewięć. A ciepło właściwe tych gazów
prawie jednakowe!
Mądrze byłoby założyć, że przy cieplnym ruchu, energia przekazywana cząsteczce,
zużywana jest na ruch postępowy i obrotowy, a drgania nie są wzbudzane przez ciepło.
Inaczej mówiąc, drgania nie dają wkładu do ciepła właściwego. Ale wtedy, konsekwentnie,
H
H
Y
Z
X
O
O
C
O
O
C
O
O
C

należałoby zaniedbać drgania również cząsteczek dwuatomowych i założyć, że nadwyżka (w
porównaniu do gazów 1atomowych) ciepła właściwego związana jest wyłącznie z obrotami.
Dla cząsteczek 2atomowych, jak widać z tablicy 3, w temperaturze pokojowej jest prawie
dokładnie równa
1
2
k na każdy obrót. Jeśli przyjmiemy tę regułę dla gazów wieloatomowych,
to ich całkowite ciepło właściwe powinno być równe 3k. W rzeczywistości jest ono nieco
większe, ale na razie nie będziemy na to zwracać uwagi.
Doszliśmy tu do interesującego wniosku: na każdy z możliwych typów ruchu
cząsteczki jako całości (postępowego i obrotowego) przypada takie samo ciepło właściwe,
równe
1
2
k .
[jest to tzw. zasada „ekwipartycji energii”]
DRGANIA – POZA REGUŁĄ?
Jeśli to ma być prawo, to dlaczego nie jest ono uniwersalne, dlaczego nie dotyczy
drgań? Sytuacja staje się jeszcze bardziej skomplikowana jeśli popatrzymy na grupową
„supercząsteczkę” – cząsteczkę ciała stałego. W ciałach stałych wszystkie tworzące je
cząsteczki znajdują się w węzłach sieci krystalicznej i nie mogą poruszać się ani postępowo,
ani obrotowo. Jedyny możliwy typ ruchu cząsteczki, jeśli pominiemy ruch całego ciała, to jej
drgania wokół położenia równowagi. Dlatego też całe ciepło właściwe ciał stałych związane
jest z drganiami. Tak, prawie wszystkie kryształy, zbudowane z atomów, mają w warunkach
normalnych ciepło molowe prawie jednakowe i równe
J
mol K
25
g
. Jest to tzw. prawo Dulonga i
Petita [1819]. Np. dla aluminium –
J
mol K
24, 4
g
, srebra – 25,2, miedzi – 24,6, złota – 26,5,
ołowiu – 26,6. Łatwo wyliczyć, że na każdy atom w ciele stałym przypada 3k ciepła
właściwego, tj. na każde drganie (dla 1 cząsteczki – trzy rodzaje drgań) przypada nie
1
2
k , ale
dwa razy więcej!
Spróbujcie dla każdego typu drgań w cząsteczce CH
4
przypisać wkład w ciepło
właściwe równy k, a otrzymacie ogromną rozbieżność z doświadczeniem.
Aby to rozwiązać, musimy popatrzeć na wyniki doświadczeń. Po pierwsze: niegłupio
byłoby się przekonać, czy ciepło właściwe gazów zależy od temperatury, a jeśli zależy, to
jak? Pokażemy taką zależność dla trzech gazów (rys. 3):
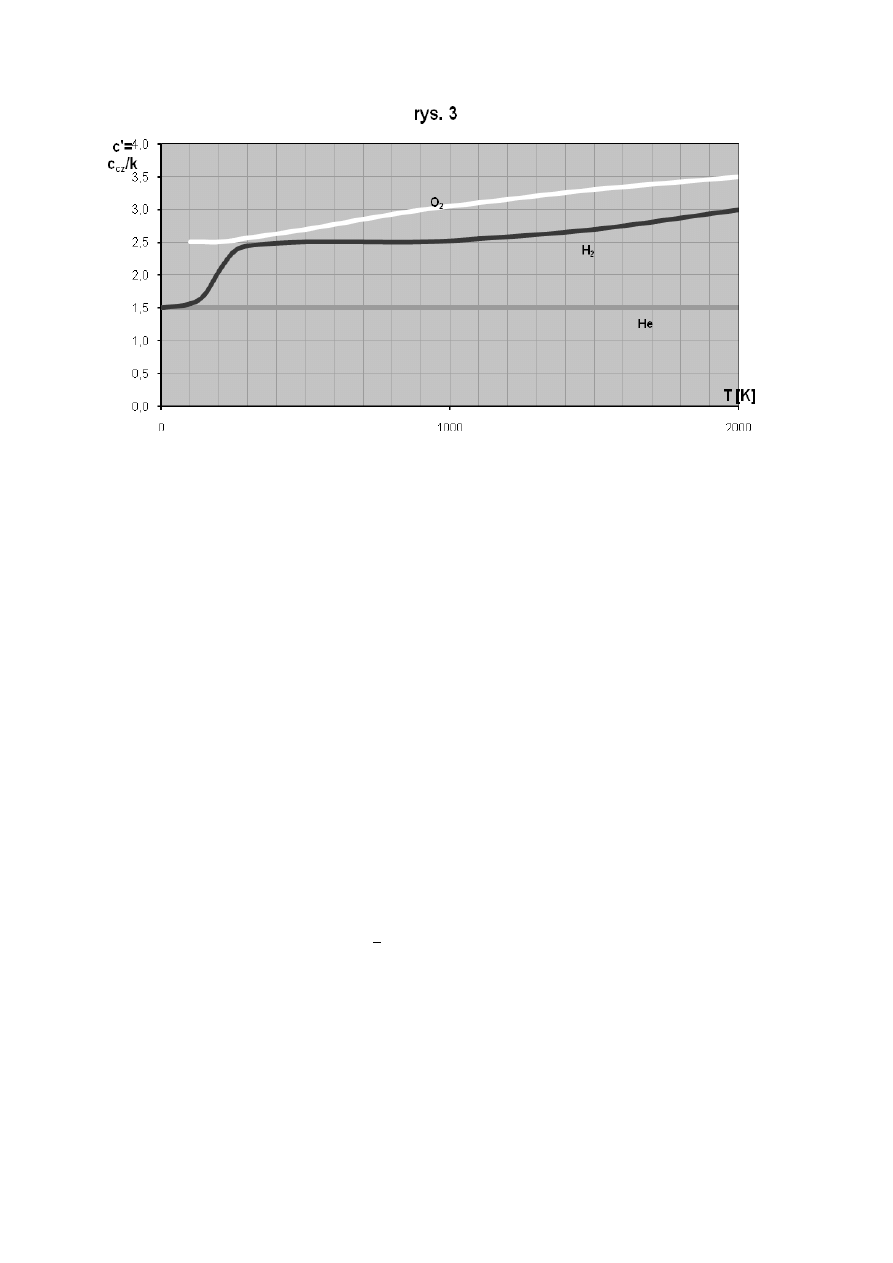
Od razu widać – w gazie jednoatomowym [He], w przedziale temperatur od bliskich
4,2K (temp. skraplania helu) i do tysięcy stopni Kelvina ciepło właściwe jest niezmienne. Ale
zależność dla wodoru jest zupełnie inna. W niskich temperaturach, podobnie jak dla helu,
ciepło właściwe jest dokładnie równe 1,5k – w tym zakresie temperatur wodór zachowuje się
jak gaz jednoatomowy. W temp. T 70K zaczyna się wzrost ciepła właściwego, i przy 250K
≈
osiąga ono nową, prawie stałą wartość 2,5k. Następnie gdzieś ok. 1000K zaczyna się nowy
wzrost, i przy 2000K ciepło właściwe osiąga wartość 3k. Przy dalszym wzroście temperatury,
ciepło właściwe nadal się zwiększa, ale nie będziemy zapuszczać się w te obszary, ponieważ
zbyt dużo zjawisk zachodzi w gazie, gdy jest on silnie nagrzany.
Popatrzmy lepiej jak zachowuje się tlen. Dla niego pomiar ciepła właściwego w
temperaturach znacząco mniejszych od 100K nie jest możliwy, ponieważ tlen przestaje być
gazem. Gdyby jednak tak nie było, to w niskich temperaturach ciepło właściwe także byłoby
równe 1,5k, a tak krzywa zaczyna się na poziomie 2,5k, ale w T = 2000K zwiększa się do
3,5k.
Jakie wnioski możemy z tego wyciągnąć?
1. Ruch postępowy cząsteczek gazu istnieje zawsze i związane z nim ciepło właściwe nie
zależy od temperatury.
2. Obroty i drgania w niskich temperaturach zanikają (ulegają tzw. „zamrożeniu”), Przy
tym temperatura pokojowa przypada na obszar, gdy obroty jeszcze są (np. dla wodoru
„zamarzają” one w temp. T 100K); a drgania są już „zamrożone”.
≈
I, na koniec,
3. W cząsteczce tlenu istnieje tylko jeden typ drgania, a ciepło właściwe przy jego
„rozmrażaniu” wzrasta nie o
1
2
k , ale o 1k.
Liczbę tę my już spotkaliśmy – przy ciele stałym! Jak to można wytłumaczyć?
NA POMOC PRZYCHODZI KWANTOWANIE
Okazuje się, że spawa dotyczy kwantowania. Pokażemy to przy pomocy analogii do
jednego z najstarszych zjawisk kwantowych – emisji elektronów z metalu. Fotoemisja –
wyrzut elektronu z metalu pod wpływem światła – zachodzi tylko wtedy, gdy energia kwantu
światła hν jest większa od pracy wyjścia elektronu z metalu. Ale istnieje również inne
zjawisko – termoemisja, szeroko wykorzystywana w technice (np. w kineskopie TV). W tym
przypadku elektrony opuszczają metal, kiedy jest on nagrzany do wysokiej temperatury,
takiej, że energia ruchu cieplnego ~kT staje się porównywalna z pracą wyjścia. Można
stwierdzić, że emisja jest „zamrożona” w niskich temperaturach i „rozmraża się” przy
nagrzewaniu. Inaczej mówiąc, „zamrażanie” ruchu zachodzi wtedy, gdy do jego wzbudzenia
należy przekazać jakiś określony kwant energii. I to jest słuszne zawsze, nie tylko w
przypadku emisji elektronu.
Wynika stąd: ponieważ drgania i obroty „zamrażają się” to znaczy, że ruchy te są
skwantowane! Taki wniosek wydaje się szczególnie nieoczekiwany, gdy odniesiemy go do
obrotów – trudno wyobrazić sobie, że cząsteczki nie mogą obracać się z dowolną (dowolnie
małą) szybkością. Ale w mechanice kwantowej to niezaprzeczalny (niepodważalny) fakt, i
cząsteczka albo nie obraca się wcale, albo od razu tak, że jej energia kinetyczna podzielona
przez stałą Boltzmanna k, osiągnęła przykładowo wartości dziesięciu – stu kelwinów
(dokładne liczby zależą od charakterystyk fizycznych cząsteczek konkretnej substancji).
Ale gdy chodzi o gaz zawierający dużą liczbę cząsteczek, to w nim zawsze znajdą się
takie, które nie obracają się – ich część jest przeważająca w niskich temperaturach: istnieją
jednak takie, które obracają się i ich udział wzrasta przy wzroście temperatury.
I tak, czysto kwantowe zjawisko wpływa na tak, wydawałoby się, typowo klasyczną
wielkość jak ciepło właściwe gazu doskonałego.
To samo, co o obrotach, można powiedzieć o drganiach. I teraz jasne jest, że różnica
między wkładem drgań w ciepło właściwe ciał stałych i gazów w temperaturach pokojowych
nie ma istoty jakościowej, a ma związek z liczbowymi różnicami między substancjami. Dla
cząsteczki wodoru lub tlenu kwant drgania w skali temperatury równy jest tysiącom
kelwinów, a dla ciał stałych – tylko setkom. I rzeczywiście, przy takich właśnie
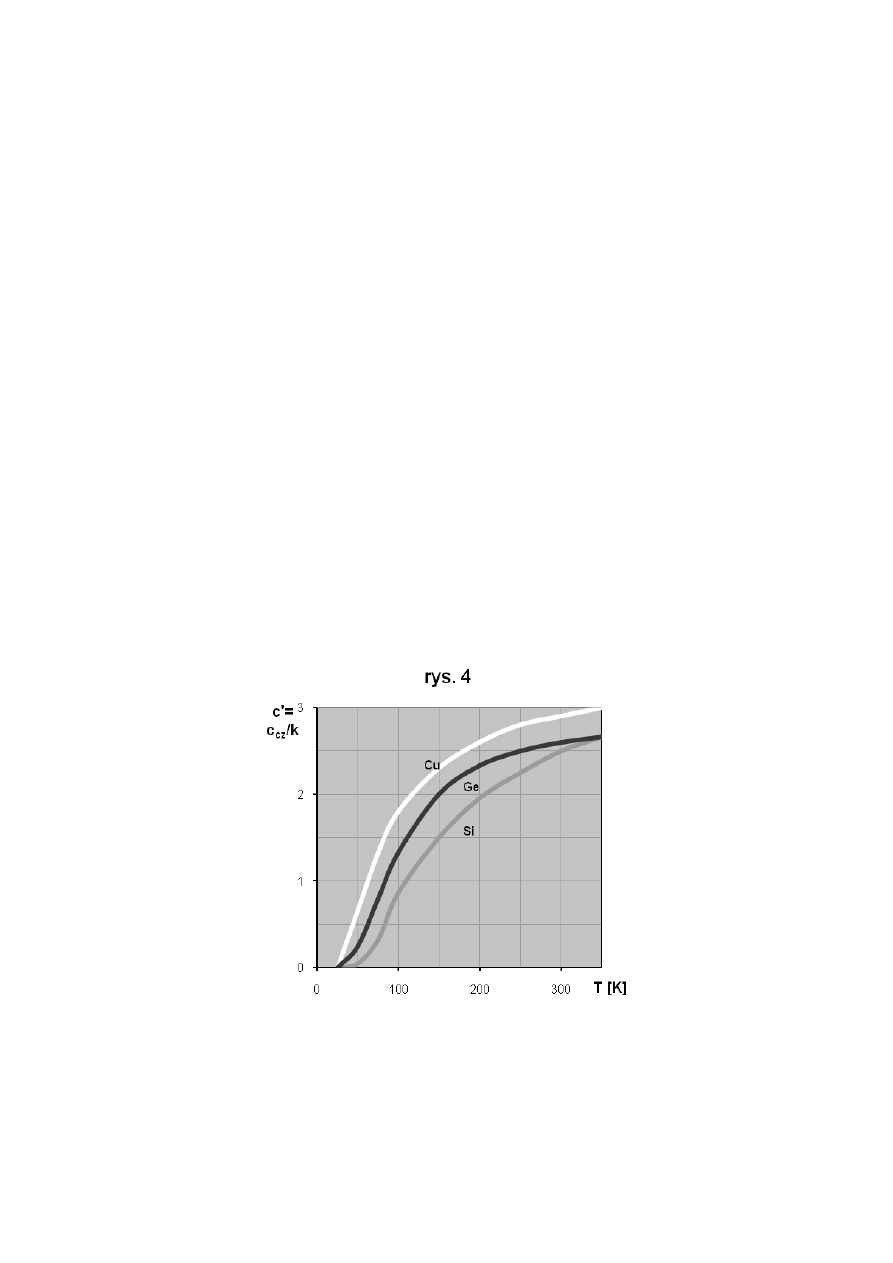
temperaturach ciepło właściwe zaczyna się szybko zmieniać (rys. 4):
I ta zbieżność liczb jest mocno związana z tym, że topnienie ciał stałych zachodzi przy
temperaturach rzędu tysięcy stopni, a zauważalna dysocjacja cząsteczek tlenu i wodoru – przy
dziesiątkach tysięcy stopni. A przecież mechanizm obu procesów jest taki sam – jest to
cieplne rozbudzenie drgań do takiej amplitudy, przy której „rozrywają się” wiązania, i im
niższa temperatura, przy której następują drgania tym mniejsza również temperatura
rozerwania wiązania.

Oto co można wywnioskować z analizy ciepła właściwego! Do pełnej harmonii
brakuje jednego wyjaśnienia: jak ułożyć w jeden schemat
1
2
k dla ciepła właściwego
związanego z ruchem postępowym i obrotowym, a 1k – dla ruchu drgającego. Okazuje się, że
jest przepiękne wytłumaczenie. W istocie, zwróćcie uwagę, że
1
2
k pojawia się tam, gdzie
ruch charakteryzuje się tylko energią kinetyczną. Ale przy drganiach istnieje jeszcze energia
potencjalna, i jeśli pełna energia drgania jest równa kT (tj. ciepło właściwe 1k), a to znaczy, że
układ oscylatora przechodzi ze stanu z zerową energią kinetyczną i z maksymalną energią
potencjalną równą kT, w stan z zerową energią potencjalną i maksymalną energią kinetyczną
także równą kT. A średnio, w czasie, energia kinetyczna równa jest energii potencjalnej, i,
oczywiście, obie energie mają średnią wartość
1
2
kT – i wróciliśmy do połówki.
I oto końcowe wnioski: w danej temperaturze wzbudzają się te typy ruchu, których
energia kwantu równa jest kT lub od tej wartości mniejsza. Przy tym i kinetyczna energia i
potencjalna (o ile ona jest!), przypadająca na 1 stopień swobody jest taka sama i wynosi
1
2
kT .
Wnioski te doskonale zgadzają się z wieloma eksperymentami i z teorią wynikającą z
mechaniki kwantowej.
Oczywiście, że rozpatrywaliśmy przykłady najprostsze z możliwych. Możemy jednak
zajrzeć głębiej: wyliczając stopnie swobody, rozpatrywaliśmy atomy jako proste cząsteczki,
ale nie zawsze jest to słuszne. W każdym atomie istnieją własne wewnętrzne stopnie swobody
ruchu elektronów w powłokach względem jąder. Jednak do ich rozmrożenia potrzeba już
dziesiątek i setek tysięcy stopni. Fizyka plazmy bada właśnie gazy, w których „rozmrożono”
ruch elektronów. Można pójść i dalej – również jądra zbudowane z oddzielnych cząstek
elementarnych, a także same te cząstki niezupełnie elementarne. Ale żeby wzbudzić takie
cieplne ruchy, potrzebne są już miliony i miliardy stopni (i jeszcze więcej), i tu zaczyna się
ścieżka wiodąca do historii narodzin gwiazd, galaktyk i samego Wszechświata. A pierwszy
krok na tej ścieżce – gaz doskonały ze swoimi prawami.
Wyszukiwarka
Podobne podstrony:
CIEPLOWNICTWO EGZ id 117055 Nieznany
zeliwo wlasciwosci id 587230 Nieznany
Cieplo wlasciwe gazow doskolnal Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron