
Ciepło właściwe gazów
doskonałych
Opracowanie: dr inż. Ewa Fudalej-Kostrzewa
1
CIEPŁO WŁAŚCIWE GAZÓW DOSKONAŁYCH
W kinetycznej teorii gazów udowodniono, że pojemność cieplna gazów doskonałych przy
stałej objętości
K
kmol
J
c
jest wielkością stałą, proporcjonalną do liczby stopni swobody
cząsteczki gazu, a nie zależy od rodzaju gazu – a więc zależy od ilości atomów składających
się na cząsteczkę. Na jeden stopień swobody przypada pojemność cieplna
R
5
,
0
, czyli:
K
kmol
J
R
f
c
5
,
0
gdzie:
R
-
uniwersalna stała gazowa,
f
– liczba stopni swobody cząsteczki.
Liczba stopni swobody ruchu postępowego cząsteczek nie zależy od rodzaju cząsteczki
i
wynosi trzy. Cząsteczka może poruszać się w przestrzeni w trzech prostopadłych do siebie
kierunkach.
Liczba stopni ruchu obrotowego cząstek zależy od ilości atomów w cząstce. Cząstki
jednoatomowe nie mają energii kinetycznej ruchu obrotowego w związku z założeniem
nieskończenie małych rozmiarów (moment bezwładności cząsteczki względem dowolnej osi
przechodzącej przez nią jest równy zeru).Cząsteczki dwuatomowe mają budowę liniową i mogą
obracać się dookoła dwóch osi prostopadłych do linii łączącej atomy, przechodzących przez
każdy z atomów. Moment bezwładności względem osi przechodzącej przez oba atomy jest
równy zeru. Mają więc dwa stopnie swobody ruchu obrotowego.
Cząstki trój i więcej atomowe mają trzy stopnie swobody ruchu obrotowego.
KIlom
olowa pojemność cieplna gazów doskonałych przy stałej objętości wynosi więc:
Gazy jednoatomowe:
Liczba stopni swobody f
: 3 (ruch postępowy - 3, ruch obrotowy – 0)
K
kmol
kJ
R
R
f
c
47
,
12
7
,
8314
2
3
2
3
2
1
Gazy dwuatomowe:
Liczba stopni swobody f
: 5 (ruch postępowy - 3, ruch obrotowy – 2)
K
kmol
kJ
R
R
f
c
787
,
20
7
,
8314
2
5
2
5
2
1
Gazy
trój i wieloatomowe:
Liczba stopni swobody f
: 6 (ruch postępowy - 3, ruch obrotowy – 3)
K
kmol
kJ
R
R
f
c
94
,
24
7
,
8314
2
6
2
6
2
1
Ciepło właściwe gazów
doskonałych
Opracowanie: dr inż. Ewa Fudalej-Kostrzewa
2
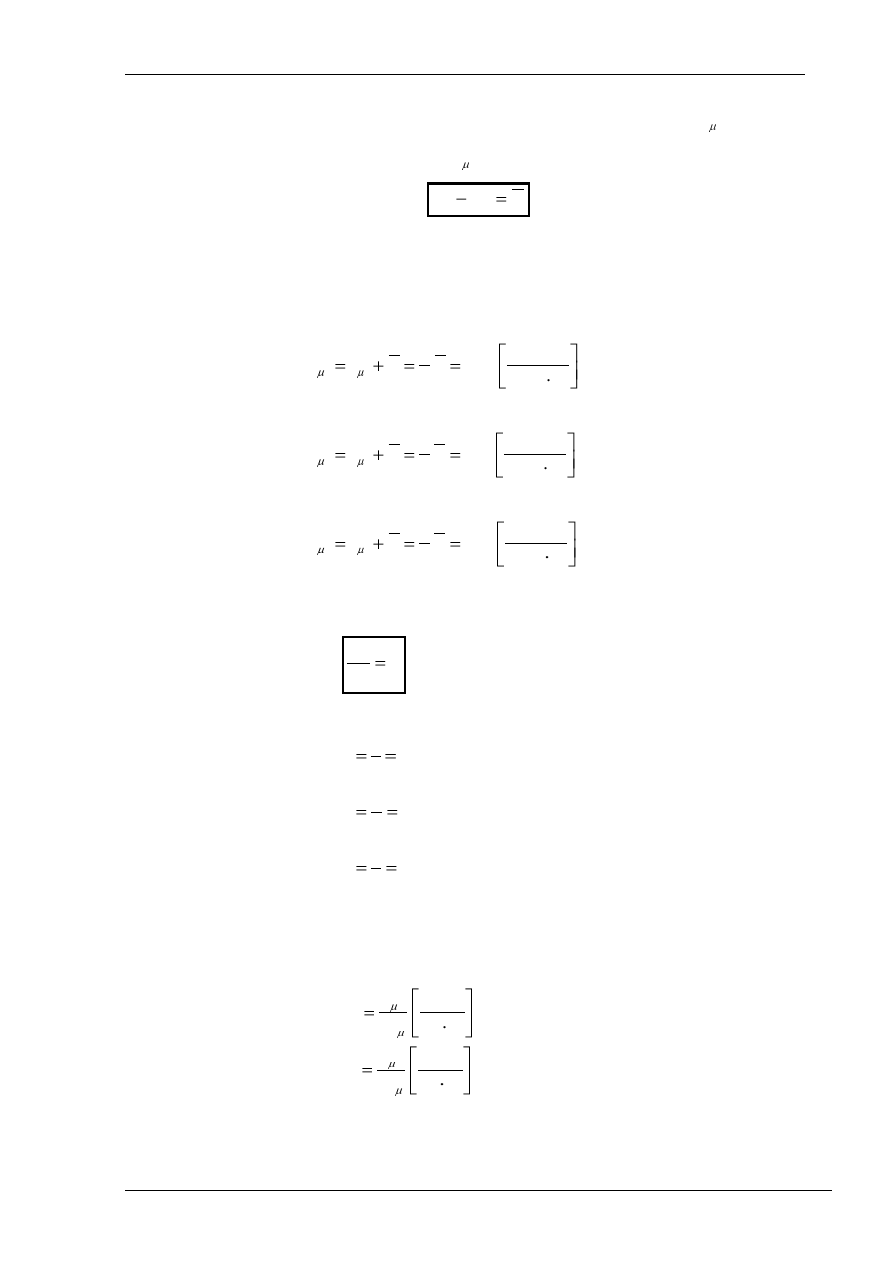
Udowodniono również, że pomiędzy pojemnością cieplną przy stałej objętości
v
c
a
pojemnością cieplną przy stałym ciśnieniu
p
c
zachodzi następująca zależność:
R
c
c
μv
μp
zwana
równaniem Mayera.
A zatem kilo
molowa pojemność cieplna gazów doskonałych przy stałym ciśnieniu wynosi:
- gazy jednoatomowe:
K
kmol
kJ
,
R
R
c
c
v
p
8
20
2
5
- gazy dwuatomowe:
K
kmol
kJ
,
R
R
c
c
v
p
1
29
2
7
-
gazy trój i wieloatomowe:
K
kmol
kJ
,
R
R
c
c
v
p
3
33
2
8
Ciepło właściwe przy stałym ciśnieniu jest zawsze większe od ciepła właściwego przy stałej
objętości, a ich stosunek:
k
c
c
μv
μp
jest ważną wielkością w wielu zastosowaniach. I tak dla gazów:
- jednoatomowych :
...
,
k
666
1
3
5
- dwuatomowych:
4
1
5
7
,
k
-
trój i wieloatomowych :
...
,
k
333
1
6
8
Znając masę kilomolową danego gazu można z ciepła kilomolowego obliczyć ciepło właściwe
odniesione do 1 kg materii:
K
kg
J
M
c
c
K
kg
J
M
c
c
v
v
p
p
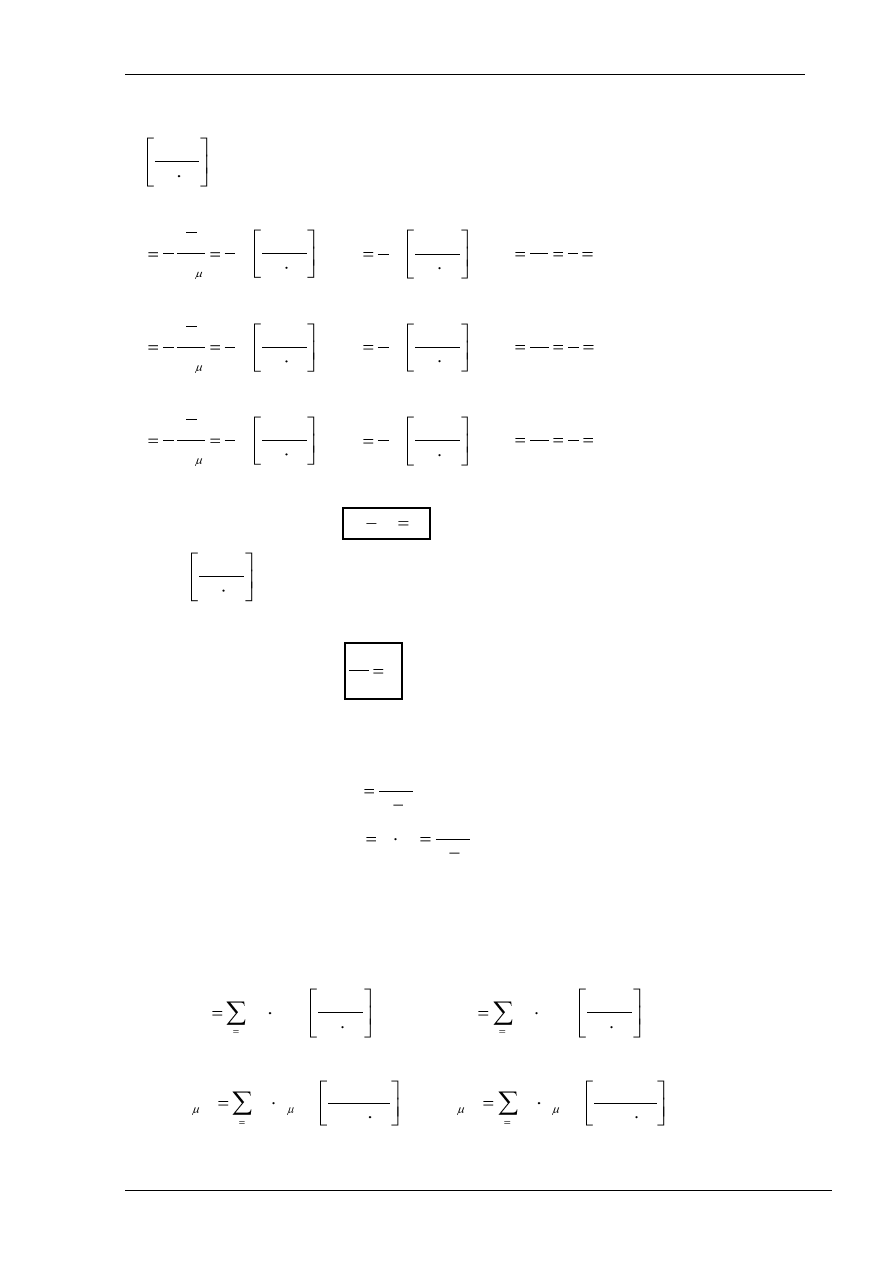
Ciepło właściwe gazów
doskonałych
Opracowanie: dr inż. Ewa Fudalej-Kostrzewa
3
Ciepło właściwe gazów doskonałych przy stałej objętości i stałym ciśnieniu, wyrażone
w
K
kg
J
, wynosi więc:
- gazy jednoatomowe:
K
kg
J
R
M
R
c
v
2
3
2
3
K
kg
J
R
c
p
2
5
...
,
c
c
k
v
p
66
1
3
5
-gazy dwuatomowe:
K
kg
J
R
M
R
c
v
2
5
2
5
K
kg
J
R
c
p
2
7
4
1
5
7
,
c
c
k
v
p
-
gazy trój i wieloatomowe:
K
kg
J
R
M
R
c
v
2
6
2
6
K
kg
J
R
c
p
2
8
...
,
c
c
k
v
p
33
1
6
8
Równanie Mayera przyjmuje postać:
R
c
c
v
p
(1)
gdzie:
K
kg
J
R
- indywidualna s
tała gazowa,
a
k
c
c
v
p
(2)
Zależności (1) i (2) pozwalają określić pojemność cieplną przy stałym ciśnieniu i stałej objętości
w zależności od k i R:
R
k
k
c
k
c
k
R
c
v
p
v
1
1
CIEPŁO WŁAŚCIWE ROZTWORÓW GAZÓW DOSKONAŁYCH
Dla 1 [kg] materii:
K
kg
J
c
g
c
vi
k
i
i
vm
1
K
kg
J
c
g
c
pi
k
i
i
pm
1
(3)
Dla 1 [kmol] materii:
K
kmol
J
c
z
c
vi
k
i
i
vm
1
K
kmol
J
c
z
c
pi
k
i
i
pm
1
(4)

Ciepło właściwe gazów
doskonałych
Opracowanie: dr inż. Ewa Fudalej-Kostrzewa
4
Wyprowadzenie zależności (3) i (4) jest przedstawione dalej.
CIEPŁO WŁAŚCIWE PRZEMIAN POLITROPOWYCH
Wykładnik przemiany politropowej m:
ILOŚĆ CIEPŁA
I
lość ciepła pochłoniętego przez czynnik można ogólnie zapisać wzorem:
)
T
T
(
c
M
Q
1
2
2
1
jednostki: Q [J],
c[J/(kg∙K)], T[K]
(5)
lub w odniesieniu do 1 kg czynnika:
)
T
T
(
c
q
1
2
2
1
jednostki: q[J/kg],
c[J/(kg∙K)], T[K]
(6)
gdzie: c
– pojemność cieplna właściwa (ciepło właściwe).
WYPROWA
DZENIE ZALEŻNOŚCI (3) i (4)
Ilość ciepła pochłoniętą przez mieszaninę gazów można obliczyć jako sumę ciepeł
pochłoniętych przez tworzące ją gazy:
2
1
2
1
2
1
2
1
C
B
A
m
Q
Q
Q
Q
Załóżmy, że pochłanianie ciepła odbywa się przy stałej objętości. Zapiszemy to następująco:
)
(
)
(
)
(
)
(
)
(
1
2
1
2
1
2
1
2
2
1
2
1
2
1
2
1
T
T
c
M
c
M
c
M
T
T
c
M
T
T
c
M
T
T
c
M
Q
Q
Q
Q
vC
C
vB
B
vA
A
vC
C
vB
B
vA
A
vC
vB
vA
vm
(7)
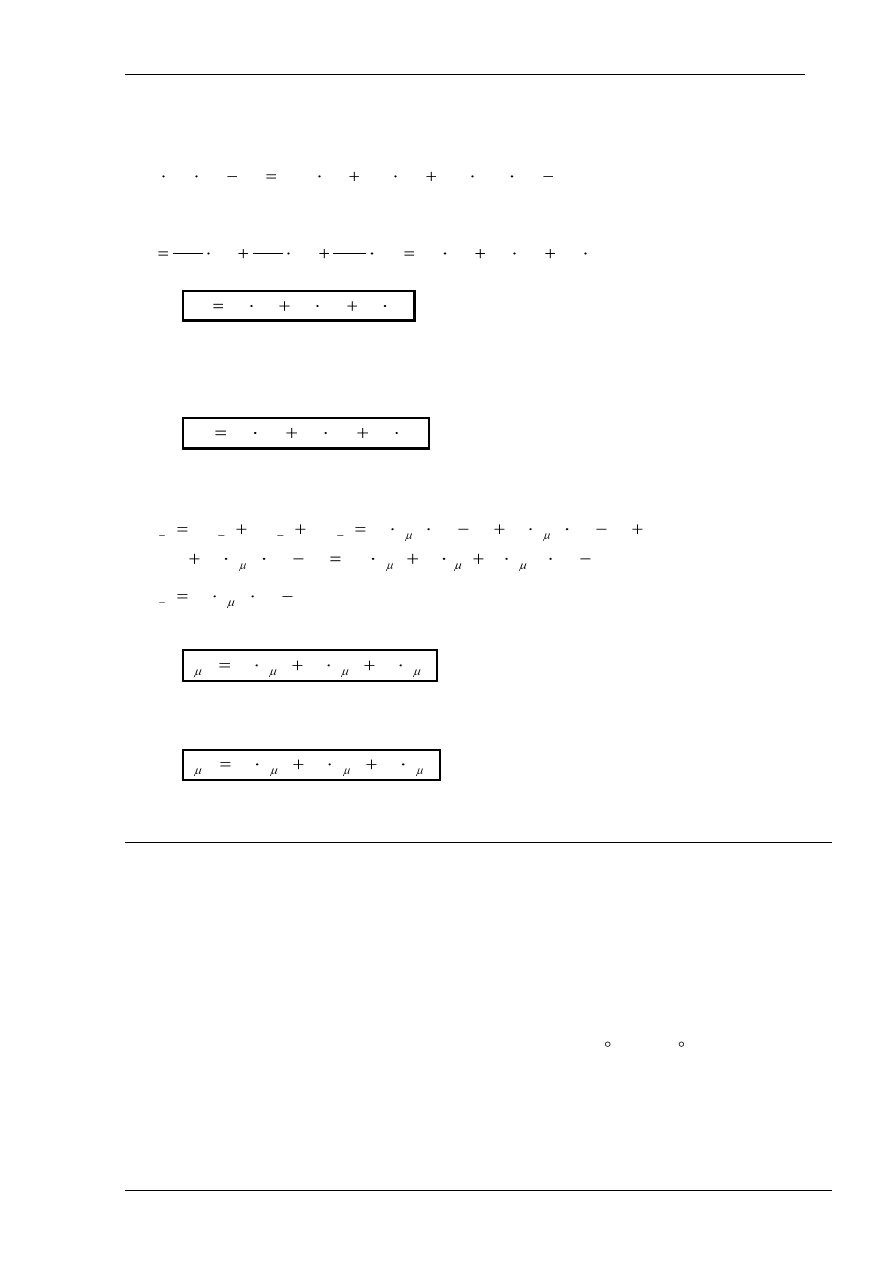
Ciepło pochłonięte przez mieszaninę gazów można zapisać, wykorzystując (5), następująco:
)
(
1
2
2
1
T
T
c
M
Q
vm
m
vm
(8)
gdzie: M
m
– masa mieszaniny,
K
kg
J
c
m
k
m
c
y
otrzymujem
k
c
c
iu
podstawien
i
c
c
m
c
c
mc
m
c
c
c
c
c
m
ceniu
przeksztal
po
c
c
c
c
m
v
v
p
v
p
v
p
v
p
v
v
p
1
:
:
)
(
)
1
(
)
(
:
Ciepło właściwe gazów
doskonałych
Opracowanie: dr inż. Ewa Fudalej-Kostrzewa
5
c
vm
– ciepło właściwe mieszaniny przy stałej objętości.
Porównując prawe strony równań (7) i (8) otrzymamy:
)
(
)
(
)
(
1
2
1
2
T
T
c
M
c
M
c
M
T
T
c
M
vC
C
vB
B
vA
A
vm
m
(9)
Równanie (9) można przekształcić do następującej postaci:
vC
C
vB
B
vA
A
vC
M
C
vB
m
B
vA
m
A
vm
c
g
c
g
c
g
c
M
M
c
M
M
c
M
M
c
vC
C
vB
B
vA
A
vm
c
g
c
g
c
g
c
ciepło właściwe mieszaniny przy stałej objętości
Zakładając, że pochłanianie ciepła odbywa się przy stałym ciśnieniu i dokonując takich
samych przekształceń otrzymuje się zależność:
pC
C
pB
B
pA
A
pm
c
g
c
g
c
g
c
ciepło właściwe mieszaniny przy stałym ciśnieniu
Stosując zapis molowy ciepła pochłanianego przy stałej objętości:
)
(
)
(
)
(
)
(
)
(
1
2
1
2
1
2
1
2
2
1
2
1
2
1
2
1
T
T
c
n
c
n
c
n
T
T
c
n
T
T
c
n
T
T
c
n
Q
Q
Q
Q
vC
C
vB
B
vA
A
vC
C
vB
B
vA
A
vC
vB
vA
vm
)
(
1
2
2
1
T
T
c
n
Q
vm
m
vm
i dokonując przekształceń otrzymuje się:
vC
C
vB
B
vA
A
vm
c
z
c
z
c
z
c
ciepło kilomolowe mieszaniny przy stałej objętości
W przypadku
pochłaniania ciepła przy stałym ciśnieniu otrzymuje się:
pC
C
pB
B
pA
A
pm
c
z
c
z
c
z
c
ciepło kilomolowe mieszaniny przy stałym ciśnieniu
ZADANIA
Zadanie 1
Obliczyć ciepło właściwe izochoryczne i izobaryczne azotu N
2
.
Odp.: c
p
= 1050 J/(kg
∙K), c
v
= 750 J/(kg
∙K)
Zadanie 2
Podczas pewnej przemiany gaz d
oskonały został ogrzany od 100 C do 200 C, pobierając
130
kJ ciepła. Obliczyć ciepło właściwe gazu podczas tej przemiany, jeśli wiadomo, że ilość
gazu wynosi 1,5 kg.
Odp.: c = 867 J/(kg
∙K)

Ciepło właściwe gazów
doskonałych
Opracowanie: dr inż. Ewa Fudalej-Kostrzewa
6
Zadanie 3
W pewnej przemianie 1 kg gazu oddał do otoczenia Q = 37 kJ ciepła. Wiadomo, że cały proces
odbywał się przy stałym cieple właściwym c = 650 J/(kg∙K). Obliczyć spadek temperatury gazu.
Odp.: T = 57 K.
Zadanie 4
Obliczyć ciepło właściwe jednoatomowego gazu doskonałego w przemianie politropowej
o
wykładniku n = 2,1. Stała gazowa R = 208 J/(kg∙K).
Odp.: c = 122,9 J/(kg
∙K)
Zadanie 5
Ile ciepła wymienia z otoczeniem wodór w przemianie politropowej o wykładniku m = 1,7
realizowanej w zakresie temperatur od 300K do 500K. Potraktować wodór jako gaz doskonały.
Odp.: q = 890,8 kJ/kg
Zadanie 6
Obliczyć ciepło właściwe tlenu przy stałym ciśnieniu i przy stałej objętości oraz przy przemianie
politropowej o wykładniku 2. Potraktować tlen jako gaz doskonały.
Odp.: c
p
= 918,8 J/(kg
∙K), c
v
= 656,3 J/(kg
∙K), c = 393,8 J/(kg∙K)
Zadanie 7
Wyznaczyć ciepło właściwe izochoryczne jednoatomowego gazu doskonałego o masie
kilomolowej M
= 40 kg/kmol. Na podstawie wyznaczonej wartości ciepła właściwego obliczyć
stałą gazową tego gazu.
Odp.: c
v
= 315 J/(kg
∙K), R = 210 J/(kg∙K)
Wyszukiwarka
Podobne podstrony:
CIEPLO WLASCIWE id 117049 Nieznany
2.11 ciepło właściwe gazów, materiały, Fizyka
2.12 molowe ciepło właściwe, materiały, Fizyka
Praca absolutna, ciepło właściwe, I zasada termodynamiki
fizyka lab3 cieplo wlasciwe Wstęp laboratorium 3
Ciepło właściwe (test, Ściągi, notatki, materiały szkolne
ciepło właściwe gazu
bryja, fizyka ciała stałego II, Ciepło właściwe wg Debye’a
CIEPLOWNICTWO EGZ id 117055 Nieznany
bryja, fizyka ciała stałego II, Ciepło właściwe wg Debye’a
Badanie wlasciwosci tworzyw id Nieznany (2)
ciepło właściwe metalu, studia, fizyka
ciepło właściwe ciał stałych poprawione
zeliwo wlasciwosci id 587230 Nieznany
CIEPLO WLASCIWE GAZU DOSKONALEGO
Bilans cieplny i ciepło właściwe
więcej podobnych podstron