
SPRAWOZDANIE
WICZENIE 11 : KINETYKA INWERSJI SACHAROZY
Ć
TEORIA
1. Szybkość reakcji chemicznej
Szybkość zmiany liczby moli dowolnie wybranego reagentu w układzie
reakcyjnym odniesiona do wybranej wielkości charakteryzującej układ, którą może
być:
–
objętość układu reakcyjnego
–
objętość reaktora
–
wielkość powierzchni międzyfazowej
–
masa fazy stałej
2. Liczba postępu reakcji chemicznej
Parametr charakteryzujący zaawansowanie reakcji chemicznej.
Liczba postępu reakcji chemicznej jest równa stosunkowi powstałej (lub zużytej) w
reakcji liczby moli danego reagenta do jego współczynnika stechiometrycznego w
równaniu tej reakcji.
Wartość liczby postępu reakcji chemicznej jest w danej chwili dla wszystkich
reagentów jednakowa.
3. Klasyfikacja reakcji chemicznych
1. Reakcje syntezy - tworzenie nowej substancji z dwóch lub więcej substancji
A+B–>C
np. N
2
+3H
2
–>2NH
3

2. Reakcje analizy - z substancji złożonej tworzą się dwie(lub więcej) nowe
substancje
AB–>A+B
np. CaCO
3
–>CaO+CO
2
3. Reakcje wymiany - polegają na przekształceniu dwóch lub więcej substancji
wyjściowych w nowe substancje o innym ugrupowaniu atomów lub
jonów wchodzących w ich skład
3.1. Reakcje wymiany pojedynczej
A+BC–>AB+C lub AC+B
np. Zn+2HCl–>ZnCl
2
+H
2
3.2. Reakcje wymiany podwójnej
AB+CD–>AC+BD lub AD+BC
np. BaCl
2
+H
2
SO
4
–>BaSO
4
+2HCl
3.3. Reakcje podstawienia (substytucji) - polegajace na tym, że atom lub
grupa funkcyjna w cząsteczce zostaje podstawiona(zastąpiona)
przez inny atom lub grupę funkcyjną
np. CH
3
CH
2
Br+OH
-
–>CH
3
CH
2
OH+Br
-
4. Reakcje przyłączenia -charakterystyczne dla związków zawierajacych
w cząsteczce wiązania wielokrotne: polegajace na przyłączeniu atomu
lub grupy funkcyjnej do takiej cząsteczki, przy czym następuje
wysycenie wiązań
np. CH
2
=CH
2
+Cl–>CH
2
Cl–CH
2
Cl
5. Reakcje eliminacji -polegające na oderwaniu od cząsteczki substratu dwóch
podstawników
np. CH
3
-CH
2
-Br+OH
-
–>CH
2
=CH
2
+Br
-
+H
2
O
6. Przegrupowanie wewnątrzcząsteczkowe - polegające na zmianie struktury
lub przestrzennego rozmieszczenia atomów w cząsteczce (np.
przegrupowanie pinakolinowe)

4. Reakcje pseudojednocząsteczkowe
Jedna z reagujących substancji występuje w tak dużym nadmiarze, że jej stężenie
praktycznie nie ulega zmianie w czasie reakcji, np. hydroliza octanu etylu w
środowisku kwaśnym
H+
CH COOC H + H O → CH COOH + C H OH
₃
₂ ₅
₂
₃
₂ ₅
5. Metody wyznaczania rzędu reakcji.
Rząd reakcji – suma wykładników potęgowych w równaniu kinetycznym (n).
równanie kinetyczne (postać ogólna):
v=k c
A
α
c
B
β
c
C
χ
. ..
n=α β χ .. .
Reakcje dzielimy na reakcje rzędu:
− zerowego (reakcje, których szybkość nie zależy od stężenia reagenta, np.
reakcje fotochemiczne, niektóre reakcje elektrolizy),
− pierwszego (reakcje w których szybkość zależy w pierwszej potędze od
stężenia reagenta. Są to m. innymi reakcje rozpadu promieniotwórczego,
− drugiego (reakcje w których suma wykładników potęg w równaniu
kinetycznym jest równa 2).
Znane są także reakcje o rzędowości ułamkowej. Tłumaczy się to tym, że reakcje
są reakcjami wieloetapowymi.
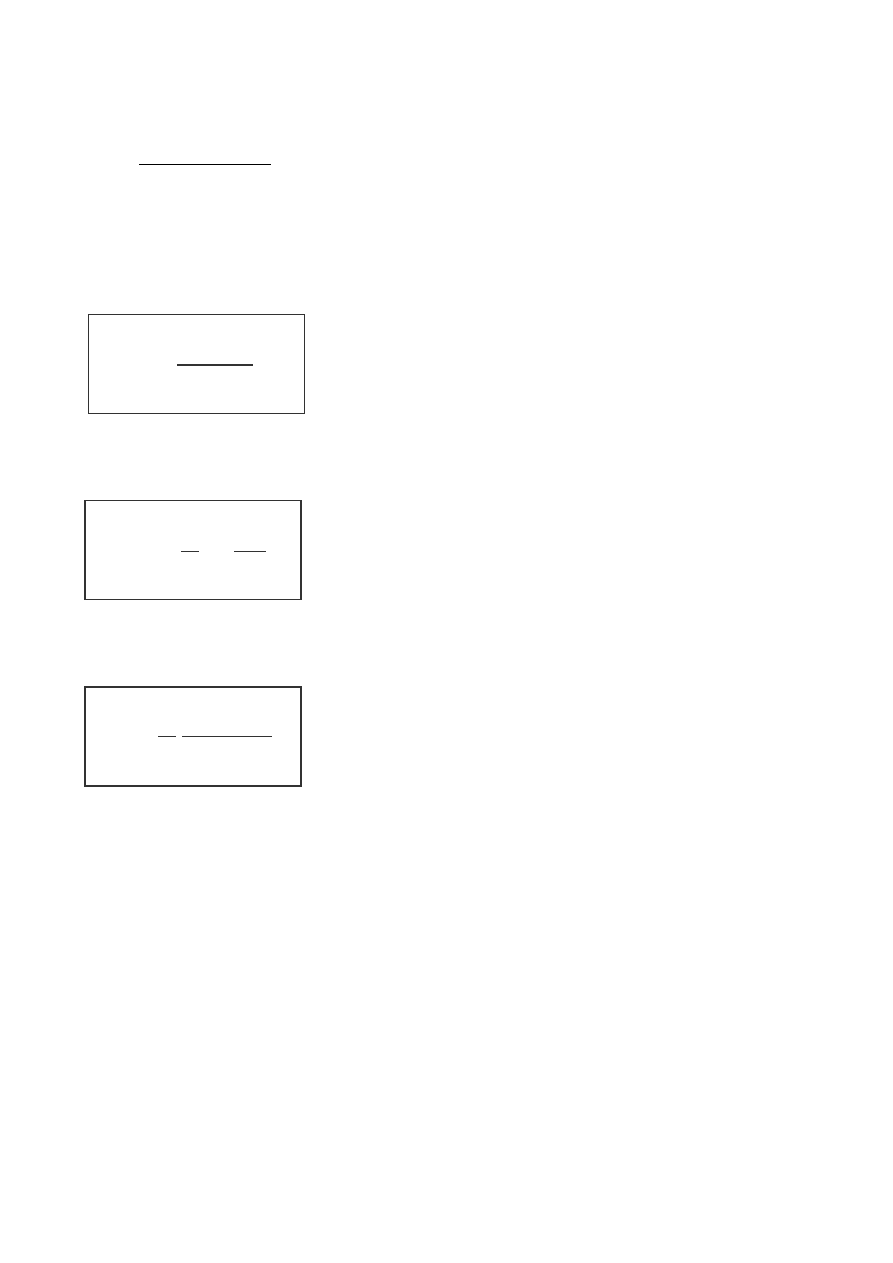
Metody wyznaczania rzędu reakcji:
–
podstawiania
oznaczonych stężeń, w znanych odstępach czasu, do
scałkowanego kinetycznego równania reakcji. Dane doświadczalne podstawia
się do równań kinetycznych różnych rzędów i stwierdza, dla którego z nich
wartość stałej szybkości jest faktycznie stała
n=0
n=1
n=2
k =
c
ο
c
t
k =
1
t
ln
c
ο
c
k =
1
t
c
ο
−
c
c
ο
⋅
c
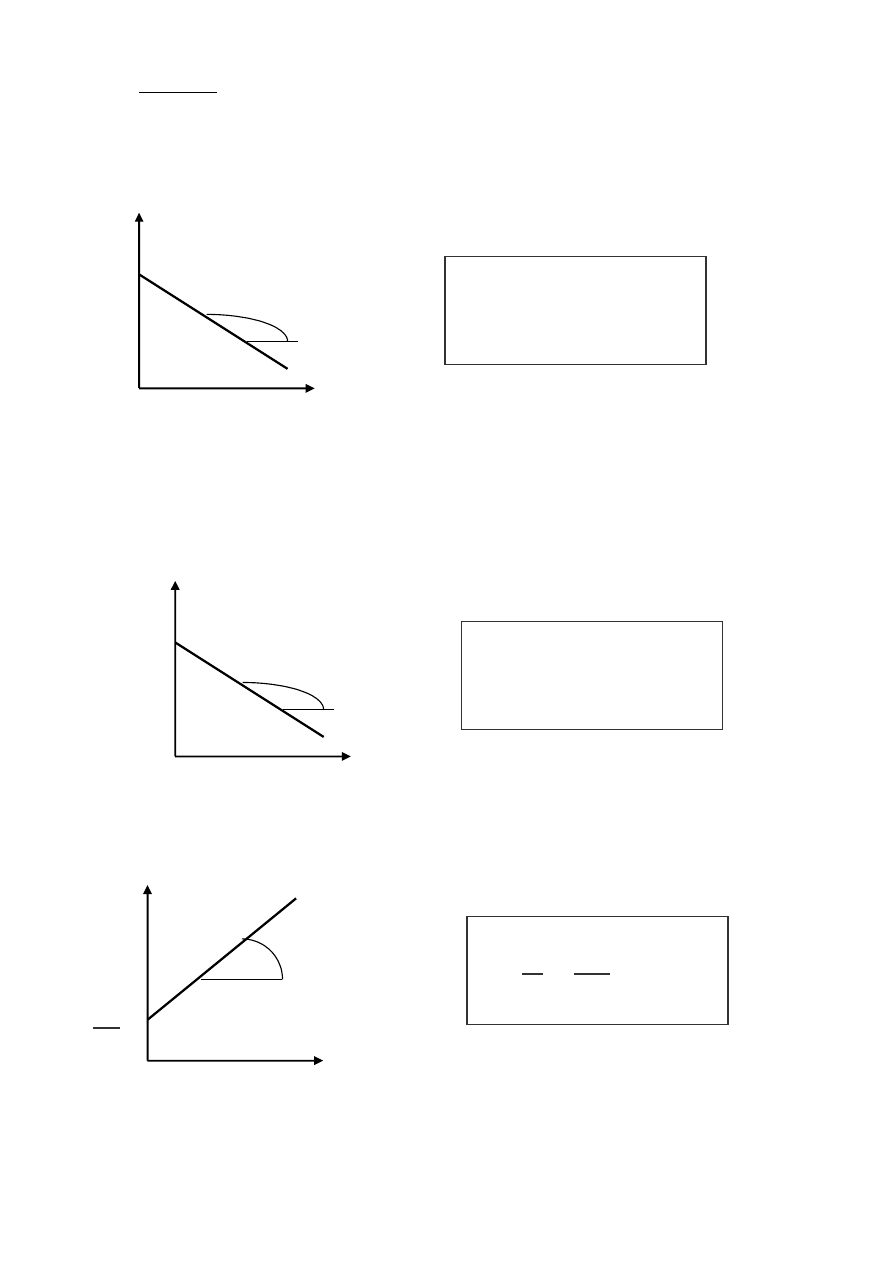
–
graficzna
n=0
n=1
n=2
c
c
o
t
α
tg α = a = k
c=c
ο
−
k t
ln c
ln c
o
t
α
tg α = a = k
ln c =ln c
ο
−
k t
t
1
c
ο
α
tgα = a = k
1
c
=
1
c
ο
k t
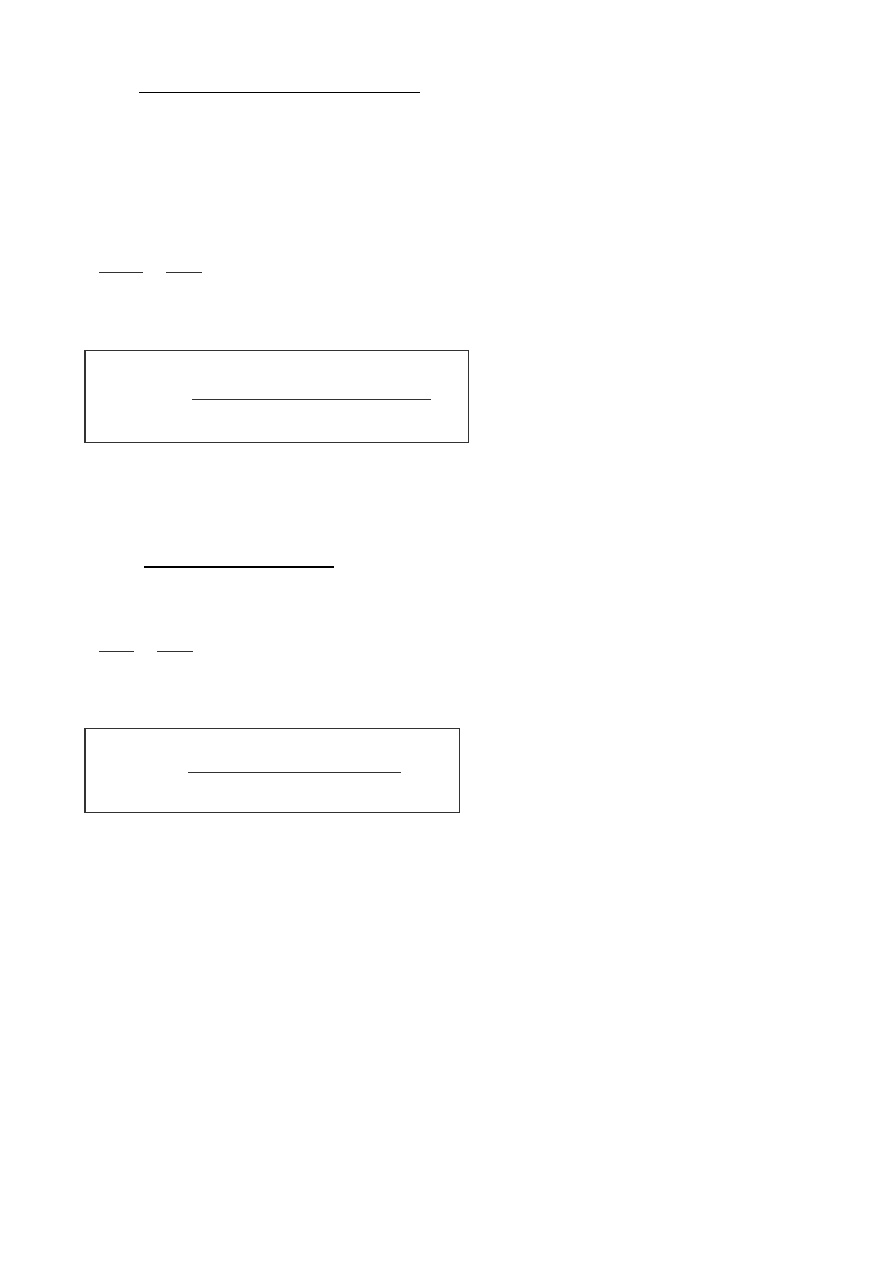
–
całkowa Ostwalda i Zawidzkiego
wychodzi się z dwóch różnych stężeń początkowych i oznacza czasy t
1
i t
2
, po
których przereaguje ten sam ułamek początkowego stężenia substratu:
t
0 . 51
t
0. 5 2
=
c
ο
2
c
ο
1
n−1
–
różnicowa van’t Hoffa
v
0 1
v
0 2
=
c
ο
1
c
ο
2
n
6. Polarymetria
Technika analityczna, która wykorzystuje zjawisko skręcania płaszczyzny
światła spolaryzowanego do wykrywania lub oznaczania stężenia substancji
optycznie czynnej.
Przyrządem służącym do oznaczania kąta skręcenia płaszczyzny światła
spolaryzowanego jest polarymetr.
n=1
log t
0. 5 1
−
log t
0. 5 2
log c
ο
2
−
log c
ο
1
n=
log v
01
−
log v
0 2
log c
ο
1
−
log c
ο
2
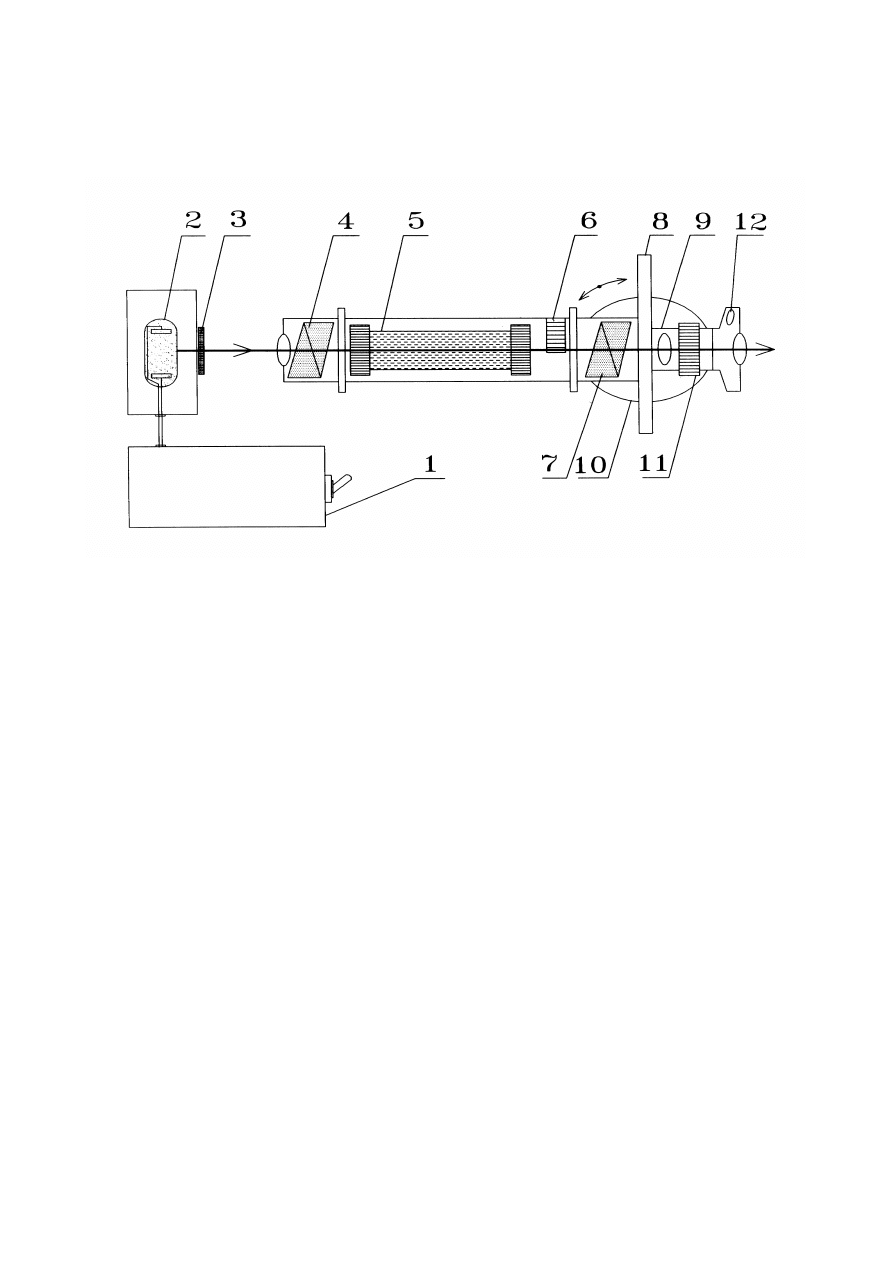
SCHEMAT BUDOWY POLARYMETRU
1 - transformator obniżający napięcie
2 - lampa sodowa
3 - matówka
4 - polaryzato,
5 - kuweta z roztworem cukru
6 - płytka półcieniowa
7 - analizator
8 - obrotowy kątomierz z noniuszem do odczytu kąta skręcenia płaszczyzny
polaryzacji
9 - lunetka
10 - pokrętło do regulacji kątomierza
11 - pokrętło do ustawiania ostrości obrazu
12 - soczewka do odczytywania kąta z kątomierza

7. Elektromagnetyczna teoria światła
Falami elektromagnetycznymi nazywamy indukujące się wzajemnie zmienne
pola elektryczne i magnetyczne, przy czym wektor natężenia pola elektrycznego
i wektor indukcji pola magnetycznego są w każdym punkcie prostopadłe do siebie
i do kierunku rozchodzenia się fali (fale poprzeczne).Prędkość rozchodzenia się fal
elektromagnetycznych w próżni jest równa prędkości światła w próżni.
WŁAŚCIWOŚCI FAL ELEKTROMAGNETYCZNYCH:
- emiotowane z nadajnika, a odbierane przez odbiornik
- przechodzą przez izolatory, a nie przechodzą przez przewodniki
- podlegają zjawisku odbicia zgodnie z prawem odbicia
- jest falą poprzeczną
- ulegają zjawisku dyfrakcji, interferencji i polaryzacji
Dla światła zachodzą zjawiska interferencji, dyfrakcji oraz polaryzacji, co
świadczy, że jest ono falą. Dodatkowo polaryzacja (z którą mamy do czynienie
w opisywanym doświadczeniu) jest dowodem na to, że światło jest falą poprzeczną,
bo tylko ten rodzaj fal ulega polaryzacji.
8. Polaryzacja liniowa światła
Ma miejsce, gdy drgania wektora natężenia pola elektrycznego zachodzą tylko
w jednej płaszczyźnie, która nie zmienia w czasie swej orientacji w przestrzeni
(płaszczyzna drgań wektora jest ta sama wzdłuż całego promienia).
9. Aktywność optyczna, skręcanie płaszczyzny polaryzacji światła
Aktywność optyczna lub czynność optyczna to właściwość niektórych
związków chemicznych polegająca na zdolności skręcania płaszczyzny polaryzacji
światła spolaryzowanego.
Warunkiem koniecznym występowania aktywności optycznej cząsteczek jest
ich chiralność, czyli istnienie w formie dwóch nienakładalnych enancjomerów. Nie
wszystkie cząsteczki chiralne wykazują jednak aktywność optyczną. Aby ją
wykazywać w zauważalnym stopniu, chiralne cząsteczki muszą posiadać silnie
spolaryzowane wiązania chemicznej blisko centrum chiralności lub posiadać przy
tym centrum znacząco różne podstawniki.

Skręcalność optyczna jest funkcją długości fali światła. Cząsteczki dla różnych
długości fal mogą skręcać światło w prawo, w lewo lub w ogóle.
Współczynnik γ nazywamy skręceniem właściwym lub zdolnością skręcającą
roztworu.
Skręcenie właściwe zależy od długości fali padającego światła. Zjawisko
zależności skręcenia właściwego od długości fali światła nosi nazwę dyspersji
skręcenia płaszczyzny drgań. Na ogół skręcenie właściwe γ maleje wraz ze wzrostem
długości fali światła.
Skręcenie płaszczyzny polaryzacji zależy od kąta pomiędzy kierunkiem
rozchodzenia światła a kierunkiem wektora indukcji magnetycznej. Jest ono
największe, gdy światło biegnie równolegle do kierunku wektora indukcji
magnetycznej.
WYKONANIE ĆWICZENIA
Kolejno do kolbek stożkowych odmierzono 25 cm³ 0,5M cukru i 25 cm³ 2M HCl.
Roztwory zmieszano i przelano do rurki polarymetru. Kąt skręcenia odczytywano po
upływie określonego czasu, tj. 10, 20, 30, 50 i 75min.
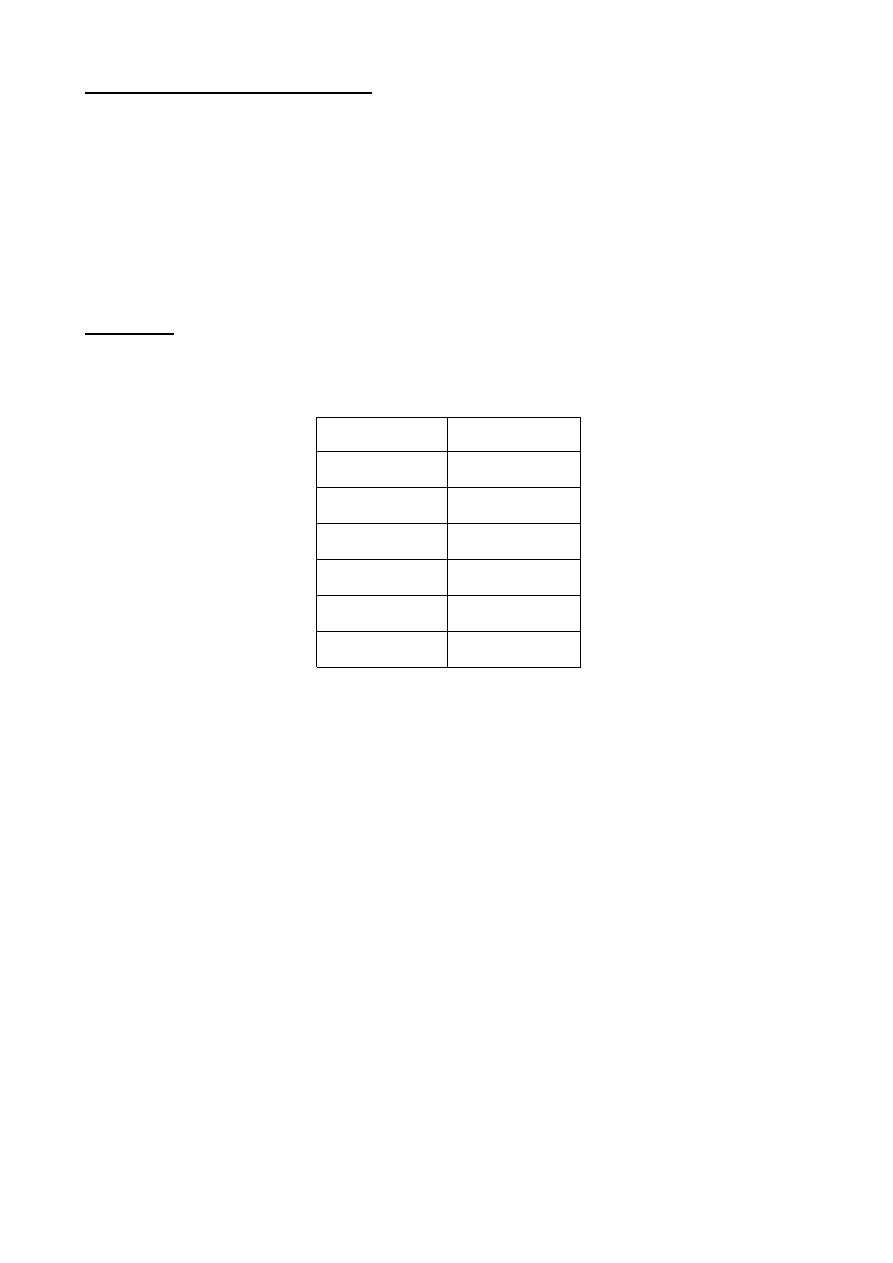
WYNIKI
GODZINA
STOPNIE
12:50
11'
13:00
10'
13:10
9,5'
13:20
8,8'
13:40
7,5'
14:05
6'
k = [ 2,303/ t ] * lg [ ( φ
0
– φ
͚ ) / ( φ
t
– φ
͚ ) ]
k
1
= [ 2,303 / 10 ] * lg [ ( 13,5 ) / ( 12,5 ) ] = 7,70 * 10
–3
k
2
= [ 2,303 / 20 ] * lg [ ( 13,5 ) / ( 12,0 ) ] = 5,89 * 10
-3
k
3
= [ 2,303 / 30 ] * lg [ ( 13,5 ) / ( 11,3 ) ] = 5,93 * 10
-3
k
4
= [ 2,303 / 50 ] * lg [ ( 13,5 ) / ( 10,0 ) ] = 6,00 * 10
-3
k
5
= [ 2,303 / 75 ] * lg [ ( 13,5 ) / ( 8,5 ) ] = 6,17 * 10
-3

lp
czas
φ
0
φ
͚
φ
t
φ
0
– φ ͚ φ
t
– φ ͚
Stała szybkości
reakcji k
1
10’
11˚ 2,5˚
10˚
13,5˚
12,5˚
7,70 * 10
–3
2
20’
11˚ 2,5˚ 9,5˚
13,5˚
12˚
5,89 * 10
3
3
30’
11˚ 2,5˚ 8,8˚
13,5˚
11,3˚
5,93 * 10
3
4
50’
11˚ 2,5˚ 7,5˚
13,5˚
10˚
6,00 * 10
3
5
75’
11˚ 2,5˚
6˚
13,5˚
8,5˚
6,17 * 10
3
Wyliczanie kąta φ
0
lg ( φ
0
– φ
͚ ) = 1,128
lg (φ
0
- (-2,5) ) = 1,128
( φ
0
+ 2,5 ) =
10
1,128
φ
0
= 10,92 ~ 11

DANE do WYKRESU
lg ( φ
0
– φ )
͚
t
10
1,0969
20
1,0792
30
1,0531
50
1,0000
75
0,9294
(wykres stanowi załącznik do sprawozdania)
Wyszukiwarka
Podobne podstrony:
Biofizyka2 cw11, Biofizyka, V Semestr, Biofizyka II, ćwiczenia
PSE Cw11
cw11 Badanie przebiegow okresowych
sprawozdaniiiie kasia cw11
cw11-spr, Politechnika
CW11
ćw11 - Badania właściwości materiałów łożyskowych, Wstępy na materiałoznawstwo
Informatyka zadanie 14 06 10 Tomasiewicz ćw11,12 Etykiety?resowe
Cw11 inst
projekt 11, MPKL ćw11, ORGANIZACJA I ZARZĄDZANIE PRODUKCJĄ
SIP Lab cw11
cw11 id 100602 Nieznany
cw11 rownowagi redox
Cw11, Politechnika Wrocławska - Materiały, fizyka 2, paczka 1, 11 modul younga predkosc dzwieku
inżynieria ćw11, Studia, I o, rok II, semestr III, inżynieria materiałowa, od Asi
więcej podobnych podstron