Seminarium 2
1.
Budowa przeciwciał i
receptorów limfocytów T
rozpoznających antygen.
2.
Źródła różnorodności
przeciwciał i receptorów
limfocytów T rozpoznających
antygen.
3.
Zastosowanie przeciwciał
monoklonalnych i ich
pochodnych.
Budowa i funkcja
przeciwciał

Frakcje białek osocza
Immunology, Kuby J., 5 ed.
osocze (natywne)
osocze po
adsorbcji
antygenem

Przeciwciała
glikoproteiny wiążące antygen obecne
na błonie komórkowej limfocytów B
(BCR) lub wydzielane do płynów
ustrojowych
przeciwciało związane z błoną
komórkową (BCR) odpowiada za
specyficzność klonów limfocytów B
przeciwciała wydzielnicze krążą we
krwi, neutralizują antygeny lub „znakują” je
do eliminacji

przeciwciało związane z błoną
przeciwciało wydzielnicze
jeden antygen
wiele epitopów
jeden antygen
wiele klonów
limfocytów B
wiele przeciwciał
o różnej
specyficzności
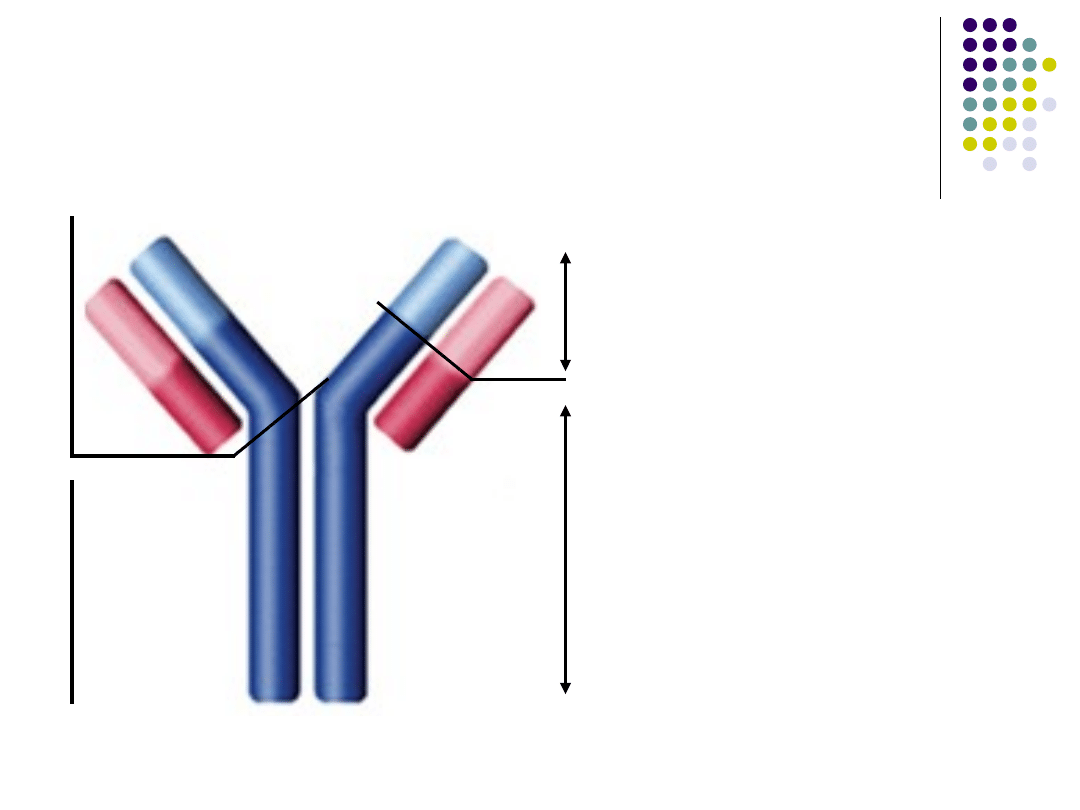
Budowa przeciwciał
Łańcuch lekki
Domena V
L
Domena
V
H
Miejsce wiążące
antygen
antygen
Łańcuch ciężki
Struktura przeciwciał
Region zmienny (V)
różnicuje przeciwciało o
jednej specyficzności od innych
Region stały (C)
dwa podtypy łańcuchów lekkich
(κ, λ)
pięć klas łańcucha ciężkiego
(γ, δ, ε, α, µ)
warunkuje klasę przeciwciała
ła
ńc
uc
h l
ek
ki
ła
ńc
uc
h c
ię
żk
i
Fab
Fc

Struktura IgG
Immunology, Kuby J., 5 ed.
idiotop – markery części
zmiennych pozwalające
na wyróżnienie idiotypu
przeciwciała
paratop – fragment
wiążący epitop antygenu
epitop – fragment
antygenu rozpoznawany
przez przeciwciało

Budowa przeciwciał

Region determinują
dopasowanie (CDR)
krótka sekwencja aminokwasowa
regionów zmiennych wszystkich
receptorów wiążących antygen która
dopasowuje się do antygenu a tym
samym zapewnia receptorowi
specyficzność względem danego
antygenu
każdy łańcuch lekki i ciężki posiada po
trzy CDR
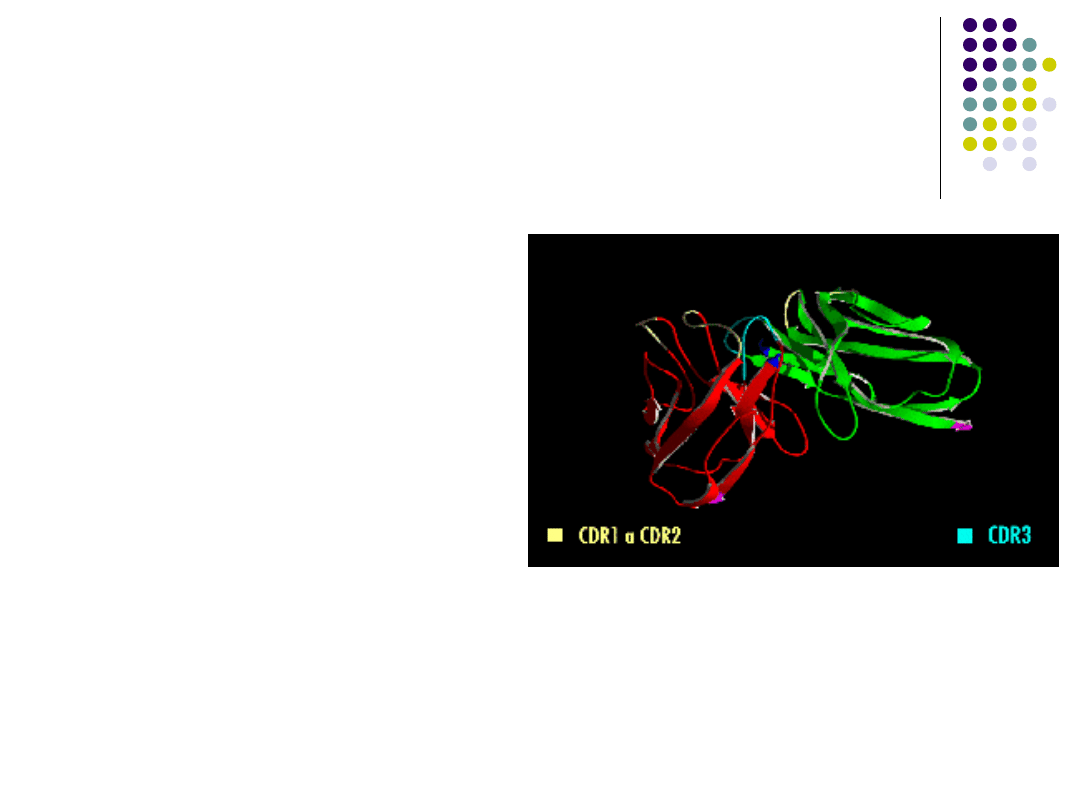
Zmienność regionów
zmiennych jest
skoncentrowana w CDR
większość
możliwości zmian w
genach dla
przeciwciał znajduje
się w sekwencjach
kodujących CDR,
stąd są one czasem
nazywane
regionami
hiperzmiennymi
3D model przeciwciała z pojedynczego
łancucha (scFV). Zaznaczono regiony CDR
en.wikipedia.org

Jak przeciwciało
rozpoznaje antygen?

Budowa przeciwciała
determinuje jego funkcje
Domeny regionu zmiennego:
V
H
i V
L
swoiste wiązanie
antygenu
Domeny regionu stałego:
C
H1
i C
L
wydłuża ramiona Fab
zwiększa maksymalną
rotację fragmentów
Fab
łączy łańcuchy lekki i
ciężki wiązaniem
dwusiarczkowym
zwiększa zmienność
przeciwciał poprzez
ułatwienie losowego
łączenia domenVH i VL
Region zawiasowy
obecny tylko na
łańcuchach ciężkich
γ, δ i α
zwiększa ruchomość
(dwa ramiona Fab
mogą wyginać się
pod różnymi kątami
podczas wiązania
antygenu)
uwrażliwia na
cięcie enzymami
proteolitycznymi
Domeny poszczególnych
klas przeciwciał
IgA IgG IgD
IgM IgE
CH1/CH1
CH1/CH1
Region zawiasowy
CH2/CH2
CH2/CH2
CH3/CH3
CH3/CH3
CH4/CH4

Domeny regionu stałego:
C
H2,
C
H3,
C
H4
Odpowiedzialne za:
wiązanie z
receptorami dla Fc
wiązanie i aktywację
dopełniacza
transport przez
łożysko

Cechy przeciwciał
SWOISTOŚĆ zdolność do wybiórczego
wiązania konkretnego antygenu
POWINOWACTWO siła wiązania
pojedynczej determinanty antygenowej
przez miejsce wiążące antygen przeciwciała
(różne dla przeciwciał o tej samej swoistości
pochodzących z różnych klonów limfocytów)
AWIDNOŚĆ = ZACHŁANNOŚĆ siła
wiązania wielowartościowego antygenu

Powinowactwo a
awidność

Działanie przeciwciał
przeciwciała nie zabijają ani nie usuwają
patogenów poprzez przyłączenie antygenu
aby zaistniała humoralna odpowiedź
przeciwzakaźna przeciwciało musi
indukować odpowiedź komórek
efektorowych (np. fagocytozę przez
komórki żerne), które w konsekwencji
spowodują śmierć lub neutralizację
patogenu

Właściwości przeciwciał
wiążąc antygeny na powierzchni niektórych komórek, np.
zakażonych wirusami lub nowotworowych bądź na
powierzchni niektórych mikroorganizmów mogą indukować
ich zniszczenie przez:
aktywację dopełniacza,
indukcję immunofagocytozy,
indukcję cytotoksyczności komórkowej zależnej od
przeciwciał (ADCC),
wiążąc antygen na powierzchni mikroorganizmów mogą
blokować ich wnikanie, np. przez nabłonek jelit,
wiążąc toksyny mogą blokować ich działanie,
wiążąc antygeny na cząsteczkach lub komórkach mogą
indukować zlepianie się (aglutynację),
niektóre przeciwciała (abzymy) mogą spełniać rolę
enzymów w stosunku do wiązanych przez siebie antygenów

Klasy przeciwciał
IZOTYP
zależy od klasy regionu stałego
łańcucha ciężkiego
wyróżniamy 5 klas łańcucha ciężkiego (klas
p-ciał):
µ
α
ε
δ
γ

Klasy przeciwciał
łańcuch ciężki determinuje zatem klasę
przeciwciała:
µ IgM
α IgA
ε IgE
δ IgD
γ IgG

Klasy przeciwciał
niewielkie różnice w sekwencji
aminokwasowej łańcuchów ciężkich α
i γ spowodowała wyróżnienie kilku
podklas:
α1 i α2 (IgA1 i IgA2)
γ1, γ2, γ3, γ4
(IgG1, IgG2, IgG3, IgG4)
Która część przeciwciała odpowiada
za aktywność biologiczną (funkcję
efektorową)?
Immunology, Kuby J., 5 ed.

Kompleksy
immunologiczne
kompleks
antygen-przeciwciało
=
kompleks
immunologiczny

Kompleksy
immunologiczne
W powstawaniu kompleksów
immunologicznych ważną
rolę odgrywa dopełniacz,
który:
hamuje ich wytrącanie czyli
precypitację,
częściowo rozpuszcza
kompleksy już wytrącone,
indukuje ich usuwanie przez
komórki żerne
Krążące kompleksy mogą się
np. odkładać w ścianach
drobnych naczyń skóry,
stawów i nerek, aktywują
dopełniacz i indukują stany
zapalne uszkadzające tkanki.

Stężenia przeciwciał u
płodu i dziecka

Stężenia przeciwciał podczas
rozwoju odpowiedzi
immunologicznej
odpowiedź
pierwotna
odpowiedź
wtórna
pierwsza
ekspozycja
na antygen
druga
ekspozycja
na antygen
tygodnie
st
ę
że
n
ie
p
rz
e
ci
w
ci
a
ł
w
o
so
cz
u

IgA
Organizm wytwarza więcej IgA niż
wszystkich innych immunoglobulin
razem wziętych, z których większość
jest wytwarzana miejscowo w
sąsiedztwie odpowiedniego nabłonka
i przechodzi do wydzielin
surowiczych i śluzowych.
Wydzielnicze IgA stanowią główny
element obrony błon surowiczych i
śluzowych przed inwazją
mikroorganizmów, a błony te są
potencjalnie największymi wrotami
zakażenia

IgA
w osoczu – występują gł. w formie
monomerycznej (80-95%), a tylko w
niewielkim odsetku w formach
polimerycznych (di-, tri- i tetramery)
w wydzielinach takich jak łzy, pot,
wydzieliny gruczołów przewodu
pokarmowego, dróg
oddechowych i dróg moczowych,
IgA występują w formie dimerów
związanych dodatkowo z tak zwanym
fragmentem wydzielniczym
. Są to
wydzielnicze IgA czyli
S-IgA
(secretory IgA).

Wydzielanie IgA

IgM
syntetyzowane w
początkowej fazie
odpowiedzi immunologicznej
pierwsze przeciwciała
syntetyzowane w rozwoju
osobniczym
uwalniane jako pierwsze
w
rozwoju pierwotnej
odpowiedzi immunologicznej
ich
powinowactwo do
antygenu jest na ogół małe
,
gdyż ich uwalnianie zachodzi
jeszcze przed dojrzewaniem
powinowactwa

IgM
mają aż 10
fragmentów Fab, stąd
łączą się z antygenem
mającym wiele
epitopów z
dużą
zachłannością, czyli
awidnością
aktywują dopełniacz
silniej niż IgG

IgG
występują w
najwyższym stężeniu
w osoczu
biorą udział w:
aktywacja dopełniacza
drogą klasyczną
ADCC
immunofagocytoza
jedyne przeciwciała
przechodzące przez
łożysko

podklasy IgG

IgE
wiążąc się z odpowiednimi
receptorami FcR na
komórkach tucznych
wywołują po przyłączeniu
antygenu degranulację
tych komórek
przeciwciała IgE
uczestniczą w obronie
przeciw pasożytom
oraz w
zjawiskach
nadwrażliwości
typu I (alergiach)

Degranulacja komórki
tucznej
zawartość
ziarnistości
(m.in.
histamina)
komórka tuczna
ziarnistości
degranulacja
receptor Fcε
IgE
Alerge
n

IgD
występują dość licznie,
wraz z IgM, na
powierzchni limfocytów
B, które nie zetknęły się
jeszcze z antygenem
(
limfocyty B dziewicze
),
jako ich receptory
immunoglobulinowe.
funkcja IgD pozostaje
mało poznana
bardzo małe stężenie w
płynach tkankowych

Do czego służą różne
klasy przeciwciał?

Do czego służą różne
klasy przeciwciał?
IgM początkowe etapy odpowiedzi
immunologicznej (przed dojrzewaniem
powinowactwa), aktywacja dopełniacza
IgA związane z błonami śluzowymi i
płynami surowiczymi
IgG ADCC, immunofagocytoza,
aktywacja dopełniacza, przechodzą
przez łożysko
IgE degranulacja komórek tucznych
Przypadki kliniczne
PRZYPADEK 1
28-letnia kobieta w 20
tygodniu ciąży
przeciwciała
przeciwko
toksoplazmozie:
IgM ↓
IgG ↑
przeciwciała
przeciwko cytomegalii
IgM ↑
IgG ↑
PRZYPADEK 2
30-letnia kobieta w 25
tygodniu ciąży
przeciwciała
przeciwko
toksoplazmozie:
IgM ↑
IgG ↓
przeciwciała
przeciwko cytomegalii
IgM ↓
IgG ↓

Przypadek 3
2-miesięczne niemowlę urodzone przez
matkę HIV(+) ma dodatni wynik
badania serologicznego na obecność
przeciwciał anty-HIV
czy badane niemowlę jest zakażone?

Markery antygenowe
przeciwciał (1)
izotypowe
(uwarunkowane przez pewne
zasadnicze
różnice w budowie łańcuchów
ciężkich i lekkich
– umożliwiają podział na
klasy i typy). Zdrowi osobnicy mają
zazwyczaj wszystkie odmiany izotypowe,

Markery antygenowe
przeciwciał (2)
allotypowe
– zależne od obecności w łańcuchach
ciężkich i lekkich (głównie w częściach stałych) różnych
aminokwasów w określonej pozycji łańcucha
polipeptydowego. U różnych osobników danego gatunku
można wykryć różne odmiany allotypowe. Geny kodujące
immunoglobuliny są bowiem genami
poliallelicznymi
.

Markery antygenowe
przeciwciał (3)
idiotypowe
– związane z różnicami w
budowie części zmiennych łańcuchów
polipeptydowych. Przeciwciała mające tę
samą
swoistość
mają te same markery
idiotypowe.
Powstawanie
przeciwciał

Nagrody Nobla za badania nad
przeciwciałami
Susumu Tonegawa
„za odkrycie
genetycznych zasad
zmienności i
różnorodności
przeciwciał”
Gerald M.
Edelman
Rodney R.
Porter
„za odkrycie chemicznej
struktury przeciwciał”
1972
1987

genom człowieka zawiera jedynie ok. 30
tysięcy genów
tylko niektóre spośród nich kodują części
zmienne immunoglobulin
jak możliwa jest zatem swoista
odpowiedź na nieograniczoną liczbę
antygenów występujących w
środowisku?
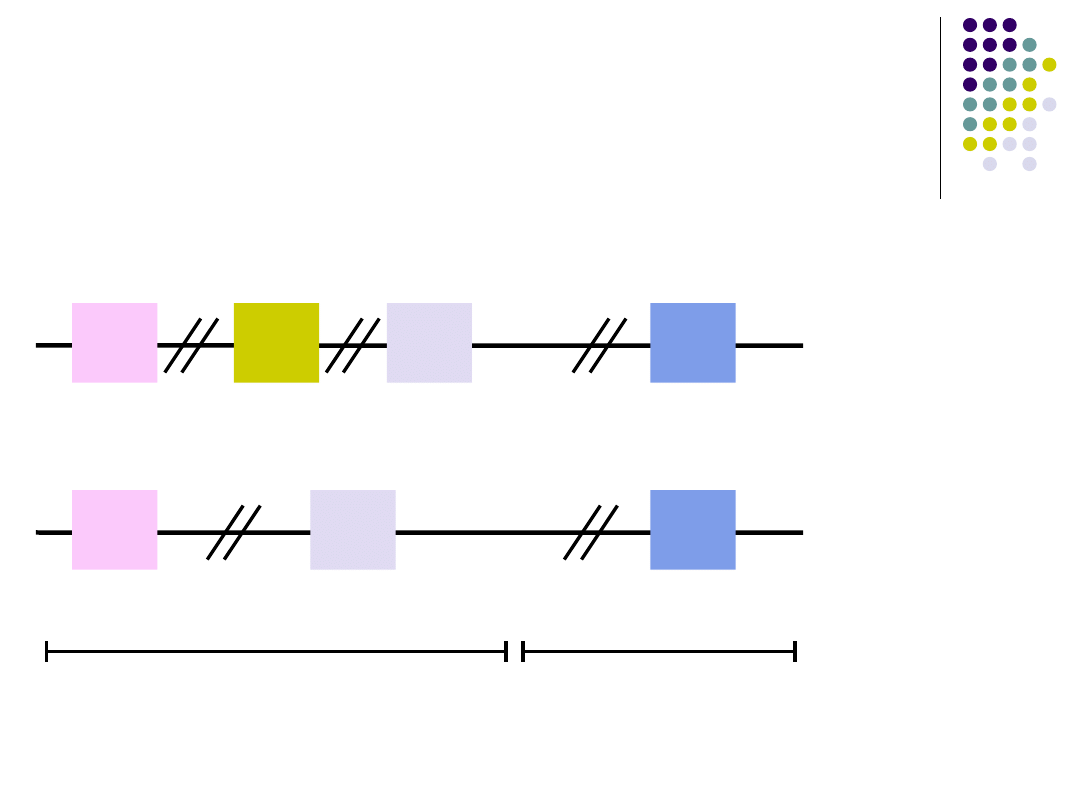
Powstawanie przeciwciał
V
D
J
C
V
J
C
Geny
łańcucha
ciężkiego Ig
Geny
łańcucha
lekkiego Ig
Geny części
zmiennej Ig
Geny części
stałej Ig

Synteza łańcucha
ciężkiego

Źródła zmienności
przeciwciał
występowanie segmentów V, D i J
w wielu wariantach
(polimorfizm
genów immunoglobulinowych)
rekombinacja łącząca przypadkowo segmenty genowe
V, D i J w trakcie formowania się genu dla części
zmiennych łańcuchów ciężkich i segmenty V i J dla
części zmiennych łańcuchów lekkich (
zmienność
rekombinacyjna
),
zmienność na złączach
segmentów genowych V, D i
J (delecja nukleotydów na złączu, regiony N,
nukleotydy P, chwytanie oligonukleotydów),
mutacje somatyczne
.

Źródła zmienności
przeciwciał
występowanie segmentów V, D i J w wielu wariantach
(polimorfizm genów immunoglobulinowych)
rekombinacja łącząca przypadkowo
segmenty genowe V, D i J w trakcie
formowania się genu dla części
zmiennych łańcuchów ciężkich i
segmenty V i J dla części zmiennych
łańcuchów lekkich (
zmienność
rekombinacyjna
),
zmienność na złączach
segmentów genowych V, D i J (delecja
nukleotydów na złączu, regiony N, nukleotydy P, chwytanie
oligonukleotydów),
mutacje somatyczne
.
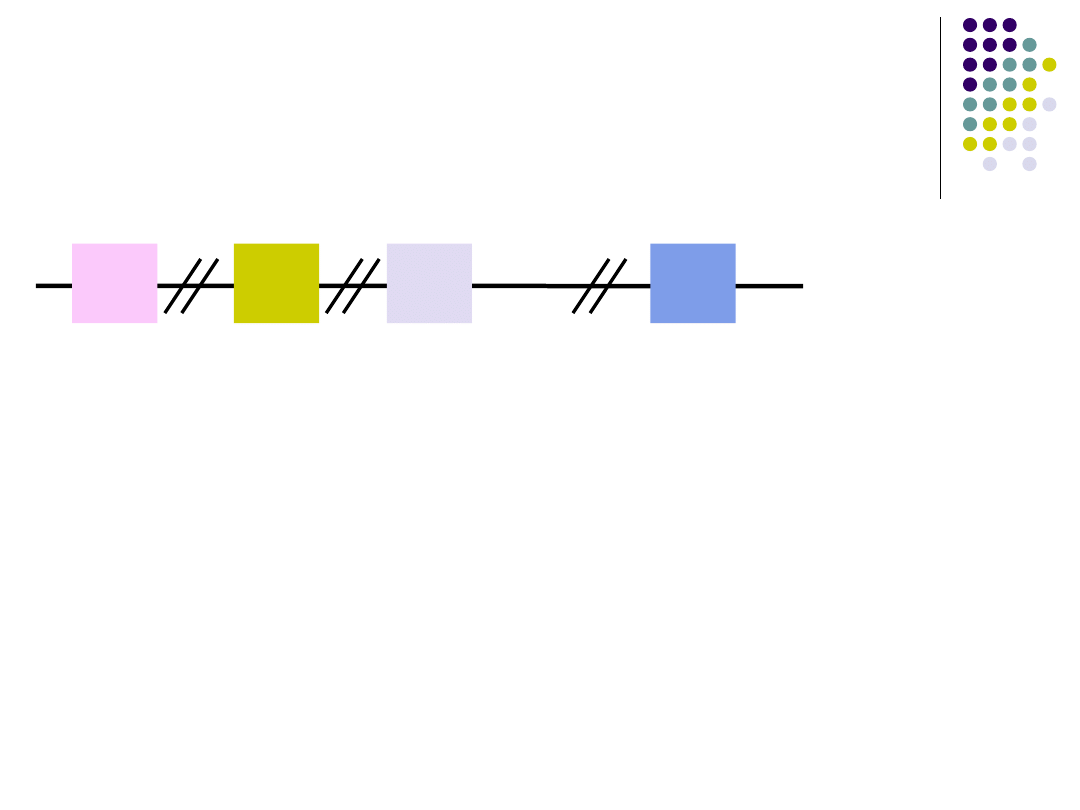
Rekombinacja genów dla
łańcucha ciężkiego
V
D
J
C
Geny
łańcucha
ciężkiego Ig
12
12
23
23
5’
3’
długość
wstawki
Rekombinacyjne łączenie fragmentów V, D i J zachodzi
dzięki działaniu rekombinazy, która rozpoznaje tzn.
sekwencje sygnałowe na każdym z fragmentów i łączy
je wg. zasady, że sekwencje łączą się tylko gdy w
jednej wstawka jest 12- a w drugiej 23- nukleotydowa.
Każdy segment D ma po obu stronach 23-nukleotydowe
wstawki, segment V po stronie 3’ i segment J po stronie
5’ mają wstawki 12 nukleotydowe.

Zmienność na złączach
•delecje w obrębie złącza
•dołączanie nukleotydów P
•bezładne dodawanie
nukleotydów – regiony N
(nowe odcinki DNA powstałe
na złączach przy pomocy
transferazy nukleotydów
terminalnych) !
bezmatrycowo !
•chwytanie nukleotydów
(dołączanie krótkich
oligonukleotydów odciętych w
innym miejscu)

Źródła zmienności
przeciwciał
występowanie segmentów V, D i J w wielu wariantach
(polimorfizm genów immunoglobulinowych)
rekombinacja łącząca przypadkowo segmenty genowe
V, D i J w trakcie formowania się genu dla części
zmiennych łańcuchów ciężkich i segmenty V i J dla
części zmiennych łańcuchów lekkich (
zmienność
rekombinacyjna
),
zmienność na złączach
segmentów genowych V, D i
J (delecja nukleotydów na złączu, regiony N,
nukleotydy P, chwytanie oligonukleotydów),
mutacje somatyczne
mutacje somatyczne
(gł. regiony
(gł. regiony
hiperzmienne, dojrzewanie
hiperzmienne, dojrzewanie
powinowactwa)
powinowactwa)

Mutacje somatyczne
(hipermutacje)
Dojrzewanie powinowactwa

Przełączanie klas
zachodzi po rozpoznaniu antygenu
przez limfocyt B
do zainicjowania tego procesu
niezbędna jest pomoc ze strony
limfocytów Th

Przełączanie klas

Przełączanie klas
Przeciwciała
monoklonalne

„za teorie dotyczące specyficzności w
rozwoju i kontroli układu odpornościowego i
odkrycie zasady produkcji przeciwciał
monoklonalnych”
Nagroda Nobla za badania nad
przeciwciałami monoklonalnymi
Niels K. Jerne
Georges J.F.
Köhler
César Milstein
1984

Jak powinna wyglądać
idealna „fabryka”
przeciwciał ?
musi posiadać umiejętność produkcji
przeciwciał
powinna produkować przeciwciała o
znanej jednej swoistości
mieć wysoką wydajność produkcji
przeciwciał
działać nieskończenie długo
Jak uzyskać „fabrykę”
przeciwciał monoklonalnych
produkcja przeciwciał
przeciwciała o jednej
znanej swoistości
nieśmiertelność
wysoka
produktywność
limfocyt B
klon
jednego
limfocytu B
szpiczak
komórka
nowotworowa
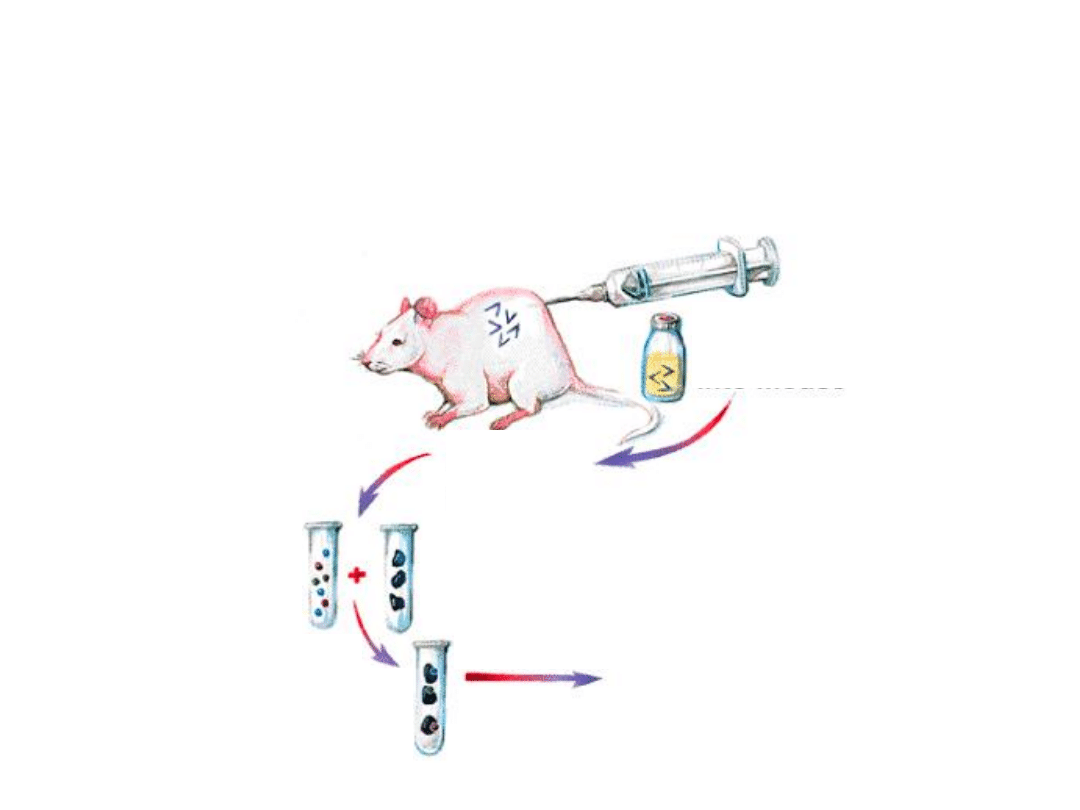
Wytwarzanie przeciwciał
monoklonalnych
Immunizacja
Limfocyty
B
aktywowan
e
antygenem
Limfocyty B
izolowane
ze
śledziony
Fuzja
Hybrydoma
Komórki
szpiczaka
Separacja
Hodowla klonów
produkujących
odpowiednie
przeciwciało
Typy przeciwciał
monoklonalnych

Technika wytwarzania ludzkich
przeciwciał monoklonalnych
istnieją aktualnie dwie
techniki inżynierii
genetycznej umożliwiające
wytwarzanie ludzkich
przeciwciał
monoklonalnych:
„phage display”
–
opracowana w 1985 roku,
technika tworzenia zwierząt
transgenicznych
–
opracowana w 1994 roku.

Metoda phage-display
Istotą metody „phage
display” jest
wbudowanie genów
dla części zmiennych
łańcuchów lekkich i
ciężkich do genomu
faga włókienkowego
,
co prowadzi do
ekspresji
kodowanych białek
na powierzchni faga.

Phage-display – biblioteki
scFv
Metoda „phage display”
umożliwia stworzenie
bibliotek
zawierających
swoistości w formacie
scFv
(jednołańcuchowe
białko, w skład którego
wchodzą części zmienne
łańcucha lekkiego i
ciężkiego związane
łącznikiem peptydowym).
Podobne “biblioteki”
tworzy się również w
oparciu o komórki
drożdży („yeast cell
display”) i rybosomy
(„ribosome display”).

Phage-display
Fagi wiążące dzięki tym
zabiegom odpowiedni
antygen można izolować,
po namnożeniu w
komórkach E. coli, na
kolumnach
opłaszczonych tym
antygenem. Można w ten
sposób in vitro imitować
selekcję limfocytów B
zachodzącą w trakcie
odpowiedzi
immunologicznej in vivo.

Phage-display
Powinowactwo do antygenu w
produkowanych cząsteczkach można
zwiększyć wprowadzając odpowiednie
mutacje do wbudowanych do
bakteriofaga genów
immunoglobulinowych. Do powyższych
celów można użyć zrekombinowanych
genów VDJ izolowanych z uczulonych lub
nieuczulonych limfocytów B człowieka.

Zwierzęta transgeniczne

Zwierzęta transgeniczne
Technika produkcji ludzkich MAb w oparciu o
zwierzęta transgeniczne (przede wszystkim
myszy) polega na wprowadzeniu osobno miniloci
dla genów V, D, J, μ i γ (w przypadku łańcucha
ciężkiego) oraz Vκ, Jκ i części stałej łańcucha
kappa do embrionalnych komórek macierzystych
myszy z zablokowanymi genami dla ich własnych
immunoglobulin.
Po uzyskaniu transgenicznych myszy, można je
immunizować i uzyskiwać limfocyty B
wytwarzające przeciwciała swoiste w stosunku do
odpowiednich antygenów. Limfocyty te mogą być
podstawą do tworzenia odpowiednich linii
hybrydoma.

Produkcja przeciwciał
monoklonalnych
Pochodne
przeciwciał
monoklonalnych

Pochodne przeciwciał
monoklonalnych
Najmniejszym
fragmentem
przeciwciała, który
zachowuje niewielką
zdolność wiązania
antygenu jest peptyd
obejmujący trzeci
region hiperzmienny
(
CDR3
) łańcucha
ciężkiego

Pochodne przeciwciał
monoklonalnych
monowalentne fragmenty Fab
fragmenty Fv (zawierające V
L
i V
H
)
jednołańcuchowe białka wiążące
antygen – scFv (single chain Fv) (ok. 28
kDa), składające się z domen VH i VL
związanych krótkim peptydowym
łącznikiem

Pochodne przeciwciał
monoklonalnych
formy Fv lub scFv –
biwalentne (diabodies),
triwalentne (tribodies), tetrawalentne
(tetrabodies)
połączenie Fv lub scFv o różnej swoistości –
formy bispecyficzne, trój- i czwórspecyficzne
miniciała
składające się z dwóch
fragmentów scFv, przyłączonych do
„minifragmentu” Fc, zawierającego dwie
domeny CH3

Pochodne przeciwciał
monoklonalnych

Pochodne przeciwciał
monoklonalnych -
immunokoniugaty
koniugaty przeciwciał z:
enzymami
toksynami
radioizotopami
lekami
cytokinami

Zastosowania przeciwciał
monoklonalnych:
diagnostyka
terapia:
chorób nowotworowych
chorób autoimmunologicznych
ostrych zespołów wieńcowych
starczego zwyrodnienia plamki
badania naukowe
inne
Przeciwciała monoklonalne
w diagnostyce
laboratoryjnej i badaniach
naukowych

Diagnostyka obrazowa
Radioscyntygrafia -
do umiejscowienia
nawet małych (3 mm średnicy) ognisk
nowotworowych używa się PM
przeciwnowotworowych sprzężonych z
radioizotopami i detektora promieniowania
Przeciwnowotworowe przeciwciała
monoklonalne znakowane technetem 99m i
indem 111 stosuje się do lokalizacji zmian
nowotworowych metodą
SPECT
(single
photon emission computed tomography)

Przeciwciało
monoklonalne
A33 związane z
radioizotopem
jodu w
diagnostyce
przerzutów raka
jelita grubego

ELISA

FACS - przykładowy
histogram

mieszanina komórek
laser
nowa kropla
sygnał pozytywny
brak sygnału
sygnał negatywny
brak sygnału
komórka niewyznakowana
czerwona komórka
pusta kropla
zielona komórka
Sortowanie
komórek
przy pomocy
cytometrii
przepływow
ej

Western blotting

Immunofluorescencja
diagnostyka pęcherzycy
IF bezpośrednia na bioptacie skóry
IF pośrednia (surowica chorego)
Przeciwciała
monoklonalne w
terapii

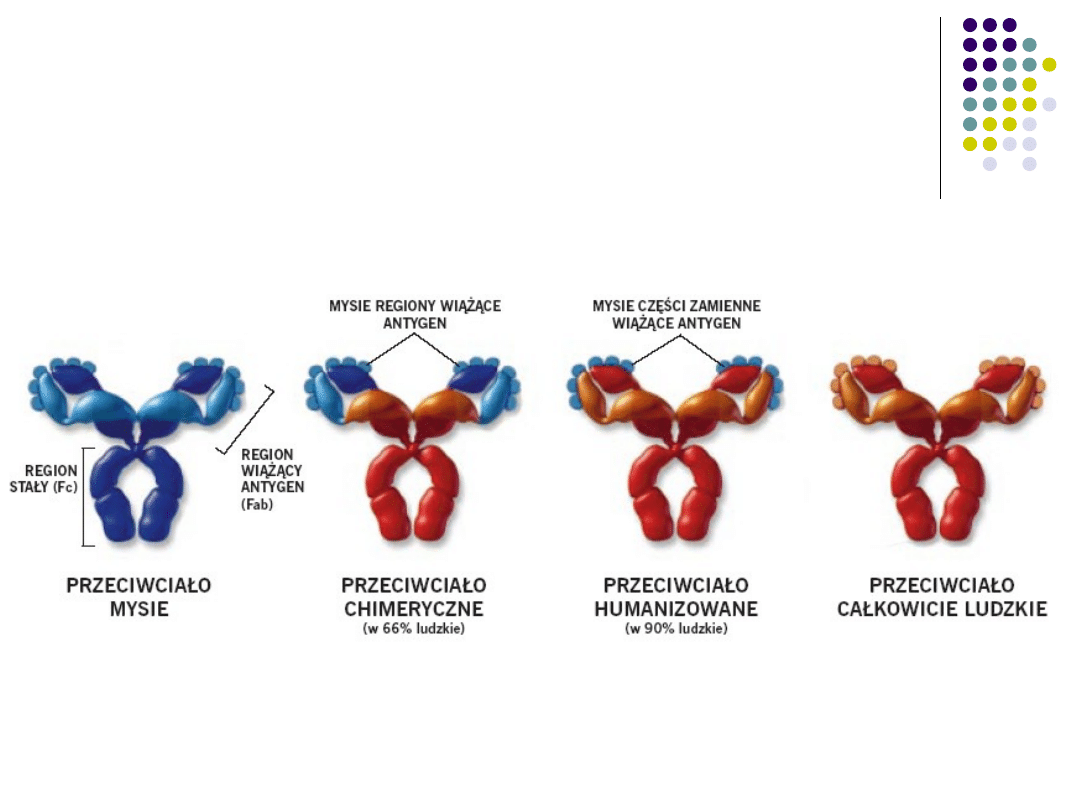
MAb w terapii
Większość stosowanych w lecznictwie PM
to formy chimeryczne lub humanizowane.
W roku 2003 zaaprobowano do użycia w
klinice pierwsze PM ludzkie (adalimumab).
Na skalę przemysłową PM uzyskuje się
przede wszystkim z hodowli
zmodyfikowanych genetycznie komórek
linii CHO (komórki jajnika chomika).

Przeciwciałą
monoklonalne w terapii

Onkologia
Rak piersi z nadekspresją onkogenu
her2/neu –
Trastuzumab
–
monoklonalne humanizowane
przeciwciało przeciwko białku Her2
terapia przerzutowego raka sutka
w połączeniu z chemioterapią

Onkologia – rak okrężnicy
Bevacizumab
– humanizowane MAb
przeciwko VEGF
w trakcie badań klinicznych
Cetuximab
– chimeryczne MAb
przeciwko EGFR
leczenie przerzutowego raka okrężnicy z
nadekspresją EGFR w połączeniu z
chemioterapią

Onkologia – hematologia
chłoniak nieziarniczy z limfocytów B w III i
IV stadium zaawansowania, nawrót
chłoniaka
Rituximab
– chimeryczne przeciwciało
monoklonalne przeciwko CD20
przewlekła białaczka limfatyczna (CLL) z
limfocytów B, gdy nieskuteczna jest
chemioterapia
Alemtuzumab
– chimeryczne przeciwciało
monoklonalne przeciwko CD25

Onkologia -
radioimmunokoniugaty
immunokoniugaty z radioizotopami
stosowane w terapii chłoniaków
nieziarniczych typu B:
sprzężone z jodem
131
I PM przeciwko CD20 –
tozytumomab
koniugat mysiego MAb przeciwko CD20 ze
związkiem chelatującym (tiuksetanem)
radioizotop itru
90
Ytr
lub indu
111
In –
ibrytumomab tiuksetan
.
To przeciwciało może być stosowane wyłącznie z innym MAb
przeciwko CD20 - rituximabem

Onkologia -
immunotoksyny
Gentuzumab ozogamicin
– immunotoksyna
składająca się z humanizowanego MAb IgG4
przeciwko CD33 (linia komórek
mielomonocytowych) połączonego
kowalencyjnie z cytotoksycznym
antybiotykiem przeciwnowotworowym –
kalicheamycyną
stosowana w leczneniu AML o fenotypie CD33
+
u
osób powyżej 60 roku życia, które nie mogą
otrzymywać standardowej chemioterapii

Pediatria, pulmonologia
Paliwizumab
– monoklonalne
przeciwciało humanizowane klasy IgG1
przeciwko białku F wirusa RS typu A i B
stosowane w profilaktyce zakażeń RSV u
dzieci z grup ryzyka (gł. wcześniaki i dzieci
z chorobami układu krążenia i płuc)

Alergologia, interna
Omalizumab
– humanizowane
przeciwciało monoklonalne wiążące
domenę Cγ3 fragmentu Fc przeciwciała
IgE (odpowiedzialną za wiązanie z
receptorem dla IgE)
stosowany uzupełniająco w leczeniu astmy
oskrzelowej i alergicznego zapalenia błony
śluzowej nosa

Transplantologia
OKT3 – poliklonalne mysie przeciwciało
przeciwko CD3 (historyczne)
immunoglobulina antytymocytarna
(ATG)
stosowana w profilaktyce i leczeniu ostrego
odrzucania przeszczepu nerki
Daclizumab
– chimeryczne przeciwciało
monoklonalne przeciwko CD 25
wskazane w profilaktyce (ale nie leczeniu)
ostrego odrzucania alloprzeszczepu nerki

Dermatologia
Efalizumab
– humanizowane
przeciwciało monoklonalne
IgG1 przeciwdko CD11a
(=CD28=LFA1)
wskazania: łuszczyca o
umiarkowanym lub ciężkim
przebiegu
Infliximab
– chimeryczne
MAb przeciwko TNFα
wskazania: łuszczyca o
umiarkowanym lub ciężkim
przebiegu, łuszczycowe
zapalenie stawów

Okulistyka
Ranibizumab –
humanizowane
monoklonalne
przeciwciało w klasie
IgG1 przeciwko VEGF
wskazania:
zwyrodnienie plamki
związane z wiekiem

Reumatologia
humanizowane MAb przeciwko
integrynie α4 –
NATALIZUMAB
–
stosowane w SM i chorobie
Leśniowskiego-Crohna
chimeryczne MAb przeciwko
TNFα –
INFLIXIMAB
– stosowane
w ZZSK, RZS, chorobie
Leśniowskiego-Crohna
humanizowane MAb przeciwko
TNFα –
ADALIMUMAB
–
stosowane w RZS
Receptor
limfocytów T (TCR)

Za wyjaśnienie, że
limfocyty T rozpoznają nie
sam antygen, ale
prezentowany w
połączeniu z cząsteczkami
MHC
, Zinkernagel i
Doherty otrzymali w 1996
roku nagrodę Nobla

TCR – receptor limfocytu T
wiążący antygen
receptory limfocytów T, które wiążą i
odpowiadają najczęściej na
antygeny
peptydowe
połączone z cząsteczkami MHC
w
błonie komórki prezentującej antygen
HLA klasy 1
HLA klasy 2
Błona komórkowa
limfocytu T CD4
Błona komórkowa
limfocytu T CD8
TCR
Błona komórkowa
komórki prezentującej antygen

Limfocyty T mogą również rozpoznawać i
odpowiadać na
antygeny lipidowe i
glikolipidowe
prezentowane im w
połączeniu z cząsteczkami
CD1
, a
niektóre limfocyty Tγδ rozpoznają
również inne związki, np. tak zwane
fosfoantygeny
bez udziału cząsteczek
MHC.
Budowa TCR
TCR jest zbudowany z
dwóch łańcuchów, a
każdy łańcuch ma
podobnie do
przeciwciała
część zmienną
część stałą
i jest związany z
komórką poprzez
odcinek śródbłonowy
odcinek
wewnątrzkomórkowy
rodzaje
TCR
receptory
składające się z
łańcuchów α i β
receptory
składające się z
łańcuchów γ i δ
limfocyty
αβ
90%
limfocyty γδ
10%

Kompleks TCR
Zarówno receptory αβ
jak i γδ łączą się w
błonie limfocytów T z
kompleksem CD3, w
skład którego wchodzą 4
rodzaje łańcuchów: γ, δ, ε i
ζ, zwanych czasami
niezmiennymi w celu
odróżnienia od łańcuchów
TCR
Kompleks TCR‑CD3
pozostaje w błonie
komórkowej w kontakcie z
cząsteczkami: CD2, CD5 i
CD4 lub CD8.

Źródła zmienności TCR
zmienność kombinacyjna (geny VDJ)
zmienność na złączach
możliwość transkrypcji genu D w trzech
ramkach odczytu (dla łańcuchów β i δ)
mutacje somatyczne – w niewielkim
stopniu

Zmienione ligandy
peptydowe (APL)
Zmiana pojedynczych aminokwasów w antygenie
prezentowanym limfocytowi T może spowodować, że
choć nadal antygen ten będzie wiązany i
prezentowany przez daną cząsteczkę MHC, to
rozpoznający go przez swoisty TCR limfocyt T nie
będzie już nań odpowiadał.
Zmieniony antygen może nawet stać się antagonistą
i może przekazywać sygnał hamujący odpowiedź
limfocytu T zarówno na zmieniony jak i pierwotny,
niezmieniony antygen
Antygeny takie nazywamy zmienionymi
ligandami peptydowymi (altered peptide ligand –
APL).
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
Wyszukiwarka
Podobne podstrony:
konspekty, 38-PR-Uwalnianie się od przeciwnika ( z piłką i bez piłki ), KONSPEKT LEKCJI: 29
konspekty, 38-PR-Uwalnianie się od przeciwnika ( z piłką i bez piłki ), KONSPEKT LEKCJI: 29
Kompetencja kulturowa bez obrazkow
Ucho anatomia i fizjologia bez obrazków
nadnercza bez obrazkow ppt
Kinezyterapia - 13 maj 2011 - Zaliczenie semestru drugiego - wersja bez obrazków, UJK.Fizjoterapia,
konspekty, Piłka ręczna - Uw
Big Book Of Wrestling Moves (opisy słowne technik bez obrazków)
Mały Książę e book (bez obrazków)
Socjologia slajdy bez obrazków (asm)
więcej podobnych podstron