
Chemia Fizyczna
Dr inż. Małgorzata Przybyt
Instytut Podstaw Chemii Żywności
Zespół Biofizyki Chemicznej
Pokój 409



Dlaczego musimy znać podstawy chemii
fizycznej ?
Wyjaśnia i interpretuje obserwacje dotyczące
fizycznych i chemicznych własności substancji
Jest bazą dla wszystkich innych działów chemii :
nieorganicznej, organicznej, biochemii, analitycznej
Daje ilościowy opis własności substancji i reakcji
chemicznych
Jest bazą współczesnych technik analitycznych jak
metody spektroskopowe, elektrochemiczne i inne
Jest podstawą metod pozwalających na poznanie
struktury i własności cząsteczek chemicznych od
najprostszych jak np. O
2
do tak złożonych jak DNA.
Chemia fizyczna jest trudna, ale gdy ją
zrozumiemy,
to
docenimy
jej
użyteczność !!!!

Jak osiągnąć sukces na egzaminie
czyli garść przydatnych porad
Nauczenie się, zaliczenie ćwiczeń rachunkowych i
zdanie egzaminu z chemii fizycznej sprawia większości
studentów dużo trudności. Aby zmniejszyć problemy z
tym związane, garść praktycznych porad.
Wykład jest wskazówką do tego, czego należy się
nauczyć samodzielnie. Robiąc notatki nie skupiać się
nad
dokładnym
przerysowaniem
pokazywanych
rysunków, a lepiej notować, co one oznaczają. W tym
celu dostajecie materiały pomocnicze.
Ucząc się wyprowadzeń, zwracać uwagę na wstępne
założenia, jaki układ w danym momencie opisujemy itp.
Wzory są nie po to, aby je zapamiętać same w sobie.
Trzeba zawsze wiedzieć, do czego dany wzór służy, co
opisuje i co oznaczają wielkości w nim występujące.

Nie uczyć się na pamięć rysunków w sposób
fotograficzny.
Nauczyć się liczyć na własnym kalkulatorze.
Nauczyć się greckiego alfabetu (załączony w
materiałach).
W chemii fizycznej prawie każda wielkość posiada
jednostki. Zwracać na nie baczną uwagę i zawsze
zapisywać
w
odpowiednim
miejscu.
Zawsze
przeprowadzać rachunek jednostek. Nigdy nie
dodawać czy odejmować wielkości bez uzgodnienia
najpierw jednostek.
Pisząc kolokwium czy zdając egzamin dokładnie
czytać treść poleceń.
Korzystać z polecanych podręczników, a nie ze
skserowanych notatek wątpliwej jakości.
Jeśli będziecie każdy samodzielnie dla siebie pisać
ściągi (których zresztą nie wolno używać), to jednak
coś zostanie w głowie. Gdy będziecie korzystać ze
skserowanych ściąg kolegów, to nie zostanie w głowie
nic. Czyli ucząc się, robić sobie notatki.

Samodzielnie rozwiązywać zadania z arkusza, a
nie korzystać z gotowych rozwiązań zrobionych
przez nie wiadomo kogo.
Większość krążących pomiędzy studentami
skserowanych ściąg, streszczeń wykładów itp.
materiałów
zawiera
koszmarne
błędy
i
uproszczenia.
Wniosek – tylko samodzielna praca ze
zrozumieniem przyniesie sukces.

Gazy
W XIX wieku sformułowano prawa
opisujące własności gazów na podstawie
szeregu wyników eksperymentalnych. Są
to :
Prawo Boyle’a-Mariotte’a
Prawo Gay-Lussaca
Prawo Charlesa
Hipoteza Avogadro
Prawo Daltona
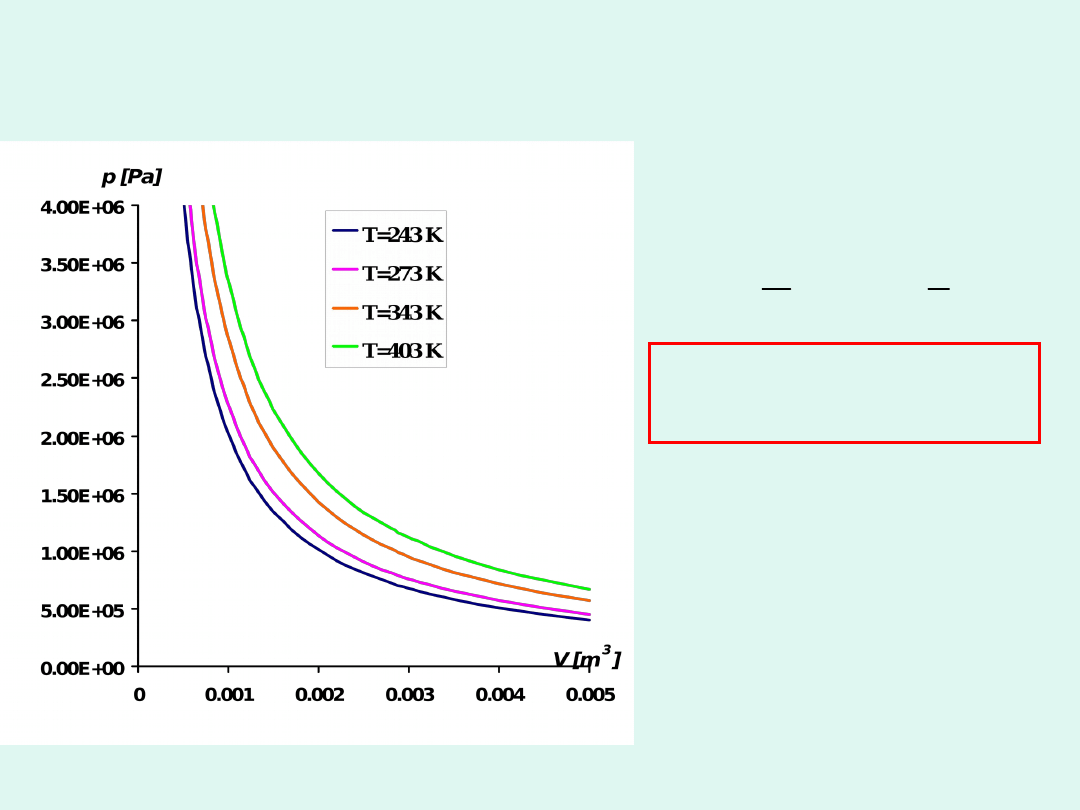
Prawo Boyle’a-Mariotte’a
p
1
V
lub
V
1
p
const
T
i
const
m
lub
const
n
const
pV
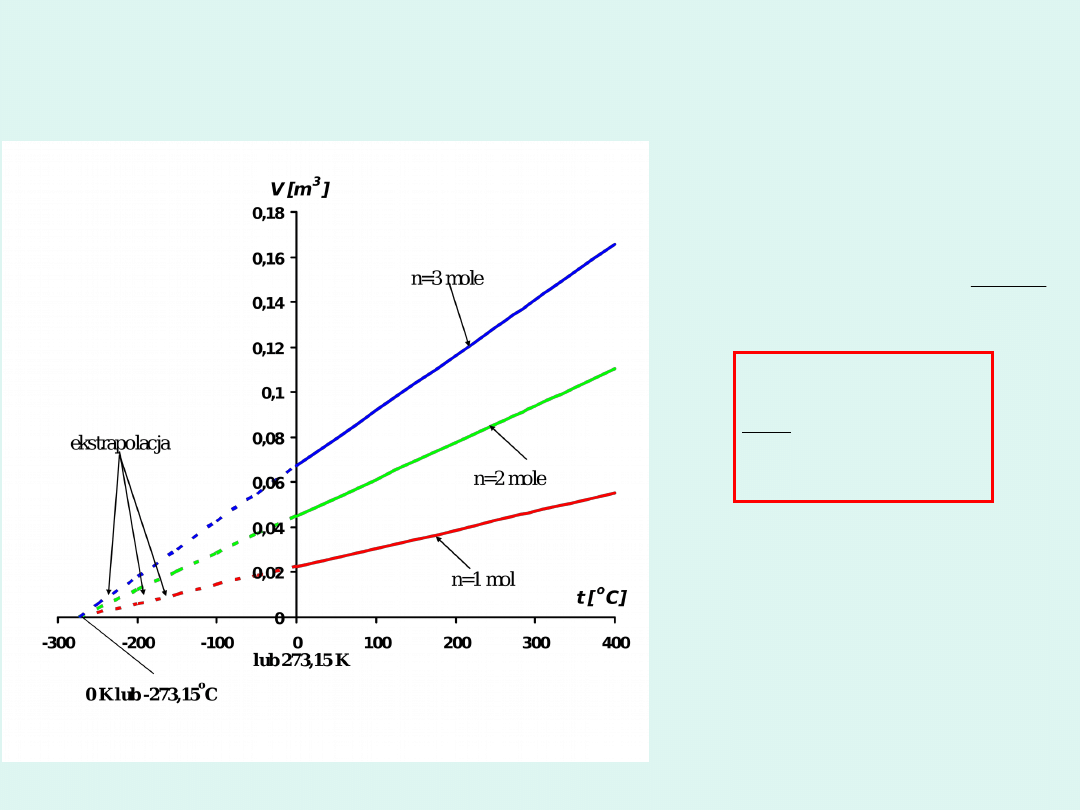
Prawo Gay-Lussaca
273,15
1
o
t
1
V
V
const
p
i
const
m
lub
const
n
const
T
V
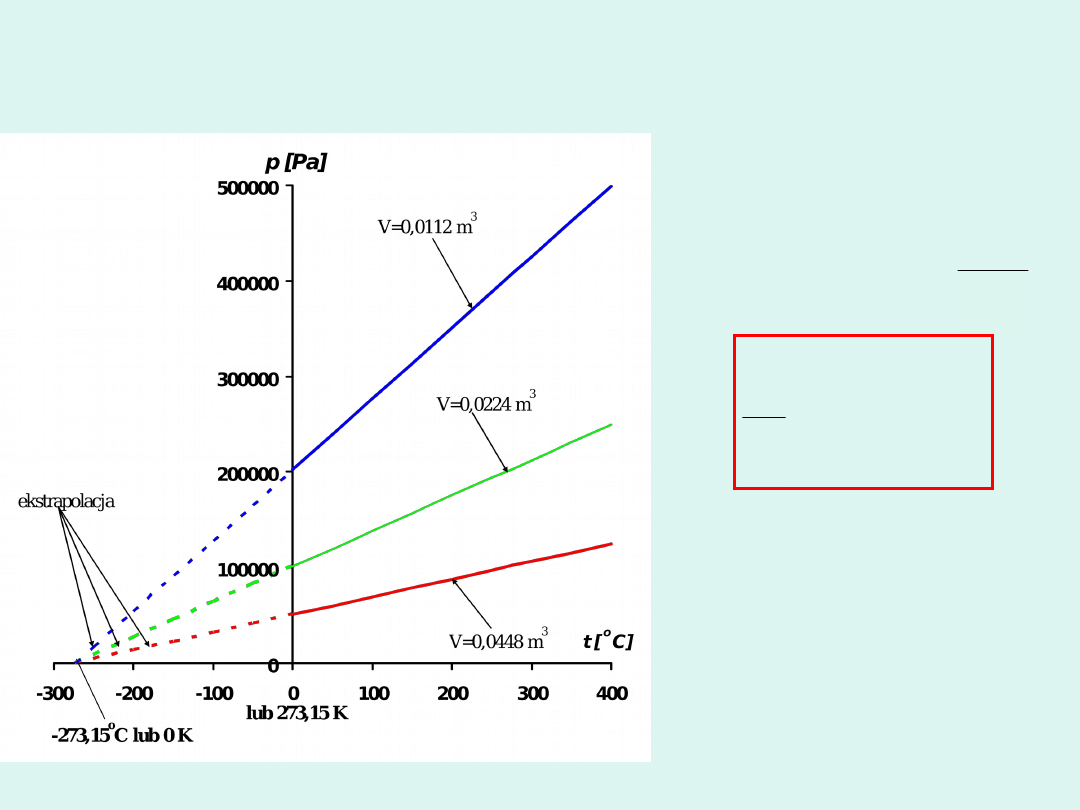
Prawo Charlesa
273,15
1
o
t
1
p
p
const
V
i
const
m
lub
const
n
const
T
p

Teoria kinetyczno-molekularna
gazów
Założenia :
Wymiary cząsteczek są znikomo małe w
porównaniu z odległościami pomiędzy nimi.
Można traktować je jako punkty materialne.
Cząsteczki są w ciągłym, chaotycznym
ruchu.
Cząsteczki nie oddziaływują na siebie na
odległość, jedynie dochodzi do doskonale
elastycznych zderzeń.
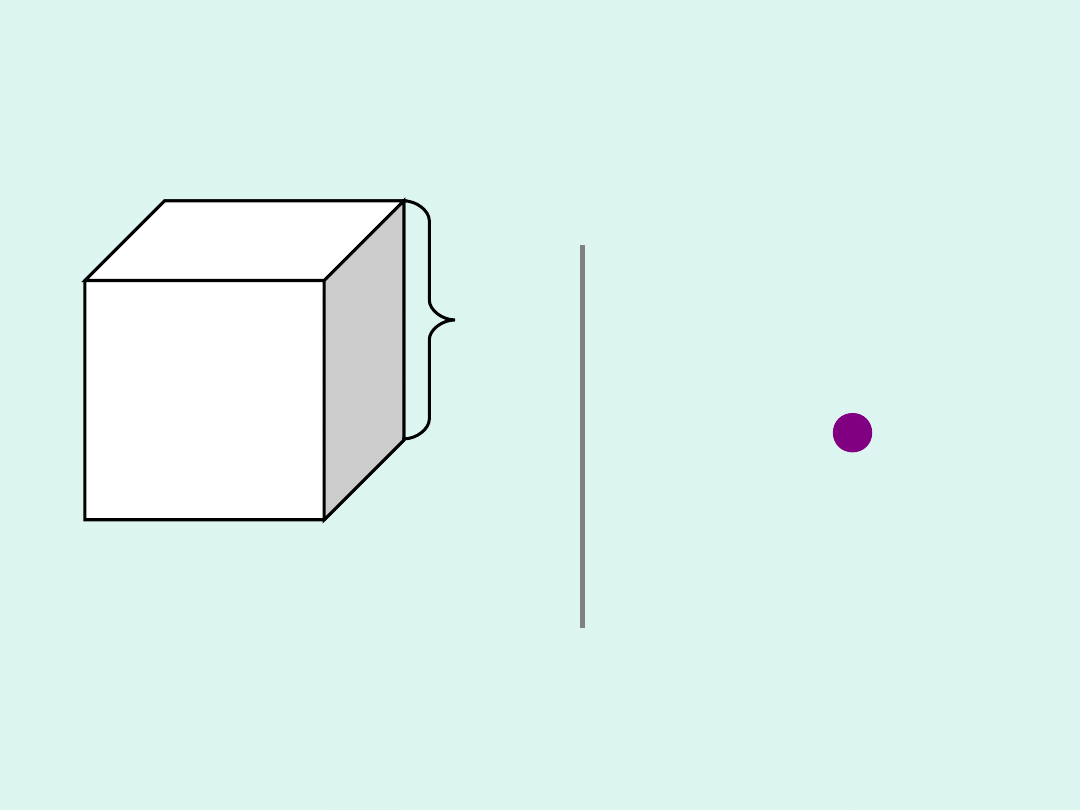
l
N
W sześcianie o boku
l
zamkniętych jest
N
cząsteczek, każda o masie
m
poruszająca się ze
średnią szybkością
v
.
Całkowita zmiana
pędu pojedynczej
cząsteczki wynosi :
pv
2
p
x,
v
x
z,
v
z
y,
v
y
v
Zasada ekwipartycji (równego
podziału) energii
z
,
kin
y
,
kin
x
,
kin
kin
2
z
2
y
2
x
2
z
y
x
E
E
E
E
2
mv
2
mv
2
mv
2
mv
v
v
v
v
Na każdy stopień
swobody ruchu
cząsteczki przypada
energia wynosząca
½k
B
T
.
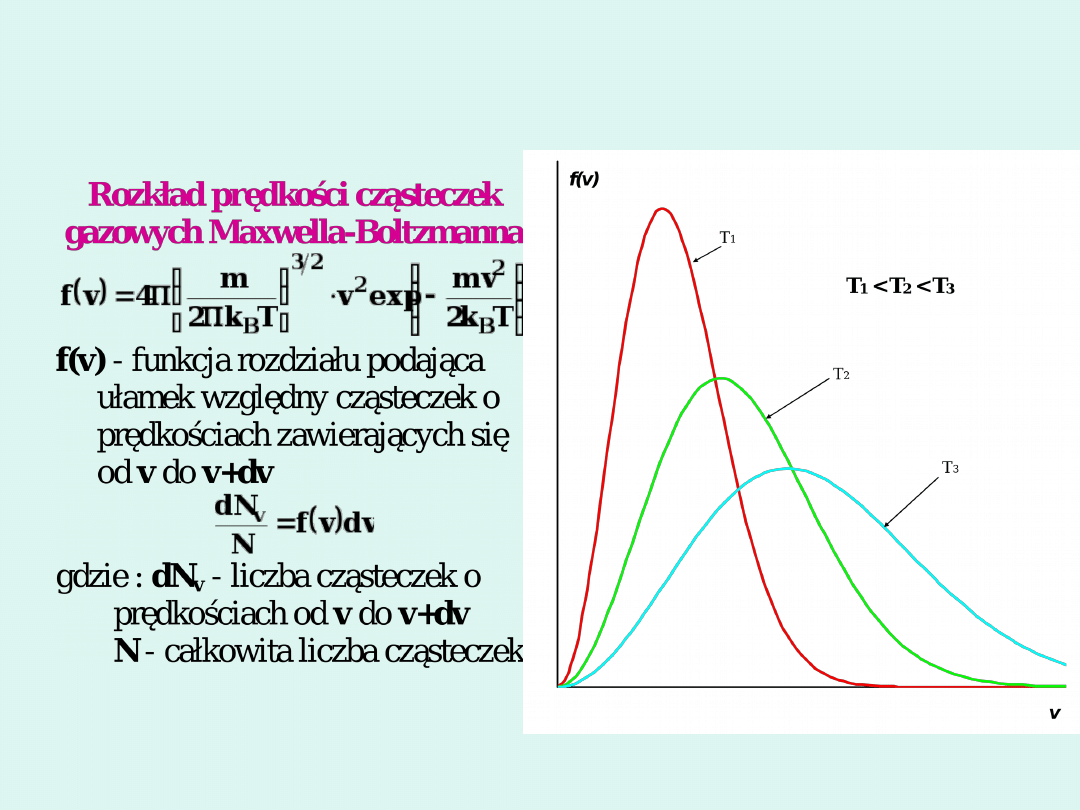
Teoria kinetyczno-molekularna gazów
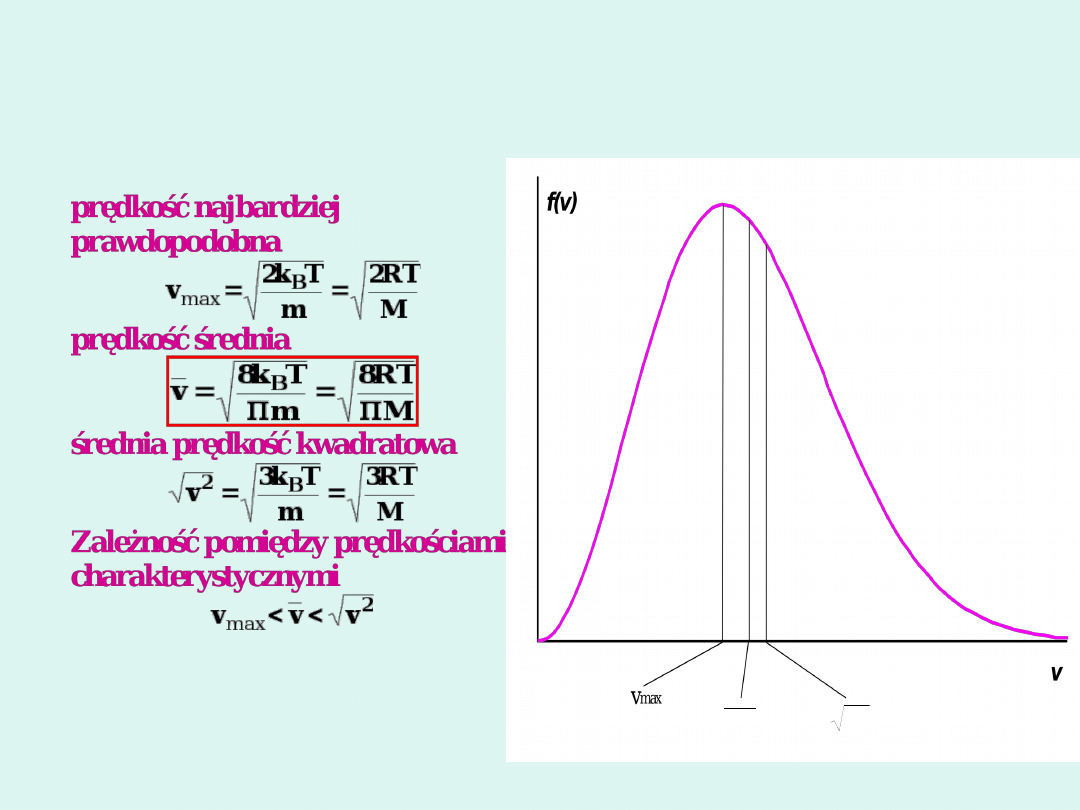
Prędkości charakterystyczne w
rozkładzie Maxwella Boltzmanna
v
2
v
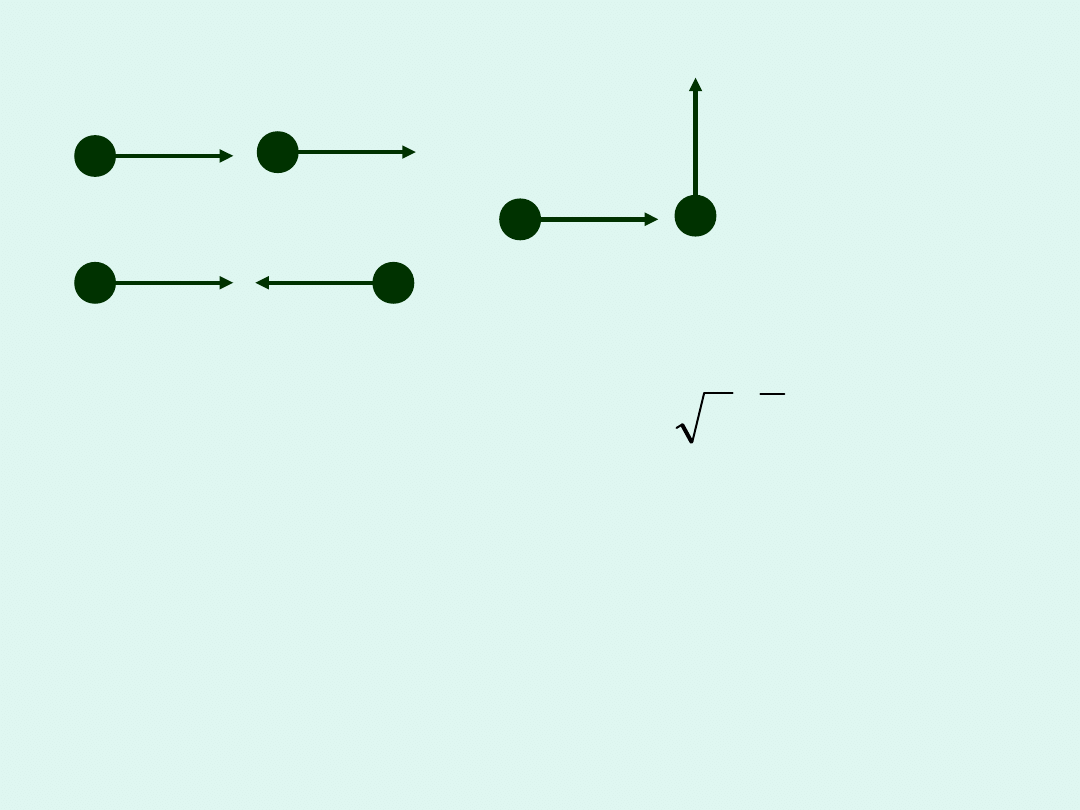
Przykładowe zderzenia dwu cząsteczek
v
2
Wobec tego średnia prędkość
dwu cząsteczek względem
siebie wynosi :
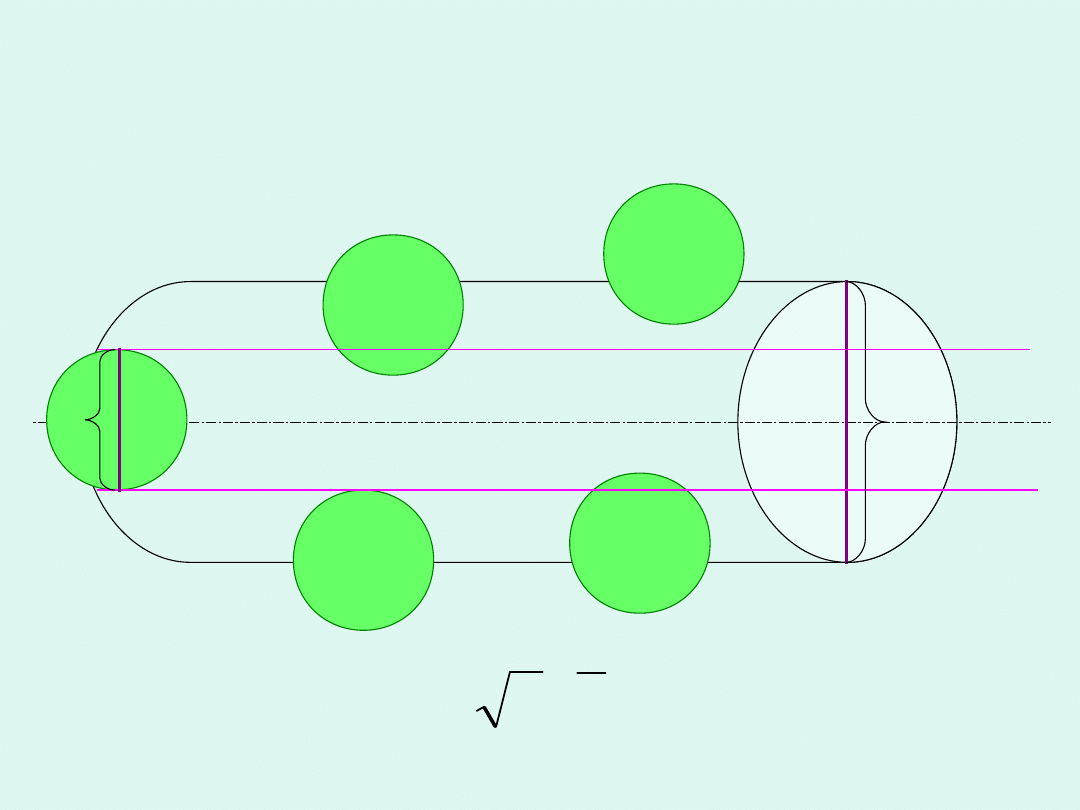
2
Zderzenia wybranej cząsteczki z
innymi cząsteczkami
2
1
v
2
Z
N

Zjawiska przenoszenia w gazach
Przenoszenie pędu – lepkość
Przenoszenie energii kinetycznej –
przewodnictwo
cieplne
Przenoszenie masy - dyfuzja
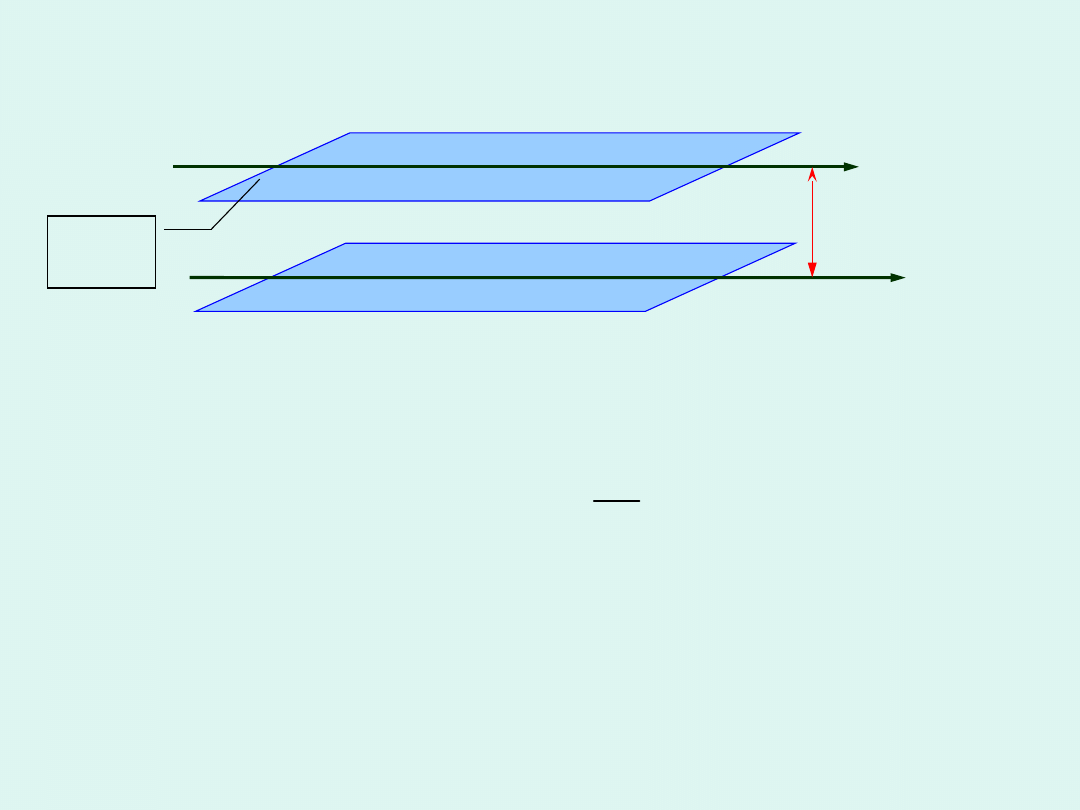
Przenoszenie pędu - lepkość
A
v
v+d
v
Aby wprawić w ruch dolną warstwę względem
górnej, trzeba przyłożyć siłę określoną
wzorem
Newtona
:
dx
dv
A
F
d
x
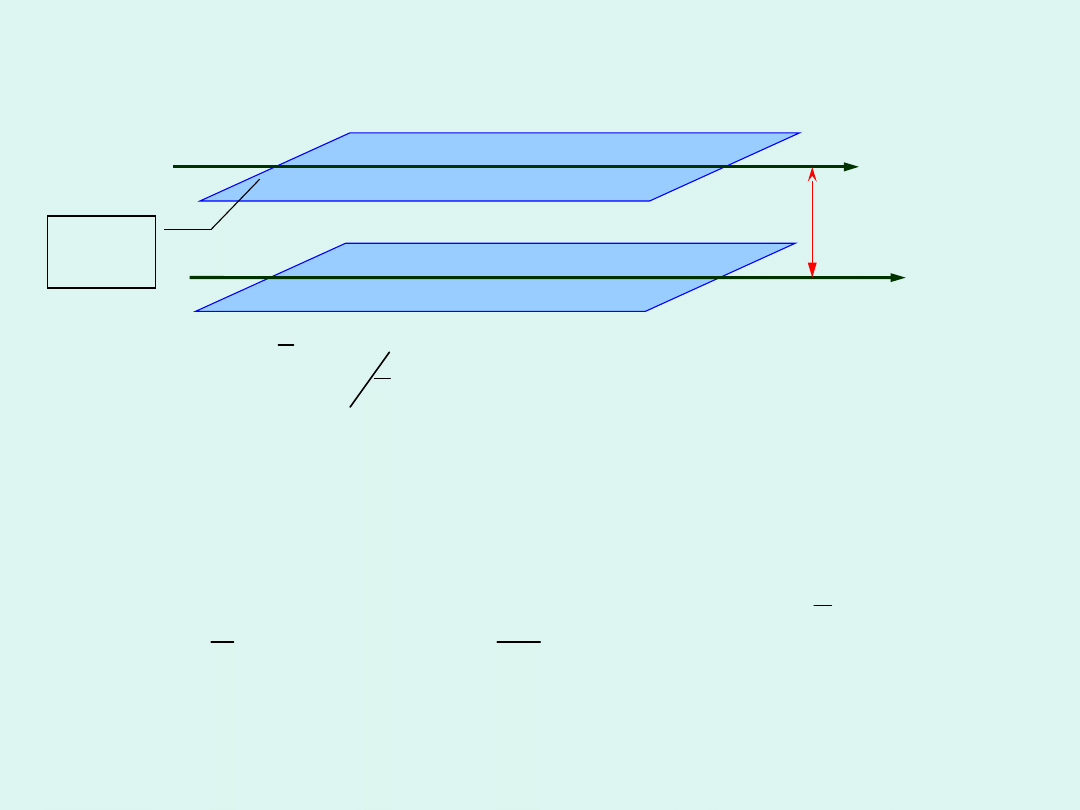
Przenoszenie pędu - lepkość
A
v
v+
v
W czasie
:
v
t
Pomiędzy warstwami przewędruje w każdą
stronę, unosząc ze sobą swój pęd ¼ wszystkich
cząsteczek z danej warstwy.
zmiana pędu = popęd siły
t
F
m
A
2
dx
dv
4
1
N
Przenoszenie pędu - lepkość
2
2
1
2
2
v
m
m
v
N
T
Wnioski :
Lepkość nie zależy od ciśnienia.
Lepkość rośnie wraz z temperaturą.

Przenoszenie energii kinetycznej –
przewodzenie ciepła
A
2
V
V
3
1
N
2
3
c
v
A
c
v
T
Wnioski :
Współczynnik przewodzenia ciepła nie zależy
od ciśnienia.
Współczynnik przewodzenia ciepła rośnie
wraz z temperaturą.
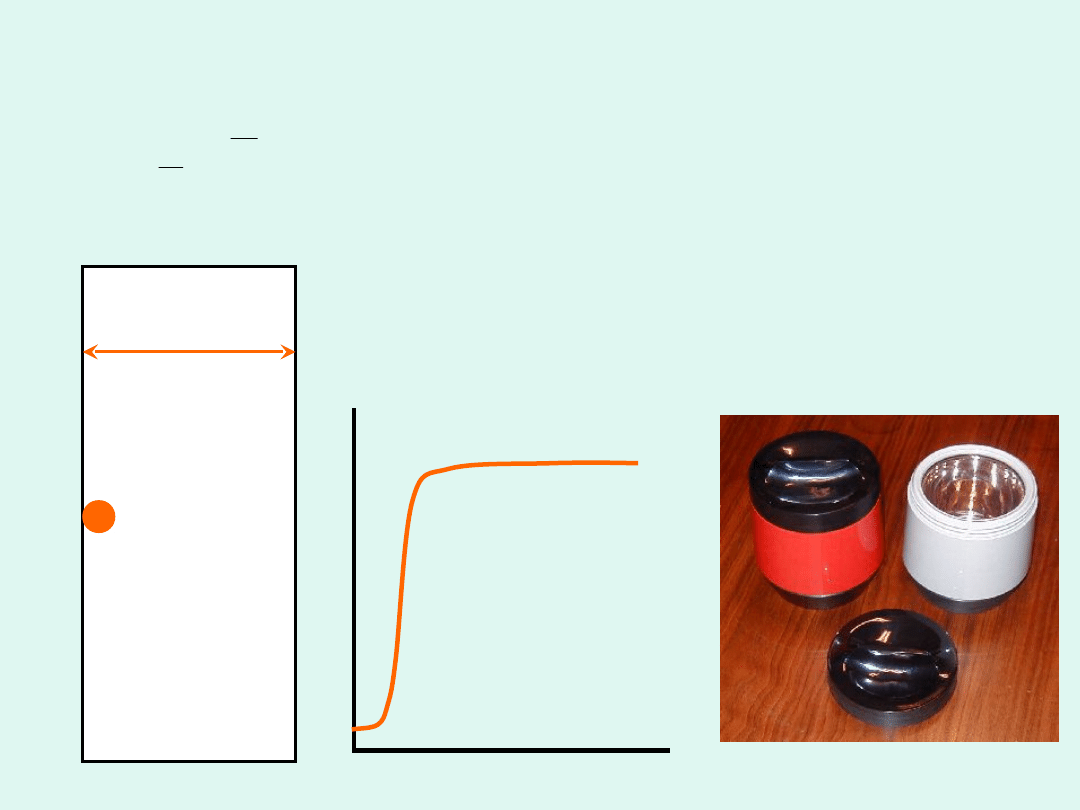
Zachowanie współczynnika przewodzenia
ciepła przy bardzo niskich ciśnieniach
A
c
v
V
3
1
Średnia droga swobodna
bardzo rośnie, gdy
ciśnienie gazu spada.
Wtedy jej wartość może
stać się porównywalna z
rozmiarami naczynia i
przewodnictwo cieplne
raptownie maleje.
p
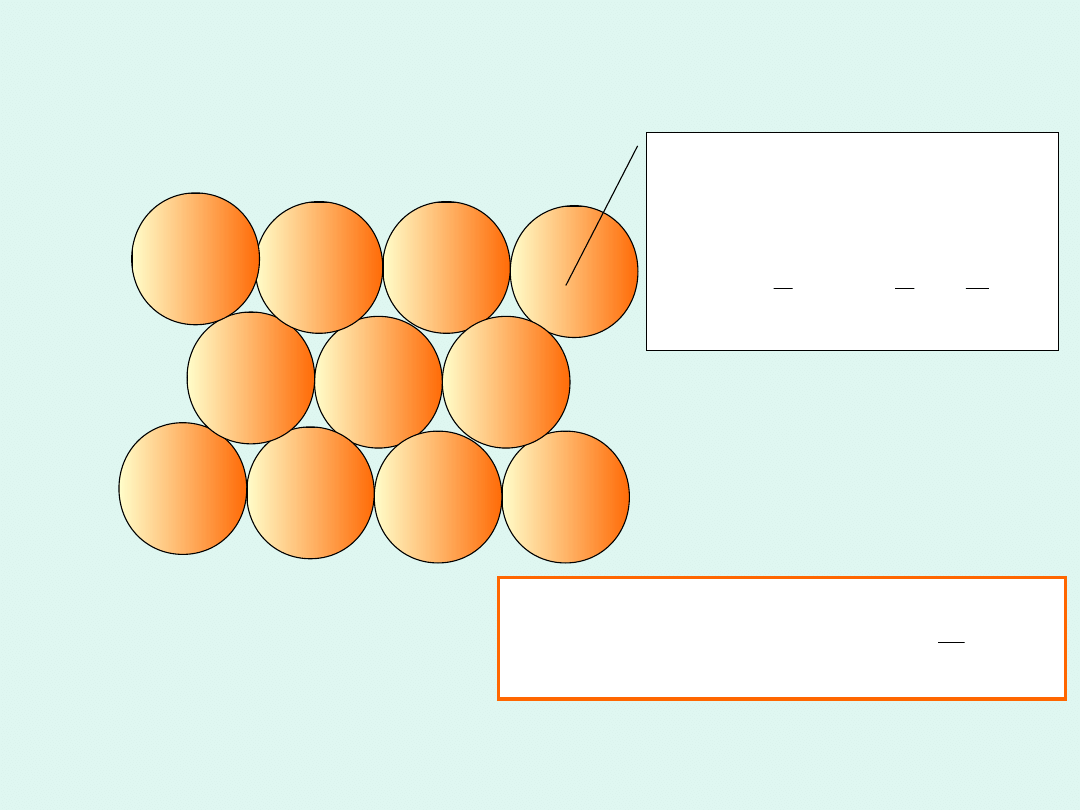
Pojedyncza
cząsteczka ma
objętość :
3
3
cz
2
3
4
r
3
4
V
1 mol cząsteczek
może zająć
najgęściej
upakowany,
objętość :
3
A
cz
A
r
3
4
N
4
V
N
4
b
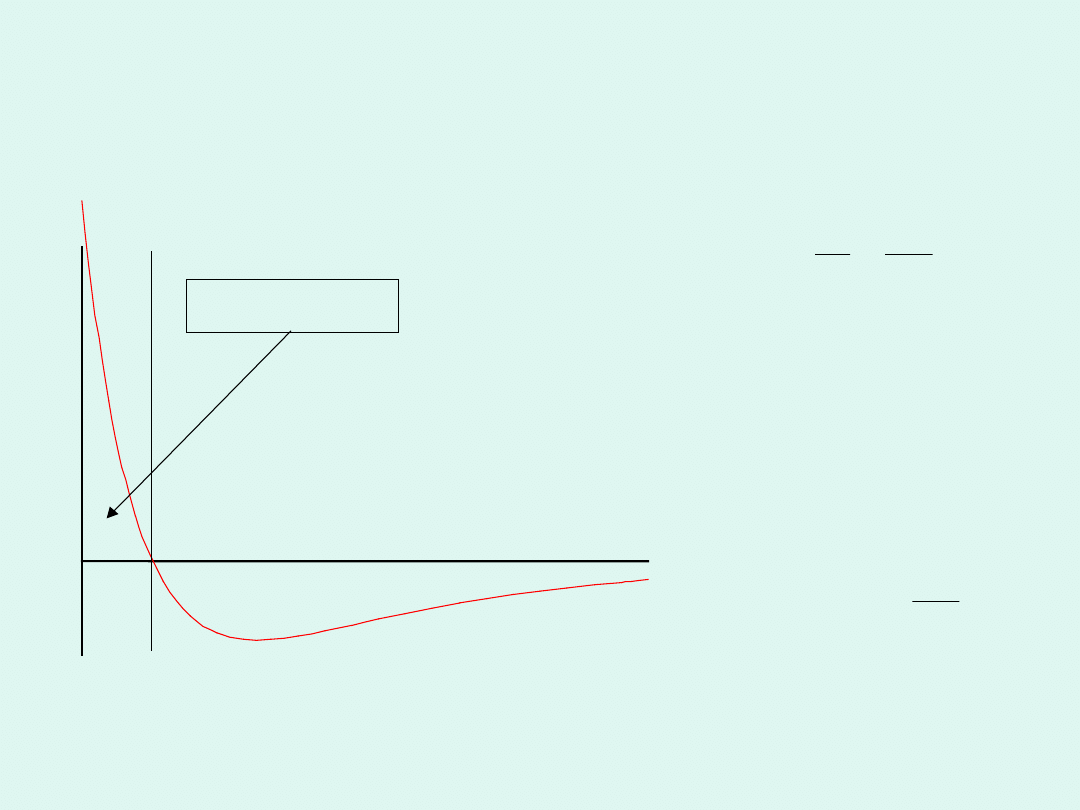
Oddziaływania pomiędzy
rzeczywistymi cząsteczkami
12
6
r
B
r
A
E
odległość pomiędzy
cząsteczkami
E
przewaga
przyciągania
przewaga
odpychania
0
Siły odpychające są
istotne tylko dla
bardzo małych
odległości
pomiędzy
cząsteczkami,
wobec tego : 6
r
A
E
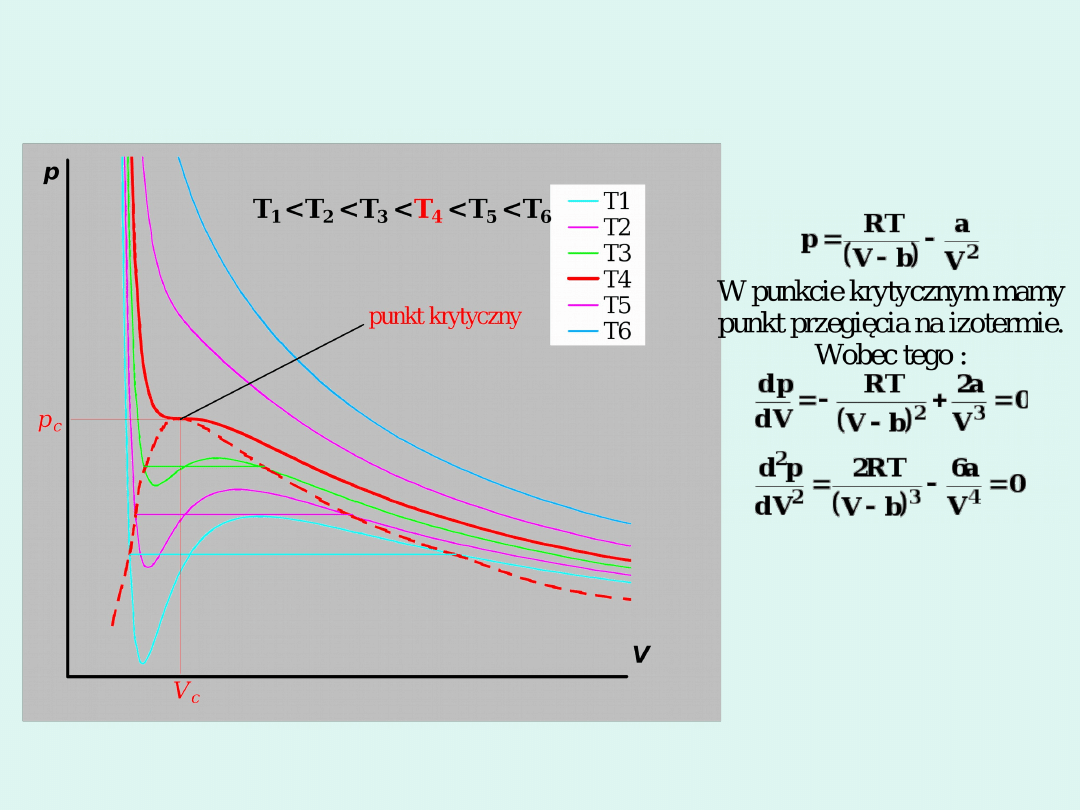
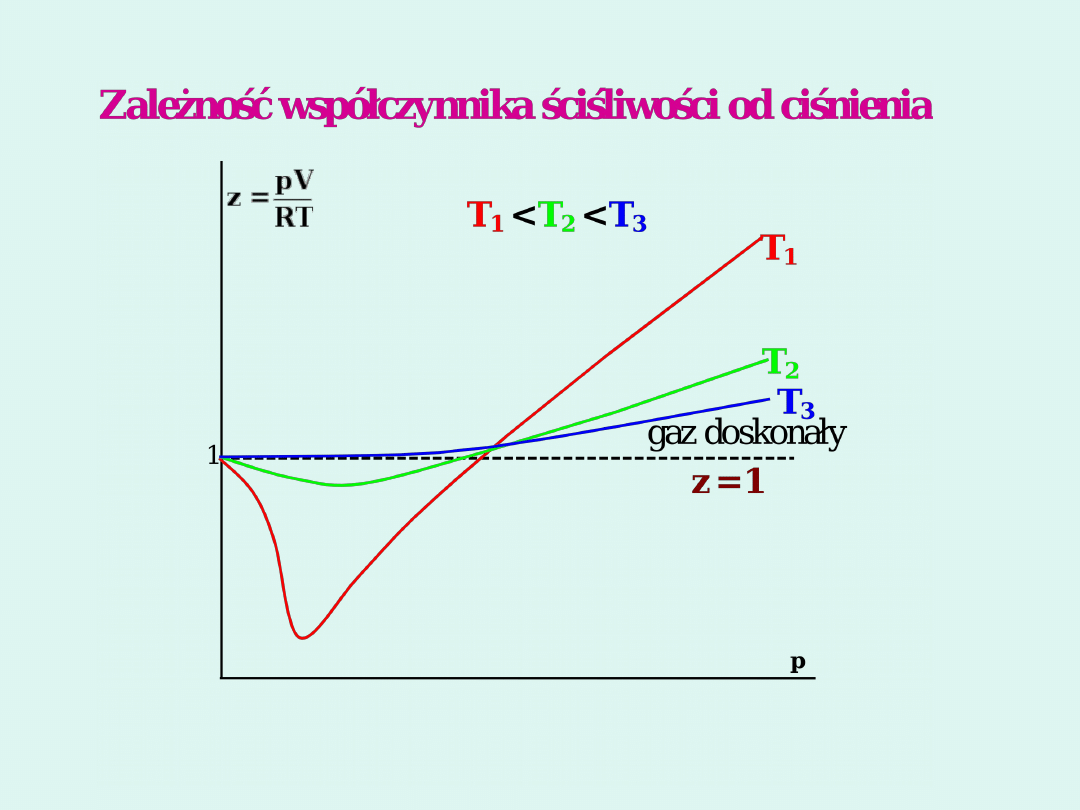
Izotermy van der Waalsa

Zredukowane równanie van der
Waalsa
3
8
3
1
3
T
T
V
V
p
p
2
kr
kr
kr
W punkcie krytycznym współczynnik ściśliwości
8
3
z
kr
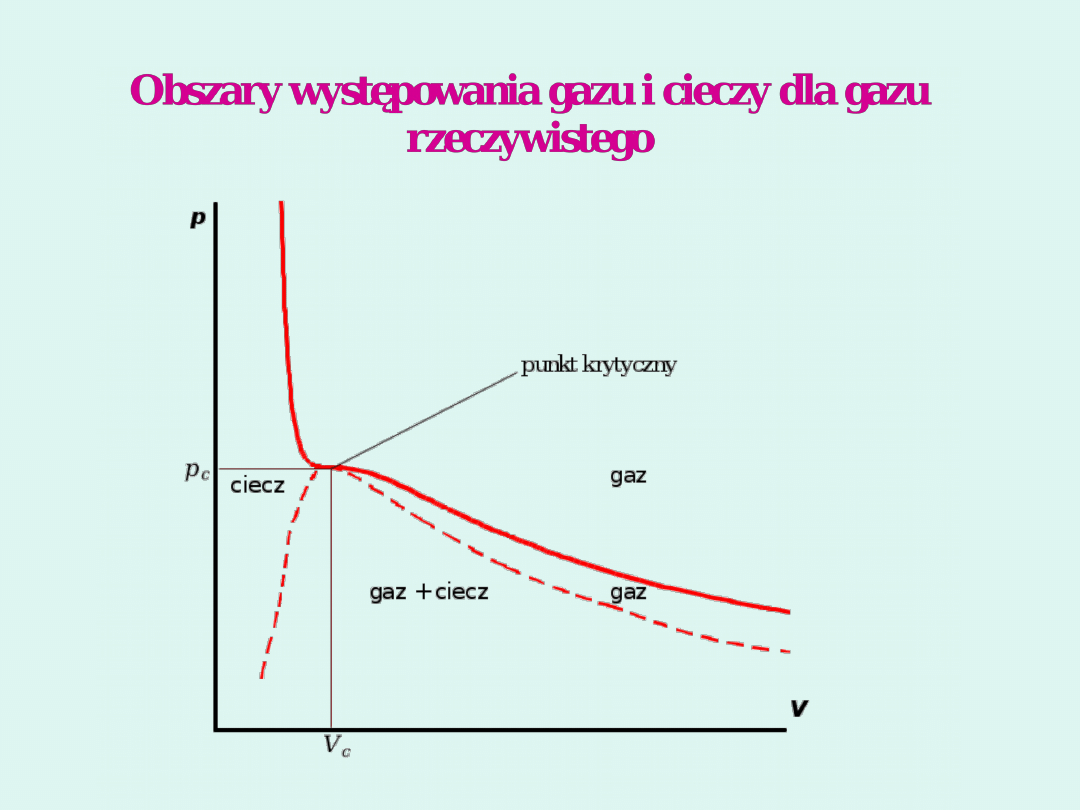
Prawo stanów odpowiadających
sobie
Jeśli dwa parametry zredukowane
różnych gazów są sobie równe, to
pozostałe parametry zredukowane też są
sobie równe.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
Wykład Ch F I zasada
Wykład Ch F potencjometria
5 Wykład Ch F II zasada1
10 Wykład Ch F wielkości koligatywne
6 Wykład Ch F fazy wstęp
2 Wykład Ch F gazy1 2id 20950 ppt
więcej podobnych podstron