
Przedmiot:
Przedmiot:
CHEMIA ANALITYCZNA
CHEMIA ANALITYCZNA
Kierunek studiów: BIOTECHNOLOGIA
Kierunek studiów: BIOTECHNOLOGIA
Zakład Chemii Nieorganicznej i Analitycznej - dr Janusz PUSZ
Zakład Chemii Nieorganicznej i Analitycznej - dr Janusz PUSZ
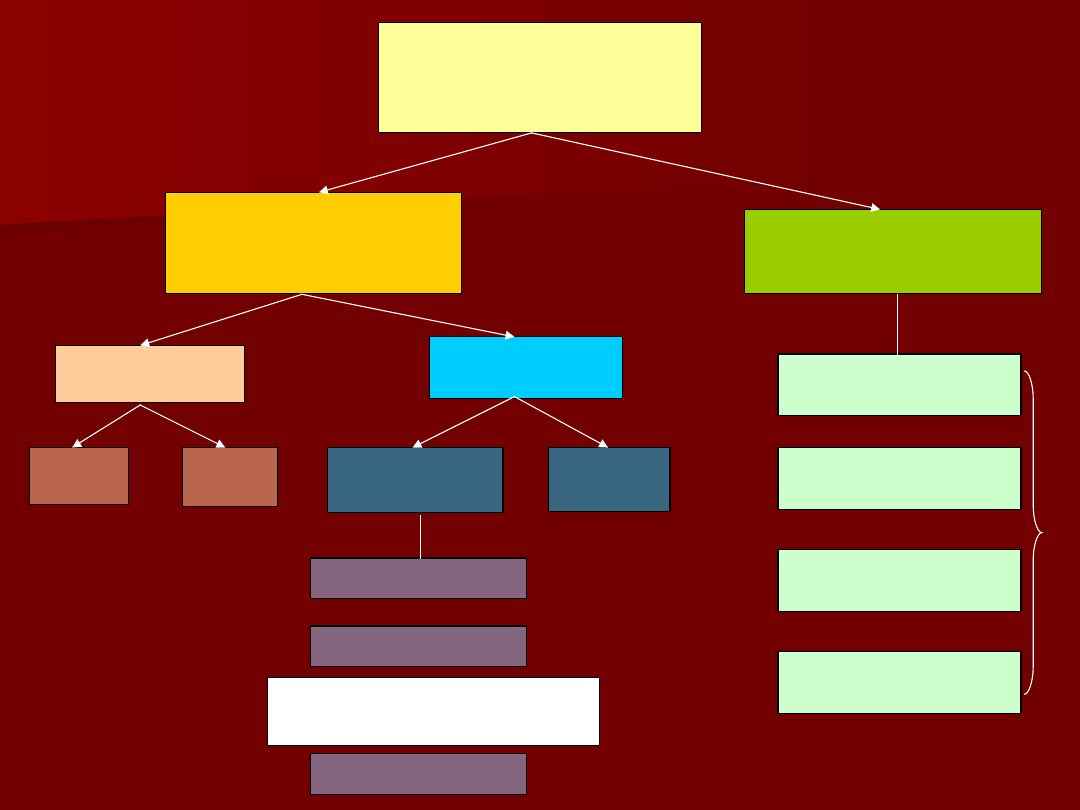
ANALIZA
CHEMICZNA
METODY CHEMICZNE
(KLASYCZNE)
METODY
ELEKTROCHEMICZN
E
METODY
INSTRUMENTALNE
METODY
SPEKTROSKOPOWE
METODY
CHROMATOGRAFICZ
NE
METODY
RADIOMETRYCZNE
ANALIZA
JAKOŚĆIOWA
METODY
WAGOWE
METODY
MIARECZKOW
E
ANALIZA
ILOŚĆIOWA
Analiz
a
anionó
w
Analiza
kationó
w
ALKACYMETRIA
REDOKSOMETRIA
STRĄCENIOWA
KOMPLEKSOMETRI
A

KOMPLEKSOMETRIA
KOMPLEKSOMETRIA
Kompleks
– składa się z atomu centralnego i ligandów
Atom centralny
– atom lub kation metalu –
akceptor elektronów
Ligand
– jon lub cząsteczka tworząca wiązanie kowalencyjne z
atomem centralnym -
donor elektronów
Liczba koordynacyjna
– liczba wiązań kowalencyjnych
utworzonych
przez atom centralny ( najczęściej LK=2, 4, 6)
Ligand jednopozycyjny
– ligand mający jedną wolną parę
elektronową (H
2
O, NH
3
, Cl
-
, Br
-
, I-, SCN-, CN
-
i td.)
Ligand wielopozycyjny (ligand chelatowy)
– posiada dwie lub
więcej grup donorowych w jednej cząsteczce
Kompleks mieszany
– zawiera jeden jon centralny i więcej niż 1
rodzaj ligandów
Kompleks jednordzeniowy
– zawiera 1 atom centralny (ML
n
)
Kompleks wielordzeniowy
– zawiera więcej niż 1 atom centralny
(M
m
L
n
)

Reakcję tworzenia się kompleksów w roztworach można
przedstawić następująco:
M + n L ML
n
gdzie: M - jest atomem centralnym, L- jest ligandem kompleksu.
Sumaryczna stała trwałości
n
=
Dla reakcji odwrotnej, związanej z rozkładem jonu kompleksowego
ML
n
M + n L
Stała nietrwałości
K
n
=
(stała dysocjacji)
n
n
L
M
ML
]
][
[
]
[
]
[
]
][
[
n
n
ML
L
M

Tworzenie się kompleksu ML
Tworzenie się kompleksu ML
n
n
w roztworze można przedstawić w
w roztworze można przedstawić w
następujący sposób:
następujący sposób:
stopniowe stałe trwałości
stopniowe stałe trwałości
M + L
M + L
ML
ML
1
1
=
=
ML + L
ML + L
ML
ML
2
2
2
2
=
=
ML
ML
2
2
+ L
+ L
ML
ML
3
3
3
3
=
=
ML
ML
n-1
n-1
+ L
+ L
ML
ML
n
n
n
n
=
=
stąd
stąd
MLn
MLn
=
=
- sumaryczna stała trwałości
- sumaryczna stała trwałości
równa się:
równa się:
MLn
MLn
=
=
1
1
.
.
2
2
.
.
3
3
.
.
......
......
.
.
n
n
]
L
][
M
[
]
ML
[
]
L
][
ML
[
]
ML
[
2
]
L
][
ML
[
]
ML
[
2
3
]
][
[
]
[
1
L
ML
ML
n
n
n
n
L
M
ML
]
][
[
]
[

Znajomość stałych trwałości lub
Znajomość stałych trwałości lub
nietrwałości kompleksów pozwala
nietrwałości kompleksów pozwala
przewidywać reakcje wymiany
przewidywać reakcje wymiany
ligandów lub jonów centralnych.
ligandów lub jonów centralnych.
Stała nietrwałości kompleksu
K
n
= 1/
n
=
]
[
]
][
[
n
n
ML
L
M

Warunkowa
Warunkowa
stała trwałości kompleksów
stała trwałości kompleksów
Ringom
Ringom
zastosował pojęcie
zastosował pojęcie
warunkowej stałej trwałości
warunkowej stałej trwałości
.
.
Dla reakcji
Dla reakcji
M + L
M + L
ML
ML
’
’
ML
ML
=
=
w którym:
w którym:
[M’] - stężenie jonów metalu we wszystkich postaciach związanych z
[M’] - stężenie jonów metalu we wszystkich postaciach związanych z
wyjątkiem kompleksu ML ( [M’ ] = [M] + [MA] + [MA
wyjątkiem kompleksu ML ( [M’ ] = [M] + [MA] + [MA
2
2
] + ...
] + ...
gdzie A - anion wodorotlenowy lub inny konkurencyjny jon),
gdzie A - anion wodorotlenowy lub inny konkurencyjny jon),
[L’]- stężenie ligandu obecnego roztworze we wszystkich postaciach
[L’]- stężenie ligandu obecnego roztworze we wszystkich postaciach
z wyjątkiem kompleksu ML ( [L’ ] = [L] + [BL] + [B
z wyjątkiem kompleksu ML ( [L’ ] = [L] + [BL] + [B
2
2
L] + .... gdzie B –
L] + .... gdzie B –
kation wodorowy lub inny konkurencyjny jon),
kation wodorowy lub inny konkurencyjny jon),
]
][
[
]
[
'
'
L
M
ML

Przy obliczaniu stałych warunkowych bardzo przydatne są tak zwane
współczynniki reakcji ubocznych
α
wprowadzone przez
Schwarzenbacha
:
α
M
=
i
α
L
=
[M’] –stężenie jonów metalu we wszystkich postaciach związanych z wyjątkiem kompleksu ML,
[L’] - stężenie ligandu obecnego w roztworze we wszystkich postaciach z wyjątkiem kompleksu
ML.
•
w przypadku kiedy jon M reaguje tylko z liganiem L według reakcji głównej to
α
M
=
1,
• kiedy jon M wchodzi w jakiekolwiek uboczne reakcje konkurujące, wartość
α
M
>1
,
• podobnie gdy ligand ulega reakcjom ubocznym np. z jonami wodorowymi,
α
L
>1.
]
'
[
]
[
M
M
]
'
[
]
[
L
L

Zależność między stałą trwałości a warunkową stałą trwałości
przedstawia się następująco:
Wartości współczynników
α
można obliczyć znając stałe równowagi
reakcji ubocznych.
Jeśli np. metal wchodzi w reakcję uboczną z liganiem
A
tworząc z
nim kilka kolejnych kompleksów, to
α
M(A)
=
gdzie:
α
M(A)
– współczynnik reakcji ubocznej jonu metalu
M
z ligandem
A
,
[A]
– stężenie ligandu A,
β
MA
, ….,β
MAn
– kolejne stałe trwałości kompleksów M z jonami A.
L
M
ML
ML
'
n
MA
n
MA
MA
A
A
A
]
[
.......
]
[
]
[
1
2
2

Analogicznie, jeśli ligand
L
wchodzi w uboczne reakcje z kationem
B
, to
α
L(B)
=
przykłady:
dla EDTA
α
EDTA(H)
=
warunkowa stała trwałości Zn-EDTA w roztworze o pH=12
β
Zn-EDTA
= 10
16,5
β’
Zn-EDTA
= 10
8,2
warunkowa stała trwałości Pb-EDTA w roztworze o pH=7
β
Pb-EDTA
= 10
18
β’
Pb-EDTA
= 10
14
n
LB
n
LB
LB
B
B
B
]
[
.......
]
[
]
[
1
2
2
1
2
3
4
4
2
3
4
3
3
4
2
4
]
[
]
[
]
[
]
[
1
a
a
a
a
a
a
a
a
a
a
K
K
K
K
H
K
K
K
H
K
K
H
K
H

WNIOSKI
WNIOSKI
1. Kompleks jest tym trwalszy, im mniejsza jest jego stała
dysocjacji, a zarazem tym trwalszy im większy jest
wykładnik stałej nietrwałości pK = -log K
2. Jeśli odczynnik może kompleksować z kilkoma
substancjami to w pierwszej kolejności tworzy się
kompleks najtrwalszy.
3. Za trwałe kompleksy uważa się takie , dla których
stała trwałości > 10
7
.
4. Jeśli w roztworze znajduje się kilka kompleksów
jednocześnie, po dodaniu do mieszaniny silniejszego
środka kompleksujacego następuje w pierwszej fazie
rozkład kompleksu najmniej trwałego.

Metody
Metody
kompleksometryczne
kompleksometryczne
Metody miareczkowej analizy kompleksometrycznej oparte są
na reakcji tworzenia się trwałego, trudno dysocjującego,
rozpuszczalnego związku kompleksowego
Typy miareczkowań kompleksometrycznych:
1. miareczkowanie w którym wykorzystuje się kompleksy
proste
1. miareczkowanie w którym wykorzystuje się kompleksy
chelatowe
(miareczkowanie chelatometryczne).

Ad 1)
np. metoda Liebiga oznaczania cyjanków mianowanym roztworem
AgNO
3
AgNO
3
+ 2 CN
-
Ag(CN)
2
-
+ NO
3
-
Ag
+
+ Ag(CN)
2
-
Ag[Ag(CN)
2
]
( PK - zmętnienie roztworu)
np. oznaczanie I
-
mianowanym roztworem Hg(NO
3
)
2
Hg
2+
+ 4 I
-
HgI
4
2-
Hg
2+
+ HgI
4
2-
2
HgI
2
( PK - zmętnienie roztworu)

ad 2) miareczkowanie chelatometryczne - wiadomości ogólne
• kompleksy chelatowe tworzą ligandy wielopozycyjne,
• ligandy wielopozycyjne są to związki organiczne, które łącząc się z
metalami w kompleksy tworzą pierścienie. Znane są ligandy:
dwupozycyjne
np. etylenodiamina
,
trójpozycyjne
np. kwas winowy
,
czteropozycyjne
np. kwas nitrylotrioctowy
,
pięciopozycyjne
np. azometany
sześciopozycyjne
np. EDTA (Na
2
H
2
edta),
• możliwość powstania kompleksów chelatowych jest uwarunkowana
obecnością w ligandzie
grup kwasowych
(
-OH, -COOH, =N-OH, = NH,
- SH,
-SO
3
H )
i
grup koordynujących
. Grupy koordynujące to grupy
wchodzące w skład liganda, zawierające atomy z wolną parą elektronową
np.
–NH
2
, -NHR, -NR
2
, -C=O, =CS,
-NO, -N=N-,
itp.

• znaczna trwałość kompleksu chelatowego jest związana z tzw. efektem
chelatowym,
• najtrwalsze są kompleksy 5-cio i 6-cio członowe,
• pod względem trwałości chelaty znacznie przewyższają kompleksy
jednofunkcyjne, co łatwo stwierdzić na przykładzie:
Ni(NH
3
)
6
2+
β
Ni(NH3)6
= 10
8
Ni(etylenodiamina)
3
2+
β
Ni(etylenodiamina)3
= 10
18
• obojętny kompleks chelatowy, w którym ładunek dodatni jonu
centralnego został skompensowany ujemnym ładunkiem liganda, nazywa
się wewnętrznym chelatem lub związkiem wewnątrzkompleksowym
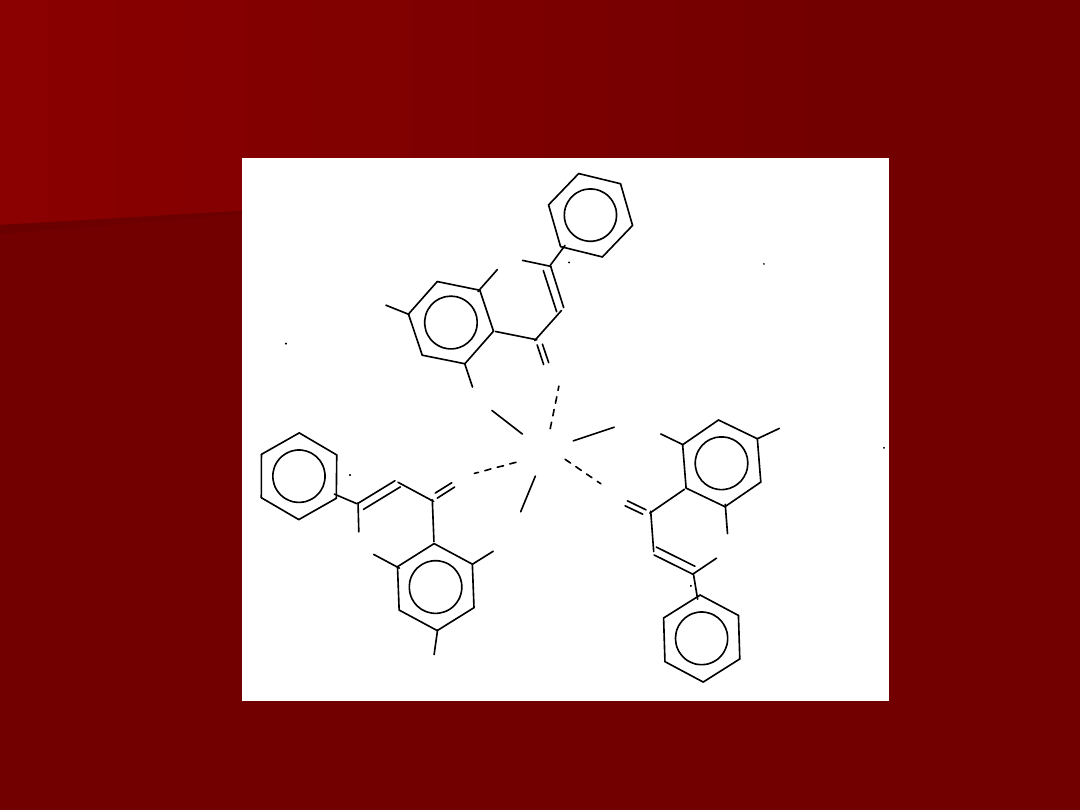
Przykład:
kompleksy chryzyny (5,7 – dihydroksyflawon) z jonami
lantanowców
Ln
O
O
O
HO
O
O
HO
O
O
O
O
OH

KOMPLEKSONOMETRIA
(CHELATOMETRIA)
Kompleksony
– wprowadził do analizy Gerold Schwarzenbach
(szwajcarski analityk)
Są to kwasy aminopolikarbonowe – pochodne kwasu iminodioctowego
CH
2
COOH
HN
CH
2
COOH
Najwieksze znaczenie uzyskał :
kwas etylenodiaminotetraoctowy (komplekson II, EDTA, H
4
Y, H
4
edta)
pK
1
= 2,07 pK
2
= 2,75
pK
3
= 6,24 pK
4
= 10,34
Sól disodowa kwasu etylenodiaminotetraoctowego
Na
2
H
2
edta
.
2 H
2
O
(komplekson III, chelaton III, trylon B, titriplex III, Versene, Nu lapon)
H C N
2
CH COOH
2
CH COOH
2
CH COOH
2
CH COOH
2
H C N
2
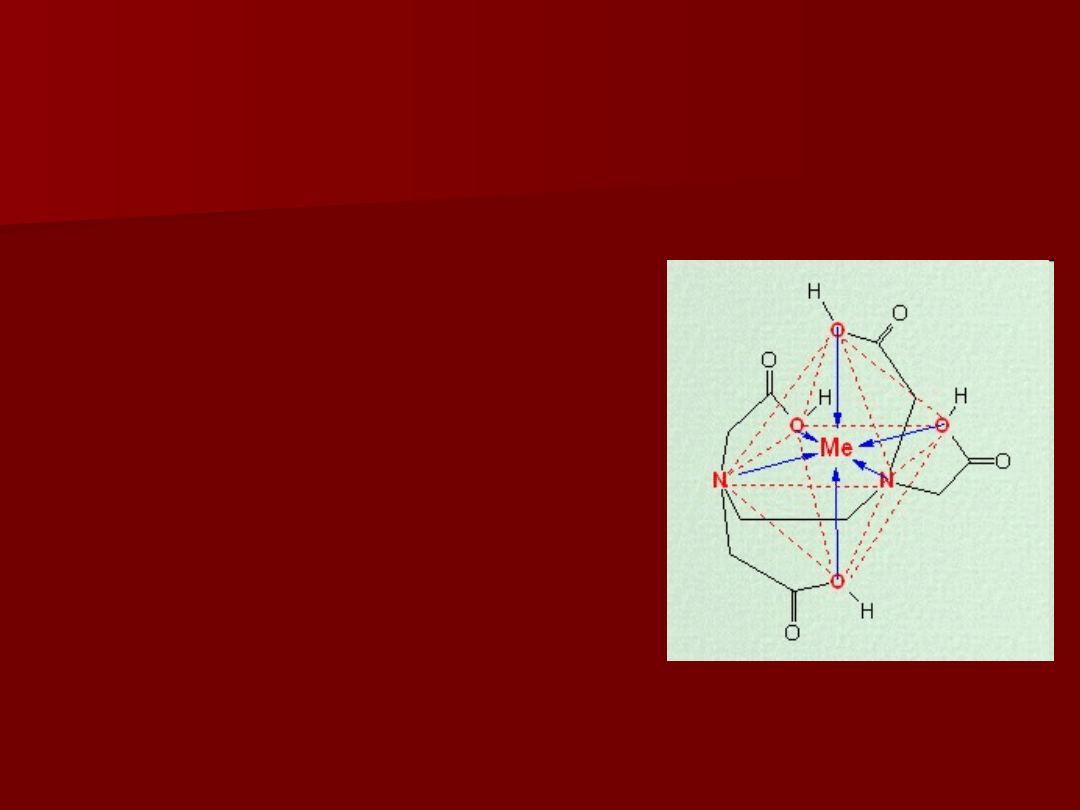
Własności EDTA
• EDTA tworzy z kationami metali kompleksy chelatowe o LK=6
• EDTA reaguje z kationami zawsze w stosunku 1:1,
niezależnie od wartościowości kationu metalu
3) W reakcji kompleksowania kationów metali
zawsze uwalnianych jest 2 mole jonów wodorowych
M
2+
+ H
2
Y
2-
MY
2-
+ 2 H
+
M
3+
+ H
2
Y
2-
MY
-
+ 2 H
+
M
4+
+ H
2
Y
2-
MY + 2 H
+

Technika miareczkowania za pomocą EDTA
1. miareczkowanie bezpośrednie
2. miareczkowanie odwrotne
3. miareczkowanie podstawieniowe
4. miareczkowanie pośrednie

Ad 1)
Miareczkowanie bezpośrednie
Bezpośrednie miareczkowanie danego kationu roztworem kompleksonu
jest możliwe, gdy w warunkach oznaczania:
• trwałość kompleksu kation-EDTA jest dostatecznie duża,
• reakcja kompleksowania przebiega szybko,
• kation nie ulega hydrolizie,
• dysponujemy odpowiednim wskaźnikiem.
Ad 2) Odmiareczkowywanie nadmiaru (
miareczkowanie
odwrotne
)
• gdy kation tworzy dostatecznie trwały kompleks z EDTA, ale
nie ma dla niego wygodnego wskaźnika,
• gdy kompleks kationu ze wskaźnikiem jest zbyt trwały (np.
Co, Ni, Al, Ti, Cu z czernią eriochromowa),
• gdy kompleks z EDTA tworzy się zbyt wolno.
.

Ad 3)
Miareczkowanie podstawieniowe
W miareczkowaniu podstawieniowym (substytucyjnym) wykorzystuje
się różnice trwałości kompleksów odpowiednich metali. Większość
kationów tworzy z EDTA mocniejsze chelaty niż Mg i dlatego po
dodaniu do ich roztworu stałego kompleksu Mg-EDTA następuje reakcja
podstawiania (wypierania):
M
2+
+ MgY
2-
MY
2-
+ Mg
2+
Uwolniony magnez można łatwo miareczkować roztworem EDTA.
Ad 4)
Miareczkowanie pośrednie
Jest stosowane przy oznaczaniu anionów, które wytraca się w postaci
osadów analitycznych, a po rozpuszczeniu tychże równoważną ilość
kationu związaną z anionem oznacza się normalnym sposobem.

Krzywe miareczkowania kompleksometrycznego
Założenia:
• Reakcja główna przebiegająca w roztworze:
M + L ML
• Stała trwałości kompleksu
ML
> 10
10
, tak że można
zaniedbać stężenia jonów pochodzących z dysocjacji
kompleksu
Przykład:
Ca
2+
+ H
2
Y
2-
CaY
2-
+ 2 H
+
C
Ca
= 0,1 M; C
edta
= 0,1 M; V
0
= 100 cm
3
, log
Ca-edta
= 9,3
1.
Punkt wyjściowy miareczkowania – PW
2. Punkty przed PR (50 cm
3
EDTA)
3. PR
4. Punkty po PR (150 cm
3
EDTA)
5. Skok krzywej miareczkowania

ad 1) w punkcie wyjściowym
pM = - log [M] = - log [Ca
2+
] = - log 0,1 =
1
ad 2) przed PR (dodano 50 cm
3
EDTA)
Można założyć, że cała ilość dodanego ligandu L została związana w
kompleks; zatem stężenie jonów metalu odpowiednio zmniejszyło się i
wynosi
[M] =
pM = - log [M] = - log = - log =
1,48
V
V
V
c
V
c
Y
H
M
0
0
2
V
V
V
c
V
c
Y
H
M
0
0
2
50
100
50
1
,
0
100
1
,
0

ad 3) w PR
dodano 100 cm
3
EDTA
Stała trwałości kompleksu wynosi:
M-edta
=
Ponieważ
[M] = [H
2
Y
2-
] =
[MY] =
Stąd
pM = -log = ½ log
M-edta
- ½ log [MY] = ½ log
M-edta
- ½ log
=
= ½ 9,3 - ½ log =
5,15
]
][
[
]
[
2
2
Y
H
M
MY
edta
M
MY
]
[
V
V
V
c
0
0
M
edta
M
MY
]
[
V
V
V
c
0
0
M
100
100
100
1
,
0

ad 4) po PR
- dodano 150 cm
3
roztworu EDTA
W roztworze znajduje się nadmiar ligandu H
2
Y
2-
; jego stężenie wynosi
[H
2
Y
2-
] =
oraz
[MY] =
Z wyrażenia na stałą trwałości kompleksu
M-edta
=
mamy
[M] = pM = log
M-edta
– log =
= log
M-edta
– log = 9,3 – log =
8,99
0
0
M
Y
H
V
V
V
c
V
c
2
0
0
M
V
V
V
c
]
Y
H
][
M
[
]
MY
[
2
edta
M
2
]
Y
H
[
]
MY
[
]
Y
H
[
]
MY
[
2
0
M
Y
H
0
M
V
c
V
c
V
c
2
100
1
,
0
150
1
,
0
100
1
,
0

ad 5) skok krzywej maireczkowania
pM
- 0,1%
= - log [M] = - log = - log =
4,3
pM
+0,1%
= log
M-edta
– log = 9,3 – log =
6,3
9
,
99
100
9
,
99
1
,
0
100
1
,
0
V
V
V
c
V
c
Y
H
M
0
0
2
]
Y
H
[
]
MY
[
2
100
1
,
0
1
,
100
1
,
0
100
1
,
0
pM = 4,3 – 6,3
%
1
,
0
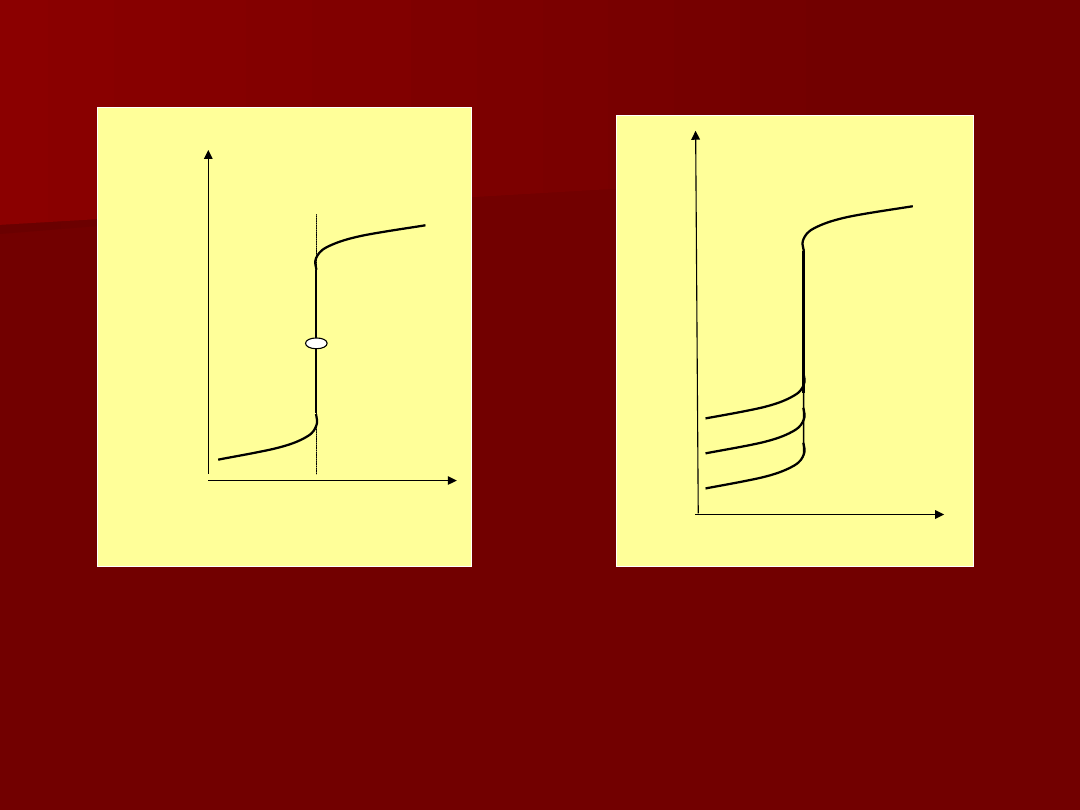
pM
V
Krzywa
miareczkowania
Zależność wielkości skoku krzywej
miareczkowania od stężenia
reagujących składników
0,1 M
0,01 M
0,001 M
pM
V

log = 10
log = 8
log = 6
pM
V
Zależność wielkości skoku krzywej mkiareczkowania
od wartości stałych trwałości

Wskaźniki w kompleksometrii
Wskaźniki możemy podzielić na:
1. metalowskaźniki (wskaźniki matalochromowe)
1. wskaźniki redoks
Metalowskaźniki – są to substancje barwne lub
bezbarwne – które w warunkach miareczkowania, są
zdolne utworzyć barwny kompleks z jonami metalu
oznaczanego lub użytego do odmiareczkowania
nadmiaru kompleksonu.

Ogólny przebieg miareczkowania z użyciem wskaźników
M - Ind + edta M - edta + Ind
barwa I
barwa II
Warunki jakim powinien odpowiadać wskaźnik stos. w
kompleksometrii
•
reakcja powinna być na tyle czuła, aby w pobliżu PK zabarwienie roztworu
było jeszcze silne
• reakcja powinna być specyficzna albo selektywna i możliwie mało zależna od
czynników ubocznych
• kompleks ze wskaźnikiem powinien być wystarczająco trwały, (
M-Ind
=10
4
-10
5
i
powinna być mniejsza o 4 rzędy od
M-EDTA
)
• różnica barw między wolnym wskaźnikiem a kompleksem z metalem powinna
być wyraźna i łatwo dostrzegalna
• reakcja wskaźnika z metalem powinna być natychmiastowa
• wskaźnik powinien odpowiadać powyższym warunkom w tym obszarze pH, w
którym jest prowadzone miareczkowanie.
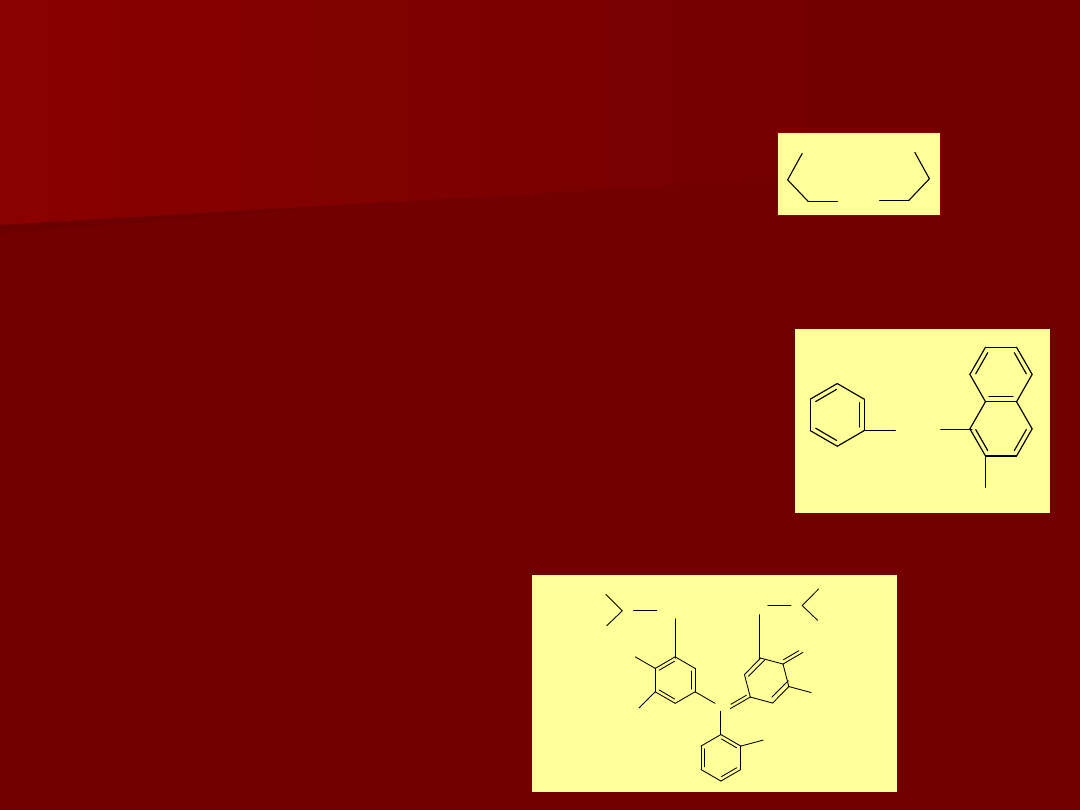
Podział wskaźników metalochromowych
1. Barwniki orto, orto-dihydroksyazowe;
np.:
(zawierają ugrupowanie)
Czerń eriochromowa T
(czerń T)
Granat eriochromowy R (Calcon)
Kalces
2. Orto, orto’-dwupodstawione barwniki azowe;
np.:
PAN
(1-(2-pirydyloazo-2-naftol))
3. Ftaleiny i sulfoftaleiny,
np.:
Fluorekson (kalceina)
Oranż ksylenolowy (rys)
Fiolet pirokatechinowy
Mureksyd
OH
HO
N=N
N
N=N
OH
C
O
SO H
3
HOOC-H C
HOOC-H C
N
H C
2
2
2
N
H C
2
2
2
CH - COOH
CH - COOH
CH
3
HO
H C
3

Najczęściej stosowane wskaźniki
Czerń eriochromowa T
(pierwszy wskaźnik wprowadzony przez G.
Schwarzenbacha)
H
3
In H
2
In
-
HIn
2
-
In
3
-
barwa
barwa
barwa
czerwona
niebieska
pomarańczowa
W środowisku pH około 9-10 niebieska postać wskaźnika tworzy
różowofiołkowe kompleksy chelatowe z kationami metali: Mg,
Ca, Zn, Ni i inne
OH
N=N
OH
NO2
3
SO H
pH 6,3
pH 11,5
K
a1
= 5
.
10
-7
K
a2
= 2,8
.
10
-12

Wskaźniki redoks
Wykorzystuje się je podczas miareczkowania jonów metalu o
wysokim potencjale utleniającym np.
żelaza lub miedzi
.
Przed PR
– wskaźnik ma barwę właściwą dla utlenionej
postaci wskaźnika
Po PR
– po związaniu prawie całej ilości ilości metalu prze
ligand, potencjał układu na tyle się obniża, że wskaźnik ma
postać zredukowaną inaczej zabarwioną.
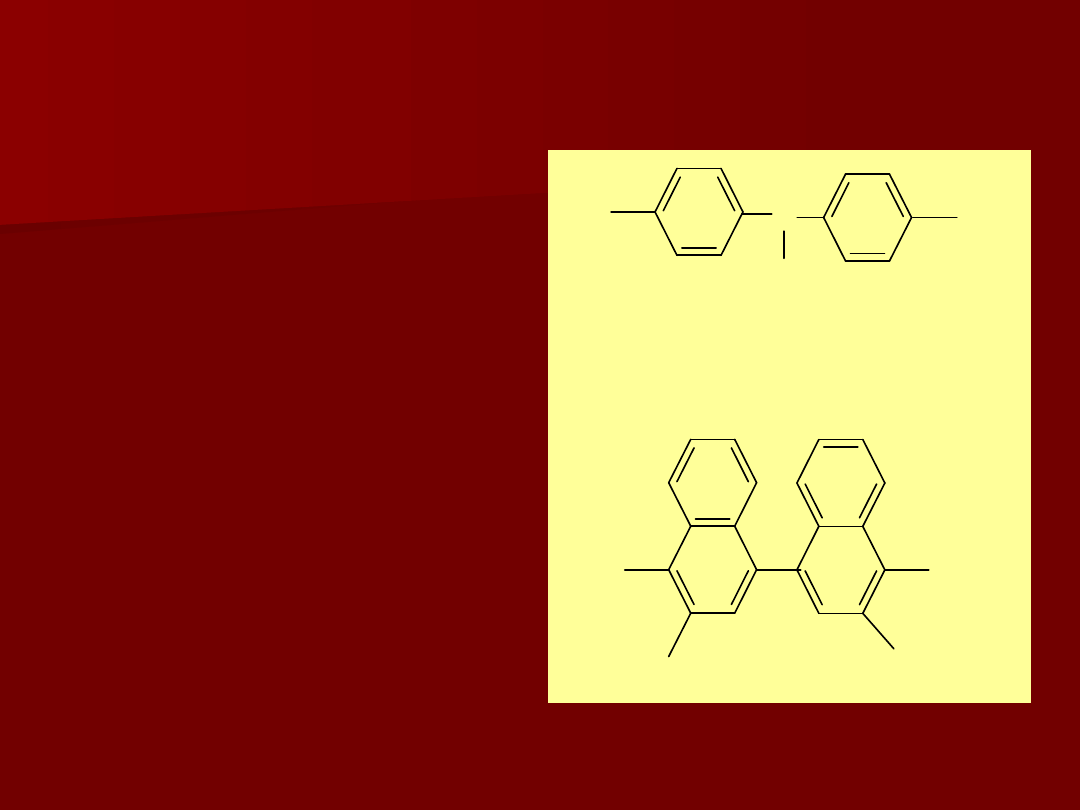
Przykłady wskaźników redoks w kompleksometrii:
błękit wariaminowy
forma utl: niebieska
forma zred: bezbarwna
3,3’-dimetylonaftydyna
forma utl: czerwona
forma zred: bezbarwna
H N
N
H
OCH3
2
NH2
3
3
2
CH
CH
H N

Kation
lg β’
MY
Kation
lg
β’
MY
Kation
lg
β’
MY
Na
+
1,66
Co
2+
16,31 V
3+
25,9
Li
+
2,79
Co
3+
36
VO
2+
18,77
Ag
+
7,2
Ni
2+
18,62 A1
3+
16,13
Mg
2+
8,69
Cu
2+
18,80 In
3+
24,9
Ca
2+
10,96
Zn
2+
16,50 Ti
3+
21
Sr
2
+
8,63
Cd
2+
16,46 TiO
2+
17,3
Ba
2+
7,76
Hg
2+
21,80 Ti
4+
19
Mn
2+
14,04
Pb
2+
18,04 Cr
3+
23
Fe
2+
14,33
Sn
2+
22,1
Th
4+
23,2
Fe
3+
25,1
V
2+
12,7
Zr
4+
31
Logarytmy stałych trwałości normalnych kompleksów niektórych
kationów z kwasem wersenowym w temp. 20°C w roztworach o sile
jonowej µ = 0.1
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
Chemia analityczna wykład prezentacja
Zadanie 4 CHEMIA ANALITYCZNA
Chemia analityczna kolos
CHEMIA ANALITYCZNA 2 TEST poprawione przez G M
analiza wody sprawozdanie chemia analityczna analiza wody teoria
chemia analityczna wyklad 11 i 12
kationy IIIgr(1), Farmacja, Farmacja, - Chemia Analityczna
Notatki chemia analityczna
chemia analityczna wyklad 02
Chemia analityczna skrypt
Program, Ochrona Środowiska, Chemia analityczne środowiska
Zasady nazewnictwa wybranych klas zwi-zk-w organicznych, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA
WSPOLCZESNE WYZWANIA CHEMII ANALITYCZNEJ, Chemia środków bioaktywnych i kosmetyków, Chemia analitycz
chemia analityczna wyklad 13 i 14
ĆWICZENIE 9, Studia TOŚ, chemia analityczna-labor. semestr III
ZAGADNIENIA TEORETYCZNE ĆW.7-8, Studia TOŚ, chemia analityczna-labor. semestr III
pytania do kolokwium z analizy wagowej i alkacymetrii, chemia analityczna
więcej podobnych podstron