

Tkanka tłuszczowa największy
„gruczoł” endokrynny
leptyna
rezystyn
a
RBP-4
apelin
a
wisfatyn
a
waspina
omentyn
a
TNF + sR
IL-6 + sR
NO
PAI-1
angiotensynog
en
TGF
adipsyna
AdipoQ
ApoE
IGF-1
ASP
białko
Agouti
steroidy
Czynniki
komplementarne
adiponektyna
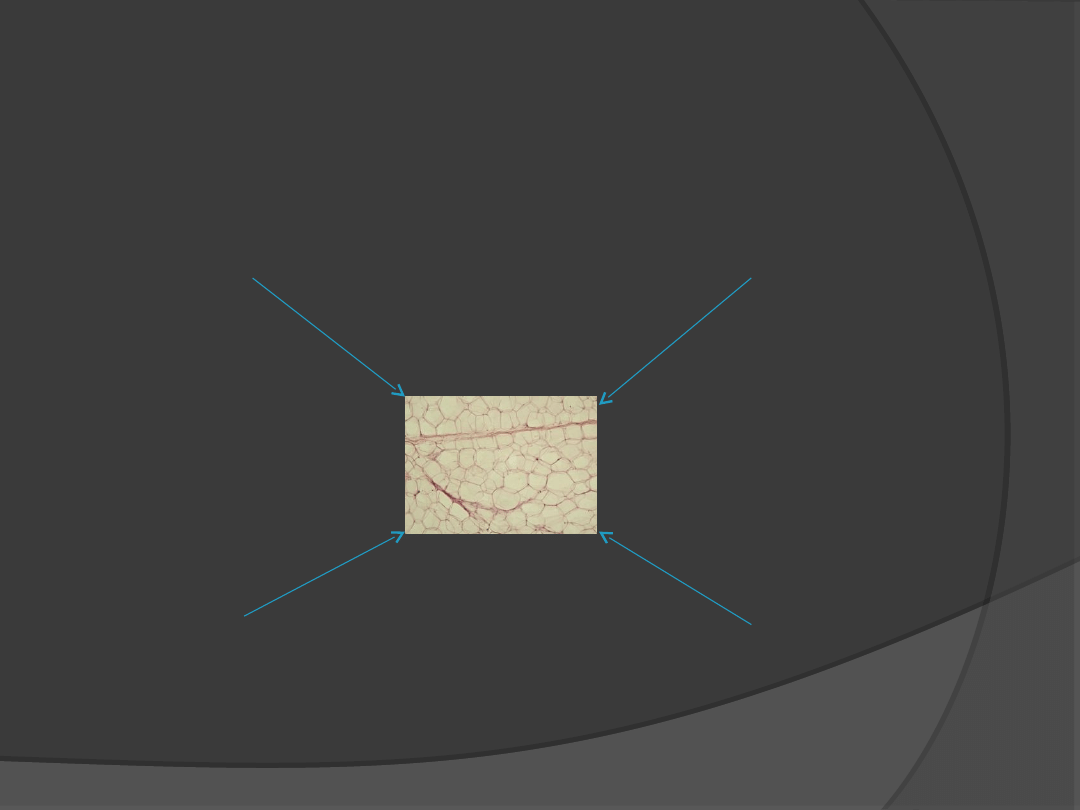
Ekspresja niektórych
receptorów
w tkance tłuszczowej
Receptory dla „tradycyjnych
„ endokrynnych hormonów ;
- rec. insulinowy
- rec. glukagonowy
- rec. GH
- rec. TSH
- rec. Gatrynowy/CCK
- rec. GLP-1
- rec. Angiotensyny II t
1 i 2
Receptory dla
katecholamin;
-
1 2
Jądrowe hormonalne
receptory;
- rec. glikosterydowy
- rec. witaminy D
- rec. hormonów tarczycy
- rec. Estrogenowy
- rec. Androgenowy
- rec. progesteronowy
Receptory
cytokinowe:
- rec. leptynowy
- rec. IL-6
- rec. TNF

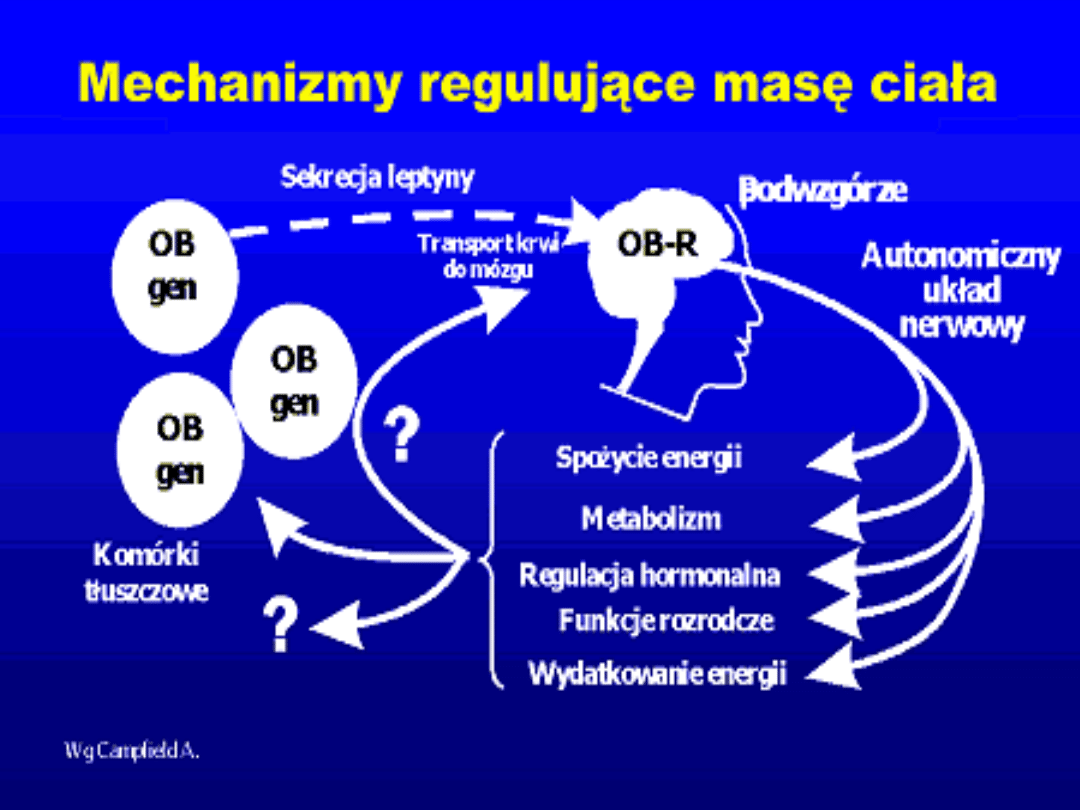
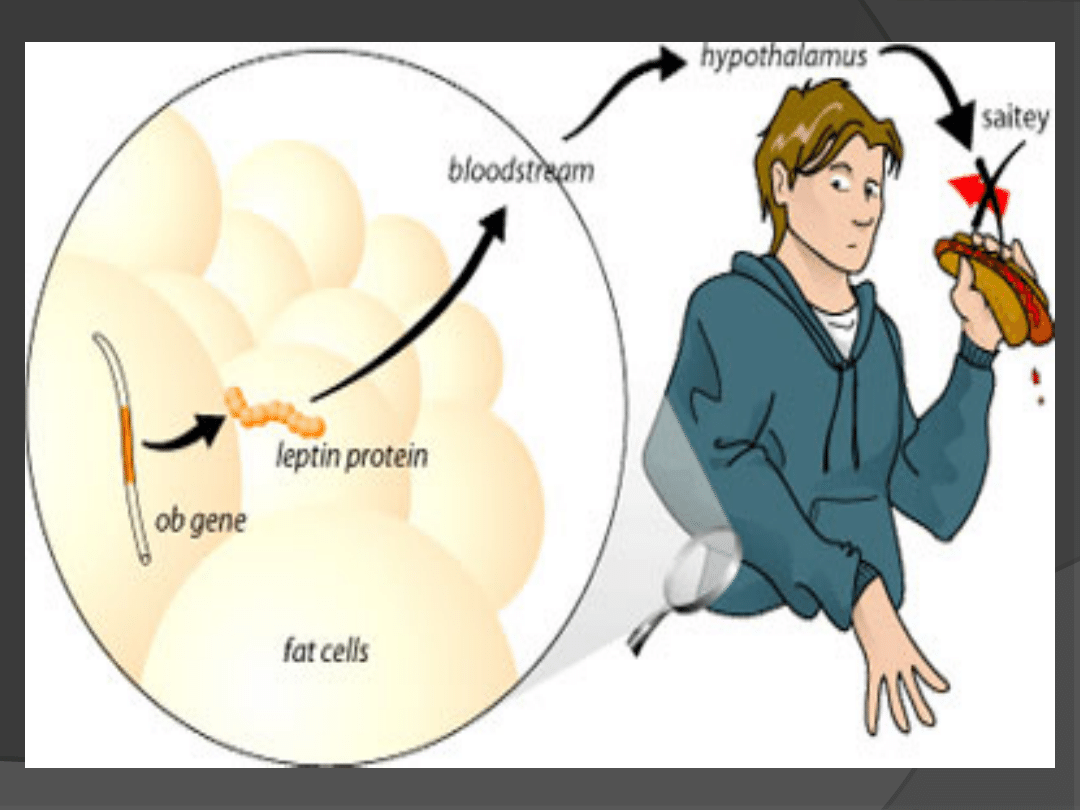
Historia odkrycia leptyny
1958 r. Harvey wykazał obecność
hormonu, który reguluje masę ciała
działając na podwzgórze;
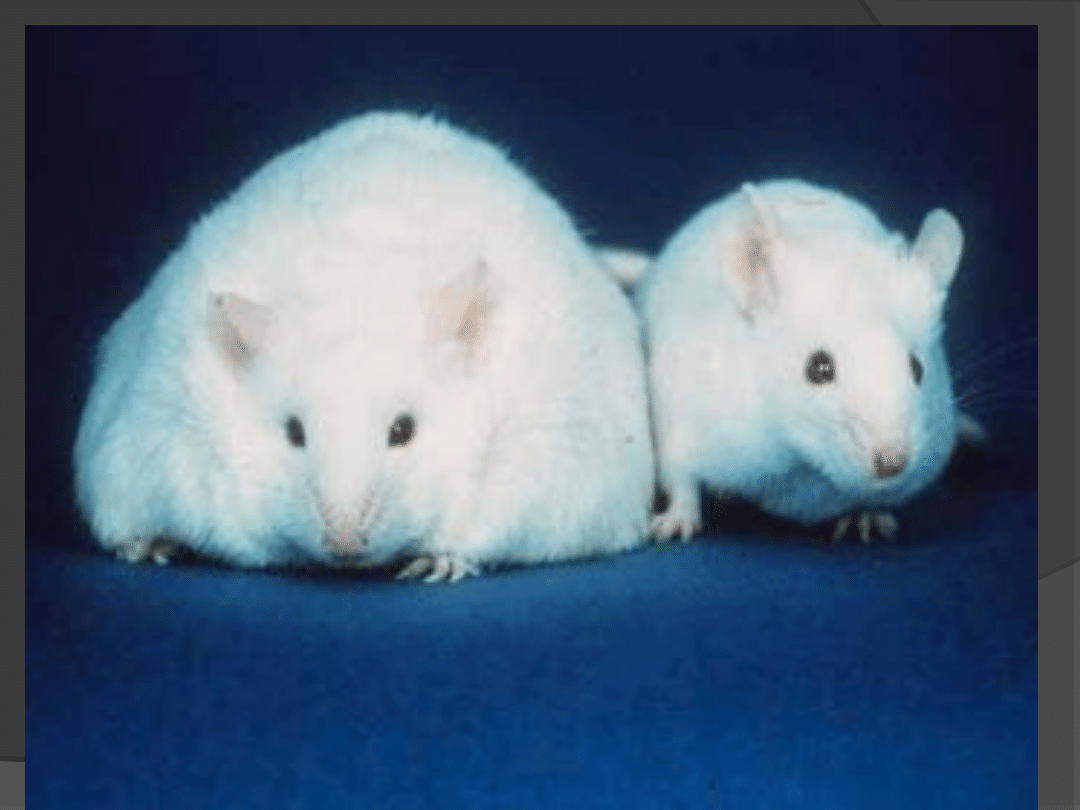
1959 r. Hausberger wykazał, że u myszy z
genetycznie uwarunkowaną otyłością
szczepu C57BL/6J brak jest czynnika
sytości;
1994 Zhang i wsp. zidentyfikowali i zbadali
sekwencję genu otyłości u myszy (gen ob)

GEN OB
Lokalizacja 6 chromosom;
Ekspresja tkanka tłuszczowa; łożysko, tkanka
gruczołowa żołądka; mięśnie szkieletowe,
wątroba.
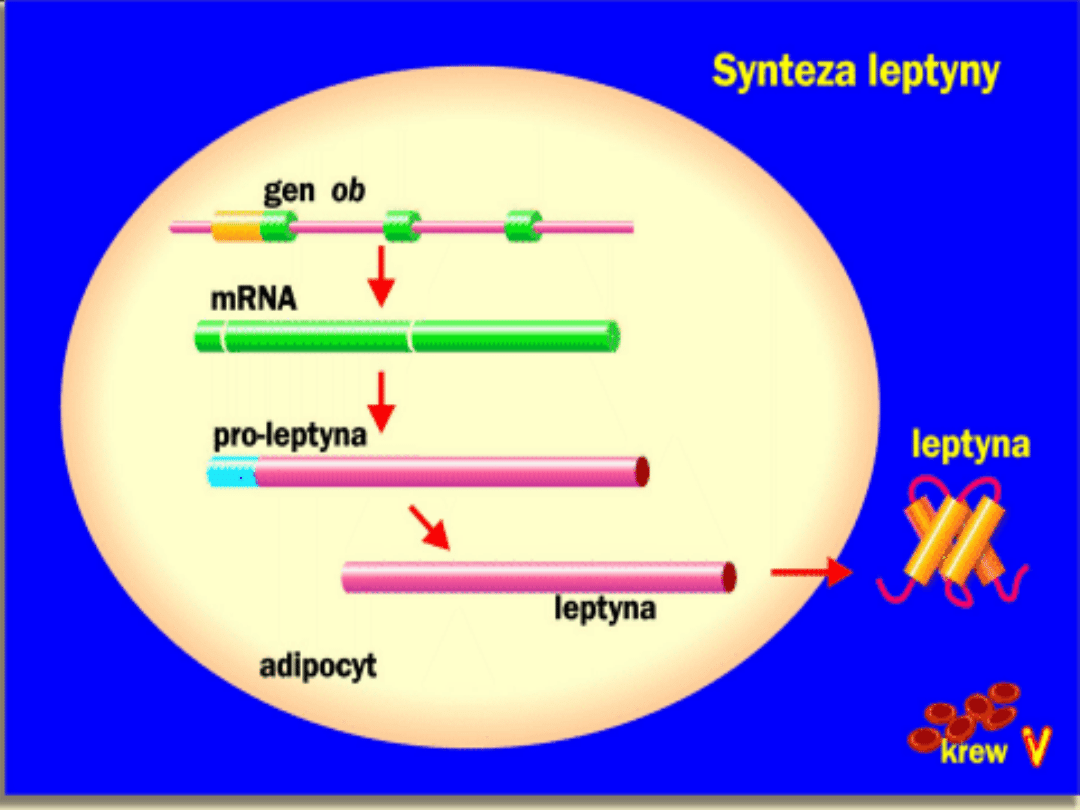
Koduje mRNA:
-
u myszy złożone z 4,5 kb
-
u ludzi 20 kb i zawierające egzony
poprzedzielane 2 intronami;
-
produktem jest białko
leptyna
o masie
cząsteczkowej 16 kDa, zbudowane z 167
aminokwasów
-
Sekwencja leptyny jest w 84% identyczna
u myszy i u ludzi
Leptyna w krążeniu
Cząsteczka złożona ze 146 aminokwasów –
odłączenie 21 aminokwasowego sygnałowego
odcinka wydzielniczego;
Czas półtrwania 25 minut;
U ludzi wiąże się z 2 białkami o masie
cząsteczkowej 176 kDa i 240 kDa, które mogą
zmieniać jej biodostępność
i bioaktywność;
Uwalniana w rytmie dobowym ze
szczytem w godzinach nocnych.

Wydzielanie leptyny
Jest proporcjonalne do masy tkanki tłuszczowej.
Podlega regulacji przez różne inne czynniki, takie jak:
1)
wzrost wydzielania:
-
insulina;
-
glikokortykosteroidy;
-
estrogeny;
-
TNF-
2 zmniejszenie wydzielania:
-
androgeny;
-
GH;
-
agoniści PPAR-;
-
FFA;
-
agoniści receptorów adrenergicznych .

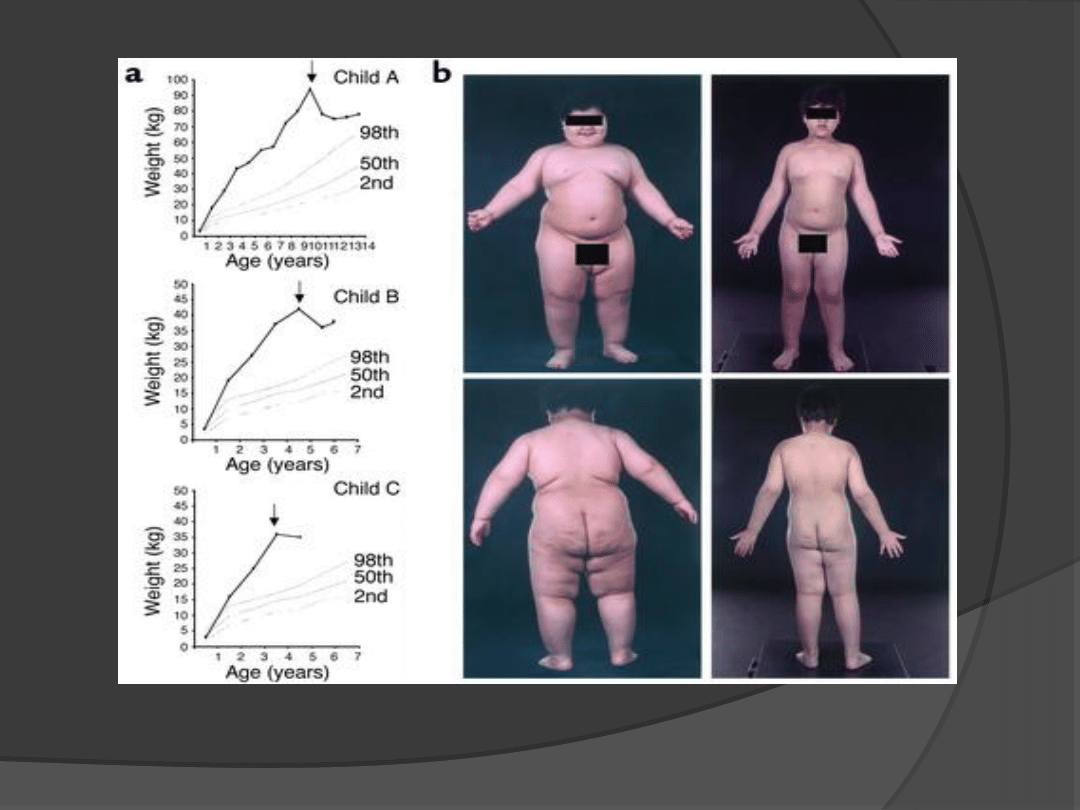
Dlaczego myszy ob/ob są
otyłe ?
Mutacja C-T w obrębie 105
kodonu genu ob powoduje
przedwczesne zakończenie
transkrypcji poprzez brak
kodowania argininy;
W adipocytach 20-krotnie
wzrasta ekspresja
nieprawidłowego mRNA
genu ob przy braku
prawidłowej cząsteczki
leptyny

Do czego to prowadzi ?
Hiperfagii;
Obniżenia termogenezy;
Bezpłodności
(zmniejszenie zawartości
LHRH w podwzgórzu
i gonadotropin w
osoczu;
Rozwoju cukrzycy typu 2.

Jak odchudzić mysz
ob/ob ?
Podać leptynę:
-
mniej jedzą;
-
zwiększa się termogeneza;
-
wraca płodność;
-
chudną i ustępują
zaburzenia metaboliczne.

A co z innymi otyłymi?
Myszami db/db;
Szczurami fa/fa;
Ludźmi

Nie wykryto u nich mutacji genu ob;
Ekspresja mRNA genu ob jest wyższa niż
u szczupłych;
Nie wykryto mutacji potranslacyjnych
w cząsteczce leptyny;
Stężenie leptyny w surowicy wyższe w
wyniku zwiększonej produkcji przez tkankę
tłuszczową;
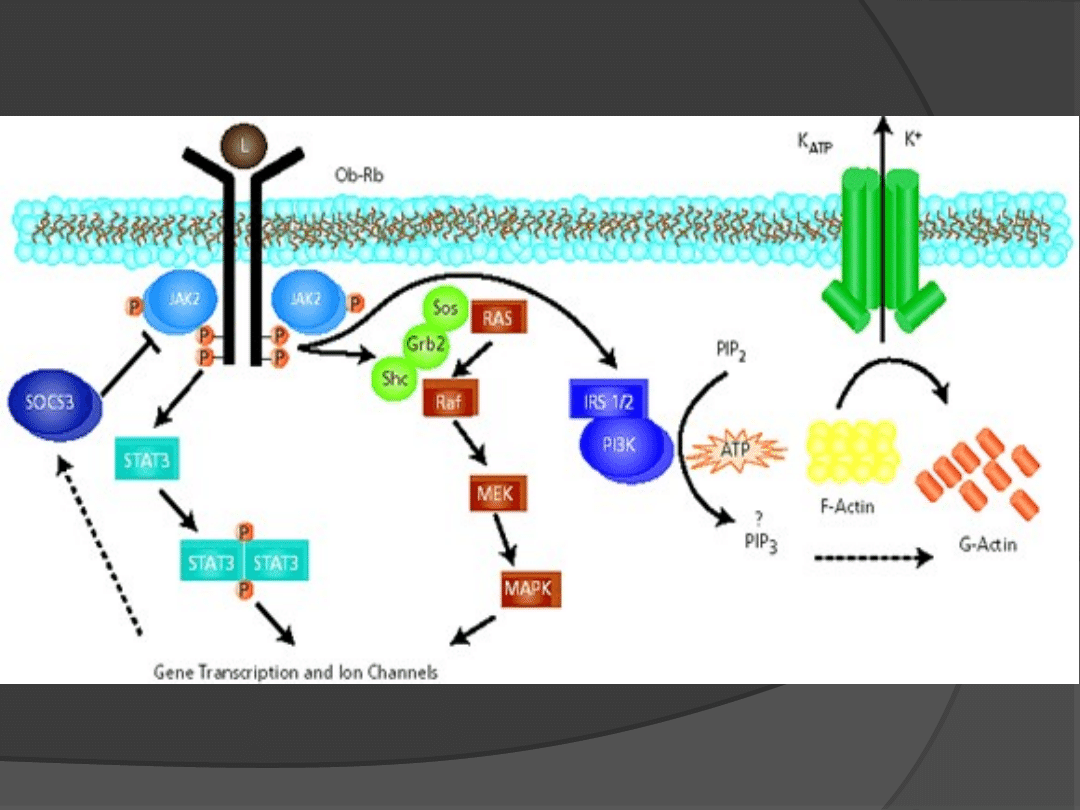
Leptynooporność czy defekt receptorowy?

Receptor leptynowy (OB-R)
1995 r. Tartagila i wsp. zidentyfikowali
gen dla receptora leptyny i miejsce jego
ekspresji;
U myszy zlokalizowny na chromosomie 4
a u ludzi na chromosomie 1;
Należy do klasy I rodziny receptorów dla
cytokin

OB-R
Domena
zewnątrzkomórkow
a 840
aminokwasów
Domena
przezbłonowa
4
aminokwasy
Domena
wewnątrzkomórko
wa - zmienna

Odmiany OB-R
Ob – Ra (krótki receptor dla leptyny z 4
aminokwasową domeną
wewnątrzkomórkową):
-
zlokalizowany w splocie naczyniówkowym
mózgu, podwzgórzu, płuca, nerki, tkanka
tłuszczowa;
-
pełni funkcję transportową.

Ob – Rb (długi receptor dla leptyny z 04
aminokwasową domeną wewnątrzkomórkową):
-
występuje w jądrze łukowatym podwzgórza
oraz innych okolicach mózgu biorących udział
w regulacji bilansu energetycznego
(jądro brzuszno-przyśrodkowe, boczne
podwzgórze, jądro przykomorowe, jądro
nadwzrokowe);
-
uczestniczy w przekazywaniu pobudzenia
wewnątrz komórki.
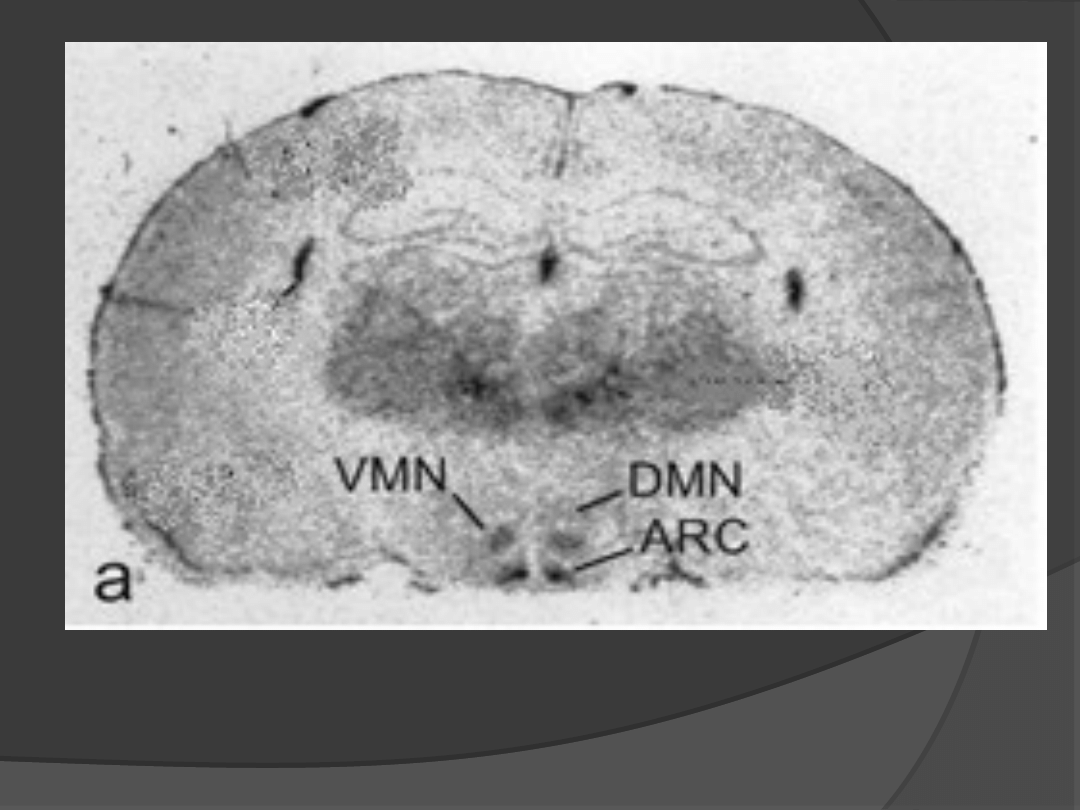
(Schwartz i wsp, 1996)
Neuropharmacology, 44, 947-849 (200).

Ob – Rc (z 2 aminokwasową domeną
wewnątrzkomórkową):
-
pełni funkcję transportową.
Ob – Re (najkrótszy, pozbawiony domeny
przezbłonowej, złożony tylko z 808
aminokwasów:
-
jest receptorem rozpuszczalnym;
-
Jest jednym z białek wiążących leptynę
w surowicy.

Receptory leptynowe znajdują się nie tylko
w mózgu, ale również w:
-
przednim płacie przysadki;
-
nadnerczach;
-
wątrobie;
-
płucach;
-
sercu;
-
nerkach;
-
jądrach;
-
jajnikach;
-
macicy;
-
komórkach beta trzustki;
-
śledzionie;
-
węzłach chłonnych;
-
tkance tłuszczowej.

Mutacje Ob – R u myszy
db/db
punktowa mutacja G-T powoduje
dodanie egzonu między Lys
889
– Pro
890
wielkości 106 bp, który zawiera
przedwczesny sygnał zakończenia
transkrypcji , co prowadzi do syntezy
Ob – R bez domeny
wewnątrzkomórkowej.
Powoduje to całkowitą niewrażliwość
na leptynę, a następnie otyłości.

Mutacje Ob – R u szczurów
fa/fa
Punktowa mutacja dająca zamianę w
pozycji 880 (A – C) w cDNA, a w pozycji
269 łańcucha aminokwasowego –
glutaminy na prolinę w
domenie zewnątrzkomórkowej Ob – R.
Powoduje to istotne zmniejszenie
całkowitego wiązania przez receptor
leptyny.

Ludzie
Nie wykryto podobnych mutacji genu OB – R;
Stwierdzono jedynie polimorfizm w sekwencji
cDNA tego genu w pozycji 668 (A G), co
powoduje zmianę substytucyjną
aminokwasów, glutamina – arginina w pozycji
22.
Jednak polimorfizm ten występuje zarówno
u szczupłych jak i u otyłych.

Jaki jest mechanizm oporności na
leptynę u otyłych ludzi
Mogą istnieć:
1)
Wewnątrznaczyniowy defekt, np.
-
przeciwciała przeciwko leptynie;
-
antagoniści leptyny;
-
zwiększona produkcja białek wiążących
leptynę, które ograniczają ilość wolnej
leptyny docierającej do mózgu;
-
przyspieszony rozkład i eliminacja z
krążenia.

2) Defekt w systemie transportującym
leptynę do OUN.
) Defekt sygnałowy.
Opisano heterozygotyczne mutacje genu
leptyny prowadzące do jej niedoboru
i otyłości oraz pojedyncze
homozygotyczne mutacje genu ob, która
skutkuje brakiem leptyny, hiperfagią i
otyłością olbrzymią.
J. Clin. Invest. 2002; 110: 109-110 .


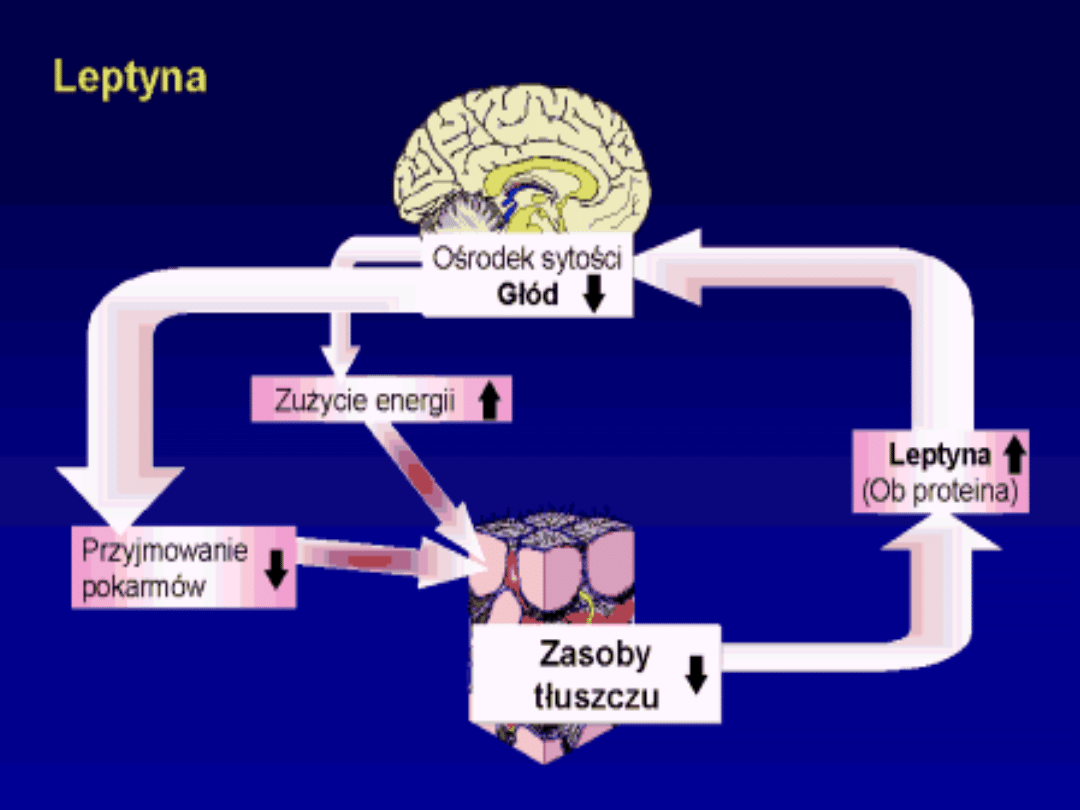
1) Zmniejsza głód;
2) Zwiększa metabolizm
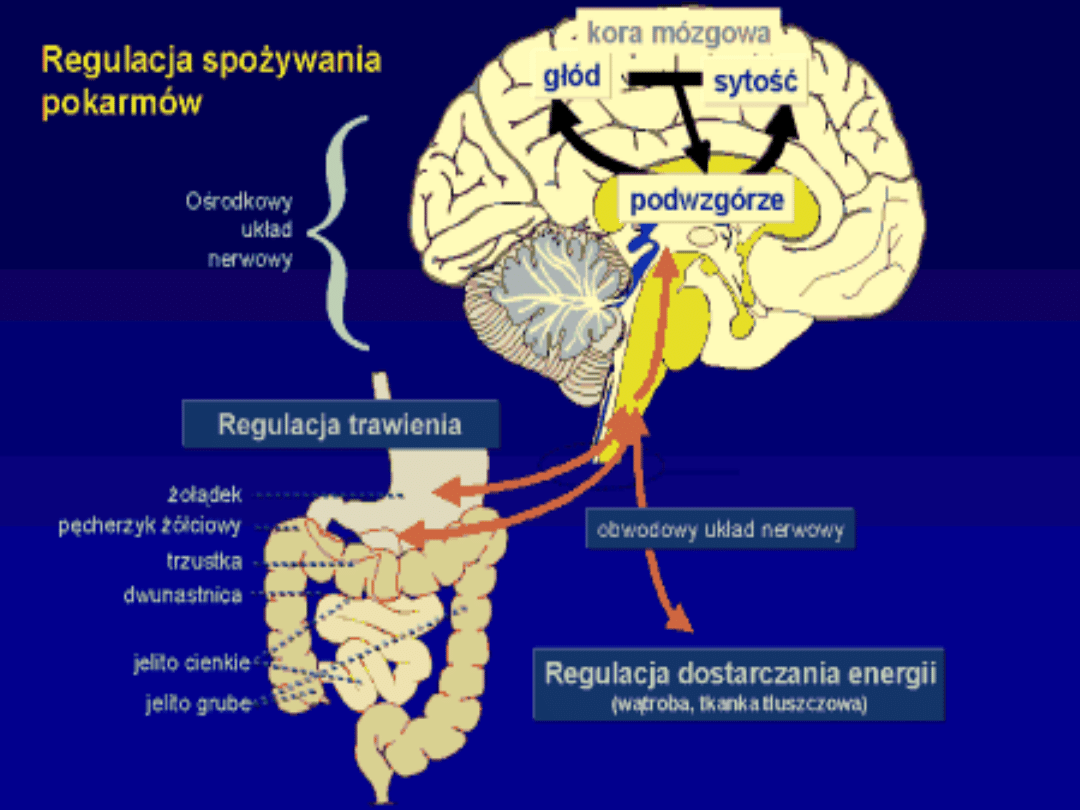
Masa tłuszczu
Dostępność
składników
pokarmowych
Krążące
składniki
pokarmowe
Sygnały pokarmowe
np. wolne kwasy
tłuszczowe
Sygnały z tkanki
tłuszczowej
(leptyna,
insulina)
Produkcja
glukozy
Równowaga
energetyczna
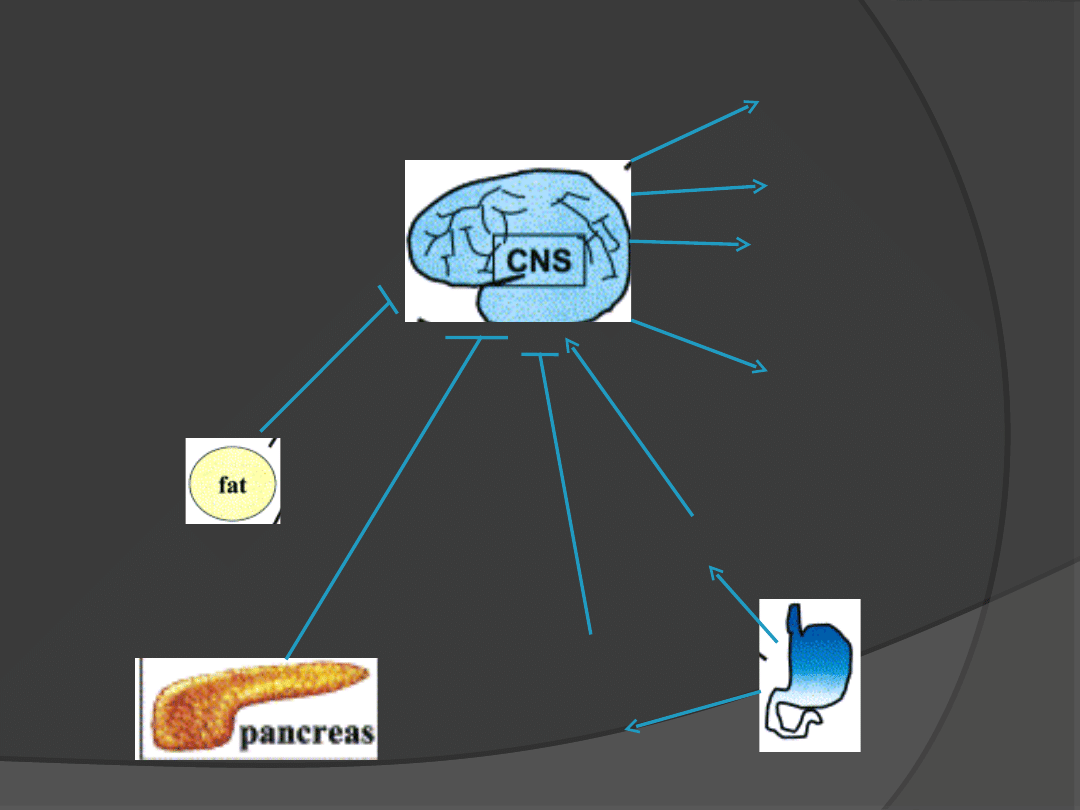
Długoczasowe
Sygnały
aferentne
leptyna
insulina
apetyt
Wydatek
energrtyczny
Środowisko
hormonalne
Reprodukcja, wzrost
Grelina
PYY
GLP-1
CCK
Sygnały
aferentne
związane
z posiłkiem
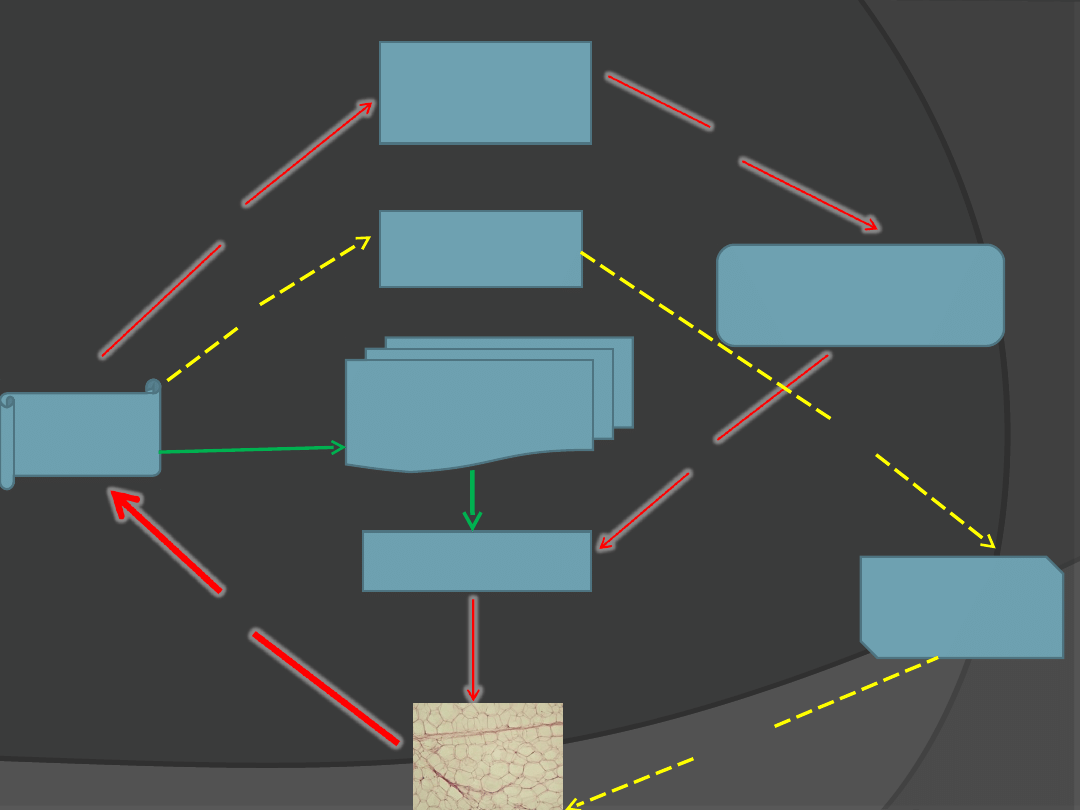
LEPTYNA
Białko
rozprzęgające
(UPC)
Apetyt
NPY
Podwzgórze
Przysadka
Tarczyca
metabolizm
Przepuszczalność
błony
mitochondrialnej
produkcja
wzrost
wzros
t
wzrost
hamowani
e
stymulacja
stymulacja
obniżeni
e
hamowanie
obniżenie
Wpływ leptyny na regulację łaknienia
tłuszcz
tłuszc
z
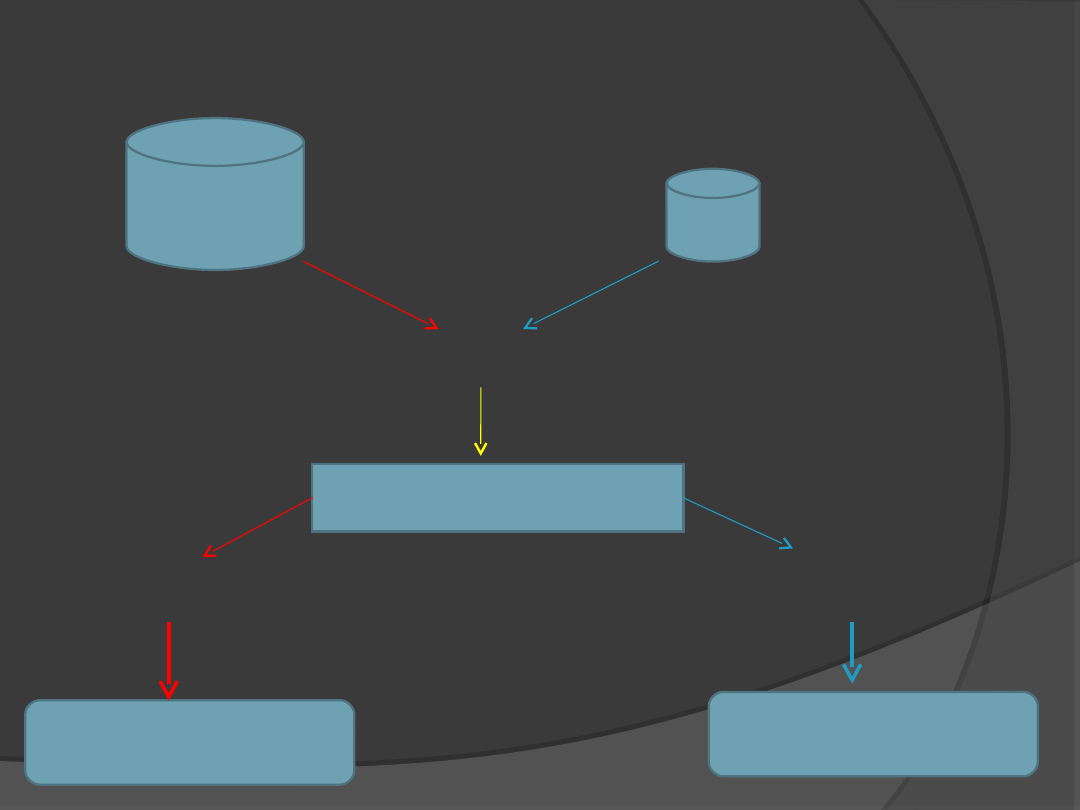
LEPTYNA
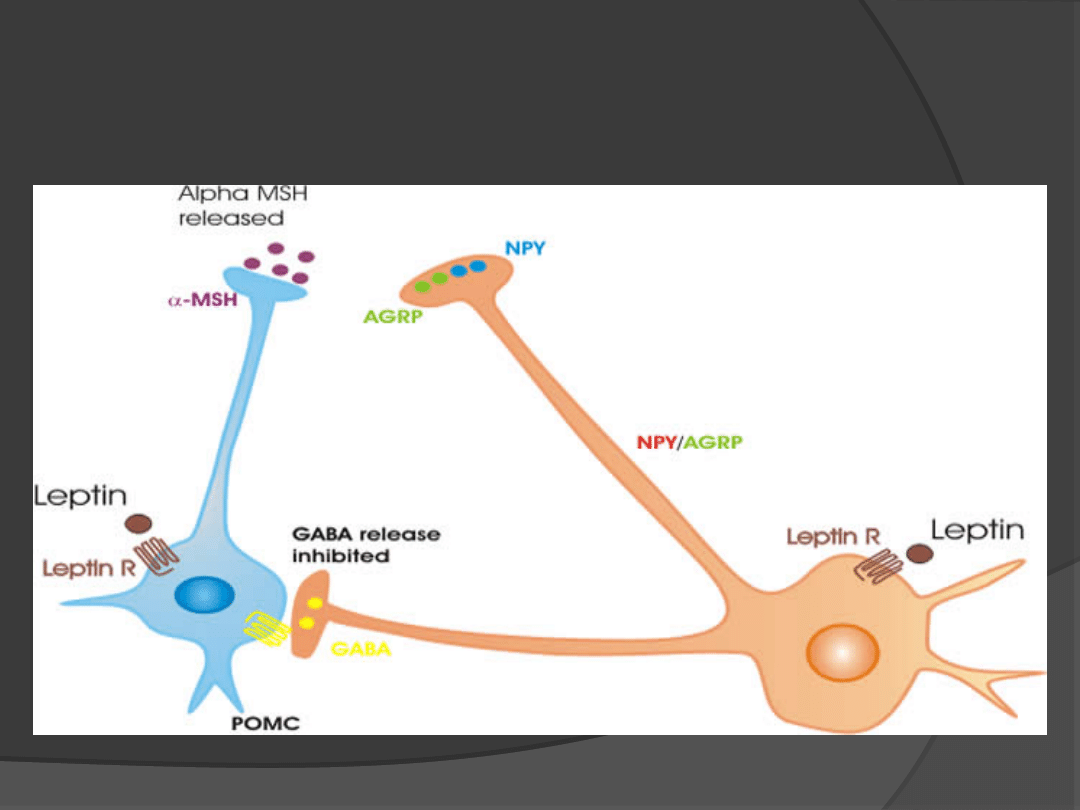
Jądro łukowate
podwzgórza
Zmniejszenie uwalniania NPY i
AgRP
Zwiększenie uwalniania POMC
Zmniejszenie
łaknienia
Wzrost sytości
Zwiększenie uwalniania NPY i AgRP
Zmniejszenie uwalniania POMC
Wzrost łaknienia
Zmniejszenie sytości
Cell, 116, 42 (2004).
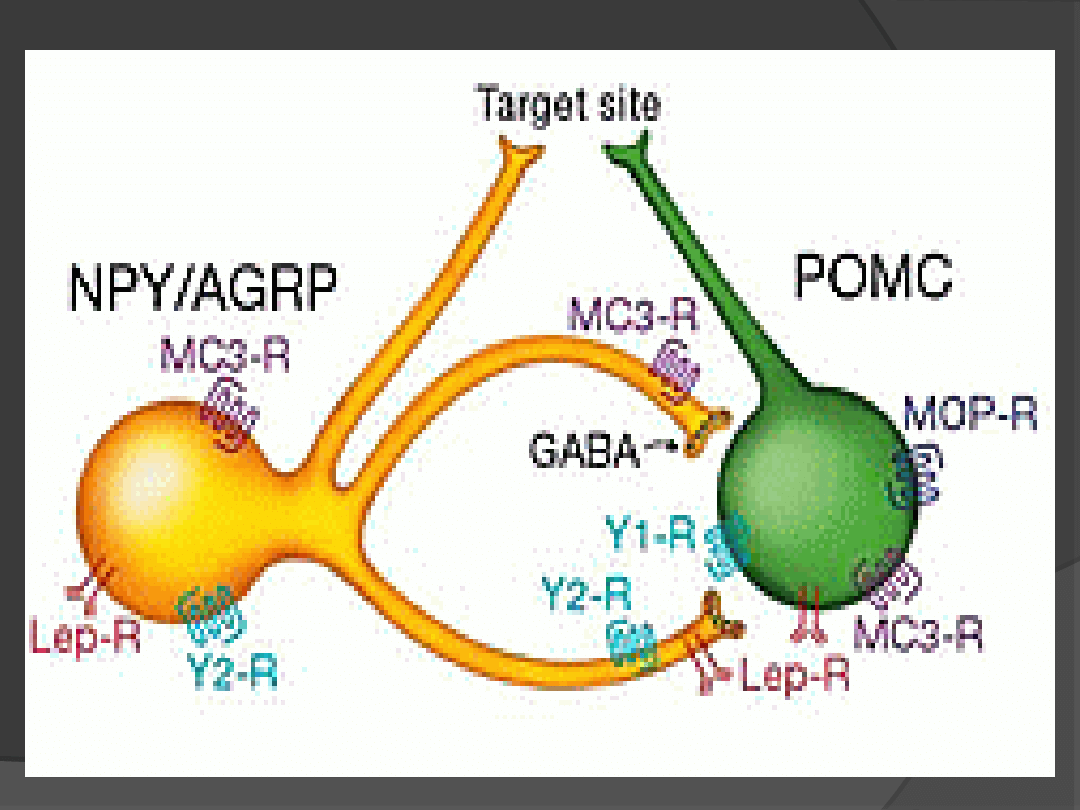
Leptyna aktywuje neurony w jądrze
łukowatym

) Aktywuje lipolizę;
4) Hamuje lipogenezę.
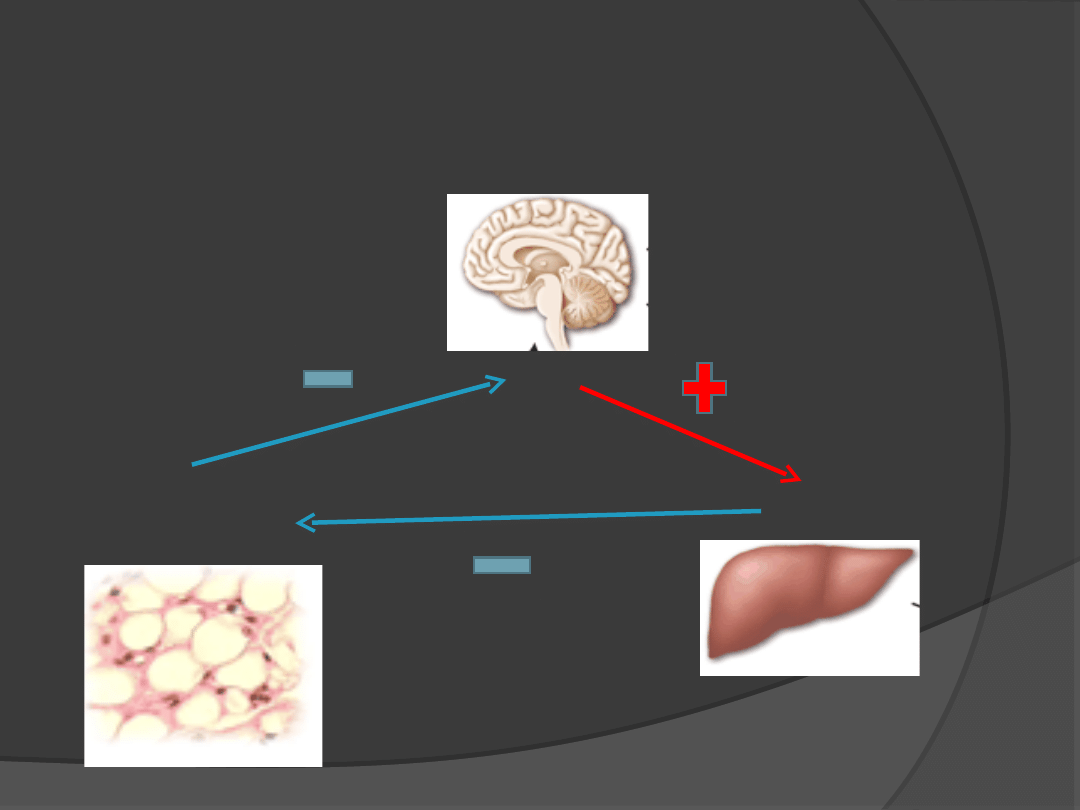
Leptyna a hormon wzrostu
Leptyna
GH
IGF-1
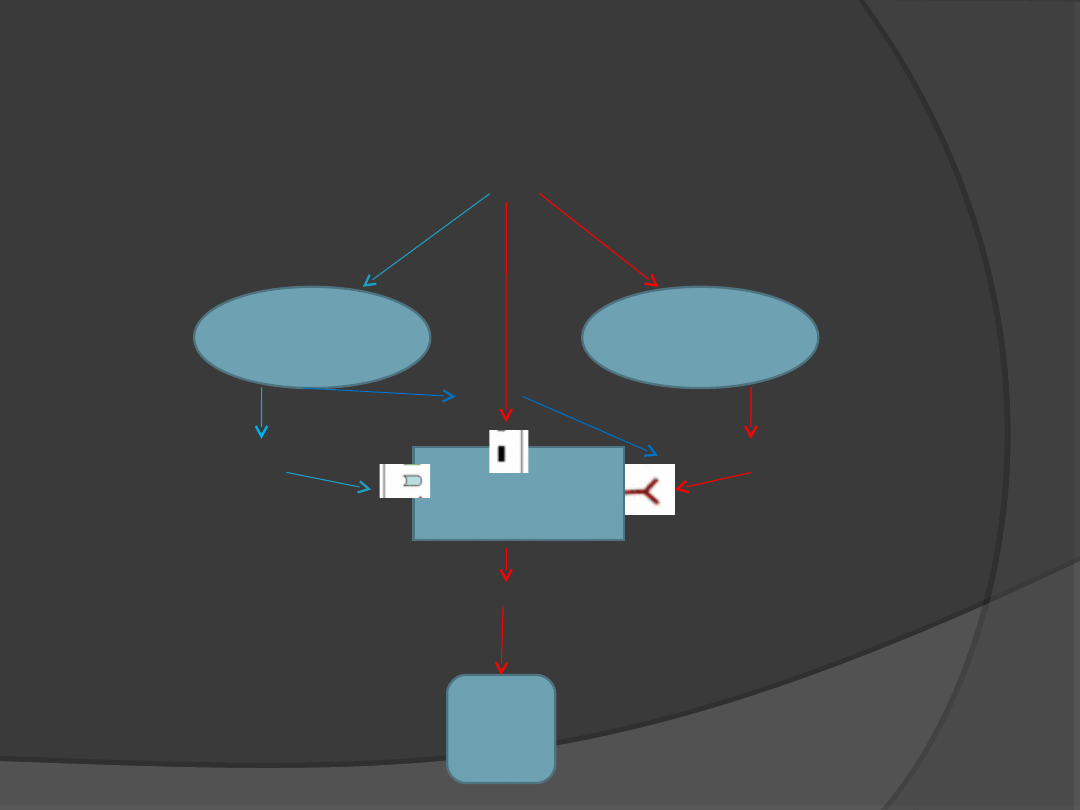
LEPTYNA
Neurony
NPY/AGRP
Neurony
POMC
Jądro
łukowate
Neurony TRH
TRH
TSH
Przysadka
Jądro
przykomorowe
-MSH
NPY
AGRP
Leptyna a hormony tarczycy
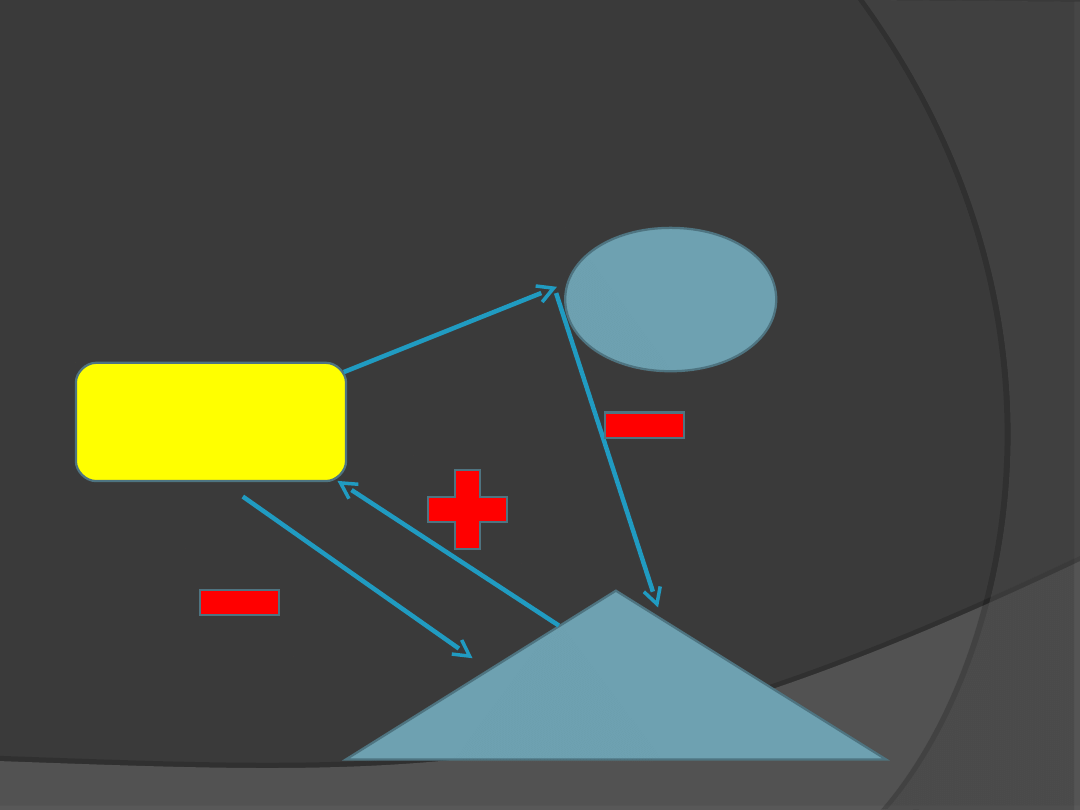
Wpływ leptyny na oś
podwzgórze – przysadka -
nadnercza
LEPTYNA
Nadnercza
glikokortykosteroi
dy
Przysadk
a
ACTH
Adipocyt
LEPTYNA
barier
a
Leptyna
+
białko wiążące
leptynę
podwzgórze
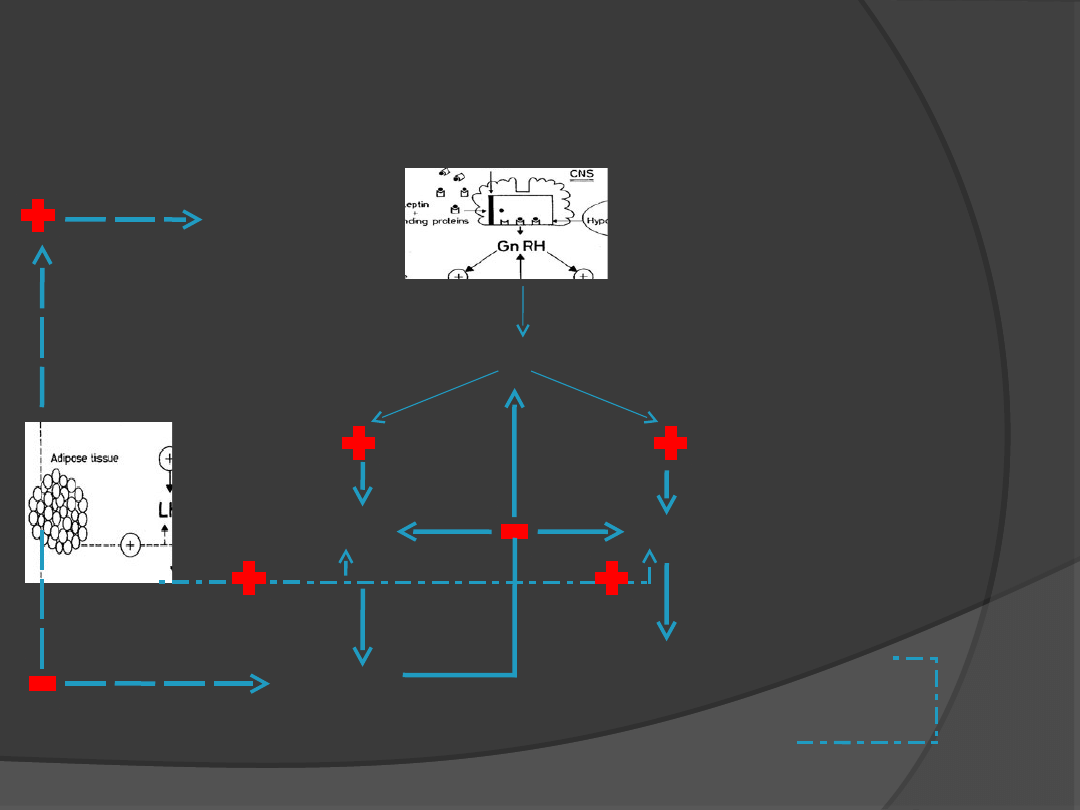
GnRH
L
H
FSH
Dojrzewanie pęcherzyka
Spermatogeneza
?
E2 wzrost
Progesteron obniżenie
Testosteron wzrost
Wpływ leptyny na oś podwzgórze – przysadka –
gonada

Leptyna a dojrzewanie
Wydaje się, że wzrost stężenia leptyny
do wartości progowych aktywuje oś
podwzgórze-przysadka do rozpoczęcia
dojrzewania płciowego.
Leptyna stymuluje podwzgórze do
produkcji GnRH, co z kolei zwiększa
syntezę gonadotropin w przysadce.
Leptyna wywiera również bezpośredni
wpływ na owulację.

Stężenia leptyny podczas cyklu
miesiączkowego
W fazie folikularnej stężenie leptyny
w surowicy obniża się;
Obserwuje się przed owulacyjny pik stężenia
leptyny;
W fazie lutealnej stężenie leptyny w surowicy jest
podwyższone.
Zmiany stężenia leptyny są związane ze zmianami
stężenia progesteronu, estrogenów i LH.

Leptyna a ciąża
Stężenie leptyny w surowicy w czasie ciąży jest
podwyższone, z największym wzrostem w drugim
trymestrze, a po porodzie gwałtownie się obniża.
Wydaje się, że obniżenie stężenia leptyny po
porodzie może odgrywać rolę w zmniejszeniu
płodności w czasie okresu laktacji.
Wzrost stężenia leptyny w czasie ciąży jest nie
tylko efektem zwiększenia masy ciała ale również w
wyniku produkcji leptyny przez łożysko i
rozwijający się płód i uwalnianiu jej do krążenia
matki.
Produkcja leptyny u ciężarnej jest zwiększana także
przez wzrost produkcji innych hormonów, takich jak
insulina, estrogeny i gonadotropiny.

Nie wiadomo czy leptyna syntezowana
przez łożysko działa jako czynnik wzrostu
płodu czy jako sygnał przekazujący
informację o stanie odżywienia między
matką a płodem.
W łożysku obecne są także receptory
leptynowe co sugeruje, że leptyna
odgrywa rolę we wzroście i rozwoju płodu.
Nie obserwowano jednak korelacji między
stężeniem leptyny u ciężarnych a masą
urodzeniową noworodka.

Leptyna a menopauza
Wydaje się, że obniżenie stężenia
leptyny w okresie menopauzy jest
spowodowane zmniejszeniem
stężenia estrogenów.
Ponieważ stężenie leptyny u kobiet
pomenopauzalnych nadal jest
wyższe niż u mężczyzn, wydaje się
że krążące androgeny mogą
również wywierać supresyjne
działanie na stężenie leptyny.
adipocyt
LEPTYNA
Komórka beta
trzustki
INSULINA
TNF –z
aktywowanych
komórek
immunologicznych
insulina
Leptyna a insulina

Wpływ leptyny na działanie
insuliny u ludzi
Receptory leptynowe występują na ludzkich
hepatocytach wykazano że leptyna moduluje
indukowaną przez insulinę aktywność tych
komórek.
Leptyna jest antagonistą sygnału insulinowego
poprzez zmniejszenie indukowanej przez
insulinę fosforylacji IRS-1, co z kolei zwiększa
ekspresję karboksykinazy PEP a zmniejsza
ekspresję glukokinazy, czego wynikiem jest
nasilenie glukoneogenezy i zmniejszenie
glikogenolizy.
Hiperleptynemia może przyczyniać się do
rozwoju wątrobowej insulinooporności.

Wpływ leptyny
na metabolizm komórkowy
Zmniejszenie wychwytu TG przez tkankę
tłuszczową i mięśnie z jednoczesnym
wzrostem ich stężenia w surowicy.
Wzrost oksydacji FFA.
Zmniejszenie przemian FA do TG w mięśniach.
Zmniejszenie syntezy białek wiążących się
z sekwencją wzmacniającą regionu
promotorowego DNA (CCAAT) w tkance
tłuszczowej, co może ograniczać różnicowanie
i wzrost adipocytów.
Aktywacja syntezy mitochondrialnych białek
rozprzęgających (termogeniny) w WAT, BAT
i mięśniach.

Bezpośrednie metaboliczne i termogenne
działanie leptyny zostało wykazano
głównie
w tkankach gryzoni labolatoryjnych.
U ludzi może mieć znaczenie
marginalne lub nawet żadne.
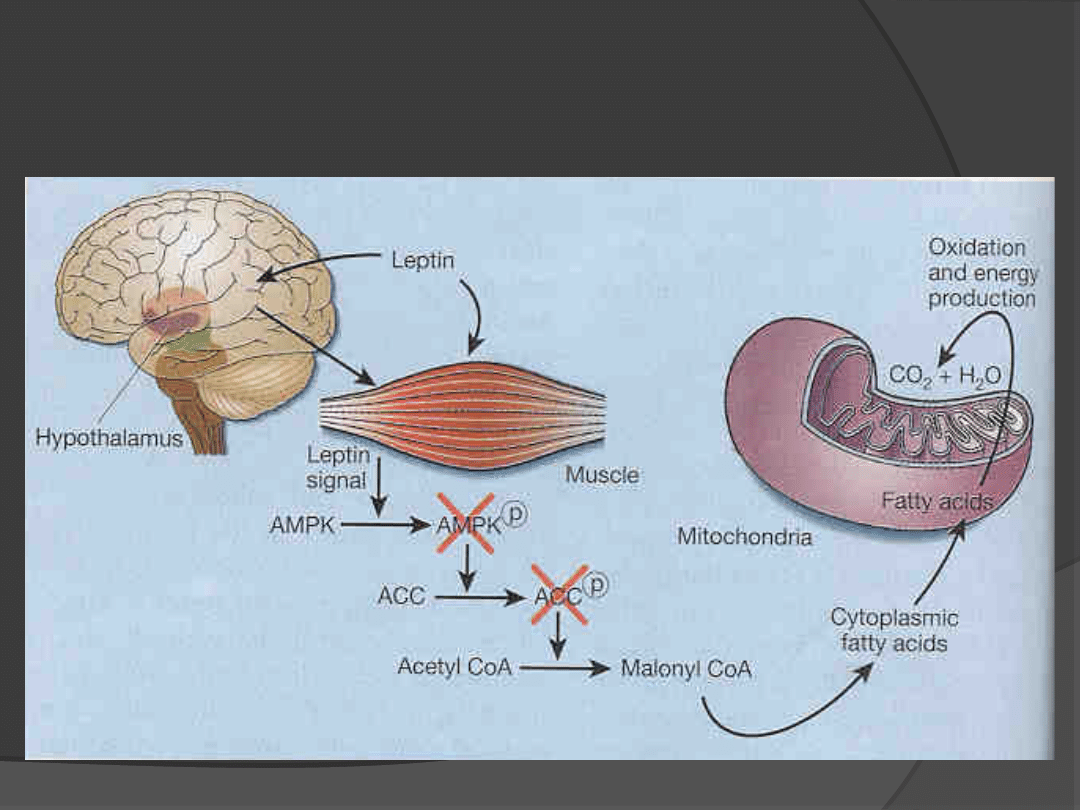
Leptyna aktywuje oksydację wolnych
kwasów tłuszczowych w
mitochondriach
NATURE, 2002; 415: 268 - 267

LEPTYNA a insulinooporność
1) Hamuje produkcję insuliny przez
komórki trzustki;
2) Zwiększa lipolizę w adipocytach i
mięśniach szkieletowych;
) Zwiększa oksydację FFA w mięśniach
szkieletowych

Leptyna a cukrzyca
Wydaje się, że towarzysząca otyłości
hiperleptynemia może uczestniczyć w
rozwoju cukrzycy typu 2, poprzez
supresję sekrecji insuliny indukowanej
przez glukozę oraz przez wpływ na
rozwój insulinooporności w tkankach
obwodowych.
Z drugiej strony leptyna może
wywierać działanie antycukrzycowe
przez zmniejszanie akumulacji
triglicerydów w tkankach.

Wpływ leptyny na funkcję
endotelium
Receptory leptynowe są obecne w komórkach
endotelium, zaobserwowano również indukowaną
przez leptynę fosforylację tyrozyny i aktywację
czynnika transkrypcyjnego Stat, co jest ważne w
regulacji odpowiedzi endotelium na leptynę.
Receptory leptynowe występują ponadto w ścianie
naczyń, zarówno u ludzi jak i u zwierząt .
W badaniach doświadczalnych wykazano, że
przewlekły wlep leptyny na poziomie
porównywalnym do tego, który występuje w otyłości
podnosi ciśnienie tętnicze. Przewlekła
hiperleptynemia powoduje również istotną
dysfunkcję endotelium w postaci zmniejszonej
produkcji i biodostępności NO.

Część z tych działań leptyny może być
efektem aktywacji układu NADPH oksydazy,
który odgrywa decydującą rolę w regulacji
stresu oksydacyjnego w naczyniach.
Poza tym leptyna w tętnicach wieńcowych
może wywierać działanie
naczyniorozkurczowe przez szlak niezależny
od NO.

Leptyna a miażdżyca
Ekspresję receptorów leptynowych
zaobserwowano w blaszkach
miażdżycowych.
W badaniu WOSCOPS, które
prospektywnie oceniało stężenie leptyny
przed i po incydencie kardiologicznym
potwierdzono, że leptyna jest niezależnym
czynnikiem ryzyka miażdżycy.

Leptyna a gospodarka
lipidowa
Zaobserwowano
1) Ujemne korelacje między stężeniem w
surowicy leptyny a stężeniami:
-
Apoliporoteiny A-I;
-
HDL;
-
TG
w populacji osób z wysokim ryzykiem
sercowo-naczyniowym.
2) Natomiast u pacjentek z zespołem PCO
dodatnią korelację między stężeniem leptyny a
stężeniem HDL.

Leptyna a układ
krzepnięcia
Leptyna wykazuje również działanie
pro-zakrzepowe. Receptory leptynowe
są obecne na płytkach krwi a ich
aktywacja zwiększa agregację płytek
krwi.

Wpływ leptyny na mięsień
sercowy
Opisano bezpośrednie działanie leptyny na
mięsień sercowy.
Zaobserwowano, że podawanie leptyny może
powodować upośledzenie funkcji miocytów
komory i wydaje się, że działanie to jest
wywierane na szlak NADPH oksydazy poprzez
receptor dla endoteliny-1.
Inne badania pokazały, że leptyna indukuje
zaburzenie kurczliwości kardiomiocytów poprzez
szlak zależny od NO.

Wpływ leptyny na kości
Leptyna pośrednio hamuje ale
bezpośrednio stymuluje tworzenie
kości;

Działania stymulujące
kościotworzenie
Hamuje wytwarzanie osteoklastów przez
stymulowanie produkcji osteoprotegryny
(OPG) i równoczesne zmniejszenie
proosteoklastogenicznego RANK przez
szpikowe komórki osteoblastyczne.
Pobudza osteoblasty do produkcji IGF-I i
TGF-które z kolei stymulują proliferację
komórek osteoprogenitorowych, stymulują
mineralizację macierzy kostnej i hamuje
apoptozę osteoblastów i osteocytów.

Działania hamujące
kościotworzenie
Stymuluje komórki podwzgórza do
produkcji podwzgórzowego czynnika
hamującego osteoblasty (HOBIF) lub
uruchamia procesy nerwowe, które
hamują aktywność macierzy
osteoblastów.
Hamując uwalnianie NPY, zapobiega
aktywacji receptorów Y2R, sygnału
który może imitować aktywność HOBIF.

Inne funkcje leptyny
Stymuluje hematopoezę – proliferacja
i różnicowanie komórek
hematopoetycznych;
Stymuluje angiogenezę, wzrost komórek
endotelialnych i przyspiesza gojenie ran;

Leptyna a układ
immunologiczny
Pobudza proliferację i różnicowanie monocytów.
Indukuje również uwalnianie przez monocyty
cytokin, takich jak TNF-i IL-6 oraz CCL2 i VEGF.
Działając na neutrofile powoduje wzrost
ekspresji CD11b oraz zwiększa ich chemotaksję
i sygnały oksydacyjne, wszystko to jest bardzo
ważne we wrodzonej reakcji immunologicznej i
regulacji kolonizacji skóry i błon śluzowych przez
patogeny.

Najważniejsze działania leptyny zachodzi
na poziomie adaptacyjnej odpowiedzi
immunologicznej, głównie w regulacji
komórek T. Leptyna indukuje produkcję
cytokin (TNF- INF- i IL-2)
wpływających na rozwój limfocytów Th1.
Ponadto leptyna wpływa na wytwarzanie,
dojrzewanie i przeżywanie limfocytów T
CD4+CD45RA a hanuje proliferację
limfocytów pamięci CD4+CD45RO+.

U myszy z brakiem leptyny obserwuje się
oporność na rozwój, niektórych chorób
autoimmunologicznych, a podatność na nie
jest odzyskiwana po podaniu leptyny.
Leptyna może zwiększać reakcje
autoimmunologiczne, co częściowo może być
spowodowane przez redukcję limfocytów T
regulacyjnych.
U pacjentów z chorobami
autoimmunologicznymi obserwuje się
podwyższone stężenia leptyny.

Wpływ leptyny na komórki nowotworowe
badania in vitro
(Garofalo and Surmacz 2006)
Rak piersi:
-
Wzrost proliferacji komórek;
-
Wzrost transformacji komórkowej;
-
Aktywacja szlaków ERK1/2, STAT,
Akt/GKS, PKC-;
-
Indukuje ekspresję ER
-
Indukuje ekspresję c-myc;
-
Indukuje ekspresję aromatazy przez
mechanizm zależny od AP-1.

Rak przełyku:
-
Zwiększa proliferację komórek;
Rak żołądka:
-
Zwiększa proliferację komórek poprzez
fosforylację ERK-2 i STAT;
Rak odbytnicy:
-
Zwiększa inwazyjność komórek przez
szlaki zależne od PI-K, Rho i Rac;
-
Zwiększa wzrost komórek przez szlak
ERK1/2;
-
Hamuje apoptozę komórek, stymulując
sygnał NF-B

Rak prostaty:
-
Wzrost proliferacji komórek;
-
Supresja apoptozy;
Rak trzustki:
-
Zmniejsza proliferację komórek;
-
Stymuluje fosforylację STAT i STAT5b;
Rak jajnika:
-
Wzrost proliferacji przez szlak ERK1/2;
Rak płuc:
- Wzrost proliferacji przez szlak ERK1/2;
Gruczolak przysadki:
-
Hamuje proliferację komórek;
-
Stymuluje apoptozę oraz ekspresję i
fosforylację SOC-

Rak wątroby:
-
Brak działania;
Białaczka szpikowa:
-
Wzrost proliferacji komórek;
A zatem leptyna in vitro stymuluje
wzrost, migrację i inwazyjność komórek
nowotworowych. Może także poprzez
wpływ na angiogenezę promować
rozwój nowotworów złośliwych in vitro.

Stężenie leptyny w
surowicy
U otyłych stwierdza się kilkukrotnie wyższe stężenie
leptyny w surowicy, niż u ludzi z prawidłową
masą ciała.
Stężenie leptyny we krwi kobiet jest 2- krotnie wyższe niż
u mężczyzn, w porównywalnym wieku, o tym
samym wskaźniku BMI i w obrębie tej samej rasy,
może to wynikać z działania estrogenów
na syntezę leptyny oraz z innej ilości
i rodzaju tkanki tłuszczowej. Ponieważ
wykazano znacząco większą syntezę
leptyny przez podskórną niż trzewną
tkankę tłuszczową .

Stężenie leptyny w
surowicy
Stosowanie diety i redukcja masy
ciała powodują gwałtowne
obniżenie stężenia leptyny w
surowicy. Co może być
mechanizmem kontr regulacyjnym
zapobiegającym dalszej redukcji
masy ciała w wyniku wzrostu
łaknienia i zmniejszenia
wydatku energetycznego.
I co z tego
wszystkiego
dla mnie
wynika ???

Praktycznie na razie nic.
1) Przypuszczano, że podawanie odpowiednio
dużych dawek rekombinowanej leptyny osobom
otyłym może przełamać oporność na leptynę.
2) Niestety, randomizowane badania kliniczne
albo nie potwierdziły skuteczności, albo
wykazały niewielką efektywność podawanej
pozajelitowo ludzkiej rekombinowanej leptyny.
) Podawana podskórnie długo działająca,
pegylowana pochodna ludzkiej leptyny również
nie spowodowała utraty masy ciała większej niż
placebo.
Zły to
czy
dobry
hormon?

Dotychczasowe badania dotyczące leptyny sugerują,
że jest to hormon wpływający korzystnie na
metabolizm, płodność, kościotworzenie,
hematopoezę.
Jednak hiperleptynemia występująca u otyłych może
przyczyniać się do rozwoju insulinooporności
i nadciśnienia tętniczego i dysfunkcji
endotelium.
Leptyna może także uczestniczyć w patogenezie
chorób autoimmunologicznych i sprzyjać rozwojowi,
niektórych nowotworów.
Konieczne są dalsze badania dotyczące
ewentualnych niekorzystnych działań tego hormonu.

Koniec
lekcji
2

Dziękuję
za
uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
Wyszukiwarka
Podobne podstrony:
02 Rola Leptyny
02 Rola Leptyny
predygier innowacyjna rola klastrow
epidemiologia, czynniki ryzyka rola pielegniarki rak piersi szkola, nauczyciel
Rola badań dodatkowych w diagnostyce chorób wewnętrznych wykład
Rola witamin w żywieniu ryb
w 9, rola państwa
Kwasy żółciowe i ich rola w diagnostyce chorób
prezentacja rola słońca w panu tadeuszu
6 Rola państwa w gospodarce
WYKŁAD 3 część 2 Rola czynników psychologicznych
rola panstwa
Rola glonów w przyrodzie, a gospodarce czlowieka
Kluczowa rola VEGF w angiogenezie
Rola rynku i instytucji finansowych INowy Prezentacja programu Microsoft PowerPoint
Miejsce i rola epidemiologii w medycynie
Rola usg
Rola BGK w systemie poręczeniowym
więcej podobnych podstron