
1
POLIMERY
Polimerami nazywamy długołańcuchowe cząsteczki
zbudowane z powtarzających się jednostek
(monomerów).
W technice dentystycznej stosowane są polimery
naturalne (guma, gutaperka, agar, alginiany) oraz
syntetyczne (bakelit, polietylen, polichlorek winylu,
polistyren, kwas poliakrylowy, akryl).
Polimery są klasyfikowane w oparciu o sposób ich
syntezy. Wyróżniamy dwie klasy polimerów:
1. Polimery addycyjne
2. Polimery kondensacyjne

2
Polimery addycyjne powstają w reakcji addycji
(przyłącze-nia) jednego monomeru do drugiego w
powtarzający się sposób. Polimery addycyjne
zachowują w swoim łańcuchu wszystkie atomy
monomeru.
Reakcje polimeryzacji addycyjnej wymagają
katalizatora, który inicjuje reakcję.
Najbardziej znanym przykładem polimeru
addycyjnego jest polietylen.

3
Polimery kondensacyjne powstają najczęściej w
wyniku reakcji dwóch różnych grup funkcyjnych.
Dodatkowym produktem takich reakcji jest jakaś
mała cząsteczka np. woda.
Polimery kondensacyjne nie zawierają więc
wszystkich atomów monomeru.
Przykładem polimeru kondensacyjnego jest nylon.
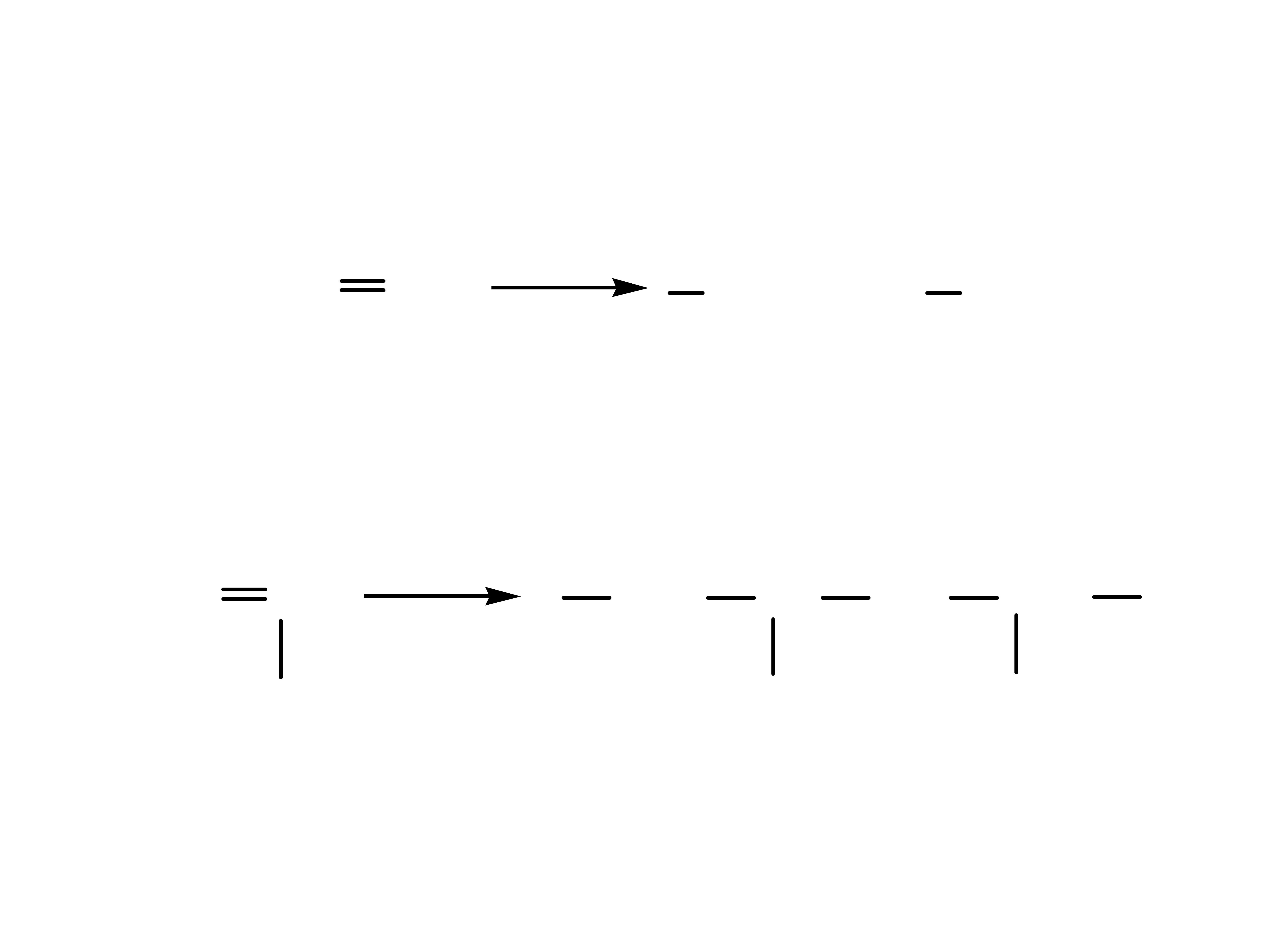
4
Monomery i powstające z nich polimery
H
2
C
CH
2
(CH
2
-CH
2
)
n
inicjator
etylen polietylen
H
2
C
CH
inicjator
Cl
(CH
2
CH CH
2
CH)n
Cl
Cl
chlorek winylu polichlorek winylu (PCV)
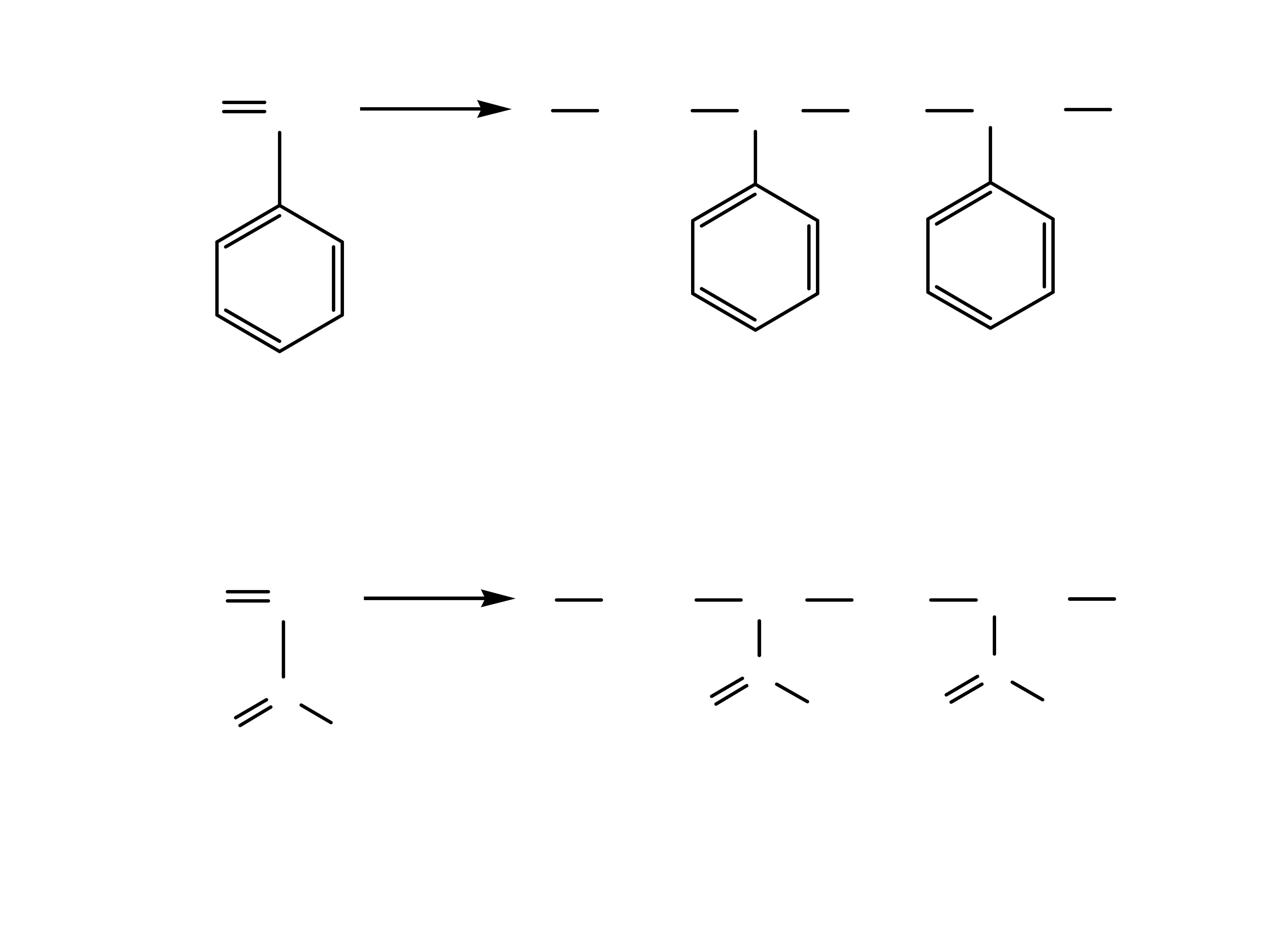
5
H
2
C
CH
inicjator
(CH
2
CH CH
2
CH)n
styren polistyren
H
2
C
CH
inicjator
C
(CH
2
CH CH
2
CH)n
C
C
kwas akrylowy kwas poliakrylowy
OH
O
OH
O
OH
O
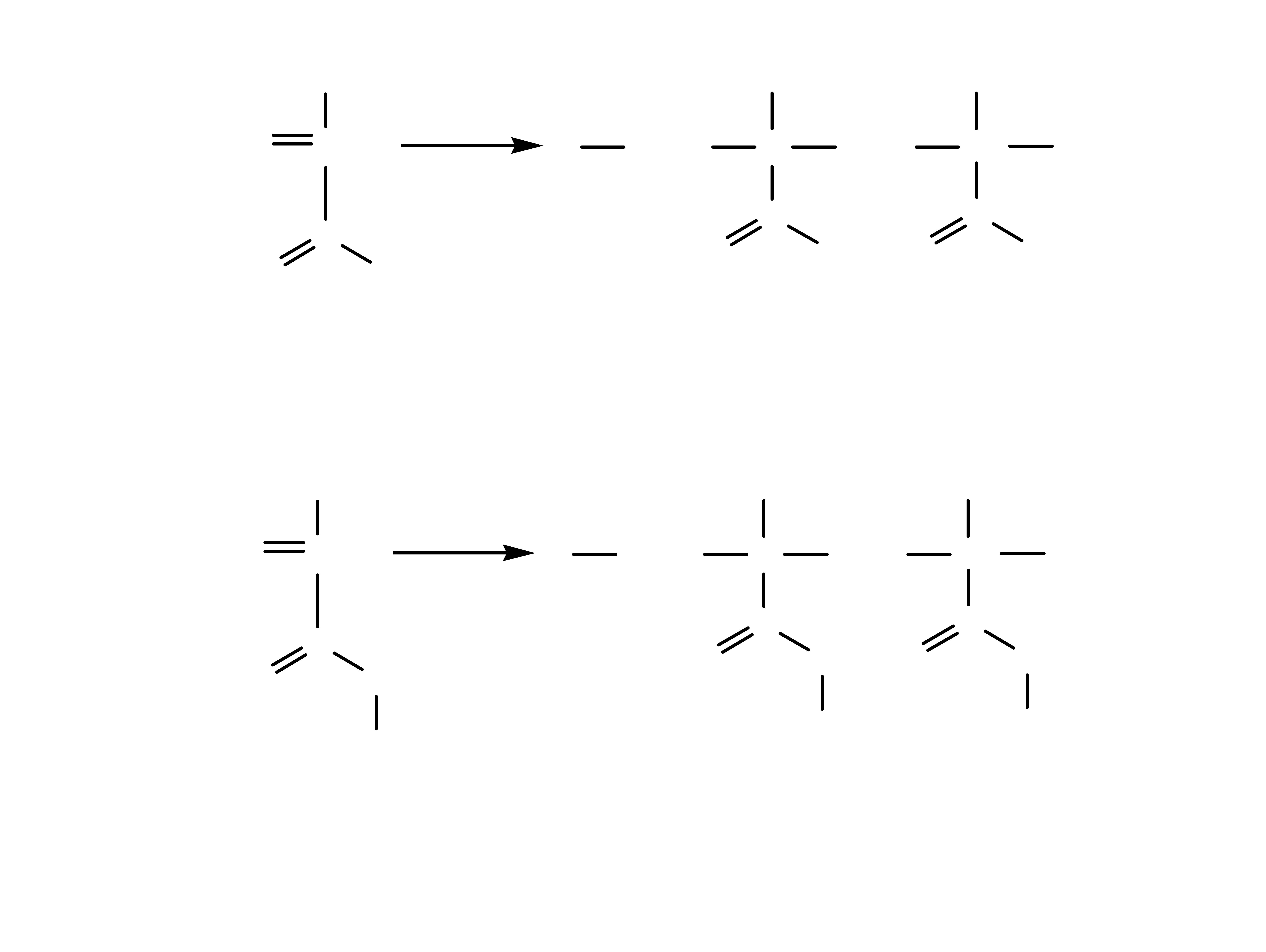
6
H
2
C
C
inicjator
C
(CH
2
C CH
2
C)n
C
C
kwas metakrylowy kwas polimetakrylowy
OH
O
OH
O
OH
O
CH
3
CH
3
CH
3
H
2
C
C
inicjator
C
(CH
2
C CH
2
C)n
C
C
metakrylan metylu polimetakrylan metylu
O
O
O
O
O
O
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
(akryl)
7
8

9
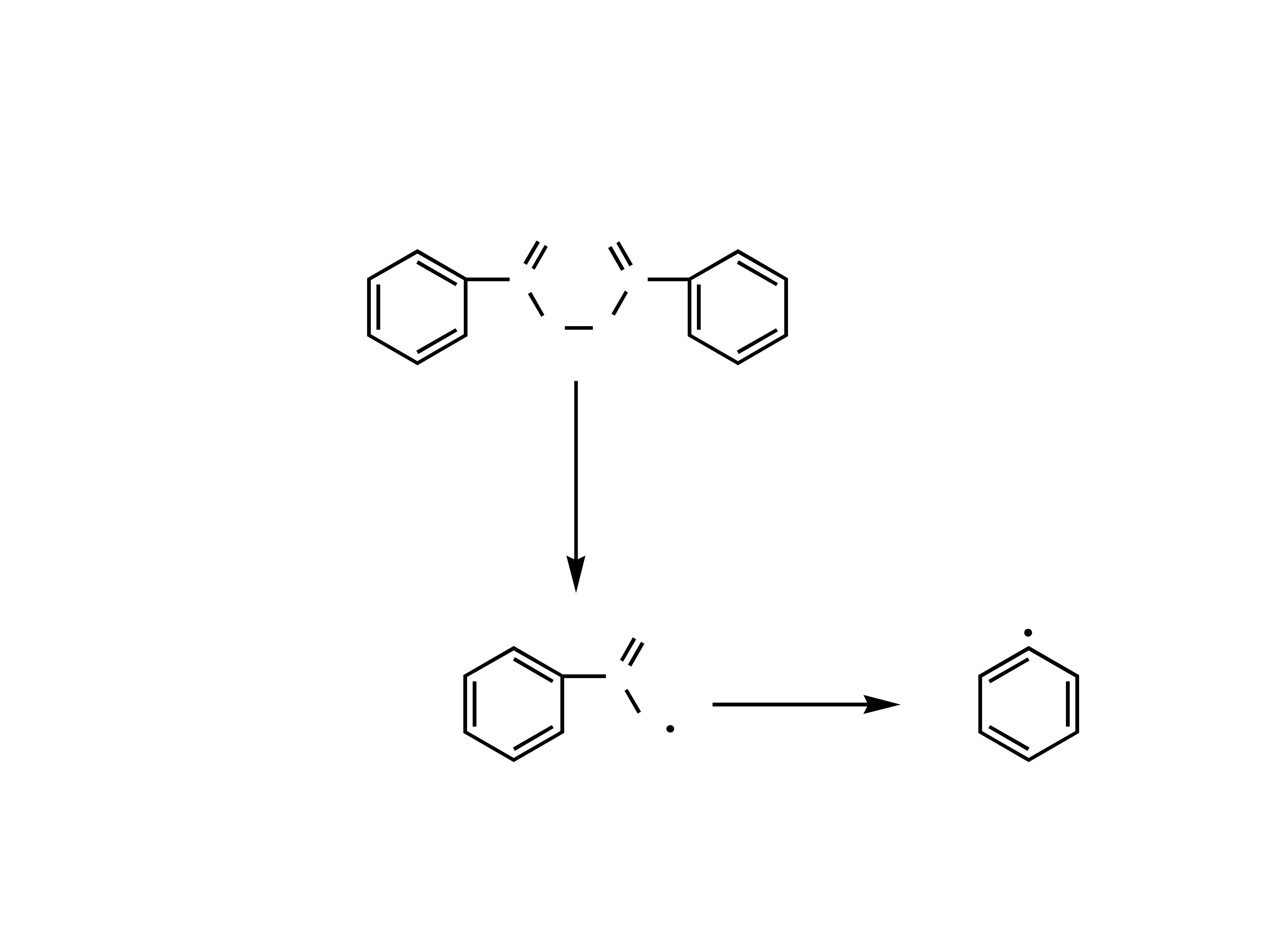
Mechanizmy polimeryzacji
Addycja wolnorodnikowa
Jest to reakcja typowa dla pochodnych winylowych
i przebiega etapowo:
- wytworzenie inicjatora i inicjacja
- propagacja
- terminacja
Inicjatorami reakcji polimeryzacji związków
winylowych są wolne rodniki czyli jony lub
cząsteczki obojętne posia-dające niesparowane
elektrony.
10
Wytworzenie inicjatora w wyniku rozkładu nadtlenków
np. nadtlenku benzoilu.
C
O
O O
C
O
ogrzewanie
prom. UV
prom.
œwiat³o widzialne
niektóre aminy
C
O
O
2
2
- 2CO
2
rodnik rodnik
benzoiloksylowy fenylowy
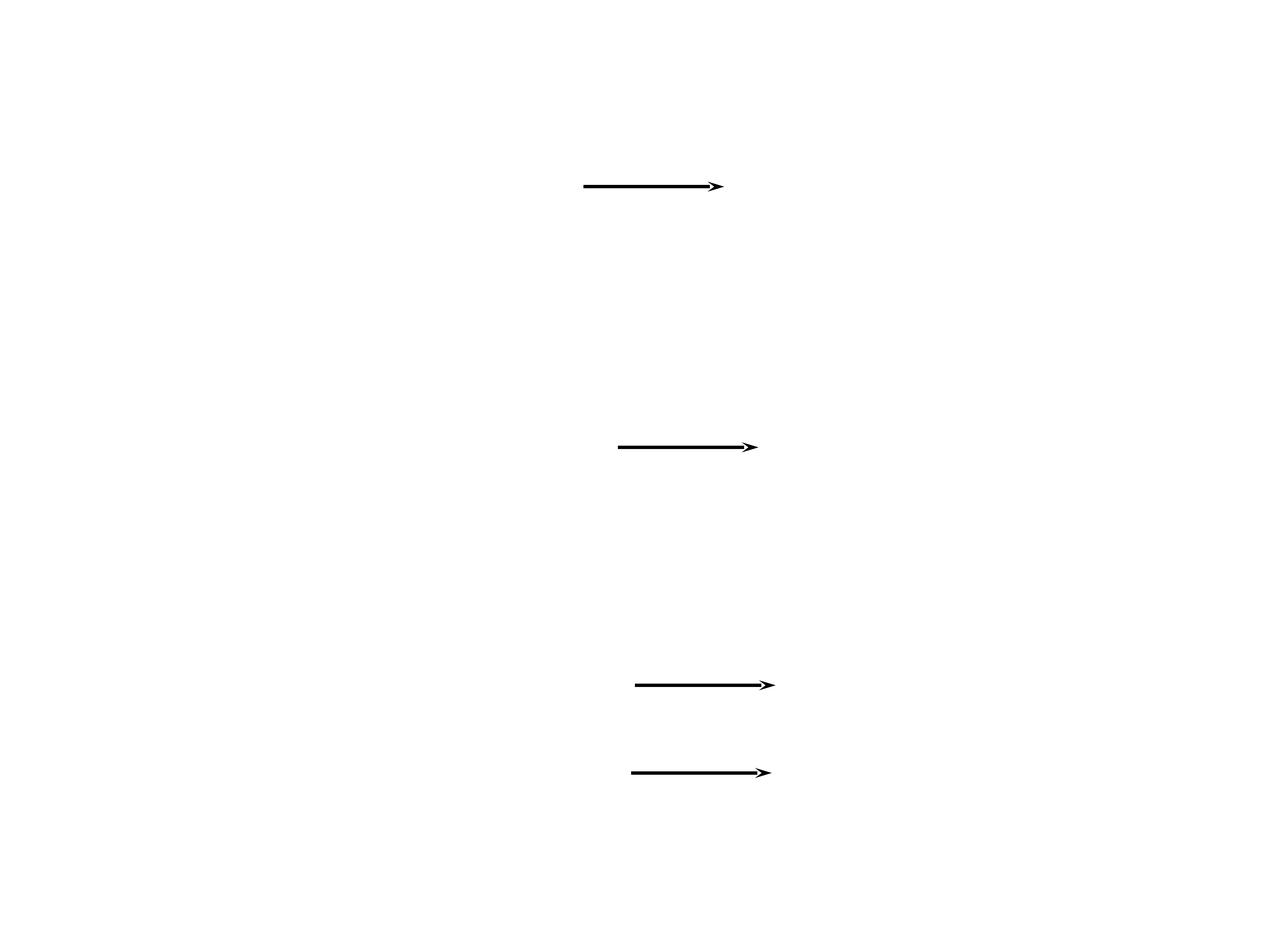
11
Etap inicjacji
R• + M R
– M•
Etap propagacji
(wydłużania)
R – M• + M R –
M – M•
Etap terminacji
R – (M)
n
– M• + R• R –
(M)
n+1
– R
R • + R• R –– R

12
WŁAŚCIWOŚCI FIZYCZNE POLIMERÓW
W oparciu o właściwości fizyczne polimery tworzą
4 klasy związków:
– elastomery
– polimery twarde amorficzne
– polimery twarde krystaliczne np. polietylen
– włókna np. nylon
W technice dentystycznej stosowane są
elastomery oraz polimery twarde amorficzne.

13
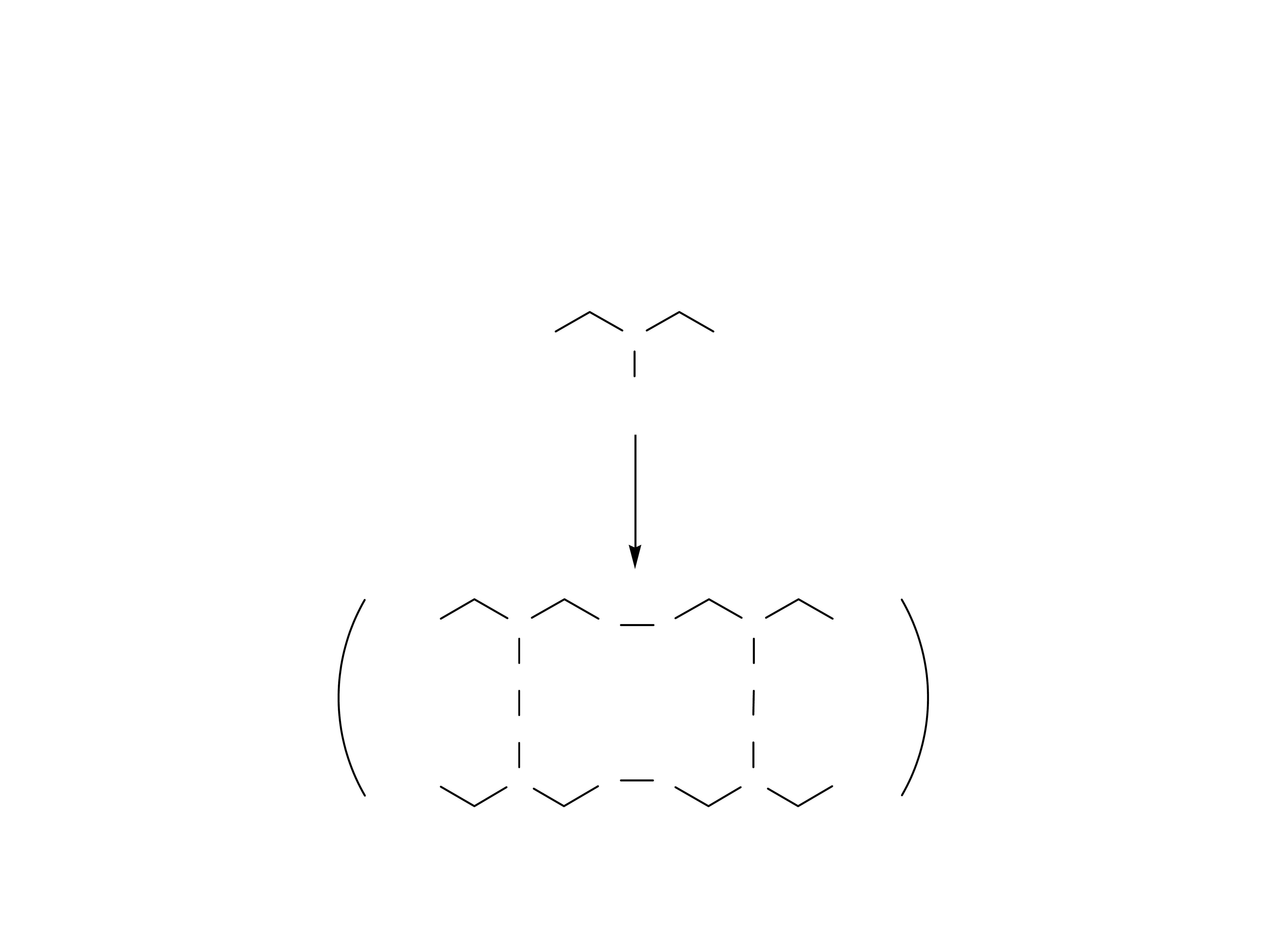
ELASTOMERY są elastycznymi, sprężystymi
polimera-mi. Pod wpływem ściskania lub
rozciągania ulegają odkształceniu, które znika po
ustąpieniu działającej siły.
Elastomery zbudowane są z długich, pozwijanych
łań-cuchów. Często są one ze sobą połączone
wiązaniami sieciującymi (krzyżowymi).

14
Elastyczność elastomerów zależy od temperatury.
W temp. pokojowej zachowują zdolność do
odwracalnej deformacji. W temperaturach niskich
dochodzi do tzw. zeszklenia czyli stwardnienia.
Elastomery scharaktery-zowane są temperaturą
zeszklenia T
G
. Poniżej T
G
elasto-mery są twarde i
zbite przypominając szkła organiczne.
Elastomery można zmiękczać dodając do nich
substan-cje zmiękczające czyli plastyfikatory.
Powodują one obniżenie TG.
15
utleniacz, zwykle PbO
2
HS
R
SH
SH
HS
R
S
S
S
R
HS
S
R
SH
S
S
S
R
SH
S
n
monomer
polisulfid
Elastomery o znaczeniu stomatologicznym.
Polisulfidy (zwane także masami kauczukowymi,
masami merkaptanowymi lub tiokolowymi).
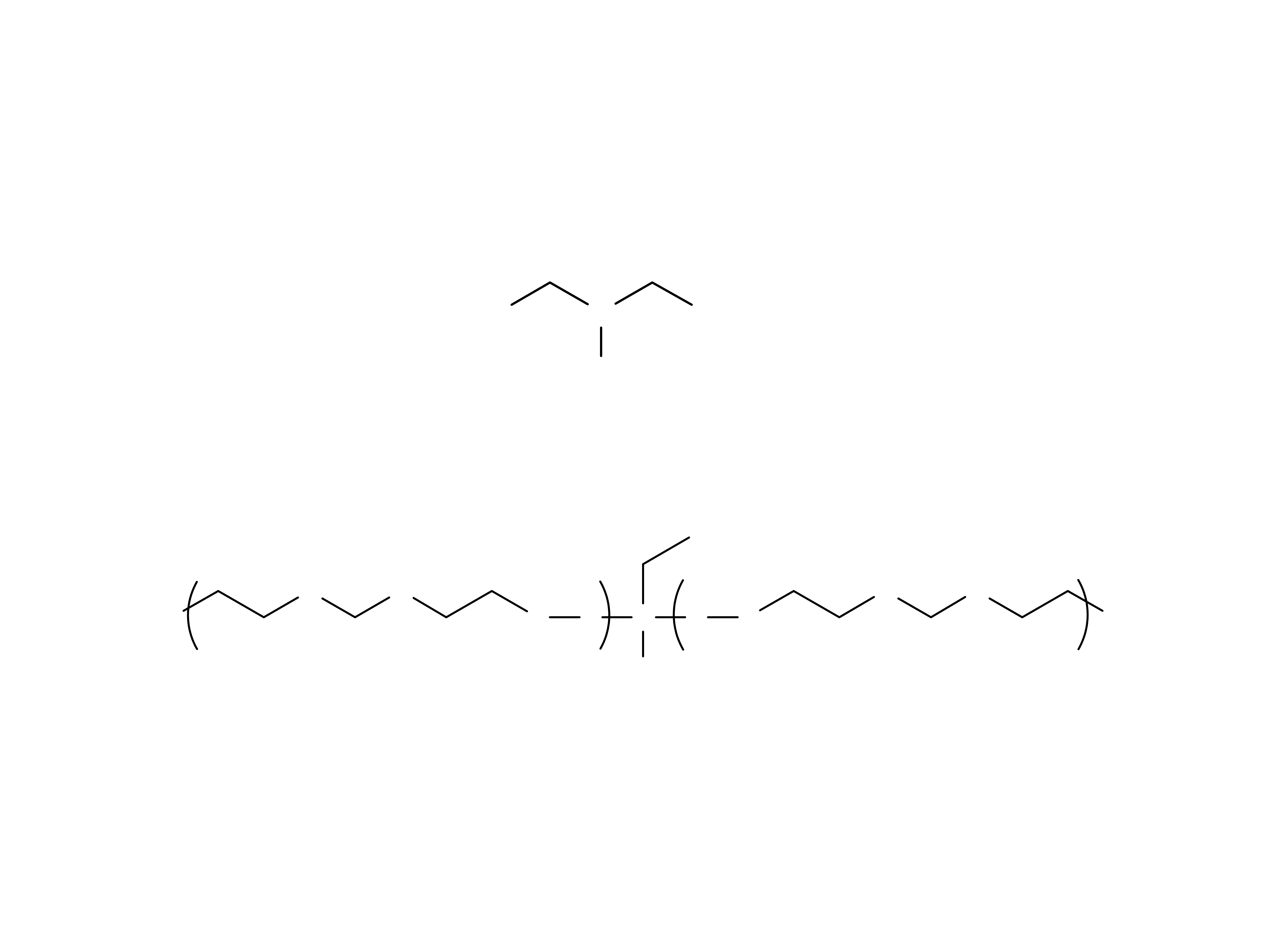
16
HS
O
O
S
S
C
SH
S
S
O
O
SH
n
n
pe³na struktura
HS
R
SH
SH
struktura uproszczona
Struktura monomeru polisulfidów
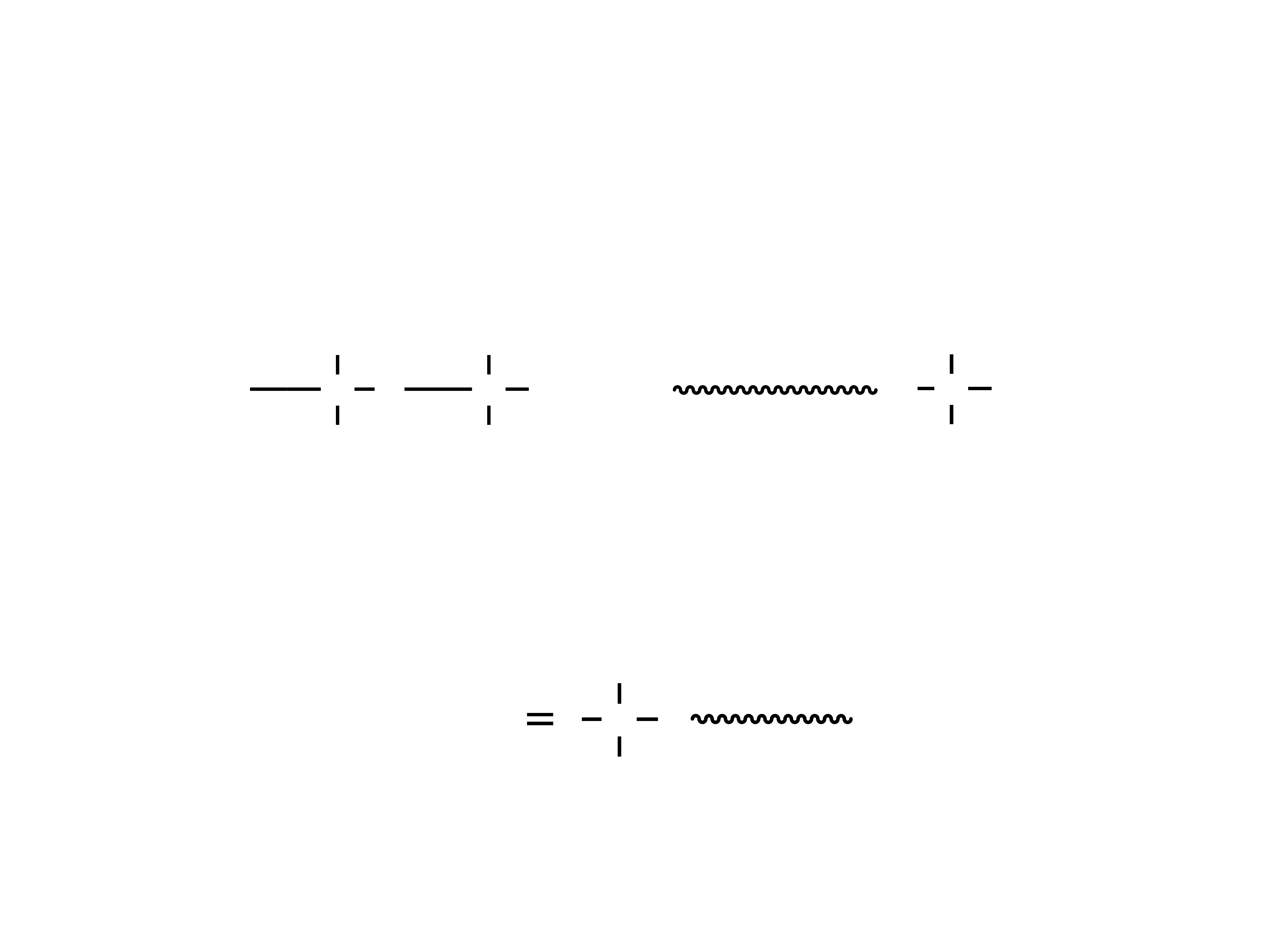
17
Masy (kauczuki) silikonowe
Materiały silikonowe otrzymywane są w reakcji
polimerów silikonowych ze związkami
silanowinylowymi.
Si
CH
3
CH
3
O
H
3
C
( )
Si
CH
3
H
CH
3
n
O Si H
CH
3
CH
3
wzory ogólne polimerów silikonowych
H
2
C C
H
Si O
CH
3
CH
3
zwi¹zek silanowinylowy
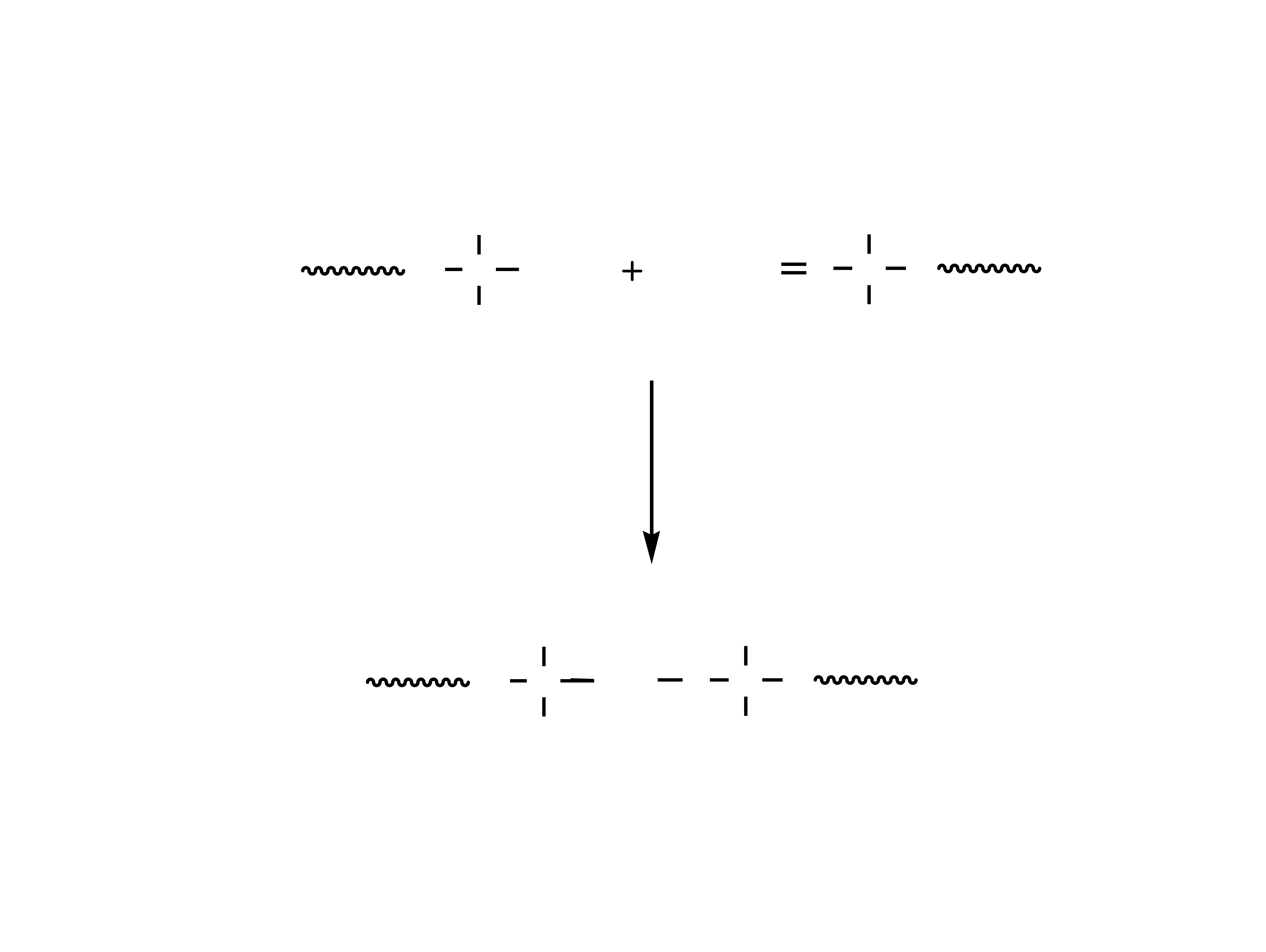
18
O Si H
CH
3
CH
3
H
2
C C
H
Si O
CH
3
CH
3
H
2
PtCl
6
O Si
CH
3
CH
3
H
2
C C
H
2
Si O
CH
3
CH
3
kauczuk silikonowy
Otrzymywanie kauczuku silikonowego
19
C C
H
2
C
H
3
C
CH
2
H
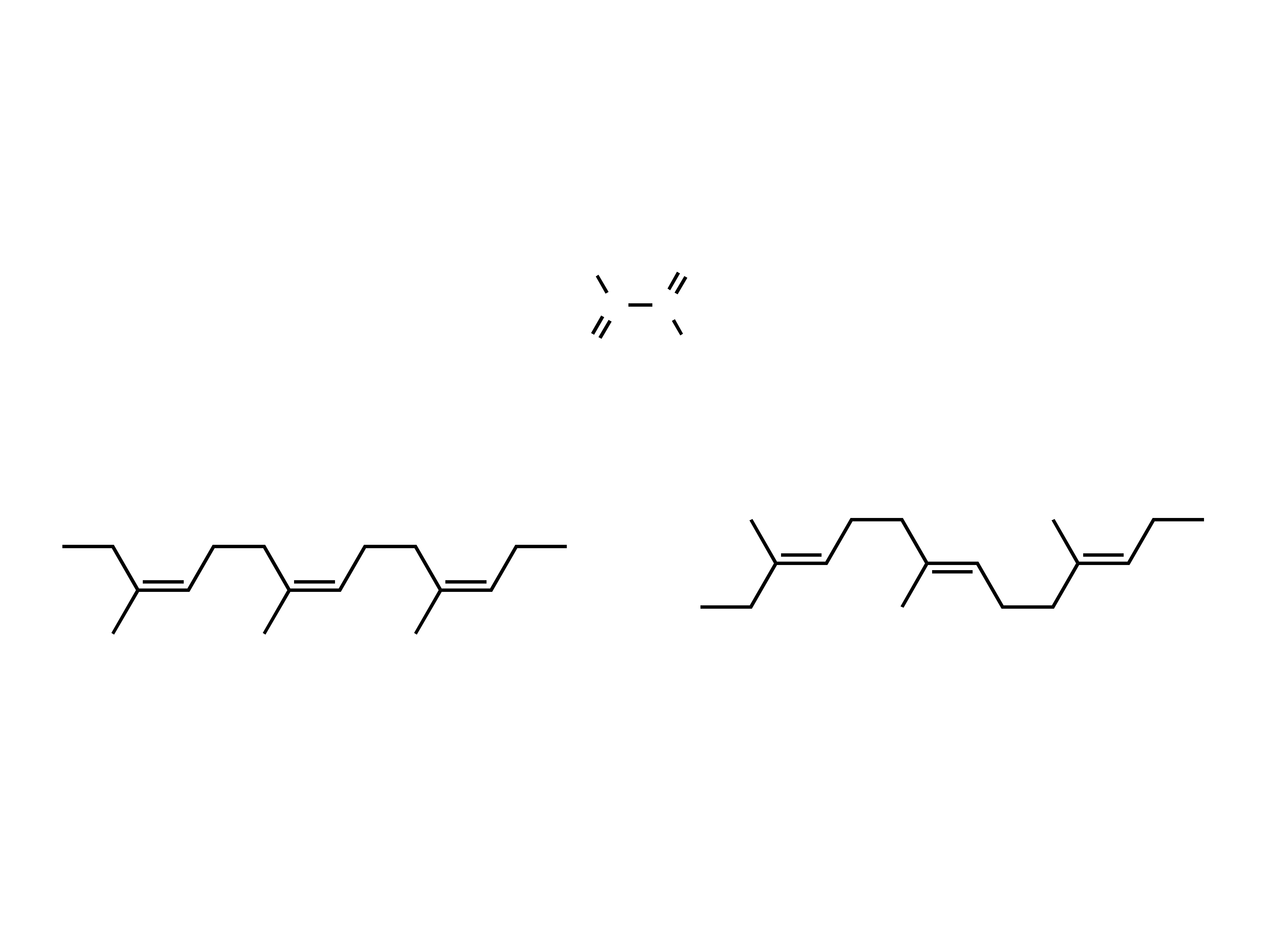
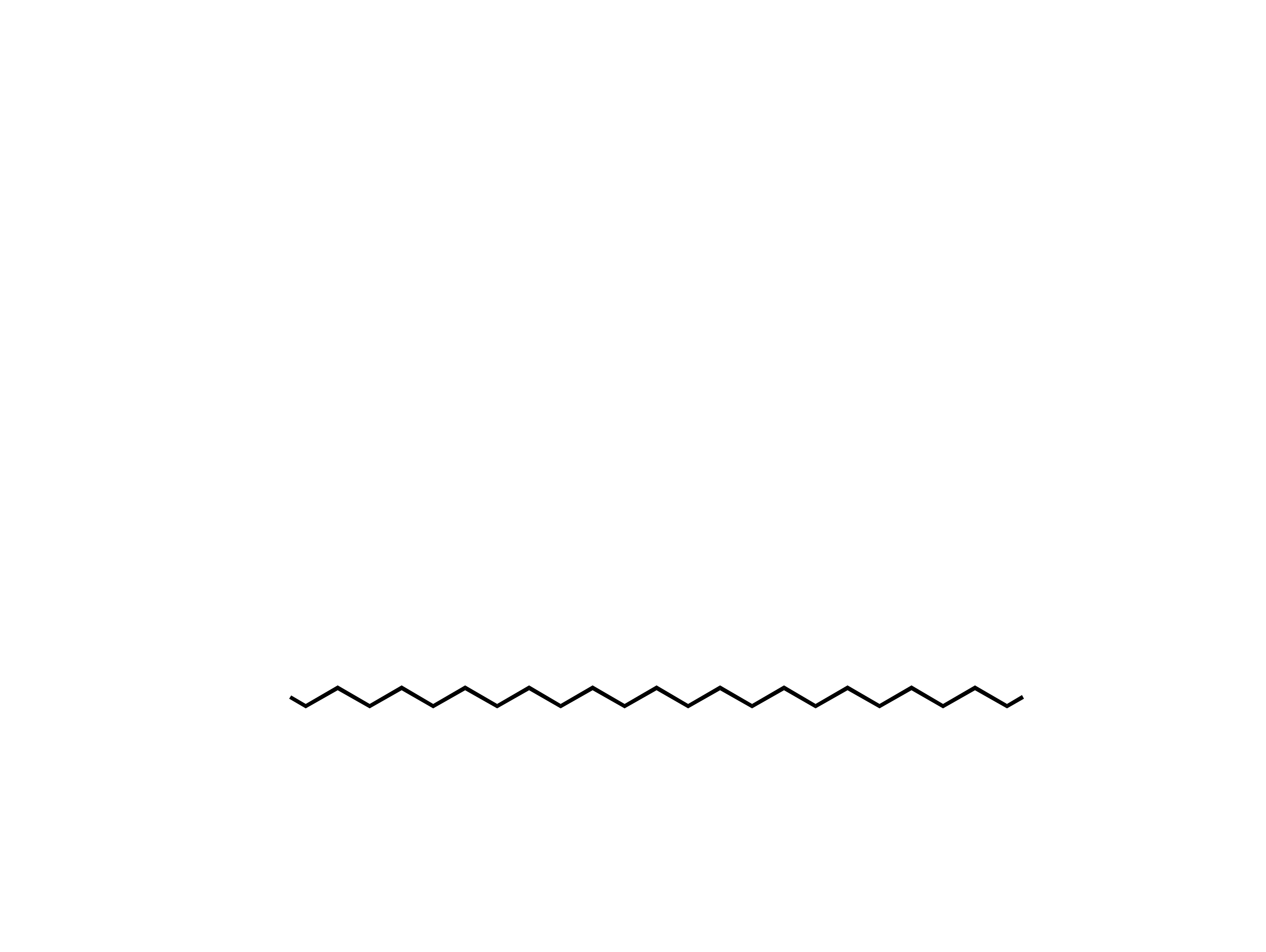
izopren
kauczuk (izomer cis)
(
)
n
(
)
n
gutaperka (izomer trans)
Kauczuk i gutaperka
Są to naturalne polimery izoprenu
20
21
WOSKI
Woski są hydrofobowymi substancjami, które w
temperaturze pokojowej mają charakter ciał stałych
o niezbyt dużej twardości.
Do wosków zaliczamy substancje o różnej budowie
chemicznej.
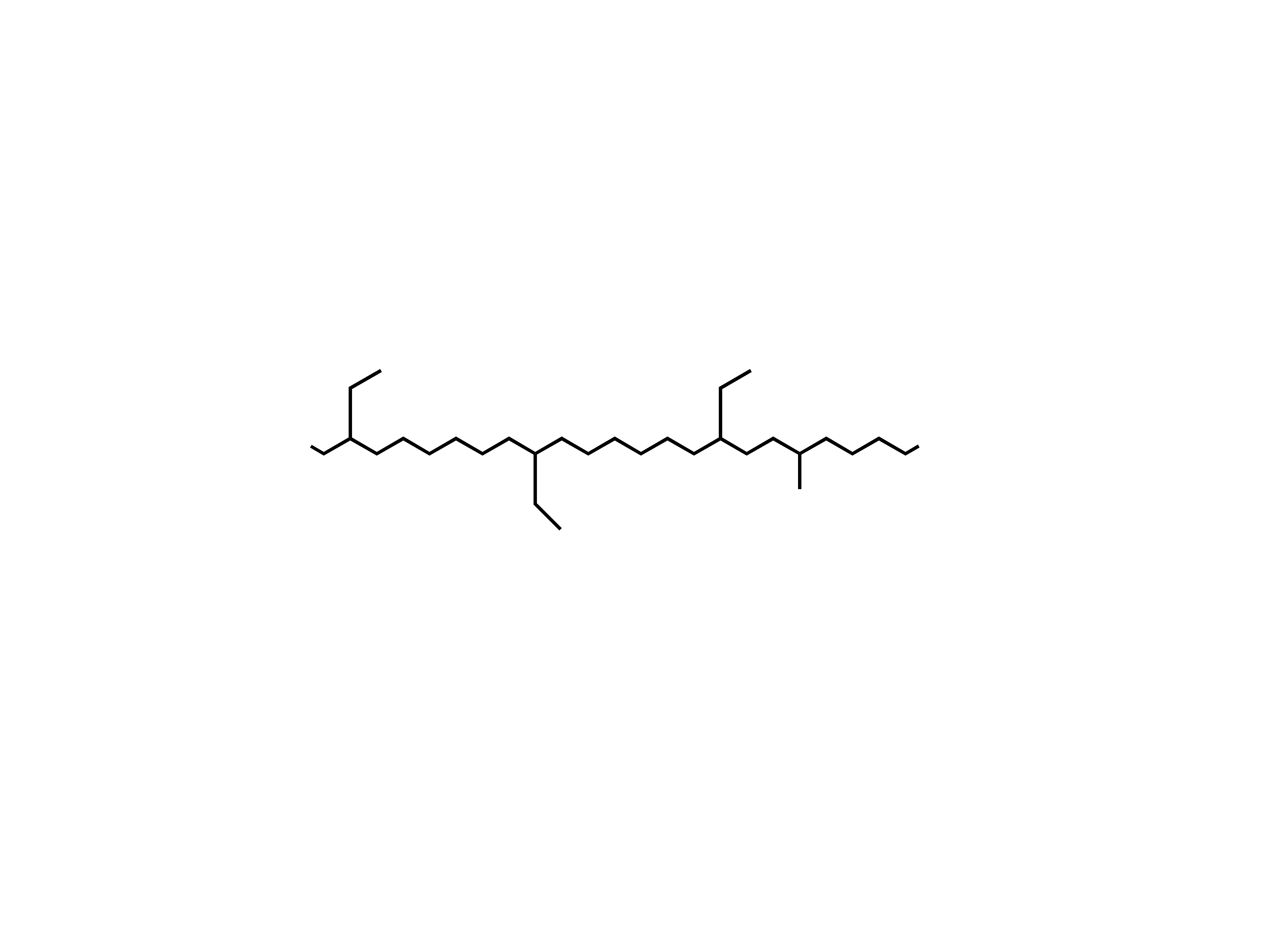
Parafiny – węglowodory nasycone o
nierozgałęzionym szkielecie węglowym.
H
3
C
CH
3
22
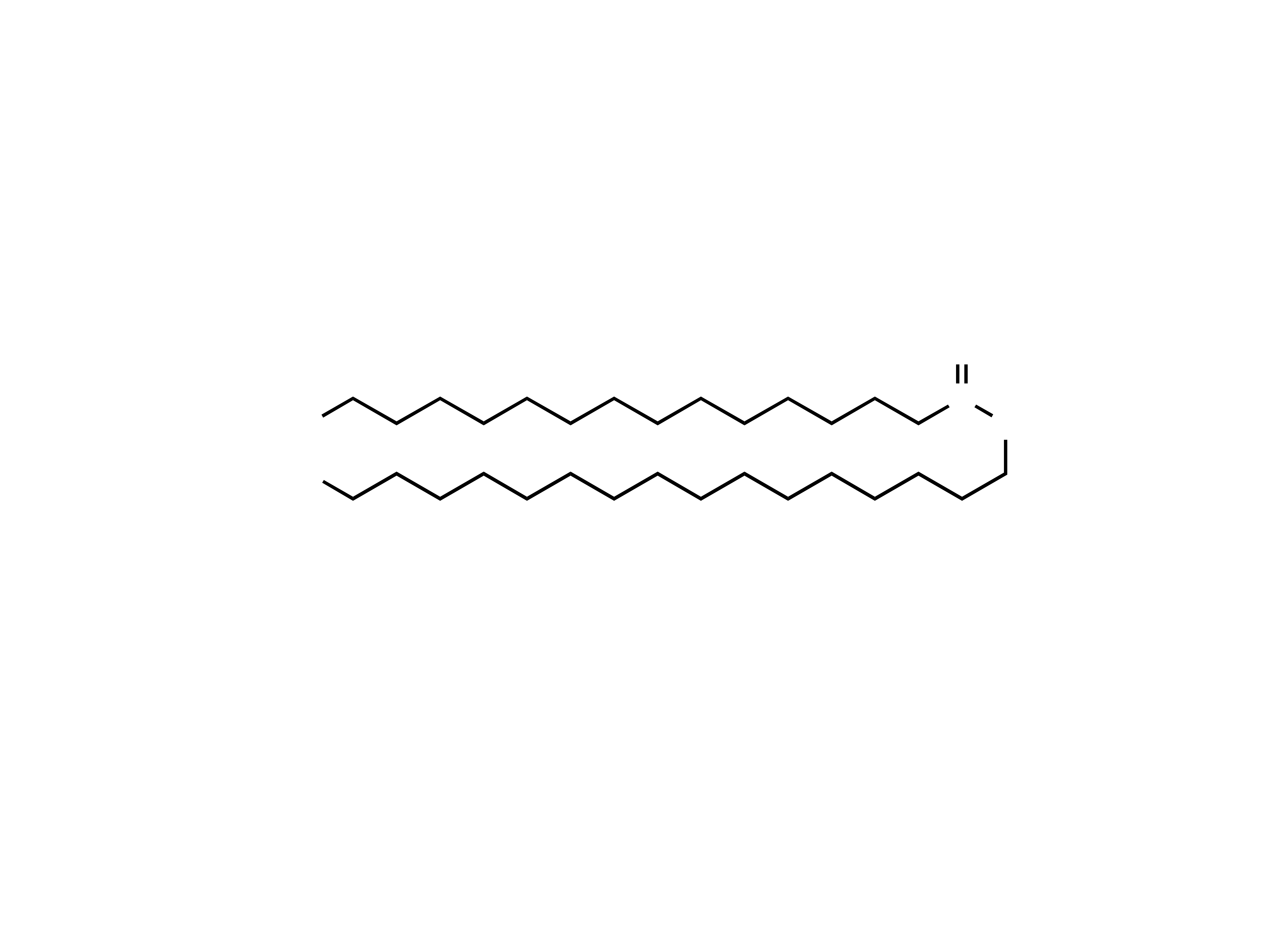
Orokezyty (cerozyny) – węglowodory nasycone z
rozgałę- zionym łańcuchem.
H
3
C
CH
3
CH
3
CH
3
CH
3
CH
3
23
Wosk pszczeli i woski roślinne (np. wosk
karnauba otrzy-mywany z palm), są estrami
długołańcuchowych alkoholi i kwasów tłuszczowych.
H
3
C
C
O
O
H
3
C
W technice dentystycznej używa się wosków
odpowiednio przetworzonych np. zmieszanych z
olejami lub mieszanek parafiny z woskiem pszczelim.
Stosowane są również mieszanki wosków z żywicami i
kauczukiem.
24
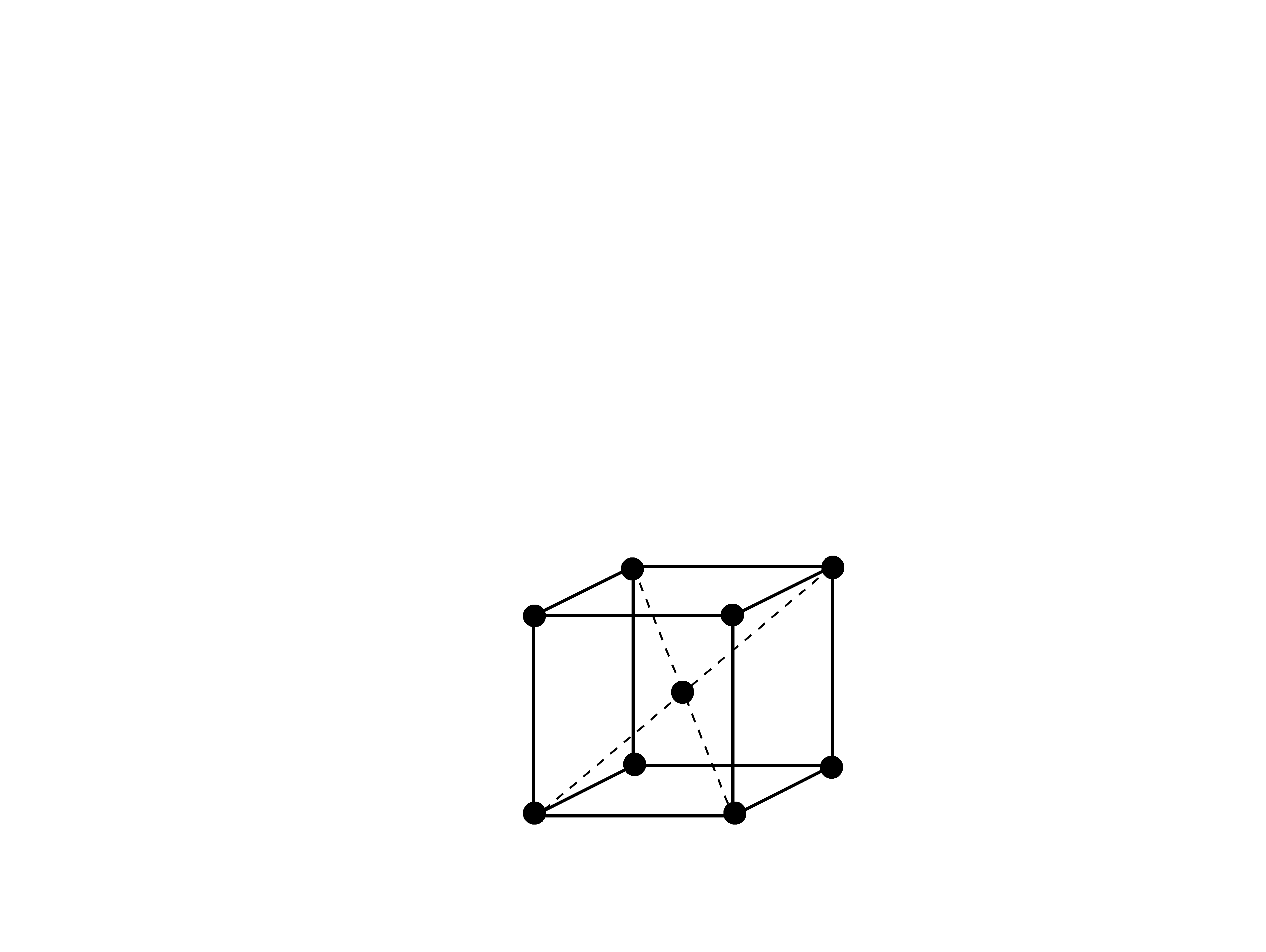
Metale
Atomy metali w stanie stałym tworzą przestrzenną
sieć krystaliczną.
W węzłach sieci umieszczone są jony metalu, a w
przestrzeni wokół węzłów rozmieszczone są
elektrony.
Ten typ ułożenia atomów i ich powiązania przez
elektrony nazywamy wiązaniem metalicznym.
Komórka
elementarna
żelaza
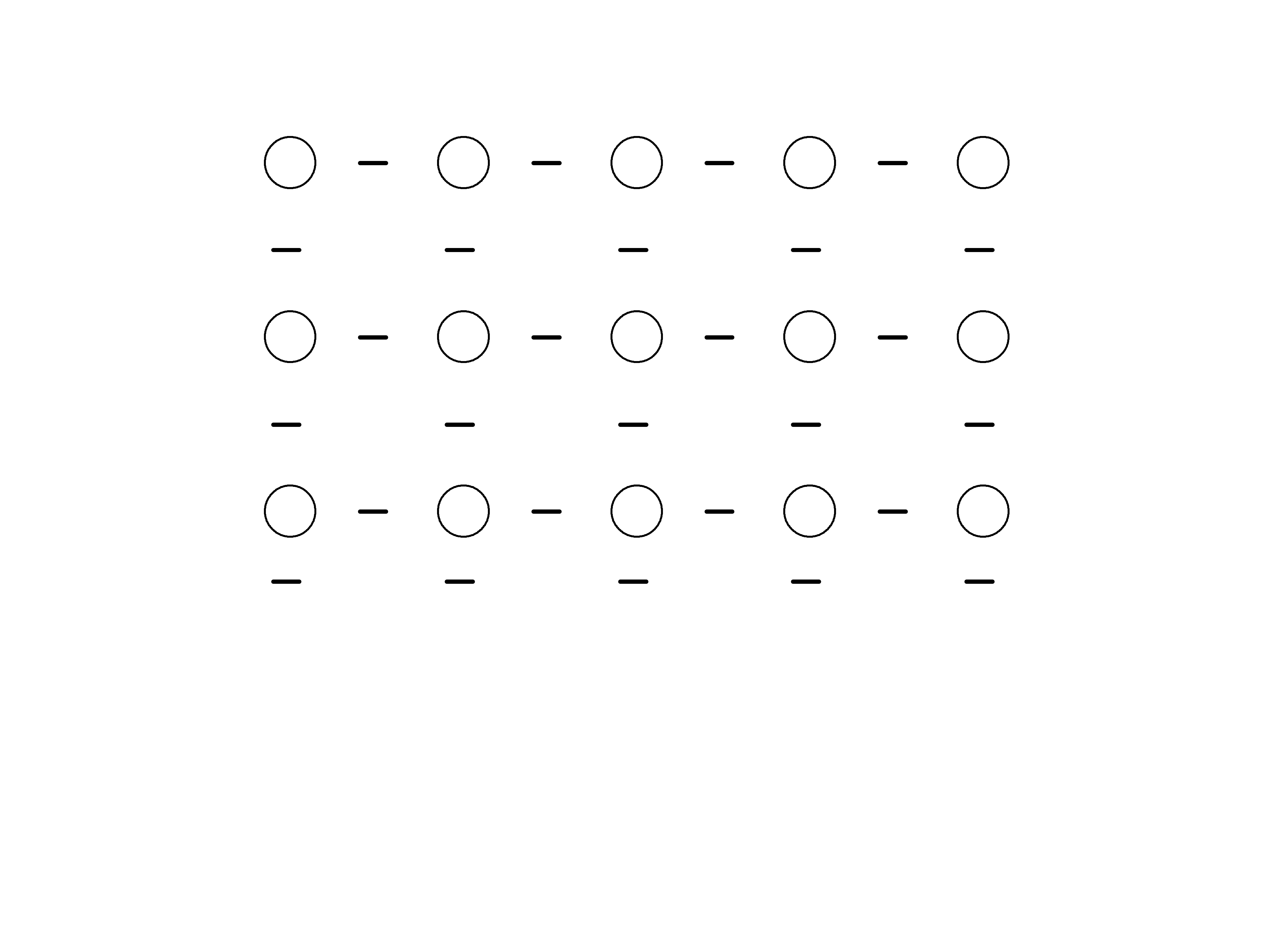
25
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
Wiązanie metaliczne

26
Metale mające zastosowanie w technice
dentystycznej to: złoto, srebro, pallad, platyna,
miedź, cyna, cynk, glin, ind, chrom, nikiel, żelazo,
rtęć, beryl.
Metale w stanie czystym stosowane są bardzo
sporadycznie (złoto, platyna).
Metale są stosowane w formie stopów lub
amalgamatów. Wynika to z faktu, że bardzo często
stop składający się np. z dwóch metali ma
korzystniejsze właściwości niż każdy ze składników
osobno.
W skład stopów mogą również wchodzić niemetale,
np. węgiel w stali.

27
Stopy są roztworami o charakterze ciał stałych.
Otrzymywane są w wysokich temperaturach w
których metale składowe przechodzą w stan ciekły.
Stopy można też otrzymać poprzez ucieranie
sproszkowa-nych metali lecz mają wówczas słabsze
właściwości mecha-niczne, gdyż składniki nie są
powiązane wiązaniem meta-licznym lecz
oddziaływaniami międzycząsteczkowymi.

28
AMALGAMATY
Amalgamaty są stopami rtęci i innych metali. Poza
rtęcią do otrzymywania amalgamatów używa się
takich metali jak:
– srebro
– miedź
– cyna
– cynk
Amalgamaty są często używane do wypełnień. W
technice dentystycznej są stosowane do
wytwarzania twardych mikromodeli.

29
GIPS
Materiały, których głównym składnikiem jest gips,
stoso-wane są do wytwarzania nieelastycznych mas
wycisko-wych oraz modeli uzębienia.
Gips jest uwodnionym siarczanem wapnia.
Siarczan wapnia może być uwodniony w różnym
stopniu. Ten, który występuje w gipsach
dentystycznych nazywany jest zwyczajowo
siarczanem półwodnym ze względu na stosunek
molowy wody do siarczanu wynoszący ½. Półwodny
siarczan wapnia znajduje się także w gipsie
sztukatorskim stosowanym w rzemiośle
artystycznym.
2CaSO
4
•H
2
O

30
Gipsy dentystyczny składa się z kalcynowanego
(otrzymy-wanego przez prażenie w 120°C minerału
CaSO
4
•2H
2
O, zwanego siarczanem dwuwodnym) i
dodatków kontrolujących szybkość twardnienia.
Gipsy wyciskowe zawierają dodatkowo siarczan
potasu, boraks i barwniki.
Gipsy modelowe zawierają dodatki wpływające
czas twardnienia i barwniki.

31
Proces twardnienia gipsu
Podstawą twardnienia gipsu jest prosta reakcja
przekształ-cenia siarczanu półwodnego w
dwuwodny.
2CaSO
4
•H
2
O + 3H
2
O CaSO
4
•2H
2
O
Po zmieszaniu gipsu z wodą powstaje zawiesina.
Część cząsteczek CaSO
4
dysocjuje na jony Ca
2+
i
SO
4
2–
.
Ponieważ powstający siarczan dwuwodny jest
bardzo słabo rozpuszczalny ulega wytraceniu i
krystalizacji, co jest powodem twardnienia
półpłynnej zawiesiny.

32
Początkowo w wyniku twardnienia powstaje
sztywna masa o małej twardości. Jest to tzw.
wiązanie wstępne). Dalsza hydratacja cząsteczek
siarczanu wapnia prowadzi do tzw. ostatecznego
związania gdzie masa uzyskuje dużą twardość i
wytrzymałość mechaniczną.
Czas ostatecznego związania zależy od dodatków
obecnych w gipsie i w temp. 25°C wynosi dla
twardego gipsu dentystycznego około 75 min.

33
CHEMICZNE WYBIELANIE ZĘBÓW
Przyczyny ogólne przebarwień zebów:
- choroba hemolityczna,
- żółtaczka noworodkowa,
- choroby przewodów żółciowych
- alkaptonuria,
- fluoroza,
- porfiria wrodzona,
- zatrucia metalami,
- przyjmowanie niektórych leków.
Przyczyny miejscowe przebarwień:
- urazy mechaniczne,
- rozpad zgorzelinowy miazgi,
- resorpcja fizjologiczna lub patologicznakorzeni

34
Przyczyny pochodzenia zewnętrznego:
- zaleganie barwników w płytce bakteryjnej lub
osłonce
nabytej,
- zmiany chemiczne składników płytki lub osłonki
nabytej,
- występowanie w płytce bakterii chromogennych,
-próchnica.
Klasyfikacja przebarwień w oparciu o
stosowane do wybielenia zębów zabiegi
lecznicze:
Przebarwienia N-1, możliwe do usunięcia za
pomocą zabiegów higienicznych.
Przebarwienia N-2, usuwane za pomocą
profesjonalnego czyszczenia.
Przebarwienia N-3, usuwane za pomocą
chemicznego wybielania.

35
Wybielanie chemiczne
Wybielanie chemiczne polega na utlenieniu
barwników związanych z zębiną, szkliwem lub
osłonką nabytą zębów.
Środki utleniające reagują z barwnikami przede
wszystkim atakując wiązania podwójne
węglowodorów nienasyconych i aromatycznych.
Prowadzi to do powstania nadtlenków, bezbarwnych
alkoholi i dalszej degradacji do niskocząsteczkowych
aldehydów i alkoholi.
Długotrwałe działanie czynników utleniających może
doprowadzić do całkowitego utlenienia barwnych
związków organicznych do H
2
O i CO
2
.
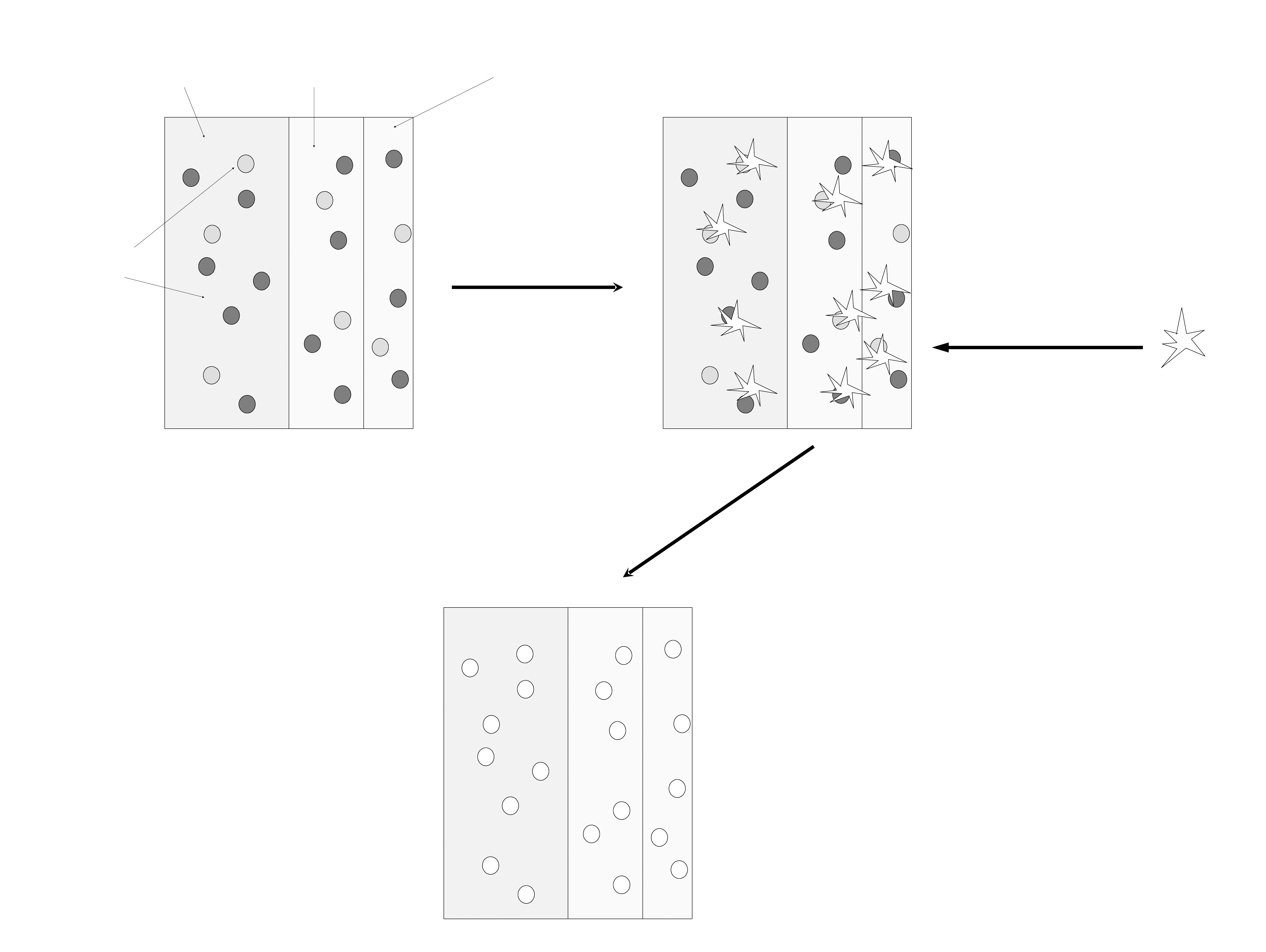
36
Zębina szkliwo osłonka
nabyta
barwniki
Czynnik utleniający
dyfunduje do
osłonki, szkliwa i
zębiny.
Powstają związki
bezbarwne

37
Podstawowym utleniaczem stosowanym do
wybielania zębów jest nadtlenek mocznika.
Jest to równomolowa mieszanina mocznika i
nadtlenku wodoru.
C
O
H
2
N
H
2
N
O
O
H
H
nadtlenek wodoru mocznik
Mocznik pełni rolę stabilizatora, który zapobiega
rozkładowi nadtlenku wodoru.
Do środków wybielających dodaje się także inhibitor
rozkładu nadtlenku wodoru, który zmniejsza szybkość
utleniania i zapobiega uszkodzeniu kolagenu zębiny.
38
2H
2
O
2
2H
2
O + O
2
H
2
O
2
H + HO
2
H
2
O
2
H
2
O + O
1)
2)
3)
H
2
O
2
OH + OH
4)
Fe
3+
Rozpad nadtlenku wodoru
1 – równanie sumaryczne rozpadu na tlen i wodę.
2 – rozpad wolnorodnikowy dominujący w środowisku
alkalicznym.
3 – rozpad wolnorodnikowy dominujący w środowisku
kwaśnym.
4 – rozpad wolnorodnikowy katalizowany przez jony
Fe(III).

39
Najsilniejsze działanie utleniające mają rodniki:
40
R
R
R
R
H
2
O
2
H
2
O
2
R
R
OH
OH
OH
OH
OH
OH
OH
R
C
O
H
R
C
O
OH
H
2
O
2
wybielanie powinno byæ zakoñczone
na tym etapie
CIEMNY ROZJAŒ
NIONY
BEZBARWNY
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
Wykłady chemia cz 7
Wykłady chemia cz 5 korekta
Wykłady chemia cz 6
Wykłady chemia cz 2
Wykład Chemia kwantowa 11
Wykład 9 CHEMIA ORGANICZNA
Mikrobiologia wykład IV cz 1
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
WYKŁAD 1 chemia, Chemia
wykłady WDS cz.5, Geologia, I semestr, Socjologia
wykłady chemia sem 1
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
Wykład III cz II moder kot
WYKŁAD chemia gips
więcej podobnych podstron