
1
Teoria elektrolitów mocnych
Wartość stopnia dysocjacji ( jest podstawą klasyfikacji
elektrolitów. Zgodnie z teorią elektrolitów mocnych
istnieją dwie klasy elektrolitów.
Elektrolity mocne zawsze posiadają = 1
niezależnie
Od ich stężenia i obecności innych elektrolitów.
Elektrolity słabe posiadają
Wartość elektrolitów słabych zależy od stężenia i od
obecności innych elektrolitów.

2
Aktywność molowa
Zauważono, że właściwości stężonych roztworów
niek-
tórych substancji (szczególnie mocnych elektrolitów)
nie
Są wprost proporcjonalne do stężenia molowego.
W ramach teorii elektrolitów mocnych zapropono-
wano pojęcie aktywności molowej , nazywaną także
aktywnością roztworu, które w wielu równaniach
powin-
no zastępować stężenie molowe.
Jednostką aktywności (a) jest mol/dm
3
.
Aktywność molowa jest efektywnym
termodynamicznie
(pozornym) stężeniem roztworu przejawiającym się
w
konkretnych właściwościach fizykochemicznych
roztworu.
3
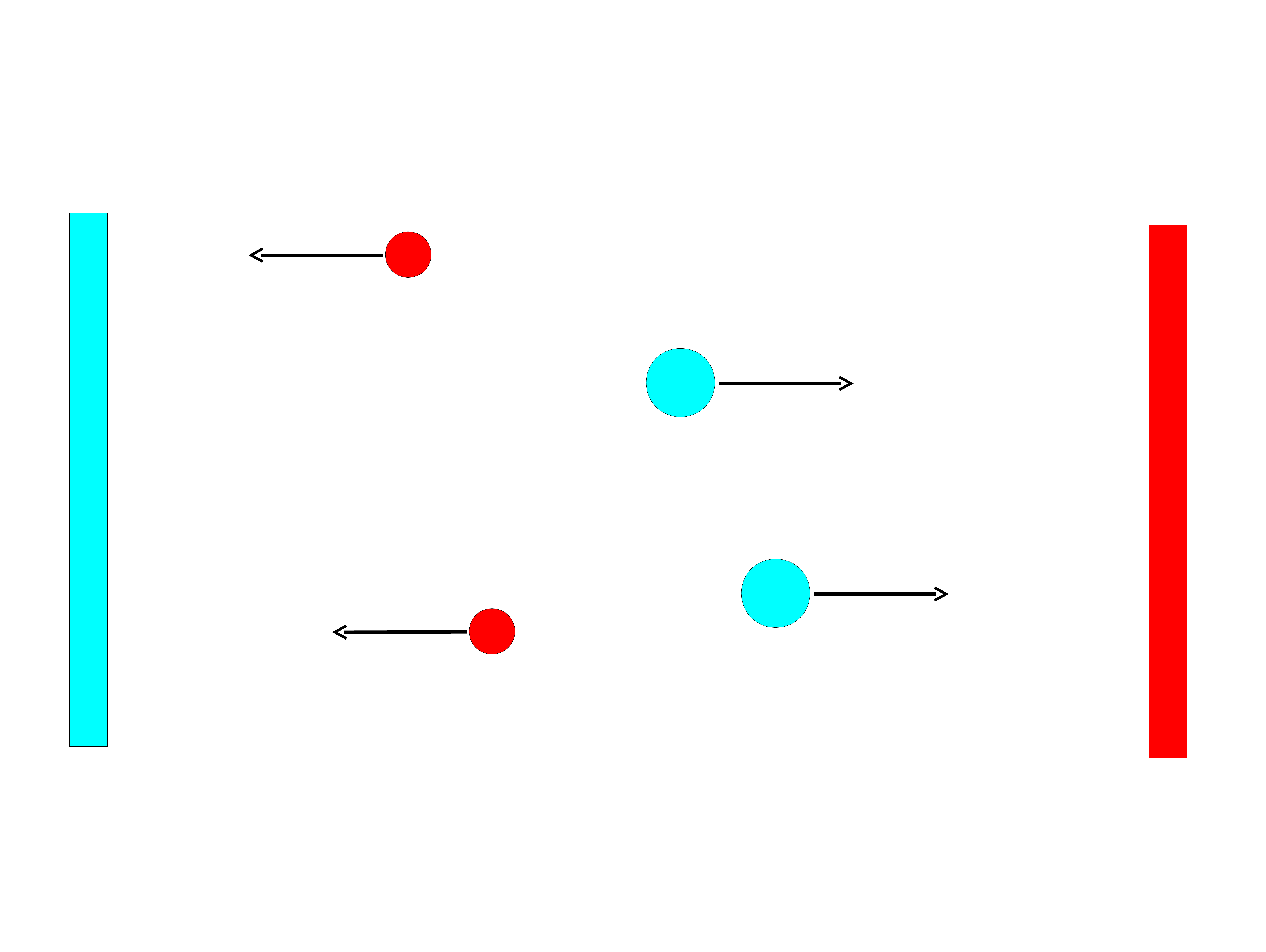
_
+
Pomiar przewodnictwa (niskie stężenie
jonów)
+
_
+
-
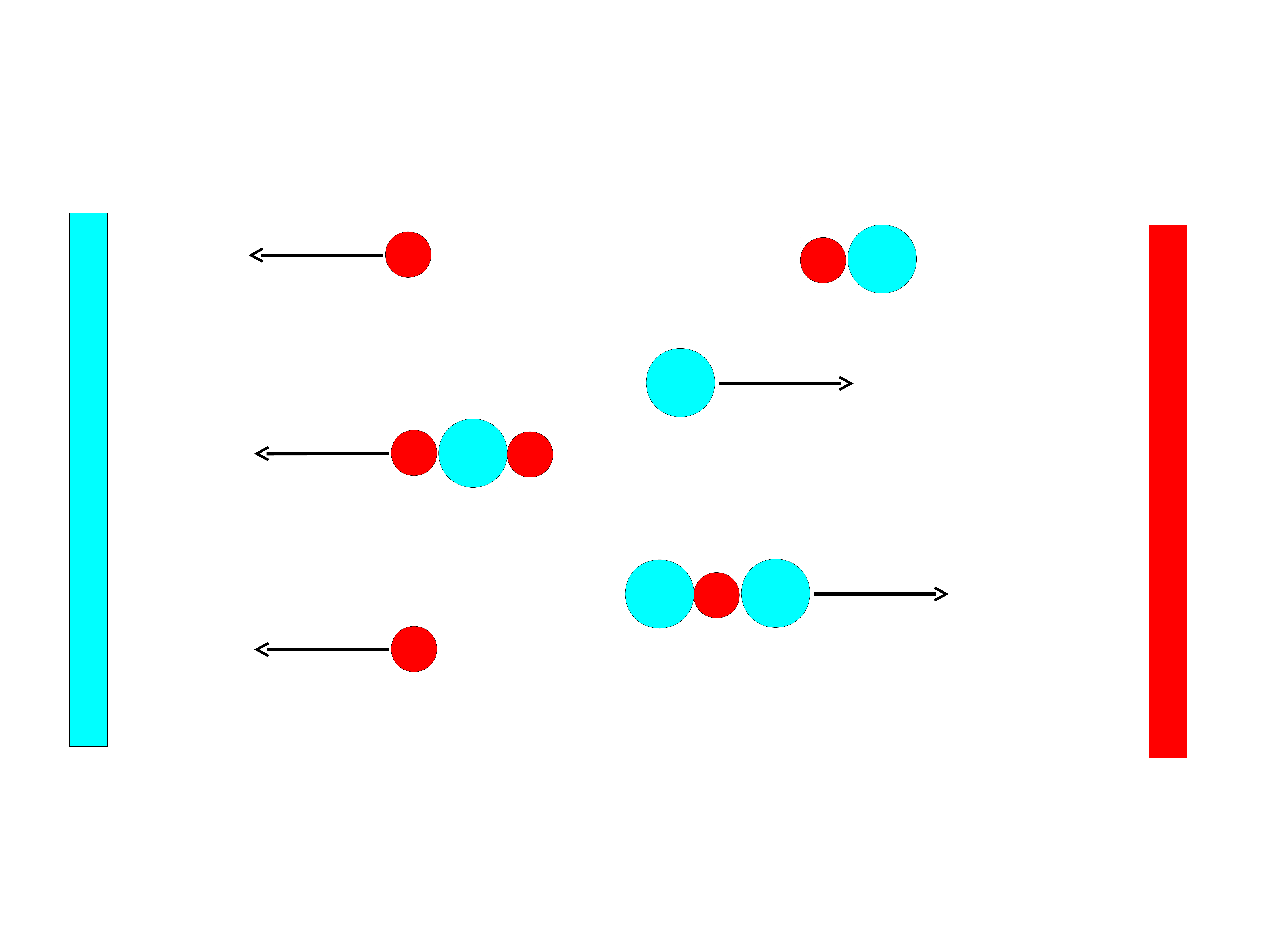
4
_
+
Pomiar przewodnictwa (wysokie stężenie
jonów)
+
_
+
-
+
_
+
+
_
_
+
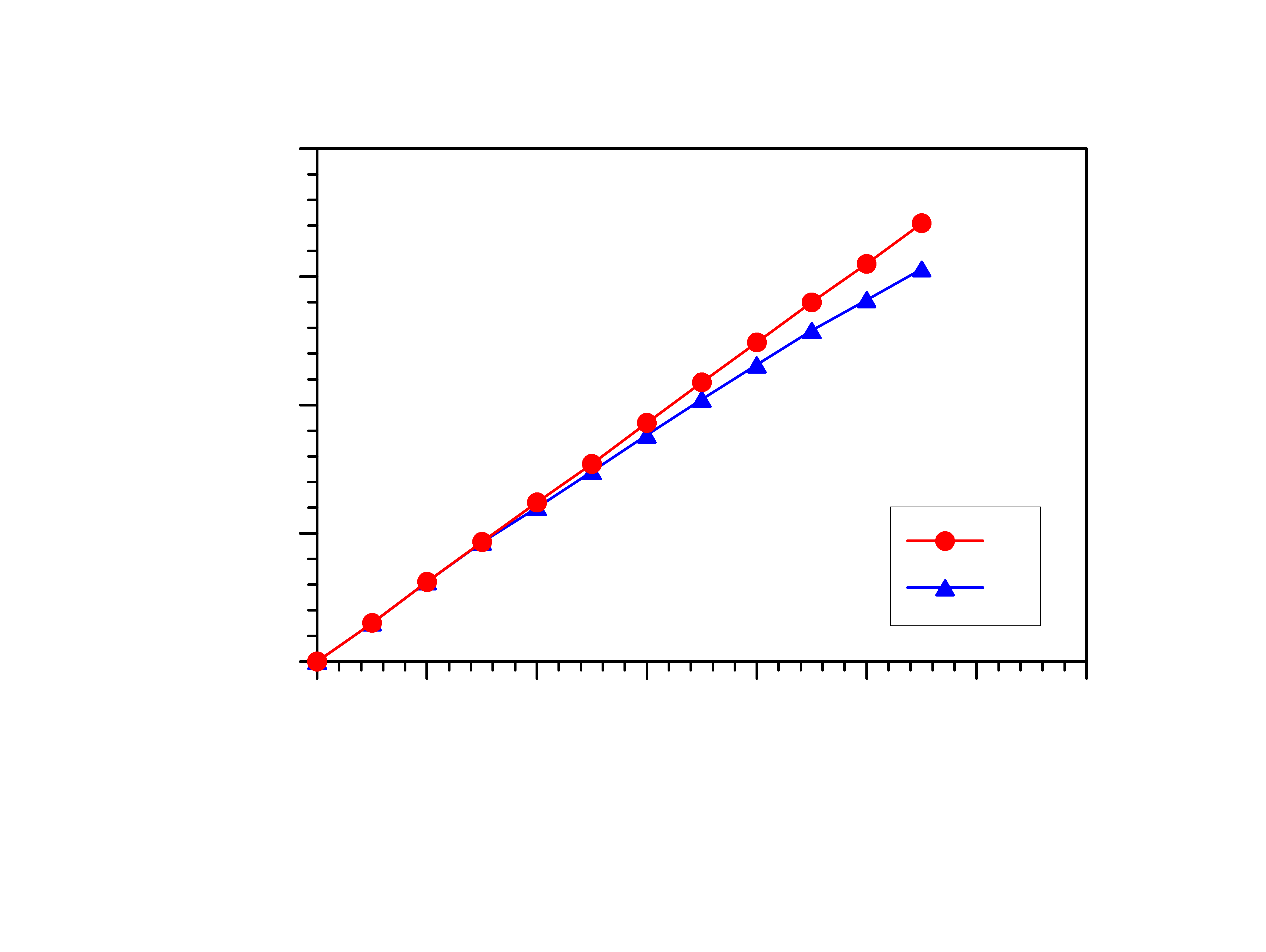
5
0,00
0,05
0,10
0,15
0,20
M
ol
ar
c
on
ce
nt
ra
tio
n
an
d
ac
tiv
ity
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Concentration (g/100g)
C
a

6
Aktywność zależy od stężenia molowego roztworu,
lecz nie jest do niego wprost proporcjonalna
a ~ c
a = f · c
gdzie f jest współczynnikiem aktywności zależnym od
siły oddziaływań między cząsteczkami substancji
rozpuszczonej.
0 ≤ f ≤ 1 czyli 0 ≤ a ≤ c
Aktywność jest równa molowości tylko w roztworach
nieskończenie rozcieńczonych (w praktyce o bardzo
niskim stężeniu), w których f = 1.

7
Wartość f zależy od oddziaływań między jonami.
Im są silniejsze, tym f jest niższy. Wzrost stężenia
jonów obniża współczynnik aktywności.
Absolutna wielkość ładunku jonów również ma
wpływ na współczynnik aktywności f.
Np. jony Ca
2+
wpływają na wartość f w większym
stopniu niż jony Na
+
o tym samym stężeniu.
W wielu wzorach i równaniach chemicznych
zamiast stężenia molowego należy używać
aktywności.

8
Działanie kwasów na szkliwo
Szkliwo ma bardzo niską rozpuszczalność w wodzie
lecz bardzo dobrą rozpuszczalność w kwasach.
Ca
10
(PO
4
)
6
(OH)
2
+ 20H
+
10Ca
2+
+ 6H
3
PO
4
+ 2H
2
O
Reakcja ta jest podstawą kondycjonowania szkliwa
(trawienia) za pomocą roztworów kwasów
(fosforowego lub cytrynowego). Mocne kwasy
rozpuszczają hydroksyapatyt znacznie łatwiej od
słabych kwasów organicznych. Nie mają jednak
zdolności do tzw. selektywnej dekalcyfikacji czyli
wypłukiwania jonów Ca
2+
z powierzchniowej
warstwy szkliwa.

9
Największe znaczenie w technice dentystycznej
ma 30-50% roztwór kwasu fosforowego. Usuwa
on w ciągu 1-2 min powierzchniową warstwę
szkliwa o grubości około 5 µm oraz odwapnia
szkliwo na głębokość 10-120 µm.
Przed trawieniem Po trawieniu

10
Wytrawianie szkliwa kwasami ma na celu:
- usunięcie osadów,
- wytworzenie zagłębień dla lepszego
wnikania i wiązania żywic,
- obniżenie napięcia powierzchniowego
szkliwa w celu łatwiejszego jego zwilżenia,
- zwiększenie powierzchni adhezyjnej.

11
Erozja szkliwa
Erozja szkliwa jest procesem jego destrukcji
zachodzącym
pod wpływem czynników chemicznych takich jak
kwasy i
związki chelatujące.
Związki chelatujące mają zdolność do wiązania
kationów
metali (Ca
2+
, Mg
2+
, Zn
2+
oraz kationy metali
ciężkich).
Głównymi czynnikami powodującymi erozję szkliwa
są
obecne w pożywieniu kwasy organiczne i kwas
fosforowy.
Kwasy te rozpuszczają HAP, a niektóre z nich
wytrącają
lub chelatują jony Ca
2+
.
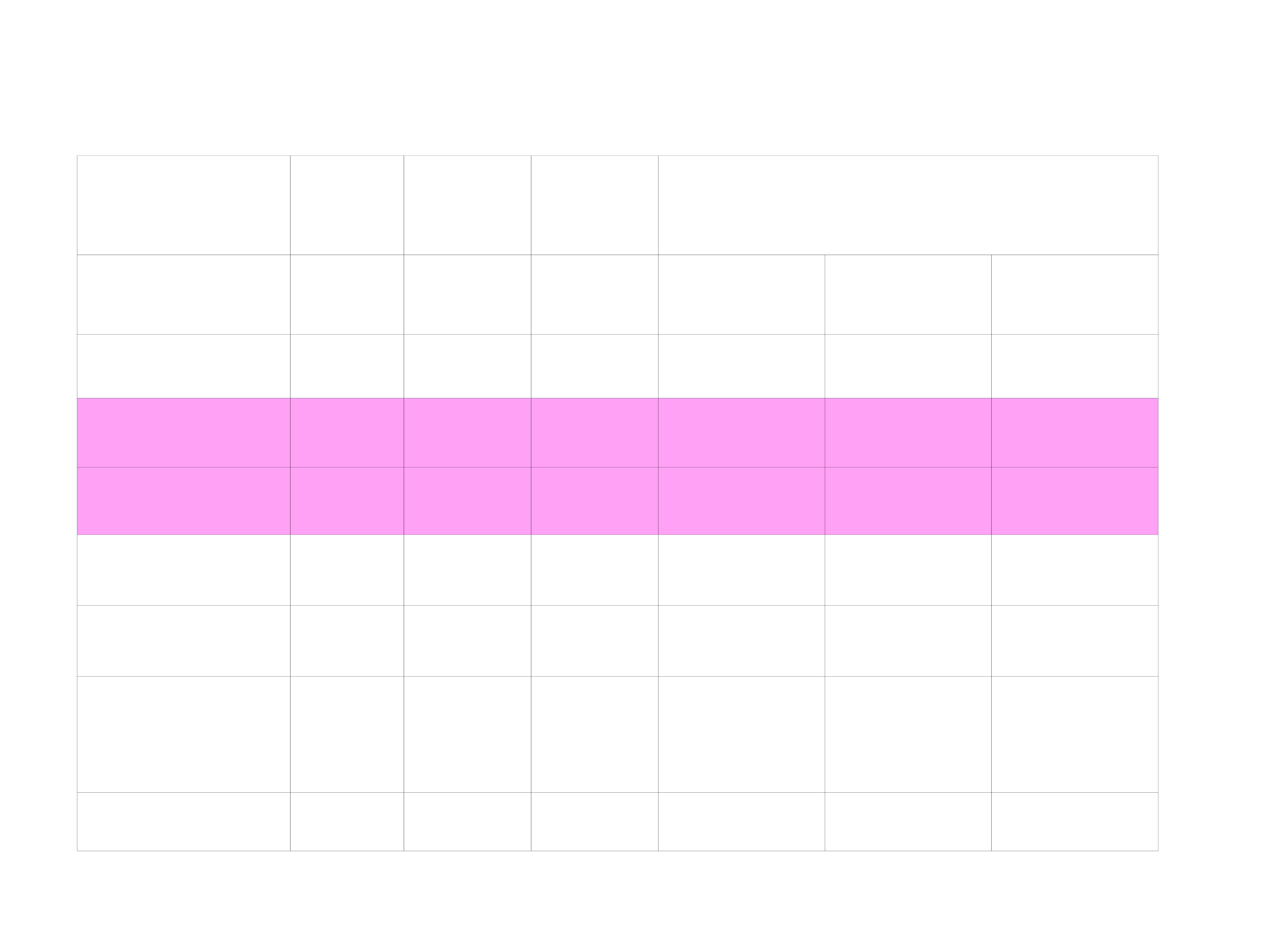
12
Kwas
pK
1
pK
2
pK
3
log stałej wiązania jonów Ca
Octowy
4,7
,2
Mlekowy
3,9
,4
Cytrynowy
3,
4,8
6,4
,
3,
4,7
Fosforowy
2,2
7,
2,2
,4
2,7
6,5
Winowy
3,0
4,4
0,9
2,8
Węglowy
6,5
0,3
3,
Szczawiow
y
,2
4,3
,8
3
EDTA
0,7
Najważniejsze kwasy powodujące erozję szkliwa
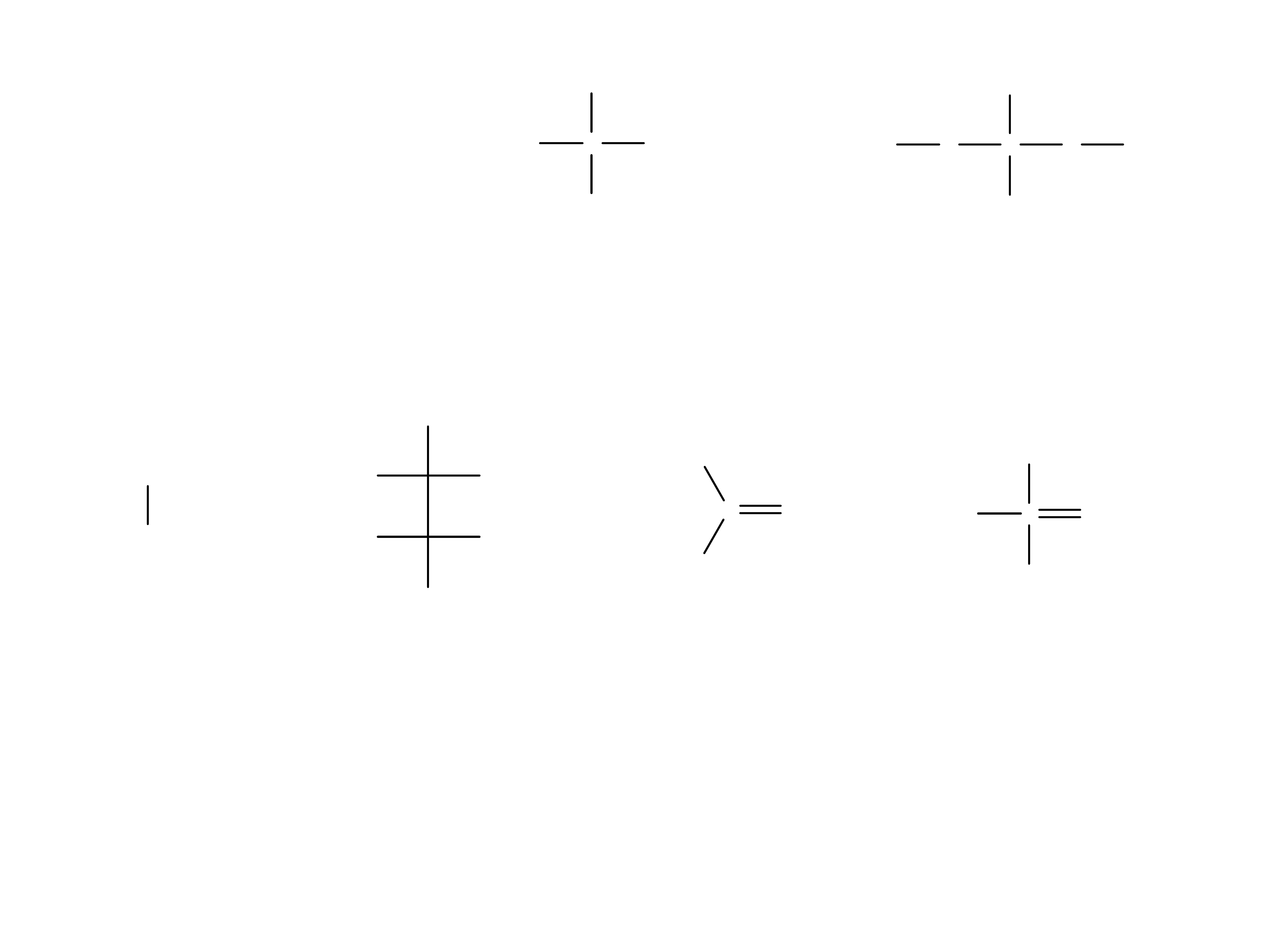
13
CH
3
COOH
H
3
C
C
OH
COOH
H
OH
C
COOH
C
H
2
C
H
2
COOH
COOH
COOH
COOH
OH
H
H
OH
C
O
HO
HO
P
OH
OH
HO
O
octowy
mlekowy
cytrynowy**
szczawiowy*
winowy**
(jeden z izomerów)
wêglowy*
fosforowy*
COOH
HOOC
* tworzą trudnorozpuszczalne sole, ** chelatują
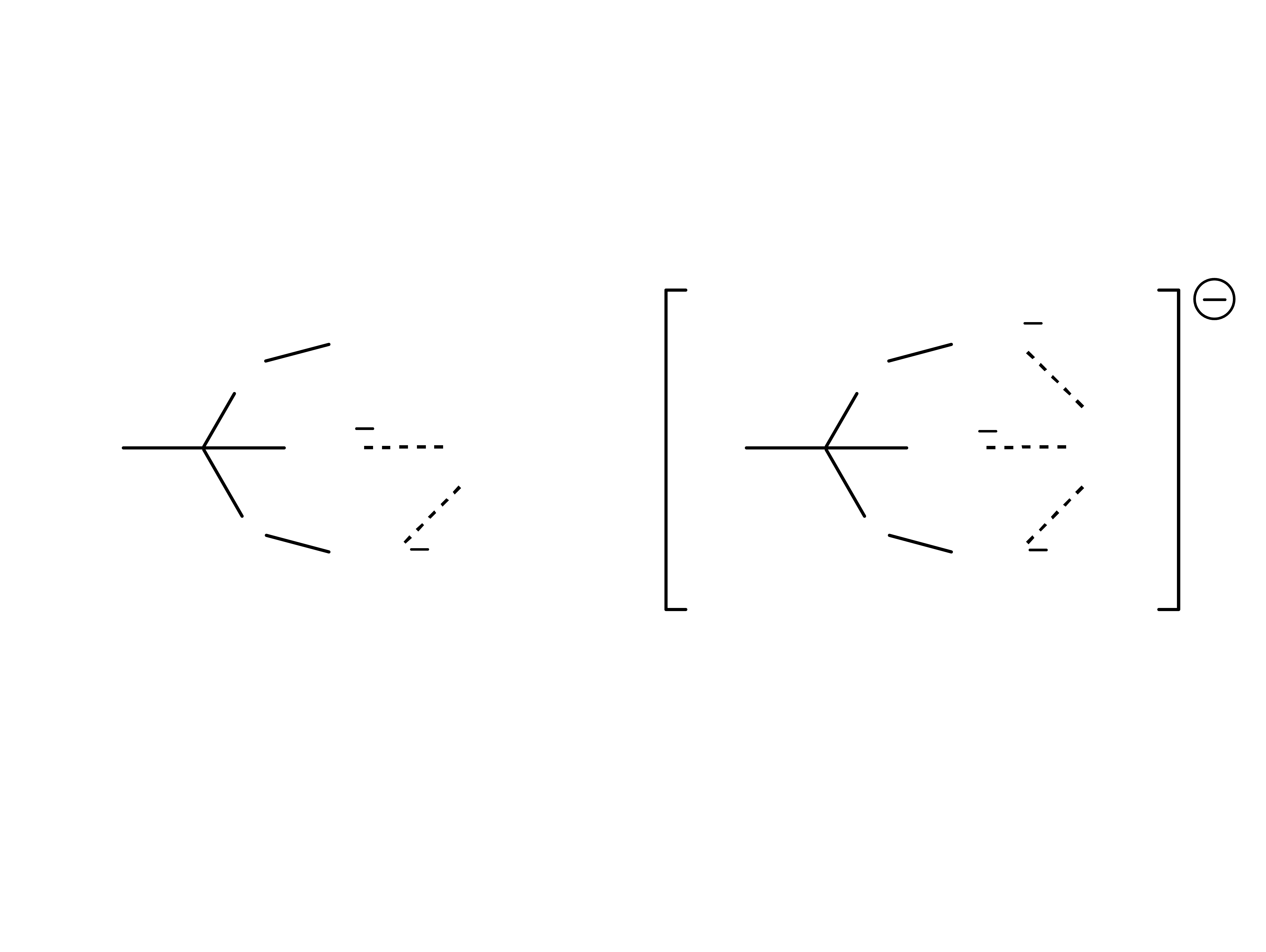
14
H
2
C
H
2
C
HO
COO
COO
COO
Ca
2+
H
2
C
H
2
C
HO
COO
COOH
COO
Ca
2+
Chelatowanie Ca
2+
przez cytrynian
pH 4 – 6,5 pH > 7

15
Wiązanie jonów wapnia na drodze ich wytrącania
lub chelatowania ułatwia rozpuszczanie szkliwa i
przyspiesza jego erozję. Dlatego kwasy wiążące
wapń są dla szkliwa bardziej niebezpieczne.
Ca
10-x
Me
x
(PO
4
)
6-y
(CO
3
)
z
(OH)
2-u
F
u
Wysoka zawartość węglanów w szkliwie zwiększa
jego podatność na erozję, gdyż często obecne w
pożywieniu słabe kwasy octowy i mlekowy są
mocniejsze od kwasu węglowego.

16
Napój
pH
H
3
PO
4
Kwas
cytrynow
y
Kwas
jabłkowy
Inne
kwasy
Sok
jabłkowy
3,0 – 3,4
0,2%
0,74%
mlekowy
0,02%
Cola
2,2 – 2,6
0,33
0,9%
węglowy
0,5%
Sok
grapefrui
t.
3,2 -3,4
21%
0,04%
Sok
pomarań
.
3,4 – 3,7
1,2%
0,3%
Wino
czerwon
e
mlekowy
0,24%
winowy
0,15%
Zawartość kwasów w popularnych napojach

17
Najbardziej szkodliwe dla szkliwa są napoje typu
cola. Posiadają najniższe pH i zawierają
dwutlenek węgla podstawiający jony fosforanowe
oraz kwasy: fosforowy i cytrynowy najsilniej
wiążące wapń.
Szkliwo
prawidłowe
Szkliwo po 15 min
ekspozycji na Colę

18
Cementy dentystyczne powstające w wyniku reakcji
kwasowo-zasadowej
Kwas
Zasada
Cement
H
3
PO
4
ZnO
Cynkowo-
fosforanowy
H
3
PO
4
Szkło glino-
krzemianowe
Krzemianowy*
EBA
ZnO
EBA
Poliakrylowy
ZnO
Cynkowo-poli-
karboksylowy
Poliakrylowy
Szkło glino-
krzemianowe
Szklano-
jonomerowy
19
Otrzymywanie cementu cynkowo-
fosforanowego
3ZnO + 2H
3
PO
4
Zn
3
(PO
4
)
2
+ 3H
2
O
Otrzymywanie cementu cynkowo-
polikarboksylowego
Kwas poliakrylowy (PAA) n ≈ 200
(
CH
2
CH CH
2
CH
)
n
C
C
O
OH
O
OH
20
Otrzymywanie cementu cynkowo-
polikarboksylowego
PAA + nZnO Zn(poliakrylan) + nH
2
O
(
CH
2
CH CH
2
CH
)
n
C
O
O
(
CH
2
CH CH
2
CH
)
n
C
O
O
C
O
O
C
O
O
Zn
2+
Zn
2+
Struktura cementu cynkowo-
polikarboksylowego
21
Zn
Zn
Zn
R
R
R
R
R
R
R
R
Zn
Zn
R
R
Zn
Wypełniacz
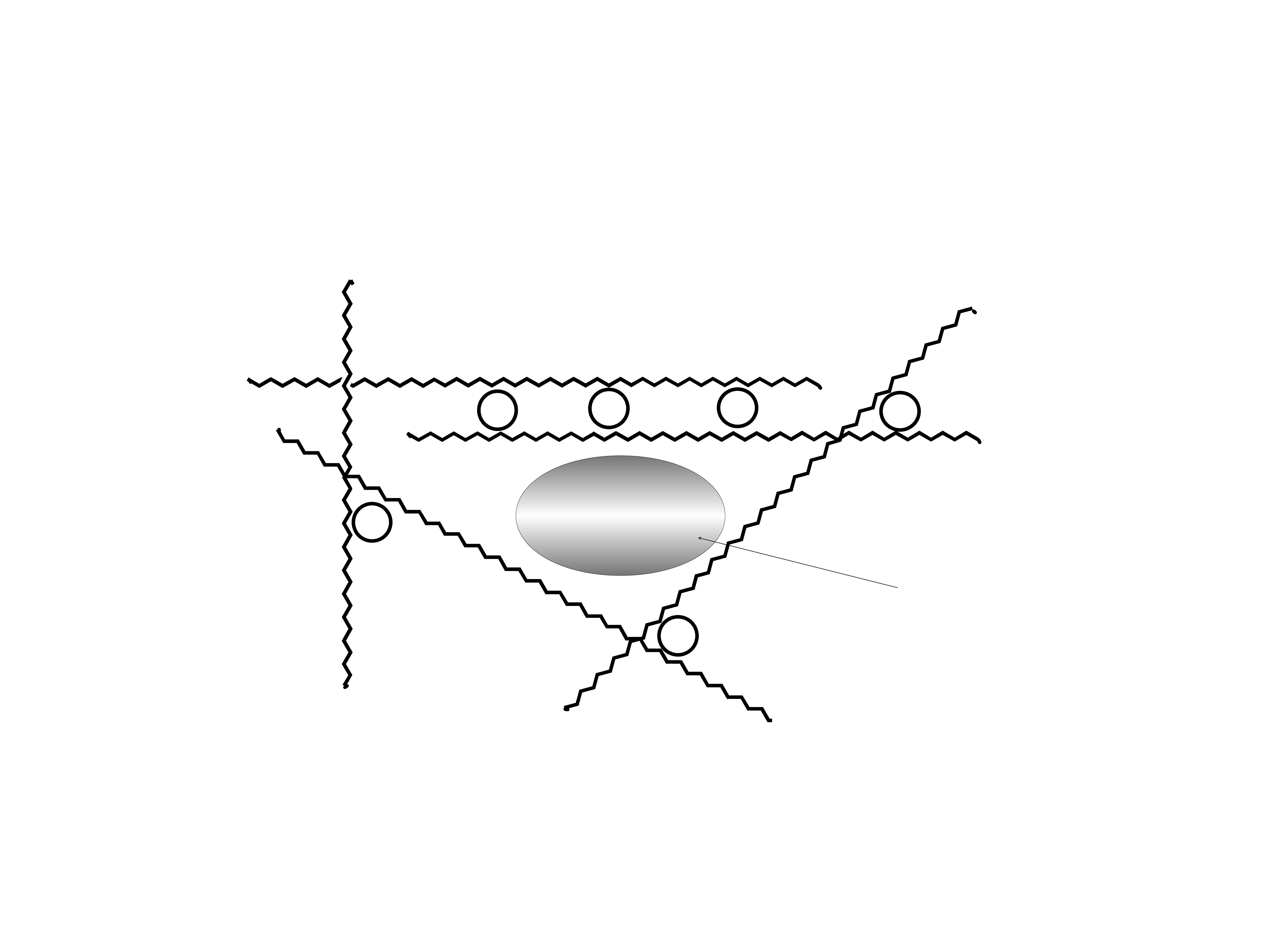
Uproszczony model cementu cynkowo-
plikarboksylowego
Grupy karboksylowe PAA nie są pokazane.
22
Otrzymywanie cementu szklano-
jonomerowego
Cement otrzymuje się w wyniku reakcji PAA ze
sproszko-wanym szkłem glinowo-krzemianowym.
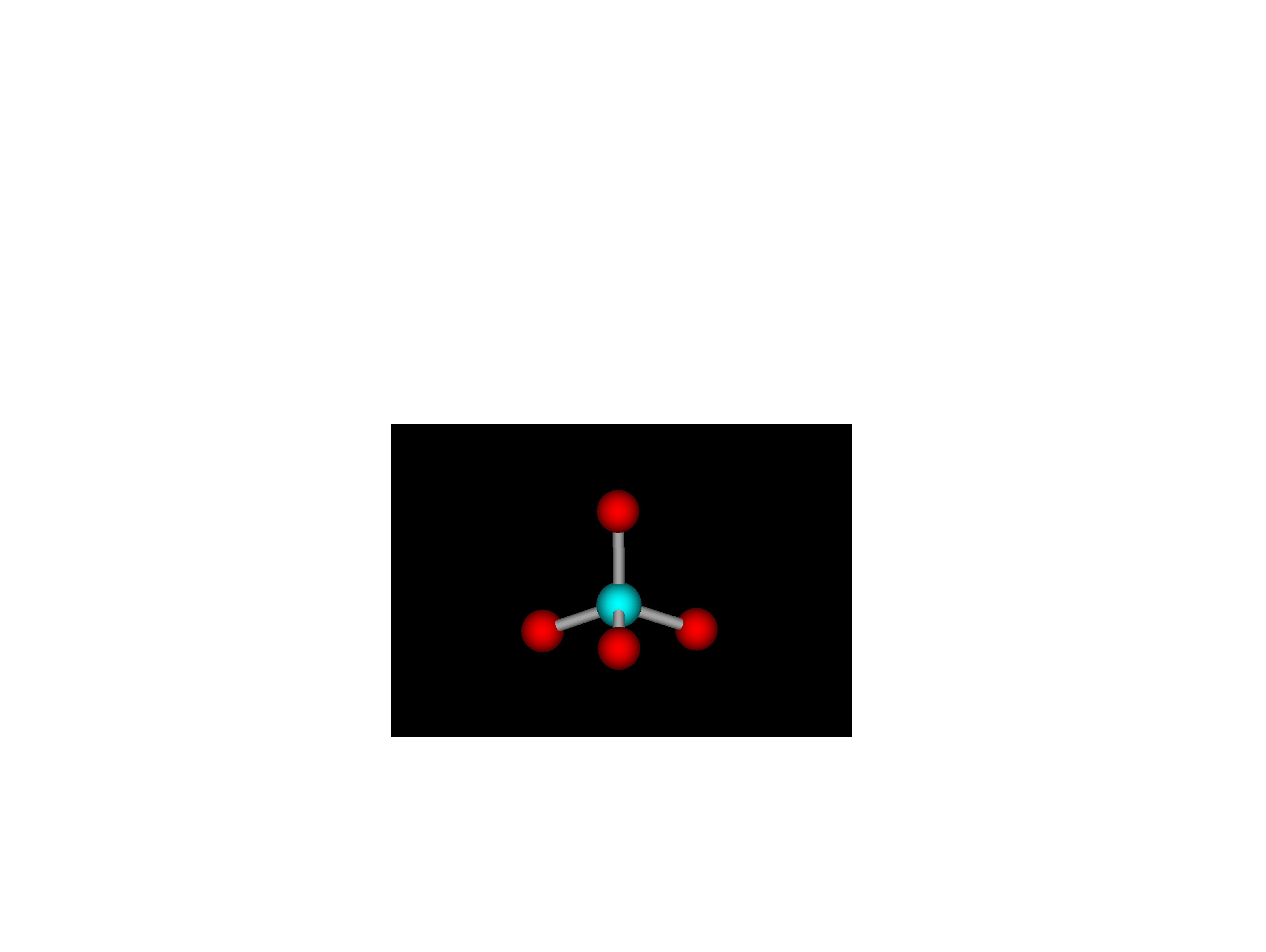
Model szkła kwarcowego
Tetraedryczna
jednostka
podstawowa SiO
4
23
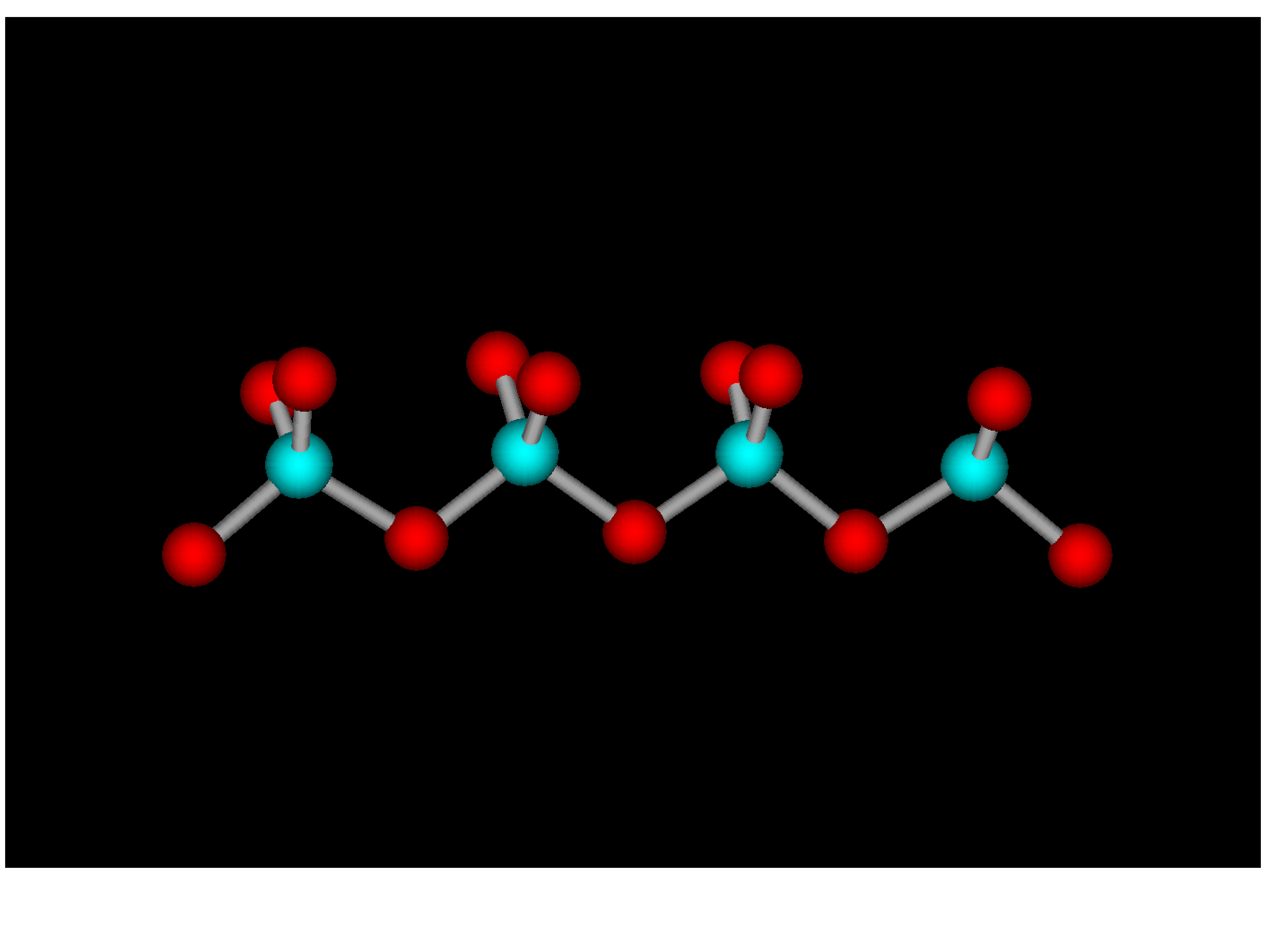
Jednostki są powiązane poprzez wspólne
atomy tlenu
24
Szkło kwarcowe
Przestrzenna sieć powiązanych jednostek
O Si O Si O Si O
O
O
O
O
Si
O
O
O
O
O
Si
Si
Si
Si
O
O
O
O
O
O
O
O
O
25
O
Al
O Si O
Al
O
O
O
O
O
Si
O
O
O
O
O
Si
Al
Al
Si
O
O
O
O
O
O
O
O
O
Szkło dentystyczne (glinowo-
krzemianowe).
Ładunek ujemny jest zobojętniony przez
jony Na
+
oraz Ca
2+.
W szkłach
dentystycznych znajduje się
dodatek CaF
2
.
Ten rodzaj szkła reaguje z kwasami np. z
PAA.

26
CaF
2
AlO
3
PAA-COOH +
Ca
2+
F
-
Al
3+
SiO
2
Reakcja rozpoczyna się od ataku kwasu
poliakrylowego na powierzchnię mikrokuleczek szkła.
27
2H + CaF
2
Ca
2
+ 2HF
HF + H
2
O F + H
3
O
6H + AlO
3
Al
3
+ 3H
2
O
SiO
4
4
+ 4H Si(OH)
4
¿el krzemianowy

28
PAA-COO
-
Ca
2+
F
-
Al
3+
Żel krzemianowy
Si(OH)
4
Al
3+
Al
3+
Al
3+
Al
3+
Ca
2+
Ca
2+
Ca
2+
F
-
F
-
F
-
PAA-COO
-
PAA-COO
-
Uproszczony model cementu szklano-jonomerowego
29
R
R
COO
COO
COO
COO
COO
COO
R
R
COO
COO
COO
COO
COO
COO
R
R
COO
COO
COO
COO
COO
COO
Ca
2+
Ca
2+
Ca
2+
Al
3+
Al
3+
Ca
2+
Al
3+
F
-
F
-
F
-
Uproszczony model cementu szklano-
jonomerowego

30
Wpływ czynników chemicznych na
trwałość cementów stomatologicznych
Cementy są trudno rozpuszczalnymi solami słabych
kwasów H
3
PO
4
, EBA, eugenol, PAA i podlegają tym
samym prawom co proste sole nieorganiczne.
W jamie ustnej cementy narażone są na działanie
śliny i składników pożywienia. Niektóre z tych
składników takie jak sól kuchenna i kwasy organiczne
są szczególnie szkodliwe, ponieważ zwiększają
rozpuszczalność cementów.

31
Teoria elektrolitów mocnych
Wartość stopnia dysocjacji ( jest podstawą klasyfikacji
elektrolitów. Zgodnie z teorią elektrolitów mocnych
istnieją dwie klasy elektrolitów.
Elektrolity mocne zawsze posiadają = 1
niezależnie
Od ich stężenia i obecności innych elektrolitów.
Elektrolity słabe posiadają
Wartość elektrolitów słabych zależy od stężenia i od
obecności innych elektrolitów.

32
Równowaga układu: osad soli - roztwór
nasycony
Równowaga ta jest scharakteryzowana przez pojęcie
rozpuszczalności (S) oraz iloczynu rozpuszczalności
K
s
).
Rozpuszczalność dostarcza informacji o wydajności
rozpuszczania i stosujemy ją zarówno dla
elektrolitów dobrze rozpuszczalnych jak i trudno
rozpuszczalnych.
Cementy charakteryzują się bardzo niską
rozpuszczal-nością, ale w warunkach jamy ustnej nie
jest możliwe wytworzenie się równowagi między
cementem i roztworem nasyconym, co powoduje, że
cement jest bardzo powoli rozpuszczany i
wypłukiwany.

33
Rozpuszczalność (definicje)
Definicja potoczna
Zdolność substancji do rozpuszczania się.
Definicja chemiczna
Masa substancji wyrażona w gramach, która tworzy
w określonych warunkach (temp. i ciśnienia)
roztwór nasycony w 100 g danego rozpuszczalnika.
Stosowana jest w katalogach i kalendarzach
chemicznych w celu charakterystyki właściwości
danego związku.
Definicja chemiczna 2
Rozpuszczalność (S) jest to stężenie molowe
nasyconego roztworu danej substancji w
określonych warunkach (temp. i ciśnienia).
Stosowana do obliczeń.

34
Rozpuszczalność zależy od kilku czynników:
- budowy cząsteczek rozpuszczalnika i substancji
rozpuszczonej;
- temperatury;
- pH;
- obecności w roztworze innych substancji.

35
Równowaga układu: osad soli - roztwór
nasycony
Równowaga ta jest scharakteryzowana przez pojęcie
rozpuszczalności (S) oraz iloczynu rozpuszczalności
K
s
).
Rozpuszczalność dostarcza informacji o wydajności
rozpuszczania i stosujemy ją zarówno dla
elektrolitów dobrze rozpuszczalnych jak i trudno
rozpuszczalnych.
Iloczyn rozpuszczalności używany jest do opisu
układów składających się z trudno rozpuszczalnych
soli lub wodorotlenków oraz ich roztworów
nasyconych.
Iloczyn rozpuszczalności wyprowadza się ze stałej
równowagi dysocjacji elektrolitów
36
NaCl Na + Cl
KOH K + OH
CH
3
COONa Na + CH
3
COO
CaCO
3
Ca
2
+ CO
3
2

37
CaCO
3
Ca
2
+ CO
3
2
K =
[
Ca
2+
][
CO
3
2-
]
[
CaCO
3
]
K
[
CaCO
3
]
=
[
Ca
2+
][
CO
3
2-
]
K
[
CaCO
3
]
= K
s
[
Ca
2+
][
CO
3
2-
]
K
s
=
poniewa¿ [CaCO
3
] jest sta³e to

38
AgCl Ag
+
+ Cl
-
K
s
=
[
AgCl
] = [
Ag
+
] = [
Cl
-
] = x
czyli K
s
= x x = x
2
= S
2
[
Ag
+
][
Cl
-
]
gdzie x jest rozpuszczalnoœ
ci¹
Ks charakteryzuje układ i zależy wyłącznie
od temperatury.
Im wyższa rozpuszczalność tym wyższa wartość
Ks.
Dla różnych typów elektrolitów zależność
pomiędzy K
s
i S jest inna.

39
Mg(OH)
2
Mg
2+
+ 2OH
-
[
Mg
2+
][
OH
-
]
2
K
s
=
[
Mg(OH)
2
]
=
[
Mg
2+
]
= x
[
OH
-
] =
2x
K
s
= x (2x)
2
= 4x
3
= 4S
3

40
Al(OH)
3
Al
3+
+ 3OH
-
[
Al
3+
][
OH
-
]
3
K
s
=
[
Al(OH)
3
]
=
[
Al
3+
]
= x
[
OH
-
] =
3x
czyli K
s
= x (3x)
3
= 27x
4
= 27S
4

41
Rozpuszczalność podobnie jak wydajność reakcji
zależy nie tylko od temperatury i rodzaju
rozpuszczalnika lecz także od obecności innych
elektrolitów w roztworze.
Zn
3
(PO
4
)
2
3Zn
2+
+ 2PO
4
3-
PO
4
3-
+ H
3
O
+
HPO
4
2-
+
H
2
O
Obniżanie pH zwiększa rozpuszczalność soli
słabych kwasów np. cementu cynkowo-
fosforanowego.

42
Zn
3
(PO
4
)
2
3Zn
2+
+ 2PO
4
3-
Na
3
PO
4
3Na
+
+
PO
4
3-
Efekt wspólnego jonu
Efekt mocnych elektrolitów nie mających
wspólnych jonów z osadem (efekt solny)
NaCl Na
+
+
Cl
-
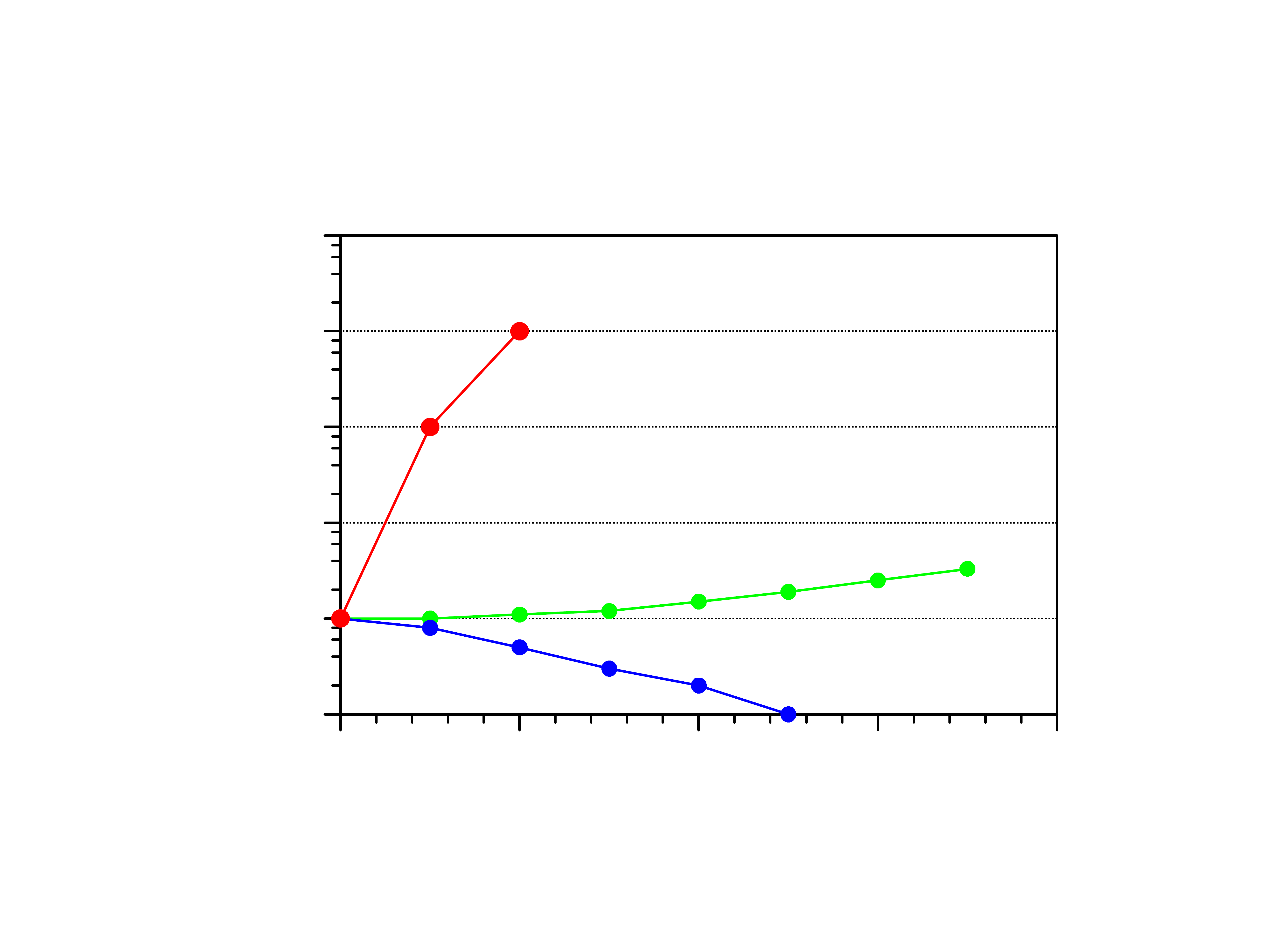
43
0,00001
0,00010
0,00100
0,01000
0,10000
1,00000
S
ol
ub
ili
ty
(
M
)
0,0
0,5
1,0
1,5
2,0
External electrolyte (M)
H
3
O
+
NaCl
Na
2
CO
3
Rozpuszczalność cementu Zn
3
(PO
4
)
2
zmienia się
pod wpływem innych elektrolitów
Stężenie molowe dodanego elektrolitu
S
Na
3
PO
4

44
Wniosek
Pokarmy silnie kwaśne oraz mocno słone
zwiększają rozpuszczalność cementów
dentystycznych i obniżają ich trwałość.

45
Kwasowość aktualna i potencjalna.
Kwasowość aktualna (wolna) wyraża aktualne
stężenie jonów wodorowych, które w roztworze
występują w postaci swobodnych jonów [H
3
O
+
].
Kwasowość aktualną można wyznaczyć przez
pomiar pH roztworu.
Kwasowość potencjalna (ogólna, całkowita) jest
sumą wolnych jonów wodorowych i protonów
związanych w cząsteczkach kwasu
niezdysocjowanego, które w reakcji
z zasadami ulegają zobojętnieniu.
Kwasowość potencjalną oznacza się na drodze
ilościowego zobojętnienia (miareczkowania)
roztworu kwasu roztworem zasady.
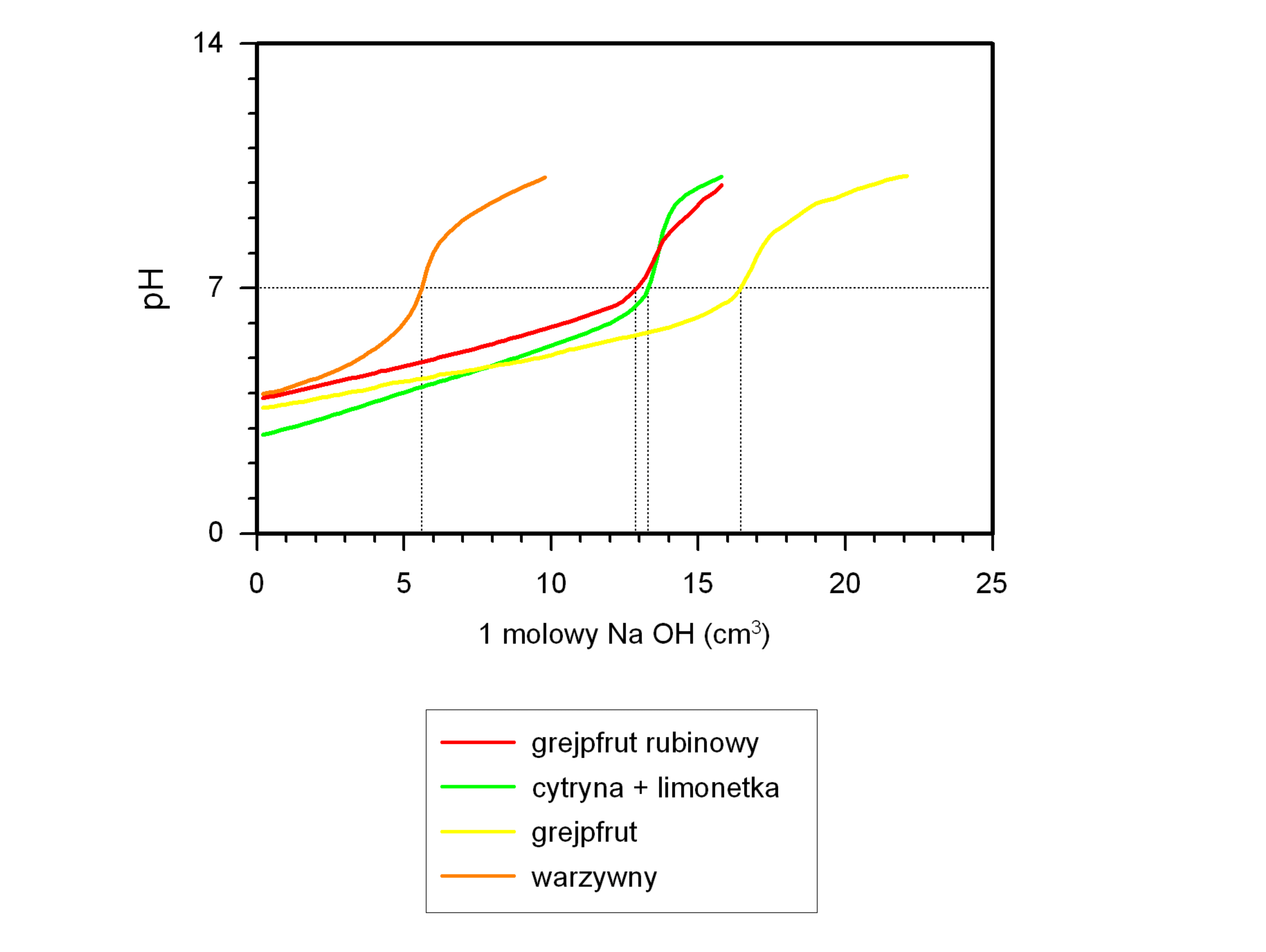
46

47
Napój
pH
Kwasowość
aktualna
(mol/dm
3
)
Kwasowość
potencjalna
(mol/dm
3
)
Sok warzywny
3,9
1,2 x 10
-4
0,057
Grejpfrut
rubinowy
3,8
1,5 x 10
-4
0,129
Cytryna +
limonetka
2,8
1,6 x 10
-3
0,133
Grejpfrut żółty
3,6
2,7 x 10
-4
0,165
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
Wykłady chemia cz 8
Wykłady chemia cz 7
Wykłady chemia cz 5 korekta
Wykłady chemia cz 6
Wykład Chemia kwantowa 11
Wykład 9 CHEMIA ORGANICZNA
Mikrobiologia wykład IV cz 1
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
WYKŁAD 1 chemia, Chemia
wykłady WDS cz.5, Geologia, I semestr, Socjologia
wykłady chemia sem 1
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
Wykład III cz II moder kot
WYKŁAD chemia gips
więcej podobnych podstron