Wojciech Piątkowski
Wykład VII
ADSORPCJA I
ADSORPCJA I
CHROMATOGRAFIA
CHROMATOGRAFIA
Katedra Inżynierii Chemicznej i Procesowej
Wydział Chemiczny, Politechnika Rzeszowska
LITERATURA
R. Petrus; G. Aksielrud; J. Gumnicki; W. Piątkowski – „ Wymiana masy w
układzie ciało stałe – ciecz”
N. Kielcew – „Podstawy techniki adsorpcyjnej”
Z. Witkiewicz – „Podstawy chromatografii”
Z. Kembłowski, St. Michałowski, Cz. Strumiłło, R. Zarzycki –„ Podstawy
teoretyczne Inżynierii Chemicznej i Procesowej”
Tadeusz Hobler – „Dyfuzyjny ruch masy i absorbery”
Praca zbiorowa pod red. Z. Ziółkowskiego – „Procesy dyfuzyjne i
termodynamiczne” – skrypt Pol. Wrocławskiej część;1; 2; 3;
K.F.Pawłow; P.G. Romankow; A.A. Noskow – „Przykłady i zadania z zakresu
aparatury i inżynierii chemicznej”
Z. Kawala; M. Pająk; J. Szust – „Zbiór zadań z podstawowych procesów
inżynierii chemicznej”; skrypt Pol. Wrocławskiej cz.: I, II, III
T.Kudra (pod redakcją) – „Zbiór zadań z podstaw teoretycznych inżynierii
chemicznej i procesowej”
R. Zarzycki – „Zadania rachunkowe z inżynierii chemicznej”
Praca zbiorowa pod red. J. Bandrowskiego – „Materiały pomocnicze do
ćwiczeń i projektów z inżynierii chemicznej” – skrypt Pol. Śląskiej

ADSORPCJA
Podstawowe pojęcia
Podział
adsorbentów
adsorbentów
ze względu na porowatość:
Adsorbenty
Adsorbenty
nieporowate - mają one niewielką powierzchnię właściwą,
rzadko przewyższającą 10 m
2
/g. Najczęściej powierzchnia ta wynosi od 0,1
do 1 m
2
/g.
Należą do nich:
sadza grafitowana,
BaSO
4
,
aerożele krzemionkowe.
Adsorbenty
Adsorbenty
porowate - ciała stałe o powierzchniach właściwych od
setek do tysiąca m
2
/g. Adsorbenty takie stosuje się w postaci ziarnistej
(tabletki, granulki, kulki) w celu nadania im odpowiedniej wytrzymałości i
zmniejszenia oporu w stosunku do strumienia gazu lub cieczy. Rozmiary
ziaren wynoszą najczęściej od 0,1 do 15 m.
Wyróżniamy wśród nich:
żele krzemionkowe,
uwodniony Al
2
O
3,
węgle aktywne,
sita molekularne (zeolity),
szkła porowate.

Metody otrzymywania
adsorbentów
Adsorbenty nieporowate
otrzymuje się przez:
strącanie krystalicznych osadów, jak np. BaSO
4
,
mielenie szklistych lub krystalicznych ciał stałych,
niepełne spalanie substancji organicznych (tzw. czarne sadze) lub
krzemoorganicznych (tzw. białe sadze),
hydrolizę chlorowcobezwodników kwasu ortokrzemowego np. SiCl
4
lub SiF
4
w silnie przegrzanej parze wodnej, uzyskując tzw. aerozole
krzemionkowe,
obróbkę zwykłej sadzy polegającą na ogrzewaniu jej w temperaturze
3000°C pod zmniejszonym ciśnieniem, w atmosferze gazu obojętne-
go lub atmosferze redukującej. W temperaturze 3000°C cząsteczki
sadzy przybierają postać wielościanów, których płaszczyzny
zbudowane są z grafitu. Otrzymujemy tu sadze grafitowane.
ADSORPCJA
Podstawowe pojęcia

ADSORPCJA
Podstawowe pojęcia
Metody otrzymywania
adsorbentów
Wyróżniamy dwie główne metody otrzymywania
adsorbentów porowatych:
1. synteza (aglomeracja) -
która polega na zbudowaniu sztywnego szkieletu
adsorbentu z małych cząstek o rozmiarach koloidalnych; cząstki te
(korpuskuły) zlepiają się lub zrastają w miejscach zetknięcia, tworząc
szkielet o olbrzymiej powierzchni wewnętrznej; w ten sposób otrzymuje się
m.in. żele krzemionkowe, uwodniony Al
2
O
3
;
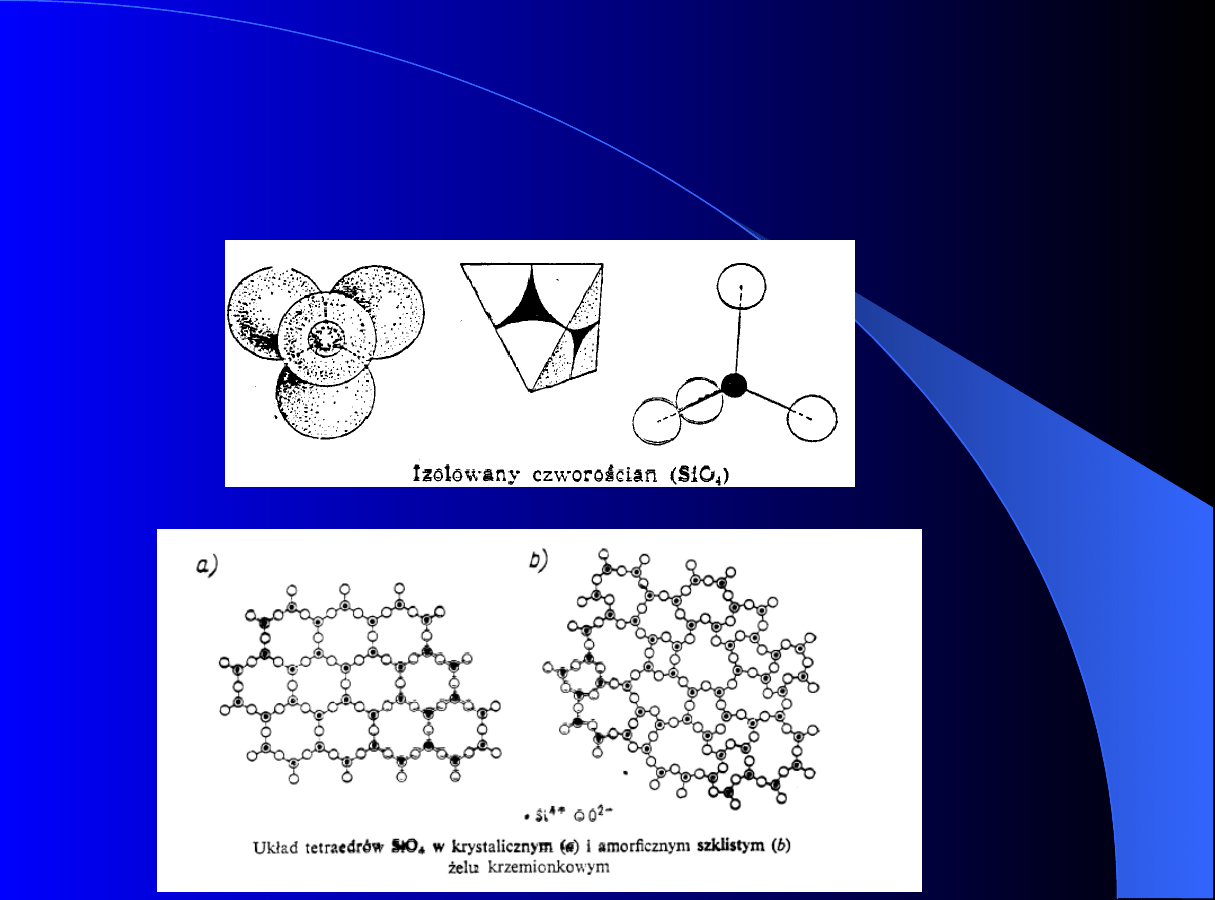
ADSORPCJA
Podstawowe pojęcia
Cząstki żelu krzemionkowego zbudowane są z
Cząstki żelu krzemionkowego zbudowane są z
tetraedrów
SiO
tetraedrów
SiO
4
4
ułożonych
w
postaci
ułożonych
w
postaci
przestrzennej nieuporządkowanej sieci.
przestrzennej nieuporządkowanej sieci.

ADSORPCJA
Podstawowe pojęcia
Metody otrzymywania
adsorbentów
2. wywarzanie porów w litym materiale wyjściowym -
polega na
działaniu na porowate lub nieporowate ciała (koks, szkło),
aktywnymi gazami lub cieczami.
Przykłady:
węgiel aktywny
z bardzo rozwiniętą powierzchnią (rozmiary porów od
kilku do kilkudziesięciu nm) - powstaje podczas działania na nieaktywny
węgiel gazami utleniającymi w temperaturze od 1123 do 1223 K;
wówczas część węgla ulega spaleniu;
szkła porowate -
otrzymuje się działając kwasami na szkło sodowo –
borowe. Rozmiary porów zależą od obróbki cieplnej szkła i końcowego
przemywania roztworami NaOH lub KOH;
metale porowate,
jak np. nikiel Raney’a otrzymuje się poprzez
wyługowanie NaOH stopu Ni z Al; w stopie tym podczas krzepnięcia
wydzielają się obydwa metale jako oddzielne fazy; po rozpuszczeniu
glinu w NaOH pozostaje porowaty szkielet niklowy.
ADSORPCJA
Podstawowe pojęcia
Adsorbenty porowate
Adsorbenty porowate
Klasyfikacja porów wg Dubinina:
Klasyfikacja porów wg Dubinina:
mikropory
mikropory
– pory o promieniach mniejszych od
– pory o promieniach mniejszych od
2 nm,
2 nm,
pory pośrednie (mezopory)
pory pośrednie (mezopory)
– pory o
– pory o
promieniach większych od 2 nm a mniejszych od
promieniach większych od 2 nm a mniejszych od
200 nm,
200 nm,
makropory
makropory
– pory o promieniach większych od
– pory o promieniach większych od
200 nm.
200 nm.

ADSORPCJA
Podstawowe pojęcia
Powierzchnia
Powierzchnia
adsorbentu
adsorbentu
znajduje się w innym stanie
energetycznym niż jego wnętrze, a siły działające na tej
powierzchni są niezrównoważone. Wyeksponowanie ciała stałego w
płynie spowoduje zjawisko gromadzenia się cząstek płynu na
powierzchni tego ciała. Efekt ten będzie tym lepszy, im większa
będzie powierzchnia właściwa (przypadająca na jednostkę masy
ciała stałego). Zdolność pokrywania powierzchni ciała stałego
cząstkami tego samego rodzaju substancji jest charakterystyczna
dla danego układu płyn-ciało stałe. Zatem cząstki płynu będącego
mieszaniną dwu- lub więcej składników mogą mieć różne
powinowactwo do powierzchni ciała stałego. Spowoduje to zmianę
stężenia każdej substancji biorącej udział w
ruchu masy
ruchu masy
: stężenia
objętościowego tej substancji w płynie oraz jej stężenia
powierzchniowego, w warstwie osadzonej na powierzchni ciała
stałego. Opisane zjawisko nosi nazwę
adsorpcji
adsorpcji.
Równowaga termodynamiczna układu dwufazowego płyn-ciało stałe
jest zazwyczaj silnie przesunięta na korzyść stężenia substancji
zaadsorbowanej w warstwie powierzchniowej i przez to
adsorpcja
adsorpcja
jest szczególnie efektywną metodą rozdziału mieszanin, pozwalającą
na zmniejszenie stężenia objętościowego danej substancji w płynie,
nawet do wartości stężenia rzędu ppm.

Charakter sił wiążących
adsorbat
adsorbat
z
powierzchnią adsorbentu
powierzchnią adsorbentu
dzieli
adsorpcję
adsorpcję
na dwa rodzaje: (*)
adsorpcję typu fizycznego
adsorpcję typu fizycznego
oraz (*)
adsorpcję typu chemicznego
adsorpcję typu chemicznego
.
Adsorpcja fizyczna
Adsorpcja fizyczna
jest spowodowana działaniem przyciągających
sił międzycząsteczkowych, w większości przypadków sił typu van der
Waalsa, spotęgowanych niekiedy siłami elektrostatycznymi lub siłami
wiązania wodorowego.
Adsorpcja chemiczna
Adsorpcja chemiczna
- chemisorpcja
- chemisorpcja
,
zwana
adsorpcją aktywowaną
adsorpcją aktywowaną
, jest związana z wytworzeniem
wiązania chemicznego między
adsorbatem
adsorbatem
a
adsorbentem.
adsorbentem.
Następujące kryteria pozwalają rozróżnić
adsorpcję
adsorpcję
fizyczną
fizyczną
od
chemisorpcji:
chemisorpcji:
1.
ciepło adsorpcji
ciepło adsorpcji
- małe wartości ciepła adsorpcji, rzędu 220
[kJ/mol] dla
adsorpcj
adsorpcj
i
i
fizyczn
fizyczn
ej
ej
, duże dla - zmiana równowagi
procesu jest łatwa w przypadku
adsorpcj
adsorpcj
i
i
fizyczn
fizyczn
ej
ej
, spowodowanie
chemisorpcji
chemisorpcji
, rzędu 20400 [kJ/mol], porównywalne z ciepłem
reakcji;
2.
odwracalność procesu
odwracalność procesu
takiej zmiany dla
chemisorpcji
chemisorpcji
wiąże się
z koniecznością zastosowania bardziej drastycznych warunków, na
przykład zwiększenia temperatury desorpcji,
3.
grubość warstw adsorpcyjnych
grubość warstw adsorpcyjnych
- w przypadku
adsorpcj
adsorpcj
i
i
fizyczn
fizyczn
ej
ej
tworzą się na powierzchni warstewki
adsorba
adsorba
tu
tu
, których
grubość odpowiada kilku średnicom cząstek tego ostatniego; w
przypadku
chemisorpcji
chemisorpcji
powstają warstewki jednocząsteczkowe
warstewki
adsorbatu
adsorbatu
.
ADSORPCJA
Podstawowe pojęcia

Podczas
adsorpcji
adsorpcji
w układzie ciecz-ciało stałe często jest możliwe
wystąpienie obu typów
adsorpcji
adsorpcji
jednocześnie już w temperaturze
otoczenia.
Z termodynamicznego punktu widzenia, w adsorpcji, jak w
każdym procesie równowagowym, obowiązuje równanie Gibbsa:
G
=
H
r
-T
S
Ze względu na to, że
adsorpcja
adsorpcja
jest procesem samorzutnym energia
swobodna Gibbsa
G < 0.
Przejście
adsorptywu
adsorptywu
A
z płynu w
adsorbat
adsorbat
zaadsorbowany na powierzchni
adsorbentu
adsorbentu jest związane
z utratą co najmniej jednego stopnia swobody (zahamowany ruch
translacyjny), a więc wystąpi także zmiana entropii układu
S < 0.
Wtedy
H < 0,
ADSORPCJA
ADSORPCJA
JEST WIĘC
PROCESEM
PROCESEM
EGZOTERMICZNYM
EGZOTERMICZNYM
.
W związku z tym, stężenie
adsorbatu
adsorbatu
na powierzchni
adsorbentu
adsorbentu
maleje ze wzrostem temperatury procesu a rośnie ze wzrostem
stężenia
adsorptywu
adsorptywu
w płynie.
ADSORPCJA
Podstawowe pojęcia
ADSORPCJA
Statyka procesu
O ilości parametrów, jakie możemy przyjmować dowolnie (zmienne
niezależne) w warunkach
równowagi a
równowagi a
d
d
sorpcyjnej
sorpcyjnej
w układzie
gaz(lub ciecz) płyn-ciało stałe informuje nas reguła faz.
W przypadku najprostszego układu 3-składnikowego:
s = i + 2 - f
-
gdzie:
i
-
ilość
składników
;
f -
ilość faz
; s -
ilość stopni swobody
.
początek
koniec
i = 3; f = 2; s = 3 + 2 - 2 = 3
stopnie swobody
Dwa z nich zajmujemy:
T
oraz
p.
Jeżeli 3-ci stopień swobody zajmiemy
jednym ze stężeń np.
c
A
-
stężeniem składnika kluczowego
(adsortywu)
(adsortywu)
A
w fazie płynu, to
stężenie tego składnika na powierzchni
adsorbentu (adsorbat)
adsorbentu (adsorbat)
po
osiągnięciu stanu równowagi będzie funkcją:
q*
A
= f(c
A
; T; p).
adsorbent
(złoże)
Faza stała
adsorbat+adsorbent
Faza stała
A* S
Faza płynu
A* + B
Faza płynu
A + B
adsorptyw+eluent
ADSORPCJ
A
Statyka
procesu c.d.
Prawidłowy, szczegółowy rodzaj stężenia użytego w modelu
adsorpcji
adsorpcji
wynika z wymiaru
bilansu masy
bilansu masy
w sześcianie jednostkowym, w którym
każdy człon winien mieć wymiar [kmolA/m
3
s]. Mimo tego, że adsorpcja
to przypadek
dyfuzji
dyfuzji
1)
lub
3)
rodzaju to dogodnym i podstawowym
stężeniem jest
koncentracja
koncentracja
molow
molow
a
a lub
masow
masow
a.
a.
Ze zmianą dwóch, głównych parametrów
T
oraz
p (dla układu gaz-
ciało stałe)
a
a
d
d
sorpcja
sorpcja
przebiega następująco. Ze wzrostem
temperatury stężenie równowagowe
adsorbatu
adsorbatu
się zmniejsza, a ze
wzrostem ciśnienia rośnie (układ gaz-ciało stałe!). Z tego powodu
a
a
d
d
sorpcj
sorpcj
ę
ę
należy prowadzić w jak najniższej temperaturze i jak
najwyższym
ciśnieniu
(zakresy
zmian
tych
parametrów
są
charakterystyczne dla danego układu absorpcyjnego) ponieważ
maksymalizujemy wówczas
si
si
łę
łę
nap
nap
ę
ę
dow
dow
ą
ą
procesu. Każdorazowy stan
równowagi powiązany jest zależnością:
(
)
*
const
K
A
T, p
A
q
c
=
=
lynu
p
fazie
w
skladnika
e
rownowagow
stezenie
adsorbentu
i
powierzchn
na
skladnika
e
rownowagow
stezenie
A
A
gdzie:
K -
stała równowagi adsorpcyjnej.
Dynamika adsorpcji
reakcji
wyniku
w
skl.
ubytek
skl.
akumulacja
skl.
odplywu
natezenie
skl.
doplywu
natezenie
A
A
A
A
Stężeniem najcz
ęś
ciej używanym w modelu adsorpcji jest
koncentracja molowa
– [kmolA/m
3
]
/
A
A
C
n V
=
z
y
x
x
N
N
Ax
Ax
d
d
d
dz
dy
N
Ax
'
A
A
A
N c u
=
Definicja
g
g
ę
ę
sto
sto
ś
ś
ci strumienia
ci strumienia
masy – miary prędkości
masy – miary prędkości
procesu:
procesu:
[kmolA/m
2
s]
'
'
d
d
A
A
N x
m
=
[kmolA/s]
I
I
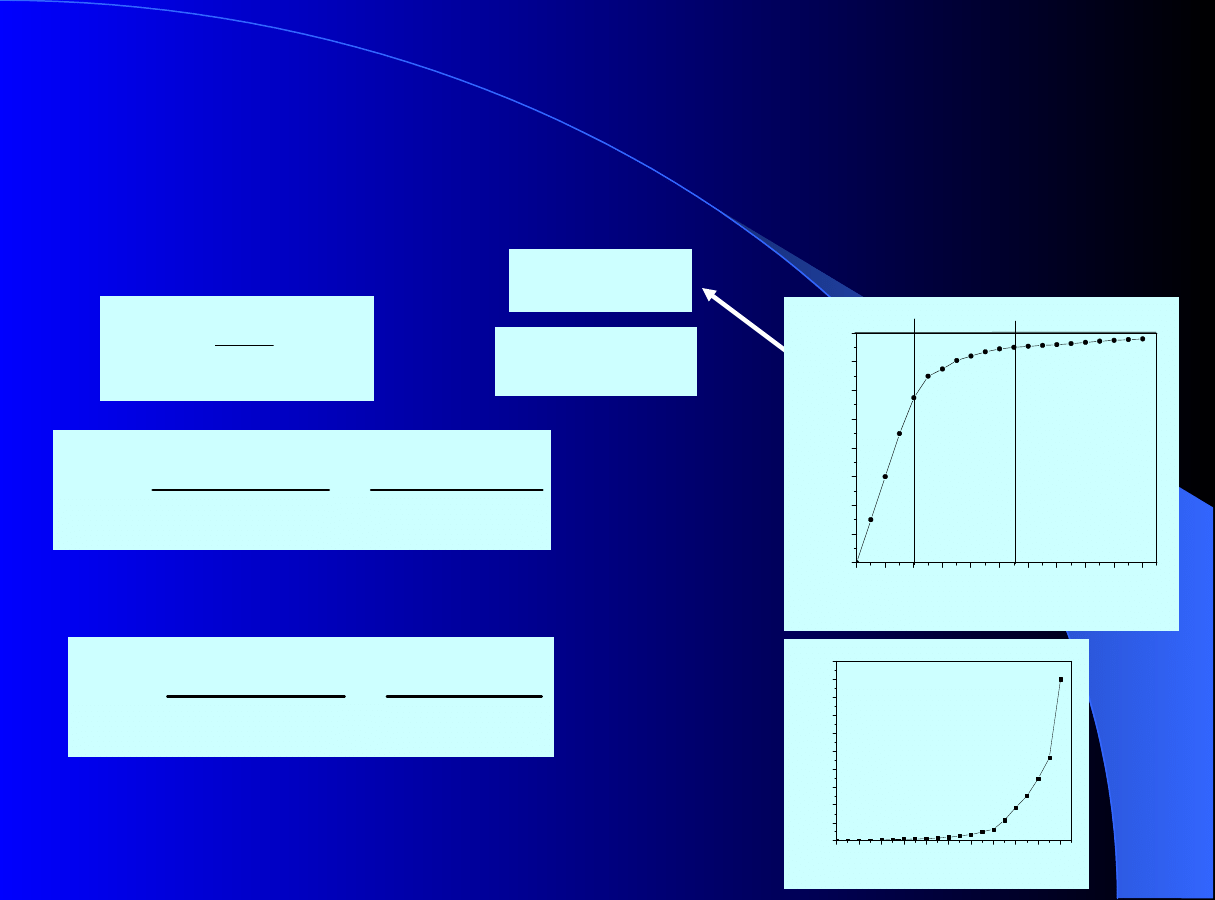
zotermy pojedyncze
zotermy pojedyncze
-
-
Modele izotermy dla idealnej
Modele izotermy dla idealnej
adsorpcji
adsorpcji
na homogenicznej powierzchni adsorbentu
na homogenicznej powierzchni adsorbentu
*
'
'
1
1
ri
i
i
i
i
ri
i
ri
i
q b c
H c
q
b c
b c
�
=
=
-
-
Izoterma antyLangmuira:
*
1
1
ri
i
i
i
i
ri
i
ri
i
q K c
H c
q
K c
K c
�
=
=
+
+
Izoterma Langmuira:
)
(
1
1
S
A
k
k
S
A
-
*
i
i
i
q
H c
=
Izoterma Henry’ego:
K
q
H
ri
i
gdzie:
0
2
4
6
8
10
12
14
16
18
20
0
2
4
6
8
10
12
14
16
III
II
I
q
C
q
*
Langmuir
0
2
4
6
8
10
12
14
16
18
20
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
1.8
2.0
C
q
*
q
antyLangmuir
R. Petrus; G. Aksielrud; J. Gumnicki; W.
Piątkowski – „ Wymiana masy w układzie
ciało stałe – ciecz” , podrozdz. 7.2.1.
ADSORPCJ
A
Statyka
procesu c.d.
I
I
zotermy pojedyncze
zotermy pojedyncze
-
-
Modele izotermy dla
Modele izotermy dla
nie
nie
idealnej
idealnej
adsorpcji
adsorpcji
na homogenicznej powierzchni adsorbentu
na homogenicznej powierzchni adsorbentu
0
5
10
15
20
25
16
18
20
22
24
Packed
Monolith
MeOH/H
2
O (65/35)
B
re
a
kth
ro
ug
h
cu
rv
es
minimum slope
of chord isotherm
q
*/
c
c [g/dm
3
]
0
5
10
15
20
25
16
18
20
22
24
Packed
Monolith
MeOH/H
2
O (65/35)
B
re
a
kth
ro
ug
h
cu
rv
es
minimum slope
of chord isotherm
q
*/
c
c [g/dm
3
]
Izoterma BET:
(
) (
)
*
1
1
i
ri i
i
L i
L i
ri i
q K c
q
K c
K c K c
�
=
-
-
+
Izoterma BET dla układu ciecz-ciało
stałe. Kształt zależności wartości
q*/c
q*/c
-
-
w funkcji stężenia
w funkcji stężenia
c
c oraz
charakterystyczny kształt krzywych
wyjścia naprowadza na prawidłowy
model izotermy adsorpcji – tutaj BET
*
1/
F
k
n
i
i
q
c
=
Izoterma Freundlicha:
gdzie:
k
F
i
n –
parametry równania
ADSORPCJ
A
Statyka
procesu c.d.

Izoterma
biLangmuira:
I
I
II
II
*
I
II
1
1
A
i
A
i
A
i
i
q K c q K c
q
K c
K c
�
�
=
+
+
+
Izoterma
UNILAN
:
h
C
K
h
C
K
h
2
q
q
i
i
A
*
A
exp
1
exp
1
ln
ADSORPCJ
A
Statyka
procesu c.d.
I
I
zotermy pojedyncze
zotermy pojedyncze
-
-
Modele izotermy dla idealnej
Modele izotermy dla idealnej
adsorpcji
adsorpcji
na h
na h
etero
etero
genicznej powierzchni adsorbentu
genicznej powierzchni adsorbentu
*
1
*
1
i
i
ri
ij
j
rj
j
q
c
K
S
q
K
c
=
=
IZOTERMY
IZOTERMY
KONKURENCYJNE -
KONKURENCYJNE -
WIELOSK
WIELOSK
Ł
Ł
ADNIKOWE
ADNIKOWE
i nazywany
selektywno
selektywno
ś
ś
ci
ci
ą
ą
równowagow
równowagow
ą
ą
, gdzie
:
q
i j
,
*
Selektywność rozdziału adsorpcyjnego
S
i,j
w przypadku
adsorpcji
adsorpcji
z
płynu więcej niż jednego adsorptywu, jest mierzona analogicznie jak w
przypadku innych metod rozdziału przez stosunek stałych
równowagi
równowagi
adsorpcyjnej
adsorpcyjnej
(analog np. lotności względnej w destylacji), definiowany
jako:
- ilość zaadsor-bowanej substancji
(
adsorbatu
adsorbatu
i/j)
w jednostce masy adsorbentu (stężenie
powierzchniowe adsorbatu) w warunkach równowagi
termodynamicznej; -
c
i,j
-
stężenie adsorptywu w
płynie;
K
ri,j
- stała równowagi adsorpcji dla składnika
kluczowego
i
lub
j.
Rozdział mieszaniny przez adsorpcję jest możliwy,
jeśli równowagowa selektywność substancji
i
od
j
jest
rzędu
S
i,j
= 1.21.5
lub większa.
Izoterma konkurencyjna
Langmuira:
*
2
1
1
i
i
i
i
j
j
j
q K c
q
K c
�
=
=
+
�
założenie:
const
tot
i
q
q
ADSORPCJ
A
Statyka
procesu c.d.

IZOTERMY WIELOSK
IZOTERMY WIELOSK
Ł
Ł
ADNIKOWE
ADNIKOWE
N
i
*
i
tot
q
q
1
jeśli:
wówczas izoterma konkurencyjna
Langmuira zamienia się w izotermę
stechiometryczną
Izoterma stechiometryczna:
B
S
A
k
k
S
B
A
-
)
(
)
(
1
1
(
)
(
)
1
1
1
*
A
rA
A
A
rA
A
A
A
rA
A
rA
A
q K c
q K c
q
C
K c
K
c
�
�
=
=
-
+
+
-
IZOTERMA KONKURENCYJNA - TEORI
IZOTERMA KONKURENCYJNA - TEORI
A
A
IAS
IAS
( )
( )
( )
0
*
0
0
0
0
0
d
i
i
c
i
i
i
i
i
q c
c
c
c
p
=
�
( )
0
i
i
mix
c
p
p
=
0
s
i
i
i
c
x c
=
0
1
1
NC
i
i
i
c
c
=
=
�
NC
i
i
*
i
s
i
*
tot
C
q
x
q
1
0
1
prz
y:
*
tot
s
i
*
i
q
x
q
TEORIA AST
TEORIA AST
a
K
a
K
q
q
i
ri
i
ri
*
i
1
i
i
i
x
a
gdzie:
Na przykładzie
izotermy
Langmuira:
TEORIA RAS
TEORIA RAS
x
,
T
NC
i
i
i
s
i
NC
i
i
*
i
s
i
*
tot
ln
x
c
q
x
q
1
1
0
1
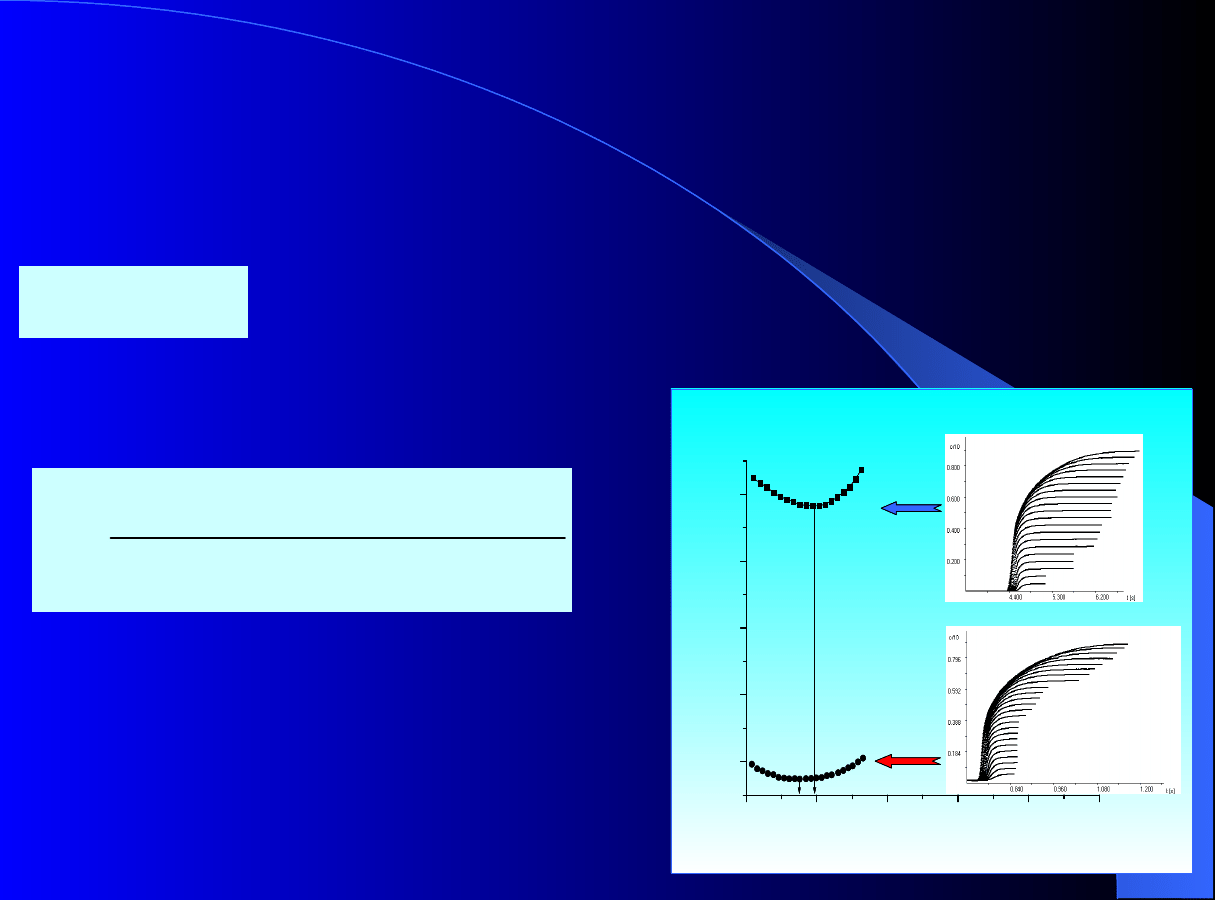
Dynamika adsorpcji i
chromatografii
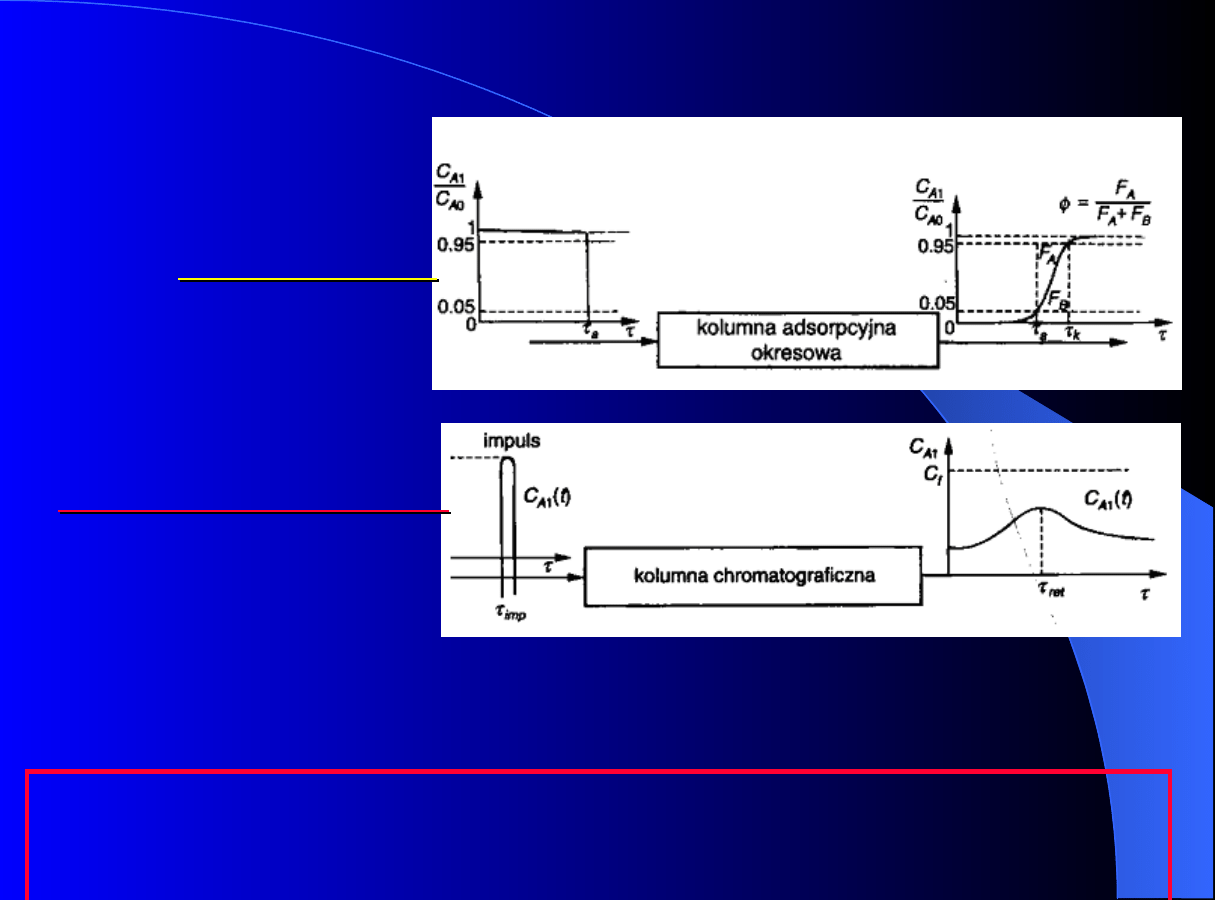
Proces w kolumnie adsorpcyjnej lub
chromatograficznej z nieruchomym złożem adsorbentu
jest procesem okresowym –
procesem nieustalonym!
Różnice pracy kolumny
okresowej:
oraz
--
chromatograficznej
chromatograficznej
--
adsorpcyjnej
adsorpcyjnej
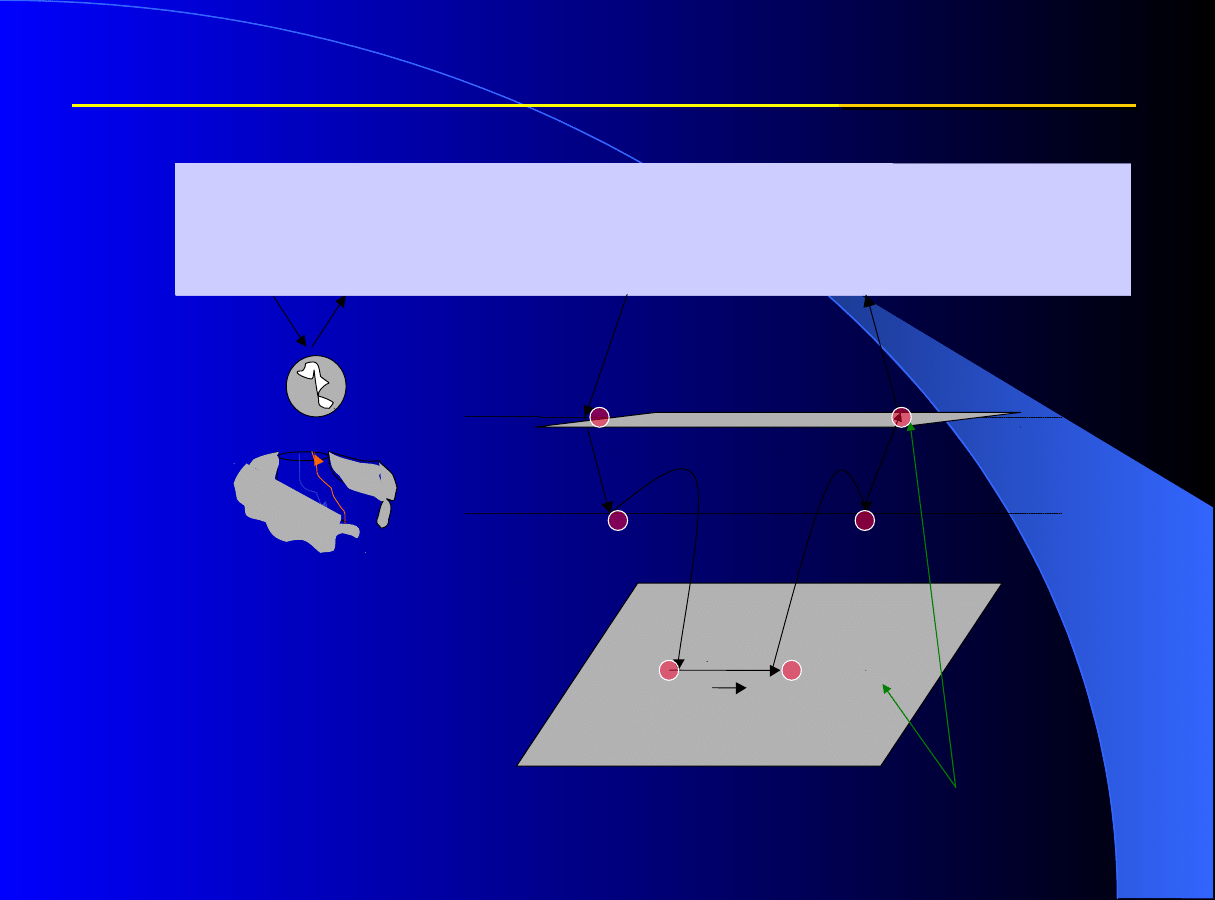
Dynamika adsorpcji
Matematyczne zależności między istotnymi
dla danego procesu wielkościami nazywa się
modelem dynamiki układu (procesu; aparatu)
pedu
ia
przenoszen
równanie
reakcji
kinetyka
procesu
mika)
(termodyna
statyka
masy
u
transport
kinetyka
masy
(bilanse)
bilans
ciepla
u
transport
kinetyka
ciepla
(bilanse)
bilans
Proces może być ustalony
(1)
lub
nieustalony
(2).
W przypadkach:
•
(2) – procesu
(2) – procesu
nieustalonego w
nieustalonego w
czasie
czasie
;
;
•
–
–
zmiennej powierzchni procesu
zmiennej powierzchni procesu
(
powierzchnia procesu
–
powierzchnia izokoncentryczna
powierzchnia izokoncentryczna
,
to miejsce geometryczne punktów o
jednakowym stężeniu w danej chwili
czasu)
Model
Model
dynamiki procesu
dynamiki procesu
transportu masy
transportu masy
to układ równań
to układ równań
różniczkowych wyrażonych jako
różniczkowych wyrażonych jako
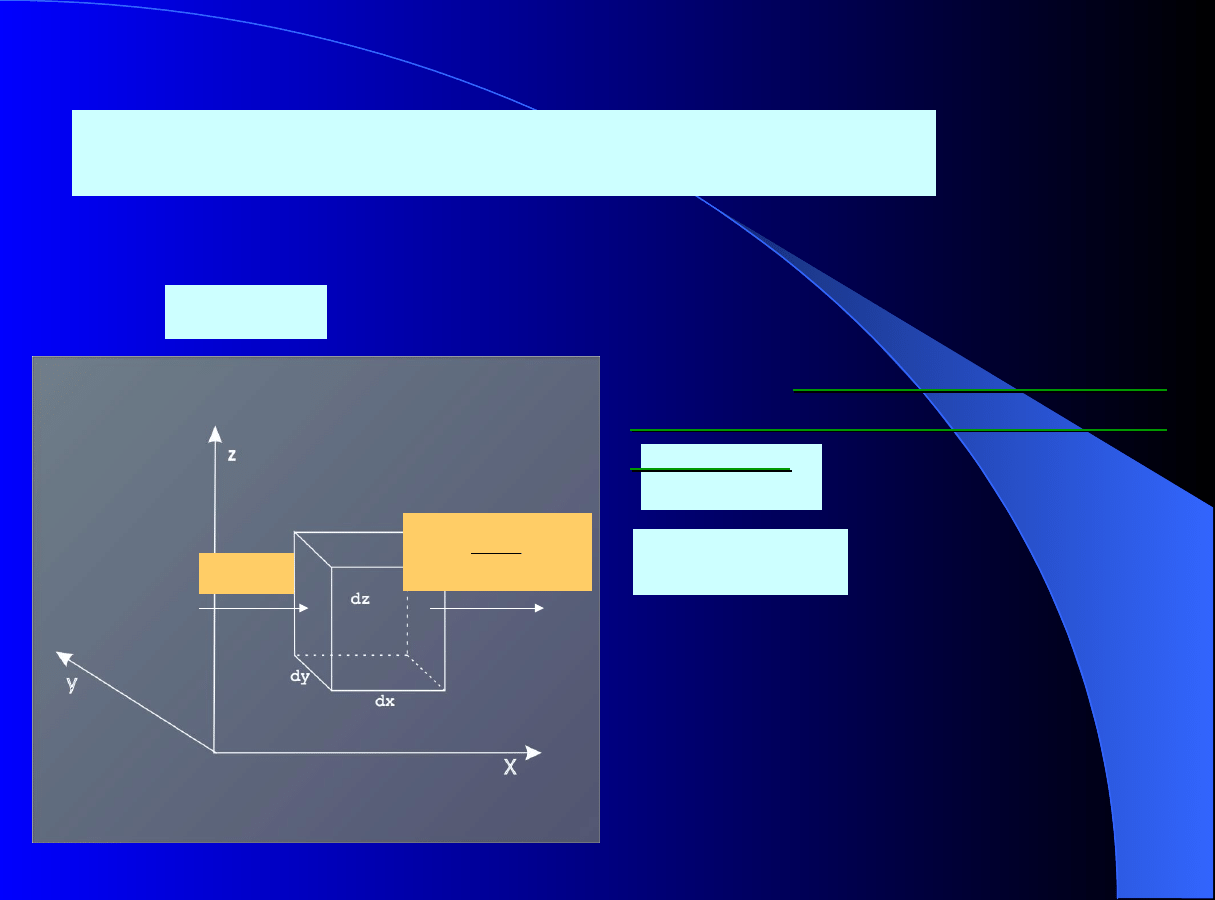
bilanse masy dla sześcianu
bilanse masy dla sześcianu
jednostkowego
jednostkowego
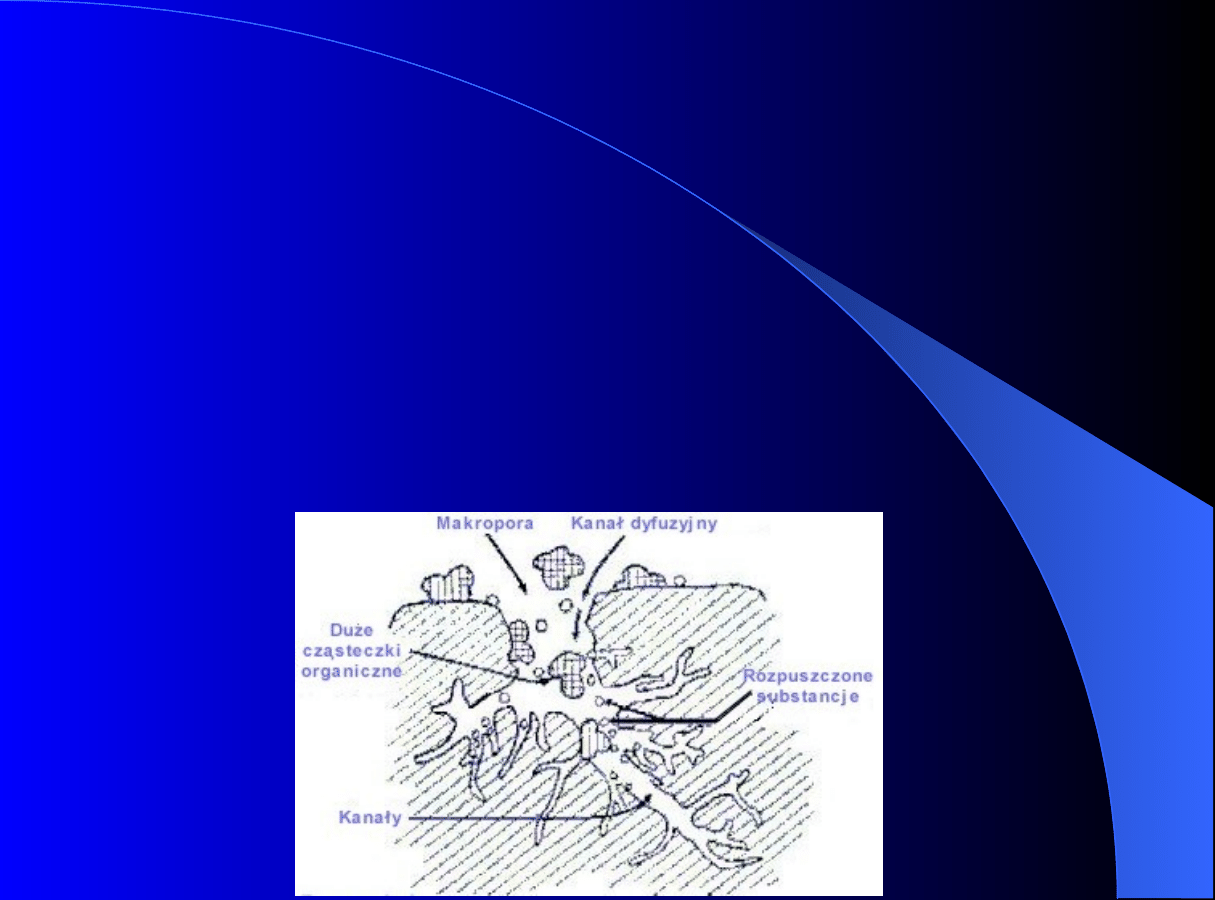
Proces w kolumnie adsorpcyjnej lub chromatograficznej z
nieruchomym złożem adsorbentu jest procesem okresowym –
procesem nieustalonym!
A
B
A
B
A
B
A
B
Powierzchnia
1
2
3
4
5
7
1
7
2,6
Płyn
Konwekcja,
dyspersja
1; 7 dyfuzja zewnętrzna
2; 6 dyfuzja wewnętrzna
3; 5 proces powierzchniowy
adsorpcja- desorpcja
4 dyfuzja powierzchniowa
6
wewnętrzna
zewnętrzna
Proces ogólny nazywany
adsorpcją
adsorpcją
Dynamika adsorpcji
Model ogólny – GR
Model ogólny – GR
(
(
dla Chromatografii
dla Chromatografii
)
)
c
iF
(t)
x = 0
x = L
Założenia upraszczające:
(*) proces jest izotermiczny,
(*) szybkość fazy ruchomej jest stała, jej
ściśliwość jest do pominięcia,
(*) złoże jest upakowane porowatymi
ziarnami
adsorbentu
o
sferycznym
kształcie i ujednoliconej wielkości,
(*)
gradient
stężenia
w
kierunku
promieniowym w aparacie jest do
pominięcia,
(*) dla każdego składnika systemu
istnieje równowaga lokalna pomiędzy
wartością
stężenia
na
powierzchni
adsorbentu a wartością stężenia w
nieruchomym filmie płynu,
(*) wartości współczynników: dyspersji
wzdłużnej oraz przenikania masy w
aparacie są stałe.
Solid phase
Bondary Layer
R
p
c
pi
c
i
q
*
i
Bilans masy dla
Bilans masy dla
i
i
-tego sk
-tego sk
ł
ł
adnika w fazie ruchomej:
adnika w fazie ruchomej:
)
(
2
2
p
pi
i
p
i,
ext
i
L
i
e
i
R
r
c
c
a
k
'
F
x
c
D
x
c
u
t
c
Bilans mas
Bilans mas
y
y
w nieruchomym filmie p
w nieruchomym filmie p
łynu w porach:
łynu w porach:
r
c
r
r
r
D
t
q
"
F
t
c
pi
p
effi
i
pi
2
2
1
gdzie:
;
1
e
e
'
F
p
p
''
F
1
Solid phase
Bondary Layer
D
effi
c
i
( , )
( , )
,
c
t r
pi
D
k
c c
t r
ext i i
pi
eff
r
�
�
�
�
�
�
�
�
=
-
( , )
0
c
t r
pi
r
�
�
=
dla
t > 0; r = 0 oraz
Model ogólny – GR
Model ogólny – GR
(
(
dla Chromatografii
dla Chromatografii
)
)
c.d.
c.d.
ubytekskl.
akumulacja
natezenie
natezenie
doplywu skl.
odplywu skl.
w wyniku reakcji
skl.
A
A
A
A
�
� �
� �
� �
�
+
=
�
� �
� �
� �
�
�
� �
� �
� �
�
-

Zale
Zale
ż
ż
no
no
ść
ść
mi
mi
ę
ę
dzy porowato
dzy porowato
ś
ś
ciami uk
ciami uk
ł
ł
adu
adu
t
t
,
,
e
e
,
,
p
p
:
:
p
e
e
t
)
1
(
gdzie:
t
,
e
,
p
są odpowiednio porowatością całkowitą, zewnętrzną oraz
wewnętrzną układu;
Dyfuz
Dyfuz
y
y
j
j
ność
ność
wewn
wewn
ę
ę
trzna
trzna
obliczana
obliczana
jest nast
jest nast
ę
ę
puj
puj
ą
ą
co:
co:
mi
p
p
mi
p
pi
D
D
D
2
2
2
D
D
ef
ef
jest
efektywnym
jest
efektywnym
wsp
wsp
ół
ół
czynnikiem dyfuzji
czynnikiem dyfuzji
w porach:
w porach:
C
pi
*
i
si
p
p
pi
effi
c
d
q
d
D
D
D
1
Do równa
Do równa
ń
ń
bilansów masy w modelu GR nale
bilansów masy w modelu GR nale
ż
ż
y do
y do
łą
łą
czy
czy
ć
ć
równani
równani
a:
a:
- zależności pomiędzy stężeniem powierzchniowym a stężeniem w płynie w
postaci:
równania kinetycznego lub równania izotermy adsorpcji
w przypadku gdy kinetyka jest szybka:
- warunki początkowe oraz warunki brzegowe całkowania dla
chromatografii.
;
p
c
f
q
i
;
p
c
f
q
*
i
Model ogólny – GR
Model ogólny – GR
(
(
dla Chromatografii
dla Chromatografii
)
)
c.d.
c.d.
Dynamika adsorpcji

R
r
s
c
c
p
c
c
,
p
sc
c
c
c
,
p
k
w
c
*
Lc
c
e
c
T
T
a
c
'
F
T
T
c
d
x
T
D
x
)
T
(
u
t
T
4
2
2
Model ogólny – GR
Model ogólny – GR
(
(
dla
dla
Adsorpcji
Adsorpcji
)
)
uzupełnienie
uzupełnienie
Bilans
Bilans
ciepła
ciepła
w fazie ruchomej:
w fazie ruchomej:
Bilans
Bilans
ciepła
ciepła
w
w
ziarnie adsorbentu
ziarnie adsorbentu
:
:
gdzie: - współczynnik dyspersji wzdłużnej w aparacie dla
transportu ciepła;
c
p,c
- ciepło właściwe płynu;
c
-
gęstość płynu
;
c
-
współczynnik wnikania ciepła od płynu do powierzchni adsorbentu;
w
-
współczynnik wnikania ciepła od płynu do ściany aparatu
; T
c
-
temperatura cieczy
; T
s
-
temperatura zewnętrznej powierzchni
adsorbentu;
T
sc
- temperatura ściany;
d
k
-
średnica aparatu.
D
Lc
*
t
q
c
H
r
T
r
r
T
c
t
T
s
s
,
p
s
s
s
s
,
p
,
es
s
2
2
2
0
gdzie:
es0
- efektywny współczynnik przewodzenia ciepła w ziarnie;
c
p,s
-
ciepło właściwe ciała stałego;
s
-
gęstość ziarna
;
H -
ciepło
adsorpcji.
+ warunki początkowe oraz warunki brzegowe całkowania dla adsorpcji.
Dynamika adsorpcji

W rozdz. VII pkt 7.4 cytowanej poniżej książki - podano
rozwiązania analityczne modelu
dynamiki ad
dynamiki ad
sorpcji
sorpcji dla
wybranego aparatu i odpowiednich, założonych uproszczeń
modelu.
Takie analityczne rozwiązania modelu pozwalają poznać jak
zachowa się proces w odpowiedzi na konkretny sygnał wlotowy –
mimo tego, że są to w większości przypadków rozwiązania za
mało dokładne!
Dynamika adsorpcji
Rozwiązania analityczne modelu dynamiki adsorpcji
Rozwiązania analityczne modelu dynamiki adsorpcji
R. Petrus; G. Aksielrud; J. Gumnicki; W. Piątkowski – „ Wymiana masy w układzie ciało
stałe – ciecz” , podrozdz. 7.2.3.

Proces nazywany
adsorpcją
adsorpcją jest procesem złożonym z
szeregowo – równoległych procesów cząstkowych. Należy szukać
i stawiać hipotezę
mechanizmu
mechanizmu tego procesu dla każdego,
badanego przypadku. Jednym z punktów tej hipotezy jest
założenie, który z procesów cząstkowych jest natychmiastowy,
szybki, a który wolny, bardzo wolny – czyli który z procesów jest
„
mechanizmem kontrolującym
mechanizmem kontrolującym” szybkość
procesu ogólnego
procesu ogólnego.
W adsorpcji oraz chromatografii wszystkie kombinacje,
który z procesów cząstkowych kontroluje szybkość ogólną
procesu są możliwe. Za pomocą modelu GR oraz różnych
zakładanych mechanizmów sorpcji można interpretować
dane doświadczalne, weryfikować hipotezę mechanizmu i
oceniać dokładność modelu.
Dynamika adsorpcji
Na
ogólną szybkość procesu adsorpcji
ogólną szybkość procesu adsorpcji mogą mieć wpływ
szybkości następujących etapów:
1. wnikania masy adsorptywu A od płynu do zewnętrznej
powierzchni adsorbentu (
dyfuzji zewnętrznej
dyfuzji zewnętrznej),
2. dyfuzji adsorptywu poprzez porowatą strukturę adsorbentu do
wnętrza ziarna (
dyfuzji wewnętrznej
dyfuzji wewnętrznej),
3. adsorpcji składnika A na powierzchni adsorbentu (
procesu
procesu
powierzchniowego adsorpcja-desorpcja
powierzchniowego adsorpcja-desorpcja).

Kinetyka procesu
)
(
p
pi
i
p
i,
ext
A
R
r
c
c
a
k
'
F
'
N
Szybkość
dyfuzji zewnętrznej
dyfuzji zewnętrznej
–
wnikania masy
w płynie na zewnątrz ziarna
R. Petrus; G. Aksielrud; J. Gumnicki; W. Piątkowski – „ Wymiana masy w układzie ciało
stałe – ciecz” , podrozdz. 7.2.3.
r
c
r
r
r
D
'
N
pi
p
effi
A
2
2
1
Szybkość
dyfuzji wewnętrznej
dyfuzji wewnętrznej
– dyfuzji w porach ziarna adsorbentu
Szybkość
procesu powierzchniowego
procesu powierzchniowego
adsorpcja- desorpcja
)
(
1
1
S
A
k
k
S
A
-
i
i
i
i
pi
i
A
q
k
)
q
q
(
c
k
'
N
1
1
i
*
pi
ri
i
q
q
c
K
k
i
)
1
(
1
To są przykłady zapisu równań szybkości poszczególnych
procesów cząstkowych w zapisie z
Modelu ogólnego– GR
Modelu ogólnego– GR
(
(
dla
dla
chromatografii
chromatografii
)
)
Przypadek podany dla Langmuira!
Dynamika adsorpcji
Dynamika adsorpcji
Zaletą modelu GR jest możliwość analizowania na jego
podstawie wpływu prawie wszystkich
oporów transportu
oporów transportu
masy
masy
występujących
w
dynamice
dynamice
adsorpcji
adsorpcji
lub
chromatografii
chromatografii
. Jednocześnie model GR jest relatywnie
skomplikowany
a
rozwiązanie
numeryczne
wymaga
stosunkowo długiego czasu komputerowego obliczeń.
W praktyce, w budowie
modelu dynamiki
modelu dynamiki
adsorpcji
adsorpcji
lub
lub
chromatografii
chromatografii
bardzo często stosuje się uproszczenia
modelu GR, które mają w określonych warunkach podobną
dokładność opisu. Rozwiązania tych uproszczonych modeli są
wystarczające do opisu rzeczywistości
adsorpcji
adsorpcji
lub
chromatografii
chromatografii
, ale otrzymuje się je znacznie szybciej.

Model Równowagowo-
Model Równowagowo-
D
D
yspersyjny
yspersyjny
(ED)
(ED)
Z
Z
a
a
ł
ł
o
o
ż
ż
enia upraszczaj
enia upraszczaj
ą
ą
c
c
e:
e:
(*) wszystkie opory procesów cząstkowych ruchu masy „ukryte” w D
a
,
(*) układ osiąga równowagę termodynamiczną procesu
powierzchniowego praktycznie natychmiast.
R
R
óż
óż
niczkowy bilans masy dla
niczkowy bilans masy dla
i
i
-tego sk
-tego sk
ł
ł
adnika w
adnika w
fazie ruchomej:
fazie ruchomej:
2
2
x
c
D
x
c
w
t
q
F
t
c
m
i
a
m
i
*
i
m
i
;
1
t
t
F
;
2
N
a
D
L
w
a
(6)
gdzie:
t
u
w
Dynamika chromatografii
Modele uproszczone
Model Kinetyczno-Dyspersyjny
Model Kinetyczno-Dyspersyjny
(
(
TD
TD
)
)
2
2
x
c
D
x
c
w
t
q
F
t
c
i
t
L
e
i
i
i
R
R
óż
óż
niczkowy bilans masy dla
niczkowy bilans masy dla
i
i
-tego sk
-tego sk
ł
ł
adnika w fazie
adnika w fazie
ruchomej:
ruchomej:
(7)
Kinetyka zewnętrznego i wewnętrznego transportu masy a także kinetyka
procesu powierzchniowego adsorpcja-desorpcja są przedstawione łącznie za
pomocą równania szybkości procesu:
)
(
*
i
i
mi
i
q
q
k
t
q
gdzie:
k
mi
jest zastępczym współczynnikiem przenikania masy
(8)
Model
Model
Reakcyjno-Dyspersyjny
Reakcyjno-Dyspersyjny
(
(
RD
RD
)
)
i
i
i
i
pi
i
i
q
k
q
q
c
k
t
q
1
1
)
(
(9)
gdzie: jest pojemnością adsorbentu (maksymalnym pokryciem złoża
miejscami aktywnymi);
jest stałą równowagi
adsorpcyjnej:
i
*
pi
ri
i
q
q
c
K
k
i
)
1
(
1
i
i
ri
k
k
K
1
1
i
q

Model
Model
Idealny
Idealny
(I
(I
D
D
)
)
0
x
c
w
t
q
F
t
c
i
*
i
i
(10)
Bilans masowy tego modelu jest
Bilans masowy tego modelu jest
nast
nast
ę
ę
puj
puj
ą
ą
cy:
cy:
MODELE DYSKRETNE
MODELE DYSKRETNE
–
–
Model Craiga
Model Craiga
Równanie bilansu masowego w modelu Craiga dla
Równanie bilansu masowego w modelu Craiga dla
i
i
-
-
tego
tego
sk
sk
ł
ł
adnika w
adnika w
j
j
-
-
tym stopniu teoretycznym oraz w
tym stopniu teoretycznym oraz w
k
k
-
-
tym etapie:
tym etapie:
0
1
1
1
k
j
,
i
k
j
,
i
k
j
,
i
k
j
,
i
q
q
F
c
c
'
'
a
k
k
0
0
c
1
N
N
Związek pomiędzy ilością stopni
teoretycznych N
c
a sprawnością
kolumny N
a
(model ED):
(11)
(12)

PORÓWNANIE ROZWI
PORÓWNANIE ROZWI
Ą
Ą
ZA
ZA
Ń
Ń
ANALITYCZNYCH
ANALITYCZNYCH
MODELI GR ORAZ ED
MODELI GR ORAZ ED
(13)
e
p
p
ex
e
eff
e
p
e
a
k
'
F
u
k
k
k
'
F
d
u
D
'
F
d
u
k
k
u
D
L
t
p
L
w
a
D
1
2
1
1
2
2
1
6
60
1
2
2
N
ED
HETP
GR
HETP
2
2
HETP
p
p
d
u
u
d
c
b
a
Równanie Van
Równanie Van
Deemtera
Deemtera
a = 2
2
e
; b = 2
1
e
D
m
;
eff
e
'
D
F
k
k
60
1
1
2
2
1
1
c
(14)
gdzie:
PORÓWNANIE ROZWI
PORÓWNANIE ROZWI
Ą
Ą
ZA
ZA
Ń
Ń
ANALITYCZNYCH
ANALITYCZNYCH
MODELI GR
MODELI GR
ORAZ
ORAZ
T
T
D
D
(15)
m
'
t
e
'
'
e
L
k
k
u
k
k
u
D
0
2
0
0
1
2
2
TD
HETP
GR
HETP
eff
p
'
e
t
m
D
d
F
k
60
1
2
1
A
2
0
0
2
1
1
0
1
1
1
'
'
'
k
k
k
k
k
A
Porównując równania (14) oraz (15) otrzymuje się (16):
(16)
gdzie:
)
(
*
i
i
mi
i
q
q
k
t
q
(8)

PRZYK
PRZYK
Ł
Ł
AD ZASTOSOWANIA ZMODYFIKOWANEGO MODELU GR
AD ZASTOSOWANIA ZMODYFIKOWANEGO MODELU GR
(*) opór wnikania masy na zewnątrz ziarna dąży do 0,
(*) opór dyfuzji powierzchniowej dąży do 0 – r-nie (3) przechodzi w
postać (17),
(*) z uwagi na wielowarstwową adsorpcję porowatość wewnętrzna
złoża
p
jest
zmienna i zależy od stężenia składnika chromatografowanego
wewnątrz porów.
Równanie na efektywny wspó
Równanie na efektywny wspó
ł
ł
czynnik dyfuzji w porach:
czynnik dyfuzji w porach:
r
c
D
c
D
p
p
p
p
eff
(17)
Z
Z
ale
ale
ż
ż
no
no
ść
ść
p
p
od st
od st
ęż
ęż
enia sk
enia sk
ł
ł
adnika chromatografowanego:
adnika chromatografowanego:
pi
p
p
p
t
p
p
c
c
a
0
1
(18)
Dodatkowe z
Dodatkowe z
a
a
ł
ł
o
o
ż
ż
enia
enia
mechanizmu sorpcji
mechanizmu sorpcji
upraszczaj
upraszczaj
ą
ą
c
c
e
e
model GR:
model GR:
(*) budowa przestrzenna wypełnienia kolumny monolitycznej składa się
z cylindrycznych porów połączonych ze sobą,
0 . 0 0
0 . 0 5
0 . 1 0
0 . 1 5
0 . 2 0
0 . 2 5
0 . 3 0
0 . 3 5
0 . 0
0 . 2
0 . 4
0 . 6
0 . 8
1 . 0
1 . 2
1 . 4
1 . 6
1 . 8
2 . 0
2 . 2
2 . 4
H
E
P
T
[
c
m
]
*
1
e
-
3
u [c m / s ]
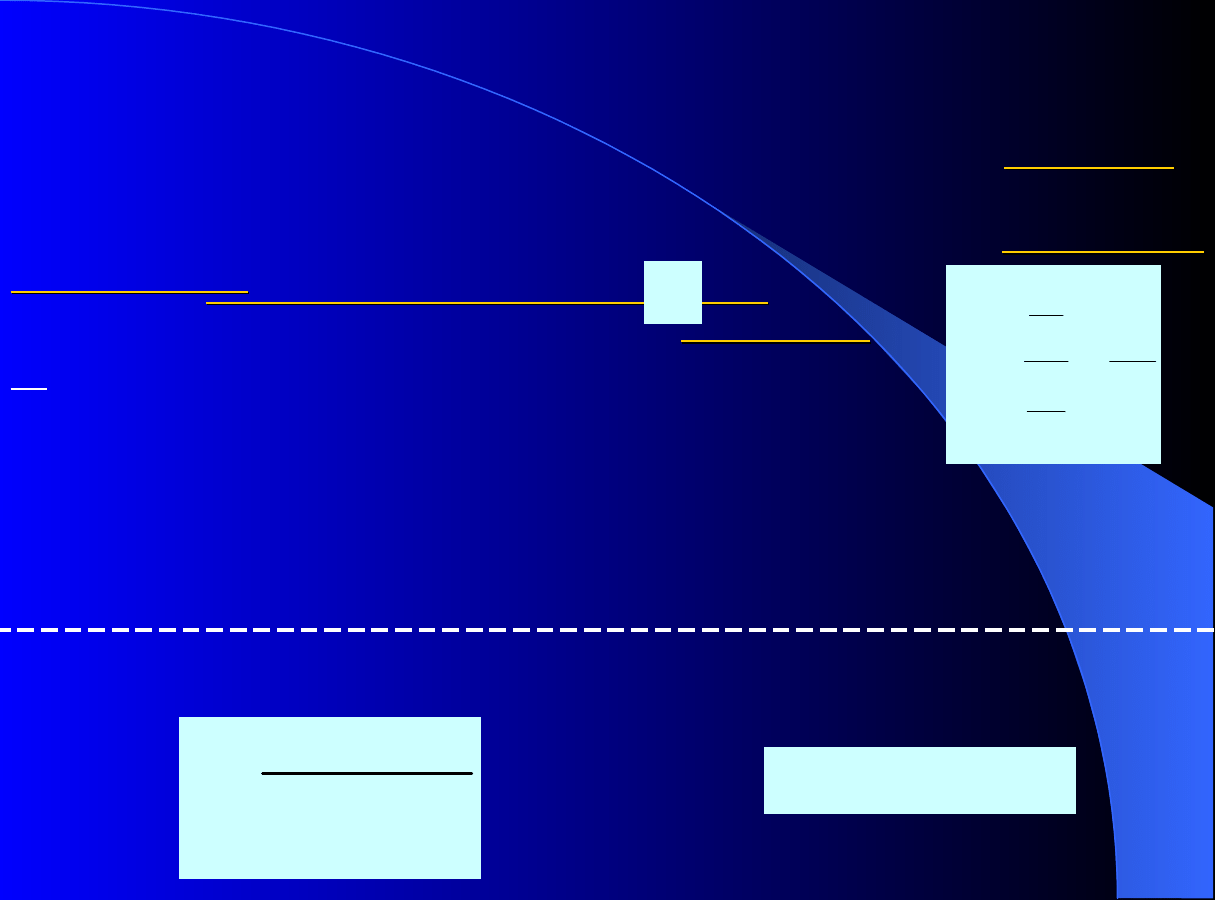
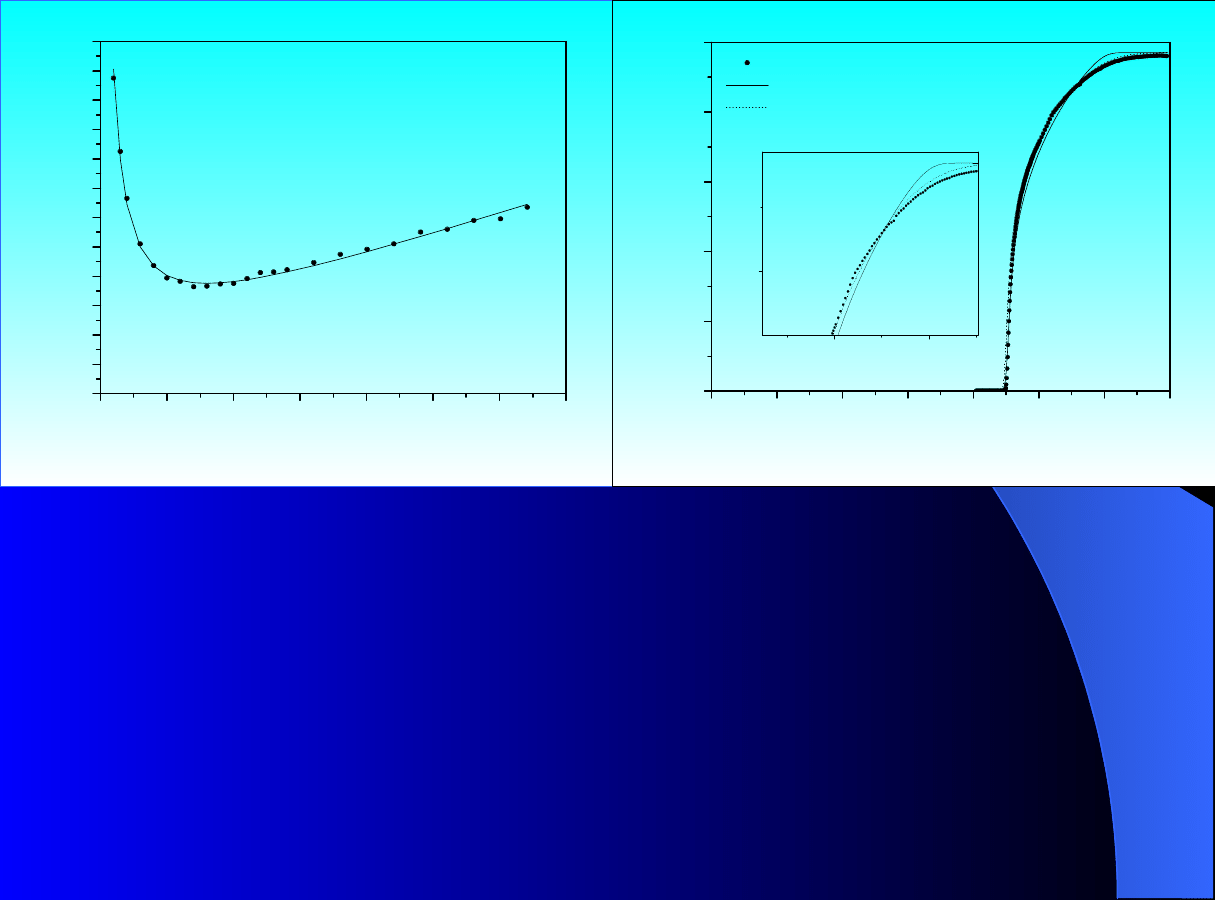
Rys.1.
Porównanie
doświadczalnego
przebiegu
krzywej
Van
Deemtera
oraz
wyników
symulacji
symulacji
modelem
modelem
GR
GR
w przypadku gdy parametry
w przypadku gdy parametry
modelu
zależą
od
zmian
modelu
zależą
od
zmian
porowatości wewnętrznej
porowatości wewnętrznej
p
p
–
linia ciągła. Otrzymano metodą
impulsu przy plateau c = 0
[g/dm
3
] dla benzoesanu butylu,
faza ruchoma 65% vol. roztwór
MeOH w wodzie; punkty –
doświadczenie, linia – symulacja
0
1 0 0
2 0 0
3 0 0
4 0 0
5 0 0
6 0 0
7 0 0
0
2
4
6
8
1 0
5 0 0
6 0 0
8
c
[
g
/d
m
3
]
t [s ]
e x p . d a ta
s i m u la ti o n a )
s i m u la ti o n b )
c
[
g
/d
m
3
]
t [s ]
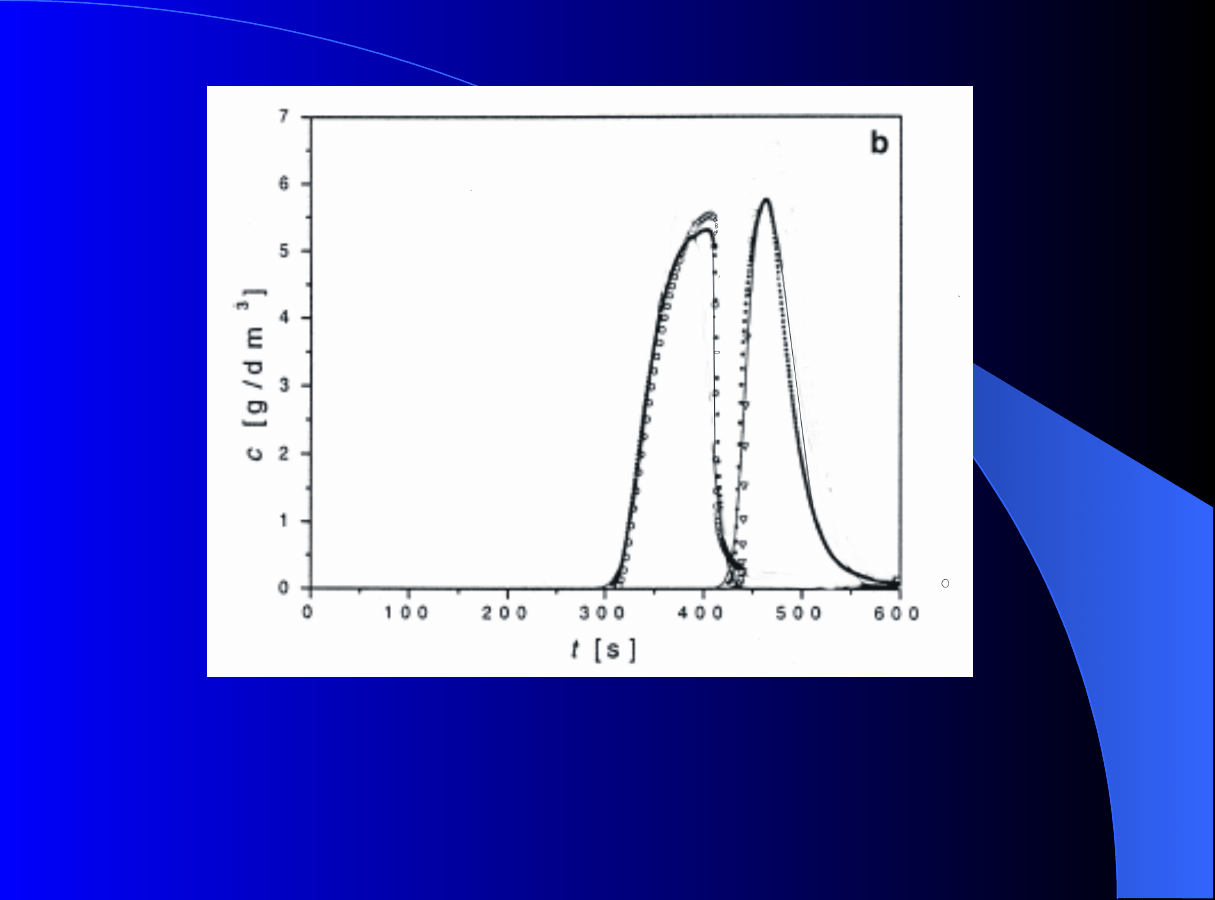
Rys.2.
Porównanie
doświadczalnego
profilu
stężenia (punkty) benzoesanu
butylu oraz wyniku symulacji
modelem
GR
w
dwóch
przypadkach gdy:
a)
parametry modelu nie
parametry modelu nie
zależą od zmian porowatości
zależą od zmian porowatości
wewnętrznej
wewnętrznej
p
p
– linia ciągła;
oraz
b)
b)
parametry modelu zależą
parametry modelu zależą
od
zmian
porowatości
od
zmian
porowatości
wewnętrznej
wewnętrznej
p
p
–
linia
–
linia
przerywana
przerywana
0
mod
c
0
100
200
300
400
500
600
700
800
900
1000
1100
0.0
0.2
0.4
0.6
0.8
1.0
1.2
C
3
2
1
c
[m
ol
/c
m
3
]
1
0
5
t [s]
Rys.3. Porównanie doświadczalnego profilu stężenia (punkty) cholanu metylu
oraz
wyników
symulacji
dla
następujących
stężeń:
składnika
chromatografowanego
c
f
= 1.89*10
-5
[mol/cm
3
], oraz następujących stężeń modyfikatora eluentu:
= 2.83*10
-3
(1); 2.25*10
-3
(2);1.17 *10
-3
[mol/cm
3
] (3); punkty -
doświadczenie; linia ciągła –
symulacje model
symulacje model
a
a
m
m
i
i
TD oraz GR z
TD oraz GR z
estymowaną wartością współczynnika dyfuzji powierzchniowej
estymowaną wartością współczynnika dyfuzji powierzchniowej
D
D
s.
s.
PRZYK
PRZYK
Ł
Ł
AD
AD
(1)
(1)
ZAST
ZAST
ĄPIENIA
ĄPIENIA
MODELU GR
MODELU GR
MODELEM TD
MODELEM TD
PRZYK
PRZYK
Ł
Ł
AD
AD
(2)
(2)
ZAST
ZAST
ĄPIENIA
ĄPIENIA
MODELU GR
MODELU GR
MODELEM TD
MODELEM TD
Rys.4. Porównanie pomiędzy danymi doświadczalnymi i symulowanymi
profilami stężenia dla fenetolu oraz benzoesanu propylu. Faza ruchoma:
65%
vol.
roztwór
metanolu
w
wodzie.
D
m
= 4.87 10
-6
[cm
2
/s]; (a) c
0
= 14.496 [g/cm
3
].
Profile stężenia
symulow
symulow
ane za pomocą modeli: GR oraz TD
ane za pomocą modeli: GR oraz TD
z
z
wprowadzoną
wprowadzoną
izotermą konkurencyjną opartą na pojedynczych
izotermą konkurencyjną opartą na pojedynczych
izoterm
izoterm
ach
ach
BET
BET
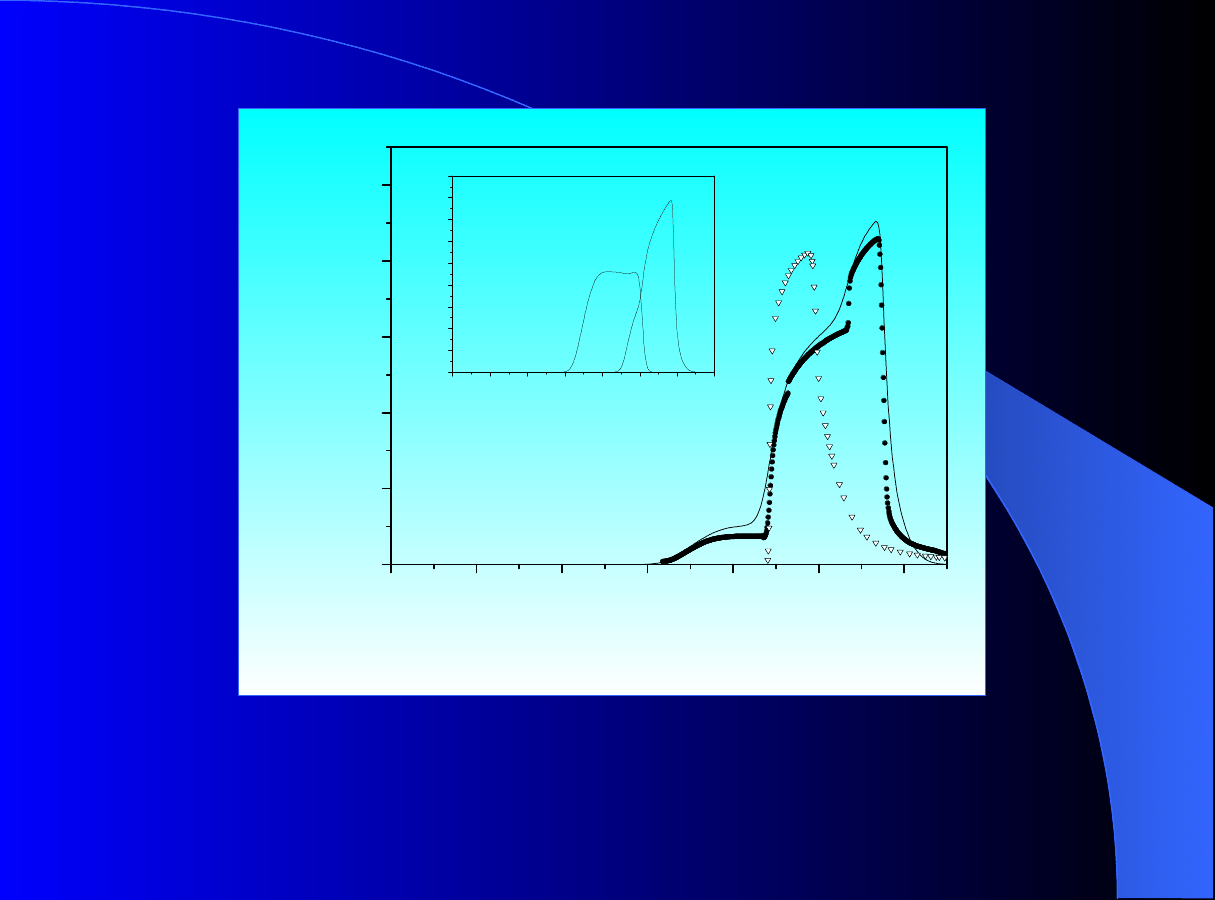
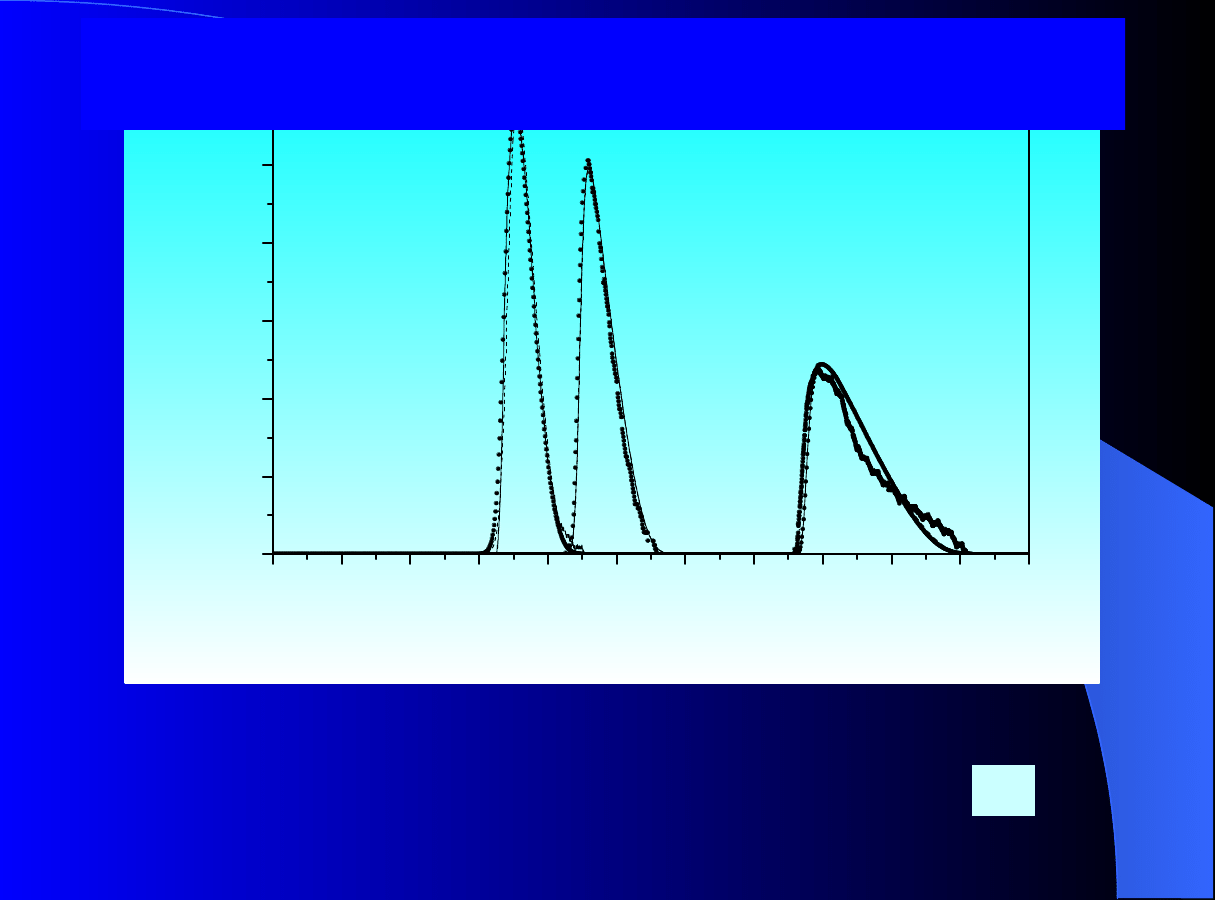
0
100
200
300
400
500
600
0
200
400
600
800
1000
0
1 0 0
2 0 0
3 0 0
4 0 0
5 0 0
6 0 0
7 0 0
0
2
4
6
8
1 0
1 2
1 4
1 6
1 8
t [s ]
c
[
g
/d
m
3
]
m
A
U
t [s]
Rys.6. Porównanie danych doświadczalnych z symulowanymi profilami
stężenia dla mieszaniny fenetolu oraz benzoesanu propylu. Profile
symulow
symulow
ane za pomocą
ane za pomocą
modelu TD z wyprowadzoną na podstawie
modelu TD z wyprowadzoną na podstawie
izoterm pojedynczych BET izotermą konkurencyjną
izoterm pojedynczych BET izotermą konkurencyjną
według teorii
według teorii
IAS.
IAS.
C
01
= C
02
= 12.08 [g/cm3];
P
P
RZYKŁAD ZASTOSOWANIA TEORII IAS
RZYKŁAD ZASTOSOWANIA TEORII IAS
P
P
RZYKŁAD ZASTOSOWANIA TEORII AST
RZYKŁAD ZASTOSOWANIA TEORII AST
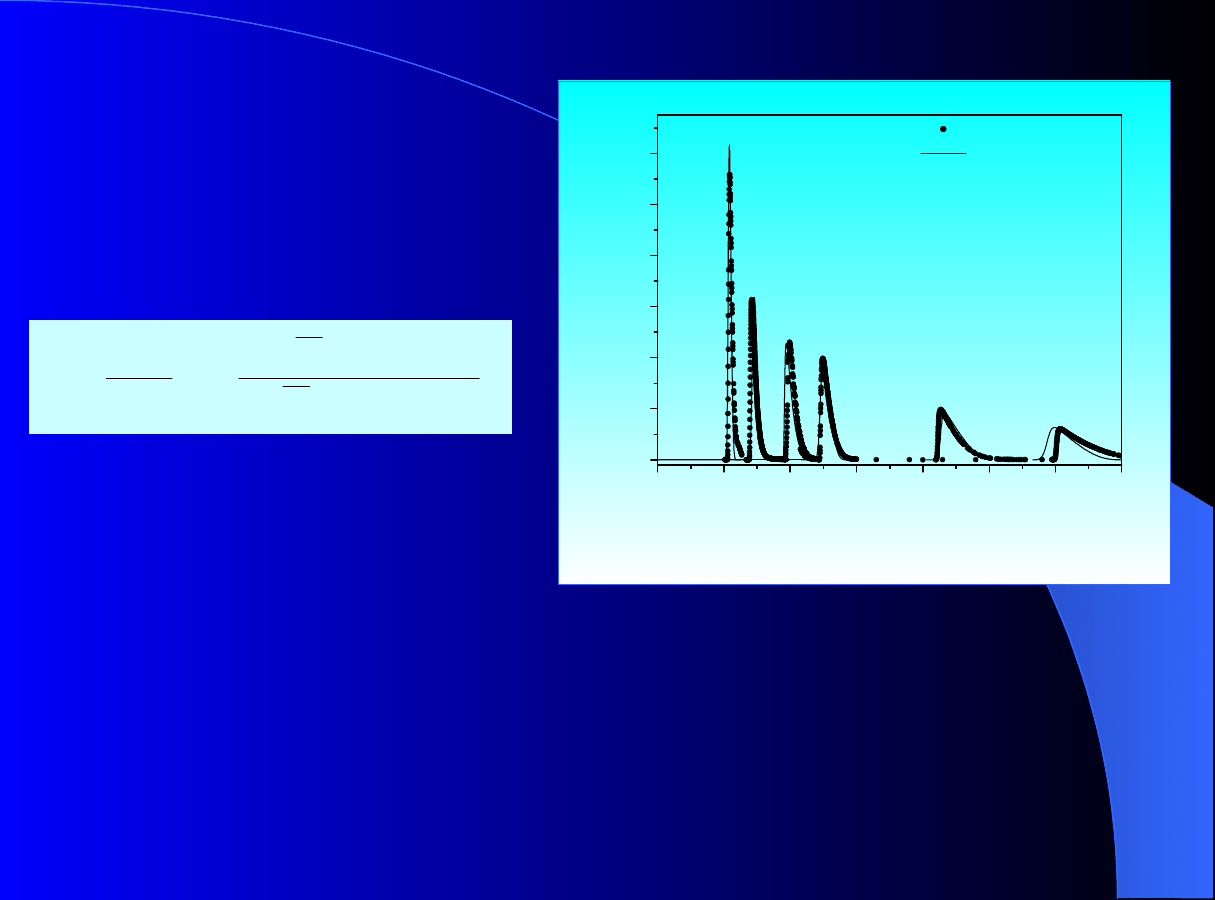
Rys. 7. Porównanie doświadczalnych profili stężenia cyklopentanonu
(C5) rejestrowane przy różnym stężeniu modyfikatora eluentu:
octanu etylu (EA) w fazie ruchomej odpowiednio: x
EA
= 0 (1); 0.066
(2);
0.129
(3);
0.25
(4);
0.364
(5);
1
(6);
eluent EA – n-heksan - z wynikami
symulacji za pomocą
symulacji za pomocą
modelu ED
modelu ED
ze wstawioną izotermą konkurencyjną opartą na
ze wstawioną izotermą konkurencyjną opartą na
teorii AST
teorii AST
otrzymanej
otrzymanej
z
z
nadmiarowych
nadmiarowych
izoterm pojedynczych UNILAN dla
izoterm pojedynczych UNILAN dla
każdego z chromatografowanych składników.
każdego z chromatografowanych składników. Wlotowe stężenie
cyclopentanonu x
C5,F
= 0.053 = const dla wszystkich przebiegów.
0
200
400
600
800
1000
1200
1400
0
1
2
3
4
5
6
C5 - exp.
Unilan isotherm
t [s]
x
A
m
ol
e
ra
tio
*
1e
3
6
4
3
5
2
1
h
a
K
h
a
K
h
2
q
q
i
i
A
*
A
exp
1
exp
1
ln
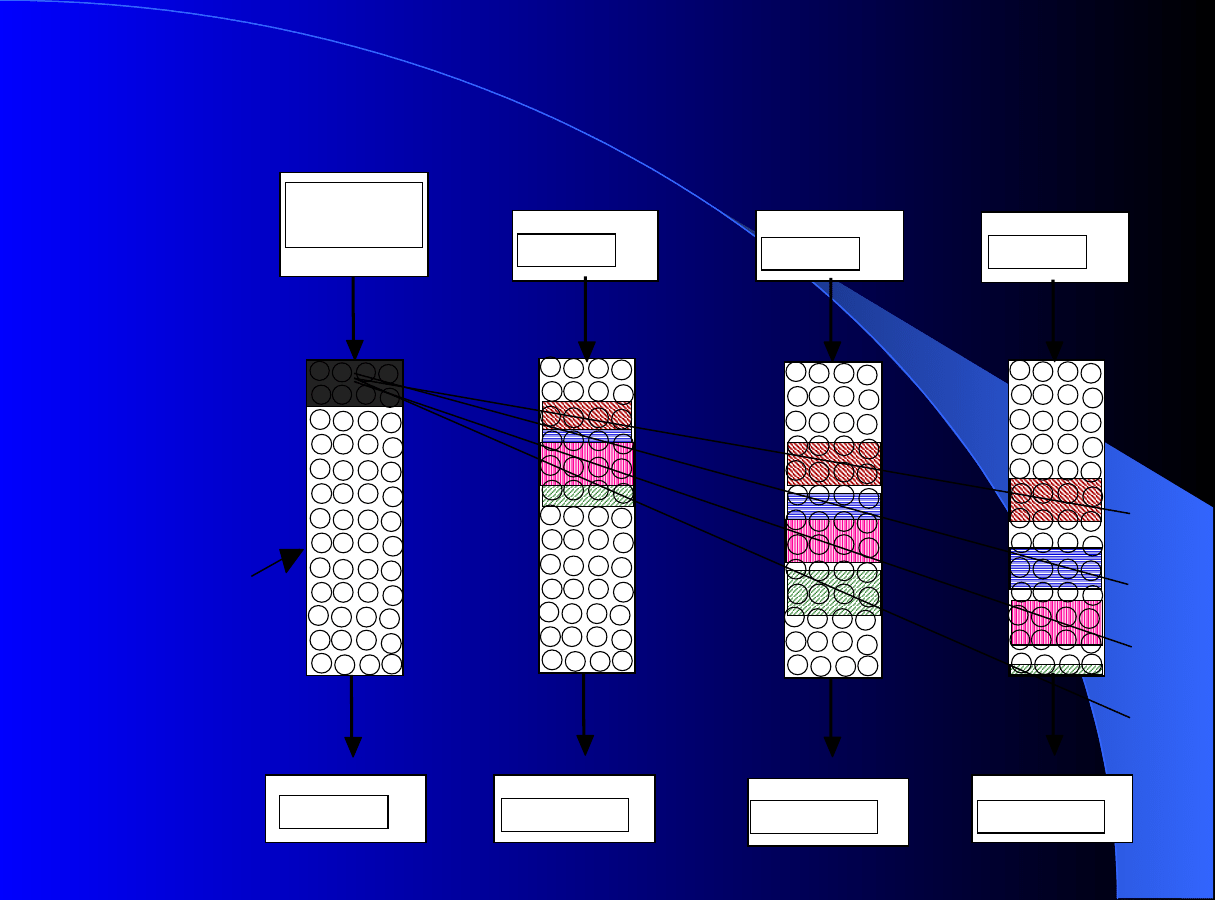
Zasilanie
próbką
Czas: 0
Kolumna
chromatograficzn
a
upakowana
złożem
adsorbentu
Idea chromatografi
Idea chromatografi
i
i
okresow
okresow
e
e
j
j
izokratyczn
izokratyczn
e
e
j
j
Eluent
Czas: 10
Eluent
Czas: 20
Eluent
Czas: 30
Eluent (E)
(A+E)
(B+E)
,
F
e
e
d
(
A
+
B
)
Efluent
C
H
Chromatografia okresowa
Chromatografia okresowa
0
100
200
300
400
500
600
700
0.0
0.2
0.4
0.6
0.8
1.0
1.2
C
on
ce
nt
ra
tio
n
Isocratic elution
0
100
200
300
400
500
600
700
0.0
0.2
0.4
0.6
0.8
1.0
Time [s]
Gradient elution
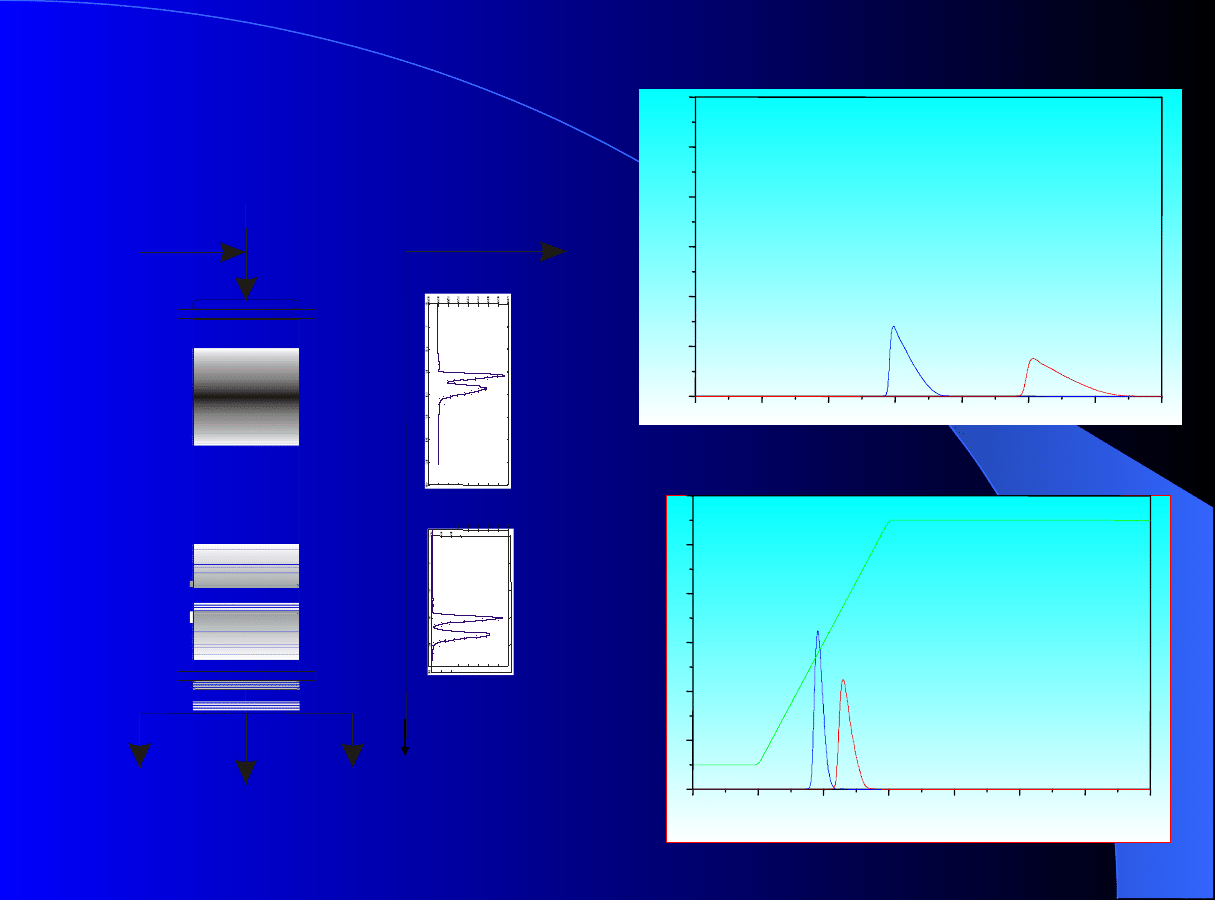
Okresowość a półciągłość procesu chromatografii
Okresowość a półciągłość procesu chromatografii
Chromatografia okresowa
Chromatografia okresowa
Chromatografia cykliczna
Chromatografia cykliczna
Chromatografia cykliczna
Chromatografia cykliczna
100
120
140
160
180
200
220
240
260
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
t
sII
interfraction
t
eII
II fraction
t
eI
t
end
t
sI
C
treshold
I fraction
C
on
ce
nt
ra
tio
n
[g
/l]
Time [s]
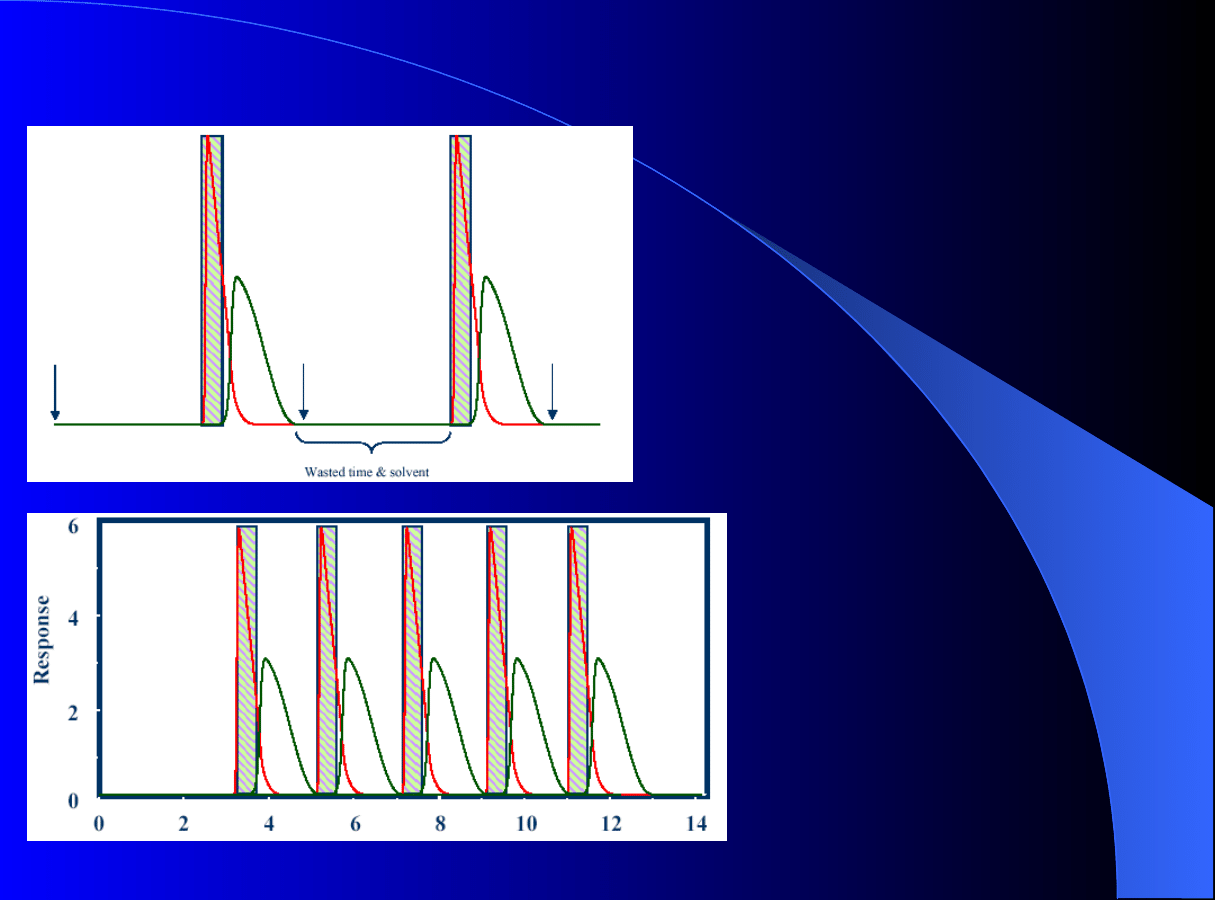
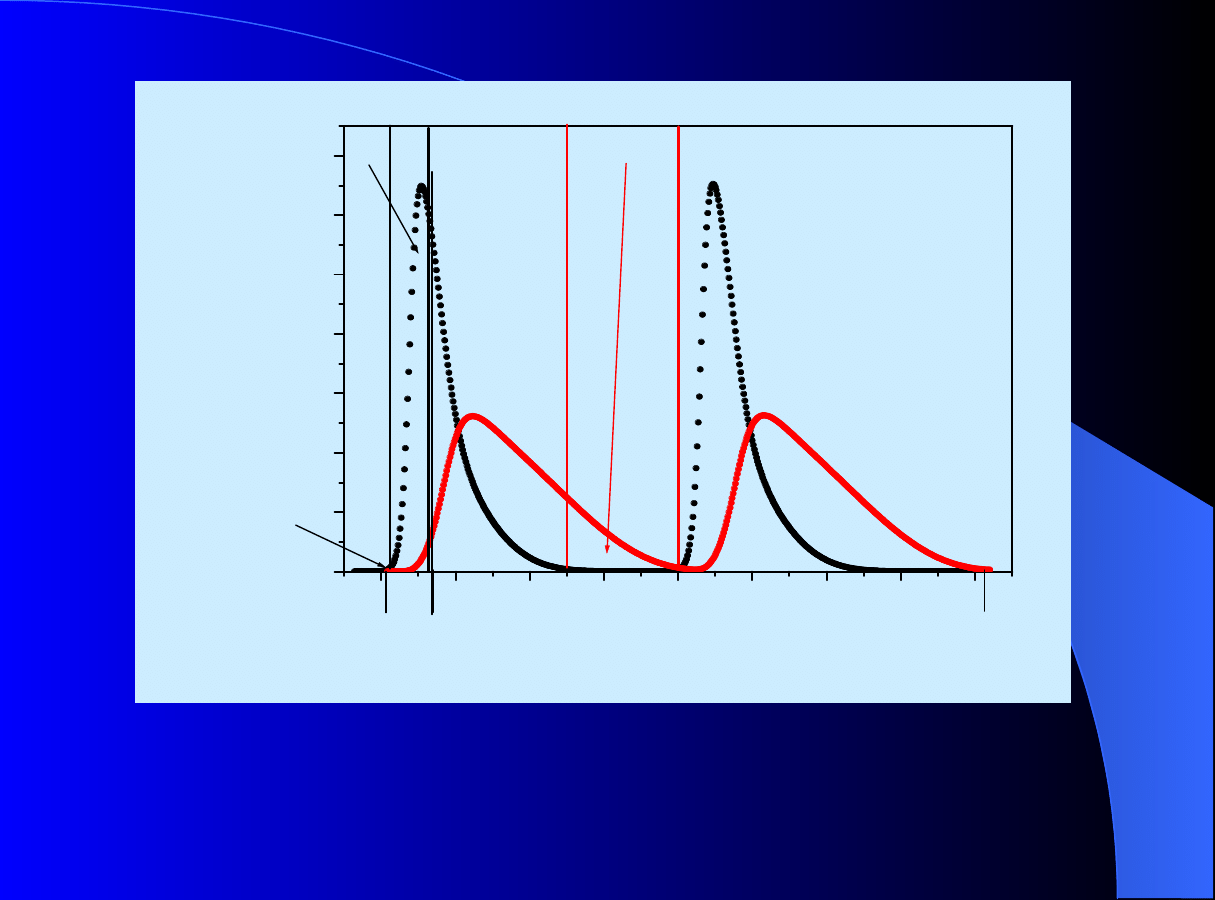
Chromatografia cykliczna
Czas trwania
∆t
c
dla dwóch kolejnych cykli:
∆t
c
= t
end
– t
sI
;
Czas odbioru i-tej frakcji:
∆t
frac
= t
ei
- t
si

ORGANIZACJA PROCEDURY
ORGANIZACJA PROCEDURY
PRZENOSZENIA SKALI
PRZENOSZENIA SKALI
ORAZ
ORAZ
OPTYMALIZACJI
OPTYMALIZACJI
CHROMATOGRAFII
CHROMATOGRAFII
1. Przeprowadzić procedurę budowania modelu dynamiki
chromatografii zaczynając od cyklu badań doświadczalnych na
kolumnie analitycznej:
Wyznaczyć parametry modelu izotermy.
Uzyskać wszystkie inne, potrzebne dane fizykochemiczne dla
optymalizowanego, wieloskładnikowego układu
chromatograficznego.
Wyznaczyć parametry modelu dynamiki procesu. Im bardziej
skomplikowany model dynamiki tym większa ilość parametrów
modelu koniecznych do wyznaczenia.
Wybrać adekwatny typ modelu dynamiki procesu.
2. Podjąć decyzje dotyczące parametrów optymalizacyjnych. W tym
celu należy:
Wybrać funkcję celu oraz składnik kluczowy procesu. Wybrać
ograniczenia i zmienne decyzyjne optymalizacji.
3. Wybrać metodę
optymalizacji
.
c
col
t
i
i
t
F
m
Pr
%
c
V
m
F
,
i
inj
i
i
100
Y
D
D
efini
efini
cje najczęściej używanych w chromatografii
cje najczęściej używanych w chromatografii
funkcji celu:
funkcji celu:
Pr
EC
elu
V
i
i
i
Y
Pr
Pf
Zmienne decyzyjne ci
Zmienne decyzyjne ci
ą
ą
g
g
ł
ł
e oraz zmienne decyzyjne
e oraz zmienne decyzyjne
dyskretne optymalizacji
dyskretne optymalizacji
:
:
mod
c
i
col
t
F
,
i
inj
i
,
f
q
V
c
V
L
1
t
wash
parametr
d
p
2
/L
2
0 p
m
max
d
k
L
u
p
p
Ograniczenia procesu
Ograniczenia procesu
optymalizacji
optymalizacji
:
:
min
i
i
Pu
Pu
2
1
Pu
c
c
c
i
i
produkt
kluczowy
0
200
400
600
800 1000 1200 1400 1600 1800 2000 2200
0.0
0.1
0.2
0.3
0.4
0.5
c
m
[g
/d
m
3
]
t [s]
Rys. 11. Przenoszenie skali
chromatografii:
z
z
kolumn
kolumn
y
y
4
4
mm;
mm;
d
d
p
p
=
=
5
5
m
m
na
na
kolumn
kolumn
ę
ę
10
10
mm
mm
;
;
d
d
p
p
=
=
12
12
m
m
.
.
L
L
= 10cm.
= 10cm.
Mieszanina izomerów cis- (C)
oraz
trans- (T) analogów terpenów.
Symulacja modelem ED;
Symulacja modelem ED;
izoterma konkurencyjna
izoterma konkurencyjna
Langmuira
Langmuira
PRZENOSZENIE SKALI CHROMATOGRAFII
PRZENOSZENIE SKALI CHROMATOGRAFII
OPTYMALIZACJ
OPTYMALIZACJ
A CHROMATOGRAFII
A CHROMATOGRAFII
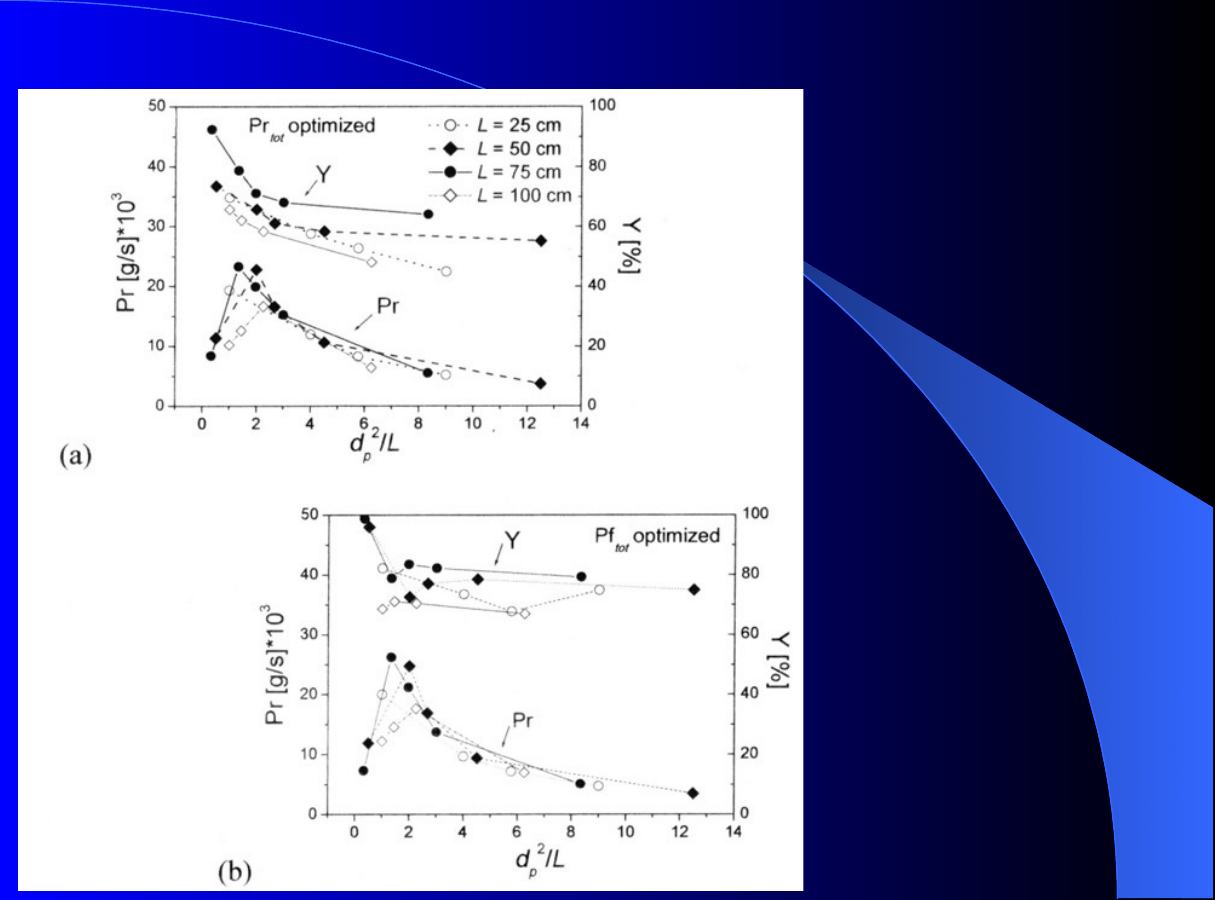
Rys. 11. Wyniki
optymalizacji
chromatografii:
Mieszanina izomerów
cis- (C) oraz
trans- (T) analogów
terpenów.
Symulacja modelem
Symulacja modelem
ED; izoterma
ED; izoterma
konkurencyjna
konkurencyjna
Langmuira
Langmuira
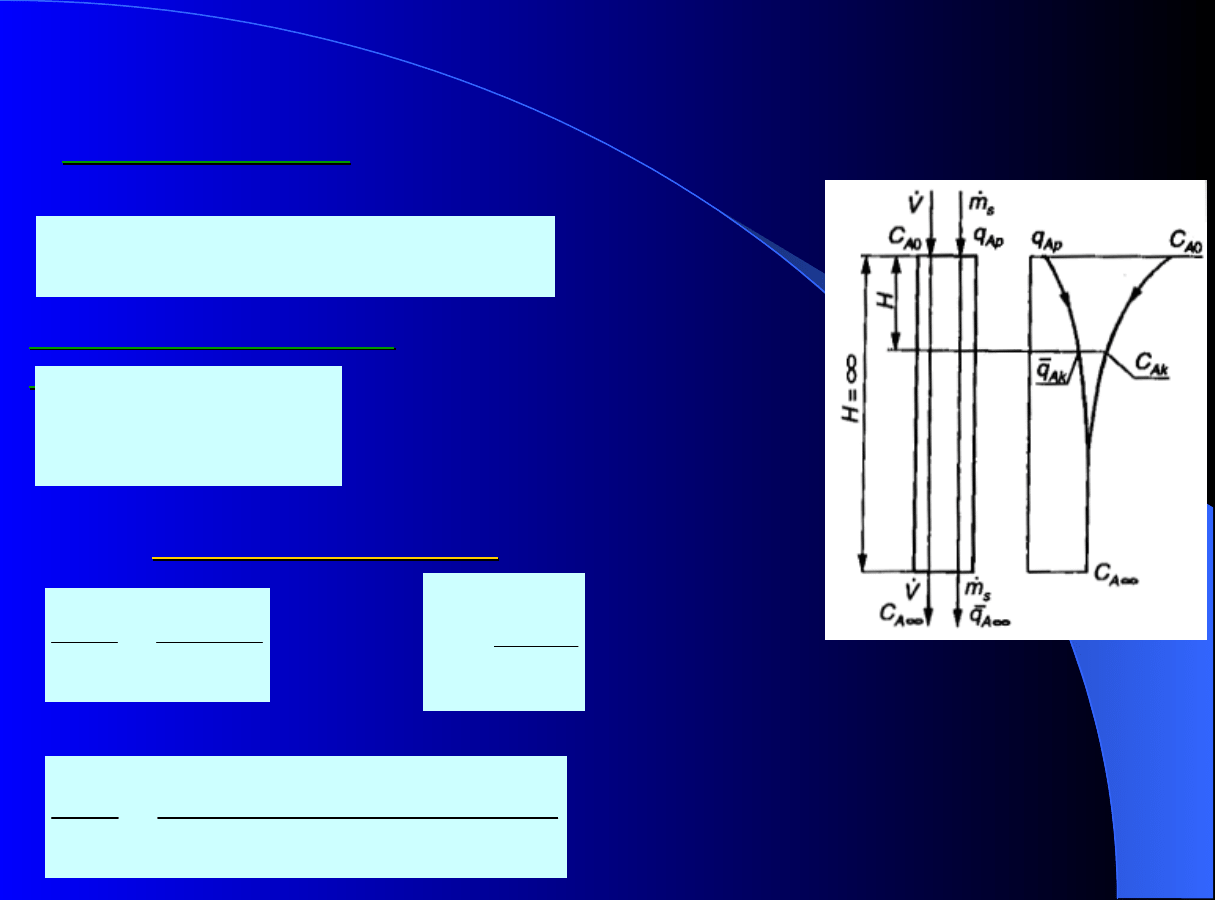
Bila
Bila
ns masowy
ns masowy
dla kolumny od
wlotu do wylotu:
Dynamika adsorpcji ciągłej
Dynamika adsorpcji ciągłej
Ap
Ak
s
Ak
A
A
q
q
m
C
C
V
m
0
S
S
zybko
zybko
ść
ść
transportu
transportu
masy
masy
:
:
A
A
s
z
A
A
A
z
A
*
C
C
A
k
m
*
C
C
k
'
N
Wynik dla
izotermy liniowej
izotermy liniowej
oraz dla
k
C
C
Ak
A0
1
1
'
Adsorber współprądowy
V
H
m
s
'
gdzie:
C
C
Ak
A
k
0
1
31
1
'
'
'
exp[ (
) ]
dla
k
rzeczywistego
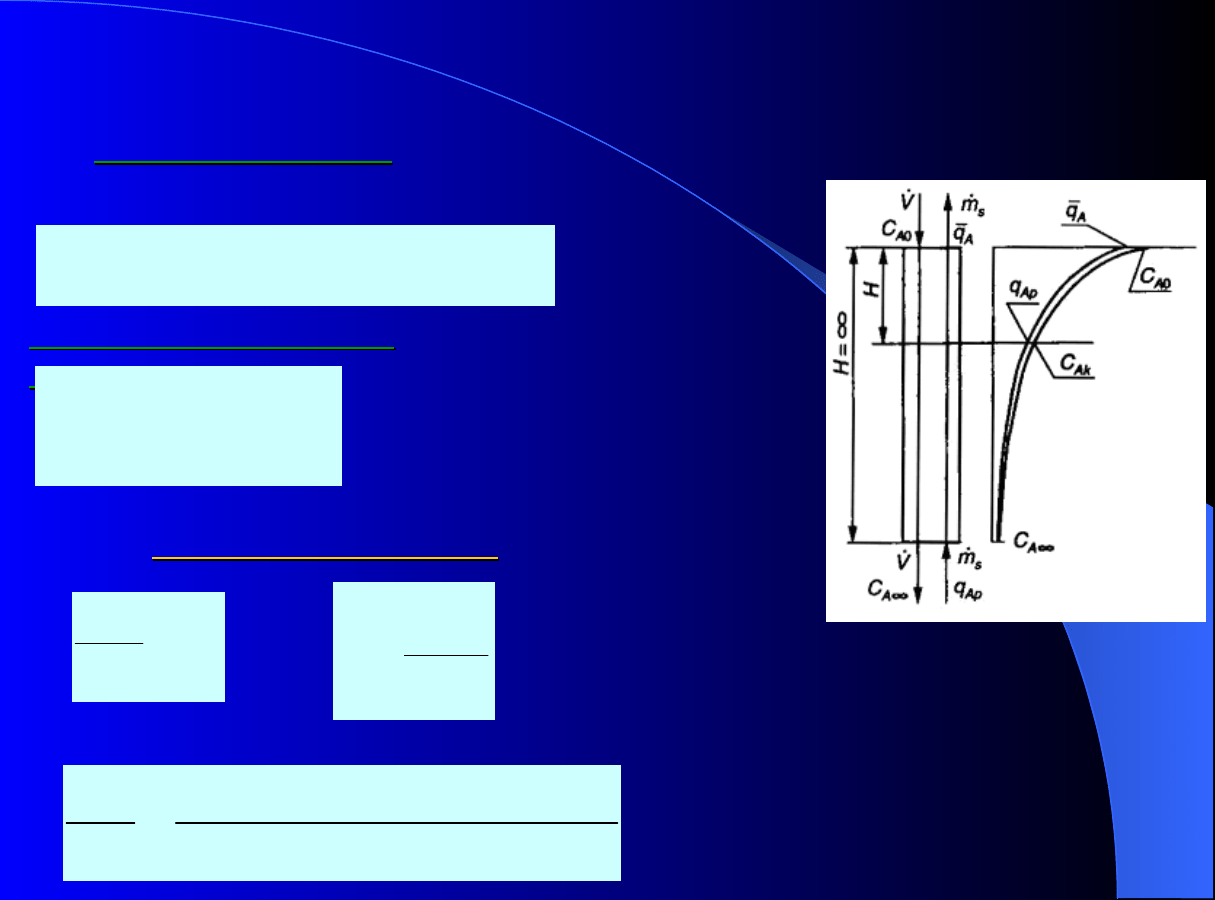
Dynamika adsorpcji ciągłej
Dynamika adsorpcji ciągłej
Adsorber przeciwprądowy
Bila
Bila
ns masowy
ns masowy
dla kolumny
od wlotu do wylotu:
Ak
Ap
s
Ak
A
A
q
q
m
C
C
V
m
0
S
S
zybko
zybko
ść
ść
transportu
transportu
masy
masy
:
:
V
H
m
s
'
gdzie:
C
C
Ak
A0
0
C
C
Ak
A
k
k
0
1
3
1
3
1
(
) exp[
(
) ]
exp[
(
) ]
'
'
'
'
A
A
s
z
A
A
A
z
A
*
C
C
A
k
m
*
C
C
k
'
N
Wynik dla
izotermy liniowej
izotermy liniowej
oraz dla
k
dla
k
rzeczywistego
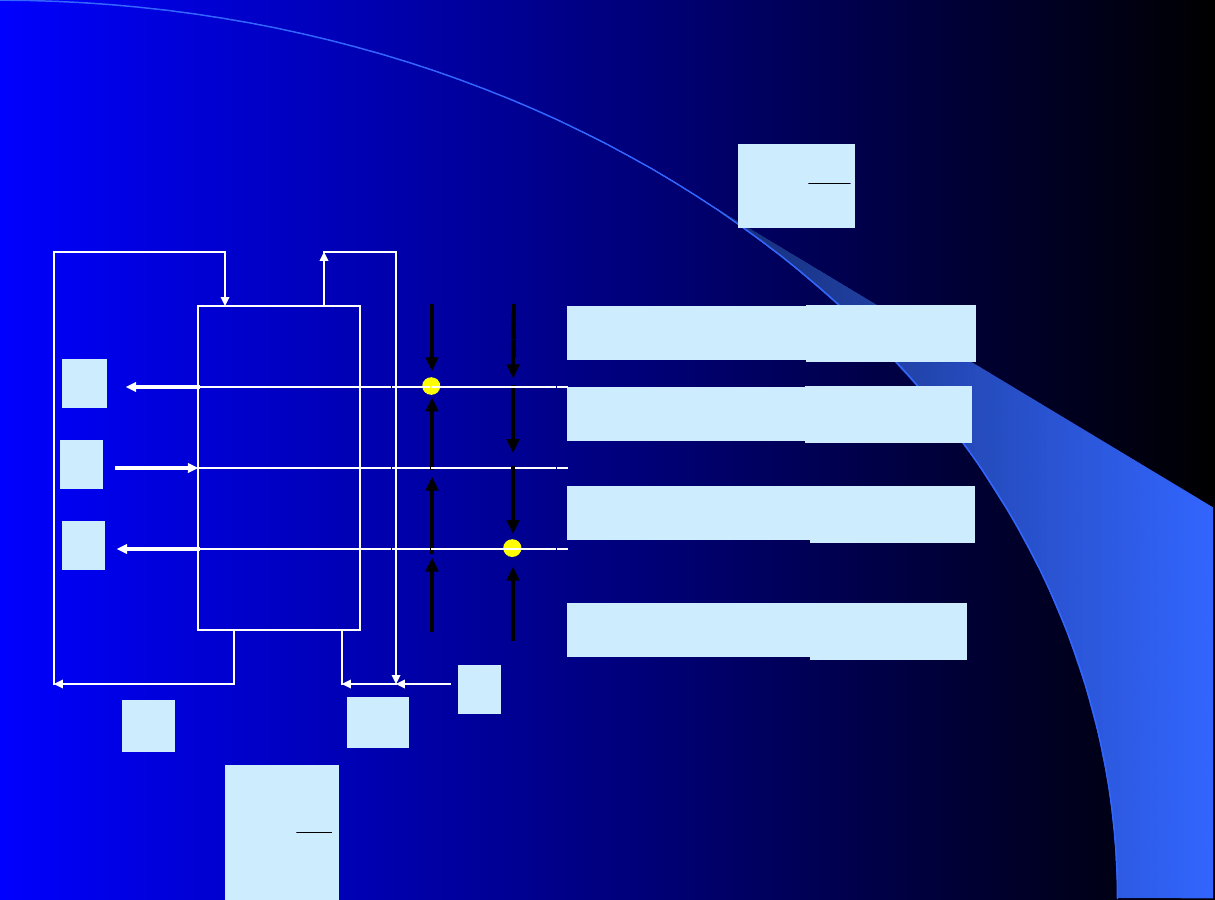
F
V
D
V
R
V
E
V
S
V
K
V
Zone IV
Zone III
Zone II
Zone I
Rozwiązanie dla izotermy liniowej q* = HC
Jeśli:
1
2
H
H
S
j
,
i
1
1
1
C
V
C
H
V
III
s
2
2
2
C
H
V
C
V
s
II
2
II
H
m
1
III
H
m
1
1
1
C
H
V
C
V
S
IV
2
2
2
C
V
C
H
V
I
S
2
I
H
m
1
IV
H
m
m
k
to bezwymiarowy stosunek
przepływów faz w danej strefie: k = I - IV
comp. 1
comp. 2
feed
comp. 1 comp. 2
.
.
s
k
k
V
V
m
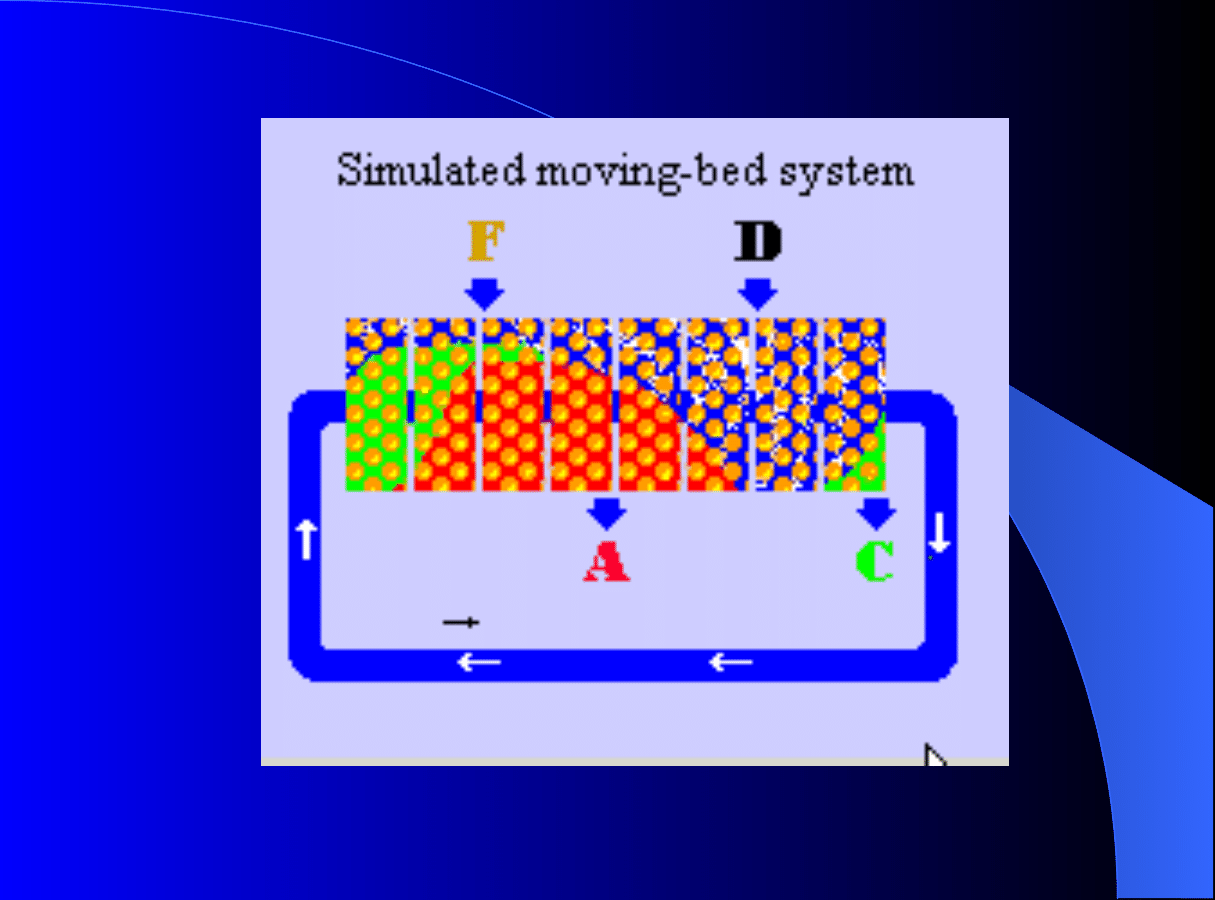
Chromatografia ciągła - TMB
Chromatografia ciągła - TMB
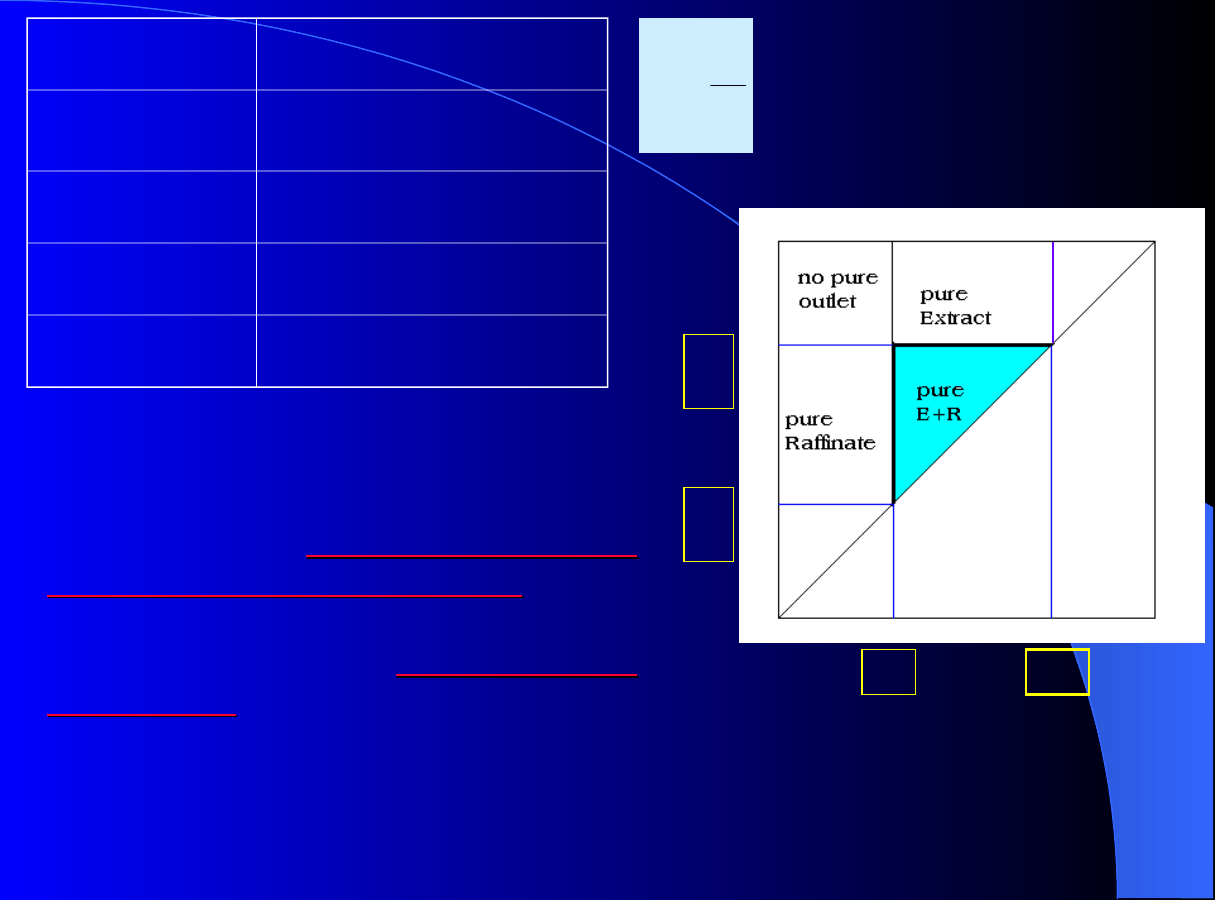
M. Mazzotti, G. Storti, M. Morbidelli, AIChE J, 40 (2004), 1825.
Rys.
pokazuje
graficznie
ograniczenia zred. przepływu m
k
w
strefach II i III a także
rozwiązanie
rozwiązanie
analityczne
analityczne
modelu idealnego
modelu idealnego
dynamiki
chromatografii
dynamiki
chromatografii
w
w
postaci
tzw.
trójkąta
postaci
tzw.
trójkąta
operacyjnego
operacyjnego dla
chromatografii
chromatografii
ciągłej TMB
ciągłej TMB
(SMB).
Trójkąt operacyjny (region pełnego
rozdziału) jest zaznaczony w funkcji
m
k
w
sekcjach II oraz III
Sekcja
m
k
I
m
I
> H
1
; m
I
> H
2
II
H
1
< m
II
< H
2
III
H
1
< m
III
< H
2
IV
m
IV
< H
1
; m
IV
< H
2
H
2
H
1
H
2
m
II
m
III
H
1
.
.
s
k
k
V
V
m
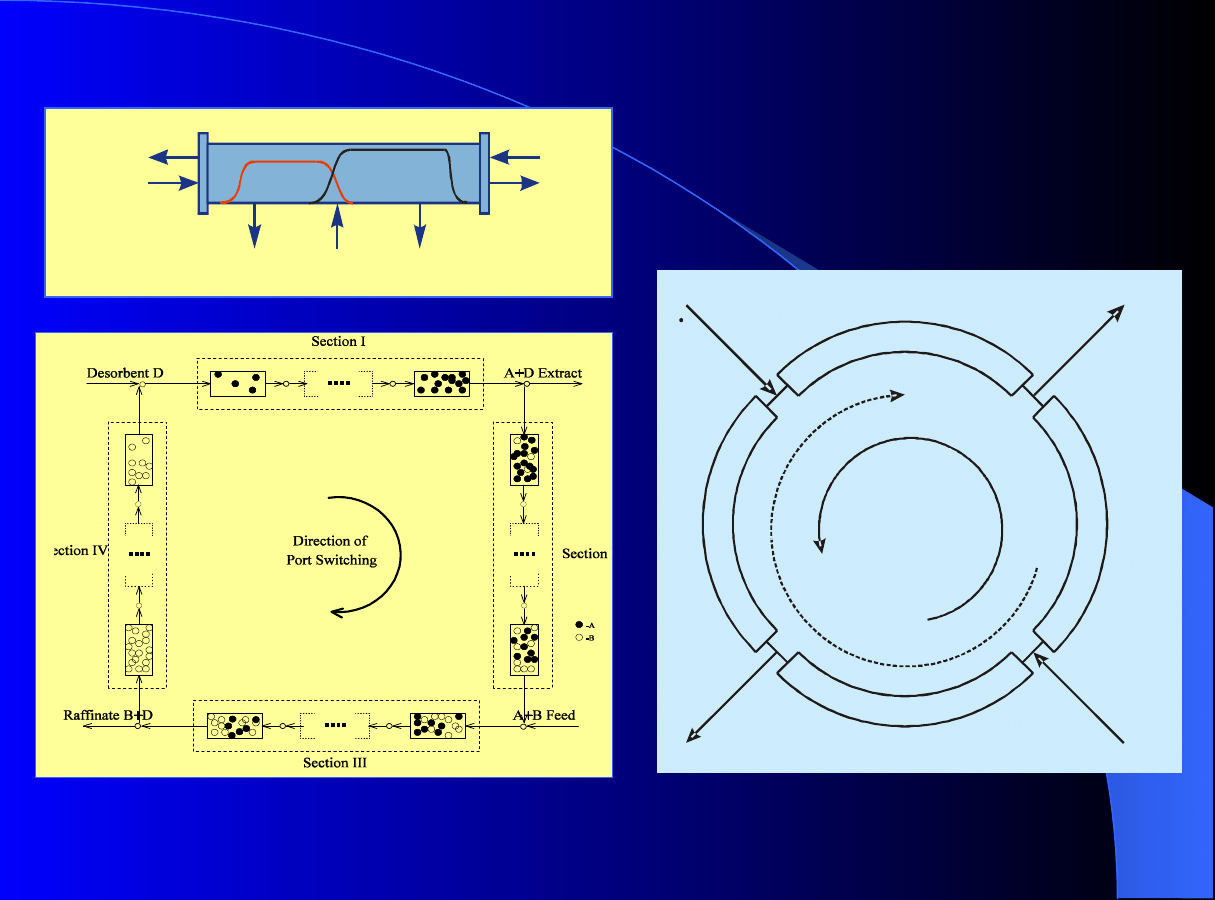
Solid stream
Feed
(A,B)
Extract
(A)
Raffinate
(B)
I
III
IV
II
B
A
Desorbent
Idea symulowanego ruchu złoża - SMB
Idea symulowanego ruchu złoża - SMB
Z o n e I
Z o n e I I I
Zo
ne
IV
Zo
ne
I
I
F e e d ( 1 + 2 )
F
C
m o d , F
V
R a ff i n a t e ( 1 )
V
R
.
F l u i d fl o w
S o l i d fl o w
D e s o r b e n t
m o d , D
C
V
D
.
E x tr a c t ( 2 )
V
.
E
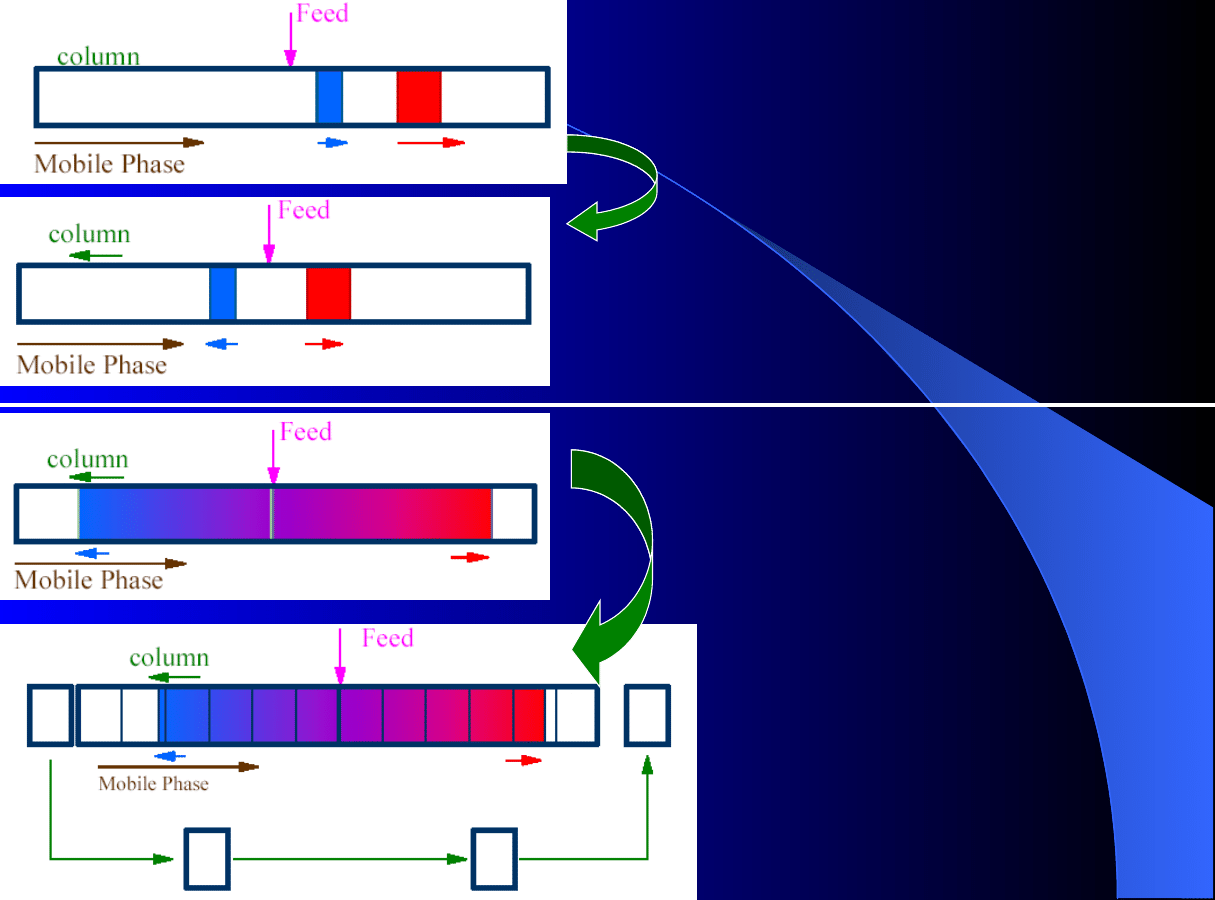
W kolumnie okresowej strumień
zasilający (feed) jest podawany w
centralny punkt kolumny okresowej.
Dwa rozdzielane składniki poruszają
się z różną szybkością i następuje ich
rozdział.
...
względem
nieruchomego
obserwatora.
Jeśli kolumna jest
odpowiednio
długa,
piki
chromatograficzne obu składników
będą rozdzielone.
Ponieważ jest to proces czysto
ciągły,
zaczynają
się
więc
problemy: potrzebuje on kolumny
o nieskończonej długości oraz
dodatkowej
drogi
na
wprowadzenie
oraz
wyprowadzenie
próbki
i
produktów rozdziału.
Modelowanie procesu polega
na podzieleniu kolumny na
małe
segmenty
oraz
symulowaniu
ich
ruchu.
Strumień zasilający (feed) oraz
eluent są teraz wprowadzane
pomiędzy segmenty.
Jeśli teraz nałożymy ruch kolumny
z prawej do lewej, z szybkością
mieszczącą
się
między
szybkościami
poruszania
się
składników,
składniki
zaczną
poruszać
się
w
przeciwnych
kierunkach
...
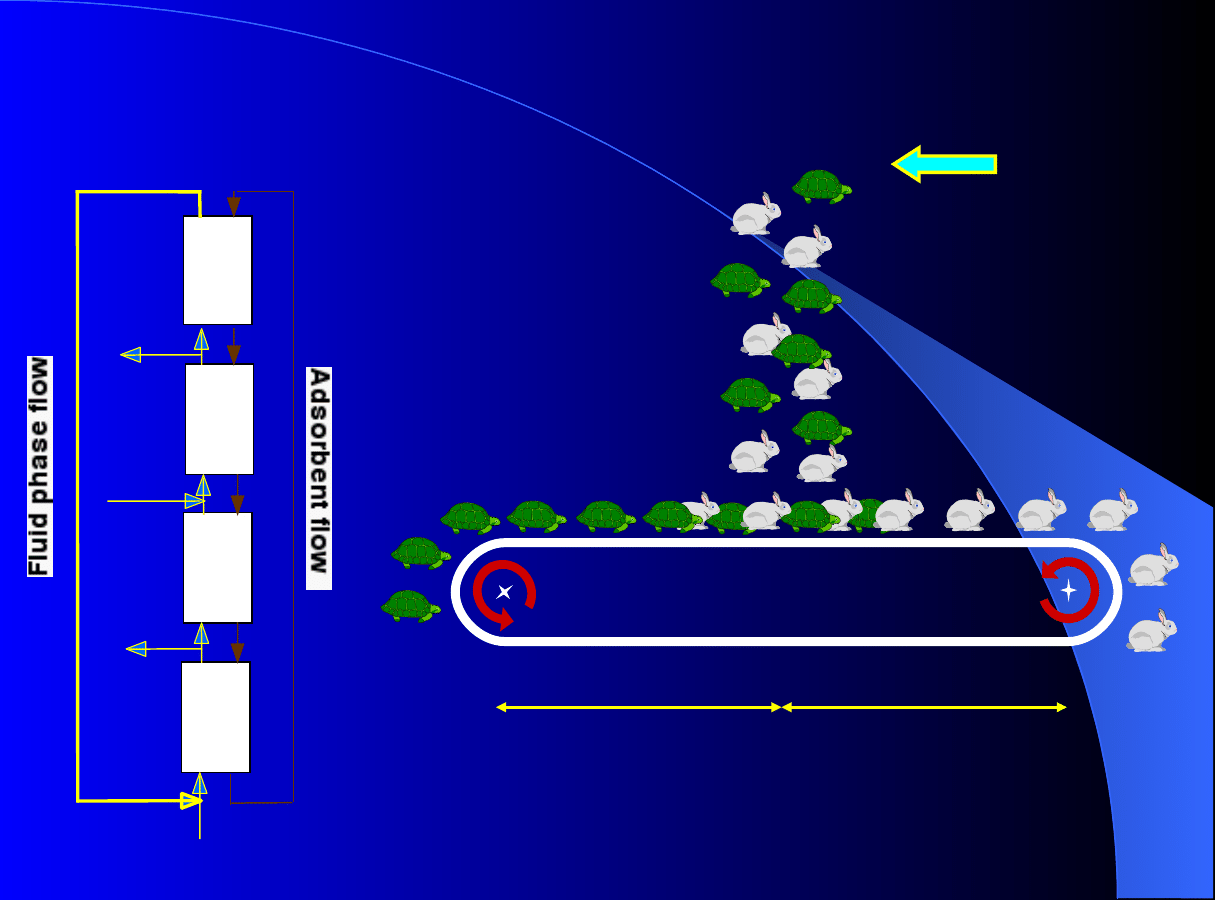
Przeciwprą
Przeciwprą
d
d
owa chromatografia ci
owa chromatografia ci
ą
ą
gła
gła
A+B
A
B
Desorbent
Zone
I
Zone
II
Zone
III
Zone
IV
Zone
II
Zone
III
A
B
A + B

Chromatografia oddziaływań hydrofobowych (HIC)
Podstawowe pojęcia
Jest szeroko wykorzystywana do separacji i oczyszczania
makrocząsteczek białkowych. Białka adsorbowane są na złożu dzięki
występowaniu oddziaływań hydrofobowych fragmentów białka z silnie
hydrofobowymi grupami ligandów, trwale umocowanych na
powierzchni nośnika pozbawionego ładunku elektrycznego. Różne
czynniki mają wpływ na zachowanie się cząsteczek białkowych w
kontakcie z hydrofobowym adsorbentem. Niektóre z nich mają
krytyczny wpływ na rozdzielczość i selektywność metody, a także
zdolność wiązania cząsteczek przez złoże.
Poniżej są wymienione najważniejsze czynniki, jakie mają wpływ na
selektywnośc rozdziału chromatograficznego, takie jak:
- typ liganda oraz jego gęstość na powierzchni nośnika,
- rodzaj nośnika,
- rodzaj i stężenie soli,
- stężenie jonów wodorowych - pH,
- temperatura,
- skład solwentów.

Chromatografia chiralna
Podstawowe pojęcia
Możliwość bezpośredniego
rozdzielenia chiralnych izomerów ma
niezwykle istotne znaczenie w chemii
i to zarówno z analitycznego, jak i
preparatywnego punktu widzenia, a
w szczególnooeci dla preparatów
farmakologicznych oraz w
biotechnologii.
Według najnowszych danych z ponad
200 najczęściej przepisywanych
leków, 114 posiada przynajmniej 1
centrum chiralne, a 25% z nich
sprzedawanych jest w postaci
racemicznej, mimo, że najczęściej
tylko jeden z optycznie czynnych
izomerów wykazuje pożądaną
czynność farmakologiczną, podczas
gdy drugi może być balastem lub
działać wręcz szkodliwie. Klasycznym
przykładem takiego oddziaływania
jest imid kwasu
N-ftaliloglutaminowego znany w
handlu pod nazwą
Talidomid
PREPARATIVE
SEPARATION
METHODS
Preferential Crystallization
Chromatograp
hic methods
Membrane
technologie
s
Other e.g.,
chiral
extraction
Przemysłowy rozdział mieszanin
racemicznych jest bardzo
opłacalny z poniższych powodów::
• rozdział mieszanin enancjomerów
jest
bardzo ważnym procesem w
przemysłach:
farmaceutycznym,
biotechnologicznym czy
agrochemicznym
• ceny chiralnych sustancji czynnych w
farmacji
rosną w stosunku powyżej 13%
rocznie
i obecnie osiągają wartość 200 mld $.
Przewidywania na rok 2009 mówią o
sprzedaży rzędu 300 mld $.
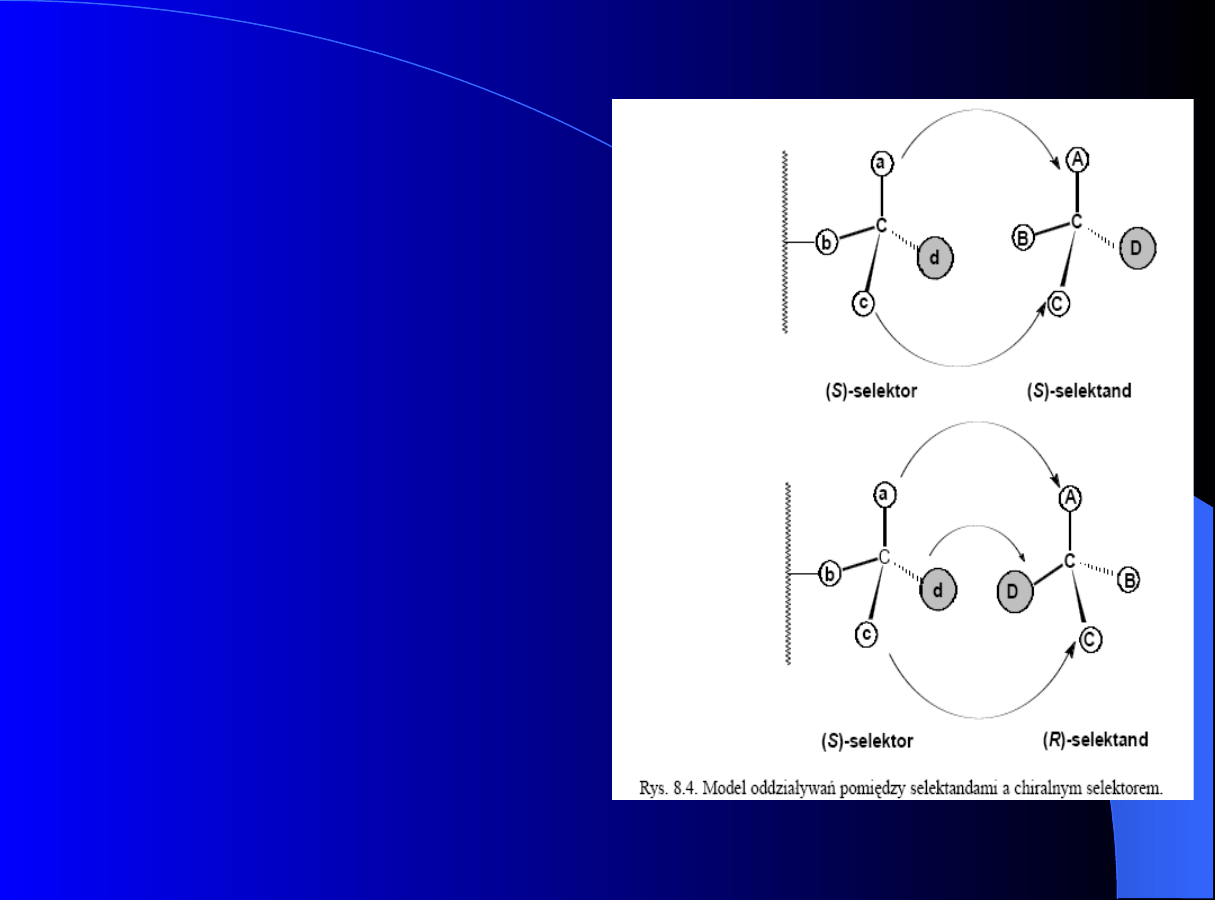
Chromatografia chiralna
Podstawowe pojęcia
Zasada Pirkle
:
aby nastąpiło
chromatograficzne różnicowanie
racemicznych cząsteczek na danej
fazie, niezbędne jest wystąpienie
minimum trzech oddziaływań
pomiędzy enencjomerami a
chiralnym selektorem, przy czym
minimum jedno z tych oddziaływań
powinno być stereochemicznie
zależne, to znaczy zależne od
konfiguracji centrum chiralnego
danego enencjomeru.
Rozdzielenie enancjomerów z
wykorzystaniem techniki HPLC przy
użyciu chiralnych faz stacjonarnych
(CSP - (Chiral Stationary Phases)) lub
chiralnych dodatków do fazy
ruchomej, oparte jest na tworzeniu
się przejściowych
diastereoizomerycznych kompleksów
pomiędzy cz¹steczką różnicującą
(selektorem), będącą elementem CSP
lub chiralnej fazy ruchomej, a
cząsteczką rozdzielanej substancji
(selektandem). Różnica w stabilności
tych kompleksów prowadzi do różnicy
czasów retencji.Enancjomer, który
tworzy mniej trwały kompleks,
szybciej wymywany jest z kolumny.
T0
T1
T2
T3
T4
D
S
L
e = r
D
S
L
T4
T3
T2
T1
T0
e
r
e
T0
T1
T2
T3
T4
e = r
T0
T1
T2
T3
T4
D
e = r
T4
T3
T2
T1
T0
e
r
e
P
2
T4
T3
T2
T1
T0
e
r
e
a)
b)
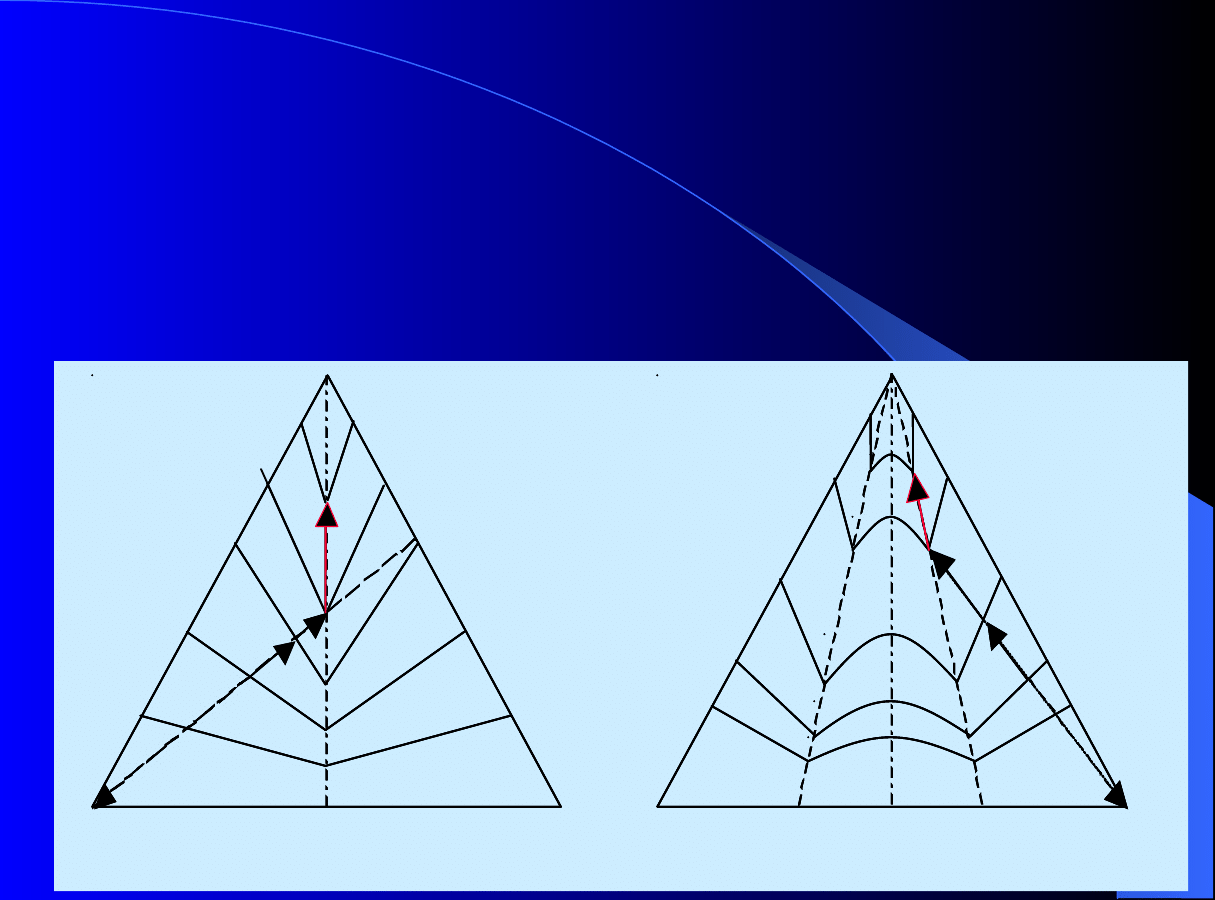
Odpowiednio:
a) układ tworzący
konglomerat
oraz
b) układ tworzący mieszaninę
racemiczną
P
0
P
2
P
3
P
4
P
3
P
4
P
0
P
1
.
.
.
.
Zasada krystalizacji
Zasada krystalizacji
czystego, pożądanego enancjomeru
czystego, pożądanego enancjomeru
poprzez och
poprzez och
ł
ł
odzenie
odzenie
Kompilacja chromatografii i krystalizacji
Podstawowe pojęcia
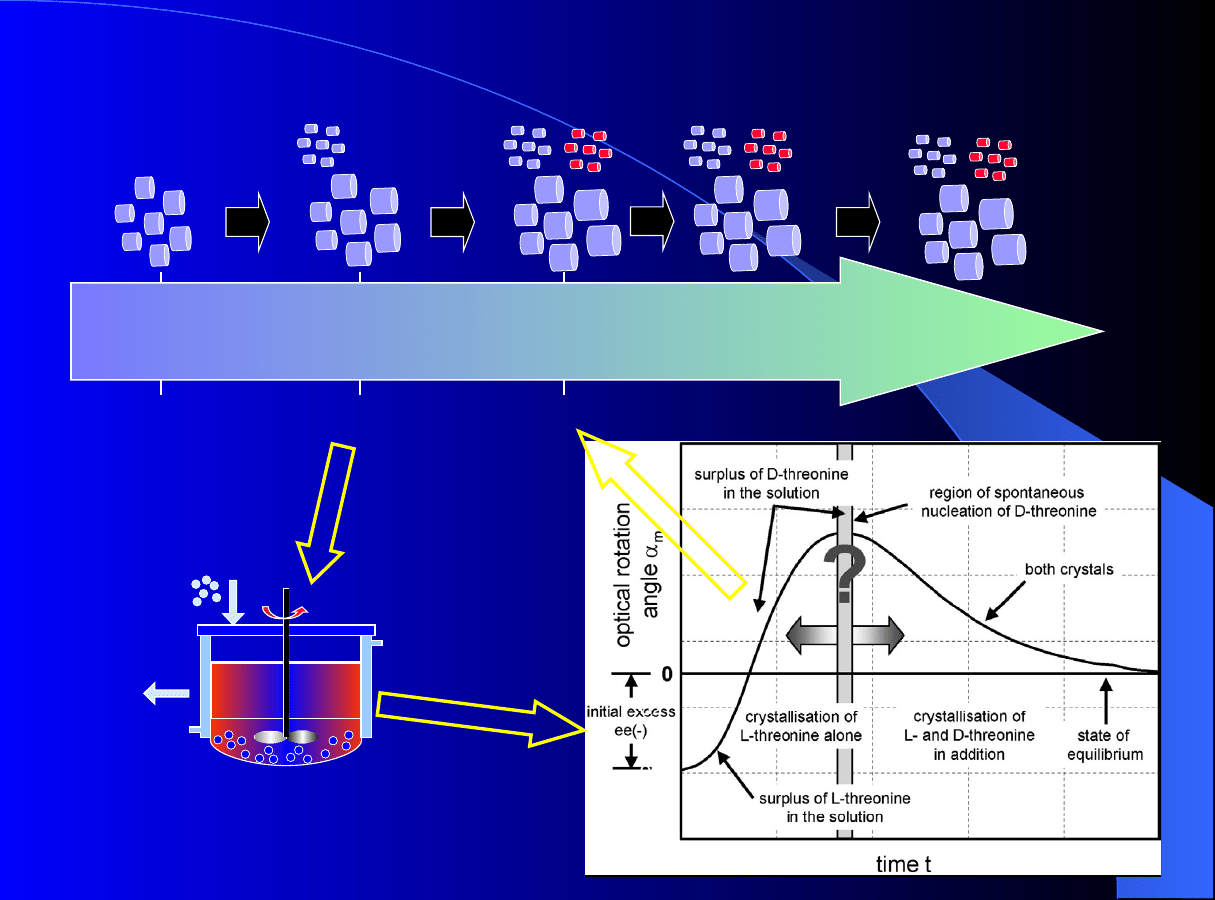
Zasady krystalizacji preferencyjnej
Zasady krystalizacji preferencyjnej
Wzrost
kryształów
E
1
Zarodkowani
e + wzrost
kryszt. E
1
Zarodkowani
e E
2
Wzrost
kryształów
E
1
, E
2
czas
0
1
2
E
1
E
1
Krystalizacja E
1
Krystalizator okresowy
Krystalizator okresowy
.
1
2
.

Żele NIPA
Podstawowe pojęcia
Żele NIPA
Żele NIPA
- hydrożele podlegające przejściom fazowym
związanym z dużą zmianą objętości.
Zmiany zachodzące pod wpływem temperatury w obrębie fazy
polimerowej mogą być wykorzystane w wielu dziedzinach współczesnej
chemii i technologii, czego przykładem są zastosowania takich
polimerów w medycynie, np. w kontrolowanym uwalnianiu leków czy
jako nośników białek i peptydów.
W większości przypadków są to termoczułe hydrożele usieciowane
głównie
N’N’-metylenobisakryloamidem,
a
także
dihydroksyetylenobisakryloamidem
i
dimetakrylanem
glikolu
etylenowego lub liniowe polimery tzw. poli(NIPAAm). Innym przykładem
jest szczepienie liniowego poli(NIPAAm) na powierzchni kapsułek i
sterowanie uwalnianiem leku za pomocą otwierania/zamykania porów
membrany
kapsułki
dzięki
rozkłębieniu/skłębieniu
liniowego
poli(NIPAAm) ze zmianami temperatury.
„Inteligentne polimery” są wykorzystywane ponadto w procesach
separacyjnych,
np.
odwadnianie
roztworów
białek
i
innych
wielkocząsteczkowych substancji biologicznie czynnych.

Produktywność 1 – 10 kg czystej
subst./dzień.
80 cm SMB
system

2 m średnicy
0.5 m wysokości
złoża
1,570 L objetości
12,000 kg wagi
(Amersham
Biosciences)

Podsumowanie
Podsumowanie
Chromatografia jest praktycznie jedyną metodą rozdziału tzw.
mieszanin „trudnych”, które nie dają się rozdzielić
alternatywnymi metodami rozdziału np. za pomocą krystalizacji,
ekstrakcji itp.
• Chromatografia jest często najszybszą oraz pewną drogą do
otrzymywania
pożądanych
enancjomerów
–
farmacja,
biotechnologia;
• Chromatografia może być z punktu widzenia ekonomiki procesu
najważniejszą drogą do produkcji substancji czynnych - farmacja.
Sprawność pojedynczej kolumny chromatograficznej okresowej
jest bardzo wysoka przy jednoczesnej wysokiej czystości
produktu kluczowego.
Jednocześnie produktywność procesu chromatografii okresowej
jest bardzo niska w porównaniu do altermatywnych metod
rozdziału.
Zastosowanie chromatografii ciągłej (SMB) pozwala znacząco
zredukować tę różnicę produktywności.

Cykl monotematycznych publikacji b
Cykl monotematycznych publikacji b
ę
ę
d
d
ą
ą
cych podstaw
cych podstaw
ą
ą
rozprawy habilitacyjnej:
rozprawy habilitacyjnej:
1. Piątkowski W., Antos D., Kaczmarski K., „Comparing simulations of
adsorption on heterogeneous surfaces by two kinetic models, the
transport-dispersive and Langmuir kinetic models”, Acta Chrom., 10
(2000), 23-38
2. Piątkowski, W., Antos D., Kaczmarski, K., “Modeling of preparative
chromatography processes with slow intraparticle mass transport
kinetics”, J.Chrom. A, 988 (2003), 219-231
3. Piątkowski W., Gritti, F., Kaczmarski, K., Guiochon, G., ”Influence of
the particle porosity on chromatographic band profiles”, J.Chrom. A,
989, (2003), 207-219
4. Piątkowski, W., Antos D., Gritti, F., Guiochon, G., ”Study of the
competitive isotherm model and the mass transfer kinetics for a BET
binary system”,
J.Chrom. A, 1003, (2003), 73-89
5. Piątkowski W., Petrushka I., Antos D., „Adsorbed solution model for
prediction of normal-phase chromatography process with varying
composition of the mobile phase”, J.Chrom. A, 1092 (2005) 65
6. Piątkowski W., “Problemy przenoszenia skali w procesie
chromatografii preparatywnej”, Inż. Chem. i Proc. 26, (2005), 605-
630
7. Piątkowski W., “Optimization problems of preparative
chromatography process illustrating by the separation of real mixture
of isomers”, Acta Chromatographica 16 (2006), 92-118

DZIĘKUJĘ ZA UWAGĘ
DZIĘKUJĘ ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
Wyszukiwarka
Podobne podstrony:
wyklad nowy
polityka społeczna w ue-wykład, Nowy folder, RECORDER, Polityka Społeczna w UE-wykład
wyklad 1-2 - nowy, FiR, 01s rachunkowość finansowa
wyklad 3 nowy
HiBŻ- wykłady, Nowy folder (2)
pieniądz wykład nowy 2009 T 9
ekonomia sektora publicznego wykład nowy
wyklad nowy
Rola warstwy wierzchniej w implantac1 nowy, Studia, Bioinżynieria - Wykład
Nowy folder, Wykład 1
KS wyklad stary i nowy
zagadnienia karto, umk, notatki, zadania, Nowy folder, Kartografia-WYKŁAD
więcej podobnych podstron