
Chemia – laboratoria
Chemia – laboratoria
Temat:
Temat:
Siły spójności tworzyw jednorodnych i
Siły spójności tworzyw jednorodnych i
niejednorodnych
niejednorodnych
Wykonali:
Wykonali:
Jasik Rafał
Jasik Rafał
Jurkiewicz Marek
Jurkiewicz Marek
Opole, 13.03.2008
Opole, 13.03.2008

Jednorodność
Jednorodność
- wykazywanie
- wykazywanie
jednakowych właściwości
jednakowych właściwości
(rozszerzalność termiczna,
(rozszerzalność termiczna,
przewodnictwo elektryczne,
przewodnictwo elektryczne,
współczynnik załamania
współczynnik załamania
światła, szybkość wzrostu i
światła, szybkość wzrostu i
rozpuszczania) w każdym
rozpuszczania) w każdym
punkcie objętości danej
punkcie objętości danej
substancji.
substancji.

Ciała (substancje, przedmioty,
Ciała (substancje, przedmioty,
cząstki) jednorodne wykazują
cząstki) jednorodne wykazują
jednakowe właściwości bez
jednakowe właściwości bez
względu na punkt ciała, w
względu na punkt ciała, w
którym dana właściwość jest
którym dana właściwość jest
rozpatrywana.
rozpatrywana.

Niejednorodność
Niejednorodność
–
–
analogicznie do jednorodności
analogicznie do jednorodności
jest to cecha charakteryzująca
jest to cecha charakteryzująca
się odmiennymi
się odmiennymi
właściwościami fizycznymi
właściwościami fizycznymi
oraz mechanicznymi tworzyw
oraz mechanicznymi tworzyw
w zależności od miejsca i
w zależności od miejsca i
kierunku przyłożenia siły.
kierunku przyłożenia siły.

Przykładowym tworzywem
Przykładowym tworzywem
jednorodnym jest:
jednorodnym jest:
Stal
Stal
Przykładowym tworzywem
Przykładowym tworzywem
niejednorodnym jest
niejednorodnym jest
Drewno
Drewno

Siły spójności
(oddziaływania
międzycząsteczkowe) są to
inne niż wiązania chemiczne
siły wiążące atomy i
cząsteczki.

Oddziaływania między
atomami w cząsteczkach
należą do oddziaływań
silnych, których energie są
większe niż 100 kJ/mol.
Istnieją też znacznie słabsze
oddziaływania o energiach
znacznie niższych od
przytoczonej wartości.

Przyciąganie
międzycząsteczkowe jest
odpowiedzialne za łączenie
się atomów lub cząsteczek,
ale jest ono ograniczone
przez zjawisko odpychania
między jądrami oraz
rdzeniami elektronowymi
sąsiadujących atomów.

Oddziaływania
międzycząsteczkowe dzieli się
na:
• oddziaływanie jon – jon
• oddziaływanie trwały dipol – trwały
dipol
• wiązania wodorowe
•
oddziaływania van der Waalsa

Wiązania wodorowe
Wiązania wodorowe

W cząsteczkach związków
chemicznych oprócz oddziaływań typu
uniwersalnego wystepują również
oddziaływania specyficzne. Należy do
nich wiązanie wodorowe.
O istnieniu tego rodzaju wiązania
świadczą wyjątkowo wysokie
temperatury wrzenia wody, amoniaku
i fluorowodoru. Jest ono utworzone
przez atom wodoru położony między
dwoma małymi, silnie
elektroujemnymi atomami
zawierającymi wolne pary
elektronowe.

Donorami wolnych par elektronowych
w szczególności atomy N, O i F.
Wiązanie wodorowe oznacza się
kropkami, by odróżnić je od
prawdziwego wiązania
kowalencyjnego, np. we wzorze;
Wiązanie wodorowe tworzy się
pomiędzy atomem wodoru związanym
z atomem o dużej elektroujemności, a
atomem z wolnymi parami
elektronowymi.
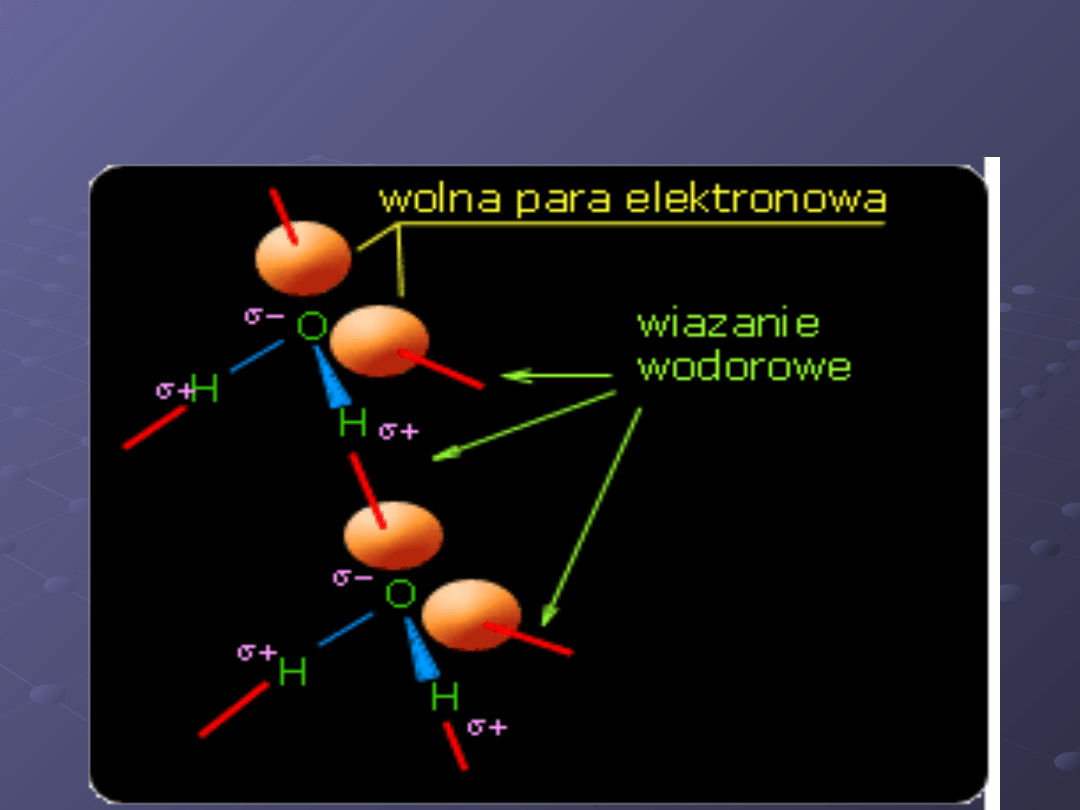
Schemat powstawania wiązania
Schemat powstawania wiązania
wodorowego
wodorowego
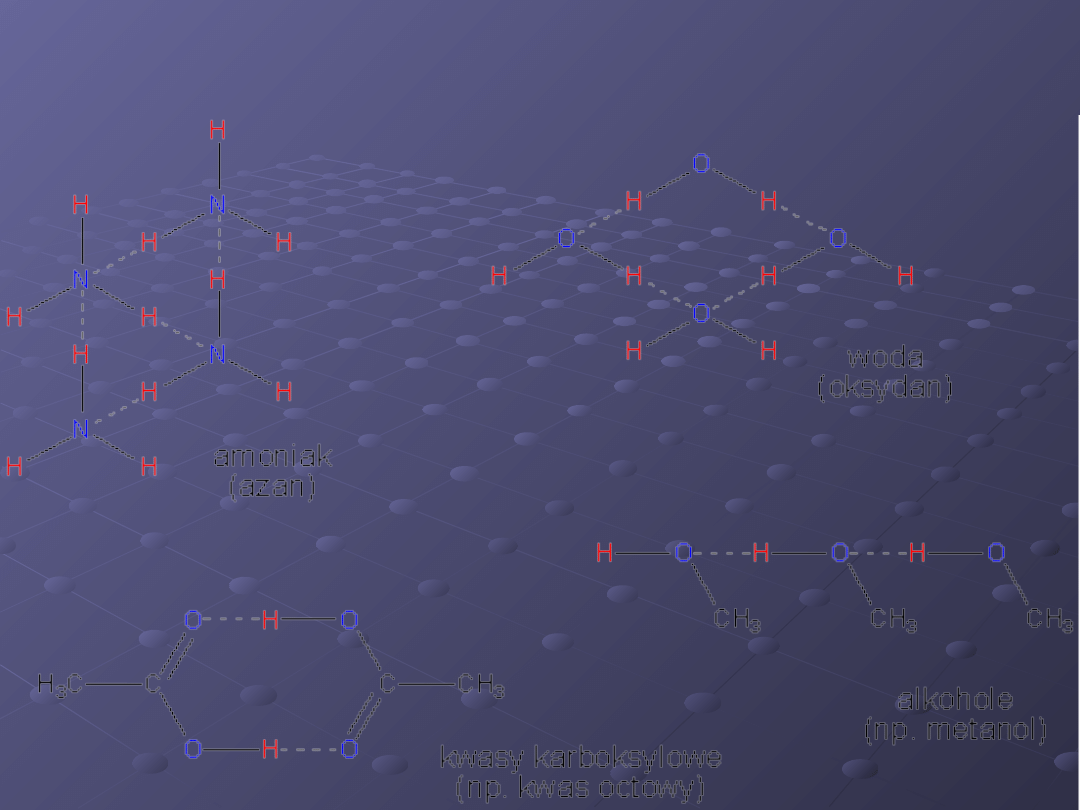
Przykładowe wiązania
Przykładowe wiązania
wodorowe
wodorowe

Aby zrozumieć powstawanie wiązania
Aby zrozumieć powstawanie wiązania
wodorowego, posłużymy się cząsteczką
wodorowego, posłużymy się cząsteczką
wody w której mamy silnie
wody w której mamy silnie
spolaryzowane wiązanie O-H.
spolaryzowane wiązanie O-H.
Elektroujemny atom tlenu silnie
Elektroujemny atom tlenu silnie
przyciąga elektrony wiązania, co
przyciąga elektrony wiązania, co
powoduje, że atom wodoru uzyskuje
powoduje, że atom wodoru uzyskuje
duży cząstkowy ładunek dodatni.
duży cząstkowy ładunek dodatni.
Dodatnio naładowany atom wodoru jest
Dodatnio naładowany atom wodoru jest
silnie przyciągany przez jedną z wolnych
silnie przyciągany przez jedną z wolnych
par elektronowych atomu tlenu
par elektronowych atomu tlenu
sąsiedniej cząsteczki wody. W wyniku
sąsiedniej cząsteczki wody. W wyniku
silnego oddziaływania wolnej pary
silnego oddziaływania wolnej pary
elektronowej o ładunku ujemnym i
elektronowej o ładunku ujemnym i
cząstkowego ładunku dodatniego
cząstkowego ładunku dodatniego
powstaje wiązanie.
powstaje wiązanie.

Wiązania wodorowe mogą tworzyć
się pomiędzy różnymi
cząsteczkami. Takie wiązanie nosi
nazwę międzycząsteczkowego
wiązania wodorowego.
Przykładem mogą być wiązania
tworzące się pomiędzy już
opisanymi cząsteczkami wody.
Ten typ wiązania wpływa, między
innymi na wartość temperatury
wrzenia temperatury topnienia
oraz rozpuszczalności
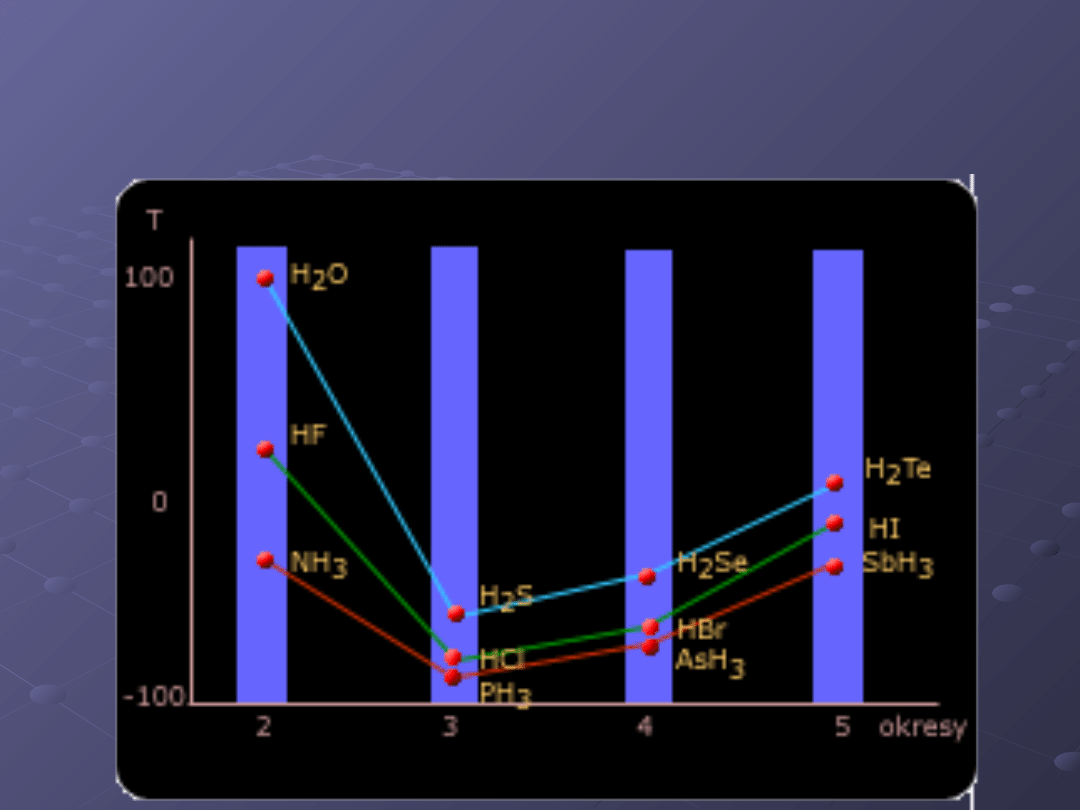
Porównanie temperatur wrzenia związków
wodoru z pierwiastkami
rodziny głównej 4-7.

Fakt występowania wiązania wodorowego
Fakt występowania wiązania wodorowego
pomiędzy cząsteczkami wody, warunkuje
pomiędzy cząsteczkami wody, warunkuje
jej szczególne właściwości, które
jej szczególne właściwości, które
umożliwiają istnienie życia na Ziemi.
umożliwiają istnienie życia na Ziemi.
Wiązania te silnie łączą ze sobą cząsteczki
Wiązania te silnie łączą ze sobą cząsteczki
wody, co powoduje, że woda ma znacznie
wody, co powoduje, że woda ma znacznie
wyższą temperaturę wrzenia, niż
wyższą temperaturę wrzenia, niż
wskazywałyby na to obliczenia. Wiązanie
wskazywałyby na to obliczenia. Wiązanie
wodorowe utrzymuje cząsteczki wody w
wodorowe utrzymuje cząsteczki wody w
pewnej odległości od siebie, gdy woda
pewnej odległości od siebie, gdy woda
krzepnie, tworząc lód; w rezultacie, lód ma
krzepnie, tworząc lód; w rezultacie, lód ma
mniejszą gęstość niż ciekła woda i pływa
mniejszą gęstość niż ciekła woda i pływa
po powierzchni. Woda zawdzięcza również
po powierzchni. Woda zawdzięcza również
wiązaniu wodorowemu dużą pojemność
wiązaniu wodorowemu dużą pojemność
cieplną, co znacznie łagodzi klimat na
cieplną, co znacznie łagodzi klimat na
Ziemi, ponieważ wielkie masy wody
Ziemi, ponieważ wielkie masy wody
znajdujące się w oceanach powoli
znajdujące się w oceanach powoli
nagrzewają się i powoli stygną.
nagrzewają się i powoli stygną.

Energia wiazań wodorowych
Wiązanie
wodorowe
Energia w kJ/mol
O-H...O
12,5 - 33,4
O-H...N
16,7 - 29,3
N-H...O
12,5 - 16,7
N-H...N
5,4 - 20,9
F-H...F
20,9 - 33,4

Wiązania zdelokalizowane
Wiązania zdelokalizowane

Są to takie wiązania atomowe,
Są to takie wiązania atomowe,
które na skutek oddziaływań
które na skutek oddziaływań
między sobą oraz ze względu
między sobą oraz ze względu
na sprzyjający kształt
na sprzyjający kształt
cząsteczki nie tworzą się
cząsteczki nie tworzą się
pomiędzy dwoma atomami, ale
pomiędzy dwoma atomami, ale
kilka wiązań spaja się w jedno
kilka wiązań spaja się w jedno
duże, które nie zajmujące
duże, które nie zajmujące
pozycji wiązań pierwotnych,
pozycji wiązań pierwotnych,
dlatego nazywane jest
dlatego nazywane jest
zdelokalizowanym.
zdelokalizowanym.
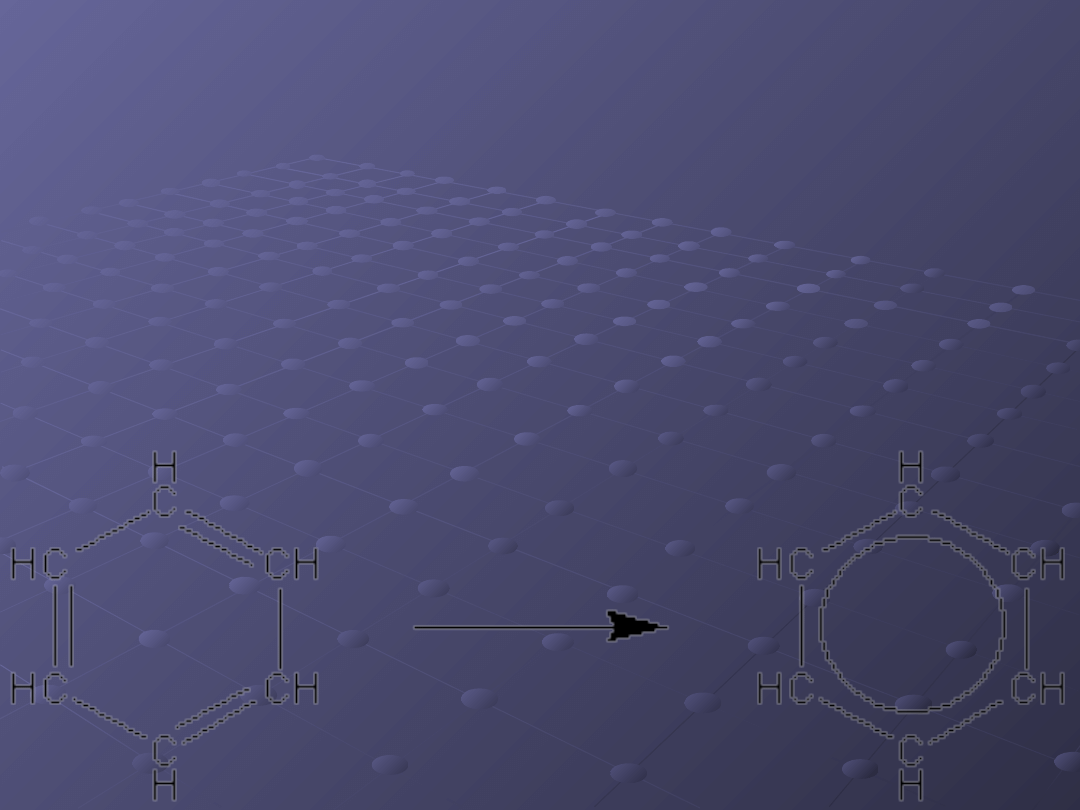
Do najbardziej
Do najbardziej
reprezentatywnych wiązań
reprezentatywnych wiązań
zdelokalizowanych należy
zdelokalizowanych należy
wiązanie w benzenie i jego
wiązanie w benzenie i jego
pochodnych. Elektrony trzech
pochodnych. Elektrony trzech
wiązań π tworzą jedno
wiązań π tworzą jedno
wiązanie (sześć elektronów).
wiązanie (sześć elektronów).

Wiązania van der Waalsa

To, że każdą substancję możemy
skroplić, jest dowodem że między
atomami i cząsteczkami występują
przyciągające oddziaływania.
Przykładem takiego przyciągania jest
oddziaływanie występujące między
atomami gazów szlachetnych, które
umożliwia ich kondensację. Ten
rodzaj oddziaływania nosi nazwę sił
van der Waalsa i jest to jedyny rodzaj
przyciągania między atomami gazów
szlachetnych i między cząsteczkami
niepolarnymi.

Siły van der Waalsa i temperatury wrzenia
niektórych helowców
Pierwiast
ek
erg *
cm
6
Temperatura
wrzenia
(kcal/mol)
He
1,2
-269
o
C
Ar
52,0
-185
o
C
Xe
217,0
-108
o
C
Wielkość tych sił podawana jest w jednostkach
erg * cm
6
. Dla porównania podano także
temperatury wrzenia odpowiednich
pierwiastków. Z przedstawionych w tabeli
danych widać, że wzrost sił van der Waalsa
powoduje wzrost temperatury wrzenia helowców.
Erg - jednostka pracy i energii, jednostka pochodna w układzie miar
CGS.
1 erg = 10
-7
J

Siły van der Waalsa są wynikiem
wzajemnego oddziaływania elektronów i
jąder w cząsteczkach. A konkretnie
polegają one na przyciąganiu się
szybkozmiennych albo inaczej falujących
dipoli.
W wyniku ruchu elektronów
walencyjnych gęstość ładunku ujemnego
na zewnętrznej powłoce atomów ulega
szybkim fluktuacjom wzbudzając
podobną fluktuację w powłoce
walencyjnej sąsiednich atomów.
Powstają szybkozmienne dipole, które
wzajemnie przyciągają się zwiększając,
w miarę zbliżania się, wzajemną
polaryzację elektronową.
Schemat powstawania
Schemat powstawania
wiązania van der Waalsa
wiązania van der Waalsa

Siły van der Waalsa są stosunkowo słabe
Siły van der Waalsa są stosunkowo słabe
w przypadku małych cząsteczek
w przypadku małych cząsteczek
(kilkanaście razy słabsze od sił wiązania
(kilkanaście razy słabsze od sił wiązania
atomów w cząsteczce), ale w przypadku
atomów w cząsteczce), ale w przypadku
dużych cząsteczek mogą nawet
dużych cząsteczek mogą nawet
przewyższać siły wiązania chemicznego
przewyższać siły wiązania chemicznego
np. w smarach albo w tworzywach
np. w smarach albo w tworzywach
sztucznych. Prawidłowość ta również jest
sztucznych. Prawidłowość ta również jest
zauważalna dla temperatur wrzenia, gdzie
zauważalna dla temperatur wrzenia, gdzie
zwykle substancje o dużej masie
zwykle substancje o dużej masie
cząsteczkowej mają wysokie temperatury
cząsteczkowej mają wysokie temperatury
wrzenia a substancje o małej masie
wrzenia a substancje o małej masie
cząsteczkowej - niskie temperatury
cząsteczkowej - niskie temperatury
wrzenia
wrzenia

Jest to spowodowane większą liczbą
Jest to spowodowane większą liczbą
elektronów w cząsteczce, czemu
elektronów w cząsteczce, czemu
odpowiadają większe fluktuacje ładunków
odpowiadają większe fluktuacje ładunków
cząstkowych uwarunkowane oscylowaniem
cząstkowych uwarunkowane oscylowaniem
elektronów między różnymi położeniami.
elektronów między różnymi położeniami.
Daje się to zauważyć wśród cząsteczek
Daje się to zauważyć wśród cząsteczek
fluorowców. I tak atom wodoru F2 ma
fluorowców. I tak atom wodoru F2 ma
tylko 9 elektronów, fluktuacje w tej
tylko 9 elektronów, fluktuacje w tej
chmurze elektronowej są małe i
chmurze elektronowej są małe i
oddziaływania międzycząsteczkowe są tak
oddziaływania międzycząsteczkowe są tak
słabe, że gazowy fluor wrze w
słabe, że gazowy fluor wrze w
temperaturze -188
temperaturze -188
o
o
C. W atomie takim jak
C. W atomie takim jak
brom Br2 mamy 35 elektronów, fluktuacje
brom Br2 mamy 35 elektronów, fluktuacje
są zdecydowanie większe a efektem tego
są zdecydowanie większe a efektem tego
jest zmiana temperatury wrzenia, która dla
jest zmiana temperatury wrzenia, która dla
bromu wynosi 59
bromu wynosi 59
o
o
C.
C.

Oddziaływania jon-jon
Oddziaływania jon-jon

Oddziaływania jon-jon nazywane też
efektem jojo (kulombowskie lub
elektrostatyczne) - zachodzą między
dwiema różnoimiennie
naładowanymi cząsteczkami; od
wiązań jonowych różni je to, że
ładunek w oddziałujących ze sobą
cząsteczkach nie jest
skoncentrowany na jednym atomie,
lecz jest zdelokalizowany na kilku-
kilkunastu atomach. Siła ich
oddziaływania jest proporcjonalna
do 1/r2 (gdzie r - odległość między
cząsteczkami). W przypadku ośrodka
zawierającego inne ładunki (np.
roztworu elektrolitu) efekt
oddziaływania jest mniejszy.

Oddziaływanie dipol-dipol
Oddziaływanie dipol-dipol

Oddziaływania trwały dipol - trwały
dipol - tworzą się między
cząsteczkami posiadającymi trwałe
momenty dipolowe. Cząsteczki takie
posiadają w jednych miejscach
nadmiar ładunku ujemnego, a w
innych jego niedomiar. Oddziałują one
ze sobą tak jak jony - tyle, że
oddziaływanie to jest słabsze, gdyż w
grę wchodzą cząstkowe, a nie
całkowite ładunki elektryczne, a także
przyciąganiu pomiędzy ładunkami
różnoimiennymi towarzyszy zawsze
odpychanie pomiędzy ładunkami
jednoimiennymi.

Cząsteczki o trwałych momentach
Cząsteczki o trwałych momentach
dipolowych mogą się
dipolowych mogą się
elektrostatycznie przyciągać
elektrostatycznie przyciągać
wzajemnie z siłą:
wzajemnie z siłą:
gdzie oznacza stałą
gdzie oznacza stałą
dielektryczna ośrodka a r -
dielektryczna ośrodka a r -
odległość pomiędzy
odległość pomiędzy
oddziaływującymi cząsteczkami.
oddziaływującymi cząsteczkami.


Oddziaływanie trwały dipol-
Oddziaływanie trwały dipol-
dipol dipol indukowany
dipol dipol indukowany
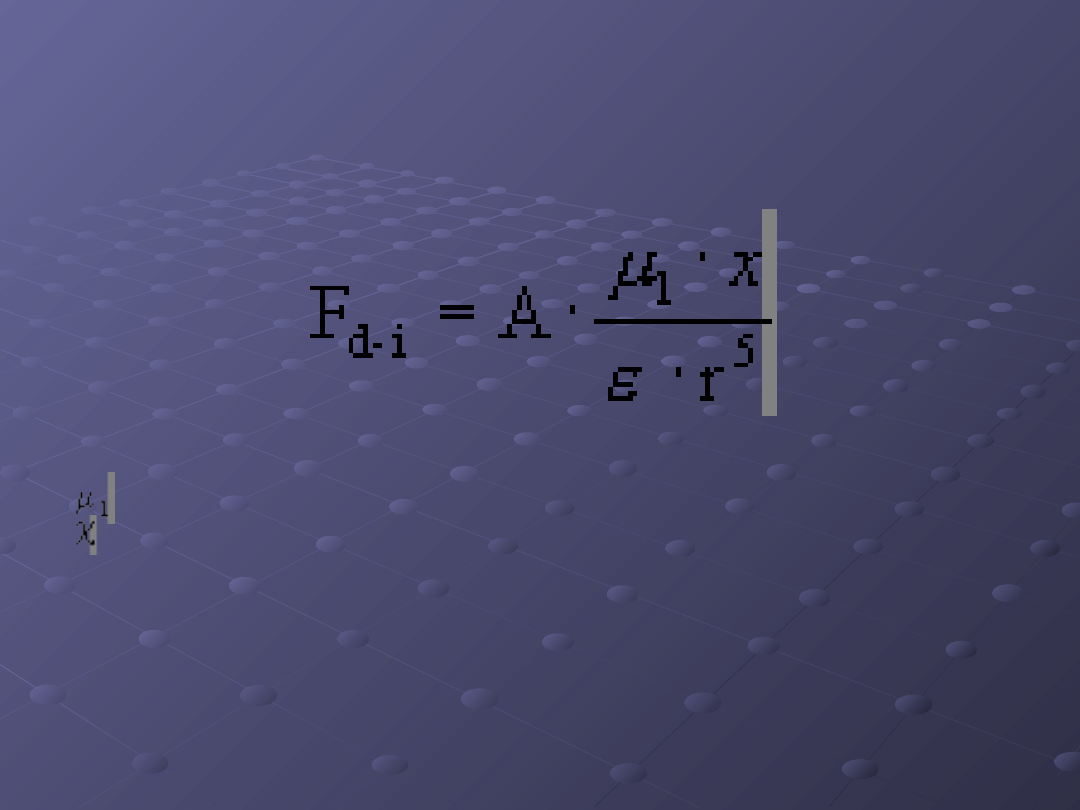
Siłę oddziaływania pomiędzy dipolem
trwałym a dipolem indukowanym można
wyrazić równaniem:
gdzie:
- trwały moment dipolowy,
- polaryzowalność cząsteczki,
A
- stała,
r
- odległość pomiędzy oddziaływującymi
cząsteczkami
.

Siły dyspersyjne Londona
Siły dyspersyjne Londona

Siły dyspersyjne Londona powstają
Siły dyspersyjne Londona powstają
wskutek periodycznych zmian
wskutek periodycznych zmian
gęstości elektronów w cząsteczkach.
gęstości elektronów w cząsteczkach.
Dlatego chwilowe asymetrie rozkładu
Dlatego chwilowe asymetrie rozkładu
ładunku wytwarzają się nawet w
ładunku wytwarzają się nawet w
cząsteczkach dla których uśredniony
cząsteczkach dla których uśredniony
w czasie rozkład elektronów jest
w czasie rozkład elektronów jest
symetryczny (np. w cząsteczce
symetryczny (np. w cząsteczce
wodoru). Powstają małe momenty
wodoru). Powstają małe momenty
dipolowe o zmiennej orientacji.
dipolowe o zmiennej orientacji.
Momenty te mogą oddziaływać na
Momenty te mogą oddziaływać na
sąsiednie powłoki elektronowe
sąsiednie powłoki elektronowe
powodując efekt indukcyjny.
powodując efekt indukcyjny.
Przyciąganie się takich chwilowych
Przyciąganie się takich chwilowych
momentów daje oddziaływanie
momentów daje oddziaływanie
dyspersyjne.
dyspersyjne.

Względne wartości efektów wzajemnego
Względne wartości efektów wzajemnego
oddziaływania cząsteczek.
oddziaływania cząsteczek.
Cząsteczka
Efekt
orientacyjny-
oddziaływanie
d-d
Efekt
indukcyjny-
oddziaływanie
d-i
Efekt dyspersyjny-
siły dyspersyjne
Londona
H
2
brak
brak
11,3
N
2
brak
brak
62,0
CH
4
brak
brak
117,0
CO
0,0034
0,057
67,0
NH
3
84,0
10,0
93,0
H
2
O
190,0
10,0
47,0
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
Obliczanie wspolczynnika przenikania ciepla dla przegrod jednorodnych i niejednorodnych
SIŁY SPÓJNOŚCI
ćw 2,3 odkształcenia plastyczne jednorodne i niejednorodne, umocnienie i rekrystalizacja(1)
Obliczanie wspolczynnika przenikania ciepla dla przegrod jednorodnych i niejednorodnych
jaroszewski,technika wysokich napięć, Wytrzymałość powietrza dla napięcia przemiennego 50 Hz w polu
ćw 2 odkształcenia plastyczne jednorodne i niejednorodne
Biochemia, poprawka biochemia, UKŁAD: jednorodny i jednoskładnikowy- sub w pierwszym stanie skupieni
Sily przyklady
OPAKOWANIA Z TWORZYW SZTUCZNYCH
postępowanie ze sprzętem jednorazowym ASEPTYKA
9 1 2 policja siły środki
w3 recykling tworzyw sztucznych
BUD OG wykład 11 1 Tworzywa sztuczne
3 Stateczność prętów prostych, Postaci utraty stateczności, określanie siły krytycznej ppt
3 Rodzaje jednorodnych transformacji stosowanych w kinematy
9 MATERIAŁY ŚCIERNE I TWORZYWA SZTUCZNE
więcej podobnych podstron