
LEKI WPŁYWAJĄCE NA
KRZEPLIWOŚĆ KRWI

• Hemostaza
to proces związany z wytworzeniem
skrzepu w celu zatrzymania utraty krwi po
uszkodzeniu naczynia krwionośnego.
• Proces ten inicjowany jest przez płytki krwi
(trombocyty), które przylegają do uszkodzonego
miejsca (adhezja), ulegają wzajemnej aktywacji, w
wyniku której agregują tworząc czop hemostatyczny.
W czasie aktywacji płytki wydzielają:
• serotoninę (5-HT)
oraz czynniki odpowiedzialne za aktywowanie
dalszych płytek:
• tromboksan A
2
(TxA
2
), ADP (adenozynodifosforan)
oraz
czynnik aktywujący płytki (PAF).
• Na powierzchni aktywowanych płytek eksponowane
są kwaśne fosfolipidy stanowiące powierzchnie, na
których mogą oddziaływać ze sobą czynniki
krzepnięcia krwi.
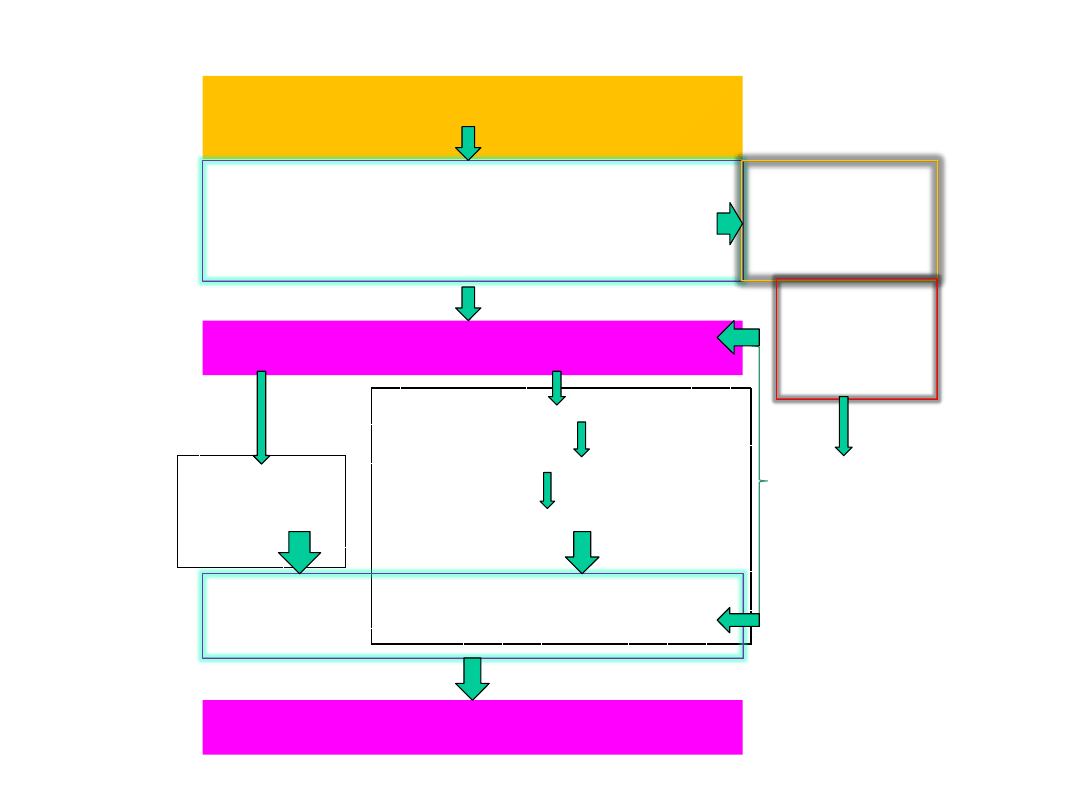
Schemat reakcji prowadzących do aktywacji
płytek
Uszkodzenie śródbłonka
naczyniowego
Adhezja płytek do uszkodzonej
powierz-chni (kolagenu i
czynnika Willebranda) poprzez
receptory GPIa/IIa i GP Ib
Aktywacja płytek
synteza kwasu
arachidonowego
synteza cyklicznych
nadtlenków
synteza
tromboksanu
A2
uwolnieni
e 5-HT
ADP
Ekpresja receptorów GPIIba/IIIa
łączących płytki między sobą i z
fibrynogenem
Agregacja płytek
Ekspozycja
kwaśnych
fosfolipidó
w kaskada
procesó
w
krzepnię
cia
trombi
na

Leki hamujące czynność płytek krwi
Leki hamujące czynność płytek krwi
1. Inhibitory cyklooksygenazy
kwas acetylosalicylowy
(hamowanie
nieodwracalne))
2. Inhibitor fosfodiesterazy
dipyridamol
3. Inhibitory odpowiedzi płytek na
ADP
klopidogrel i tyklopidyna
4. Antagoniści receptorów GPIIb/IIIa
abciksimab oraz tirofibam
5. Analogi prostacykliny (PGI
2
) –
iloprost
6. Inhibitory trombiny: heparyna,
hirudyna
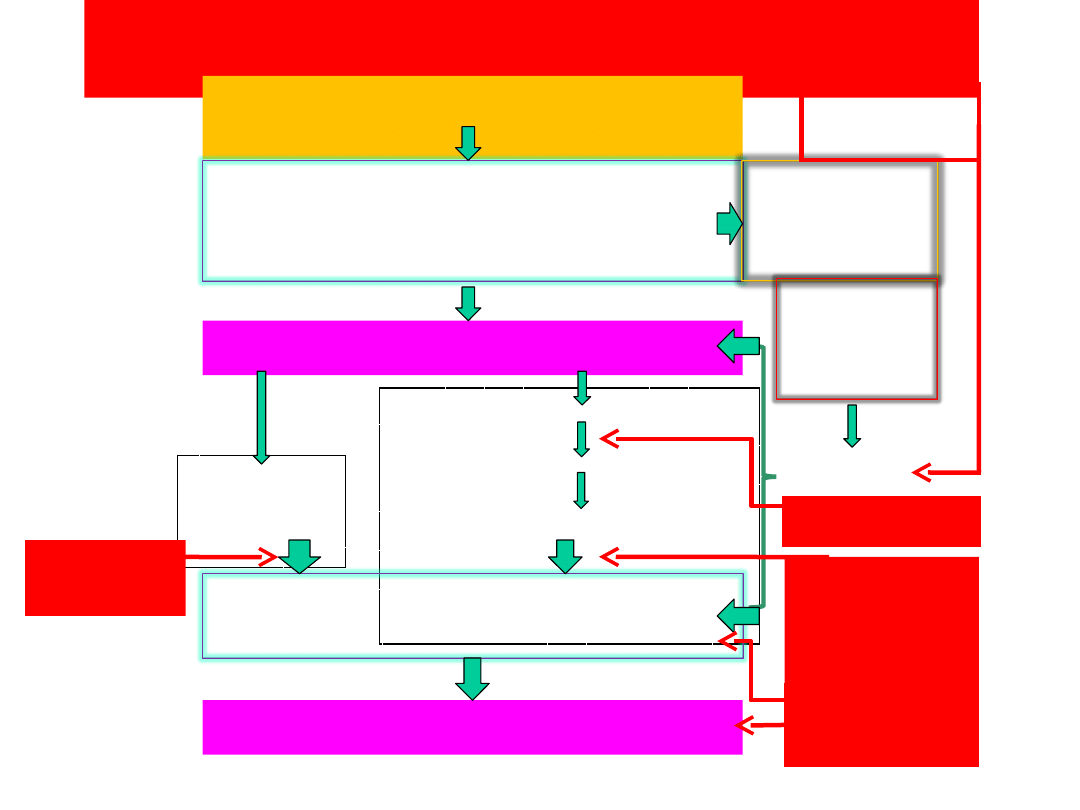
Miejsce hamującego działania leków
przeciwpłytkowych
Uszkodzenie śródbłonka
naczyniowego
Adhezja płytek do uszkodzonej
powierz-chni (kolagenu i
czynnika Willebranda) przez i
receptory GPIa/IIa i GP Ib
Aktywacja płytek
synteza kwasu
arachidonowego
synteza cyklicznych
nadtlenków
tromboksan A
2
(TXA
2
)
uwolnieni
e 5-HT
ADP
Ekpresja receptorów GPIIba/IIIa
łączących płytki z fibrynogenem i
między sobą
Agregacja płytek
Ekspozycja
kwaśnych
fosfolipidó
w
Kaskada
procesó
w
krzepnię
cia
trombin
a
aspiryna
Hirudyna,
heparyna
inhibitory
receptoró
w
GPIIb/IIIa
Iloprost
(PGI
2
)
klopidog
rel

Kwas acetylosalicylowy
•
Hamuje nieodwracalnie aktywność
cyklooksygenazy (COX1), co skutkuje
zatrzymaniem syntezy tromboksanu A2 (TXA2)
i prostacykliny czynników biorących udział w
regulacji reakcji związanych z aktywacją
trombocytów.
Działanie to wykorzystywane jest w medycynie
człowieka przy ostrym zawale serca,
zapobieganiu zatorom, przy angioplastyce,
przemijającym niedokrwie-niu mózgu, zatorze
mózgu i innych chorobach krążeniowych.
Inne NLPZ hamują COX odwracalnie i efekt
antypłytkowy jest krótkotrwały
.

MECHANIZM PRZECIWZAKRZEPOWEGO
DZIAŁANIA ASPIRYNY:
•Inhibicja COX1 jest nieodwracalna, co
wynika z acetylacji seryny w miejscu
wiązania leku na cyklooksygenazie.
• W komórkach śródbłonka następuje
szybka synteza COX i produkcja PGI2
zostaje szybko wznowiona.
•Bezjądrzaste trombocyty nie mogą podjąć
syntezy tromboksanu i czas organizacji
agregatów płytkowych ulega wydłużeniu.
• Pełna odnowa płytek trwa przez ok. 7-10
dni.
• Do uzyskania tego efektu potrzebne są
stosunkowo niskie dawki aspiryny.

Dipyrydamol
•
Inhibitor PDE zwiększa stężenie
cAMP w
komórce,
• Hamuje wychwyt adenozyny,
• W niewielkim stopniu hamuje syntezą
prostaglandyn.
• Zmniejsza agregację płytek.
•
W medycynie zalecany jako dodatek
do aspiryny w leczeniu zatoru mózgu i
przemijającym niedotlenieniu mózgu.

Klopidogrel i tyklopidyna
• To pochodne tienopirydyny hamujące
agregację inicjowaną przez ADP.
• Leki te wydłużają czas krwawienia i
zmniejszają lepkość krwi.
• Zdolność agregacji płytek krwi i czas
krwawienia powracają do wartości
wyjściowych po 5-7 dniach po zakończeniu
podawania.
• Leki te są bardziej efektywne niż aspiryna
lecz nie zawsze są dobrze tolerowane.
• Nie nadają się do długiego stosowania
indukują neutropenię.
• Klopidogrel zalecany jest do łącznego
stosowania z aspiryną w chorobie wieńcowej
zwłaszcza po interwencjach chirurgicznych.
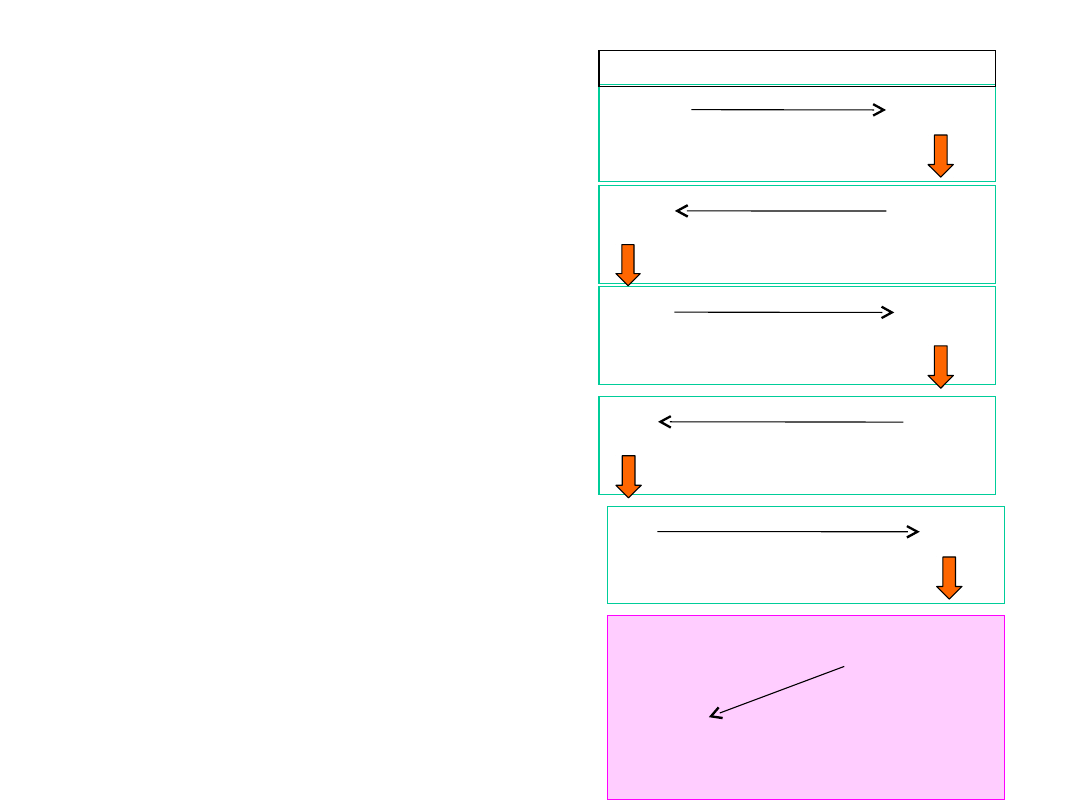
Procesy krzepnięcia
składają się z szeregu
reakcji aktywacji
zymogenów zwanych także
nieaktywnymi czynnikami
krzepnięcia.
Są to następujące czynniki :
II, (protrombina), VII, IX, X,
XI, XII.
W trakcie aktywacji każdy
zymogen przekształcany w
formę aktywną, którą jest
proteaza
oznaczana literką
„a” (IIa, (trombina), VIIa,
IXa, Xa, XIa, XIIa)
Proteaza ta aktywuje
kolejny zymogen poprzez
przecięcie wiązania lub
wiązań peptydowych w
jego strukturze.
XII
XIIa
XIa
XI
IX
IXa
Xa
X
II
IIa
fibrynogen
fibryna
Kontakt (np. ze szkłem)
VIIIa , kwaśne fosfolipidy,
Ca++
Va , kwaśne fosfolipidy,
Ca++

W każdym etapie krzepnięcia bierze
udział:
proteaza powstała w poprzednim etapie,
zymogen,
nieenzymatyczny kofaktor białkowy
(czynnik V lub VIII, które aktywuje
trombina) oraz
jony wapnia.
Powierzchnię krzepnięcia w warunkach in
vivo stanowią płytki (kwaśne fosfolipidy), a
w warunkach in vitro emulsja
fosfolipidowa.
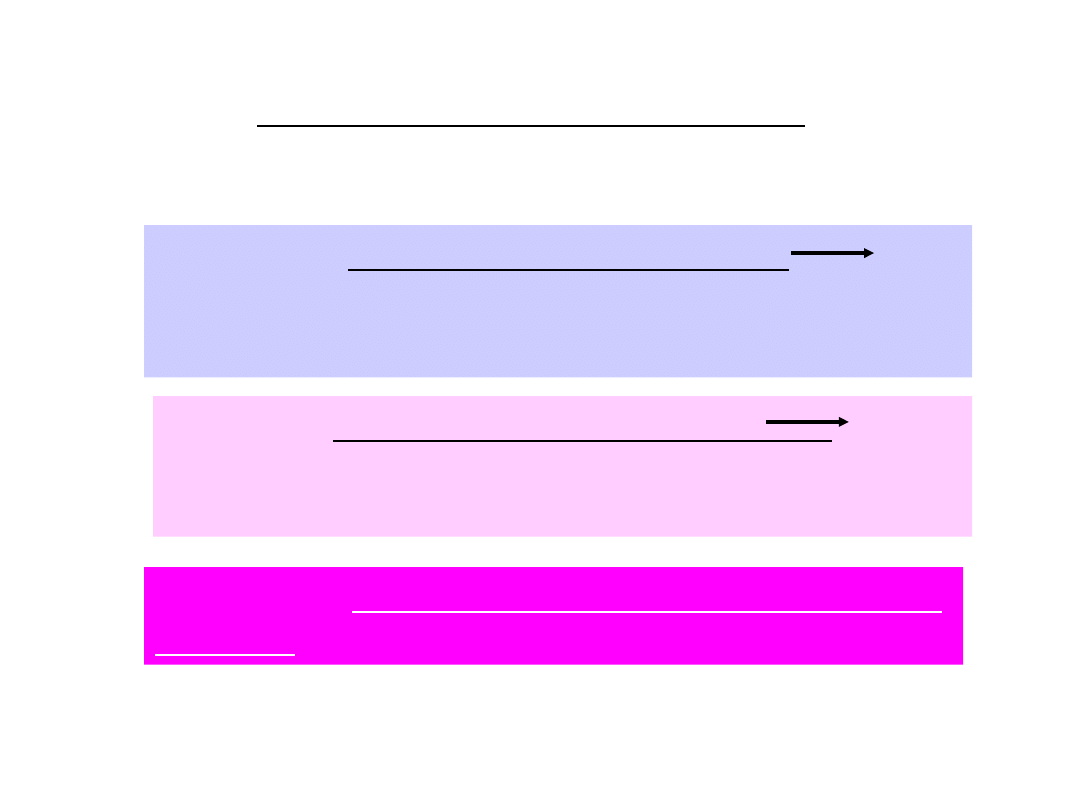
Schemat krzepnięcia krwi
ETAP 1. - aktywacja czynnika X (X
Xa)
(aktywacja czynnika Stuarta)
ETAP 2. aktywacja czynnika II (II
IIa)
(przejście protrombiny w trombinę)
ETAP 3. - przejście fibrynogenu w
fibrynę

ETAP 1. - aktywacja czynnika X
może zachodzić dwoma drogami:
1. drogą zewnątrzpochodną - przy uszkodzeniu tkanki i
naczyń
2. drogą wewnątrzpochodną - przy powstawaniu skrzepu
wewnątrz naczyń
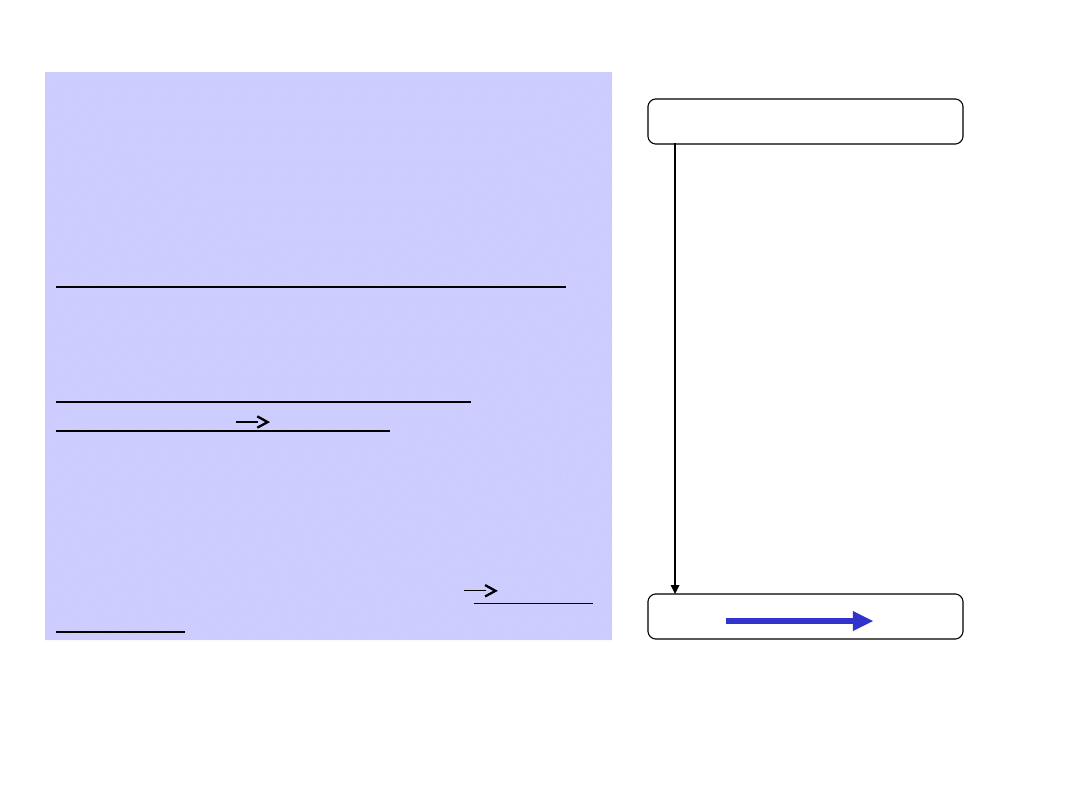
Droga zewnątrzpochodna
aktywacji czynnika X
jest
uruchamiana przy uszkodzeniu
tkanek i naczyń.
Droga ta zapoczątkowana jest
uwolnieniem czynnika tkankowego III
tzw. tromboplastyny tkankowej - białka
zawartego w błonach komórkowych
oraz
aktywacją prokonwertyny tzw.
osoczowego czynnika VII (VII VIIa)
do czego dochodzi pod wpływem jej
zetknięcia z fosfolipidami błonowymi.
Tromboplastyna tkankowa (III) w
obecności aktywowanej prokonwertyny
(VIIa), Ca
2+
(IV) i fosfolipidów aktywuje
czynnik X (X Xa)
uszkodzenie
tkanki
tromboplastyna
tkankowa (III)
prokonwertyna (VIIa)
jony wapnia (Ca
+2
)
fosfolipidy (FL)
(X
Xa)
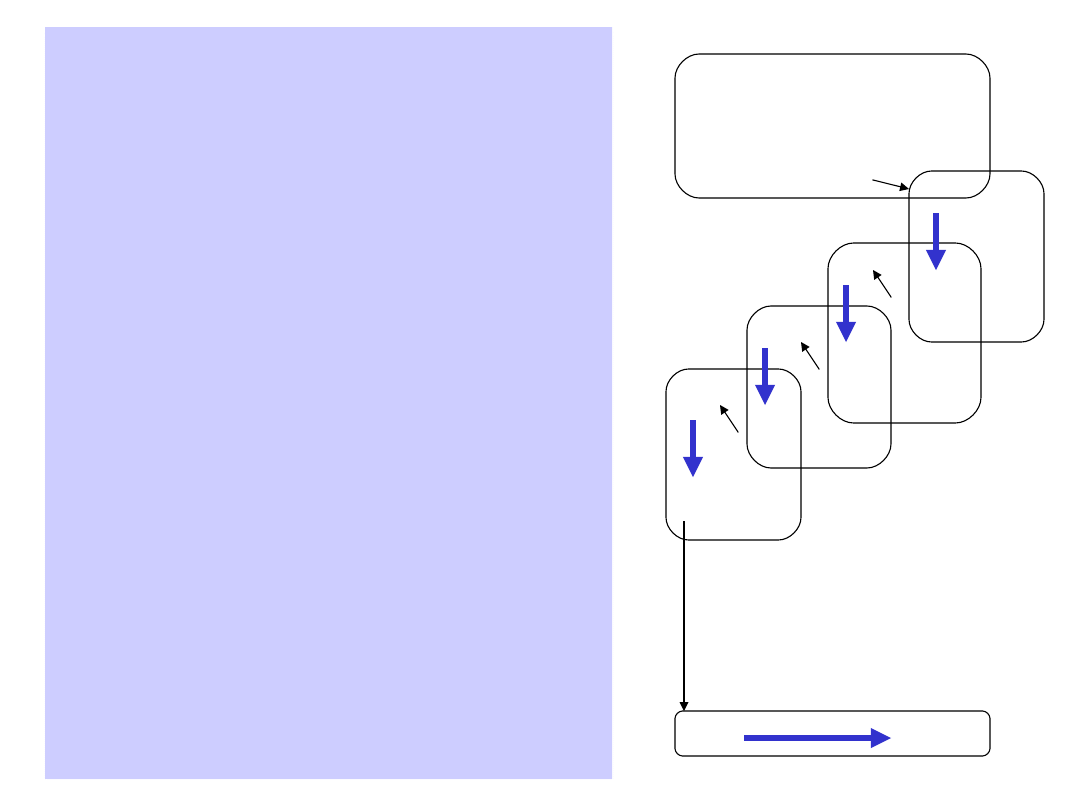
Droga wewnątrzpochodna aktywacji
czynnika X
jest uruchamiana przy powstawaniu
zakrzepu wewnątrz naczyń
Droga zapoczątkowana aktywacją czynnika
XII (czynnik Hagemana) po adherencji do
powierzchni naładowanej ujemnie (np.
powierzchni kolagenu) w obecności
kininogenu i prekalikreiny.
Aktywowany czynnik XIIa aktywuje czynnik
XI (czynnik przeciwhemofilowy C-
Rozenthala),
Aktywowany czynnik XIa aktywuje czynnik
IX (czynnik przeciwhemofilowy B -
Chrismasa
Aktywowany czynnik IXa aktywuje czynnik
VIII (czynnik przeciwhemofilowy A)
Aktywowany czynnik VIIIa, w obecności Ca
2+
, fosfolipidów i czynnika płytkowego PF
3
aktywuje czynnik X
Kontakt z
ujemnie
naładowaną
powierzchnią
- - - - - - - - - - - - -
XII
XIIa
XI
XIa
IX
IXa
VIII
VIIIa
(X
Xa)
jony wapnia (Ca
+2
)
fosfolipidy (FL)
czynnik płytkowy PF
3
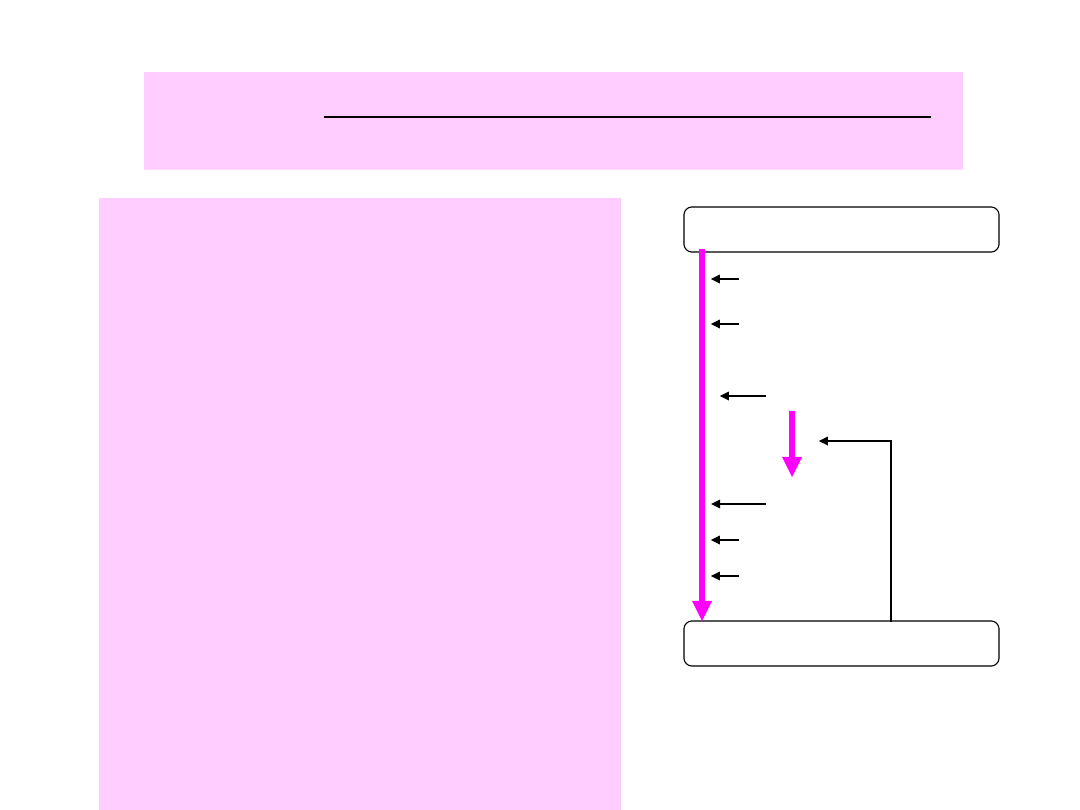
ETAP 2. aktywacja protrombiny (II)
Reakcja przejścia
protrombiny w trombinę
zachodzi w obecności :
czynnika Xa,
Ca
2+
(IV),
proakceleryny czyli czynnika
V i
akceleryny czyli czynnika Va
(dawniej czynnika VI)
fosfolipidów i
czynnika płytkowego PF
3
Przejście proakceleryny (V) w
akceleryną (Va) odbywa
się dzięki powstającej
trombinie.
Protrombina
Trombina
Xa,
Ca
2+
V
Va
FL
PF
3
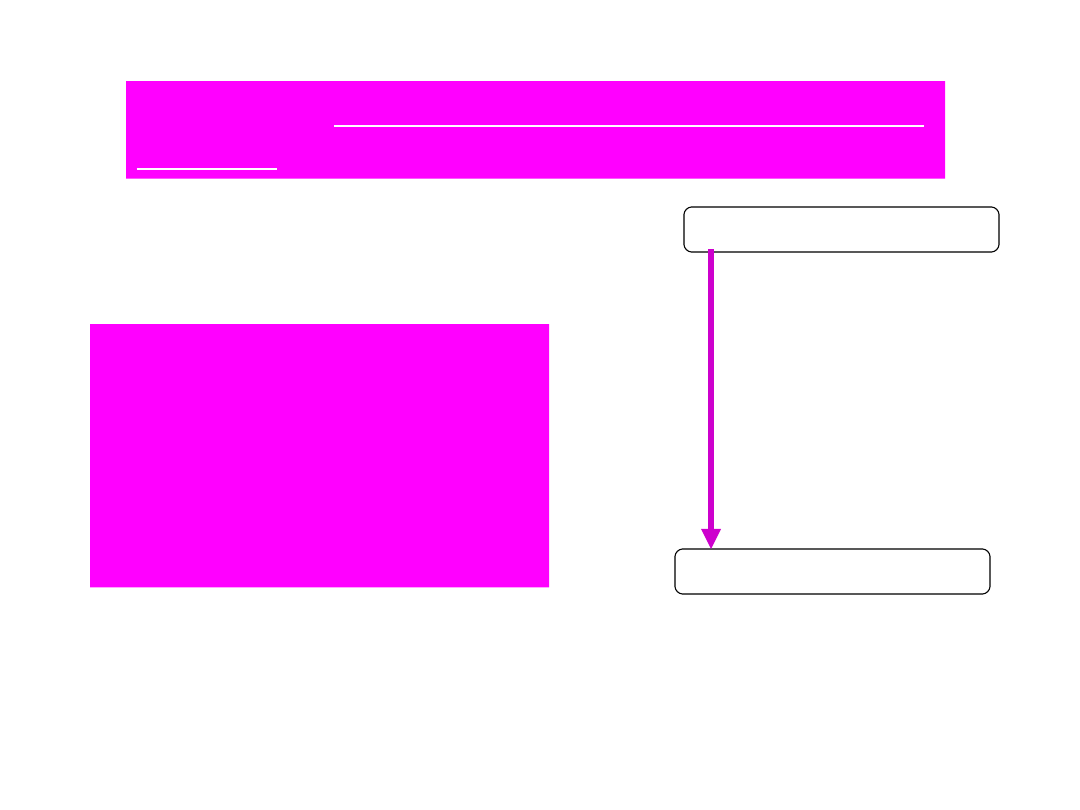
ETAP 3. - przejście fibrynogenu w
fibrynę
Przejście fibrynogenu
(czynnik I) w
nierozpuszczalną fibrynę
zachodzi w obecności
trombiny
oraz czynnika XIII tzw.
stabilizatora włókna
Fibrynogen
Fibryna
IIa
XIII
fibrynogen
trombina
czynnik XIIIa
polimery fibryny
płytki krwi
nierozpuszczalna
trombostenina sieć
fibryny
retrakcja skrzepu
Trombina hydrolizuje
wiązania peptydowe, a
powstające mono-mery
samoistnie polimeryzują
do wytworzenia luźnej
siatki włóknika.
Proces ten mogą
hamować antytrombiny
np. antytrombina III dla
której kofaktorem jest
heparyna
Proces stabilizacji
skrzepu przez czynnik
XIIIa polega na zastąpie-
niu słabych wiązań
wodorowych na silniejsze
międzypeptydowe
Obkurczenie się skrzepu
(retra-kcja) następuje pod
wpływem zawartej w
płytkach trombosteniny
ETAP 3. - przejście fibrynogenu w
fibrynę
Fibroliza
jest
proteolitycznym
rozkładem włóknika
skrzepu pod wpływem
plazminy, która
powstaje z
plazminogenu pod
wpływem endogennych
aktywatorów:
•tkankowy czynnik
aktywujący
plazminogen,
•urokinaza,
•kalikreina oraz
•elastaza neutrofilową
lub
• egzogennych
aktywatorów np. kinaz
bakteryjnych
Fibrynoliza
aktywatory plazminogenu
plazminogen
plazmi
na
Fibrynoliza

Leki fibrynolityczne (trombolityczne):
• streptokinaza,
•urokinaza,
•
alteplaza, duteplaza, reteplaza
• Działanie ich polega na aktywacji przejścia
plazminogenu w plazminę.
• Leki te stosuje się w celu rozpuszczenia
zakrzepów wewnątrznaczyniowych (trombus)
utrudniających ukrwienie ważnych dla życia
narządów
głównie we wczesnej fazie ostrych stanów
zawałowych, ostrych udarach zatorowych,
ostrym zatorze tętniczym.

• Streptokinaza to białko ekstrahowane z
kultury paciorkowców β-hemolitycznych
•
Podawana dożylnie podczas ostrego
zawału jest lekiem ratującym życie.
•Tworzy z plazminogenem kompleks
aktywatora, który przekształca we krwi i
zakrzepie plazminogen w plazminę enzym
proteolityczny i fibrynolityczny.
•Plazmina rozpuszcza zakrzepy,
przekształcając nierozpuszczalna fibrynę w
rozpuszczalne produkty degradacji.
•
Streptokinaza szybko jednak jest
unieczynniana przez swoiste przeciwciała
przeciwpaciorkowcowe !!!!

Alteplaza, duteplaza to leki otrzymane na
drodze rekombinacji.
•
Podanie dożylne powoduje, że łączą się z
fibryną, ulegają aktywacji i wykazują
zdolność przekształcenia plazminogenu w
plazminę.
• Plazmina powoduje rozpuszczanie
skrzepu.
• Leki te nie są immunogenami,
•Alteplaza ma krótki okres półtrwania i
musi być podawana w infuzji.
• Reteplaza ma znacznie dłuższy okres
półtrwania i może być podana w
jednorazowej iniekcji.

Leki hamujące fibrynolizę - inhibitory
plazminogenu.
Należy do nich:
kwas aminokapronowy, kwas traneksamowy,
aprotynina.
Leki te stosuje się w stanach chorobowych,
w których dochodzi do nadmiernego
uwalniania aktywatorów tkankowych
plazminogenu, co prowadzi do szybkiego
rozpuszczenia skrzepów i powstania skazy
krwotocznej.
Stosowane podczas krwotoków przy
wycięciu prostaty, po ekstrakcjach
zębowych, przy krwotoku miesiączkowym,
po przedawkowaniu leków
trombolitycznych.

Naturalne systemy przeciwzakrzepowe
są odpowiedzialne za utrzymanie płynności krwi i stanowią
mechanizm obronny przed zakrzepicą
Czynniki pochodzenia osoczowego:
-antytrombina III (AT III)– białko produkowane w
wątrobie wiążące zaktywowane czynniki krzepnięcia krwi
(proteazy). Jest ona czynnikiem aktywowanym przez
heparynę która łącząc się z AT III zmienia konformację
miejsc wiążących proteazy zwiększając ich powinowactwo
do AT III(ok. 1000-krotnie),
-białko C (w połączeniu z białkiem S) to zymogen osoczowy
inaktywujący białka kofaktorowe Va i VIIIa. Jego aktywacja
zachodzi pod wpływem trombiny, ale tylko w obecności
produkowanej przez śródbłonek trombomoduliny
-Inhibitor szlaku czynnika tkankowego TFPI (tissue
factor pathway inhibitor) wiąże się z czynnikiem Xa i w tym
kompleksie hamuje reakcje czynnika VIIa z czynnikiem
tkankowym

Naturalne systemy przeciwzakrzepowe
Czynniki pochodzenia śródbłonkowego
-prostacyklina (PGI
2
) wydzielana aktywnie
przez komórki śródbłonka, hamuje ona
agregację płytek, wydzielanie czynników
płytkowych i rozszerza naczynia krwionośne
- siarczan heparanu związany z powierzchnią
komórek śródbłonka ( podobnie strukturalne do
heparyny) aktywuje lokalnie antytrombinę III
- trombomodulina – białko błonowe komórek
śródbłonka umożliwia aktywację białka C przez
trombinę

Leki wpływające na układ
krzepnięcia krwi można
podzielić na dwie grupy:
1. Leki hamujące krzepnięcie
(anticoagulativa)
2. Leki ułatwiające
krzepnięcie (haemostatica)

Leki hamujące krzepliwość krwi - Antycoagulativa
1.Heparyna i jej pochodne
heparyna
heparyny małocząsteczkowe
heparynoidy sulodeksyd
2 Antagoniści witaminy K
pochodne hydrokumaryn:
dikumarol warfaryna
pochodne indandionu:
fenindion, anisyndion
3. Leki trombolityczne
streptokinaza, urokinaza,
tkankowy aktywator plazminogenu
4. Leki antyagregacyjne
kwas acetylosalicylowy,
dazoxiben (hamuje
syntezę TXA
2
), epoprostenol
(syntet. PGI
2
)
5. Leki defibrynujące
ankrod, batroksobina
6. Środki hamujące krzepnięcie in vitro:
heparyna, cytrynian Na
(3,8%),
szczawian Na (0.1%), EDTA

Leki wzmagające krzepliwość krwi -
Haemostatica
1
. Działające systemowo:
witamina K, osocze (świeżo
mrożone)
2.
Leki hamujące fibrynolizę - inhibitory plazminogenu
kwas aminokapronowy aprotynina
3. Środki działające miejscowo:
używane w chirurgii:
błony fibrynowe, gąbki fibrynowe,
trombina w postaci zasypek,
kształtki zawierające czynniki
krzepnięcia (do kości)
alginian wapniowy (4% roztwór)
leki ściągające:
kwas taninowy, ałun, chlorek
żelazowy (stężony roztwór)

• Jest mieszaniną poliestrów siarkowych
glikozaminoglikanów (mukopolisaccharydów) o
m. cz. 16.000-17.000.
• Jest silnym kwasem zawierającym dużą ilość
zdysocjowanych grup siarczanowych i
karboksylowych.
• Produkowana jest z tkanki płucnej bydła lub
błony śluzowej jelit świń jako tzw. heparyna
niefrakcjonowana.
•Można ją rozdzielić na frakcję α i β.
•Przeciwzakrzepowo działa tylko frakcja α.
•Uaktywnienie frakcji β wymaga poddanie jej
procesowi sulfonowania.
Aktywność heparyny wyraża się w jednostkach
międzynarodowych. (1 j.m. = 1/130 mg
międzynarodowego standardu heparyny)
Heparyna

•Heparyna występuje w ziarnistościach
zasadochłonnych komórek tucznych.
•Uwalniana jest z tych komórek do krwi
podczas ich rozpadu.
Jest endogennym czynnikiem zapobiegającym
powstawaniu zakrzepów !!!!!
Ponadto
-
przyśpiesza rozkład lipoprotein poprzez
nasilenie aktywności lipazy lipoproteinowej,
- wpływa supresyjnie na odpowiedź układu
odpornościowego poprzez hamowanie:
odpowiedzi typu komórkowego, reakcji
przeciwciał z antygenami i aktywności układu
dopełniacza.

Mechanizm działania
heparyny
Polega na zwiększaniu we
krwi aktywności antytrombiny
III (AT III).
W kompleksie z AT III hamuje
aktywność takich czynników
krzepliwości jak:
trombina
(IIA) oraz czynników Xa, IXa,
XIa i XIIa,

Heparyna - farmakokinetyka
• Nie jest wchłaniana w przewodzie
pokarmowym i dlatego musi być podawana
parenteralnie – dożylnie lub podskórnie
(
domięśniowo może wywołać duże krwiaki !!!1
)
• We kwi wiąże się z lipoproteinami,
globulinami i fibrynogenem
• Jest intensywnie wiązana przez śródbłonek
naczyń i usuwana przez układ siateczkowo-
śródbłonkowy
• W wątrobie jest szybko metabolizowana do
uroheparyny
• W moczu obok ww metabolitu, może się
pojawić także w postaci niezmienionej
zwłaszcza po podaniu dożylnym

•
Okres półtrwania heparyny wynosi ok.
1-1,5 godz. i zależy od wysokości dawki.
• Działa ok. 2-4 godz.
•Po podaniu heparyny stężenie leku
szybko spada, gdyż ulegają wysyceniu
miejsca jego wiązania, po czym
następuje zwolnienie tego spadku
(kinetyka saturacji).
• Podawanie kolejnych dawek znacznie
wydłuża okres półtrwania i grozi
wystąpieniem działań niepożądanych.
• Przy dłuższym podawaniu działanie
leku jest słabo przewidywalne, co
wymaga konieczności przeprowadzania
testów krzepnięcia i korekty stosowanej
dawki.

Heparyna – zastosowanie
•
W lecznictwie wykorzystywana do
hamowania krzepliwości krwi in vivo i in
vitro.
• W lecznictwie wykorzystywana jest w
postaci soli wapniowej lub sodowej.
• Stosowana jest do zapobiegania
wykrzepianiu się krwi w naczyniach
krwionośnych:
-
przed i po zabiegach chirurgicznych
zwłaszcza na sercu, płucach i naczyniach
krwionośnych
- przy wymiennym przetaczaniu krwi
- w ostrej fazie zawału serca
- przy dializach z wykorzystaniu sztucznej
nerki
• W weterynarii obok zastosowania w
chirurgii, używana najczęściej in vitro w celu
zabezpieczena próbek krwi pobieranych w
celu uzyskania osocza.

Heparyna - działania niepożądane
1.
Przy przedawkowaniu :
krwawienia ,
krwotoki, niemożliwość uzyskania hemostazy
w warunkach operacji, wylew krwi do
nadnerczy i niewydolność tego gruczołu
2. Po długotrwałym stosowaniu:
trombocytopenia,
która może przyjmować 2
postacie:
- wczesną
(po 3-5 dniach) o umiarkowanym
nasileniu, podczas której działanie heparyny ulega
nasileniu
-
późną
(po ok. 8 dniach) o dużym nasileniu,
podczas której produkowane są przeciwciała
przeciwpłytkowe, w wyniku czego dochodzi do
agregacji płytek i powstają zakrzepy, a także
znoszone jest działanie przeciwzakrzepowe
heparyny

Przy przedawkowaniu heparyny lub w celu
przerwania jej działania po zabiegach
chirurgicznych podaje się
Siarczan protaminy
•
Jest on mieszaniną zasadowych
polipeptydów izolowanych z nasienia łososia
• Silnie wiąże heparynę przywracając
krzepliwość krwi
•
W wyższych dawkach wchodzi w interakcję
z płytkami i fibrynogenem, co może wywołać
efekt przeciwzakrzepowy
Dlatego powinno się podawać dawkę
minimalną siarczanu protaminy liczoną : 1
mg protaminy na 100 jednostek heparyny
pozostającej w organizmie pacjenta
najczęściej w postaci powolnego wlewu
dożylnego.

Heparyny drobnocząsteczkowe
LMWHs ( low-molecular-weight
heparins)
Są to leki przeciwkrzepliwe o masie od 5000
d0 12000 daltonów (ok. 15 jednostek
monosacharydowych)
Otrzymywane są z heparyny
niefrakcjonowanej poprzez filtrację
chromatograficzną, degradację
enzymatyczną, strącanie etanolem, lub przez
degradację chemiczną lub np. przy użyciu
kwasu azotowego czy nadtlenku wodoru i
octanu miedzi
Do LMWHs należą:
enoksaparyna, dalteparyna,
nadroparyna, tinzaparyna,
parnaparyna, ardeparyna,
rewiparyna

• Mechanizm działania heparyn
małocząsteczkowych związany jest głównie z
hamowaniem aktywność czynnika Xa,
•Słabo wiążą natomiast trombinę,
•Słabiej zatem od heparyny hamują agregację
płytek.
• Są podawane tylko podskórnie.
• Mają znacznie dłuższy okres półtrwania niż
heparyna.
Heparyny drobnocząsteczkowe

• Efekty są bardziej przewidywalne, związane są
z wysokością dawki
• Przy dłuższym podawaniu nie wymagają
konieczności przeprowadzania testów
krzepnięcia .
•
Wywołanie trombocytopenii oraz zakrzepicy
związanej z wytworzeniem przeciwciał
przeciwpłytkowych jest po podaniu heparyn
małocząsteczkowych nie występuje.
•Są lekami bezpieczniejszymi w porównaniu z
niefrakcjonowaną heparyną

Inne antykoagulanty niezależne od
antytrombiny III
Są to pochodne m.in. pochodne
hirudiny
wytwarzanej przez pijawki lekarskie –
bezpośredniego inhibitora trombiny
Należy do nich:
Lepirudyna
- zsyntetyzowana na drodze
rekombinacji
Hirugen
- peptyd otrzymany z hirudyny
Leki te stosuje się głównie podczas
trombocytopenii późnej wywoływanej przez
heparynę.

Leki hamujące krzepliwość krwi
stosowane doustnie
Należą do nich środki hamujące aktywność
witaminy K w syntezie czynników
krzepnięcia
antagonistami witaminy K.
Do leków z tej grupy antykoagulantów używanych w
lecznictwie należą:
• warfaryna, fenoprokumon i acenokumarol
(pochodne 4-hydroksykumaryny)
• anisyndion, fenindion (pochodne indan-1,3-
dionu)
Do tej grupy związków należą także rodentycydy
antykoagulacyjne np
. dikumarol,
bromadiolon,brodifakum,difenadion i in.
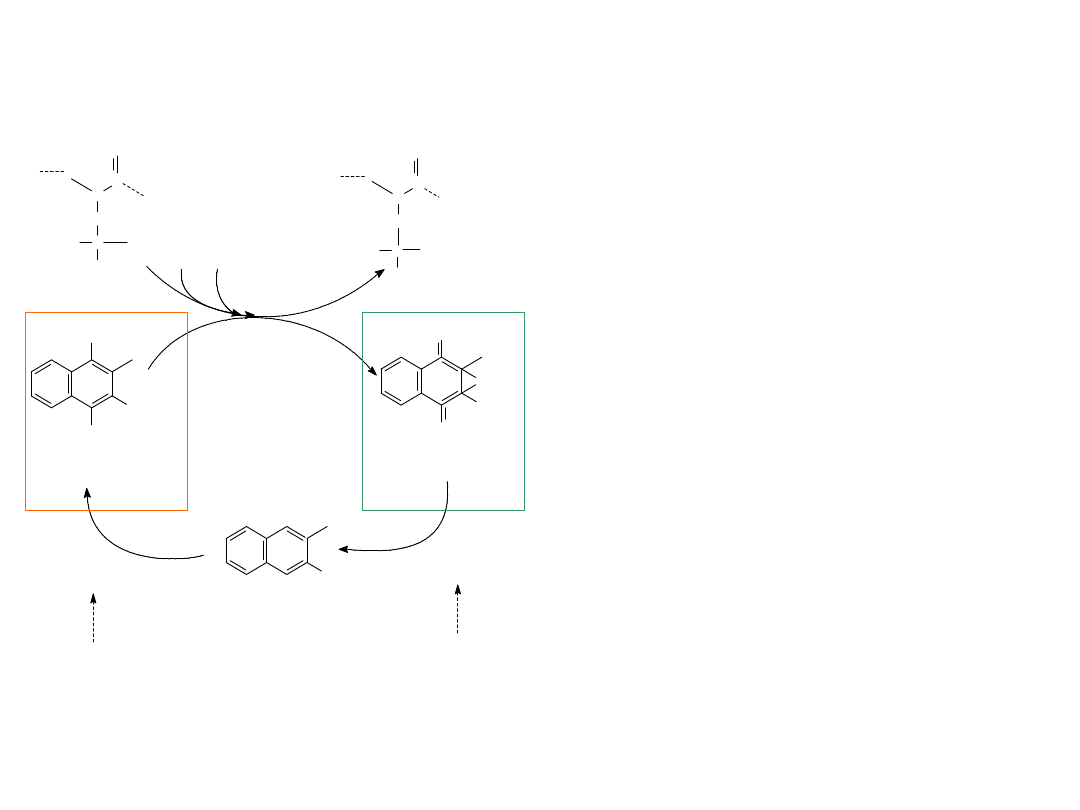
Witamina K bierze udział w
wątrobie, w syntezie czynników
krzepnięcia krwi - protrombiny
(II), prokonwertyny (VII),
czynników IX (Christmasa) i X
(Stuarta).
Pod wpływem witaminy K, 9-13
reszt glutaminowych
wbudowanych w strukturę tych
czynników krzepnięcia (od końca
aminowego) przekształcana jest w
kwas γ-karboksyglutaminowy.
Umożliwi on przyłączanie do tych
czynników jonów Ca, co jest
warunkiem ich aktywności . Przy
niedoborze witaminy K, ww
czynniki krzepnięcia są
niepełnowartościowe i występuje
skaza krwotoczna.
W czasie tej reakcji witamina K
ulega pod-wójnemu utlenieniu i
przechodzi z
aktywnej formy
hydrochinonowej
w
nieaktywną
formę epoksydową
. Warunkiem
reakty-wacji cząsteczki witaminy
K jest przejście podwójnej
redukcji, co przeprowadzają dwie
specyficzne reduktazy.
Witamina K i jej rola
C
C
CH
2
C
H
COOH
C
C
CH
2
O
O
C
H
COOH
COOH
NH
NH
H
kwas
y-karboksy-
glutaminowy
kwas
glutaminowy
R
OH
OH
R
O
O
O
R
witamina K
forma epoksydowa
witamina K
forma hydrochinonowa
witamina K
forma chinonowa
REDUKTAZA
witaminy K
REDUKTAZA
witaminy K
ANTAGONISTA
witaminy K
ANTAGONISTA
witaminy K
hamowanie
hamowanie
O
2
CO
2

Antagoniści witaminy K
Działają tylko in vivo
Działają z opóźnieniem - po wyczerpaniu
się czynników krzepnięcia
Czas eliminacji poszczególnych czynników
jest zróżnicowany np. 20-30 godz. dla
czynnika IX, 45-72 godz. dla protrombiny
Stosowane głównie u ludzi ze skłonnością
do nadkrzepliwości.
•
Należy kontrolować czas
protrombinowy. !!!!

•
Stosowanie zaczyna się dawką
nasycającą a następnie podaje dawki
podtrzymujące
•Przy przedawkowaniu lub zatruciu
podaje się witaminę K1
•
W weterynarii stosunkowo częste
problemy z zatruciami zwierząt
antykoagulantami, gdyż środki te
stosuje się w trutkach przeciw
gryzoniom
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
cw11b 10 Farmakologia ukladu oddechowego druk
Farmakologia układu współczulnego, Naukowy, farmakologia
I Farmakologia układu nerwowego
cw13 10 Farmakologia ukladu plciowego druk
FARMAKOLOGIA UKŁADU KRĄŻENIA
FARMAKOLOGIA UKŁADU ADRENERGICZNEGO
Farmakologia układu przywspółczulnego, Naukowy, farmakologia
w11.farmakologia układu oddechwego, wykłady PMWSZ w Opolu - Pielęgniarstwo, Farmakologia
w16.farmakologia ukladu pokarmowego, wykłady PMWSZ w Opolu - Pielęgniarstwo, Farmakologia
Farmakologia ukladu pozapiramidowego, farmacja, układ nerwowy
04 - 2000 - biochemia układu krzepnięcia i fibrynolizy cz 2
w10.FARMAKOLOGIA UKŁADU KRWIONOŚNEGO3, wykłady PMWSZ w Opolu - Pielęgniarstwo, Farmakologia
FARMAKOLOGIA UKLADU NERWOWEGO, Magisterka materiały, Farmakologia
Farmakologia układu oddechowego
więcej podobnych podstron