
Chemia fizyczna w
układach biologicznych
2008

Chemia fizyczna zajmuje się fizycznymi podstawami procesów chemicznych
i usiłuje wyjaśnić strukturę materii i jej zmiany odwołując się do pojęć
podstawowych, takich jak atomy, elektrony, energia.
Najogólniejszy opis materii polega na wyróżnieniu trzech stanów
skupienia:
gazów, cieczy i ciał stałych.
Gaz stanowi stan płynny materii, wypełniającej całą dostępną objętość
zbiornika, w której została zamknięta.
Ciecz jest płynnym stanem materii charakteryzującym się dobrze
zdefiniowaną powierzchnią. W polu grawitacyjnym ciecz wypełnia dolną
część zbiornika, w którym została zamknięta.
Ciało stałe zachowuje kształt niezależny od kształtu zbiornika w
którym się znajduje
.

Znaczenie terminu stan:
a. stan skupienia (gazowy, ciekły, stały)
b. opis pewnej wybranej części materii określający pewne
charakteryzujące ją wartości
objętości, ciśnienia, temperatury i ilości substancji
.
Objętość próbki V jest miarą przestrzeni jaką próbka
zajmuje
.
Ciśnienie p przedstawia siłę działającą na jednostkową
powierzchnię: ciśnienie = siła/powierzchnia;
jednostka paskal [Pa] 1 Pa=1 N.m
-2
; 1 bar = 10
5
Pa
Temperatura jest wielkością, która określa kierunek przepływu
energii, gdy ciało znajduje się w kontakcie z innym: energia
(ciepło) przepływa od ciała o wyższej do ciała o niższej
temperaturze; jednostka T [K] = t [ºC]+273,15

Masa, m, ciała jest miarą ilości materii w tym ciele;
jednostka [kg]
Mol ,n, ilość substancji w próbce n = masa/(masa molowa) =
liczba cząsteczek/ (liczba cząsteczek w molu)= liczba
cząsteczek/ liczba Avogadro; N
A
=6.02214●10
23)

Równanie stanu przedstawia matematyczną zależność między
objętością, ciśnieniem, temperaturą. Te trzy zmienne intensywne
(wielkość ich zależy od ilości) nie są nawzajem niezależne.
/
m
m
pV
RT
V
V n
=
=
Dla gazu doskonałego
:
1
1
1
1
8.3145 [
] lub [
]
-
-
-
-
=
=
pV nRT
R
kPa l K mol
J K mol
gg
g
g
g
1
nRT
p
p
V
V
=
:
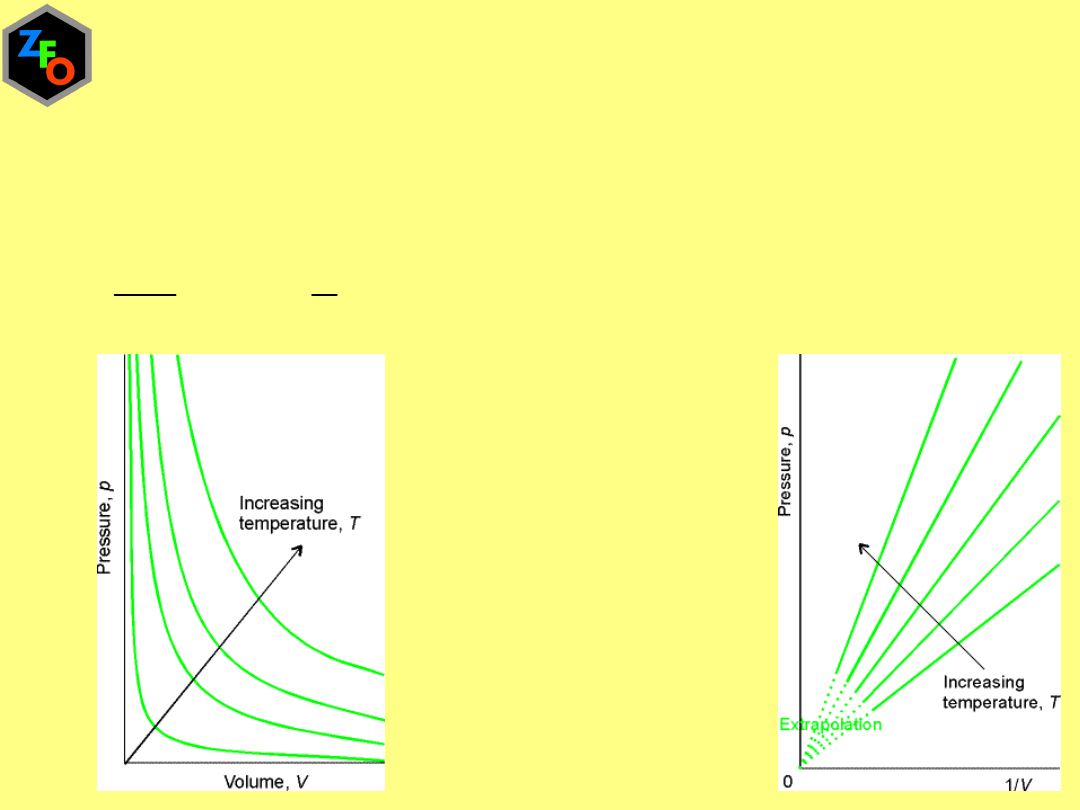
Prawo Boyle`a
Wykres zależności p=f(V)
dlaT=const
nosi nazwę
izotermy
Przemiana izotermiczna T=const
Równanie Clapeyrona

nRT
V
V T
p
=
:
Prawo Gay-Lussaca
Zasada Avogadro:
W danej temperaturze i pod danym ciśnieniem
równe objętości różnych gazów zawierają te same
ilości cząsteczek
V n
:
Przemiana izobaryczna p=const

Przemiana izochoryczna, V=const
Prawo
Charlesa
nRT
p
p T
V
=
:
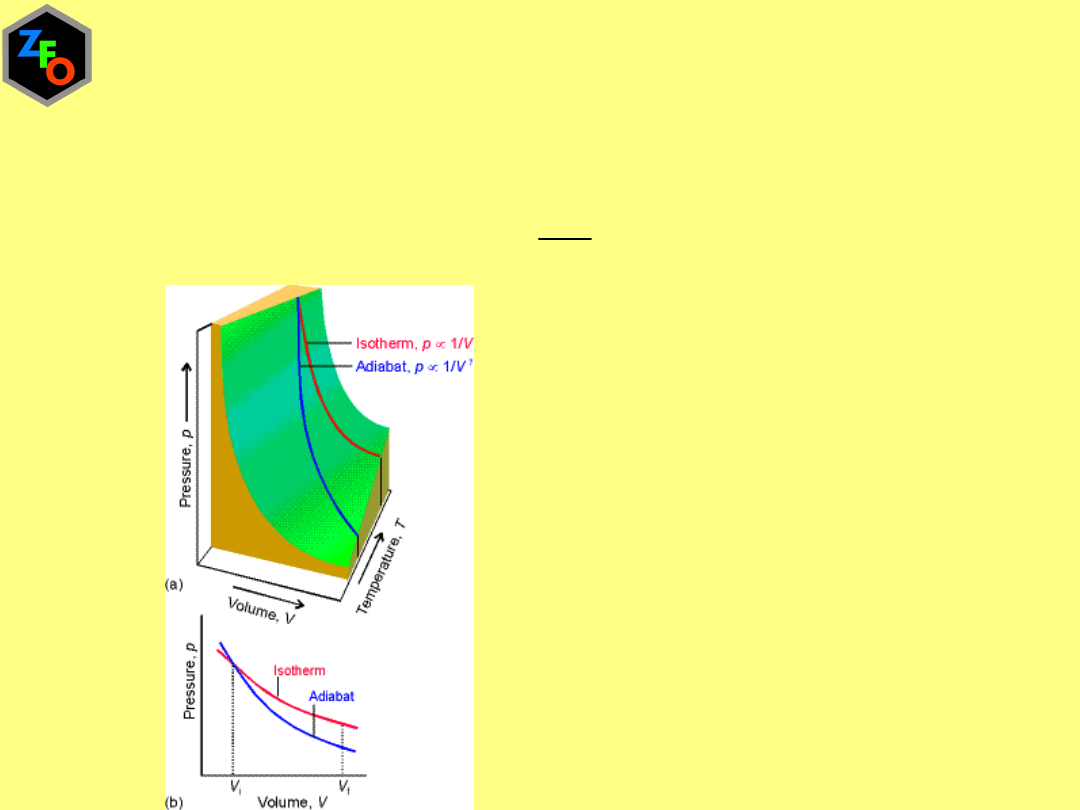
Przemiana adiabatyczna,
bez wymiany ciepła z otoczeniem
p
V
c
pV
const
c
k
k
=
=
Prawo Poissona

1 1
2 2
1 1
2 2
1
2
1
2
pV
pV
pV
pV
n
n
RT
RT
T
T
=
=
�
=
Zastosowania prawa gazu doskonałego
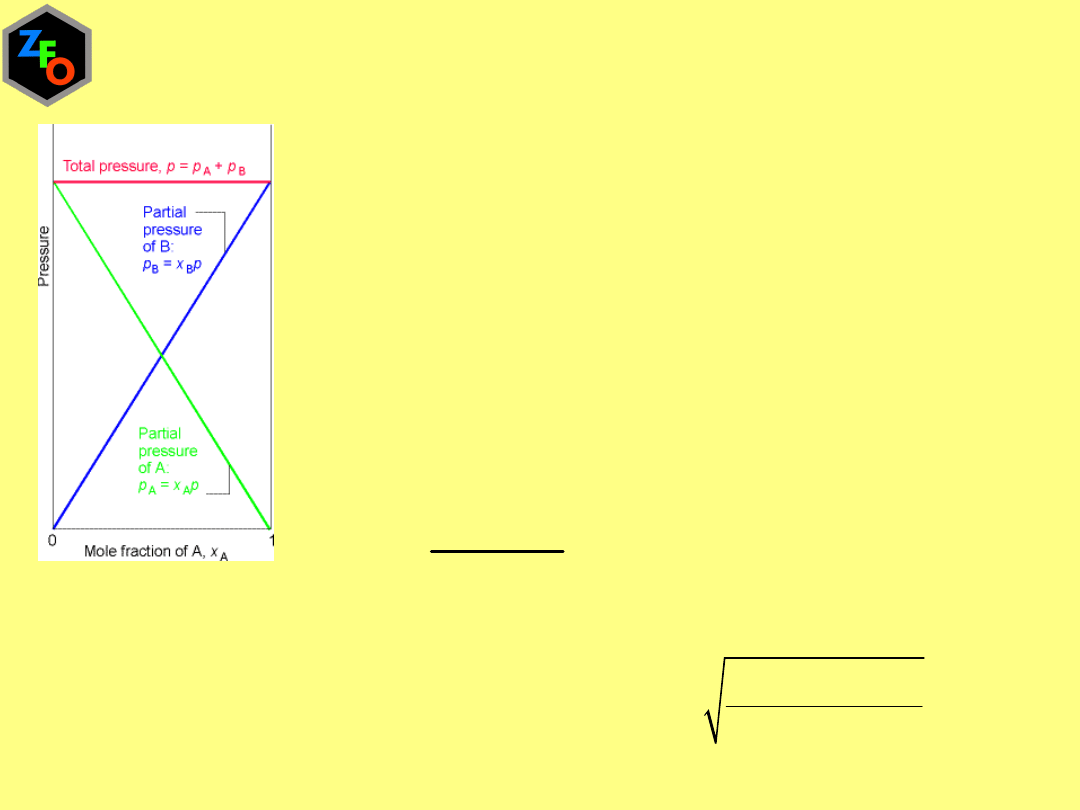
Mieszaniny gazów i ciśnienie cząstkowe
Prawo Daltona: ciśnienie wywierane przez mieszaninę gazów
doskonałych jest sumą ciśnień, jaki wywierałby każdy z gazów z
osobna, gdyby zajmował taką samą objętość jaką zajmuje
mieszanina.
Udział jaki wnosi dany gaz do ciśnienia całkowitego nosi nazwę
ciśnienia cząstkowego albo parcjalnego.
A
B
A
B
A
B
n RT
n RT
p
p
to
p p
p
V
V
=
=
=
+

Ułamek molowy, x
A
przedstawia ilość substancji chemicznej A
wyrażoną jako ułamek całkowitej ilości wszystkich cząsteczek
znajdujących się w próbce
.
1
..
A
A
i
i
A
B
i
n
x
n
n
n
n
=
=
+ + +
�
A
A
p
x p
=
Jest to ogólna definicja ciśnienia cząstkowego,
dla gazów doskonałych równoważna prawu Daltona
Uzasadnienie:
Z prawa Clapeyrona
RT
p
V
n
=
wstawiając do
:
=
=
A
A
A
A
n RT
n
p
otrzymamy
p
p
V
n
g
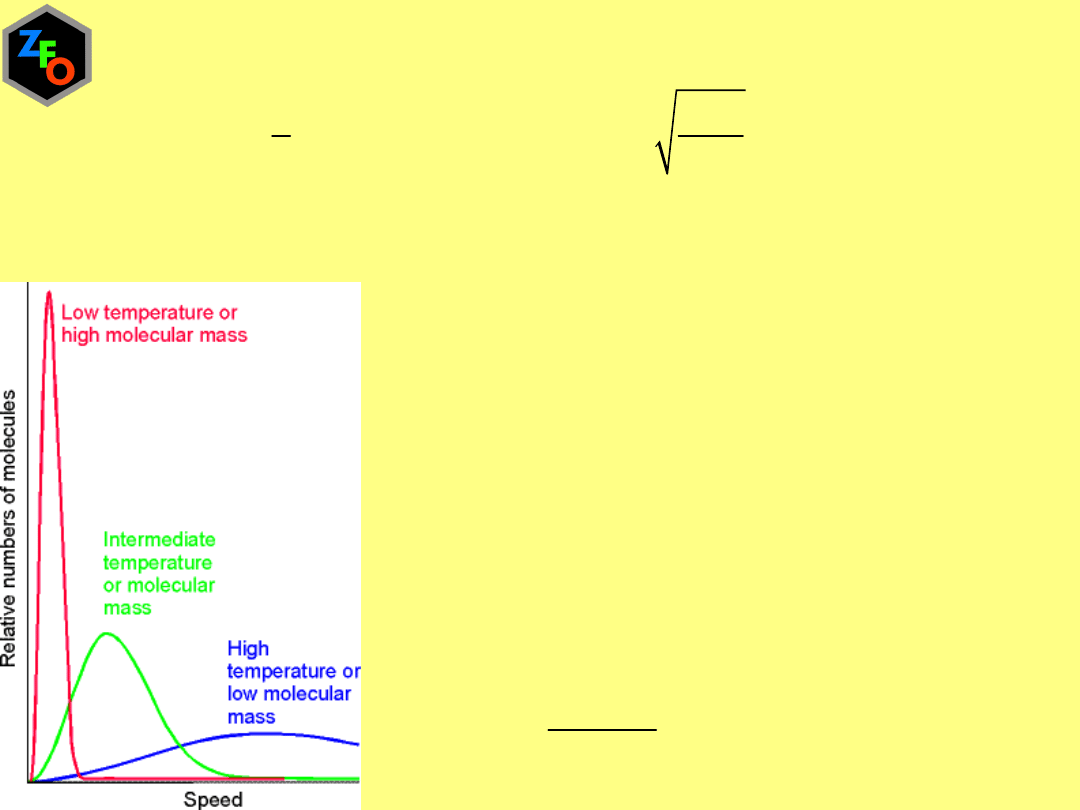
Teoria kinetyczna gazów
Założenia:
gaz składa się z cząstek znajdujących się w nieustannym
przypadkowym ruchu
wymiary cząsteczek są zaniedbywalnie małe,
mniejsze od drogi swobodnej
cząsteczki nie oddziaływują na siebie (poza zderzeniami
)
2
3
nMc
p
V
=
Gdzie c średnia szybkość kwadratowa
2
2
2
1
2
..
N
c
c
c
c
N
+ + +
=
2
1
3
3
RT
pV
nMc
nRT
c
M
=
=
�
=
2
3/2
2
/
4
2
Ms RT
M
f
s e
ds
RT
p
p
-
�
�
=
�
�
�
�
Rozkład szybkości Maxwella
Dyfuzja – proces samorzutnego mieszania się dwóch substancji
Eufuzja – wypływ gazu ze zbiornika
przez mały otwór w ścianie naczynia.
Prawo Grahama.
W danych warunkach ciśnienia i temperatury
szybkość eufuzji gazu jest odwrotnie proporcjonalna
do pierwiastka kwadratowego z jego masy molowej
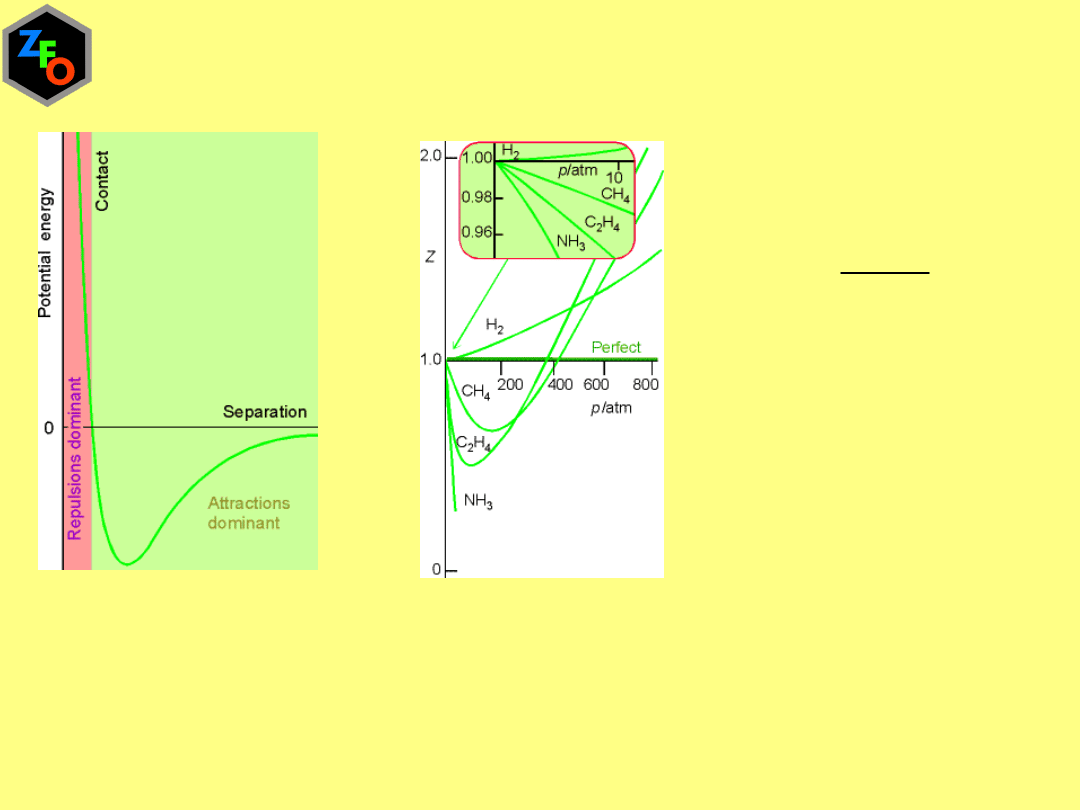
Gazy rzeczywiste
m
pV
Z
RT
=
Współczynnik ściśliwości Z
CO
2
2
1
....
m
m
m
B
C
pV
RT
V
V
�
�
=
+
+
+
�
�
�
�
Wirialne równanie stanu
1
, .
0
m
m
pV
Z
gdy V
tj gdy p
RT
=
�
� �
�
Równanie van der Waalsa
2
`
`
nRT
n
p
a
V nb
V
� �
=
-
� �
-
� �
2
m
m
RT
a
p
V
b V
=
-
-

Termodynamika
nauka o transformacjach energii
Układ jest interesującą nas częścią rzeczywistości, oddzielony od
otoczenia wyraźnymi granicami
Otoczenie jest miejscem, z którego dokonujemy obserwacji,
czyli wszystko to co nie należy do układu
Układ otwarty możliwy jest przepływ materii
i energii do otoczenia
Układ zamknięty możliwy jest przepływ
tylko energii do otoczenia
Układ izolowany albo zamknięty niemożliwy jest
przepływ materii ani energii do otoczenia

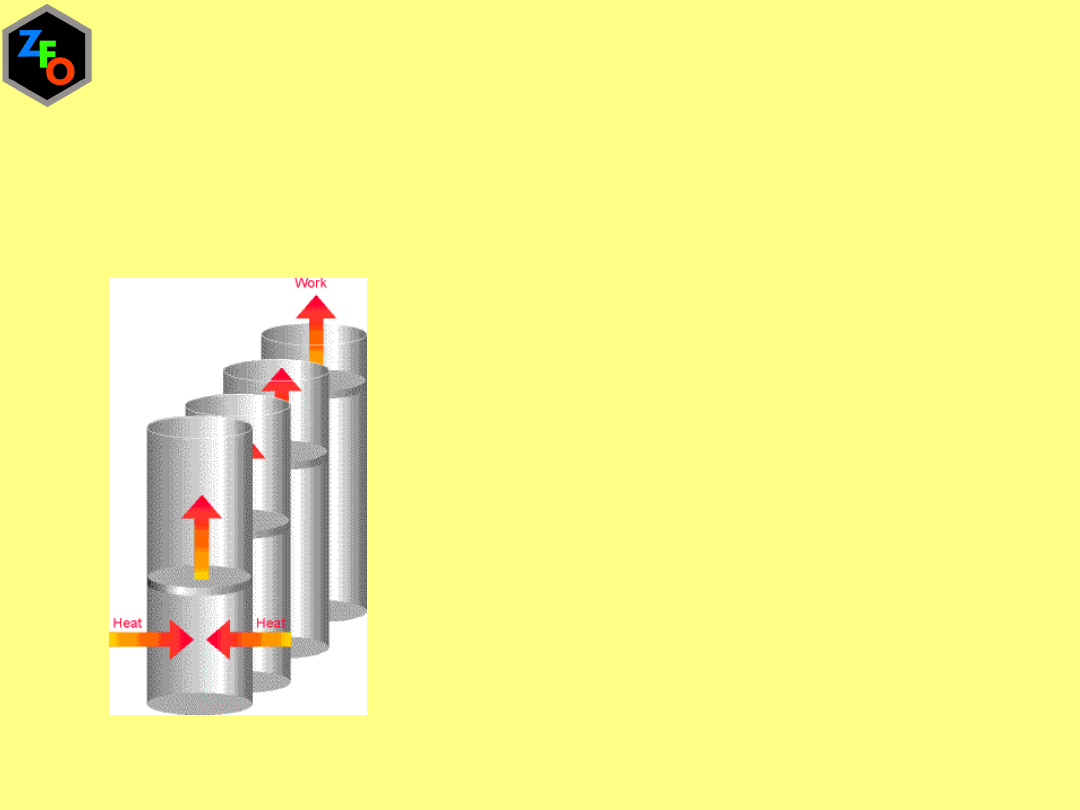
Praca, ciepło i energia
Energia – zdolność do wykonania pracy
Pracą nazywamy przeniesienie energii w taki sposób, że może ona być
użyta do podniesienia w otoczeniu ciężaru na pewną wysokość
Ciepłem nazywamy przeniesienia energii następujące w wyniku różnicy
temperatur pomiędzy układem i otoczeniem.
W ujęciu molekularnym ciepło jest formą przekazywania energii,
które polega na chaotycznym ruch cząsteczek.
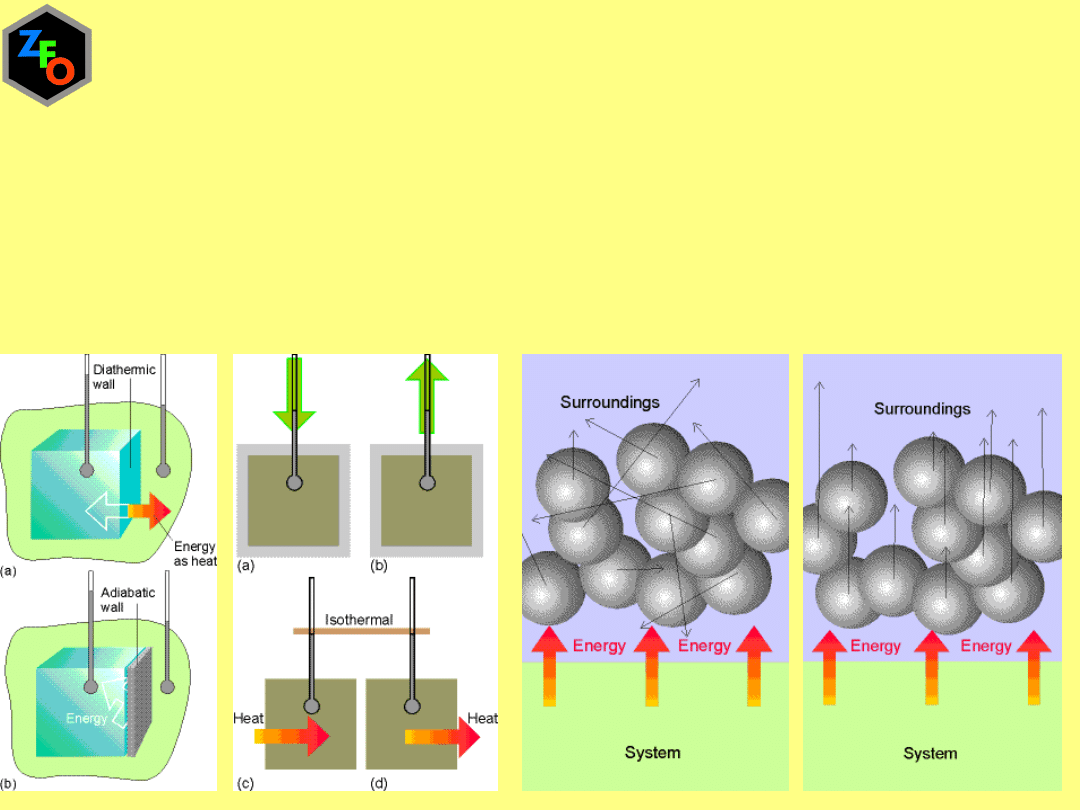
Procesy, które pochłaniają energię jako ciepło nazywamy endotermicznymi
Procesy uwalniające energię jako ciepło nazywamy egzotermicznymi

W termodynamice całkowitą energię układu nazywamy jego
energią wewnętrzną i oznaczamy jako U
k
p
U U U
D =
-
Energia wewnętrzna jest funkcją
stanu
Funkcją stanu nazywamy wielkość fizyczną,
której wartość zależy wyłącznie od stanu,
w jakim układ się znajduje, nie zaś od drogi,
po której do tego stanu doszedł
Parametry stanu układu to wielkości fizyczne
jednoznacznie określające stan układu, np.
ciśnienie (p), temperatura (T), objętość (V),
liczba moli (n
)
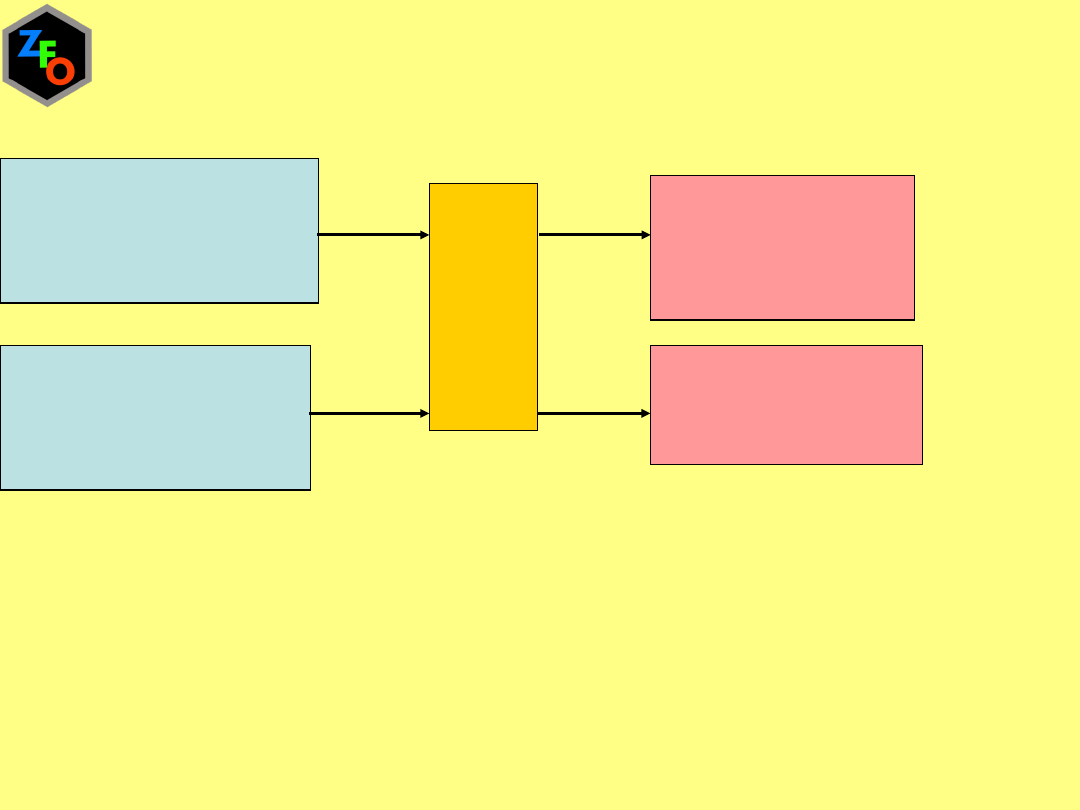
Energia dostarczona
na sposób pracy z
otoczenia
do układu
Energia dostarczona
na sposób ciepła z
Otoczenia do układu
UKŁAD
Energia oddana
na sposób pracy z
układu do otoczenia
Energia oddana
na sposób ciepła z
układu do otoczenia
+w
-w
-q
+q
w – wymiana energii na sposób pracy
q – wymiana energii na sposób ciepła
OTOCZENIE
Zmiana energii wewnętrznej układu otwartego (ΔU)
może nastąpić na sposób ciepła (q) lub na sposób pracy (w)

ΔU = q + w
równanie
Helmholtza
Jest to matematyczna postać pierwszej zasady
termodynamiki
Inna jej postać mówi, że
energia wewnętrzna układu izolowanego jest stała
ΔU = const (q = 0, w = 0)
lub
praca potrzebna do przejścia układu adiabatycznego z
jednego wyróżnionego stanu w drugi jest, bez
względu na jej rodzaj zawsze taka sama

Ogólne wyrażenie na pracę
dw
Fdz
=-
gdzie F – siła, dz - -przesunięcie
Rodzaj pracy
dw
uwagi
jednostk
i
objętościowa
-p
zew
dV -p
zew
ciśnienie zewnętrzne
dV zmiana objętości
Pa
m
3
powierzchnio
wa
γdσ
γ napięcie
powierzchniowe
dσ zmiana pola
powierzchni
N*m
-1
m
2
rozciągania
fdl
f naprężenie
dl zmiana długości
N
m
elektryczna
φdq
φ potencjał elektryczny
dq zmiana ładunku
V
C
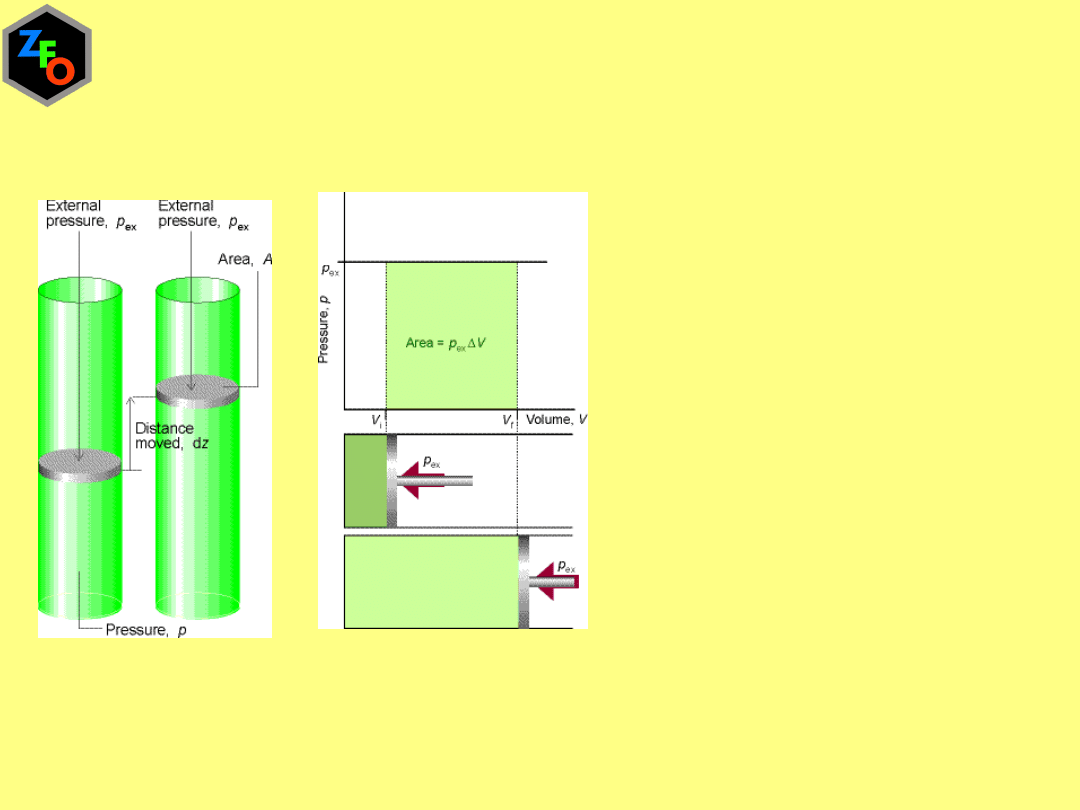
Praca objętościowa
(
)
k
p
zew
V
zew
zew
k
p
V
zew
dw
p dV
w
p
dV
p V V
w
p V
=-
=-
=-
-
=-
D
�
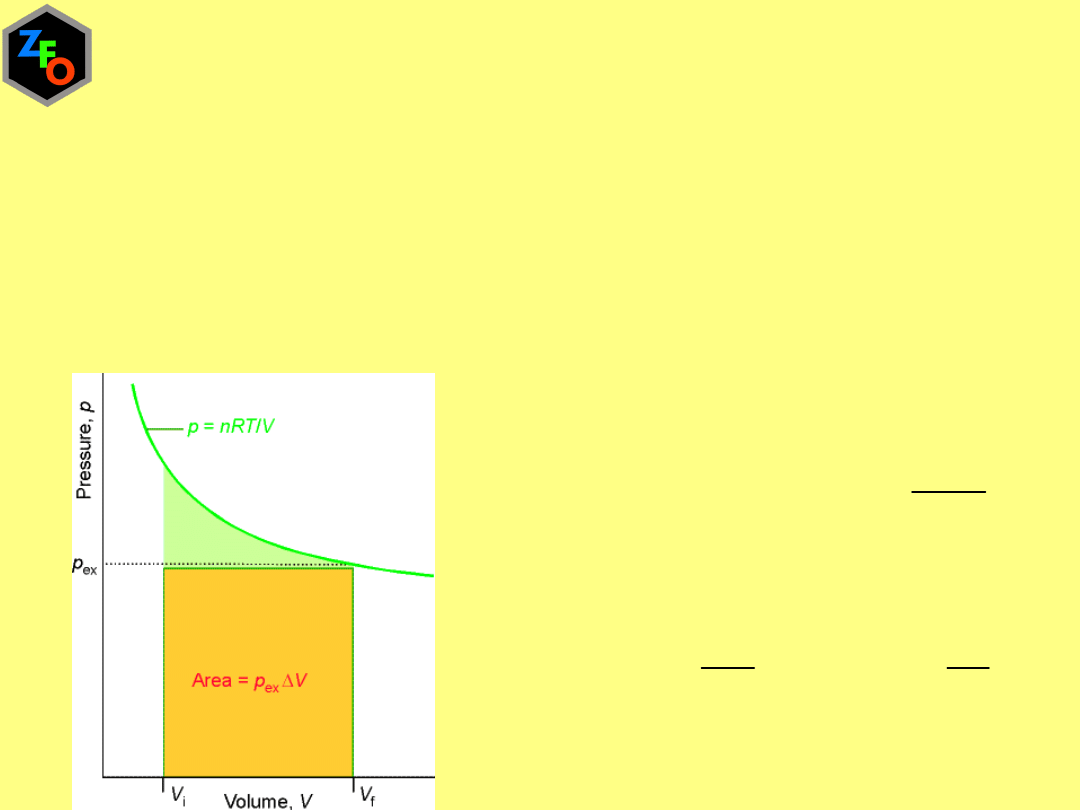
Rozprężanie odwracalne, równowagowe, p
zew
= p
k
p
zew
V
V
dw
p dV
pdV
w
pdV
=-
=-
=-
�
Odwracalne rozprężanie
izotermiczne
ln
k
p
V
k
V
p
nRT
pV nRT
p
V
V
dV
w
nRT
nRT
V
V
=
�
=
� �
=-
=-
� �
� �
� �
�
obj
z
dU dq dw
dw
= +
+
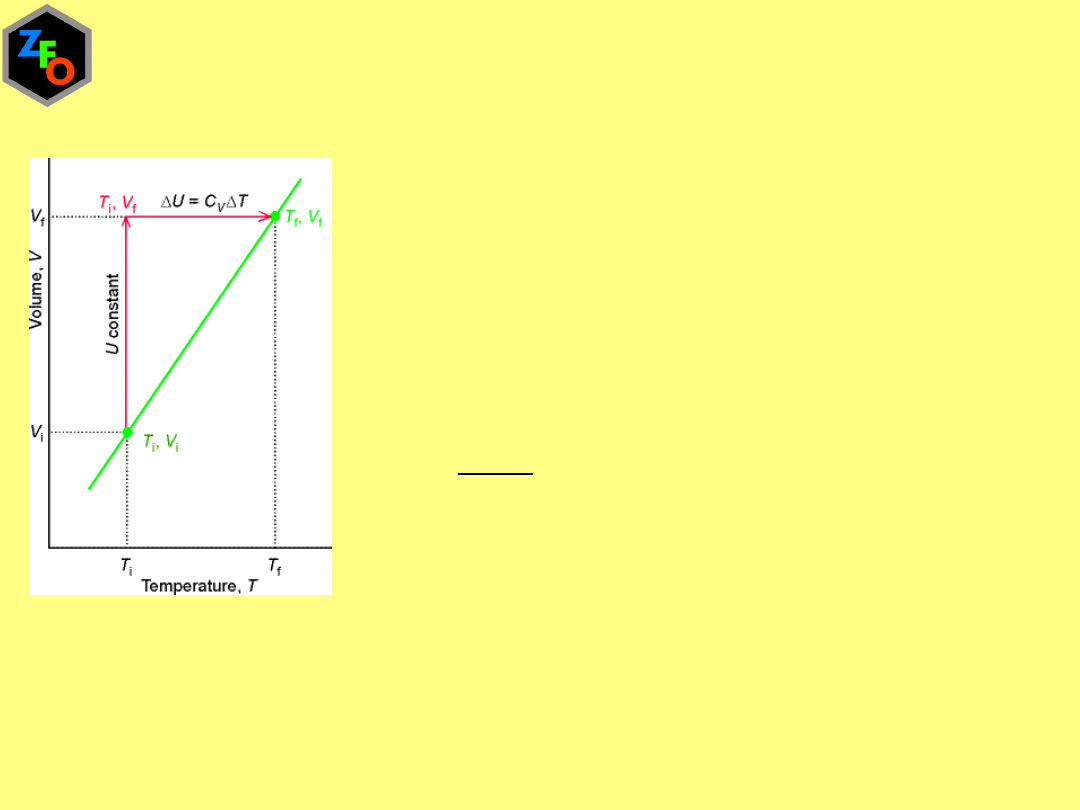
gdy V=const
V
dU dq
=
q C T
= D
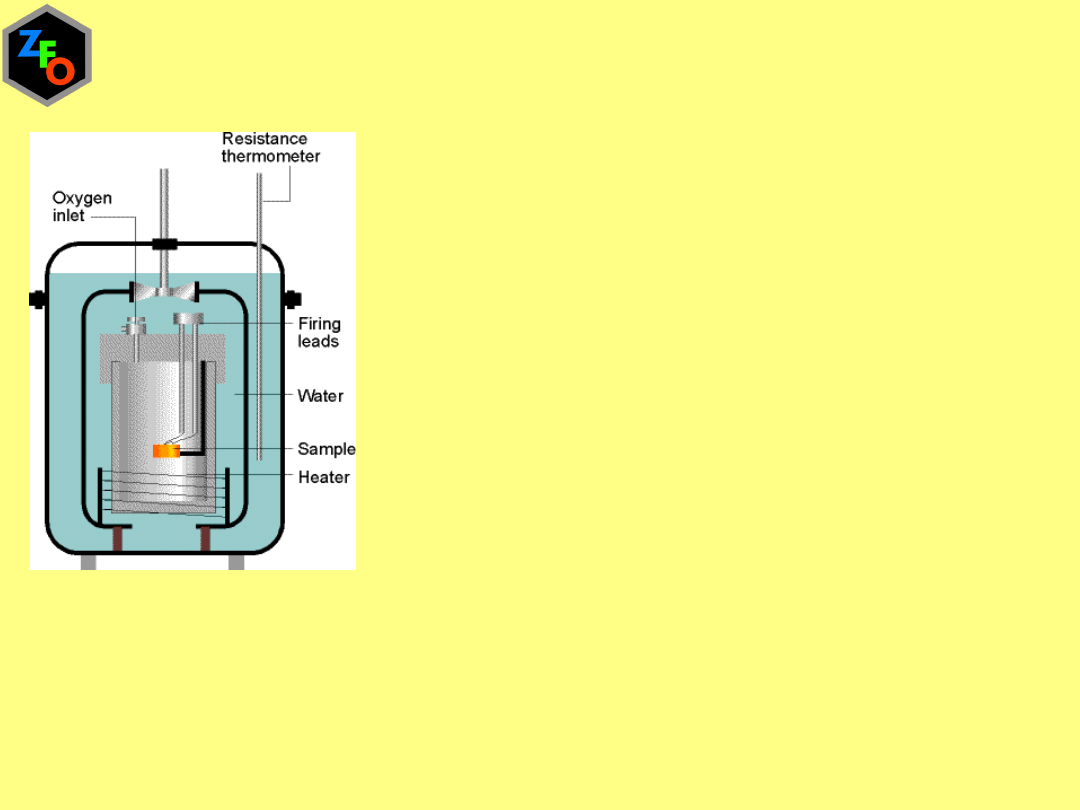
Ciepło wydzielane podczas spalania substancji
w bombie kalorymetrycznej
Wyznaczanie energii wewnętrznej
Pojemność cieplna
1
( , )
0
[
]
-
=
�
�
� �
� �
=
+
� �
� �
�
�
� �
� �
=
=
�
� �
=
=� �
�
� �
�
� �=
� �
�
� �
T
V
V
V
V
U U T V
U
U
dU
dV
dT
V
T
dla
V const
dV
U
dU dQ
dT
T
U
c
J K
T
g
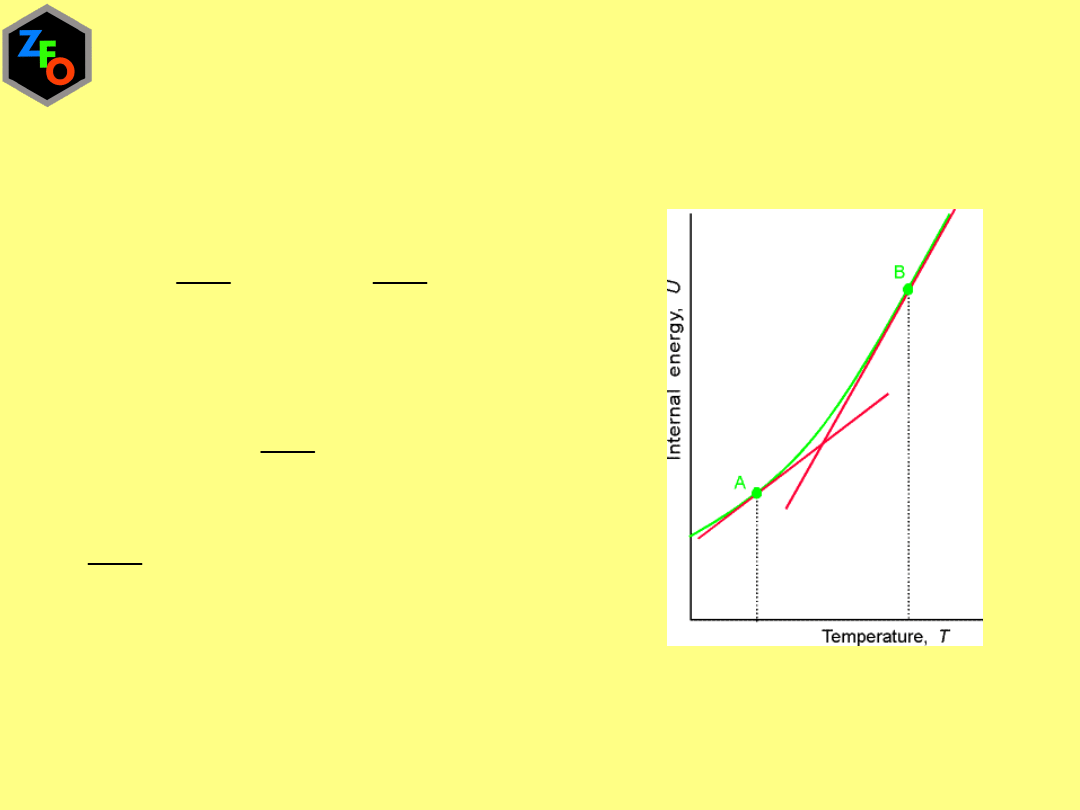
Pojemność cieplna w stałej objętości
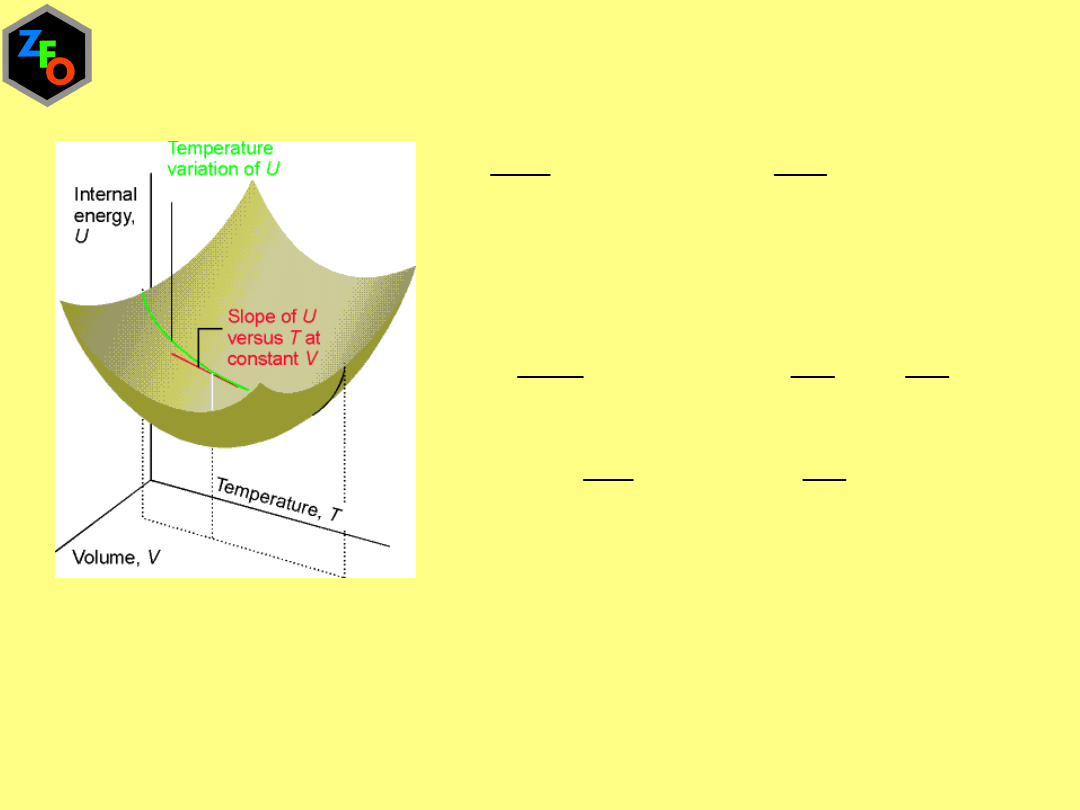
T
V
U
p
p T
V
T
�
�
� �
� �
=- +
� �
� �
�
�
� �
� �
dla gazu
doskonałego
0
V
T
nRT
p
nR
p
i
V
T
V
U
nR
stąd
p T
p p
V
V
�
� �
=
=
� �
�
� �
�
� �=- +
=- + =
� �
�
� �
W stałej temperaturze energia wewnętrzna układu
utworzonego z gazu doskonałego nie zależy od objętości
Dla warunków adiabatycznych q=0
V
ad
dU c dT w
=
=
v
c dT
pdV
=-
Dla gazu doskonałego
nRT
p
V
=

ln
ln
k
k
p
p
v
v
v
T
V
V T
V
k
k
V
p
p
c
c
nR
nR
k k
p p
dT
dV
c
nR
T
V
dT
dV
c
nR
T
V
T
V
c
nR
T
V
V T
V T
=-
=-
� �
� �
=-
� �
� �
� �
� �
� �
� �
=
�
�
inna postać adiabaty
p
V
c
c
pV
const
=

Podczas oddychania wydychamy około V=0,5 litra (5*10
-4
m
3
) powietrza
Przeciwko stałemu ciśnieniu p=1 at (101 kPa)
w=-pΔV=-(.01810
5
Pa)*(0.5*10
-4
m
3)
=-51 Pa*m
3
=-
51
J
w=-m*g*h=(7.0 kg)*(9.81 m*s
-2
)*(0.75 m)=-
52
J
CaCO
3
→CaO+CO
2
Tylko część dostarczonego ciepła
zwiększa energię wewnętrzną a część zostaje
oddana otoczeniu w postaci pracy
2 C
57
H
110
O
6
(s)+163 O
2
→114 CO
2
(g)+110 H
2
O(c)
163-114=49 moli, objętość maleje
i otoczenie wykonuje pracę na układzie,
Jaka jest zmiana energii wewnętrznej?

Entalpia
H U pV
= +
Ponieważ U, p oraz V zależą jedynie od
aktualnego stanu entalpia jest funkcją stanu
dla p=const
(
)
H
U
pV
U p V
D =D +D
=D + D
m
m
m
m
m
H
U
pV
H
U
RT
=
+
=
+
dla gazu doskonałego

H U pV
= +
Ponieważ U, p oraz V zależą jedynie od
aktualnego stanu entalpia jest funkcją stanu
dla p=const
dH dq
dla p const
=
=
Zmiana entalpii jest równa ciepłu
dostarczonemu do układu pod stałym
ciśnieniem
(dopóki
układ
nie
wykonuje
dodatkowej
pracy
objętościowej)

;
zew
zew
zew
zew
zew
H
U p V
U p
V
U q w q p
V w
p
V
H q p
V p
V q
D =D + D =D +
D
D = + = -
D
=-
D
D = -
D +
D =
Układ wykonuje pracę objętościową przeciwko ciśnieniu zewnętrznemu
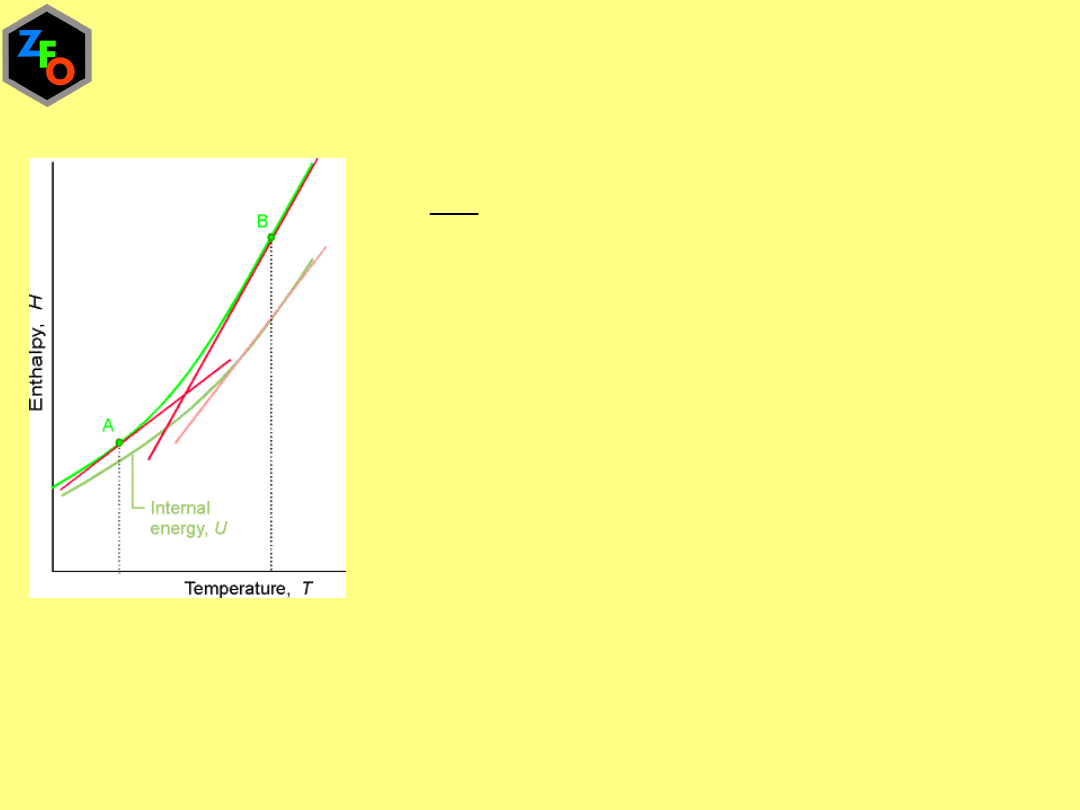
Pojemność cieplna pod stałym ciśnieniem (c
p
)
p
p
H
c
T
�
� �
=� �
�
� �
p
H c T
D = D
p
dH c dT
=
gdy c
p
nie zależy od
temperatury
dla p=const
dla gazy doskonałego c
p,m
=c
v.m
+R

Podsumowanie przemian gazu doskonałego
W przypadku każdej przemiany odwracalnej czy też nieodwracalnej
;
;
v
p
dU c dT dH c dT dU dH RdT
=
=
=
-
Dla przemian odwracalnych gazów doskonałych słuszne są zależności
:
Przemiana izotermiczna
:
2
1
1
2
ln
ln
=
=
=D -
V
p
w RT
RT
V
p
q
U w
0
dU dH
=
=
Przemiana izobaryczna:
=
=D =
= D = D
�
p
p
dH c dT
q
H
c dT
w p V R T

Podsumowanie przemian gazu doskonałego
Przemiana izochoryczna
:
0
=
=D =
=
�
v
V
dU c dT
q
U
c dT
w
Przemiana adiabatyczna
:
2
2
1
1
2
2
1
1
0;
ln
ln
ln
ln
V
V
p
q
dU
dw
c dT
pdV
T
V
c
R
T
V
T
p
c
R
T
p
=
=-
=-
=-
=
Termochemia
zajmuje się analizą wydzielonego i pochłoniętego
ciepła w reakcjach chemicznych
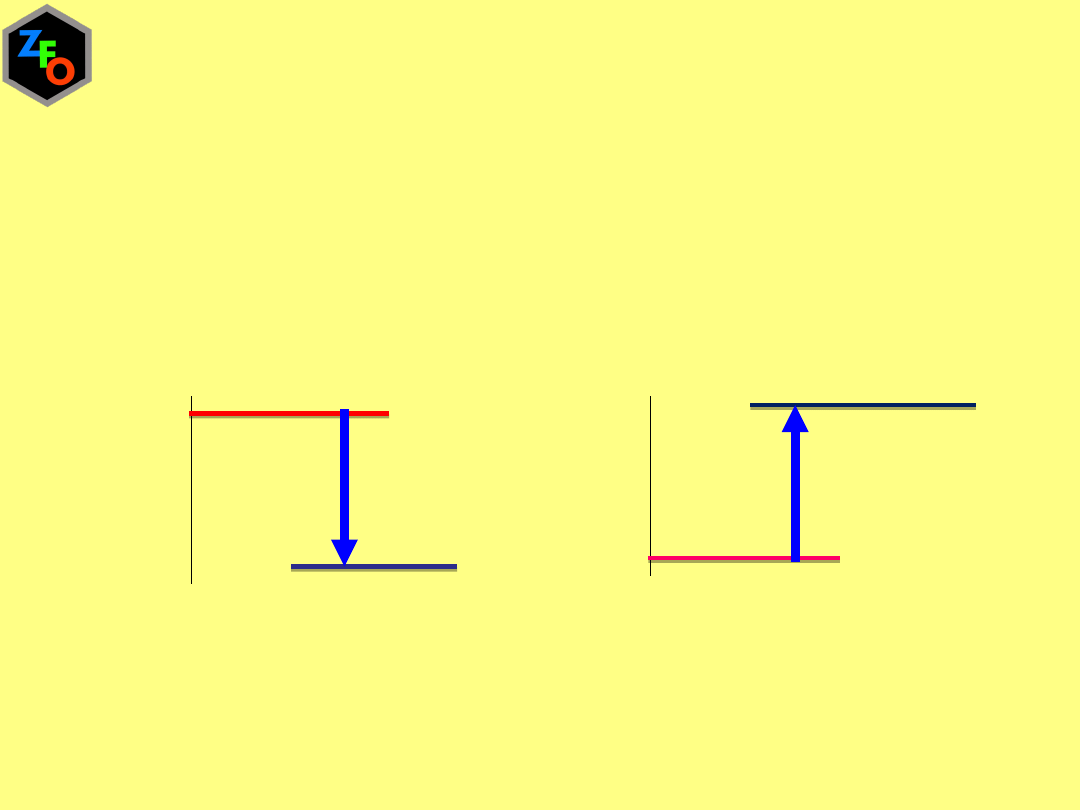
Zmiany entalpii a efekt energetyczny reakcji
substra
ty
produkty
substra
ty
produkty
-ΔH
+ΔH
ΔH
2
ΔH
1
ΔH
1
ΔH
2
r. egzoenergetyczna
r. endoenergetyczna
ΔH
2
-
ΔH
1
<0
ΔH<
0
ΔH
2
- ΔH
1
>0
ΔH>0
ΔH= ΔH(produktów)- ΔH(substratów)

ΔH
0
zmiana
entalpii
standardowej
czyli zmiana entalpii procesu, gdy wszystkie
substraty i produkty są w swoich stanach
standardowych w temperaturze przemiany
Stan standardowy substancji w danej temperaturze
odpowiada
jej czystej postaci pod ciśnieniem 1 bar
Stan standardowy pierwiastka w danej temperaturze i pod
ciśnieniem 1 bar jest stan odpowiadający jego najbardziej
stabilnej postaci w danej temperaturze
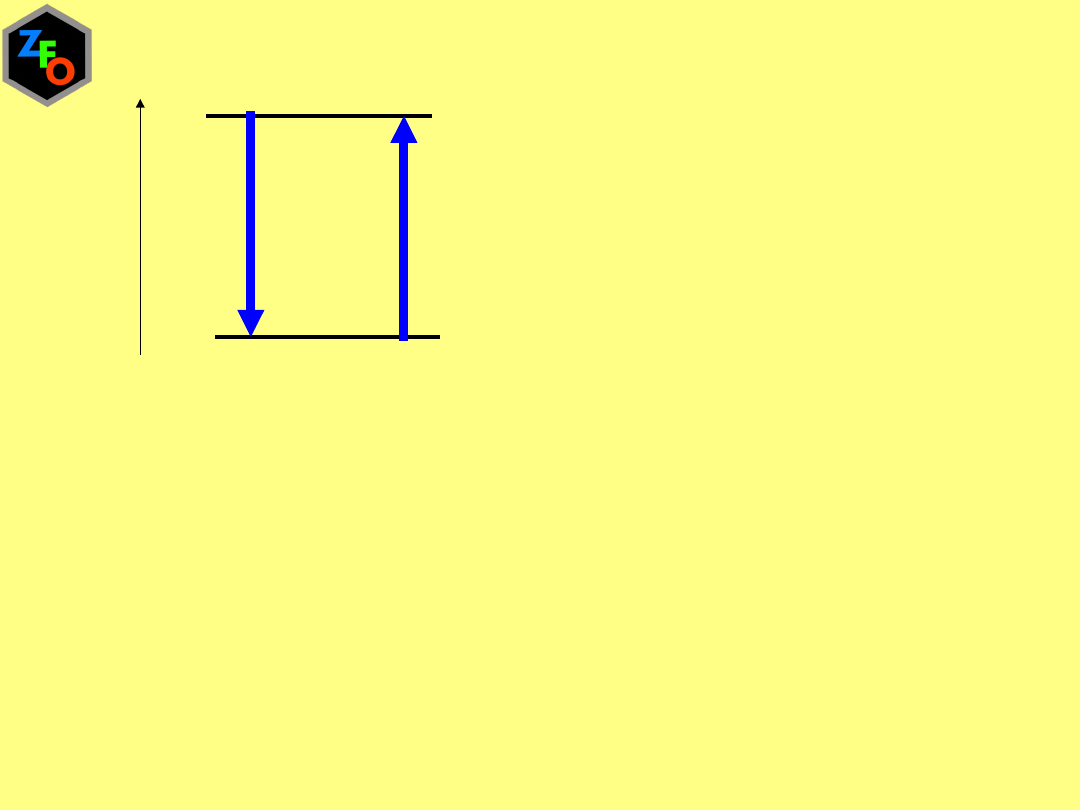
B
A
E
n
ta
lp
ia
,
H
Δ
H
0
(A
→
B
)
-Δ
H
0
(
B
→
A
)
Prawo Lavoisiera-Laplace`a
Efekt cieplny reakcji przebiegającej w danym kierunku jest równy
efektowi cieplnemu reakcji przebiegającej w kierunku odwrotnym
ze znakiem przeciwnym
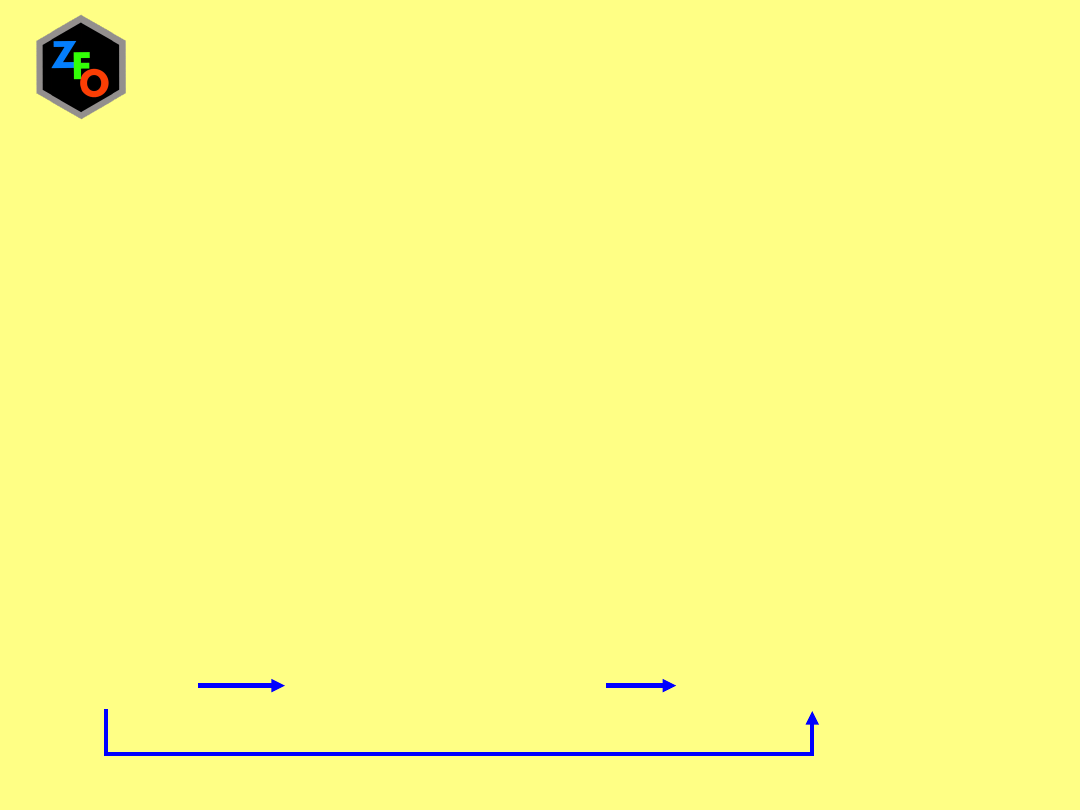
Prawo Hessa
Efekt cieplny reakcji nie zależy od drogi przemiany pod warunkiem,
że wszystkie procesy są izobaryczne lub izochoryczne
lub
standardowa entalpia reakcji całkowitej jest sumą standardowych entalpii
poszczególnych reakcji składowych, na które można daną reakcję rozłożyć
Standardowa entalpia reakcji jest Δ
r
H jest zmianą entalpii reakcji, w której
substraty w swoich stanach standardowych ulegają przemianie w produkty
znajdujące się w stanach standardowych
0
0
0
r
m
m
produkty
substraty
H
H
H
n
n
D
=
-
�
�
ν –współczynniki stechiometryczne w równaniu chemicznym
substraty
produkty pośrednie
produkty
końcowe
ΔH
1
ΔH
2
ΔH
3

przemiana
proces
oznaczeni
e
Przejście fazowe
faza α→faza β
ΔH
pf
Topnienie
s → c
ΔH
top
Parowanie
c → g
ΔH
par
Sublimacja
s → g
ΔH
sub
Mieszanie
sub. pojedyncze →
mieszanina
ΔH
miesz
Rozpuszczanie
sub. rozpuszczana →roztwór
ΔH
roz
Hydratacja
X
±
(g) → X
±
(aq)
ΔH
hyd
Atomizacja
cząsteczka (s,c,g) →atomy(g) ΔH
at
Jonizacja
X(g) → X
+
(g) +e
-
(g)
ΔH
jon
Przyłączanie
elektronu
X(g) +e
-
(g)→ X
-
(g)
ΔH
p.e.
Reakcja
substraty → produkty
ΔH
r
Spalanie
substancja (s,c,g) +O
2
→
CO
2
(g), H
2
O (g,c)
ΔH
s
Tworzenie
pierwiastki → związek
chemiczny
ΔH
tw
Aktywacja
substraty → kompleks
aktywny
ΔH
#
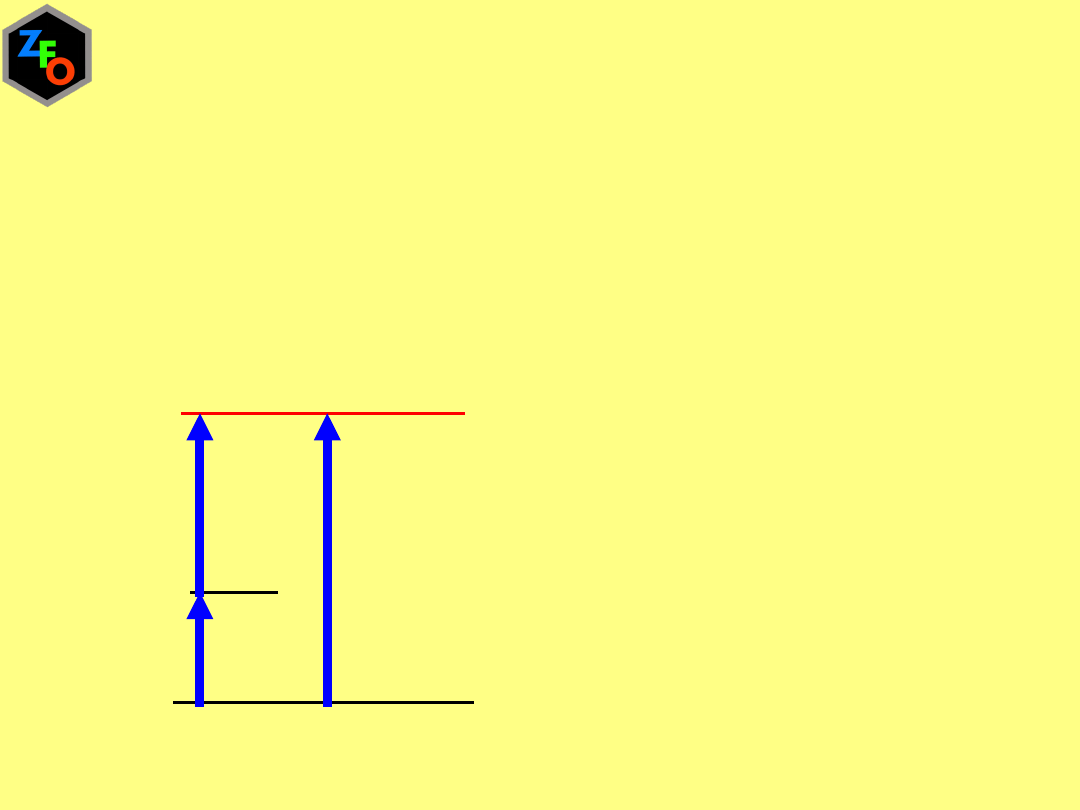
Standardowa entalpia przemiany fazowej ΔH
p.f
przedstawia
entalpię przemiany gdy obie fazy są w stanach standardowych,
tj. jako czyste substancje pod ciśnieniem 1 bara
Gdy przemiana jest złożona to standardowa entalpia przemiany jest
sumą standardowych entalpii procesów na które można rozłożyć
daną przemianę
ΔH
top
ΔH
par
ΔH
sub
ΔH
sub
= ΔH
top
+ ΔH
par
Standardowa entalpia tworzenia substancji przedstawia standardową
entalpię reakcji, w której 1 mol danej substancji tworzy się
z pierwiastków w ich stanach podstawowych
Stan podstawowy pierwiastka – najtrwalsza jego odmianaw
panujących warunkach
H
2
(g) + ½ O
2
(g)
H
2
O (c) ΔH
tw
= -286 kJ
Standardowa entalpia reakcji chemicznej jest równa sumie
standardowych
entalpii tworzenia produktów i substratów, w której każdy wyraz jest
pomnożony przez współczynnik stechiometryczny odpowiedniego
reagenta (dodatni dla produktu, a ujemny dla substratu.
pierwiastki
substraty
produk
ty
ΣΔH
0
tw,sub
ΣΔH
0
tw,prod
ΔH
0
r

0
0
0
.
.
r
tw prod
twsub
H
H
H
u
u
D
=
D
-
D
�
�
2 HN
3
(c) + 2NO(g)→ H
2
O
2
(c) +4N
2
(g)
ΔH
0
r
=ΔH
0
tw
(H
2
O,c) +4 ΔH
0
tw
N
2
(g) – {2 ΔH
0
tw
(NH
3
,c) +2 ΔH
0
tw
(NO,g)}
Standardowe ciepło spalania związku ΔH
0
sp
rozumiemy ciepło
spalania
1 mola cząsteczek tego związku w tlenie , pod ciśnieniem 1 bara,
przy czym powstają CO
2
, H
2
O (ciekła), SO
2
,N
2
0
0
0
,
,
D
=
D
-
D
�
�
r
sp subst
sp prod
H
H
H
u
u

( )
4
2
2
4
2
2
2
2
2
2
2
2
4
2
2
2
2
2
2
2
2
0
0
0
0
1
2
3
4
0
3
2
(4)
2
2 0
(2)
1
(3)
2
1
(4)
2
1* (2) 1* (3) 3* (4)
1
3
2
3
2
3
2
2
3
równanie
CH
H
CO
H
możnaotrzymać przezdodanierównań
CH
O
CO
H
CO
O
CO
H
O
H O
CH
O
CO
O
H
O
CO
H O CO
H O
H
H
H
H
+
=
+
-
+
=
+
+
=
+
=
-
-
+
-
-
-
-
=
+
-
-
D
=D
- D
- D
,
,
r
sp subst
sp prod
H
H
H
u
u
D
=
D
-
D
�
�
można to otrzymać z równania ogólnego
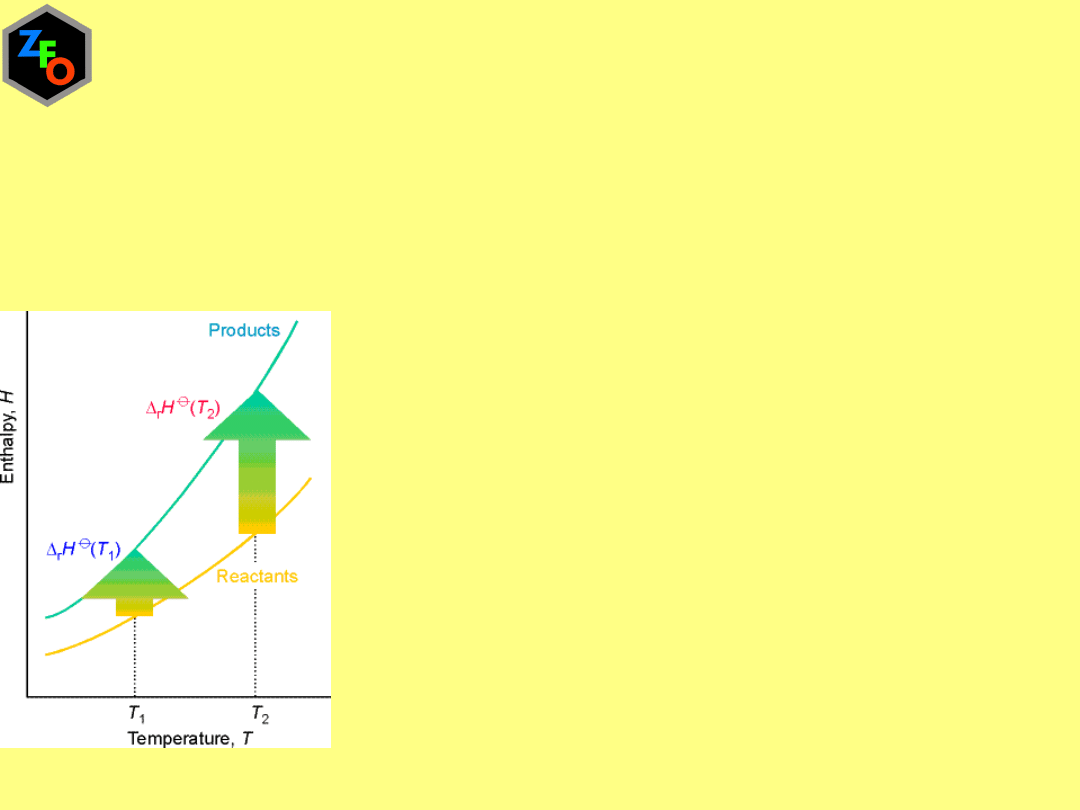
Zależność entalpii od
temperatury
prawo Kirchhoffa
2
1
2
1
,
,
( )
( )
T
r
r
i p prod
i p sub
i
i
T
H T
H T
c
c
dT
u
u
�
�
D
=D
+
-
�
�
�
�
�
�
�
`
1
2
`
2
1
,
,
. .,
,
,
( )
( )
T
r
r
i p prod
i p sub
i
i
T
T
k
p f k
i p prod
i p sub
i
i
T
H T
H T
c
c
dT
H
c
c
dT
u
u
u
u
u
�
�
D
=D
+
-
�
�
�
�
�
�
+ D
+
-
�
�
�
�
�
�
�
�
�
�
często c
p,i
przedstawia się za pomocą szeregu
potęgowego
2
2
,
p i
i
i
i
i
c
a bT cT
dT
-
= +
+
+
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
Wyszukiwarka
Podobne podstrony:
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Do druku impulsy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Do druku octowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
egz.42, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
6 7 8 9 numery, fizyczna, chemia fizyczna, Fizyczna, fizyczna koło, Fizyczna odpowiedzi do zadan
Ad 7, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
ćwiczeniee 43, materiały naukowe do szkół i na studia, chemia fizyczna moja, Chemia fizyczna, Opraco
grz8 ściąga z teorii chemia xcałość do druku (2)
polarografia, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
więcej podobnych podstron