
Dr Jolanta
Dr Jolanta
Piekut
Piekut

Materiały budowlane
Znajomość chemii jest niezbędna na kierunku
Budownictwa. Inżynier budowlany powinien wiedzieć:
• jakie właściwości ma materiał, którego użyje do budowy
• jakie zjawiska i przemiany chemiczne zachodzą podczas
:
- wytwarzania materiałów
- stosowania ich do wznoszenia budowli i prac
wykończeniowych
- użytkowania obiektu (procesy korozji)

Materiały budowlane są tak stare
jak człowiek
I Kronik 29:2
Rzekł król Dawid do całego zgromadzenia:
Według wszelkich moich możliwości przygotowałem dla
świątyni Boga
mojego
Złoto, na to, co ma być ze złota,
Srebro, na to, co ma być ze srebra,
Spiż, na to, co ma być ze spiżu,
Żelazo, na to, co ma być z żelaza,
Drzewo, na to, co z drzewa,
Kamienie karneolowe do oprawy i na zaprawę murarską,
i do mozaiki,
i wszelkiego rodzaju drogie kamienie,
i marmur w obfitości.

Ogólny podział materiałów
budowlanych
A.
Nieorganiczne
(mineralne)
Metale:
Fe, Cu, Zn, Sn, Al, Pb,
Mn, Mo, Ni, Cr, Mg
Materiały
kamienne:
minerały
SiO
2
, Al
2
O
3
, H
2
O, Fe
2
O
3
,
FeO, MgO, CaO, Na
2
O,
K
2
O, TiO
2
, P
2
O
5
B. Organiczne
Drewno
Słoma
Trzcina
Bambus
Wyroby bitumiczne
Smoły
Asfalty
Tworzywa sztuczne

O właściwościach materiałów budowlanych
decydują:
- natura chemiczna pierwiastków, z których są
zbudowane,
Wszystkie najczęściej występujące w przyrodzie
pierwiastki (ok. 30) stosowane są w
budownictwie
(w tym połowę stanowią metale).
- rodzaj występujących wiązań chemicznych,
- stan skupienia
- makrostruktura
- zjawiska powierzchniowe

Ponad 70% materiałów budowlanych to:
Metale
Metale
- wiązania metaliczne
Tlenki metali
Tlenki metali
(np. CaO, Al
2
O
3
) – wiązania jonowe lub
atomowe silnie spolaryzowane
Sole słabych kwasów
Sole słabych kwasów
(amfolitów): krzemiany,
gliniany, żelaziany, węglany, siarczany(VI) - wiązania
jonowe
lub atomowe spolaryzowane
Sole, często uwodnione są najliczniejszą grupą.
Przykładem zasady
zasady
wśród materiałów budowlanych
jest
wapno gaszone - Ca(OH)
2
.
Pozostałe to związki organiczne i krzemoorganiczne
związki organiczne i krzemoorganiczne
.
.

Wiązania chemiczne w materiałach
budowlanych
Materiał
y
budowla
ne
Wiązania wewnątrzcząsteczkowe
międzycząsteczko
we
Jonow
e
Atomo
-we
Atom.
Spolar
yz.
Kordy-
nacyjne
Metalic
z-ne
Wodor
o-we
Siły Van
der
Waalsa
Metale:
żeliwo
stal
nieżelazn
e
Materiał
y
mineraln
e:
kamienne
ilaste
spoiwa
ceramika
szkło
Materiał
y
organicz
ne:
drewno
bitumy
tworzywa
sztuczne
-
-
-
+
+
+
+
+
-
-
-
-
-
-
-
-
-
-
-
+
+
+
-
-
-
+
+
+
+
+
(+)
(+)
(+)
-
-
-
+
+
+
-
-
-
-
-
+
+
+
-
-
-
-
-
-
-
-
-
-
-
(+)
+
+
-
-
+
-
+
-
-
-
-
-
-
-
-
+
+
+

Materiały o wiązaniach metalicznych
charakteryzują się:
- wysokim połyskiem
- dobrym przewodnictwem ciepła i elektryczności
- plastycznością (kowalnością)
- dużą wytrzymałością mechaniczną
Materiały o wiązaniach jonowych:
- wysokie temperatury wrzenia i topnienia
- łatwo rozpuszczają się w wodzie
- rozsypują się pod wpływem obciążeń mechanicznych
Materiały o wiązaniach atomowych charakteryzują
się:
- dużą twardością
- mniejszą rozpuszczalnością w wodzie
- mniejszą reaktywnością chemiczną

Przykłady:
Gips
CaSO
4
.
2H
2
O
O O 2-
Ca
2+
S
O O
Wiązania jonowe, atomowe spolaryzowane i koordynacyjne
Hydraty [Al(H
2
O)
6
]
3+
, [Mg(H
2
O)
6
]
2+
Hydroksokompleksy [Al(OH)
6
]
3-
Siły typu Van der Walsa występują tylko wtedy,
gdy wiązanie wewnątrzcząsteczkowe jest
ukierunkowane (atomowe).
W przypadku materiałów o budowie krystalicznej z
wiązaniami jonowymi lub metalicznymi nie można
rozpatrywać pojedynczej cząsteczki.

Pierwiastki metaliczne występują w przyrodzie
przeważnie w postaci rud, które są przerabiane (w
celu uzyskania czystego lub prawie czystego
metalu) na drodze różnych procesów
metalurgicznych.
rudy żelaza
Syderyt - FeCO
3
Hematyt – Fe
2
O
3
Magnetyt – Fe
3
O
4
Pirotyn – FeS
Piryt – FeS
2

Surówkę żelaza otrzymuje się przez redukcję
w wielkich piecach rud tlenkowych
• Fe
2
O
3
+ 3C → 2 Fe + 3 CO
• Fe
2
O
3
+ 3CO → 2 Fe + 3 CO
2
• C + CO
2
→ 2 CO
Stopione w wielkim piecu żeliwo ulega nawęgleniu, w
wyniku czego powstaje cementyt
3Fe + C → Fe
3
C
oraz roztwory stałe węgla w żelazie (rozpuszczenie węgla
w sieci krystalicznej żelaza).
W technice największe znaczenie mają stopy żelaza z
węglem:
stal - stop obrabiany plastycznie
żeliwo - stop odlewniczy

Żużel metalurgiczny
Wyprodukowaniu 1 tony żeliwa towarzyszy
powstanie 1 tony żużlu – produkt
odpadowy na skutek reakcji dodatków
(topników) CaCO
3
z zanieczyszczeniami w
rudach:
2 CaCO
3
+ SiO
2
→ Ca
2
SiO
4
+ 2 CO
2
topnik
skała płonna
żużel
Żużel zawiera: CaO, SiO
2
, Al
2
O
3
, FeO, MnO
Stosowany jest jako dodatek do cementów
hutniczych

• Żelazo jest odporne na działanie wody
wapiennej i zimnych ługów, co ma duże
znaczenie z punktu widzenia zbrojenia
betonu (żelbet)
• Ze stali konstrukcyjnych wykonuje się w
budownictwie pręty zbrojeniowe, blachy,
druty, rury

rudy metali nieżelaznych
• miedź występuje w przyrodzie głównie w postaci rud
siarczkowych i tlenowych (chalkopiryt, chalkozyn,
kupryt, malachit, azuryt), rzadziej w stanie
wolnym.
Miedź otrzymuje się z rud.
• Ubogie siarczki miedzi wzbogaca się przez flotację
uzyskując w ten sposób koncentraty o zawartości
miedzi 15-30%.
• Koncentraty poddawane są następnie prażeniu,
podczas którego następuje ich utlenianie.
• Częściowo wyprażony materiał przetapia się w
strefie redukcyjnej w piecu szybowym,
płomieniowym lub elektrycznym.
• Otrzymuje się tzw. kamień miedziowy - jest to
mieszanina siarczków miedzi (Cu
2
S) i żelaza (FeS)
oraz innych zanieczyszczeń.

Metoda pirometalurgiczna
otrzymywania miedzi z rud
2CuFeS
2
+ 2SiO
2
+ 3O
2
→ Cu
2
S + 2FeSiO
3
+ 3SO
2
Cu
2
S + 2O
2
→ 2CuO + SO
2
Cu
2
S + 2CuO → 4Cu + SO
2
• Otrzymana miedź ( czystość ok. 90%) poddawana
jest następnie rafinacji, w wyniku czego otrzymuje się
miedź o czystości bliskiej 100%
Miedź stosowana jest jako materiał dekarski na
budowlach reprezentacyjnych-sakralnych, jako
surowiec do elementów dekoracyjnych, drutów na
przewody elektryczne, rur, stosowana do uszczelnień

Cynk jest niebieskawobiałym metalem.
W wilgotnym powietrzu ulega utlenieniu,
pokrywa się szczelną powłoką
Zn
2
CO
3
(OH)
2
, która chroni metal przed
dalszą korozją.

Najważniejszym źródłem metalicznego
cynku jest ZnS
• Proces prażenia:
2ZnS + 3O
2
→ 2ZnO + 2SO
2
• Redukcja węglem: lub tlenkiem węgla(II):
ZnO + C → Zn + CO
ZnO + CO → Zn + CO
2
CO
2
+ C → 2CO
Blachy cynkowe lub ocynkowane blachy żelazne stosowane
są w budownictwie do wykonywania rynien, pokryć
dachowych, rur i siatek.
Stop cynku -ZnAl - stosowany jest na okucia budowlane i
armaturę sanitarną.

Z powodu swoich bardzo dobrych
własności mechanicznych metale
są powszechnie wykorzystywane
jako materiały konstrukcyjne w
budownictwie.
Większość pierwiastków w układzie
okresowym to metale

Metale i stopy metali
• Żeliwo
• Stal konstrukcyjna
• Stal trudno rdzewiejąca
•
Miedź
Miedź
•
Mosiądz
Mosiądz
•
Brąz
Brąz
•
Spiż
Spiż
•
Cynk
Cynk
•
ZnAl
ZnAl
•
Cyna
Cyna
•
Aluminium
Aluminium
•
ołów
ołów
• Fe
C (>2%), (Mn, Si, P, S)
• Fe
C, Cr, Mo, Mn, Si, Ni, V,
Al, Cu, N (P, S)
• Fe
C, Cr, Ni, Ti, Mo, Co
(Al, Si)
•
Cu
Cu
-
-
•
Cu
Cu
Zn (Ni, Pb, Mn, Al, Si)
Zn (Ni, Pb, Mn, Al, Si)
•
Cu
Cu
Sn (Al, Pb, Mn, Si, Be)
Sn (Al, Pb, Mn, Si, Be)
•
Cu
Cu
Sn, Zn (Pb)
Sn, Zn (Pb)
•
Zn
Zn
-
-
•
Zn
Zn
Al. (Cu, Mg)
Al. (Cu, Mg)
•
Sn
Sn
_
_
•
Al
Al
Cu (Si, Mg, Fe)
Cu (Si, Mg, Fe)
•
Pb
Pb
_
_
Rodzaj metalu (stopu) metal
pierwiastek
podstawowy
stopowy
ż
e
l
a
z
n
e
n
n
i
i
e
e
ż
ż
e
e
l
l
a
a
z
z
n
n
e
e

Metale szlachetne - metale odporne
chemicznie:
(
,
, rod
,
, pallad
, osm
,
, iryd
i
i
) oraz
) oraz srebro
i złoto
.
Metale szlachetne bardzo słabo reagują z innymi
pierwiastkami przez co prawie nie ulegają korozji.
Metale szlachetne są odporne na działanie
stężonego kwasu solnego i innych kwasów
beztlenowych (można je jednak roztworzyć w
kwasach tlenowych)

Metale - także ich stopy - charakteryzują się obecnością
w sieci krystalicznej swobodnych (niezwiązanych)
elektronów.
Wykazują następujące własności:
- tworzenie połyskliwej, gładkiej powierzchni w stanie
stałym
- ciągliwość i kowalność
- dobre przewodnictwo elektryczne
-dobre przewodnictwo cieplne
- skłonność do tworzenia związków chemicznych o
właściwościach zasadowych.
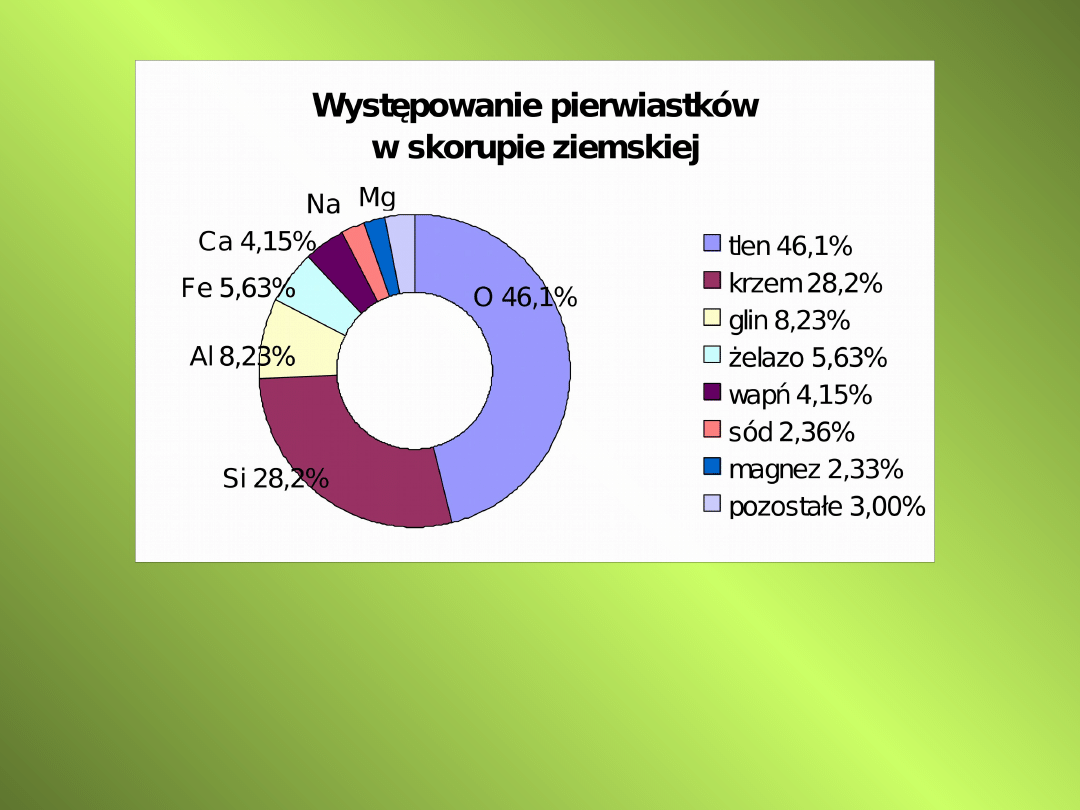
Krzem (Si – silicium) - pierwiastek chemiczny należący
do grupy węglowców. Tworzy kryształy szare, twarde,
kruche.
Jest półprzewodnikiem o temperaturze topnienia
1410°C, gęstość 2,33 g/cm
3
.

Krzemionka SiO
2
–
bezbarwne ciało stałe o temperaturze topnienia
1710
o
C, nierozpuszczalne w wodzie i kwasach (oprócz
fluorowodorowego).
Tworzy odmiany krystaliczne (kwarc, trydymit,
krystobalit).
Występuje jako minerał, główny składnik piasku i
piaskowców), w formie uwodnionej - jako chalcedon
i jego odmiany.
Stosowany do produkcji szkła i materiałów
budowlanych.
Krzemiany i glinokrzemiany –
składniki skał i minerałów

KRZEMIANY I GLINOKRZEMIANY
W przyrodzie występuje około 800 znanych minerałów
krzemianowych - najliczniejsza grupa minerałów.
Udział krzemianów i glinokrzemianów w budowie skał
wynosi około 75% wagowych.
-znaczenie skałotwórcze (dominujące),
-źródło wielu cennych metali (np. krzemiany Ni, Zn,
Li),
-tworzą złoża wielu ważnych surowców mineralnych
(kaolin, skalenie).
Wśród krzemianów znaleźć można piękne kamienie
szlachetne i ozdobne (np. szmaragd, turmalin, topaz,
nefryt).
http://www.ar.wroc.pl/~weber/halo.htm#sylwin
http://www.ar.wroc.pl/~weber/halo.htm#sylwin

1. agat, 2. ałunit, 3. ametyst, 4. aragonit, 5. baryt, 6.
chalkantyt, 7. fluoryt, 8. galena, 9. gips, 10. halit, 11.
kalcyt, 12. kwarc, 13. magnetyt, 14. miedź rodzima, 15.
piryt, 16. sfaleryt

W postaci minerałów występują:
krzemiany
ZrSiO
4
(cyrkon),
(Mg,Fe)
2
SiO
4
(oliwin),
Ca
3
Si
3
O
9
(wollastonit),
Cu
6
Si
6
O
18
x 6H
2
O (dioptaz)
glinokrzemiany:
K[Al Si
3
O
8
] (ortoklaz),
Ca[Al Si
2
O
8
] (anortyt)

Składnikami cementu portlandzkiego
są np.
metakrzemian wapnia CaSiO
3
metadikrzemian wapnia
CaSi
2
O
5
ortokrzemian wapnia Ca
2
SiO
4

Materiały kamienne
Materiały kamienne
z chemicznego punktu widzenia
z chemicznego punktu widzenia
są to: krzemiany,
są to: krzemiany,
gliniany,
gliniany,
tlenki
tlenki
i węglany
i węglany
Źródłem kamienia budowlanego są
Źródłem kamienia budowlanego są
występujące w przyrodzie skały:
występujące w przyrodzie skały:
magmowe, osadowe i metamorficzne.
magmowe, osadowe i metamorficzne.

Skały występujące w przyrodzie
magmowe
osadowe
metamorficzne
zastyganie lawy
pochodzenia
ze skał magm. i
osadowych
(wysokie p i T)
marmury
(kalcyt)
krzepnięcie stopów
kwarcyty
krzemianowych
(piaskowce)
mechanicznego
mechanicznego
gnejsy
(granity)
(
wietrzenie skał)
łupki
(kwarc i mika)
SiO
2
organogenicznego
organogenicznego
chemicznego
chemicznego
>65% kwaśne
(
szczątki org. żywych)
(krystalizacja soli)
52- 65% obojętne
wapienie
<
52% zasadowe
(kalcyt, dolomit)
siarczany
siarczany
piaski
piaski
(gips, anhydryt)
(gips, anhydryt)
żwiry
żwiry
gliny
gliny
(
(
kaolinit)
kaolinit)
piaskowce
piaskowce
granity
(kwarc, skalenie, miki)
bazalty, andezyty

Minerały skałotwórcze
Kwarc
SiO
2
Skalenie
K
2
O Al
2
O
3
6SiO
2
ortoklaz
m(Na
2
O Al
2
O
3
6SiO
2
) plagioklazy
n(CaO Al
2
O
3
2SiO
2
)
Skaleniowce
Na
2
O Al
2
O
3
2SiO
2
nefelin
Miki
K
2
O Al
2
O
3
6SiO
2
2H
2
O
muskowit
Pirokseny
MgO FeO
2SiO
2
Oliwiny
(Mg, Fe)
2
SiO
4
Węglany
CaCO
3
kalcyt
MgCO
3
magnezyt
CaCO
3
MgCO
3
dolomit
Siarczany
CaSO
4
2H
2
O
gips
CaSO
4
anhydryt
Materiały kamienne
Materiały kamienne
naturaln
e
naturaln
e
sztuczne
sztuczne
profilowe
kostki,
płyty
profilowe
kostki,
płyty
ziarniste
kruszywa
ziarniste
kruszywa
BETONY
Zaprawy
BETONY
Zaprawy
niewypalane
niewypalane
wypalane
wypalane
T≤ T
T
spiek
T >T
T
stop
Lekkie
kruszywa
Lekkie
kruszywa
Spoiwa
hydrauliczne
Klinkier cementowy
Spoiwa
powietrzne
Ceramika
budowlana
Materiały wiążące
lepiszcza
spoiw
a
Szkło
budowlane
Wełna
mineralna

Wzór klasyczny
Wzory tlenków
Wzór skrócony
(chemia
cementów)
CaSiO
3
CaO
.
SiO
2
CS SiO
2
- S
Krzemian wapnia
Ca
2
SiO
4
2CaO
.
SiO
2
C
2
S CaO -
C
Krzemian diwapnia
(belit)
Ca
3
SiO
4
3CaO
.
SiO
2
C
3
S Al
2
O
3
-
A
Krzemian triwapnia
(alit)
Ca
3
(PO
4
)
2
3CaO
.
P
2
O
5
C
3
P MgO -
M
Fosforan(V) wapnia
Ca
3
Al
2
O
6
3CaO
.
Al
2
O
3
C
3
A H
2
O -
H
Glinian triwapnia
Al
2
(Si
2
O
5
)(OH)
4
Al
2
O
3
.
2SiO
2
.
2H
2
O AS
2
H
2
Fe
2
O
3
- F
Kaolinit
(składnik gliny)

Kwasy krzemowe:
Kwasy krzemowe:
metakrzemowy
metakrzemowy
H
H
2
2
SiO
SiO
3
3
SiO
SiO
2
2
.
.
H
H
2
2
O
O
S
S
.
.
H
H
ortokrzemowy
ortokrzemowy
H
H
4
4
SiO
SiO
4
4
SiO
SiO
2
2
.
.
2H
2H
2
2
O
O
S
S
.
.
H
H
2
2
dimetakrzemowy
dimetakrzemowy
H
H
2
2
Si
Si
2
2
O
O
5
5
2SiO
2SiO
2
2
.
.
H
H
2
2
O
O
S
S
2
2
.
.
H
H
diortokrzemowy
diortokrzemowy
H
H
4
4
Si
Si
2
2
O
O
6
6
2SiO
2SiO
2
2
.
.
2H
2H
2
2
O
O
S
S
2
2
.
.
2H
2H
Krzemiany
Krzemiany
metakrzemian
metakrzemian
K
K
2
2
SiO
SiO
3
3
K
K
2
2
O
O
.
.
SiO
SiO
2
2
K
K
.
.
S
S
ortokrzemian
ortokrzemian
K
K
4
4
SiO
SiO
4
4
2K
2K
2
2
O
O
.
.
SiO
SiO
2
2
K
K
2
2
.
.
S
S
Kwasy glinowe:
Kwasy glinowe:
H
H
3
3
AlO
AlO
3
3
HAlO
HAlO
2
2
+ H
+ H
2
2
O
O
ortoglinowy
ortoglinowy
H
H
3
3
AlO
AlO
3
3
Al
Al
2
2
O
O
3
3
.
.
3H
3H
2
2
O
O
A
A
.
.
H
H
3
3
metaglinowy
metaglinowy
HAlO
HAlO
2
2
Al
Al
2
2
O
O
3
3
.
.
H
H
2
2
O
O
A
A
.
.
H
H
Gliniany:
Gliniany:
metagliniany
metagliniany
Me
Me
I
I
AlO
AlO
2
2
Me
Me
2
2
O
O
.
.
Al
Al
2
2
O
O
3
3
M
M
I.
I.
A
A
ortogliniany
ortogliniany
Me
Me
II
II
3
3
(AlO
(AlO
3
3
)
)
2
2
3MeO
3MeO
.
.
Al
Al
2
2
O
O
3
3
M
M
II
II
3
3
.
.
A
A
Kwasy żelazowe: H
Kwasy żelazowe: H
3
3
FeO
FeO
3
3
HFeO
HFeO
2
2
+ H
+ H
2
2
O
O
ortożelazowy
ortożelazowy
H
H
3
3
FeO
FeO
3
3
Fe
Fe
2
2
O
O
3
3
.
.
3H
3H
2
2
O
O
F
F
.
.
H
H
3
3
metażelazowy
metażelazowy
HFeO
HFeO
2
2
Fe
Fe
2
2
O
O
3
3
.
.
H
H
2
2
O
O
F
F
.
.
H
H
Żelaziany:
Żelaziany:
metażelaziany
metażelaziany
Me
Me
II
II
(FeO
(FeO
2
2
)
)
2
2
MeO
MeO
.
.
Fe
Fe
2
2
O
O
3
3
M
M
II.
II.
F
F
Me
Me
III
III
(FeO
(FeO
2
2
)
)
3
3
Me
Me
2
2
O
O
3
3
.
.
3Fe
3Fe
2
2
O
O
3
3
M
M
II.
II.
F
F


Materiały wiążące dzieli się na:
-spoiwa -
wiążące w wyniku reakcji
chemicznej,
-lepiszcza -
wiążące w wyniku przemiany
fizycznej,
-np. krzepnięcia lub odparowania
rozpuszczalnika

Materiały wiążące
nieorganiczne
organiczne
lepiszcza
spoiwa
lepiszcza spoiwa
siarka
bitumiczne
żywiczne
(polimer. i polikond.)
powietrzne
hydrauliczne asfalty smoły
ponaftowe
(z dest. węgla
twardniejące
twardniejące
i drewna)
w powietrzu
w wodzie
wg składu chemicznego surowca:
Spoiwa wapniowe, siarczanowo-gipsowe, magnezjowe
Główne spoiwa mineralne to: cement, wapno i gips

Spoiwa mineralne są obok
kruszywa najbardziej
powszechnym
półproduktem
stosowanym w
budownictwie, zatem
surowce do ich
wytwarzania muszą być
ogólnodostępne.
Są to głównie:
gliny i skały wapienne

gliny i skały wapienne:
wapień
CaCO
3
,
gips
CaSO
4
.
2H
2
O,
anhydryt
CaSO
4
,
magnezyt
MgCO
3
,
dolomit
MgCO
3
.
CaCO
3
,
piasek kwarcowy
SiO
2

Charakterystyka spoiw mineralnych
Spoiwo
Podstawowy
składnik
surowca %
Proces
cieplny
T
max
[
o
C]
Skład
mineralogiczn
y
Mechanizm
wiązania
i twardnienia
Rod
z
Nazwa
Spo-
iwo
hyd-
rauli
-
czne
cementy
portlandzk
ie
CaCO
3
70-75
gliny
25-30
spiekanie,
topienie
1450
C
3
S, β-C
2
S,
C
3
A, C
4
AF
hydratacja,
hydroliza,
karbonatyzacja
cementy
glinowe
CaCO
3
boksyty
topienie
1500
CA, CA
2
,
C
12
A
7
,
hydratacja,
hydroliza
cementy
romańskie
CaCO
3
50-70
gliny
30-50
prażenie
1100
β-C
2
S, CA,
C
2
F
hydratacja,
hydroliza,
karbonatyzacja
wapno
hydraulicz
ne
CaCO
3
75-95
gliny
5-25
prażenie
1200
C, β-C
2
S,CA,
C
12
A
7
,C
2
F
hydratacja,
hydroliza,
karbonatyzacja
Spo-
iwo
po-
wiet
-
rzne
wapno
palone
CaCO
3
>95
gliny <5
prażenie
1200
C
hydratacja,
karbonatyzacja
gips
CaSO
4
.
2H
2
O
prażenie
200
CżH
0,5
hydratacja
anhydryty
CaSO
4
.
2H
2
O
prażenie
350
CżH
hydratacja
CaSO
4
.
H
2
O
-
magnezjo
we
MgCO
3
MgCO
3
.
CaCO
3
prażenie
950
MC
hydratacja,
powstanie soli
zasadowych
Krzemianow
eszkło
wodne
SiO
2
, Na
2
O
SiO
2
, K
2
O
topienie
800
N
m
S
n
karbonatyzacja

Otrzymywanie każdego spoiwa mineralnego
wymaga energochłonnych procesów:
- prażenia (wapno palone),
- spiekania (cementy portlandzkie)
- topienia (szkło wodne).
Stałe spoiwa mineralne są przed użyciem
zarabiane wodą,
a spoiwo magnezjowe –
wodnym roztworem chlorków lub siarczanów.
Podczas wiązania przebiegają procesy
fizyczne:
- częściowe rozpuszczenie,
- utworzenie roztworu przesyconego,
- przejście w stan koloidalny.
Twardnienie spoiwa
- wykształcenie się struktury krystalicznej

Wiązanie i twardnienie
spowodowane jest reakcjami
chemicznymi:
hydratacji (wszystkie spoiwa),
hydrolizy (spoiwa hydrauliczne)
karbonatyzacji (spoiwa wapienne).

Otrzymywanie
każdego spoiwa
mineralnego wymaga energochłonnych
procesów:
- prażenia (wapno palone),
- spiekania (cementy portlandzkie)
- topienia (szkło wodne).
Podczas wiązania
przebiegają procesy
fizyczne:
- częściowe rozpuszczenie,
- utworzenie roztworu przesyconego,
- przejście w stan koloidalny.
Twardnienie
spoiwa
- wykształcenie się struktury krystalicznej

Wiązanie i twardnienie spowodowane
jest reakcjami chemicznymi:
hydratacji (wszystkie spoiwa),
hydrolizy (spoiwa hydrauliczne)
karbonatyzacji (spoiwa wapienne).

Hydratacja = uwodnienie
• soli
Cząstki wody wbudowane w
strukturę kryształu
- woda sieciowa
(bezpośrednio)
CaSO
4
+ 2H
2
O → CaSO
4.
2H
2
O
- woda konstytucyjna
(w postaci OH
-
)
CaO + H
2
O→ Ca(OH)
2
• jonów
akwajony
Al
3+
+ 6H
2
O→[Al(H
2
O)
6
]
3+
woda
koordynacyjna

Hydratacja – złożony proces przebiegający
w mieszaninie spoiwa z wodą
np.
CaSO
4
.
1/2 H
2
O + 3/2 H
2
O → CaSO
4
.
2 H
2
O
Hydroliza - rekcja spoiwa z wodą
przebiegająca z rozkładem
Ca
2
SiO
4
+ 2H
2
O → CaSiO
3
.
H
2
O + Ca(OH)
2
Karbonatyzacja – reakcja z tlenkiem(IV)
węgla
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O

Spoiwa hydrauliczne
Do spoiw hydraulicznych należą:
• wapno hydrauliczne
• cement portlandzki
• cement glinowy
• cementy hutnicze, żużlowe, itp.
W skład wszystkich materiałów
hydraulicznych wchodzą następujące
podstawowe tlenki: CaO, SiO
2
, Al
2
O
3
i Fe
2
O
3
.

Spoiwa hydrauliczne
Surowce do produkcji cementów:
• wapienie (CaCO
3
)
• gliny
(glinokrzemiany Al
2
O
3.
nSiO
2.
H
2
O + mH
2
O)
• surowce odpadowe (żużle hutnicze, popioły
paleniskowe, szlamy odpadowe zawierające
CaCO
3
)
Produkcja cementów obejmuje następujące etapy
• przygotowanie surowców i ich dokładne wymieszanie
• wypalanie
• mielenie
• silosowanie i pakowanie

Przemiany chemiczne w piecu
cementowym
• < 450
o
C wydzielenie wody
• 450 – 1300
o
C wypalanie, rozkład gliny i
wapieni
• 1300-1450
o
C klinkieryzacja (utworzenie
fazy
ciekłej), synteza
minerałów klinkieru
• 1200
o
C chłodzenie; krystalizacja z fazy
ciekłej

Spoiwa hydrauliczne
Skład chemiczny:
Najważniejsze związki zawarte w produkcie
wypalania (~95%): CaO, SiO
2
, Al
2
O
3
, Fe
2
O
3
Skład mineralogiczny cementu:
• krzemian triwapnia (alit) - 3 CaO
.
SiO
2
• krzemian diwapnia (belit) - 2 CaO
.
SiO
2
• glinian triwapnia - 3 CaO
.
Al
2
O
3
• glinożelazian tetrawapnia - 4 CaO
.
Al
2
O
3.
Fe
2
O
3
(braunmilleryt)

W cemencie występują ponadto
• SO
3
wprowadzony z domielonym gipsem
• MgO
• K
2
O i Na
2
O
• inne tlenki, np. TiO
2
Do klinkieru dodaje się ok. 5% gipsu jako regulatora czasu wiązania.
Bez dodatku cement wiąże błyskawicznie na skutek gwałtownej
hydratacji C
3
A. Jony siarczanowe (VI) powodują szybsze
przechodzenie Ca
2+
do roztworu.
Zbyt duża zawartość MgO jest szkodliwa, gdyż powolna hydratacja,
która może przebiegać w utwardzonym już zaczynie może
powodować niszczące naprężenia wewnętrzne
Alkalia mogą reagować z kruszywem korozja wewnętrzna

Hydratacja
w technologii
cementu
to zbiór reakcji chemicznych i procesów
fizycznych zachodzących po zmieszaniu
cementu z wodą
• Reakcje na powierzchni ziaren cementu
• Rozpuszczanie się składników cementu i
niektórych produktów w fazie ciekłej
- Rozpuszczanie się bez rozkładu – hydratacja
- Rozpuszczanie się z rozkładem - hydroliza

Hydratacja
• Hydratacja glinianu triwapnia
3CaO
.
Al
2
O
3
+ 6H
2
O →
3CaO
.
Al
2
O
3.
6H
2
O
• Hydratacja krzemianu diwapnia
(belitu)
2CaO
.
SiO
2
+ nH
2
O → 2CaO
.
SiO
2.
nH
2
O

Hydroliza
• Hydroliza belitu Ca
2
SiO
4
2CaO
.
SiO
2
+ 2H
2
O → CaSiO
3.
H
2
O + Ca(OH)
2
wolastonit
• Hydroliza alitu Ca
3
SiO
5
2(3CaO
.
SiO
2
) + 7H
2
O→ 3 CaO
.
2SiO
2.
4 H
2
O + 3Ca(OH)
2
• Hydroliza braunmillerytu
4CaO
.
Al
2
O
3.
Fe
2
O
3
+ (n+6)H
2
O → 3CaO
.
Al
2
O
3.
6H
2
O +
CaO
.
Fe
2
O
3.
nH
2
O

Karbonatyzacja –
reakcja z tlenkiem węgla (IV) CO
2
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
3CaO
.
2SiO
2
.
2H
2
O +3 CO
2
→ 3CaCO
3
+ 2SiO
2
+
+
2H
2
O
4CaO
.
Al
2
O
3
.
13H
2
O + 4CO
2
→ 4CaCO
3
+
2Al(OH)
3
+
+10 H
2
O

Karbonatyzacja
występuje w ostatnim stadium twardnienia
cementu portlandzkiego i wapna
.
Stanowi także podstawowy mechanizm
wiązania
i twardnienia
szkła wodnego
.

Reakcje zachodzące podczas wiązania
cementu
• Tworzenie soli Candlota (dodanie gipsu)
3CaO
.
Al
2
O
3
+ 3CaSO
4
+ 32 H
2
O →3CaO
.
Al
2
O
3.
3CaSO
4.
32H
2
O
• Hydratacja glinianu triwapnia
3CaO
.
Al
2
O
3
+ 6H
2
O → 3CaO
.
Al
2
O
3.
6H
2
O
• Hydroliza glinożelazianu tetrawapnia
4CaO
.
Al
2
O
3x
Fe
2
O
3
+ (n+6)H
2
O →3CaO
.
Al
2
O
3.
6H
2
O +
+CaO
.
Fe
2
O
3.
nH
2
O

Reakcje zachodzące podczas
twardnienia masy cementowej
• Hydroliza alitu
3CaO
.
SiO
2
+ (n+1)H
2
O → 2CaO
.
SiO
2.
nH
2
O +
Ca(OH)
2
• Hydratacja belitu
2CaO
.
SiO
2
+ nH
2
O → 2CaO
.
SiO
2.
nH
2
O
• Karbonatyzacja
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
Decydują o właściwościach wytrzymałościowych

Domieszki do betonu
Bezpośrednio przed sporządzeniem
mieszanki betonowej dodawane są:
• Przyspieszacze
• Opóźniacze
• Plastyfikatory
• Środki napowietrzające

Ceramika budowlana
Są to wyroby z wypalanej gliny:
• Cegły,
• Szkliwione kafle,
• Elementy ogniotrwałe (szamotowe,
krzemionkowe)
• Kształtki kanalizacyjne,
• Płytki kwasoodporne
• Ceramika półszlachetna - wyroby z fajansu

Ceramika budowlana
Glina zawiera:
• Kaolinit - Al
4
(OH)
8
(Si
4
O
10
)
• Montmorylonit – Al
2
(OH)
2
(Si
2
O
5
)
2.
nH
2
O
• Illit - krzemian potasu i glinu
• hematyt - Fe
2
O
3
– odp. za czerwone zabarwienie
• limonit - Fe
4
O
3
(OH)
6
– żółto-brunatny
Wypalanie zarobionej wodą mieszanki ceramicznej:
< 400
o
C wydzielanie się wody
400-600
o
C rozkład gliny :
Al
4
(OH)
8
(Si
4
O
10
) →2(Al
2
O
3.
2SiO
2
)+ 4H
2
O
250-700
o
C utlenianie substancji organicznych
> 950
o
C powstaje krystobalit(SiO
2
) i spinel (2Al
2
O
3.
3SiO
2
)
> 1100
o
C: 3Al
2
O
3
+ 6SiO
2
→3Al
2
O
3.
2SiO
2
+ 4SiO
2
mulit

Szkło
• Surowcem do produkcji tradycyjnego szkła
jest piasek kwarcowy (SiO
2
) oraz
dodatki:
węglan sodu i węglan wapnia
,
topniki: tlenki
B
2
O
3
i PbO
oraz
barwniki - tlenki metali
przejściowych (Cd, Mn).
• Surowce są mieszane, topione w piecu w
1400-1500 °C
• Szkło – otrzymuje się w wyniku stopienia
SiO
2
z różnymi dodatkami dobranymi w
odpowiednich proporcjach, a następnie
szybkiego ochłodzenia tak, aby nie doszło
do pełnej krystalizacji krzemionki
(przechłodzona ciecz).

Szkło
Właściwości
szkła
:
• materiał jednorodny, izotropowy,
bezpostaciowy
• słaby przewodnik elektryczności i ciepła
• duża odporność chemiczna na działanie
wody, powietrza, kwasów, zasad i soli
-jedynie HF, fluorki oraz stęż. NaOH
mogą reagować ze szkłem.

Szkło budowlane
W budownictwie stosuje się głównie szkło
sodowo-wapniowe o zawartości:
•
SiO
2
> 70%
• Na
2
O 15 - 17%
• CaO 0,5 - 8%

Wełna mineralna
Skład chemiczny:
• 43,0 % SiO
2
• 16,5 % Al
2
O
3
• 11,0 % FeO i Fe
2
O
3
• 1,5 % MnO
2
• 18,0 % CaO
• 8,0 % MgO
• 2 % inne

Organiczne materiały budowlane:
Pochodzenia naturalnego
- Drewno
- Słoma
- Trzcina
- Bambus
- Korek
- Asfalty naturalne
Bitumy
produkty przeróbki:
- węgla kamiennego i drewna - smoły,
-ropy naftowej- asfalty
Syntetycznie otrzymywane tworzywa sztuczne
- reakcje polimeryzacji
- reakcje polikondensacji

Występowanie substancji
organicznych w budownictwie
• Materiały budowlane
• Domieszki do betonu
• Środki impregnacyjne
• Paliwa i środki pomocnicze w produkcji materiałów
budowlanych
(gaz ziemny, oleje grzewcze, rozpuszczalniki, oleje,
smary)
• Środowisko niektórych elementów budowli:
– w przemyśle spożywczym,
– gospodarstwach inwentarskich,
-
oczyszczalniach ścieków

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
Wyszukiwarka
Podobne podstrony:
ceramika materialy budowlane id Nieznany
CENTRALNE LABORATORIUM OCHRONY materialy budowlane id 109799
2 Praca, bezpieczeństwo, trwałość budowli id 19631 ppt
Materialy budowlane exam id 284 Nieznany
Materialy budowlane Pokrycia dachowe id 284661
MATERIALY BUDOWLANE WYKLADY CALOSC id 284315
Materialy budowlane Zaczyny i zaprawy id 284665
Identyfikacja materialow budowl uzupelnienie skryptu id 209295
13 ZMIANY WSTECZNE (2)id 14517 ppt
!!! ETAPY CYKLU PROJEKTU !!!id 455 ppt
Właściwości fizyczne materiałów budowlanych
2 Podstawowe definicje (2)id 19609 ppt
MATERIAŁY BUDOWLANE 1
2 Realizacja pracy licencjackiej rozdziałmetodologiczny (1)id 19659 ppt
02 MAKROEKONOMIA(2)id 3669 ppt
11b Azotowanie i nawęglanie (PPTminimizer)id 13076 ppt
więcej podobnych podstron