Biosynteza
nukleotydów
pirymidynowych
Marta Świerczyńska, gr. 17
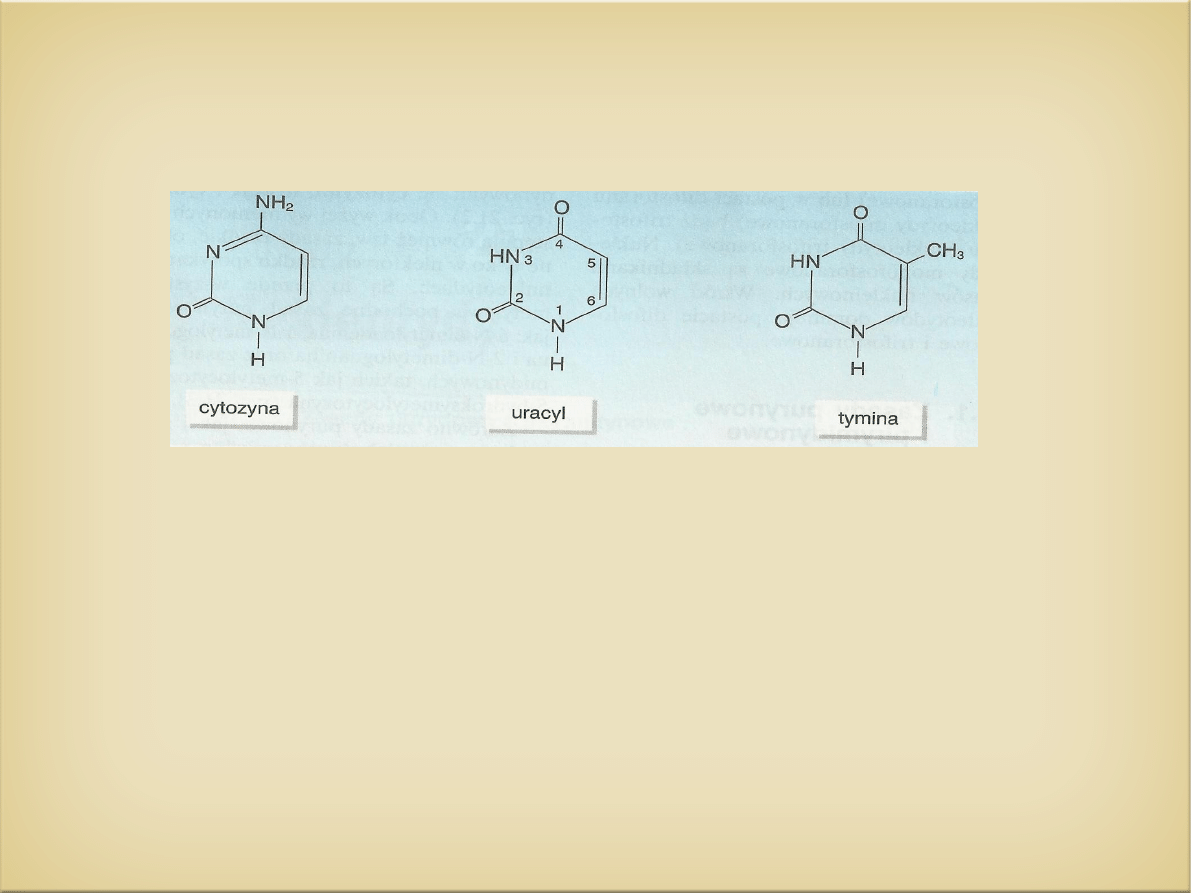
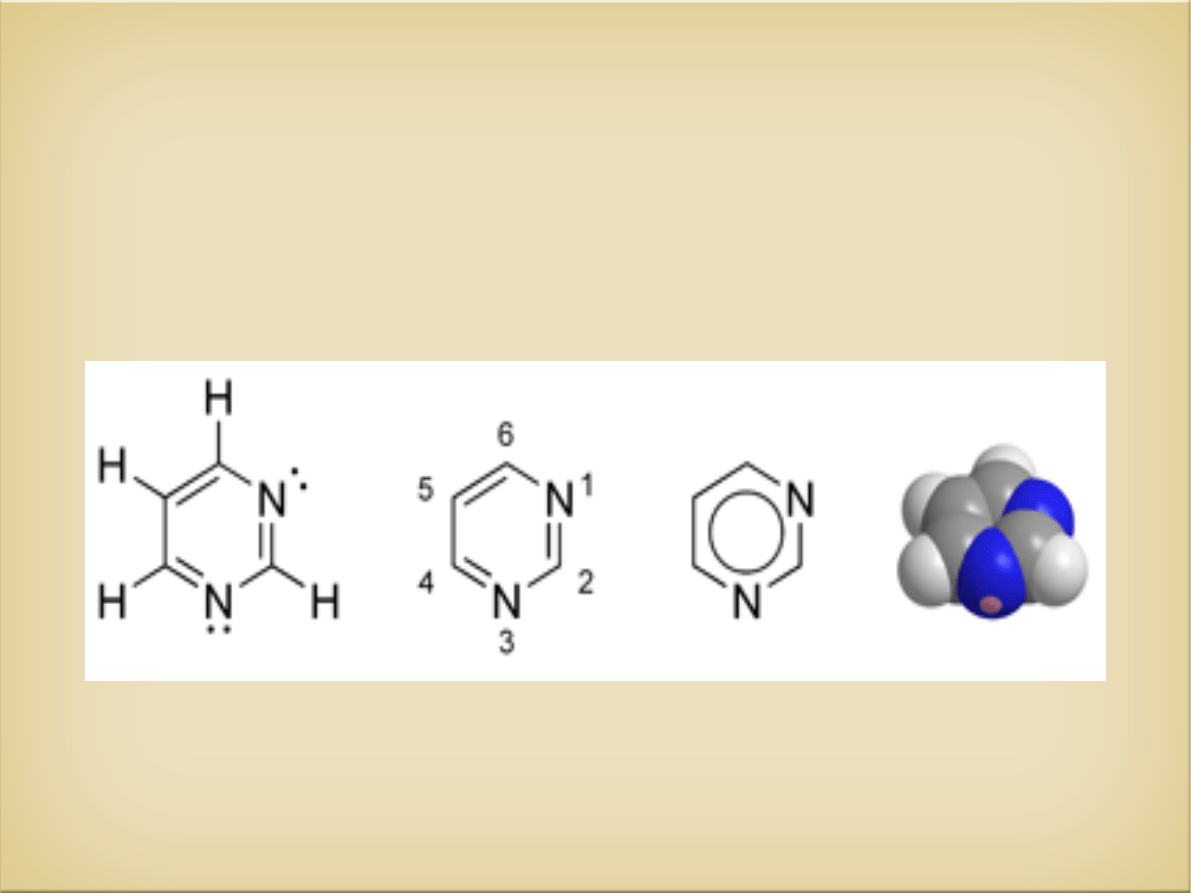
Zasady pirymidynowe
- heterocykliczne związki organiczne zawierające azot
- jako pierwszy powstaje pierścień pirymidynowy, który
następnie łączy się z rybozofosforanem i powstaje
nukleotyd
- wyróżniamy nukleotydy
Monofosforanowe np. UMP
Difosforanowe np. UDP
Trifosforanowe np. UTP

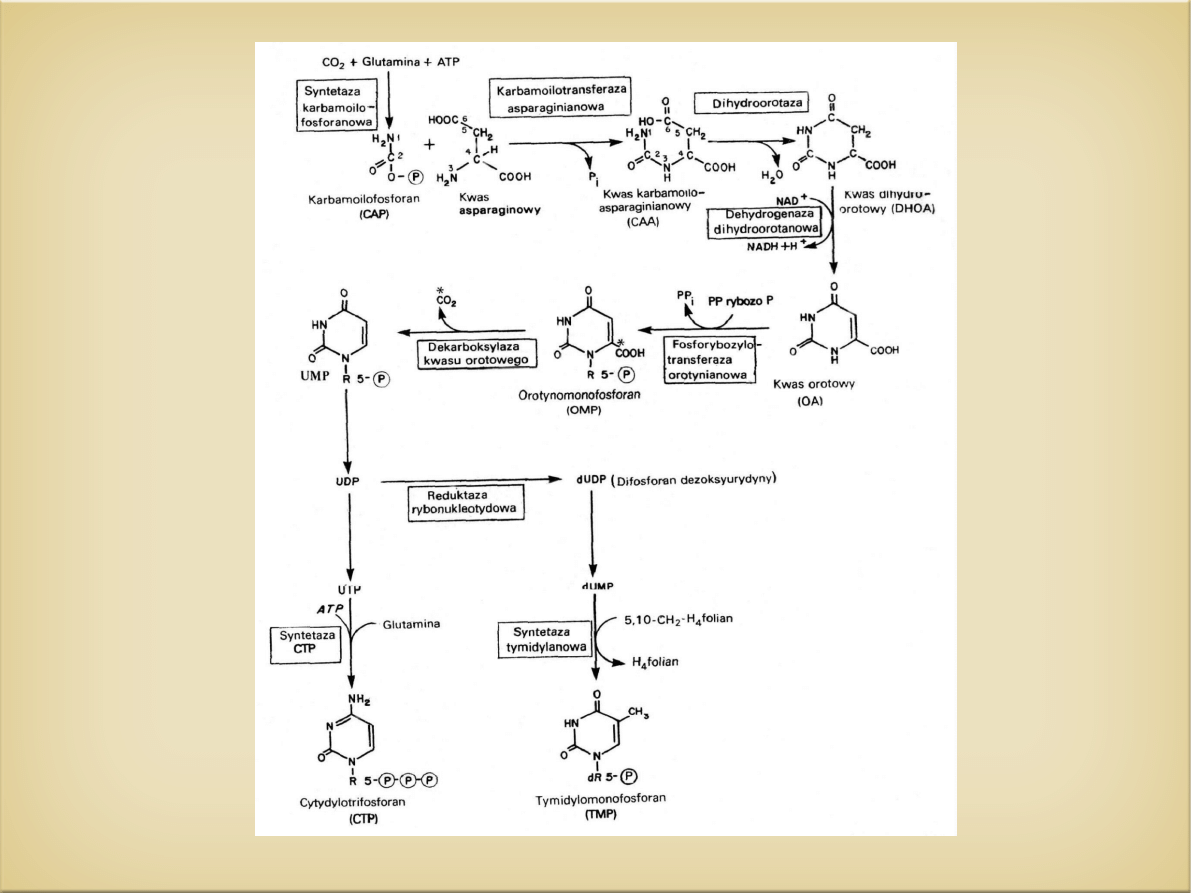
synteza de novo:
- zasady pirymidynowe są syntezowane z prostych związków,
tzn. z glutaminy, asparaginianu i CO
2
- podczas syntezy nukleotydu pirymidynowego powstaje
najpierw cząsteczka zasady pirymidynowej, która następnie
jest przyłączana do rybozy
- tworzenie pierścienia pirymidyny jest nezależne od rybozy
(w przciwiestwie do syntezy nukleotydów purynowych)
synteza rezerwowa:
- przyłączanie do rybozy zasad pirymidynowych odzyskanych z
innych procesów
- u ssaków mniej istotna, niż synteza rezerwowa
nukleotydów purynowych

U organizmów wyższych biosynteza pirymidyn
jest katalizowana przez enzymy wielofunkcyjne
1.
MEpyr1-3 , CAD
– syntetaza
karbamoilofosforanowa, karbamoilotransferaza
asparaginianowa i dihydroorotaza (1,2,3)
2. MEpyr5-6
Kompleks enzymów 5 i 6, czyli
fosforybozylotransferazy orotanowej i
dekarboksylazy orotydyno-5-fosforanowej
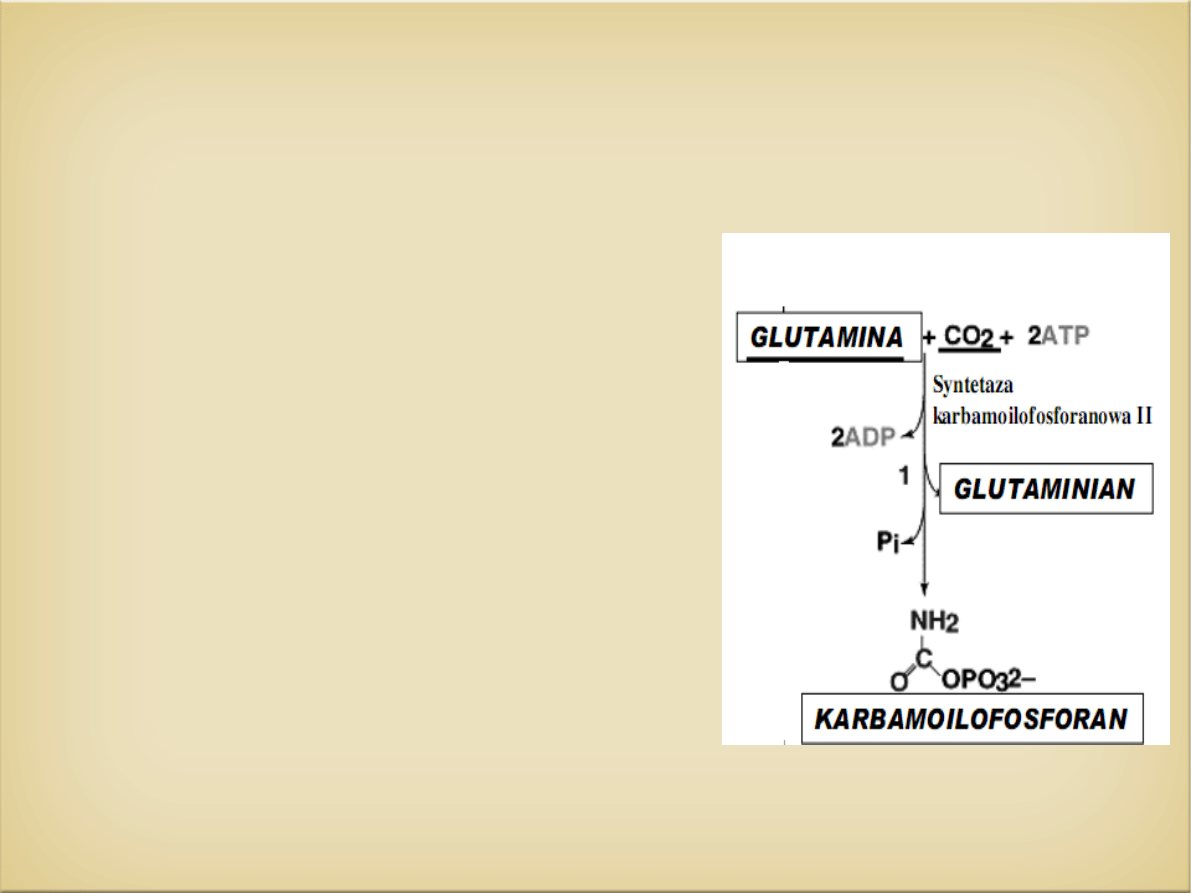
1.
Glutamina +2ATP +CO2 Karbamoilofosforan + 2ADP+ Pi +
glutaminian
Syntetaza karbamoilofosforanowa II
(CPS II)- bierze udział
w syntezie pirymidyn w
cytoplazmie.
Hamowana: UTP i nukleotydy
purynowe
Aktywowana: PRPP
Syntetaza karbamoilofosforanowa I
( CPS I)- bierze udział
w syntezie mocznika w
mitochondrium
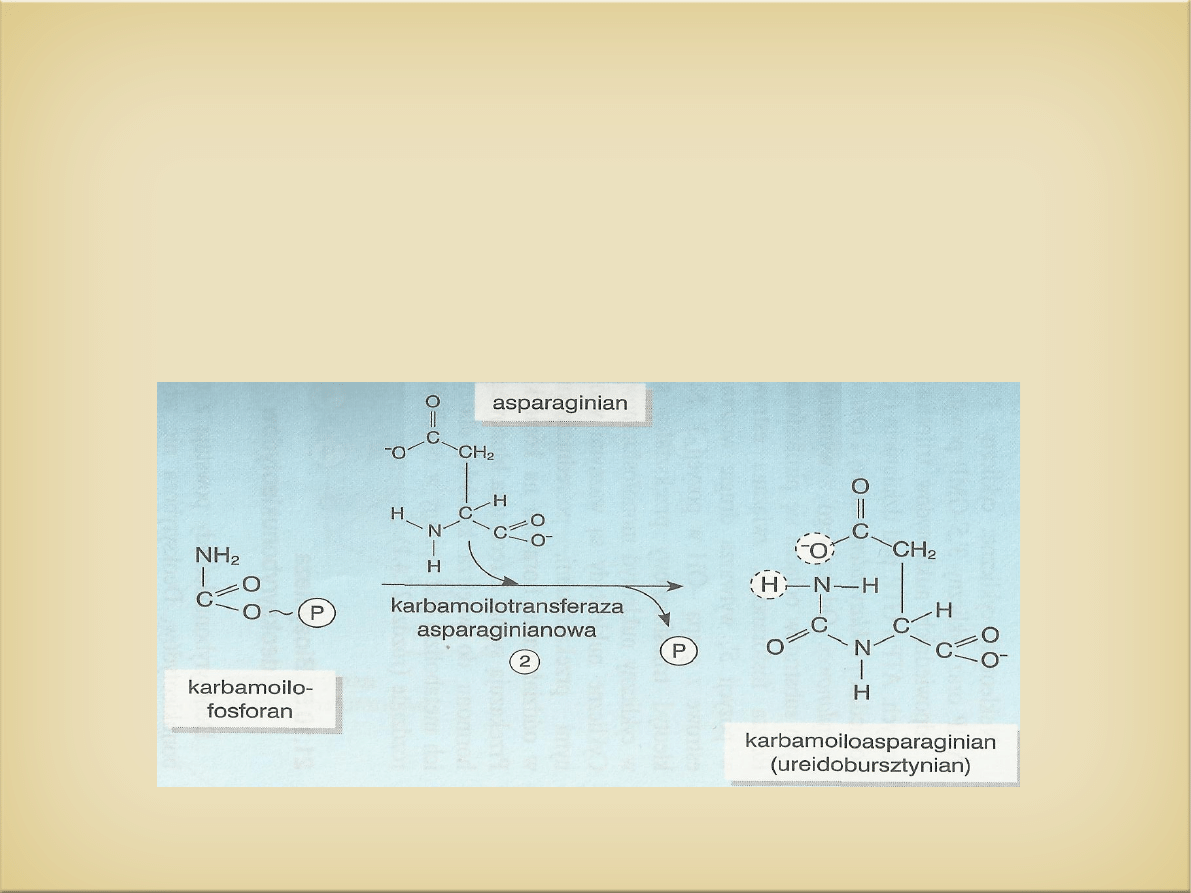
- karbamoilotransferaza asparaginianowa ( ATC-aza)
- jest to enzym regulacyjny
- hamowanie: na zasadzie sprzężenia zwrotnego przez CTP
- aktywacja: ATP
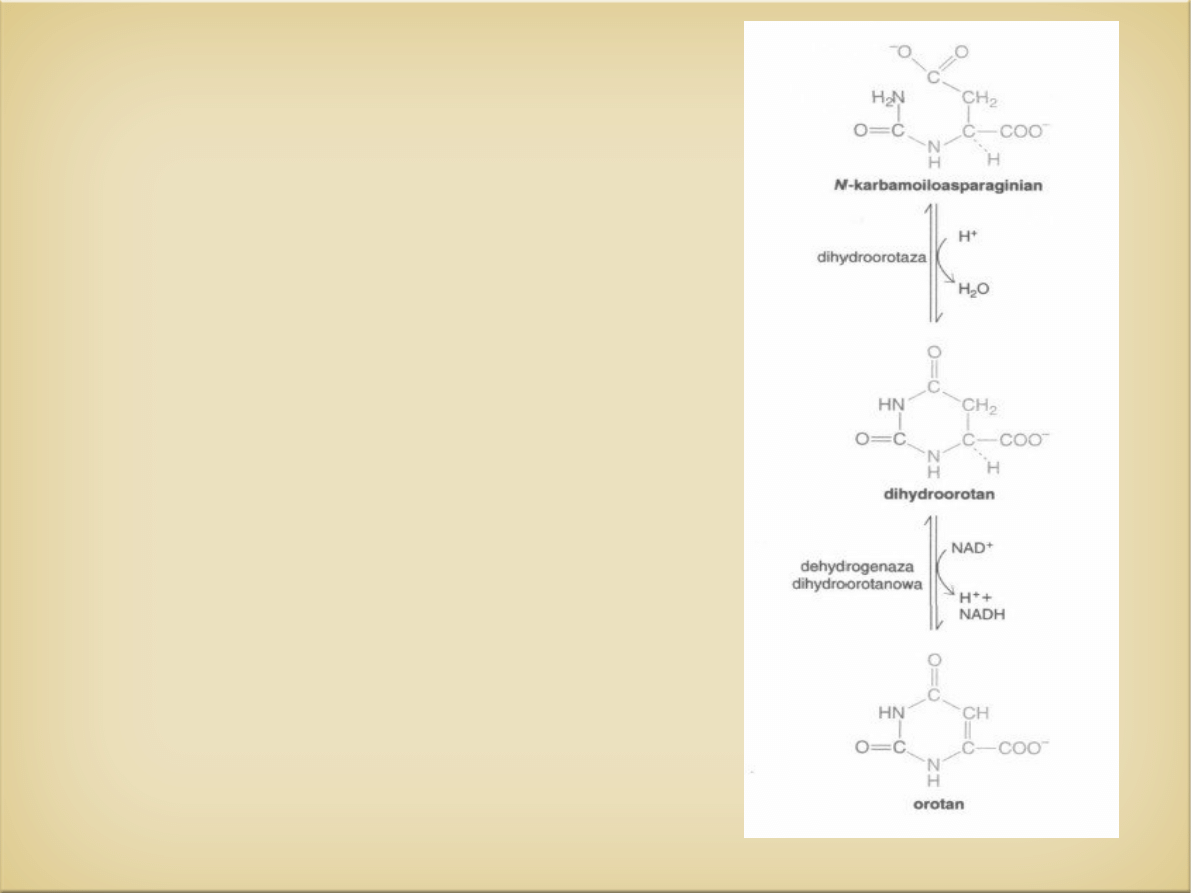
Enzym : dehydrogenaza
dihydroorotanowa
mitochondrialna – jest to
jedyny nie -
cytoplazmatyczny enzym
tego szlaku.
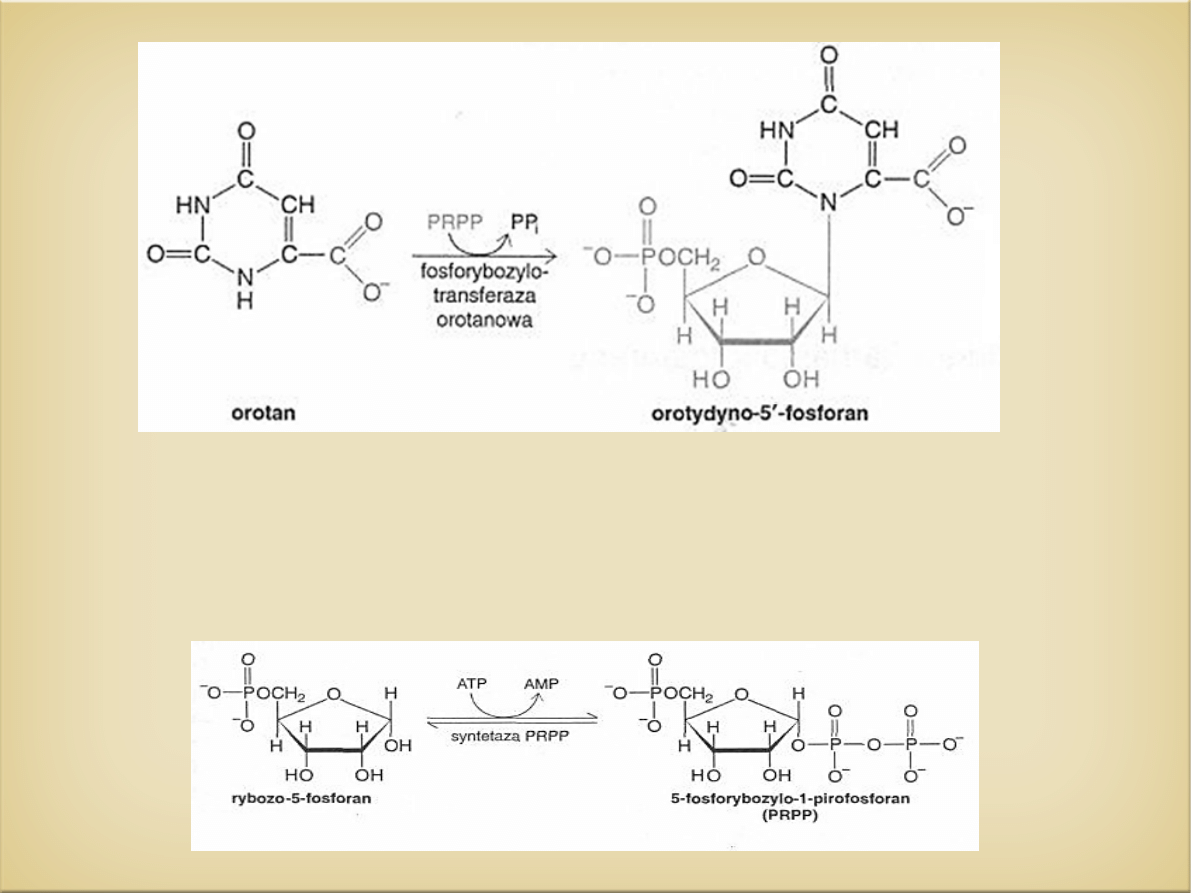
PRPP-(5-fosforybozylo-1-pirofosforan) jest donorem reszty
rybozofosforanowej w nukleotydach
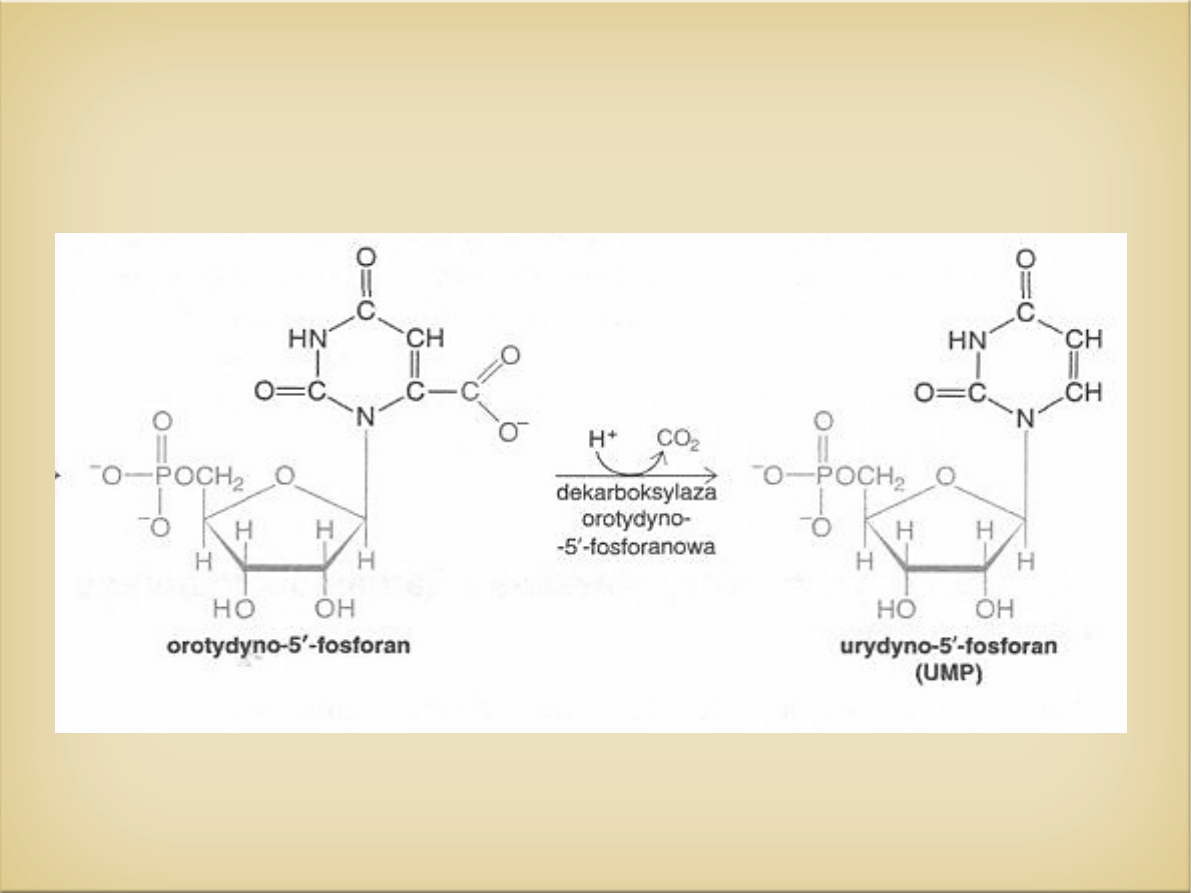
Powstanie głównego nukleotydy pirymidynowego
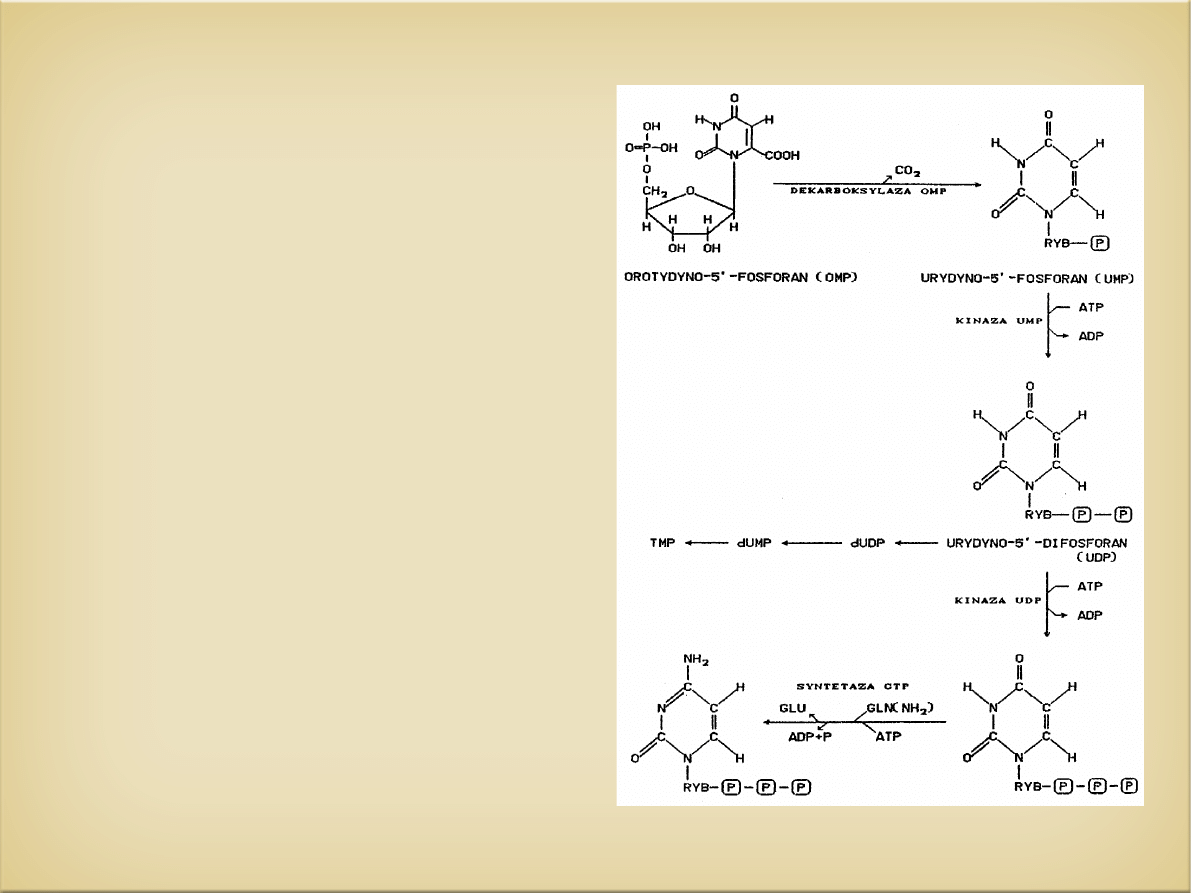
Deaminacja UTP –
wytworzenie CTP
- u ssaków donorem
grupy aminowej jest
grupa amidowa
glutaminy
- u Procaryota jest
nim NH4+
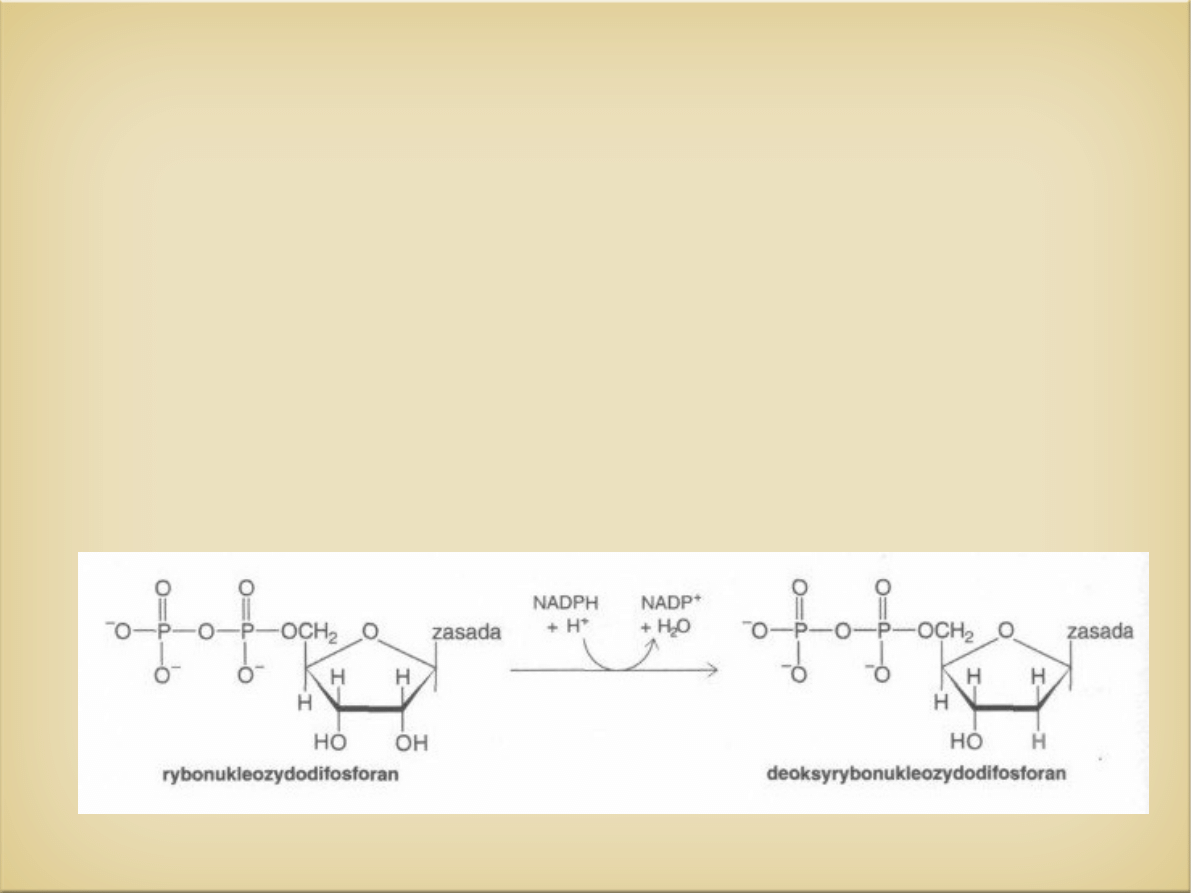
Synteza
deoksyrybonukleotydów
- deoksyrybonukleotydy powstają z rybonukleotydów
- deoksyryboza nie wbudowuje się do nukleotydów, lecz
powstaje poprzez redukcję rybozy zawartej w
rybonukleotydach
- reduktorem jest NADPH i H+
- w procesie tym uczestniczy enzym- reduktaza
rybonukleotydowa
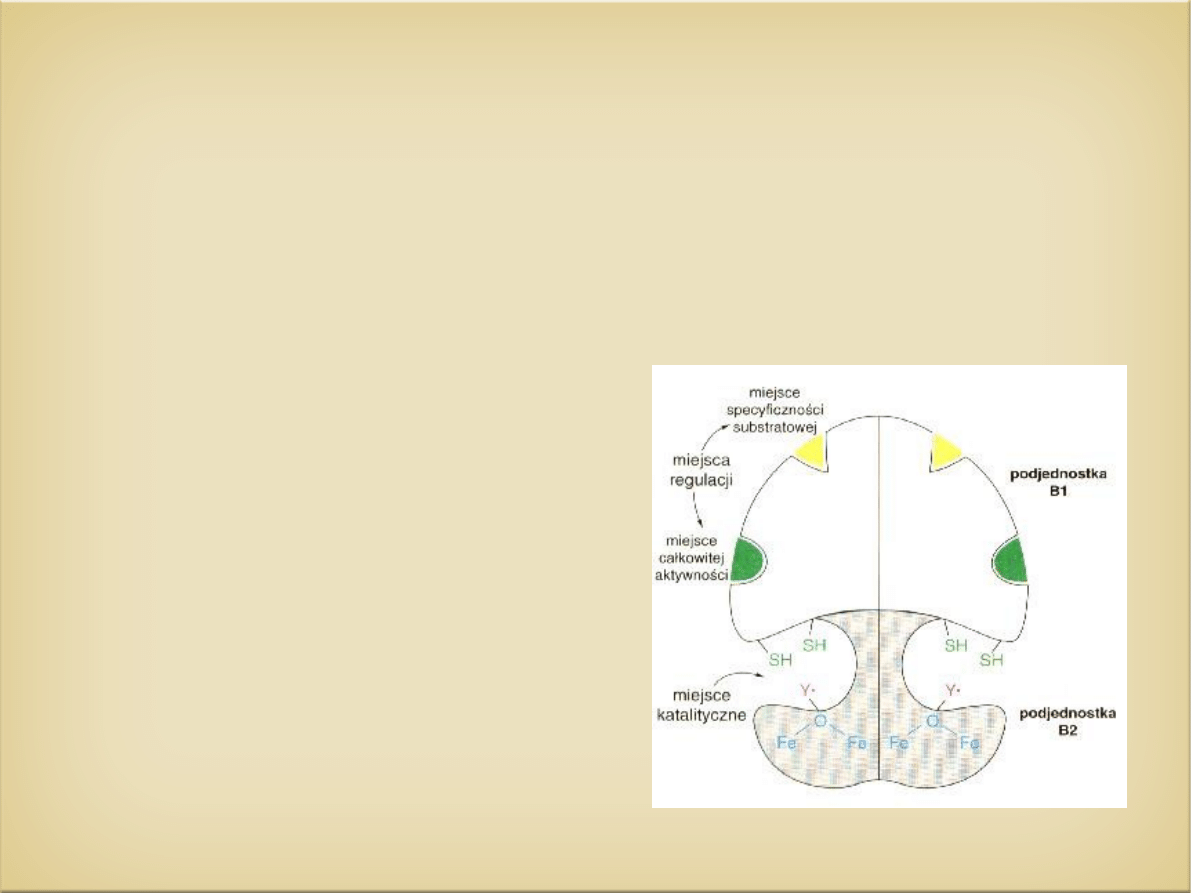
Reduktaza rybonukleotydowa
Składa się z dwóch podjednostek
B1-dwa miejsca regulacji allosterycznej, oraz parę grup
hydrosulfidowych
B2- współtworzy miejsce katalityczne oraz posiada rodnik tyrozylu
Miejsce całkowitej aktywności:
dATP
ATP
Miejsce specyficzności substratowej:
dATP, ATP- redukcji nukleotydów
pirymidynowych
dTTP- redukcja GDP
dGTP- redukcja ADP
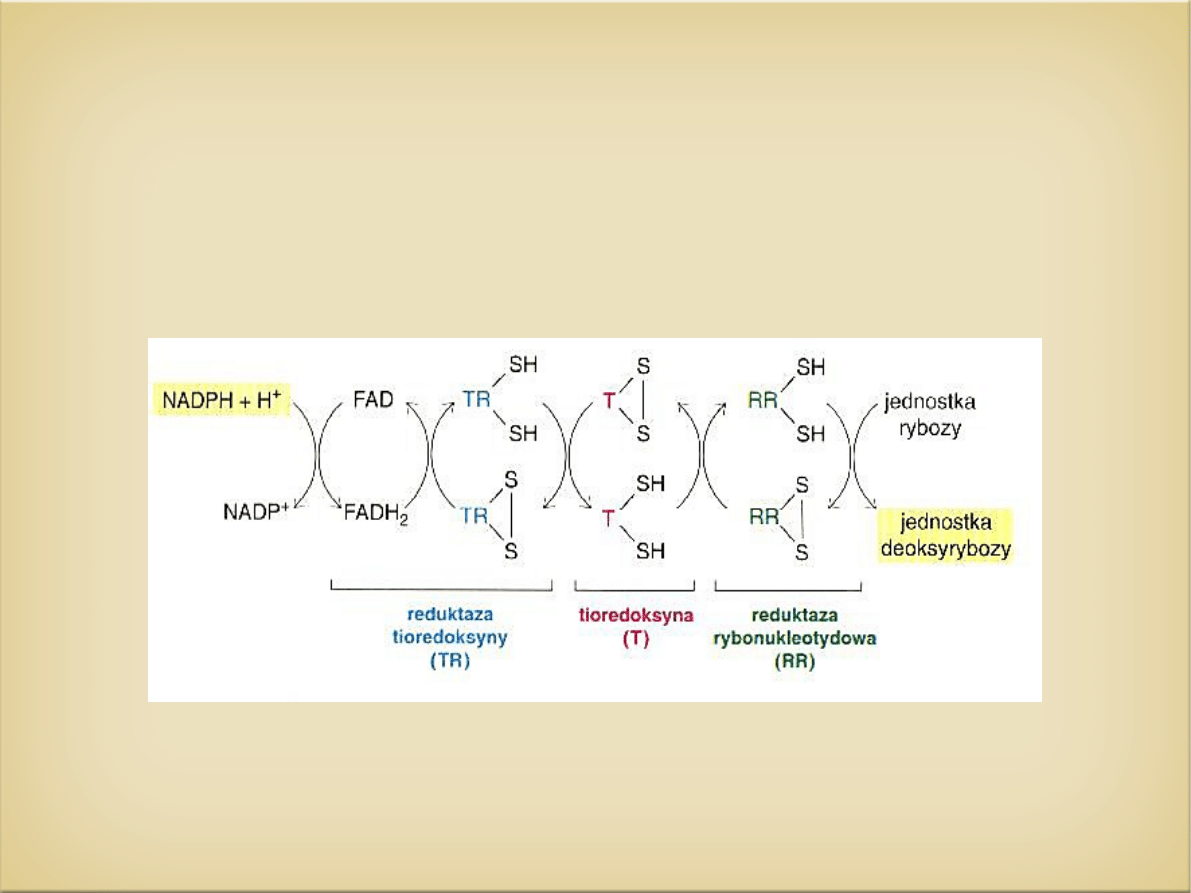
- elektrony z NADPH na grupy hydrosulfidowe reduktazy są
przenoszone za pomocą białka – TIOREDOKSYNY
- wszystkie tioredoksyny zawierają sekwencje -Trp –Cys-Gly-
Pro-Cys
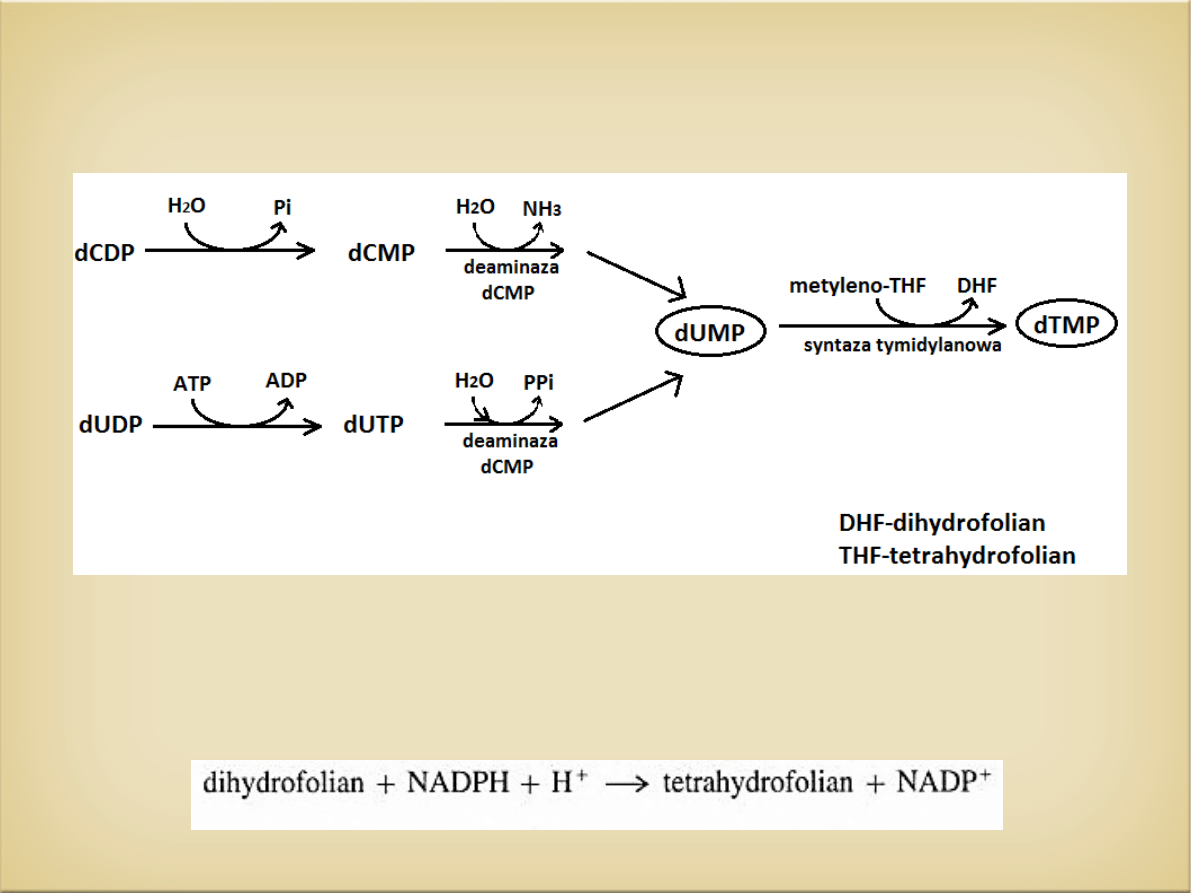
Powstawanie deoksytymidynomonofosforanu
reduktaza dihydrofolianowa
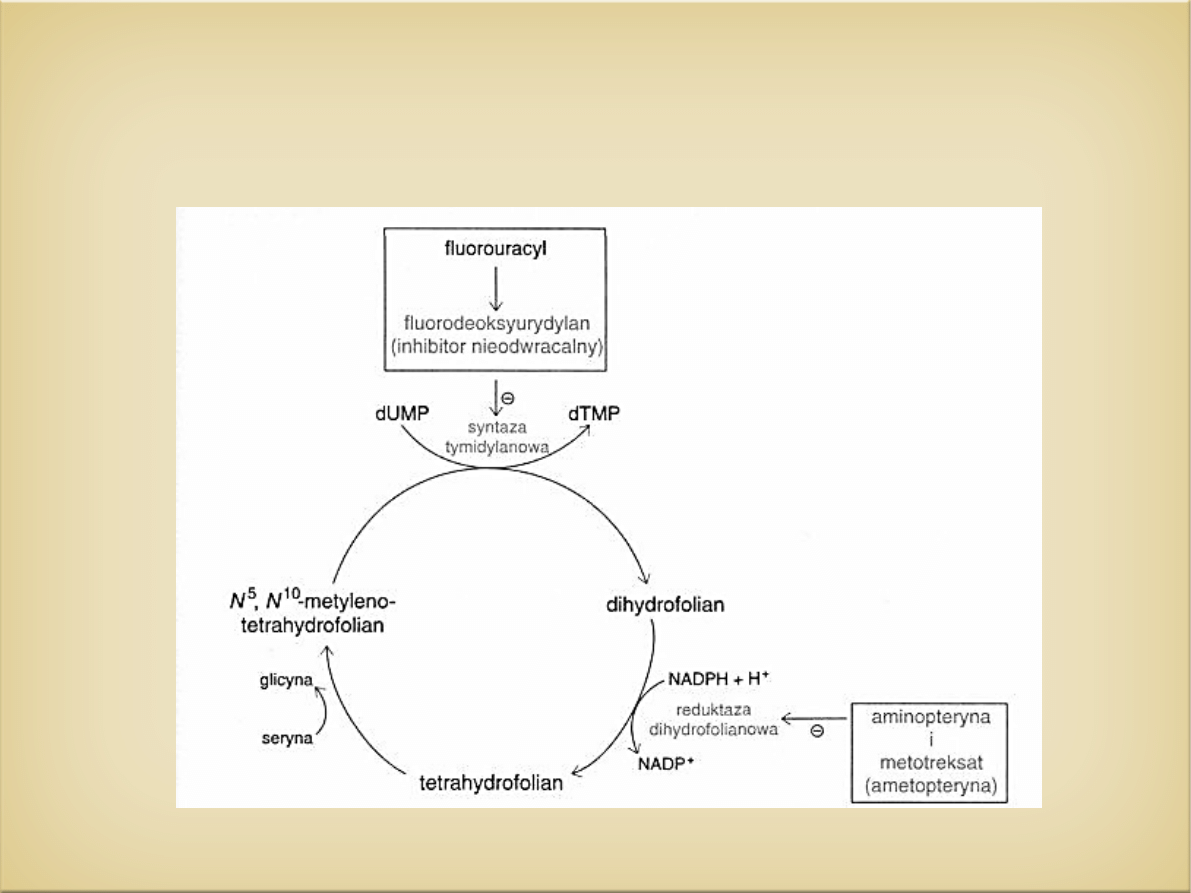
Terapia nowotworów

SYNTEZA NUKLEOTYDÓW
PIRYMIDYNOWYCH - REZERWOWA
- w wyniku reutylizacji pirymidyn powstają nukleotydy
- reakcje są katalizowane przez fosforybozylotransferazę
pirymidynową (uracylowa, orotanowa, tyminowa)
- drugim substratem jest PRPP

REGULACJA BIOSYNTEZY
NUKLEOTYDÓW PIRYMIDYNOWYCH
- 3 pierwsze i 2 ostatnie enzymy regulowane są przez
skoordynowaną represję i derepresję
- 2 pierwsze enzymy są wrażliwe na regulację
allosteryczną

Dwa pierwsze enzymy: syntetaza karbamoilofosforanowa
(CPS) i karbamoilotransferaza asparaginianowa (ATC )
są regulowane allosterycznie
CPS :
jest hamowana przez UTP i nukleotydy purynowe
jest aktywowana przez PRPP
ATC :
jest hamowana przez CTP
jest aktywowana przez ATP

Znaczenie regulacji aktywności ATC:
ATP i CTP konkurują o wiązanie z miejscem
regulacyjnym enzymu
Aktywacja przez ATP sygnalizuje, że istnieje energia
do replikacji DNA
Hamowanie przez CTP - w obecności nadmiaru
nukleotydów nie dojdzie do zbędnej syntezy
karbamoilofosforanu i strat energii

Acyduria orotowa (orotoacyduria)
- dziedziczona recesywnie
- związana z blokiem w przemianie pirymidyn
- gromadzeniem się kwasu orotowego
- wzrostem jego stężenia w moczu
Typy acydurii orotowej:
1. typ I - uszkodzenie fosforybozylotransferazy orotowej
oraz dekarboksylazy orotydylanowej
2. typ II - uszkodzenie dekarboksylazy orotydylanowej

Efekt:
- niedostateczna synteza pirymidyn
- zaburzona równowagą stosunku puryny-pirymidyny
- deficyt kwasów nukleinowych
Objawy:
- zaburzenia dojrzewania układu erytroblastycznego
- dysfunkcje immunologiczne
- kumulacja niewykorzystywanych produktów pośrednich,
powodująca uszkodzenie OUN
- kamica orotowa
Leczenie - doustne podawanie urydyny

Bibliografia
Berg Jeremy, Tymoczko John, Streyer Lubert, BIOCHEMIA, Warszawa
2007, PWN.
Murray Robert, Granner Daryl, Mayes Peter, Biochemia Harpera,
wyd.3, Warszawa 1995.
Bańkowski Edward, Biochemia – podręcznik dla studentów uczelni
medycznych, Wrocław 2009
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
Oleksyszyn, biochemia II, biosynteza nukleotydów
BIOSYNTEZA NUKLEOTYDÓW PURYNOWYCH
Oleksyszyn, Biochemia II, zagadnienia do biosynteza nukleotydów
Przemiana nukleotydów pirymidynowych
Przemiany zasad pirymidynowych i zaburzenia przemiany nukleotydów
Pirymidyny 2003
BIOSYNTEZA BIAŁKA
aldehydy i ketony addycja nukleofilowa
pirymidyny 2003
cykliczne nukleotydy
Nukleotydy
SEM-15WF2011 - Metabolizm nukleotydow pur i pyr, Studia, I semestr II rok, Biochemia, Różne
transkrypcja biosynteza rna, INNE KIERUNKI, biologia
VII, Lekarski WLK SUM, lekarski, biochemia, cykl crebsa, puryny i pirymidyny
3 Halogenoalkany Substytucja nukleofilowa
1 Wielka siła malych cząteczek biologiczne znaczenie nukleotydów
Ćwiczenie 7 Hydroliza nukleoproteidów
więcej podobnych podstron