
Niedokrwistości
hemolityczne

Niejednolity zespół defektów
zewnątrz- i/lub
wewnątrzerytrocytarnych
prowadzących do znacznego
(poniżej 10 dni),
niekompensowanego przez
hiperplazję erytronu w szpiku,
skrócenia przeżycia krwinki
czerwonej
Definicja niedokrwistości
hemolitycznych

Podział niedokrwistości
hemolitycznych
Wrodzone niedokrwistości hemolityczne
defekt błony komórkowej (sferocytoza,
eliptocytoza)
defekty enzymatyczne
hemoglobinopatie i talasemie
Nabyte niedokrwistości hemolityczne
n. autoimmunohemolityczne
n. h. polekowe
n. h. toksyczne
hipersplenizm
n. mikroangiopatyczne
n. makroangiopatyczne
nocna napadowa hemoglobinuria
Wspólna cecha niedokrwistości
hemolitycznych: skrócenie czasu przeżycia
krwinki czerwonej niekompensowane
hiperplazją układu erytroblastycznego
.
Podział Lanzkowsky’ego uwzgledniający
etiologię
i główne cechy diagnostyczne
hemolitycznych
A. Spowodowana defektem wewnątrz-krwinkowym
1. Defekty błony (sferocytoza, eliptocytoza).
Budowa,
oporność
osmotyczna;
2. Defekty enzymatyczne (kinaza pirogronianowa,
dehydrogenaza glukozo-6-fosforanowa - G-6-PD)
autohemoliza
, badania
enzymatyczn
e;
3. Defekty hemoglobiny
a. Hemu
b. Globiny
c. Jakościowe (np. niedokrwistość sierpowato-
komórkowa)
elektroforeza
hemoglobiny;
d. Ilościowe (np. talasemie)
HbF,
obecność
hemoglobiny
A
2

.
Podział Lanzkowsky’ego uwzgledniający
etiologię
i główne cechy diagnostyczne
hemolitycznych
B. Spowodowana defektem pozakrwinkowym
1. Immunohemolityczna
odczyn
Coombsa;
a. Izoimmunohemolityczna
b. Autoimmunohemolityczna
c. Idiopatyczna
odczyn
Coombsa,
identyfikacja
przeciwciał;
d. Makroangiopatyczna
sztuczne
zastawki,
protezy
naczyniowe
e. Mikroangiopatyczne
poszukiwanie
nowotworu!

Podział Lanzkowsky’ego uwzgledniający
etiologię
i główne cechy diagnostyczne
hemolitycznych
C) Wtórna
Zaburzenia immunologiczne (np.
toczen)
zmniejszona zawartość
składowych dopełniacza:
C
3
, C
4
, CH
50
, obecność
przeciwciał
przeciwjądrowych (ANA);
Obejmująca jeden szereg komórkowy
(np. czerwonokrwinkowy)
Niedokrwistość z
dodatnim odczynem
Coombsa;
Obejmująca wiele szeregów
komórkowych (np. białokrwinkowy,
płytkowy)
pancytopenia
neutropenia
trombocytopenia - ITP;
Na tle nieimmunologicznym (idiopatyczna, wtórna)
infekcje (cytomegalia, toksoplazmoza, różyczka, kiła)
niedokrwistość hemolityczna na tle uszkodzeń drobnych naczyń z
zespołem DIC albo bez: rozsiane zakażenie herpes simplex,
infekcje wywołane wirusami Coxacckie B, posocznica w zakażeniu
bakteriami Gram - ujemnymi, zakrzepica żył nerkowych,
nieprawidłowo przebiegający poród, niektóre przypadki zespołów
błon szklistych

objawy kliniczne
Objawy ogólne: gorączka, dreszcze, bóle
mięśni i stawów
Objawy niedokrwistości
Objawy żółtaczki
Splenomegalia i/lub hepatomegalia
Cechy laboratoryjne
stężenie bilirubiny
stężenia urobilinogenu w
moczu
stężenia sterkobilinogenu w
kale
retikulocytozy
aktywności LDH
stężenia Fe
haptoglobiny
czasu przeżycia erytrocytów

Przebieg niedokrwistości
hemolitycznej:
Ostry
Podostry
Przewlekły
Przełom hemolityczny
ostre bóle w okolicy
lędźwiowej
i kończyn dolnych
bóle głowy, brzucha
dreszcze
gorączka
pogłębienie niedokrwistości
ze wzrostem retikulocytozy
nasilenie bilirubinemii
wzrost leukocytozy z
przesunięciem w lewo w
rozmazie
wystąpienie lub nasilenie
splenomegalii
Przełom aplastyczny
ciężki stan ogólnych
chorego
gorączka
wymioty
hipo- lub aplazja układu
czerwonokrwinkowego
pancytopenia lub
duocytopenia
zmniejszenie odsetka
retikulocytów
narasta stężenie żelaza
obniżenie stężenia
bilirubiny
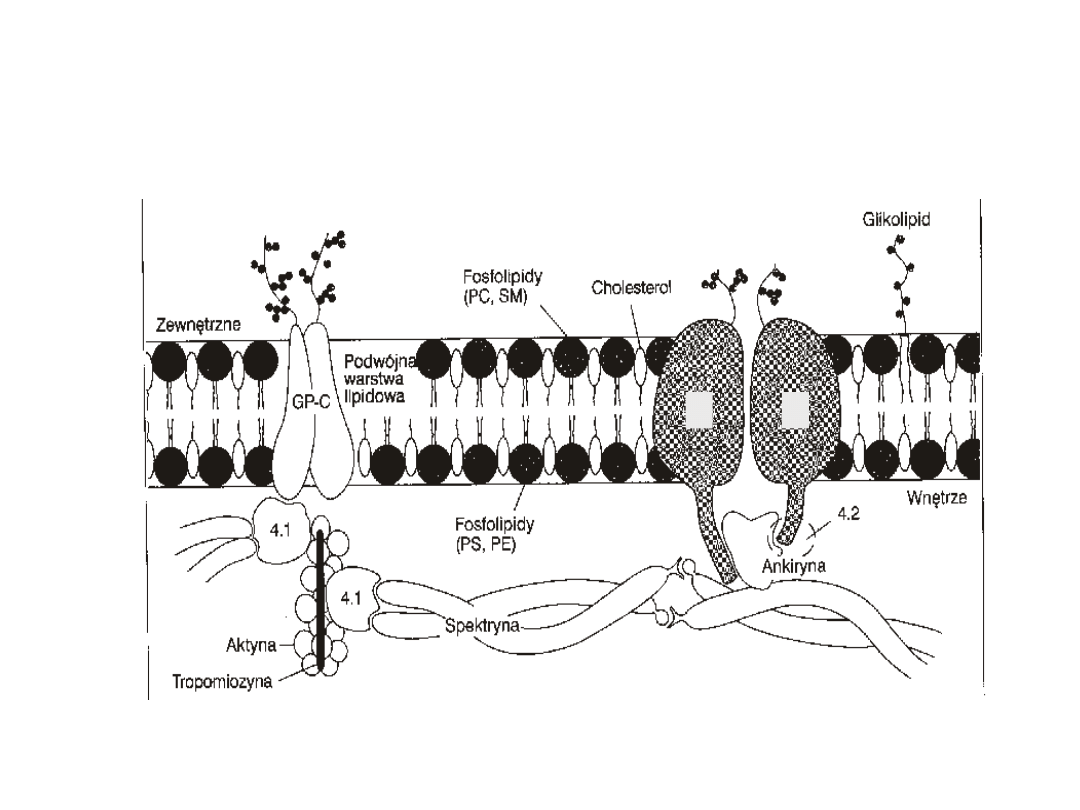
Budowa błony erytrocyta i białka
szkieletu
3
3

Sferocytoza wrodzona
Występowanie: Europa północna i USA (1/5000)
Druga co do czestości wystepowania wrodzoną
niedokrwistością hemolityczną po niedoborze
dehydrogenazy
glukozo-6-fosforanowej.
Defekt: niedobór/mutacja spektryny - autosom.
recesywne niedobór/mutacja spektryny - autosom.
dominujące
nieprawidłowości ankiryny
nieprawidłowości białka 3
zwiększenie przepuszczalności błony k. dla Na+ i
K+
Anomalie białek błony komórkowej prowadzą do
wytwarzania sferocytów, które ulegają sekwestracji
w śledzionie.

PRZEBIEG: Choroba ujawnia sie niekiedy już w
okresie noworodkowym pod postacią cieżkiej
żółtaczki i niedokrwistości.
Umiarkowaną niedokrwistość, dyskretną żółtaczkę i
powiekszoną śledzionę obserwuje sie na ogół już od
2 roku życia.
Kamica żółciowa wystepuje u 50% chorych.
Najcięższym powikłaniem choroby w dziecinstwie
są zagrażające życiu epizody aplastyczne.
W tym czasie we krwi obwodowej stwierdza się
brak retikulocytów, a w szpiku wystepuje zanik
układu czerwonokrwinkowego. Epizody aplastyczne
rozwijają się w związku z zakażeniami wirusowymi,
szczególnie parwowirusem i trwają zwykle około 14
dni.
Sferocytoza wrodzona

Oporność osmotyczna krwinek czerwonych jest
obniżona.
Test autohemolizy wykazuje destrukcje 15-45%
erytrocytów po 48 godzinach.
W celu odróżnienia wrodzonej sferocytozy od
autoimmunohemolitycznych niedokrwistości należy
wykonać odczyn Coombsa.
Przy hiperbilirubinemii okresu noworodkowego
należy różnicować z konfliktem serologicznym
w grupach głównych.
W przypadku negatywnego wywiadu rodzinnego
właściwą diagnoza możliwa jest po dłuższym
okresie obserwacji.
Sferocytoza wrodzona

Badania dodatkowe: sferocyty (+ akantocyty)
zmniejszenie oporności osmotycznej,
powiększenie retikulocytozy, hiperplazja
erytronu
Leczenie: splenektomia po 5 roku życia
Po usunieciu śledziony ustepują objawy choroby, ale
nadal utrzymuje sie sferocytoza i obniżona odporność
osmotyczna.
Usuniecie śledziony zapobiega wystepowaniu
pprzełomów aplastycznych, kamicy żółciowej,
hemosyderozy i uszkodzeń wątroby.
Po wykonaniu splenektomii istnieje niebezpieczenstwo
wystąpienia piorunujących zakażen pneumokokowych.
Uodpornienie szczepionką przeciwpneumokokową
przed zabiegiem i profilaktyczne podawanie penicyliny
o przedłużonym działaniu w pierwszych latach po
splenektomii chroni dzieci przed niebezpieczenstwem
wystąpienia piorunujących posocznic.
Sferocytoza wrodzona
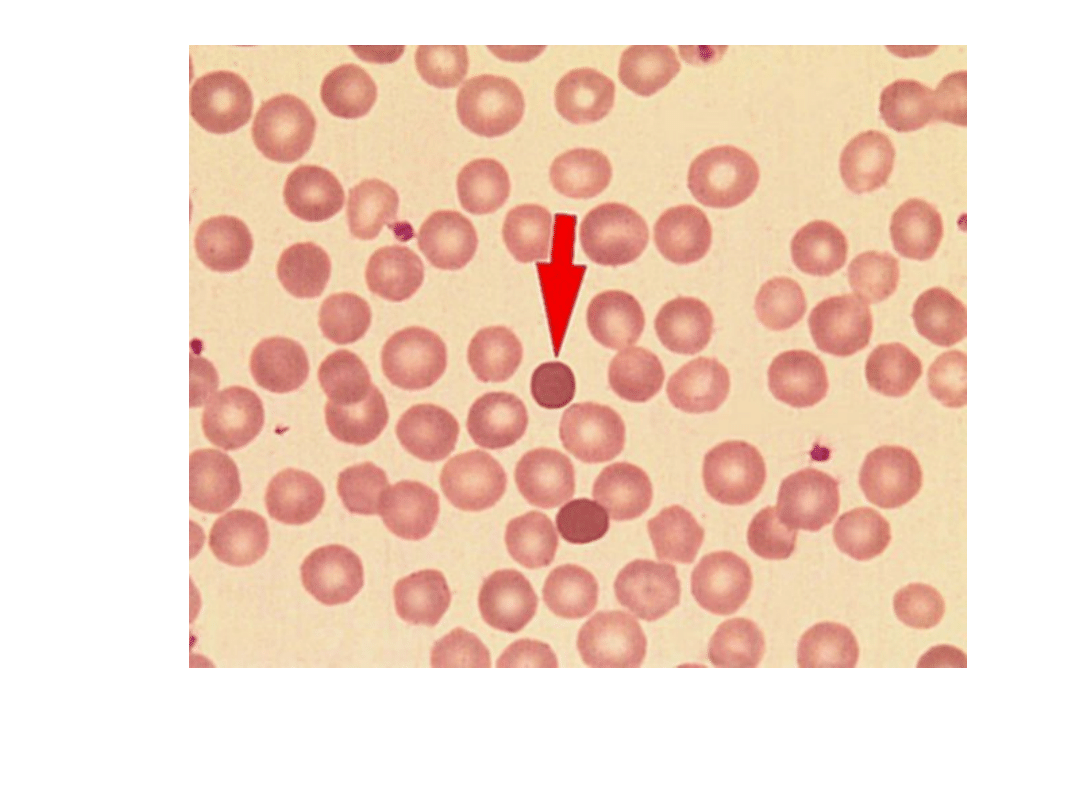
Sferocyty (strzałka)
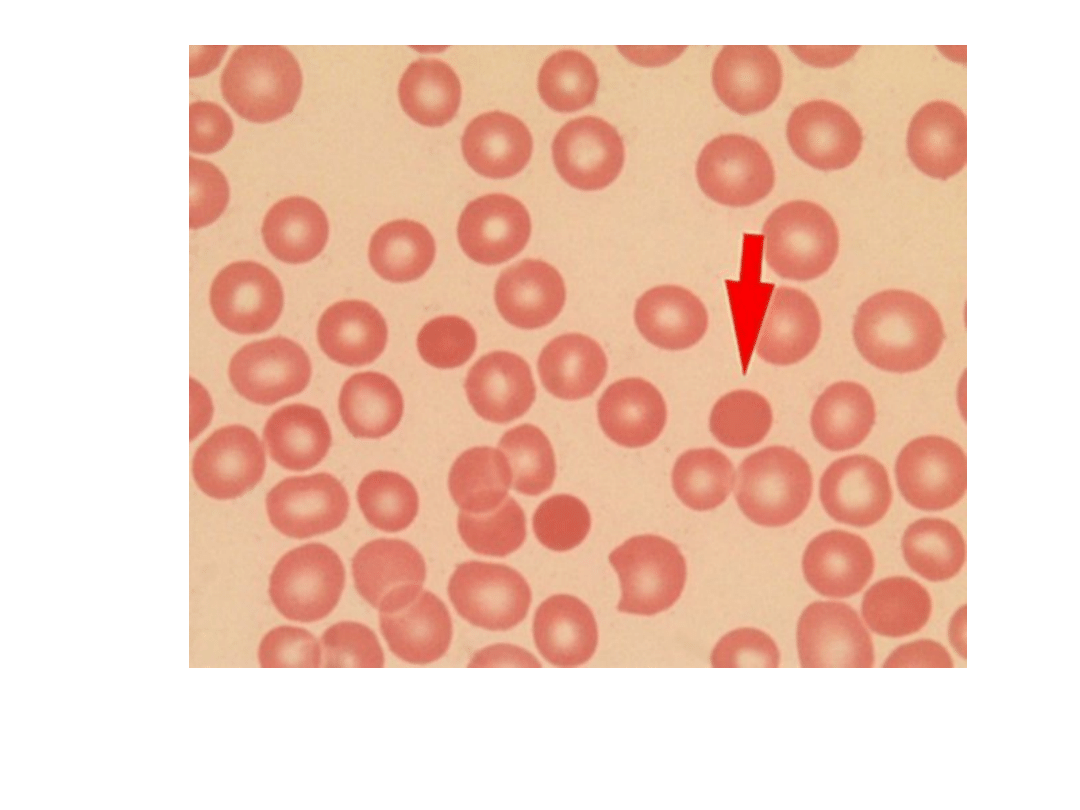
Sferocyty (strzałka)
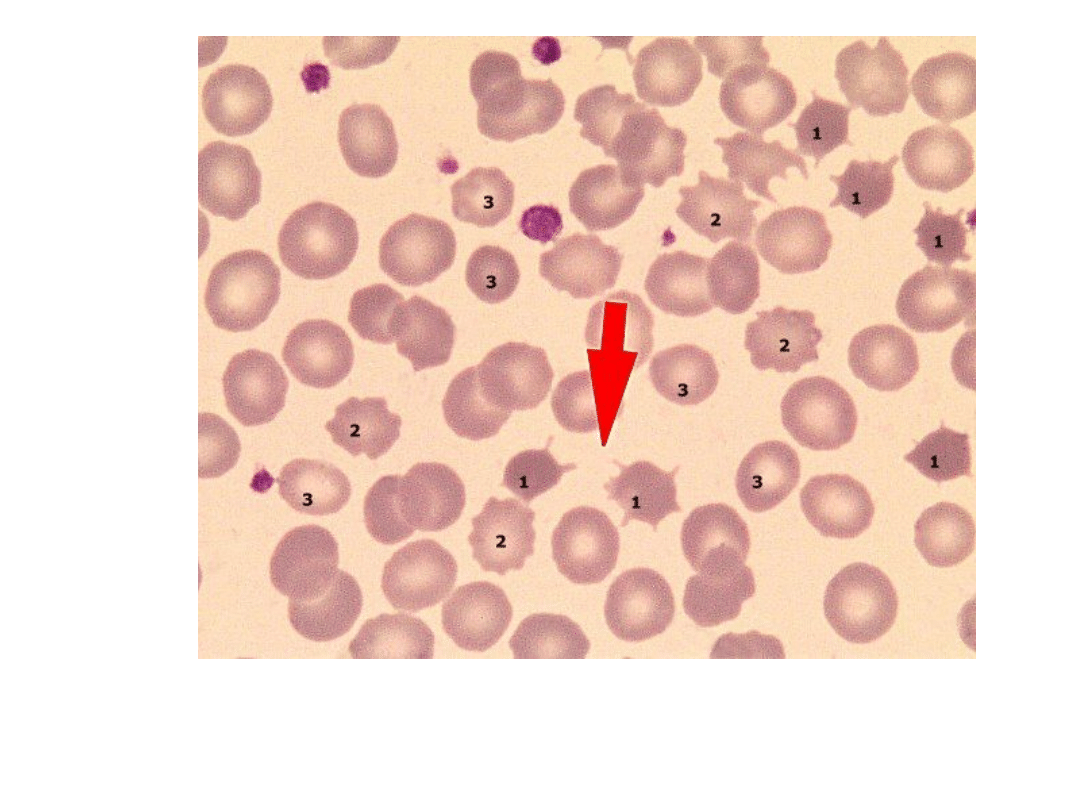
1 – akantocyty
2 – echinocyty
3 – mikrocyty

Eliptocytoza wrodzona
Występowanie: powszechne (1/5000)
Defekt: nieprawidłowe warianty spektryny (a. dominujące)
niedobór białka 4,1, glikoforyny C, białka 4,9
nieprawidłowości białka 3
zmniejszenie wiązania ankiryny do białka 3
Odmiany: eliptocytoza pospolita, sferocytowa
i stomatocytowa
Objawy: przebieg najczęściej łagodny, bezobjawowy,
możliwe zaostrzenia w postaci przełomów
aplstycznego, hemolitycznego
(przebieg ciężki w postaci homozygotycznej)
Badania dodatkowe: eliptocyty (owalocyty) sferocyty,
fragmentocyty,
prawidłowa lub zwiększona oporność osmotyczna,
powiększenie retikulocytozy, hiperplazja erytronu
Leczenie: splenektomia ?
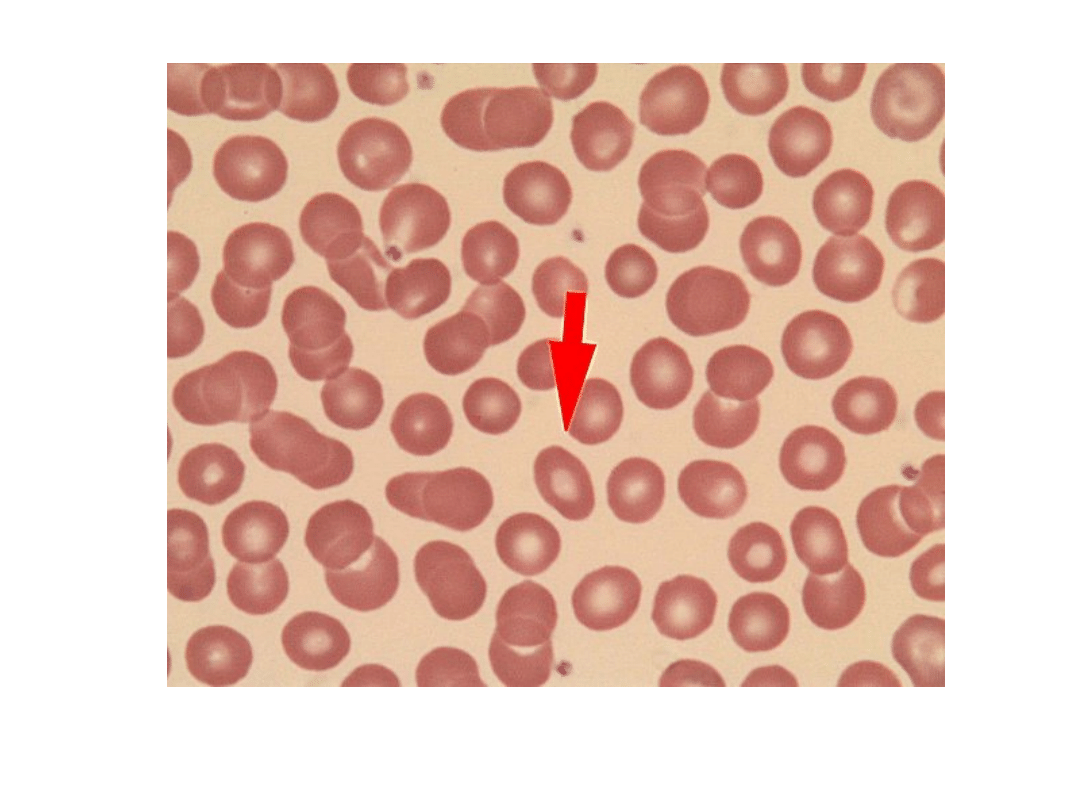
Eliptocyt (strzałka)
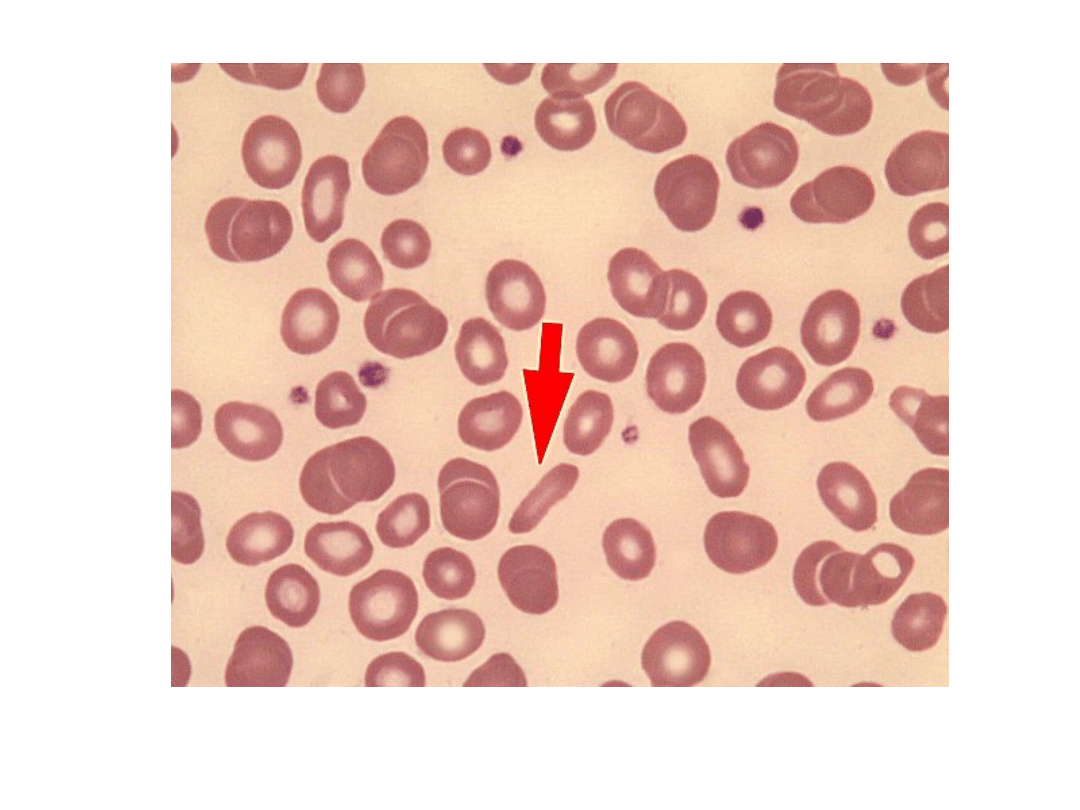
Eliptocyt (strzałka)
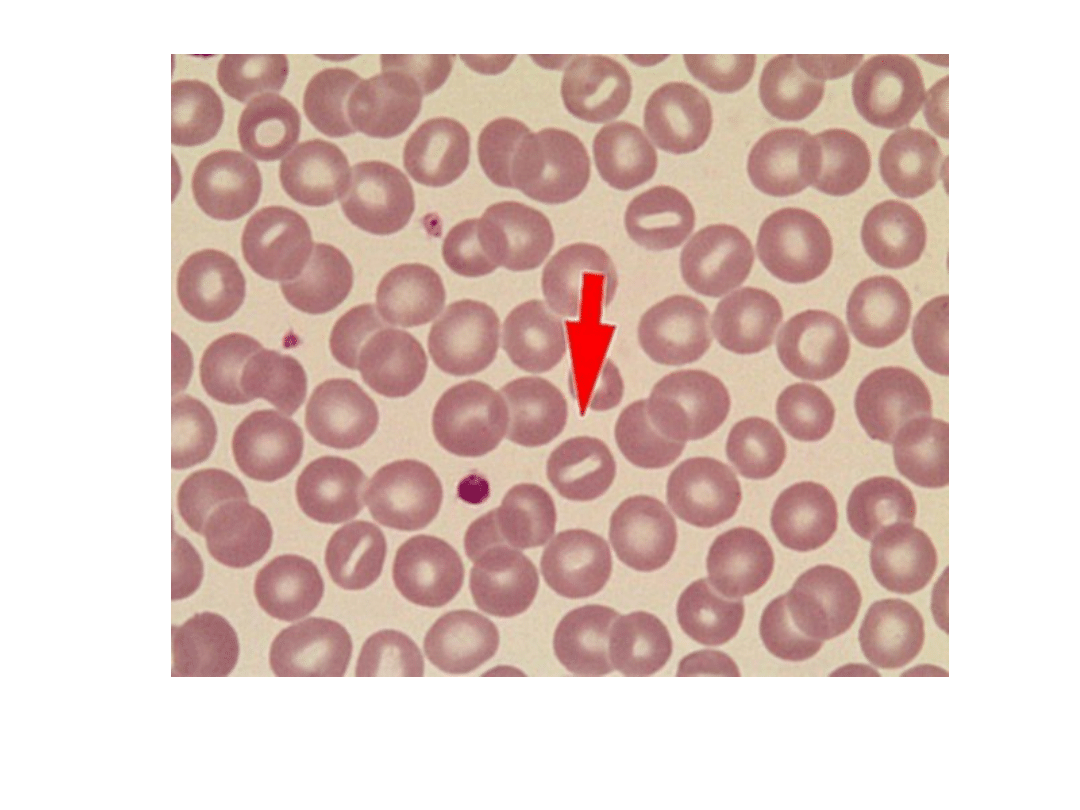
Stomatocyt (strzałka)

Enzymopatie
Anomalie enzymów cyklu glikolizy beztlenowej
(Embdena-Meyerhofa
Niedobór kinazy pirogronianowej (autos.
recesywne)
Niedobór fosfoheksoizomerazy
Anomalie enzymów cyklu pentozowego
Niedobór dehydrogenazy glukozo-6-fosforanowej
Anomalie enzymów syntezy glutationu
Niedobór reduktazy glutationu
Anomalie przemiany nukleotydów
Niedobór pirymidyno-5-nukleotydazy
Nadmiar dezaminazy adenozyny
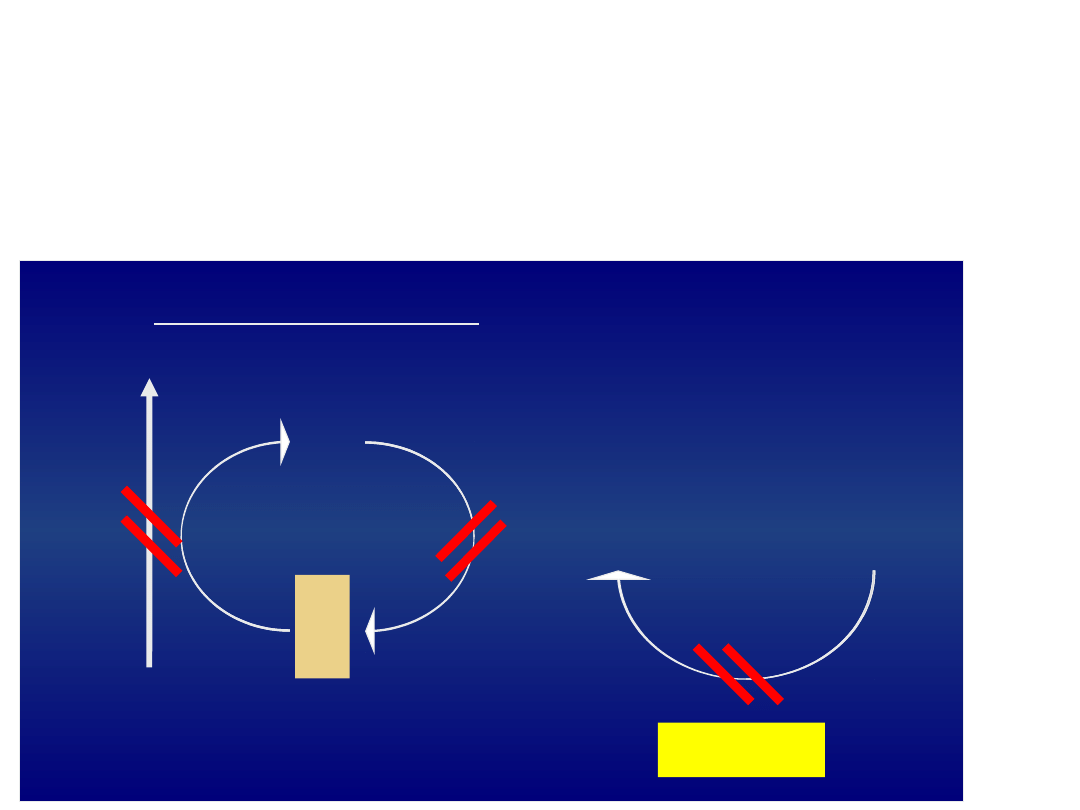
Anomalie enzymów cyklu pentozowego
Niedobór dehydrogenazy glukozo-6-
fosforanowej
Częstość – 2%
Dziedziczenie związane z chromosomem X – pełna
ekspresja wady tylko u mężczyzn
U kobiet aktywność bardzo różna – mozaikowe populacje
erytrocytów
H
2
O
2
H
2
O
G
S
H
G
S
S
G
P
e
ro
k
s
y
d
a
za
g
lu
ta
ti
o
n
u
R
e
d
u
k
ta
za
g
lu
ta
ti
o
n
u
NADPH
NADP
G-6-PD
Zmniejszenie stężenia zredukowanego glutationu (GSH)
DENATURACJA GLOBINY: ciałka HEINZA
methemoglobinemia

Opisano około 150 wariantów niedoboru G-6-PD.
Najcześciej wystepującymi wariantami defektywnego enzymu
są wariant A oraz wariant B, zwany śródziemnomorskim.
•
Wariant A wystepuje głównie u Murzynów afrykanskich i
amerykanskich. Enzym ulega szybko inaktywacji (jego
półokres biologiczny wynosi 13 dni).
•
Wariant śródziemnomorski B jest spotykany u Greków oraz
u Włochów,
a polega on na niemal zupełnym braku aktywności enzymu,
nawet w młodych erytrocytach. Przyczyną jest skrajna
niestabilnośa G-6-PD (jej okres biologiczny wynosi zaledwie
kilka godzin).
Anomalie enzymów cyklu
pentozowego
Niedobór dehydrogenazy glukozo-
6-fosforanowej

Anomalie enzymów cyklu pentozowego
Niedobór dehydrogenazy glukozo-6-fosforanowej
Objawy kliniczne – hemoliza indukowana przez leki
(
wewnątrznaczyniowa)
fawizm
hemoliza indukowana zakażeniami (Salmonella, E.coli,
EBV)
przewlekła niedokrwistość hemolityczna
hiperbilirubinemia noworodków
niedokrwistość towarzysząca kwasicy
Badania dodatkowe – zmniejszenie aktywności G-6-PD (badanie w
okresie zacisza)
niedokrwistość
zwiększenie retikulocytozy
hiperbilirubinemia
hemoglobinuria
c. Heinza
sferocytoza, fragmentocytoza
Leczenie – unikanie czynników wywołujacych
transfuzja wymienna u noworodków
regularne transfuzje ME
antyoksydanty (Vit E)
splenektomia ?
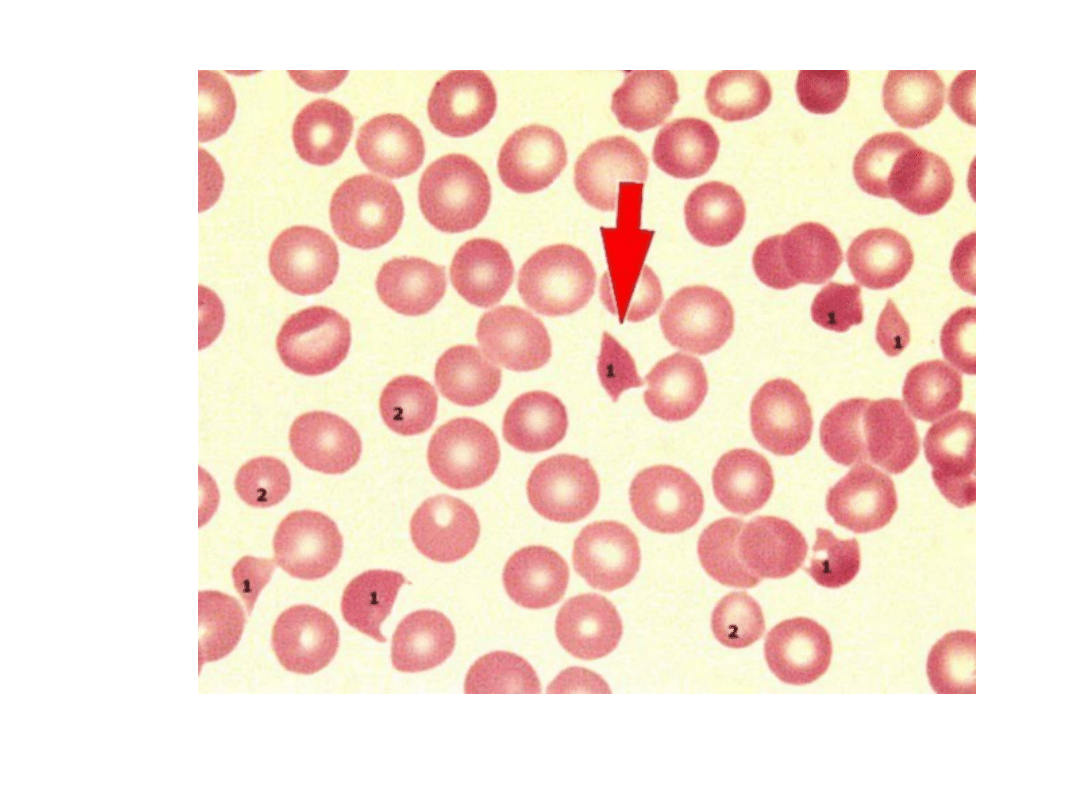
Fragmentocyty (strzałka)

Anomalie enzymów cyklu
pentozowego
Niedobór dehydrogenazy glukozo-
6-fosforanowej
Leki wywołujące hemolizę – acetaminofen
chinina
chloramfenikol
chlorochina
fenylobutazon
fenytoina
izoniazyd
kolchicyna
kwas acetylosalicylowy
lewodopa
nitrofurantoina
sulfonamidy
streptomycyna
trimetoprym
Vit C
Vit K

•
Zbyt mała aktywność G-6-PD w erytrocytach prowadzi do zmniejszenia
liczby cząsteczek zredukowanego glutationu w ilościach wystarczających do
ochrony przed działaniem czynników utleniających.
•
„Wolne rodniki” powodują utlenianie grup sulfhydrylowych hemoglobiny,
a w nastepstwie tego jej denaturacje.
•
Cząsteczki hemu i globiny dysocjują. Globina precypituje w postaci ciałek
Heinza, tworzących mostki dwusiarczkowe z błoną krwinkową.
•
Uszkodzone erytrocyty są usuwane z krwi przez komórki układu siateczkowo
- śródbłonkowego. Masywnie uszkodzone krwinki
czerwone mogą hemolizować śródnaczyniowo.
•
Klasycznym objawem niedoboru G-6-PD jest wystepowanie ostrych
przełomów hemolitycznych, zwykle wywołanych przez leki. Może także
objawiać sie hemolizą w przebiegu zakażeń i żółtaczki noworodków, w
przewlekłej niesferocytowej niedokrwistości hemolitycznej lub jako fawizm.
Anomalie enzymów cyklu pentozowego
Niedobór dehydrogenazy glukozo-6-
fosforanowej – podsumowanie

•
U chorych z wariantem A lub B, po okresie latencji trwającym 1-3
dni od chwili podania leków utleniających (np. sulfonamidów,
salicylanów, fenacetyny), wystepuje nagle hemoliza krwinek
czerwonych. Jej przebieg zależy od wariantu defektu G-6-PD.
•
U chorych z wariantem A hemolizie ulega tyko populacja starych
erytrocytów. Zdrowienie nastepuje wraz z pojawieniem sie w krwi
obwodowej krwinek młodych z G-6-PD o aktywności wystarczającej
do ochrony przed działaniem czynników utleniających .
•
U chorych z wariantem śródziemnomorskim hemolizie ulegają
wszystkie populacje erytrocytów w jednakowym stopniu. Chorzy ci
wymagają przetoczeń do czasu usunięcia leków z organizmu.
•
Chorym z niedoborem G-6-PD, prowadzącym do ostrych przełomów
hemolitycznych, nie należy podawać leków indukujących hemolize.
Splenektomia nie poprawia stanu klinicznego tych chorych.
Anomalie enzymów cyklu pentozowego
Niedobór dehydrogenazy glukozo-6-
fosforanowej – podsumowanie

Hemoglobinopatie
Błędy w budowie hemoglobiny prowadzące do
zmiany powinowactwa do tlenu
powstania nietrwałej hemoglobiny
Zaburzenia sierpowatokrwinkowe: wywołane odziedziczonym
genem drepanocytozy
Niedokrwistość sierpowatokrwinkowa: homozygoty
z hemoglobiną S
Defekt: -globina (walina kwas glutaminowy) taktoidy
Klinika: owrzodzenia podudzi, zatorowość płucna, udary
mózgu,
nadciśnienie płucne, niewydolność krążenia, choroby
siatkówki, niewydolność nerek, skłonność do infekcji
pałeczkami Gram(-), Przełom bólowy, przełom sekwestracyjny
Początkowa splenomegalia cofa sie ponieważ wielokrotne
zatory prowadzą do marskości śledziony.

Chorobę spotyka się przeważnie u Murzynów.
Homozygoty mają 80-100% HbS, 2-3% HbA
2
i 20%
HbF. Chorzy umierają przeważnie w dzieciństwie.
Heterozygoty mają 30-45% HbS, 70-55%HbF i małą
ilość HbA
2
. Te osoby, z powodu skróconego czasu
przeżycia krwinek czerwonych, są chronione przed
zachorowaniem na zimnice
i są lepiej dostosowane do rejonów malarycznych,
dlatego cześciej wystepują w danej społeczności.
Czesto te osoby wykazują zapalenie kości
wywołane przez Salmonella.
Test na „sierpowacenie" ujawnia sie wyraźnie
dopiero wtedy, gdy krew umieści sie na 6-24
godziny w środowisku bez dostepu tlenu (pod
uszczelnionym szkiełkiem nakrywkowym).
Sierpowatokrwinkowość
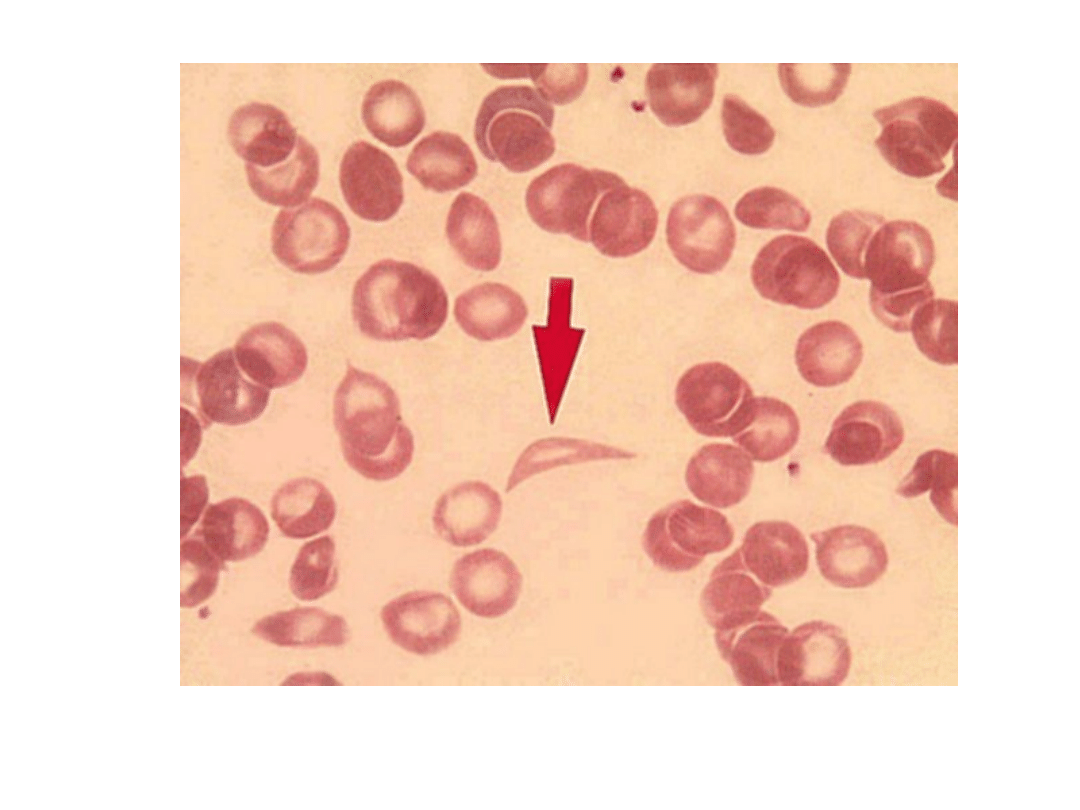
Drepanocyt (strzałka)

Methemoglobinemia
1.
Dziedziczna aut. dominująco wada hemoglobiny
utrudniająca jej redukcję methemoglobiny do
hemoglobiny
2.
Dziedziczna aut. Recesywnie niedobór reduktazy
methemoglobinowej
3.
Nabyta: ekspozycja na utleniacze (lidokaina,
nitraty, sulfasalazyna, sulfonamidy, pochodne
benzenu)
Klinika: przewlekła hemoliza wewnątrznaczyniowa
30-40% methemoglobinemii – śmiertelne
Leczenie: infuzja błękitu metylenowego 1-2mg/kg

Karboksyhemoglobina
Wadliwa instalacja wentylacyjna i
kominowa
Palacze cygar i papierosów
50% karboksyhemoglobinemii –
śmiertelne
Leczenie – tlenoterapia,
transfuzje ME

Talasemia
Talasemia - zaburzenia syntezy łańcucha hemoglobiny,
nadprodukcja łańcucha
Delecja 4 loci łańcucha hemoglobiny - powstają tetramery
łańcucha - hemoglobina Barta – postać śmiertelna w okresie
płodowym lub noworodkowym
Delecja 3 loci łańcucha hemoglobiny – powstaje
hemoglobina H –nietrwała – krwinki tarczowate, ciałka
Heinza;
objawy w okresie dzieciństwa lub dojrzewania
Delecja 2 loci łańcucha hemoglobiny – nosicielstwo
talasemii – umiarkowana niedokrwistość niedobarwliwa,
mikrocytarna – często mylona z n. sideropeniczną
Delecja 1 loci łańcucha hemoglobiny – bezobjawowe
nosicielstwo talasemii

Talasemia
Talasemia - zaburzenia syntezy łańcucha
hemoglobiny, nadprodukcja łańcucha
Powstają:
hemoglobina A
2
–
2
2
hemoglobina F –
2
2
Klinika: niedokrwistość mikrocytarna, obecność
krwinek tarczowatych, hepatosplenomegalia,
erytropoeza pozaszpikowa (kości czaszki –
mongołowaty wyraz twarzy), niewydolność
krążenia, nerek, kamica żółciowa, zahamowanie
wzrostu, wtórna hemosyderoza
Postać major (homozygoty) – ciężki przebieg ze
zgonem w ciągu kilku miesięcy/lat
Postać minor (heterozygoty) – postać łagodna
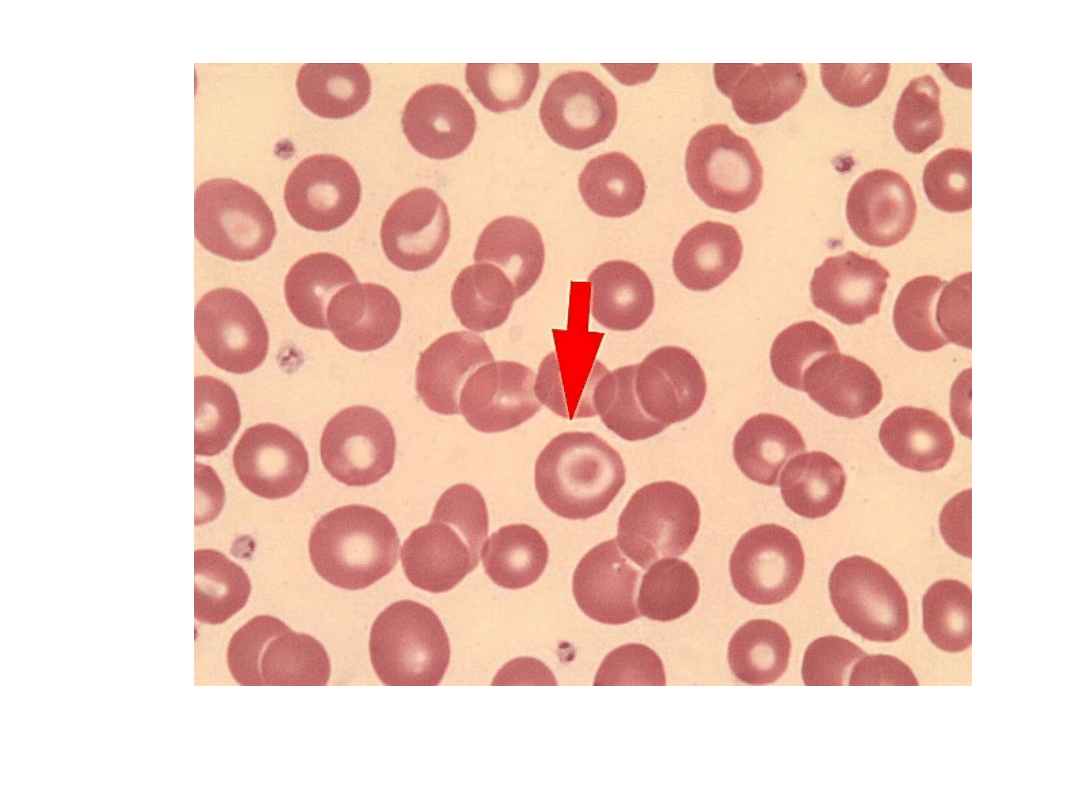
Erytrocyt tarczowaty (strzałka)
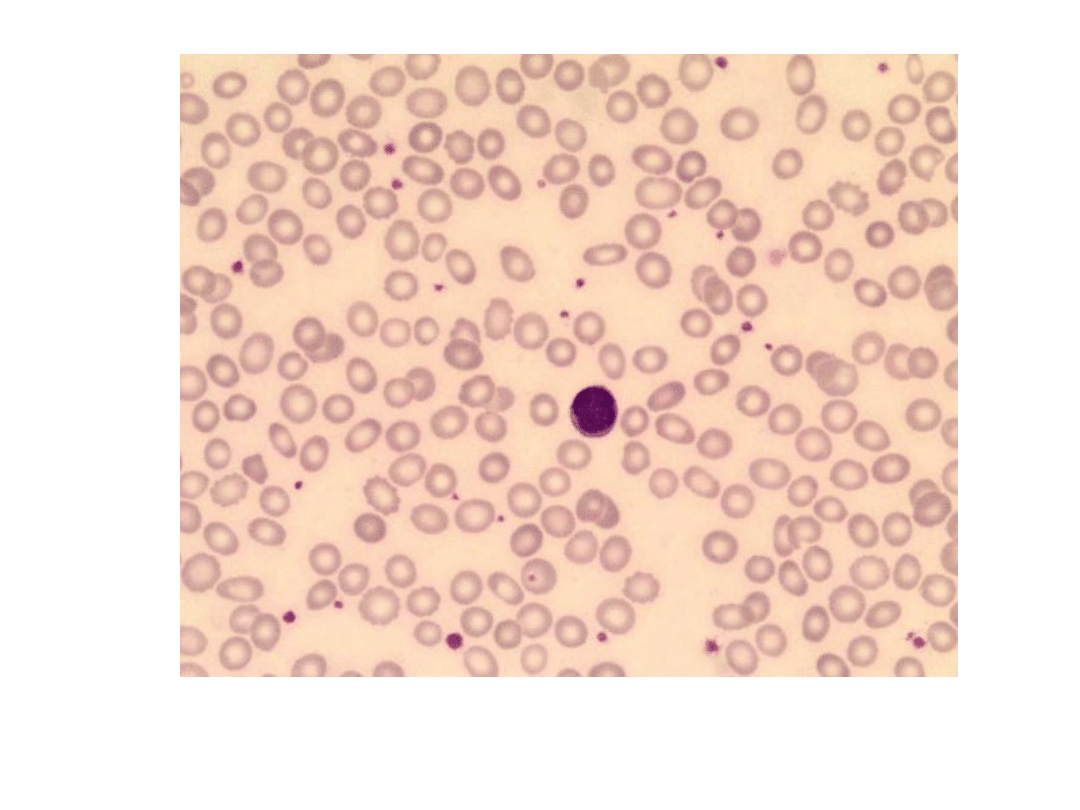
Mikrocyty
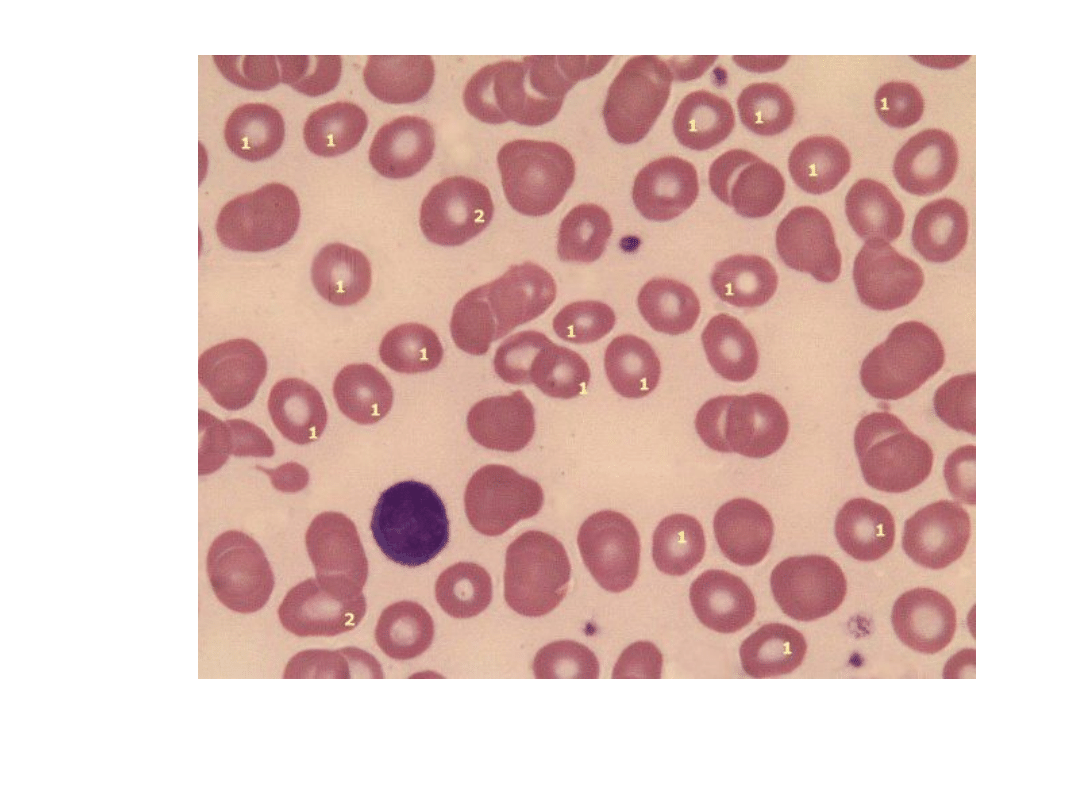
1 – mikrocyty
2 – normocyty

Podział nabytych niedokrwistości
hemolitycznych
zewnątrzkrwinkowe niedokrwistości hemolityczne
n. autoimmunohemolityczne AIHA
n. h. polekowe
n. h. toksyczne
hipersplenizm
n. mikroangiopatyczne
n. makroangiopatyczne
nocna napadowa hemoglobinuria
wewnątrzkrwinkowe niedokrwistości hemolityczne
nocna napadowa hemoglobinuria
zewnątrzkrwinkowe i wewnątrzkrwinkowe
niedokrwistości hemolityczne
niedokrwistość megaloblastyczna,
sideropeniczna

Przyczyny niedokrwistości
autoimmunohemolitycznych
Samoistne (70%)
Objawowe: NHL
(41,5%)
SLE
(24,5%)
przewlekłe zapalenie wątroby (10,7%)
przewlekłe zakażenia (8,9%)
grypa
RZS
(3,6%)
gruźlica
ziarnica złośliwa
sarkoidoza
rakowiak (1,8%)
Choroba zimnych aglutynin: samoistna
Mycoplasma pneumoniae
mononukleoza zakaźna
NHL
Zimna napadowa hemoglobinuria: samoistna
kiła
gruźlica
P
rz
e
ci
w
ci
a
ła
t
y
p
u
ci
e
p
łe
g
o
P
rz
e
ci
w
ci
a
ła
t
y
p
u
zi
m
n
e
g
o
Charakterystyka autoprzeciwciał
I, i
anty-Rh, Kell
swoistość
+
+/-
wiązanie
dopełniacza
kappa
kappa/lambda
typ łańcucha
lekkiego
IgM
IgG
klasa Ig
Kompletne
niekompletne
kompletność
aglutynacja lub
hemoliza
aglutynacja lub
hemoliza
typ reakcji
0 - 32
o
C
37
o
C
zakres temp.
16%
84%
częstość
Zimne
Ciepłe
Typ
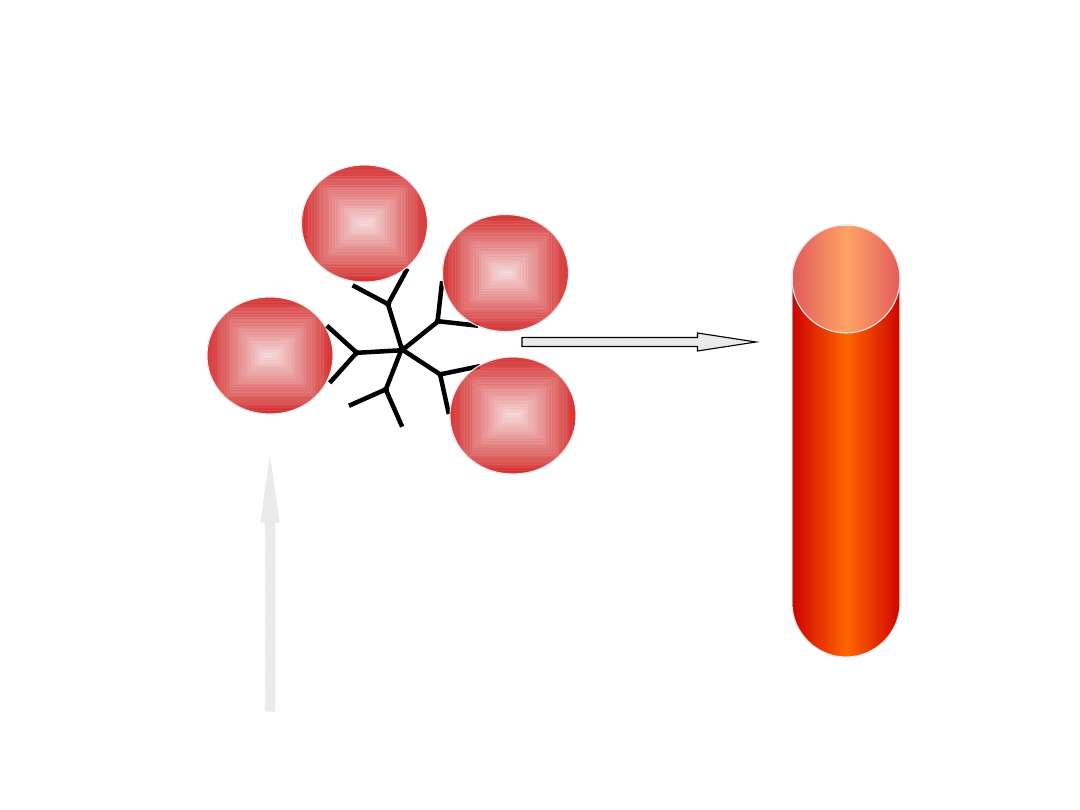
Mechanizm niszczenia erytrocytów przez
autoprzeciwciała IgM
IgM -
kompletne
DOPEŁNIACZ
aktywacja
cytolitycznych
składowych
dopełniacza
RBC
hemoliza
wewnątrznaczynio
wa
RBC
RBC
RBC
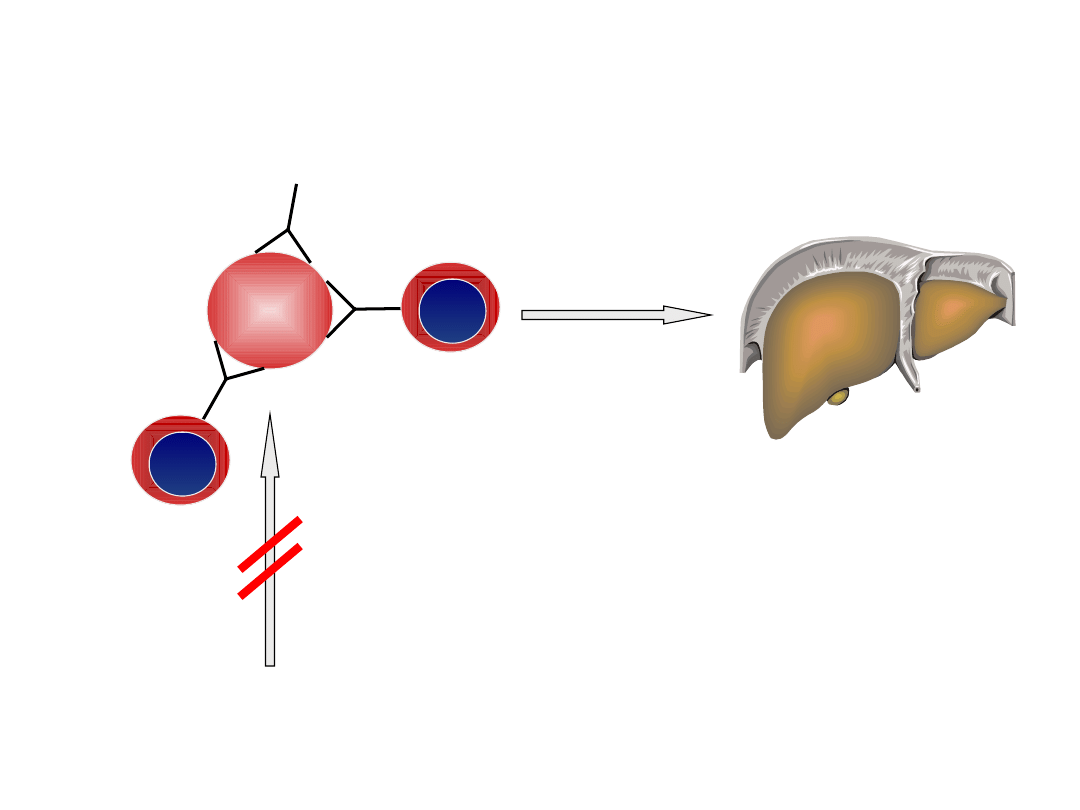
Mechanizm niszczenia erytrocytów przez
autoprzeciwciała IgG
IgG -
niekompletne
DOPEŁNIACZ
brak możliwości
aktywacji
dopełniacza
RBC
hemoliza w
układzie
siateczkowo-
śródbłonkowym
makrofa
g
makrofa
g

Polekowe niedokrwistości
hemolityczne - mechanizmy
Zainicjowanie reakcji immunologicznej
Działanie utleniające z powstaniem
methemoglobiny
Pogłębianie defektów metabolicznych
Denaturacja hemoglobiny

Polekowe niedokrwistości
autoimmunohemolityczne
•
Typ metyldopy – indukcja „odpowiedzi immunologicznej”
skierowanej przeciwko autologicznym erytrocytom
poprzez:
modyfikację białka błony erytrocyta
modyfikację białka surowicy
modyfikację odczynowości komórkowej
(ibuprofen, mefacit, cymetydyna, fenytoina, metotrexat)
•
Bezpośredni udział leku w reakcji antygen-przeciwciało
lek + białko błony erytrocyta = antygen (penicylina,
ampicylina, cefalosporyny, cisplatyna)
lek + białko surowicy = kompleks immunologiczny =
antygen
(chinina, pyralgin, fenacetyna, ryfampicyna, triamteren)

Niedokrwistość hemolityczna mikro-
(makro)angiopatyczna
Przyczyny:
nowotwory złośliwe – gruczolakorak żoładka,
j. grubego, jajnika , sutka, trzustki, płuca, prostaty, jądra,
chłoniaki nieziarnicze
z. hemolityczno-mocznicowy
nadciśnienie tętnicze faza złośliwa
naczyniaki mnogie lub olbrzymie
kolagenozy
toksyny bakteryjne
reakcja odrzucania przeszczepu
angiopatia cukrzycowa
patologia ciąży
protezy zastawek i naczyń
postać samoistna

Niedokrwistość hemolityczna mikro-
(makro)angiopatyczna
Patogeneza:
wewnątrznaczyniowa destrukcja erytrocytów
w mechanizmie:
mechanicznym – zwiększone opory krążenia
erytrocytów przez mikrokrążenie
chemicznym – wydzielanie substancji
tromboplastycznych, agregacji płytek,
aktywacji krzepnięcia, hamowanie fibrynolizy,
wytrącanie fibryny, aktywacja dopełniacza
Klinika:
przebieg ostry (z. h.m.) lub przewlekły
objawy choroby podstawowej,
niedokrwistość, żółtaczka, skaza krwotoczna
patologiczne formy erytrocytów we krwi,
małopłytowość, leukocytoza, BTA(-), PTA (-)

Nocna napadowa hemoglobinuria:
Zespół mieloproliferacyjny defekt komórki macierzystej
somatyczna mutacja genu PIG-A na chr. X niedobór glikozylo-
fosfatydyloinozytolu (GPI) nadmierna wrażliwość krwinek
czerwonych, płytkowych, granulocytów na cytolityczne działanie
dopełniacza ujawniające się w kwaśnym ph krwi w nocy
Początek w 30-40rż, epizody głębokiej anemizacji z oddawaniem
ciemnego moczu, bólami brzucha, głowy ok. lędźwiowej trwające dni
lub tygodnie, skłonność do zakrzepicy w naczyniach m.in. nerek,
wątroby
pancytopenia, hipo- lub aplastyczny szpik, hemoglobinuria,
stężenia żelaza, retikulocytozy, obecność fragmentocytów,
akantocytów, sferocytów w rozmazie krwi obwodowej
Rozpoznanie:
wywiad
test Hama
ocena ekspresji CD59 (MIRL, błonowy inhibitor lizy)na
erytrocytach, granulocytach, płytkach krwi
ocena ekspresji CD55 (DAF, czynnik przyspieszonego rozpadu) na
erytrocytach, granulocytach, płytkach krwi
Leczenie: objawowe, sterydy, transplantacja szpiku

Niedokrwistość hemolityczną należy
podejrzewać:
W każdym przypadku współistnienia niedokrwistości i
żółtaczki
W każdej niedokrwistości o innych podłożu, możliwy jest
komponent hemolityczny
W przypadku następującej konstelacji badań dodatkowych
bez jednoczesnych objawów krwotoku:
bilirubiny (pośredniej)
retikulocytozy
obecność fragmentocytów, akantocytów, sferocytów
w rozmazie krwi obwodowej
Mimo braku objawów klinicznych niedokrwistości
występuje:
nadmierna wrażliwość obwodowych części ciała na zimno
ostre bóle brzucha bez uchwytnej przyczyny
okresowe oddawanie ciemnego moczu
kamica żółciowa w młodym wieku
splenomegalia
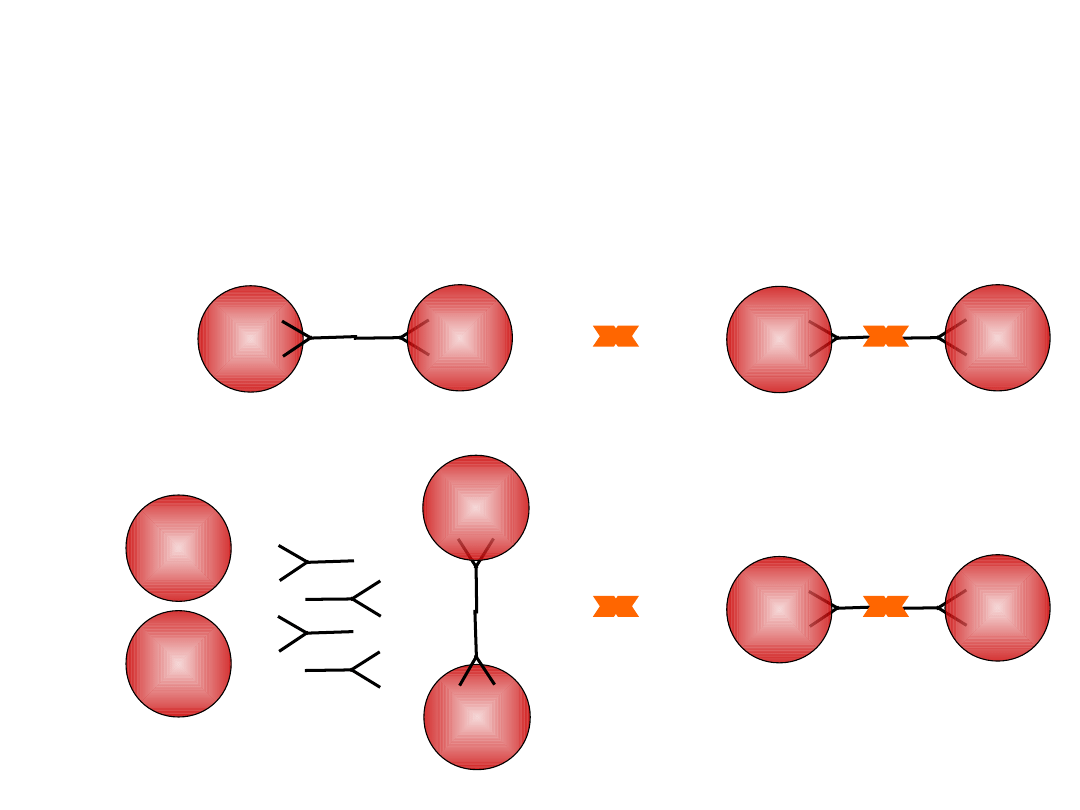
Diagnostyka niedokrwistości
hemolitycznej
Wywiad
Badanie fizykalne
Badanie morfologiczne krwi
Badanie biochemiczne
Badania serologiczne: BTA, PTA, test Hama, test Donatha-
Landsteinera
RBC
anty-
gamma-
globuliny
+
=
BTA
RBC
RBC
RBC
aglutynacja
RBC
anty-
gamma-
globuliny
+
=
PTA
RBC
RBC
RBC
aglutynacja
erytrocyty
testowe
+
surowica
badana
R
B
C
R
B
C
=

Diagnostyka niedokrwistości
hemolitycznej
Oporność osmotyczna erytrocytów (n = 4,5 – 3,0g/l
NaCl)
Zmniejszenie oporności osmotycznej:
nabyte niedokrwistości hemolityczne,
sferocytoza wrodzona
Zwiększenie oporności osmotycznej:
niedokrwistość sideropeniczna
po splenektomii
talasemie
niedokrwistość sierpowatokrwinkowa
Czas przeżycia krwinek czerwonych (n
51
Cr 28dni)
Wskazania:
potwierdzenie rozpoznania w przypadkach niejasnych
różnicowanie przyczyn wewnątrz- i zewnątrzkrwinkowych
(krzyżowe przetaczanie
51
Cr erytrocytów)
ocena wskaźnika śledzionowo-wątrobowego – kwalifikacja do
splenektomii (n=1,3:1)

W przypadku podejrzenia niedokrwistości
hemolitycznej
Dowody rozpadu krwinek czerwonych:
Badanie rozmazu krwi
Oznaczanie steżenia bilirubiny w surowicy
Oznaczanie wydalania urobilinogenu z moczem
Oznaczanie haptoglobiny w osoczu
Dowody odnowy w układzie krwinek czerwonych:
Oznaczanie liczby retikulocytów
Badanie rozmazu krwi
Badanie rentgenowskie układu kostnego
Diagnostyka niedokrwistości
hemolitycznej

Stwierdzenie niedokrwistości hemolitycznej typu
krwinkowego
Rozmaz krwi
Test oporności osmotycznej
Test autohemolizy
Hemoglobina
Test na sierpowatość
Elektroforeza hemoglobiny
Oznaczanie hemoglobiny F
Test termostabilności
Test Hama
CD59, CD55
Zaburzenia enzymatyczne
Udokumentowanie obecności ciałek Heinza
Testy enzymatyczne
Diagnostyka niedokrwistości
hemolitycznej

Stwierdzenie pozakrwinkowego typu
niedokrwistości hemolitycznej
Odczyn Coombsa
Test na obecność kwaśnych hemolizyn
Test sacharozowy
Test na obecność przeciwciał typu Donatha-
Landsteinera
Test na obecność przeciwciał przeciwjądrowych (ANA)
Diagnostyka niedokrwistości
hemolitycznej

Leczenie niedokrwistości
hemolitycznej
•
Przyczynowe: leczenie choroby
podstawowej,
eliminacja leku lub innej
substancji
unikanie oziębienia ciała
•
Objawowe:
glikokortokosteriody
(prednizon 1mg/kgmc.)
puls sterydowy: 0,5-1,0g
metylprednisolonu/dz.
cyklofosfamid 1-1,5 mg/kg.mc.
azatiopryna 2mg/kgmc.
plazmafereza
transfuzja (wymienna) ME
unikanie transfuzji w AIHA
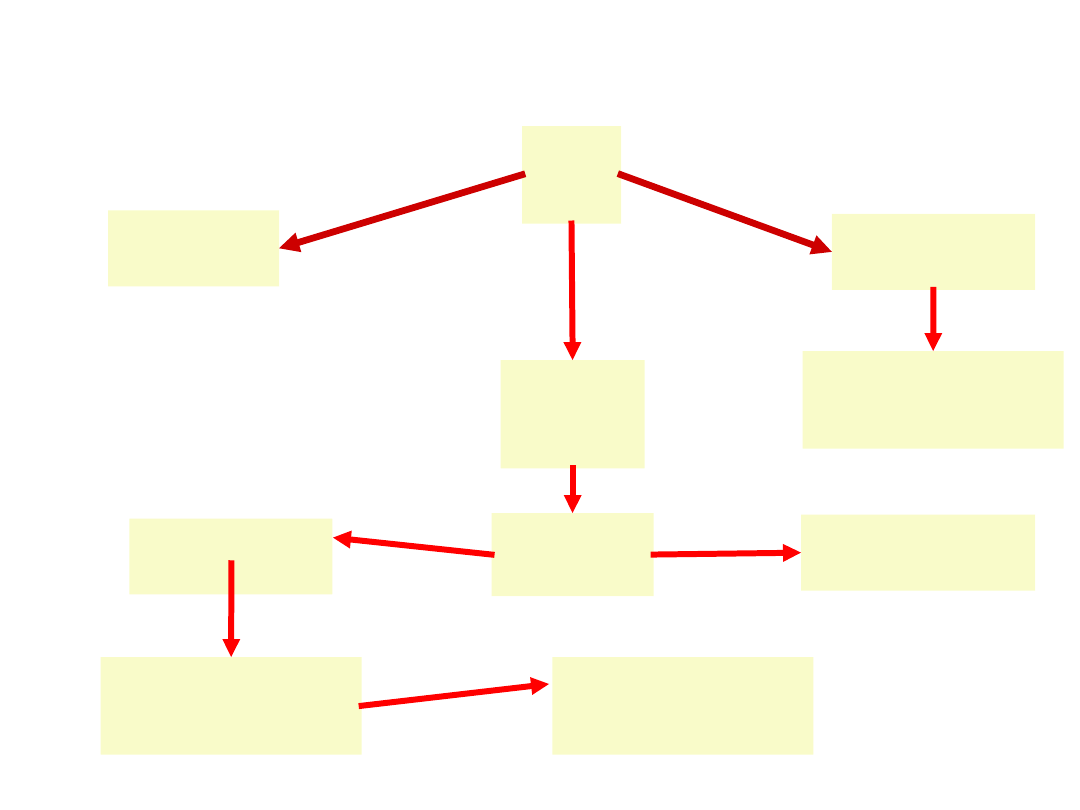
Algorytm leczenia AIHA
AIH
A
splenektomi
a
Prednis
on
1mg/kg
odpowi
edź
redukcja
dawki
Puls
sterydowy
obserwac
ja
ciężka
łagodna
2-3
tyg.
TAK
NIE
Puls
sterydowy
splenektomi
a
chemioterapi
a
brak
odpowiedz
i
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
Wyszukiwarka
Podobne podstrony:
Niedokrwistości hemolityczne, Analityka medyczna, Hematologia
NIEDOKRWISTO¦Ć HEMOLITYCZNA
Niedokrwistości hemolityczne, MEDYCYNA i RATOWNICTWO, Pediatria
Niedokrwistości hemolityczne 3
Niedokrwistości hemolityczne
Niedokrwistości hemolityczne
Wykład 5 Niedokrwistości hemolityczne
(32) Leki stosowane w niedokrwistościach niedobrowolnych i hemolitycznych
Choroba niedokrwienna serca
(33) Leki stosowane w niedokrwistościach megaloblastycznych oraz aplastycznych
Choroba hemolityczna p odu na kurs
więcej podobnych podstron