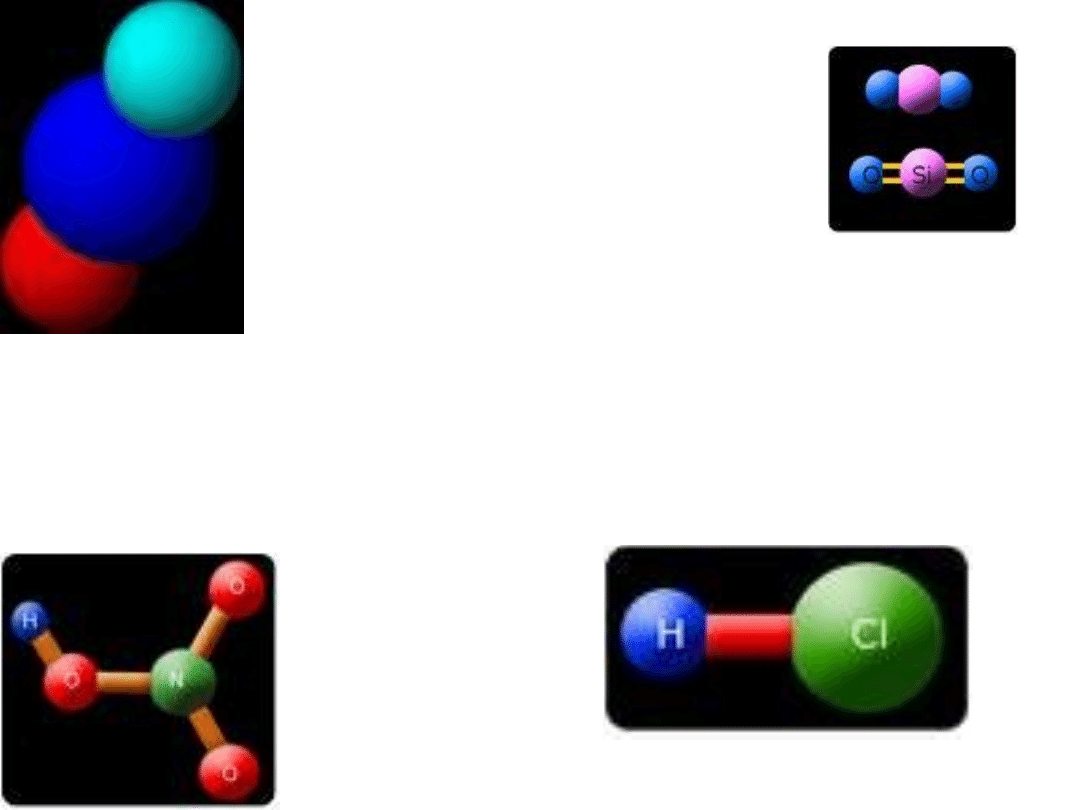
Związki
nieorganiczne
Tlenki
Wodorotlenki/Zasady
Kwasy beztlenowe i tlenowe
Sole

Tlenki
Tlenki to połączenia różnych pierwiastków z
tlenem.
X
2
O, XO, X
2
O
3
, XO
2
, X
2
O
5
, XO
3
, X
2
O
7
N
2
O, NO, Al
2
O
3
, N
2
O, CO
2
, P
2
O
5
, SO
3
, Cr
2
O
7
,
Znane są tlenki wszystkich pierwiastków (z wyjątkiem niektórych
metali szlachetnych).
Własności fizyczne i chemiczne tlenków zależą od
elektroujemności pierwiastków połączonych z tlenem.
Rozróżnia się tlenki:
•zasadowe,
•kwasowe,
•amfoteryczne
•obojętne.

Tlenki zasadowe
to tlenki metali litowców i berylowców
(z wyjątkiem berylu). Są trudno topliwymi ciałami stałymi,
z kwasami tworzą sole, z wodą wodorotlenki (Na
2
O).
Tlenki kwasowe
to tlenki niemetali oraz metali w
wyższych stopniach utlenienia. Występują we wszystkich
stanach skupienia. Z zasadami tworzą sole. Niektóre
(bezwodniki kwasowe) z wodą tworzą kwasy(P
2
O
5
).
Tlenki amfoteryczne
to tlenki metali o średniej
elektroujemności. Reagują zarówno z kwasami tworząc
sole jak i z zasadami tworząc tlenki i wodorotlenki
podwójne (ZnO).
Tlenki obojętne
nie reagują ani z zasadami, ani z
kwasami, np. CO, N
2
O. Mają duże znaczenie w wielu
procesach przemysłowych.

Metody otrzymywania tlenków
1. bezpośrednia reakcja z tlenem
C + O
2
---> CO
2
2 Mg + O
2
---> 2 MgO
2. utlenianie tlenków
2 SO
2
+ O
2
---> 2 SO
3
2 Cu
2
O + O
2
---> 4 CuO
3. redukcja tlenków
MnO
2
+ H
2
---> MnO + H
2
O
CO
2
+ C ---> 2 CO
4. termiczny rozkład soli lub wodorotlenków
CaCO
3
---> CaO + CO
2
Cu(OH)
2
---> CuO + H
2
O
5. inne metody np. spalanie metanu
CH
4
+ 2 O
2
---> CO
2
+ 2 H
2
O

W kosmetyce największe zastosowanie mają
tlenek cynku ZnO i tlenek tytanu(IV)
TiO
2
A także:
•tlenek glinu Al
2
O
3
•tlenek wodoru (woda) - mineralna,
destylowana lub przegotowana.
•tlenek(I) wodoru (H
2
O
2
)

Tlenek cynku
Tlenek
cynku
(ZnO)
wyparowuje
w
temperaturze 1300°C, roztapia się tylko
pod
zwiększonym
ciśnieniem
w
temperaturze 1975°C. Jest substancją
bardzo stabilną - nietoksyczny
Tlenek cynku absorbuje promieniowanie
ultrafioletowe. Nie rozpuszcza się w
wodzie. Jest odporny na światło, ale nie ma
tak kryjacych właściwości jak tlenek
tytanu(IV).
Tlenek cynku ma niewielkie właściwości
bakteriobójcze. Działa łagodząco i gojąco
na skórę, ale także lekko wysuszająco.
Często jest używany w maściach i pastach
przyspieszających gojenie się skóry (pasta
cynkowa).

Tlenek tytanu(IV)
Tlenek tytanu (TiO2) zwany również bielą
tytanową jest najpopularniejszym i najlepiej
kryjacym białym pigmentem. Stosuje się go w
pudrach, fluidach, kremach, w mydłach, a także
w paście do zębów.
W
kosmetykach
oprócz
ochrony
przeciwsłonecznej ma działanie kryjące i
rozjaśniające.
Jest bardzo stabilny, topnieje dopiero w
temperaturze 1855°C, nie ulega zmianom pod
wpływem światła, trudno reaguje z innymi
substancjami.
Nie jest toksyczny, w przemyśle spożywczym
występuje pod symbolem E171.
Ze względu na swoje cechy rozjaśniające i
kryjące jest również używany w farbach
malarskich. Swoją najbielszą biel zawdzięcza
właściwości
polegającej
na
całkowitym
rozproszeniu światła.
.

Tlenek cynku i tlenek tytanu(IV)
są naturalnymi,
mineralnymi filtrami przeciwsłonecznymi. Mikroskopijne
ziarenka pigmentu pozostają na skórze i pochłaniają,
reflektują lub rozszczepiają światło słoneczne. Nie
dopuszczając go tym samym do skóry. Tlenek tytanu(IV) i
tlenek cynku chronią skórę zarówno przed promieniami UVA
jak i UVB.
Promieniowanie ultrafioletowe dzieli się na trzy rodzaje:
UVC - 200-280 nm - Ten rodzaj promieniowania jest prawie
całkowicie pochłaniany przez warstwę ozonową atmosfery, otaczającą kulę
ziemską, tak więc promienie UVC nie występują w świetle słonecznym
docierającym do powierzchni Ziemi. Promieniowanie UVC wykorzystuje się
na przykład w warunkach laboratoryjnych do sterylizacji czyli odkażania i
zabijania chorobotwórczych mikroorganizmów, jak np. bakterii.
UVB - 280-320 nm - Stanowi ono 5 % całego promieniowania
ultrafioletowego docierającego do powierzchni Ziemi. To ono jest
odpowiedzialne za pojawianie się rumienia i oparzeń słonecznych, a także
powoduje pigmentację, czyli efekt opalonej skóry.
UVA - 320-400 nm - Dodatkowo zakres UVA został podzielony na
dwie podgrupy:
- UVA - I, czyli fale długie 340-400 nm
- UVA-II, czyli fale krótkie 320-340 nm
Promieniowanie UVA stanowi 95 % całego promieniowania
ultrafioletowego docierającego do powierzchni Ziemi. Nie powoduje
powstawania rumienia i poparzeń, natomiast powoduje pigmentację skóry,
czyli opaleniznę oraz, jak się okazało w ostatnim czasie, to ono jest głównie
odpowiedzialne za tzw. fotostarzenie się oraz zmiany nowotworowe skóry.

Tlenek tytanu(IV) i tlenek cynku mają postać
drobnego, białego proszku. Użyte w kremie mogą
zostawiać białe smugi na skórze. Aby zmniejszyć
ten efekt mieli się, przede wszystkim, tlenek tytanu
na bardzo miałki pył. Wówczas tytan nie "maluje"
skóry, jednak ochrona skóry, głównie przed
promieniami UVA, zmniejsza się. Dlatego najlepszą
ochroną jest dodanie do kremu mieszanki obydwu
pigmentów. Oba pigmenty nie działają
komedogennie (nie zatykają porów w skórze).

Wodorotlenkami
nazywa się wszystkie związki nieorganiczne, w
których wzorze wyróżnia się symbol metalu oraz
jednowartościowe grupy - OH (grupy
wodorotlenowe)
Liczba grup OH we wzorze wodorotlenku zależy od
wartościowości metalu.
Jeżeli metal tworzy dwa różne wodorotlenki, to ich
nazwa tworzy się tak, jak nazwy tlenków:
Fe(OH)
2
- wodorotlenek żelaza (II)
Fe(OH)
3
- wodorotlenek żelaza (III).
Gdy metal tworzy jeden wodorotlenek, wówczas
wskaźnik wartościowości w nazwie pomija się:
Ba(OH)
2
- wodorotlenek baru.

Wodorotlenki dzielą się na:
* wodorotlenki zasadowe
- czyli reagujące z
kwasami a nie reagujące z zasadami;
*wodorotlenki amfoteryczne
- czyli reagujące z
kwasami i z zasadami.
Charakter kwasowo-zasadowy wodorotlenków jest zależny od
charakteru i mocy wiązania M-O (metal-tlen). Jeżeli wiązanie
to jest silne i jonowe, wodorotlenek ma charakter zasadowy i
w pełni dysocjuje na jony OH
-
.
Jeżeli wiązanie ma charakter kowalencyjny wodorotlenek
może mieć właściwości amfoteryczne z przewagą zasadowych
(Zn(OH)
2
), a nawet kwasowych (Ti(OH)
4
).

Wodorotlenki
są substancjami bezbarwnymi,
krystalicznymi. Wodorotlenki litowców są silnie
higroskopijne, chłoną parę wodną z powietrza i w
utworzonej tak wodzie rozpuszczają się.
Wodorotlenki berylowców są trudniej rozpuszczalne,
przy czym ich rozpuszczalność wzrasta ze wzrostem
liczby atomowej berylowca.
Rozpuszczanie się wodorotlenków polega na
rozpadzie sieci krystalicznej, powstają przy tym
uwodnione jony metalu i aniony wodorotlenkowe.

Wodorotlenki, których wodne roztwory mają
odczyn zasadowy, nazywa się wodorotlenkami
zasadowymi lub zasadami.
Do zasad zalicza się nie tylko wodorotlenki
zasadowe [Mg(OH)
2
] lecz także amoniak i aminy (-
NH
2
, =NH, =N-), a więc wszystkie związki, które
zwiększają stężenie jonów wodorotlenkowych w
wodzie.
Istnieje znaczna liczba wodorotlenków, głównie
metali leżących w środkowych grupach układu
okresowego, które nie mają budowy krystalicznej,
tworzą trudno rozpuszczalne żele i nie wykazują
odczynu zasadowego. Wodorotlenki te zalicza się do
wodorotlenków amfoterycznych (Pb(OH)
2,
Zn(OH)
2)
). Wodorotlenki zasadowe i amfoteryczne
łączy wspólna cecha: zdolność do reagowania z
kwasami.

Wodorotlenki mają duże zastosowanie w
kosmetyce:
wodorotlenek sodu NaOH (do produkcji sodowych
mydeł twardych i innych syntetycznych środków
piorących)
wodorotlenek potasu KOH (do produkcji mydła - mydła
potasowe są maziste - past i niektórych kremów do
golenia)
Amoniak NH
3
- (NH
4
OH woda amoniakalna) służy do
wyrobu kremów, mleczek kosmetycznych, do
zobojętniania kwasów przy regulowaniu odczynu płynów
kosmetycznych. Rozcieńczona wykorzystywana jest w
płynach do ondulacji i przeciw łupieżowych, przy
utlenianiu i farbowaniu włosów, w wielu innych płynach
kosmetycznych.
wodorotlenek magnezu Mg(OH)
2
wodorotlenek cynku Zn(OH)
2
(związki cynku mogą
wywołać zatrucia dlatego wykorzystuje się go w
kosmetykach do użytku zewnętrznego)
wodorotlenek glinu Al(OH)
3

Wodorotlenek magnezu
w temperaturze pokojowej
jest substancją stałą, drobnokrystaliczną o białej
barwie, bardzo słabo rozpuszczalną w wodzie - w
100g wody rozpuszcza się 2x10
-3
g Mg(OH)
2
.
Nie jest żrący, daje odczyn alkaliczny.
Jest emulgatorem o symbolu E 528.
Wchodzi w skład kamienia osadzającego się w
kotłach, pralkach itp. (wpływa na twardość wody).

Wodorotlenek magnezu
jako mocna zasada
zwiększa wartość pH soku żołądkowego do wartości
powyżej 5, dlatego najczęściej jest stosowany w
preparatach leczniczych złożonych łącznie z
wodorotlenkiem glinu, który działa słabo
zobojętniająco, ale bardziej długotrwale. Uzyskuje
się w ten sposób korzystniejsze właściwości
zobojętniające i koryguje niepożądane działanie
zapierające powstających w jelitach soli glinu (sole
magnezu działają przeczyszczająco).
Otrzymywanie
W reakcji tlenku magnezu z
wodą:
MgO + H
2
O
Mg(OH)
2
Działając płonącym magnezem na wodę:
Mg + 2H
2
O
Mg(OH)
2
+ H
2
W reakcji:
MgCl
2
+ 2NaOH Mg(OH)
2
+ 2NaCl

Zastosowanie
preparaty kosmetyczne (wymagające
środowiska zasadowego), np. pasty do zębów,
a także do wyrobu kremów do pielęgnacji
stóp, zasypek i pudrów higienicznych
w medycynie, jako tzw. mleko magnezjowe
(zawiesina wodorotlenku magnezu w wodzie)
w przemyśle, w procesie rafinacji cukru
w niewielkich ilościach stosuje się go w
wyrobach kakaowych i czekoladowych (jako E
528)

Wodorotlenek glinu
otrzymuje się jako biały,
krystaliczny osad w wyniku wprowadzenia
ditlenku węgla do roztworu glinianu:
2[Al(OH)
4
]
-
+ CO
2
2Al(OH)
3
+ CO
3
2-
+
H
2
O
Jest on stosowany w produkcji papieru, mydła,
kosmetyków (zasypki, pudry, kremy, barwne
pigmenty), w lecznictwie (substancja ścierająca i
polerująca przy produkcji proszków i past do
zębów).
KWASY NIEORGANICZNE
- to kwasy będące
pochodnymi minerałów. Należą do nich m.in.
kwas solny produkowany z chlorku sodu i kwas
siarkowy powstający ze związków siarki.
W zależności od stopnia dysocjacji wyróżniamy
kwasy
mocne
średniej
mocy
słabe
Moc kwasu zależy od stężenia jonów H
+
w
roztworze kwasu.
rośnie wraz ze wzrostem elektroujemności
centralnego atomu reszty kwasowej (H
4
SiO
4
<
H
3
PO
4
< HClO
4
)
rośnie wraz ze wzrostem liczby atomów tlenu
(HClO < HClO
2
< HClO
3
< HClO
4
)

Kwasy zbudowane są z wodoru i reszty kwasowej.
Wzór ogólny kwasów przedstawia się następująco
H
n
R
gdzie:
R - reszta kwasowa (fragment cząsteczki, który po
dysocjacji jonowej jest anionem) pochodząca od
kwasu tlenowego (HNO
3
) lub beztlenowego (HCl).

Otrzymywanie kwasów
1. Kwasy tlenowe otrzymuje się w reakcji bezwodnika z
wodą
N
2
O
5
+ H
2
O ---> 2 HNO
3
2. Kwasy, których bezwodniki nie reagują z wodą
otrzymuje się w reakcji jego rozpuszczalnej soli z
mocnym kwasem
Na
2
SiO
3
+ 2HCl ---> H
2
SiO
3
+ 2 NaCl
3. Kwasy beztlenowe, które nie posiadają bezwodników,
otrzymuje się przez rozpuszczenie w wodzie
odpowiedniego wodorku.
HCl otrzymywany jest przez absorbcję chlorowodoru w
wodzie. Chlorowodór do produkcji kwasu solnego
wytwarza się syntetycznie z chloru i wodoru H
2
+ Cl
2
2HCl (temp. procesu około 700-900
o
C).
Właściwości chemiczne kwasów
1. Kwasy reagują z zasadami (reakcja zobojętnienia).
Na skutek łączenia się kationów wodorowych z anionami
wodorotlenowymi powstaje cząsteczka wody
H
+
+ OH
-
---> H
2
O
której towarzyszy sól, będąca w roztworze w postaci zdysocjowanej,
albo wytrąca się w postaci osadu
2 NaOH + H
2
SO
4
---> Na
2
SO
4
+ 2 H
2
O
Ba(OH)
2
+ H
2
SO
4
---> BaSO
4
+ H
2
O
2. Większość kwasów reaguje z wieloma metalami
Zn + 2 HCl ---> ZnCl
2
+ H
2
Metale szlachetne nie reagują z kwasami beztlenowymi, a z
niektórymi kwasami tlenowymi działają, ale nie poprzez wypieranie
wodoru z kwasu.

3. Reagują z tlenkami zasadowymi i amfoterycznymi (ale
nie ze wszystkimi). Produktami reakcji są woda i sól
CuO + H
2
SO
4
---> CuSO
4
+ H
2
O
MnO
2
+ 4 HCl ---> MnCl
2
+ Cl
2
+ H
2
O
MnO
2
+ HNO
3
---> reakcja nie zachodzi
4. Reaguje z niektórymi solami organicznymi i
nieorganicznymi
H
2
SO
4
+ 2 NaCH
3
COO ---> Na
2
SO
4
+ 2 CH
3
COOH
H
2
SO
4
+ 2 NaCl ---> Na
2
SO
4
+ 2 HCl

Zastosowanie w kosmetyce
Kwas siarkowy(VI) -
do produkcji surowców i półproduktów
dla przemysłu kosmetycznego: siarczanu glinowo-potasowego
(ałun), nadtlenku wodoru, estrów i substancji zapachowych,
barwników organicznych.
Kwas azotowy(V)
- do produkcji surowców i półproduktów dla
przemysłu kosmetycznego: azotan srebra (lapis), estry
zapachowe (ambry i piżma).
Siarkowodór (H
2
S)
- w kąpielach leczniczych, do produkcji
niektórych depilatorów.
Kwas węglowy
- w zabiegach balneologicznych (kąpiele
kwasowęglowe).
Kwas borowy (H
3
BO
3
)
- jako substancja zakwaszająca,
dezynfekująca i konserwująca np.: w kremach borowo-
glicerynowych i płynach dezynfekcyjnych.
Kwas krzemowy (xH
2
O . ySiO
2
)
- żel krzemionkowy stosuje
się do wyrobu zasypek o zdolnościach chłonnych i
osuszających, do wyrobu wonnych soli i stałych perfum. Ze
względu na gęstą i kleistą konsystencję używa się do wyrobu
kremów mineralnych, a w postaci koloidalnej zawiesiny w
preparatach oczyszczających skórę (cera trądzikowa).

Sole
Sole są związkami chemicznymi o wzorze
ogólnym M
n
R
m
, gdzie: M - metal, R -
reszta kwasowa
Rozpuszczalne w wodzie sole dysocjują, a
roztwory mają odczyn obojętny, kwaśny lub
zasadowy w zależności od rodzaju soli.

Metody otrzymywania soli
1. zasada + kwas ---> sól + woda
NaOH + HCl ---> NaCl + H
2
O
(Zasadą jest związek, który w wodzie zwiększa stężenie
jonów wodorotlenowych. Do zasad zalicza się wodorotlenki
zasadowe, amoniak i aminy).
2. tlenek zasadowy + kwas ---> sól + woda
CaO + 2 HCl ---> CaCl
2
+ H
2
O
3. tlenek kwasowy + zasada ---> sól + woda
SiO
2
+ 2 NaOH ---> Na
2
SiO
3
+ H
2
O

4. tlenek zasadowy + tlenek kwasowy ---> sól
CaO + CO
2
---> CaCO
3
5. metal "nieszlachetny" + kwas ---> sól + wodór
Zn + H
2
SO
4
---> ZnSO
4
+ H
2
6. metal + niemetal ---> sól
Hg + S ---> HgS

Charakterystyka soli
Sole obojętne powstają w wyniku zastąpienia wszystkich wodorów
kwasowych atomami metalu.
Sól obojętna nie oznacza odczynu roztworu soli
3 NaOH + H
3
PO
4
---> Na
3
PO
4
+ 3 H
2
O
Fosforan (V) sodu jest solą obojętną, ale jej roztwór wodny wykazuje
odczyn zasadowy.
Wodorosole powstają z kwasów przez niecałkowite zastąpienie
wodorów kwasowych w cząsteczkach kwasów wieloprotonowych.
np. H
3
PO
4
może tworzyć dwa rodzaje wodorosoli:
H
3
PO
4
+ NaOH ---> NaH
2
PO
4
+ H
2
O
H
3
PO
4
+ 2 NaOH ---> Na
2
HPO
4
+ 2 H
2
O

Hydroksosole są produktami podstawienia niecałkowitego grup
-OH w cząsteczce wodorotlenku wielowodorotlenowego przez
reszty kwasowe
Mg(OH)
2
+ HCl ---> Mg(OH)Cl + H
2
O
Kwasy jednoprotonowe i zasady jednowodorotlenowe nie tworzą
wodorosoli ani hydrosoli.
Wiele soli tworzy hydraty, tzw. sole uwodnione, posiadające w
sieci krystalicznej cząsteczki wody hydratacyjnej. W hydratach
liczba moli wody przypadającej na jeden mol związku jest sciśle
określona np. CuSO
4
* 5 H
2
O, (CaSO
4
)
2
* H
2
O.

Zastosowanie w kosmetyce
Węglan sodu krystaliczny (Na
2
CO
3
. 10H
2
O) - do
zmiękczania wody, do produkcji mydeł, środków
pieniących, kremów i mleczek kosmetycznych.
Wodorowęglan sodu (NaHCO
3
) - do produkcji soli
kąpielowych, do kąpieli kwasowęglowych, jest
dobrym zmywaczem skóry.
Czteroboran sodu (Na
2
B
4
O
7
. 10H
2
O) - do
zmiękczania wody w zabiegach kosmetycznych,
jego roztwory służą do do odkażania i zmiękczania
skóry, roztwory o większym stężeniu służą do
usuwania piegów, do wyrobu kremów.
Węglan wapnia (CaCO
3
) - dzięki właściwościom
chłonnym i wysokiej bieli wykorzystywany jest do
wyrobu zasypek i pudrów, jest składnikiem past i
proszków do zębów.

Dwuwodny siarczan(VI)wapnia (CaSO
4
. 2 H
2
O) - do
utwardzania niektórych wyrobów stałych np. szminek i
pudrów w kamieniu.
Siarczek wapnia (CaS) - ma właściwości depilujące.
Zagęszczony substancjami kleistymi i perfumowany
wykorzystywany jest jako depilator.
Azotan srebra (AgNO
3
) - na świetle rozkłada się z
wydzieleniem atomowego tlenu, który wykazuje
działanie dezynfekcyjne, co wykorzystuje się w
powierzchniowych zabiegach kosmetycznych
(przypalanie brodawek).
Ortofosforan sodu (Na
3
PO
4
) - do regulowania
wartości pH wyrobów, zmiękczania wody, składnik
past do zębów.

Mikroelementy
- pierwiastki śladowe - niezbędne
dla prawidłowego wzrostu, rozwoju i funkcjonowania
organizmu. Zarówno ich nadmiar jak i niedobór
wpływa niekorzystnie na organizm. Są składnikami
układów enzymatycznych.
Do najważniejszych dla organizmu człowieka
mikroelememntów należą:
Cu, Mn, Mo, Zn, Co, J i F
Mikroelementy do celów kosmetycznych pozyskuje się
z soli morskiej, planktonu, mułu z dna Morza
Martwego oraz roślin: pokrzywy, skrzypu, rdestu, a
zwłaszcza
z
alg
(morszczynu),
w
których
mikroelementy występują w bardzo dużych ilościach
w postaci kompleksów metaloorganicznych i z
polisacharydami, dzięki czemu są łatwo przyswajalne.

Miedź
W ustroju dorosłego człowieka ilość miedzi nie przekracza
150mg, z czego 65 mg znajduje się w mięśniach, 25 mg w kościach,
a 20 mg w wątrobie. Dieta mleczna prowadzi do niedokrwistości nie
tylko z powodu małej ilości żelaza, ale również z powodu niedostatku
miedzi. Niedobory miedzi u ludzi zdarzają się rzadko, głównie u
chorych na nerczycę.
Źródła:
Cielęcina, orzechy, warzywa strączkowe, zboża, drób, wątroba,
małże, ryby, kasza gryczana, żółtka jaj.
skutki niedoboru:
Niedokrwistość
W kosmetykach stosowana jako środek przeciwgrzybiczny i
metalizujący pigment. Wpływa korzystnie na syntezę elastyny i
kolagenu (skóra).

Jod
Zawartość jodu w ustroju człowieka jest bardzo mała
i wynosi 20-50 mg. Występuje on w postaci jodków,
głównie w połączeniach organicznych. W tarczycy znajduje
się 8-10 mg, co stanowi około 40% całego jodu ustroju. Jod
występuje również w innych gruczołach dokrewnych,
mięśniach i skórze. Głównym źródłem jodu jest woda pitna
oraz sól kamienna. Jod może być wchłaniany nie tylko
przez przewód pokarmowy, ale również przez drogi
oddechowe oraz skórę. Przyjmuje się, że dawka 120-150
mg na dobę całkowicie wystarcza do pokrycia
zapotrzebowania człowieka. Niedobory jodu ujawniają się
ciężkimi chorobami, a nawet śmiercią. Niedobór jodu w
żywieniu kobiet w ciąży może prowadzić do uszkodzenia
płodu, a szczególnie wpłynąć na późniejszy niedorozwój
umysłowy dzieci.
Źródła:
Sól jodowana, ryby morskie, owoce morza, drożdże,
morszczyn, cebula.
Skutki niedoboru:
niedoczynność tarczycy
Stosowany w jontoforezie likwiduje blizny, zrosty, i zwalcza
cellulitis.

Fluor
Występuje w nieznacznych ilościach w różnych
produktach, ale głównym jego źródłem jest woda
pitna. Dobrym źródłem jest również herbata.
Wiadomo, że brak fluoru w pokarmie powoduje
zahamowanie wzrostu lub tempo wzrastania jest
znacznie wolniejsze, pogarsza się również stan
uzębienia.
Źródła:
Ryby morskie i produkty pochodzenia morskiego, czarna
herbata, orzechy włoskie, wątroba, soja, mleko, rośliny
strączkowe, woda mineralna.
Skutki niedoboru:
pękanie szkliwa zębów
Wykorzystywany w pastach do zębów.

Cynk
Cynk jest niezbędnym składnikiem dla roślin, zwierząt i
człowieka. Objawy niedoboru cynku to: utrata apetytu i
upośledzenie wzroku. Zmiany te są bardzo trwałe i trudne do
leczenia. Znana jest również rola cynku w gojeniu ran.
Zapotrzebowanie człowieka na cynk jest ściśle określone na
10-12 mg dziennie. Zawartość cynku w wodzie pitnej jest
niewielka.
Źródła:
Chude mięso, chude mleko, żółtko jaj, mąka pełnoziarnista, orzechy,
żywność pochodzenia morskiego.
Stosowany w kremach, przeciwdziała łojotokowi.

Mangan
Mangan jest pierwiastkiem niezbędnym w
zachowaniu prawidłowej struktury kości, procesach
rozrodu, prawidłowej czynności ośrodkowego układu
nerwowego. Wchodzi w skład niektórych enzymów.
Źródła:
Orzechy, herbata, mąka pełnoziarnista, zielone warzywa,
groszek, buraki, fasola, szpinak.
Skutki niedoboru:
zahamowanie wzrostu, niedokrwistość
W kosmetykach stosowany w postaci mlecznu, regeneruje
skórę.

Kobalt
Kobalt wchodzi w skład witaminy B12. Odgrywa
dużą rolę w aktywacji niektórych enzymów. Gospodarka
kobaltem nie jest jeszcze dobrze poznana.
Najwięcej kobaltu zawierają wątróbka, cynaderki i buraki.
W kosmetykach jako mleczan regeneruje skórę.
Molibden
Molibden stanowi integralną część grupy
prostetycznej niektórych enzymów flawoproteidowych, a w
szczególności oksydazy ksantynowej. W diecie występuje
w ilości 200-250 mg i jest to ilość optymalna dla ustroju
człowieka. Molibden dobrze wchłania się w przewodzie
pokarmowym.
Źródłem molibdenu są suche nasiona roślin strączkowych.
W kosmetykach jako mleczan goi uszkodzona tkankę skóry.

Chrom
Chrom jest pierwiastkiem niezbędnym do
prawidłowego metabolizmu glukozy. Prawdopodobnie
spełnia również rolę kofaktora insuliny. U człowieka
mogą występować stany niedoboru chromu i tylko dieta
wegetariańska zapewnia właściwy (wg obecnej wiedzy)
poziom pierwiastka dla ustroju człowieka.
Pokarmy pozwalające uzupełnić niedobory chromu to drożdże
piwne, brokuły, sok winogronowy, mięso indycze i owoce morza.
Selen
Selen jest pierwiastkiem, którego niezbędność
została ostatnio potwierdzona, choć jego rola w ustroju
ludzkim nie jest dostatecznie poznana.
Selen znajduje się w soli kamiennej, orzechach, kukurydzy i
zielonym groszku
.

Jodowana Sól do kąpieli
Wytworzona na bazie naturalnej, warzonej
próżniowo kłodawskiej soli kamiennej.
Wzbogacona relaksującymi i odświeżającymi
dodatkami:
Morska i Żeń-Szeń,
Leśna i Ginkgo Biloba,
Grejpfrut i Guarana.

Sel de Mer
Ekskluzywna sól do kąpieli, wytworzona z
naturalnej gruboziarnistej soli z
cechszyńskich pokładów. Zawiera
pierwiastki śladowe: miedź, mangan, żelazo,
kobalt, chrom. Naturalne bogactwo
wzbogacono odżywczymi składnikami:
Ekstrakt z lnu i rumianku
Ekstrakt sosnowy
Ekstrakt z brzoskwini i Retinol
(popularny w kosmetyce termin
oznacza - witaminę A - w czystej
postaci)
Ekstrakt Ginkgo (miłorzęb
japoński) i minerały morskie

Sól Bingo z mikroelementami
Wytworzona na bazie naturalnej soli zawiera
mangan, chrom, cynk, miedź, żelazo, kobalt.
Jest idealnym dodatkiem do kąpieli
wspomagającym wchłanianie oraz krążenie.
Trzy linie:
Greipfrut i Retinol
Świerk i Aloes
Jabłko i Kolagen

Substancje, których nie wolno (lub można ale z
ograniczeniami) stosować w preparatach
kosmetycznych.
Pierwiastki:
Hg, Cu, As, Pb, Cd
Związki chemiczne:
•rozpuszczalne sole baru - chlorek baru, azotan(V)
baru - silne trucizny
•związki cynku - tlenek cynku - tylko do użytku
zewnętrznego
•sole metali ciężkich - Pb, Hg, Cd, As, Cu, Sr, Co, Bi,
Ni, które występują w barwnikach kosmetycznych.
Kontroli podlega zawartość arsenu<10 ppm, ołowiu
<50 ppm, miedzi< 100 ppm.

Zabronione jest stosowanie w preparatach
kosmetycznych surowców zanieczyszczonych
związkami mutagennymi i rakotwórczymi; dotyczy
to preparatów naftowych.
Olej parafinowy, wazelina, oczyszczona nafta
mogą być używane gdy nie zawierają nawet
śladowych ilości związków rakotwórczych
(węglowodorów aromatycznych).
Ograniczona jest lista leków, które można
stosować w preparatach kosmetycznych.
Stosowanie środków miejscowo
znieczulających t.j. benzokainy, lidokainy jest
zabronione (do niedawna było dopuszczone).

Woda tylko destylowana lub
demineralizowana.
Dopuszczalne wartości pH;
kosmetyki nanoszone na skórę trwale (kremy,
toniki, mleczka itp.) - 3,0 - 8,5
kosmetyki nanoszone na skórę na krótki okres
czasu (mydła, szampony, płyny do kąpieli) - 2,0
- 10,5
kosmetyki do demakijażu - 3,0 - 8,0
preparaty do trwałej ondulacji - max 9,5
depilatory - max 12,5

Państwowy Zakład Higieny (PZH) decyduje czy
kosmetyk może zostać dopuszczony do obrotu
na terenia Polski. Dotyczy to kosmetyków
produkcji polskiej, jak i importowanych.
Ustawa o kosmetykach z dnia 30 marca 2001 r.
(Dz.U. Nr 42, poz. 473, z dnia 11 maja 2001
roku) dotyczy wymogów stawianych wytwórcom
i dystrybutorom wyrobów kosmetycznych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
Chemia kosmetyków wykład 2
chemia kosmetyków wykłady 6
Wyklad nr 3 chemia kosmetyczna
Przykładowe egzaminy, Studia - Chemia kosmetyczna UŁ, I rok, II semestr, MATEMATYKA wykłady
PRK Wyklad chemia kosmetyczna pracownia
BIO-HETEROCYKLE - PODSTAWY, Studia - Chemia kosmetyczna UŁ, III rok, VI semestr, BIOCHEMIA wykłady
chemia organiczna wykład 6
Chemia medyczna wykład 1
Chemia fizyczna wykład 11
GLAUKONIT I TALK, chemia kosmetyczna
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
Moc borowin, Studium kosmetyczne, Chemia kosmetyczna
Identyfikacja składników kosmetyków., Referaty, Chemia kosmetyczna
więcej podobnych podstron