Układ okresowy pierwiastków
Wiązania chemiczne
Reakcje oksydacyjno-redukcyjne
MASA MOLOWA (MASA ATOMOWA
)
LICZBA ATOMOWA

Właściwości fizyczne i chemiczne
pierwiastków wynikają z liczby elektronów
i sposobu ich rozmieszczenia na orbitach
atomowych (są określone przez podanie
liczby atomowej pierwiastka).
Podstawą klasyfikacji pierwiastków jest prawo
okresowości (Mendelejewa 1869).
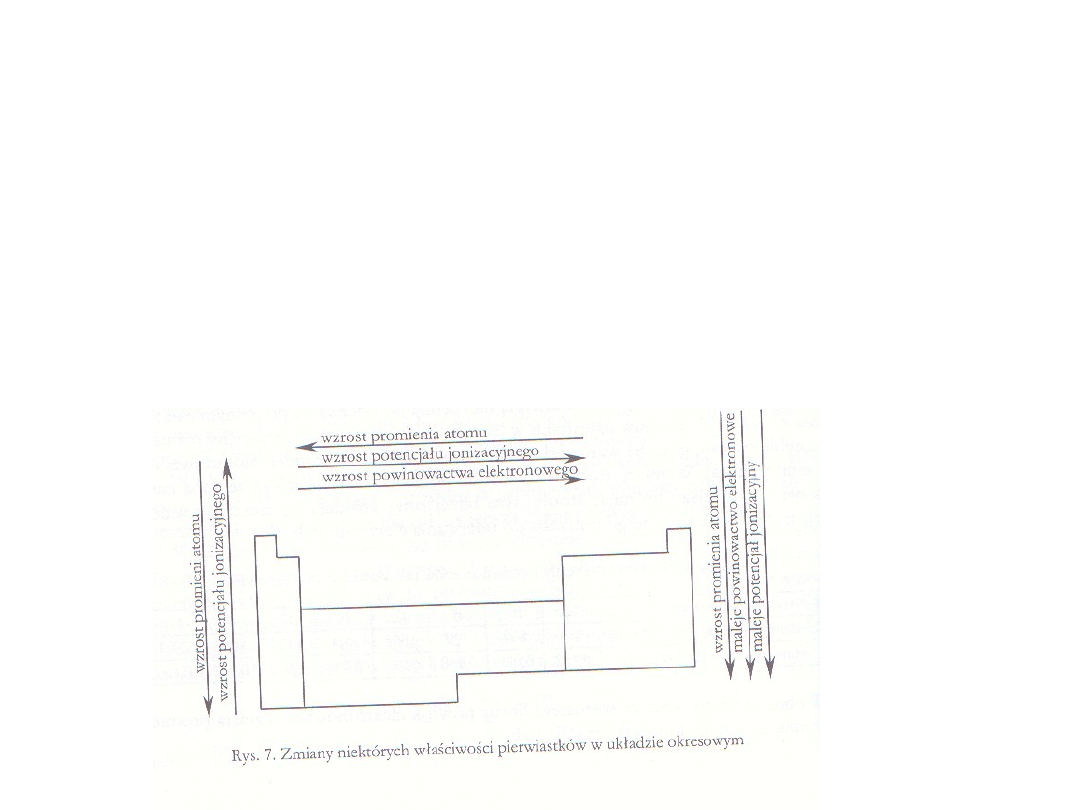
Własności chemiczne i fizyczne ulegają
cyklicznym zmianom od pierwiastków o niższych
masach atomowych do pierwiastków o wyższych
masach atomowych.
Okresowość właściwości chemicznych i
fizycznych jest spowodowana regularnym
powtarzaniem się typów konfiguracji
elektronowej.

Właściwościami powtarzającymi się
okresowo są:
•wartościowość pierwiastków,
•właściwości fizyczne (gęstość, promienie
atomu, temperatura topnienia i wrzenia),
•potencjał jonizacji i
•powinowactwo elektronowe.
Układ okresowy podzielony jest na:
7 poziomych rzędów (okresy)
18 kolumn pionowych (grupy)
8 grup głównych (1; 2 i 13-18)
10 grup pobocznych (3-12)
Pierwiastki
wewnątrzprze
jś
ciowe

Okres
jest zbiorem pierwiastków
uporządkowanych według wzrastających liczb
atomowych, których atomy zawierają
identyczną liczbę powłok elektronowych.
Numer okresu odpowiada liczbie tych powłok.
Grupa
jest zbiorem pierwiastków, których
atomy zawierają identyczną liczbę elektronów
walencyjnych, biorących udział w procesie
tworzenia cząsteczek związków chemicznych
(w tworzeniu wiązań).
Pierwiastki wewnątrzprzejściowe, czyli
lantanowce i aktynowce, nie podlegają
indywidualnej numeracji grupowej.
Przypisuje się im wspólne położenie w grupie
i umieszcza poza układem okresowym.
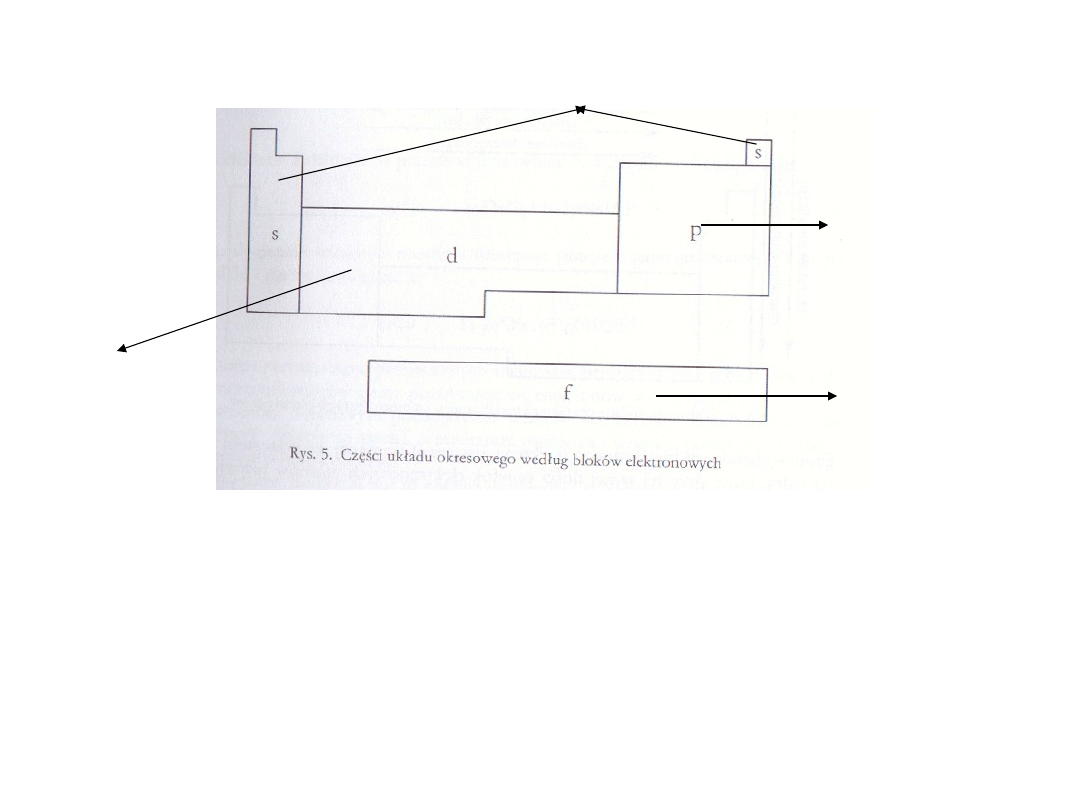
Oprócz podziału układu na grupy i okresy, wprowadzono podział
na bloki elektronowe (konfiguracyjne) oznaczone literami s, p, d,
f.
Grupa 1 i 2 oraz hel - konfiguracja elektronów
walencyjnych ns
1
i ns
2
Grupy 13-18 -
konfiguracja od ns
2
np
1
do ns
2
np
6
Pierwiastki
grup 3-12 oraz
cynkowce - (n-
1)d
1-10
ns
2
Lantanowce i aktynowce
(n-2)f
1-14
(n-1)d
10
ns
2
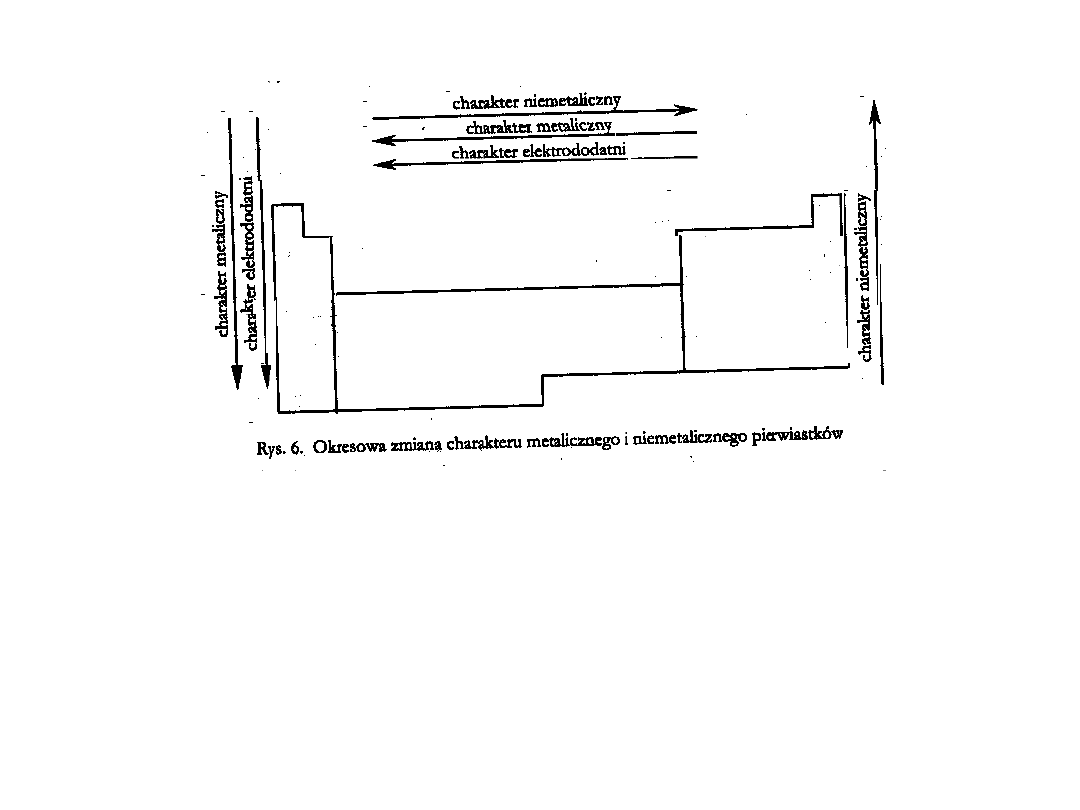
Spadek charakteru metalicznego (elektrododatniego) tłumaczy się
wzrostem ładunku jądra, które przy tej samej ilości powłok elektronowych
atomów pierwiastków tego samego okresu silniej oddziałuje na elektrony
walencyjne zwiększając elektroujemność pierwiastków
W obrębie grup wzrasta elektrododatni charakter pierwiastków,
maleje elektroujemność. Ma to związek z rosnącym promieniem
atomowym pierwiastków i większym efektem przesłaniania jądra
większą liczbą powłok elektronowych.

Potencjał jonizacji
jest to energia niezbędna
do oderwania po jednym elektronie z 6,023
.
10
23
atomów zawartych w jednym molu.
Potencjał jonizacyjny wzrasta w obrębie
okresu, gdyż ze wzrostem liczby atomowej
maleje promień atomu (wzrasta ładunek
jądra).
Wymiary atomów i wartości potencjałów
jonizacji są ze sobą związane (im mniejszy
promień atomu tym bliżej jądra znajdują się
elektrony walencyjne - tym większej energii
potrzeba do oderwania elektronu).
W obrębie grupy wraz ze wzrostem liczby
powłok elektronowych wzrasta promień
atomu, a potencjał jonizacji maleje.

Pierwiastki drugiego okresu
Li
519
Be
899
B
799
C
1088
N
1360
O
1314
F
1682
Ne
2071
Pierwsze potencjały jonizacji
[kJ/mol]
Pierwiastki grupy
pierwszej
Li
519
Na
494
K
418
Rb
402
Cs
376

Drugi, trzeci i dalsze potencjały jonizacji,
określające energię potrzebną do oderwania
następnych elektronów, są znacznie wyższe , gdyż
energia potrzebna do oderwania elektronu z
dodatniego jonu jest znacznie większa.
Glin
pierwszy potencjał jonizacji - 577
kJ/mol
drugi
- 1816
kJ/mol
trzeci
- 2745
kJ/mol
Powinowactwo elektronowe
określa wielkość energii
uwalnianej w czasie wychwytu elektronu przez obojętne
elektrycznie atomy.
Im mniejszy jest promień atomu, tym silniej oddziałuje jądro
na elektron - tym większe jest powinowactwo elektronowe
atomu.
W obrębie okresu zmniejsza się promień atomowy, wzrasta
powinowactwo elektronowe.
W obrębie grupy ze wzrostem promieni atomów
powinowactwo maleje.
Największą wartość powinowactwa elektronowego mają
atomy fluorowców (17 grupa).

Wiązania chemiczne
powstają w wyniku
zmian w położeniach elektronów
walencyjnych (elektronów zewnętrznych
powłok atomów).
Podstawy nowoczesnej interpretacji
mechanizmów tworzenia wiązań
chemicznych stworzył chemik
amerykański G.N. Lewis w 1916r.
Najbardziej znana to reguła
dubletu
i
oktetu.
Wiązania chemiczne

Reguła dubletu i oktetu
Związek chemiczny to substancja złożona z
dwóch lub większej liczby pierwiastków,
których atomy występują w określonym
charakterystycznym stosunku.
Pomiędzy atomami musi istnieć jakieś
oddziaływanie wiążące atomy między sobą.
To oddziaływanie nazywamy
wiązaniem
atomowym.
Badania struktur związków chemicznych
wykazały, że atomy związku mogą być ze
sobą powiązane i tworzyć
cząsteczki lub
mogą występować jako jony.

Cząsteczka
to określona, odrębna, obojętna
elektrycznie grupa powiązanych ze sobą
atomów.
Jon
to dodatnio lub ujemnie naładowany
elektrycznie atom albo grupa powiązanych ze
sobą atomów.
Symbol jonu podaje się w postaci symbolu
atomu lub grupy atomów z ładunkiem
umieszczonym w prawym górnym indeksie,
np.
dodatnie; Na
+
, Ca
2+
, Al
3+
,
ujemne; F
-
, S
2-
, SO
4
2-
.

Tworzenie się związków chemicznych i powstawanie
odpowiednich wiązań chemicznych pomiędzy
pierwiastkami tworzącymi cząsteczkę związku
chemicznego tłumaczy się charakterystycznym
oddziaływaniem pomiędzy elektronami i jądrami
łączących się atomów.
W wyniku tego oddziaływania, każdy z łączących się
atomów dąży do osiągnięcia takiej struktury
(konfiguracji elektronowej), która będzie bardziej
trwała jak dotychczasowa.
Pierwszy zauważył to
Gilbert Newton Lewis
i
opracował jakościową teorię wiązań chemicznych.
Zgodnie z tą teorią,
każdy pierwiastek tworząc
związek chemiczny przyjmuje konfigurację
elektronową najbliższego gazu szlachetnego
.

W atomach typowych metali, które na powłoce
walencyjnej mają 1, 2 lub 3 elektrony
walencyjne, konfiguracje elektronową
najbliższego gazu szlachetnego osiąga się
przenosząc elektrony do innego atomu,
natomiast wśród niemetali istnieje silna
tendencja do osiągnięcia struktury
helowców
przez przyłączenie jednego lub więcej
elektronów.
Kiedy atom osiąga strukturę helowca,
przenosząc elektrony do lub od innych atomów,
albo tworząc wspólne pary elektronowe z innymi
atomami, mówimy, że atom kompletuje
dublet
lub oktet elektronowy
. Taki dublet lub oktet
elektronowy charakteryzuje się dużą trwałością o
czym świadczą właściwości chemiczne
gazów
szlachetnych
.

Atomy, które oddają lub przyjmują elektrony stają
się atomami obdarzonymi ładunkami
elektrycznymi (jonami), dodatnim lub ujemnym,
ponieważ suma ładunku pochodzącego od
protonów i elektronów nie jest sobie równa.
Ilość elektronów nie jest równa ilości protonów.
W przypadku atomów, które oddają elektrony
powstają jony dodatnie – kationy, a w przypadku
atomów, które przyjmują elektrony jony ujemne -
aniony

Rodzaje wiązań chemicznych
Jonowe
(heteropolarn
e)
Kowalencyjne/Atomowe
(homopolarne
spolaryzowane)
Koordynacyjne
(semipolarne)
metaliczne
Ponadto wyróżnia się tzw. oddziaływania
międzycząsteczkowe:
•wiązania (siły) Van der Waalsa
•wiązania wodorowe

Wiązania jonowe - powstaje między atomami
pierwiastków różniących się znacznie
elektroujemnością
Elektrony walencyjne
odgrywają znaczącą role w
tworzeniu wiązań chemicznych.
Wiązanie jonowe powstaje wtedy, kiedy mamy do
czynienia z atomem -
donorem
i atomem -
akceptorem
elektronów. Przyjmując i oddając
elektrony atomy osiągają strukturę najbliższego
gazu szlachetnego.

Doskonałymi donorami elektronów są pierwiastki 1
i 2 grupy układu okresowego (metale) a
doskonałymi akceptorami są pierwiastki 17 grupy
układu okresowego (fluorowce).
Atomy pierwiastków 1 i 2 grupy (metale) powłoki
walencyjne mają umieszczone w znacznie większej
odległości od jądra atomu niż pozostałe elektrony.
Dlatego elektrony tych powłok są słabo związane w
atomie i można łatwo je oderwać od atomu.
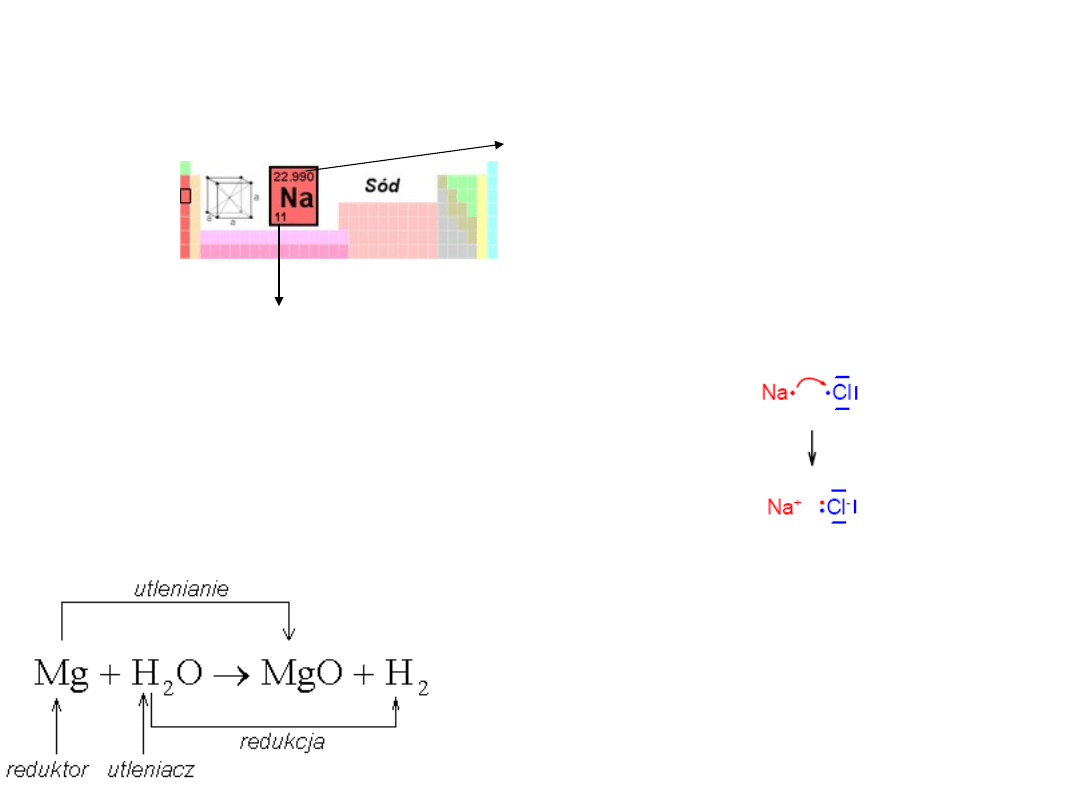
Atom sodu (Na) oddaje elektron i staje sie kationem (Na
+
).
Na (2, 8, 1) - e
-
---> Na
+
(2, 8)

W przypadku pierwiastków 17 grupy
(niemetale) mamy do czynienia z sytuacją
odwrotną. Atomy niemetali łatwo pobierają
elektrony od innych atomów.
Atom chloru (Cl) przyjmuje elektron i staje się
anionem (Cl
-
).
Cl (2, 8, 7) + e
-
---> Cl
-
(2, 8, 8)

Przyjmowanie i oddawanie elektronów zmienia
ładunek atomów. Przed oddaniem lub przyjęciem
elektronów każdy atom jest elektrycznie
obojętny. Kiedy zostaną usunięte elektrony
walencyjne, ładunek pozostałych elektronów nie
równoważy już dodatniego ładunku jądra.
Ponieważ elektron ma jednostkowy ładunek
ujemny, wynikiem usunięcia jednego elektronu z
obojętnego atomu jest powstanie kationu o
jednostkowym ładunku dodatnim.
Na przykład
kation sodu Na
+
to atom sodu, który
utracił jeden elektron, ma więc jeden ładunek
dodatni.
Każdy elektron utracony przez atom zwiększa
sumaryczny ładunek dodatni atomu o jednostkę.

W związkach jonowych nie ma
cząsteczek tylko ugrupowanie
jonów.
Wzór chemiczny związku
jonowego przedstawia jedynie
stosunek stechiometryczny
jonów i nie jest wzorem
cząsteczkowym.

Wiązania kowalencyjne (atomowe) powstają, gdy
łączą się z sobą atomy pierwiastków zaliczanych
do niemetali
. Mechanizm tworzenia wiązania
kowalencyjnego, podobnie jak i w wiązaniu
jonowym, tłumaczy się dążeniem atomów do
przyjęcia konfiguracji najbliższego gazu
szlachetnego (reguła dubletu, oktetu).
Skompletowanie oktetów (dubletu) w wiązaniu
atomowym następuje poprzez uwspólnienie par
elektronowych.
Przykładem jest cząsteczka
wodoru, w której dublet jest osiągany poprzez
uwspólnienie dwóch elektronów pochodzących
od dwóch atomów wodoru.
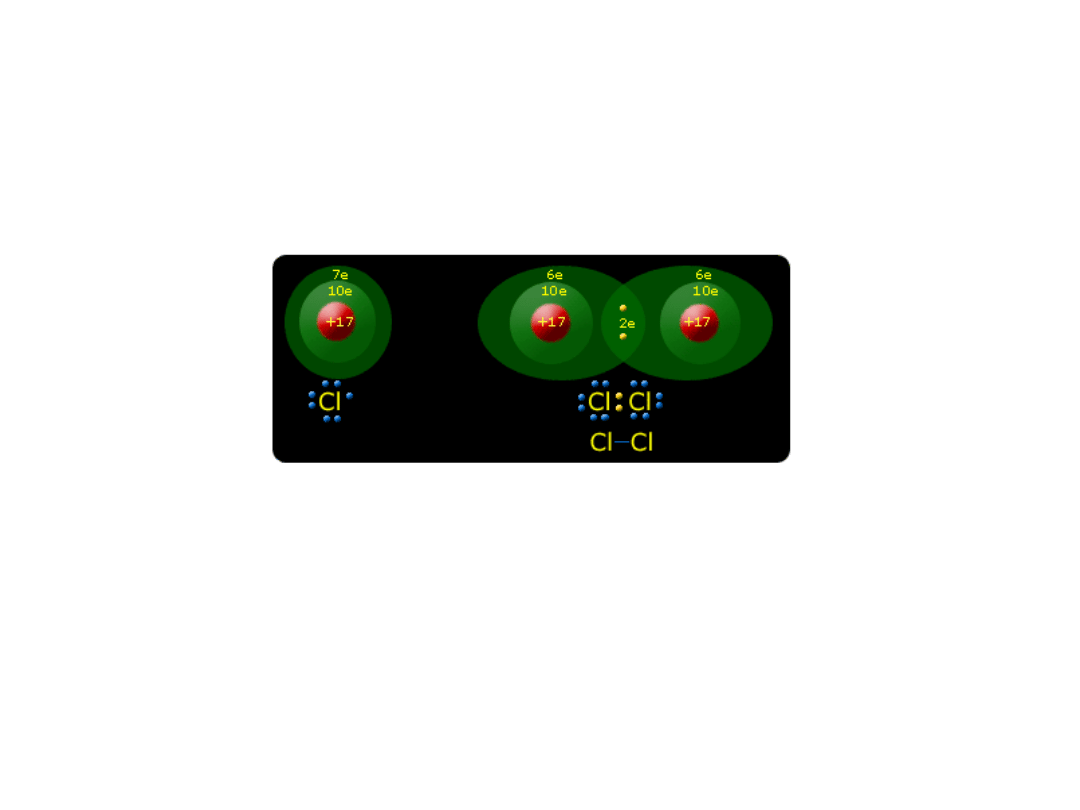
W podobny sposób powstaje wiązanie w
cząsteczkach chloru, bromu, jodu, azotu, tlenu.
Powstaje jedna wspólna para elektronowa i wtedy
każdy z atomów chloru ma 8 elektronów
walencyjnych - powstaje oktet a konfiguracja
elektronowa staje się podobna do konfiguracji
argonu (2, 8, 8)

Wiązania kowalencyjne przedstawia się za
pomocą
kresek
. Pojedyncza kreska
przedstawia parę elektronową wykorzystaną
do utworzenia wiązania między atomami.
Przykładem jest tworzenia cząsteczek chloru
i azotu. Otrzymuje się wówczas klasyczne
wzory strukturalne cząsteczek.

Wiązanie kowalencyjne (atomowe)
spolaryzowane
Mechanizm powstawania wiązania kowalencyjnego
spolaryzowanego
Wiązanie atomowe spolaryzowane
jest wiązaniem
pośrednim między jonowym a atomowym i powstaje
wówczas, gdy łączą się ze sobą atomy pierwiastków
różniących się rozmiarami i ilością powłok, lecz nie
tak znacznie jak w przypadku tworzenia wiązania
jonowego.
Cechą charakterystyczną tego wiązania jest
przesunięcie pary elektronowej wiążącej atomy w
kierunku atomu pierwiastka, który w jądrze atomu ma
więcej protonów
. Jednym z przykładów tego wiązania
może być połączenie chloru i wodoru w cząsteczce
chlorowodoru.
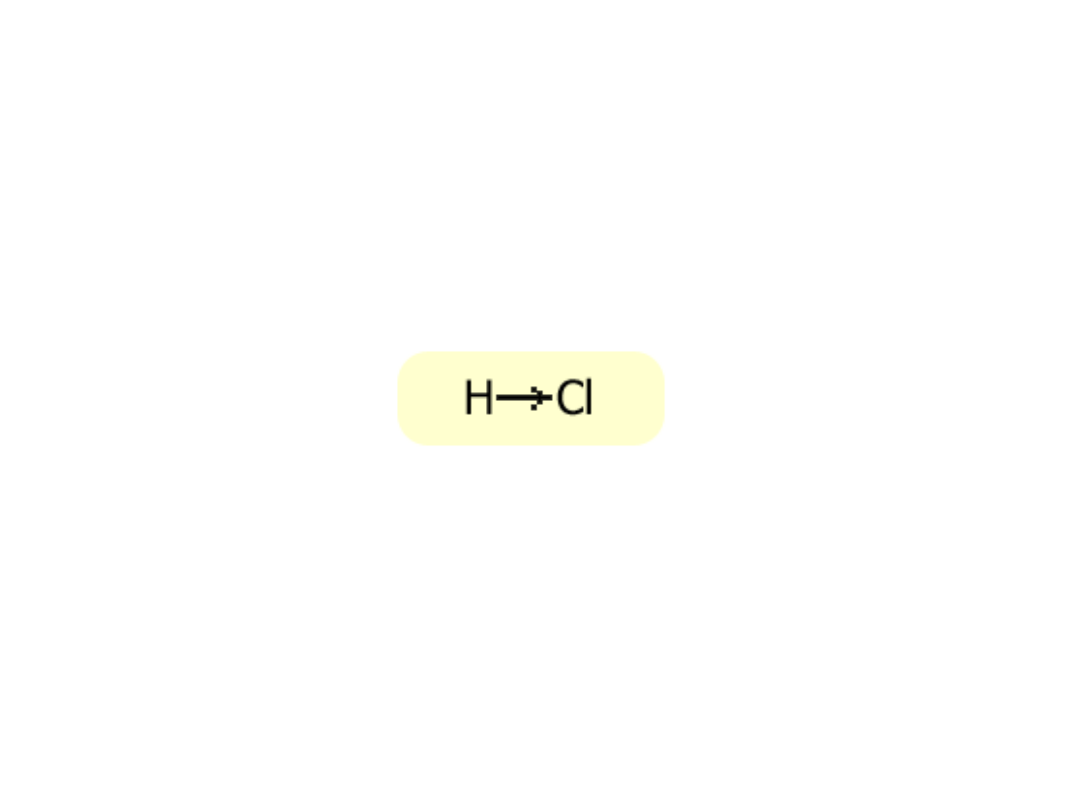
Symboliczne przedstawianie wiązania
atomowego spolaryzowanego
Tak przesunięte wiązanie atomowe
spolaryzowane często przedstawiane jest w
następujący sposób:
Cząsteczki z wiązaniami kowalencyjnymi
spolaryzowanymi z powodu nierównomiernego,
niesymetrycznego w stosunku do środka
cząsteczki, rozmieszczenia ładunków wykazują
biegunowość
. W cząsteczkach tych wyróżnić
można biegun dodatni i ujemny. Cząsteczki o
budowie polarnej nazywamy
dipolami
, tzn.
cząsteczkami dwubiegunowymi.
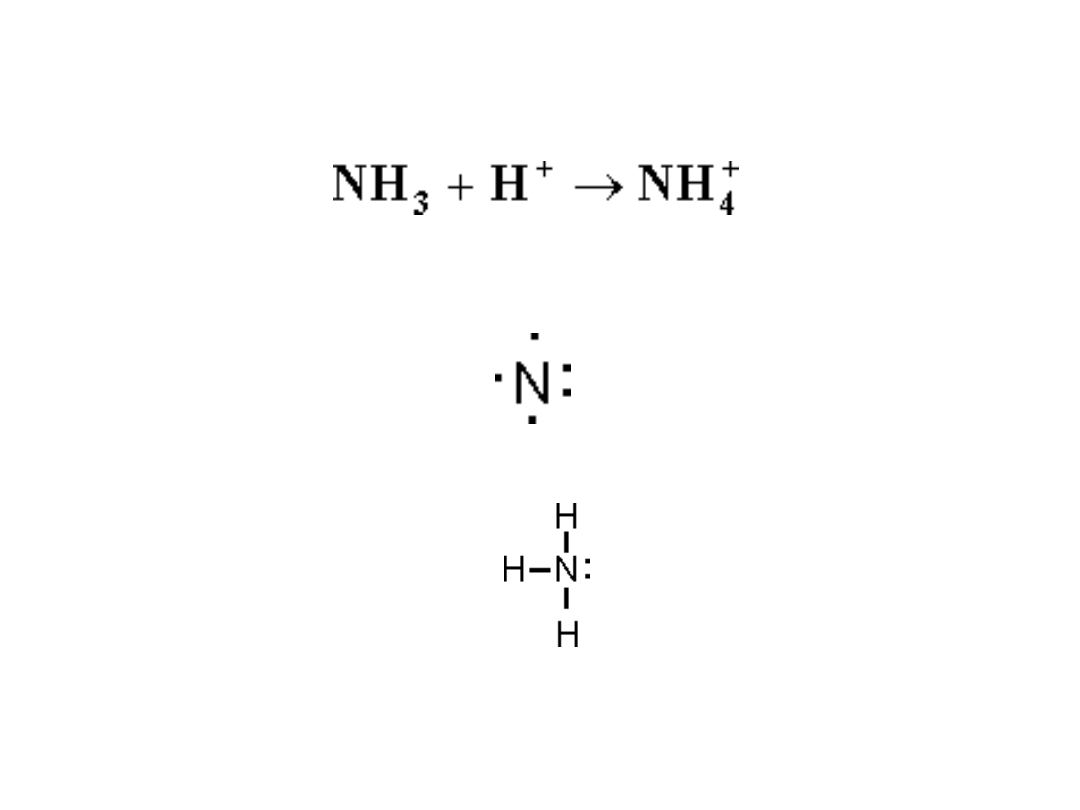
Wiązanie koordynacyjne
(donorowo-akceptorowe)
Jest to odmiana wiązania atomowego, w którym
wiążącą parę elektronów
dostarcza jeden z atomów
. Reakcja tworzenia się jonu amonowego z
amoniaku i jonu wodorowego
przebiega z utworzeniem wiązania koordynacyjnego polegającego na
tym, że wiążąca czwarty atom wodoru para elektronowa pochodzi od
azotu. Amoniak zawiera azot posiadający pięć elektronów walencyjnych
2s
2
p
3
.
Przy pomocy trzech elektronów wiąże kowalentnie trzy atomy wodoru na
cząsteczkę zachowując wolną parę elektronową.
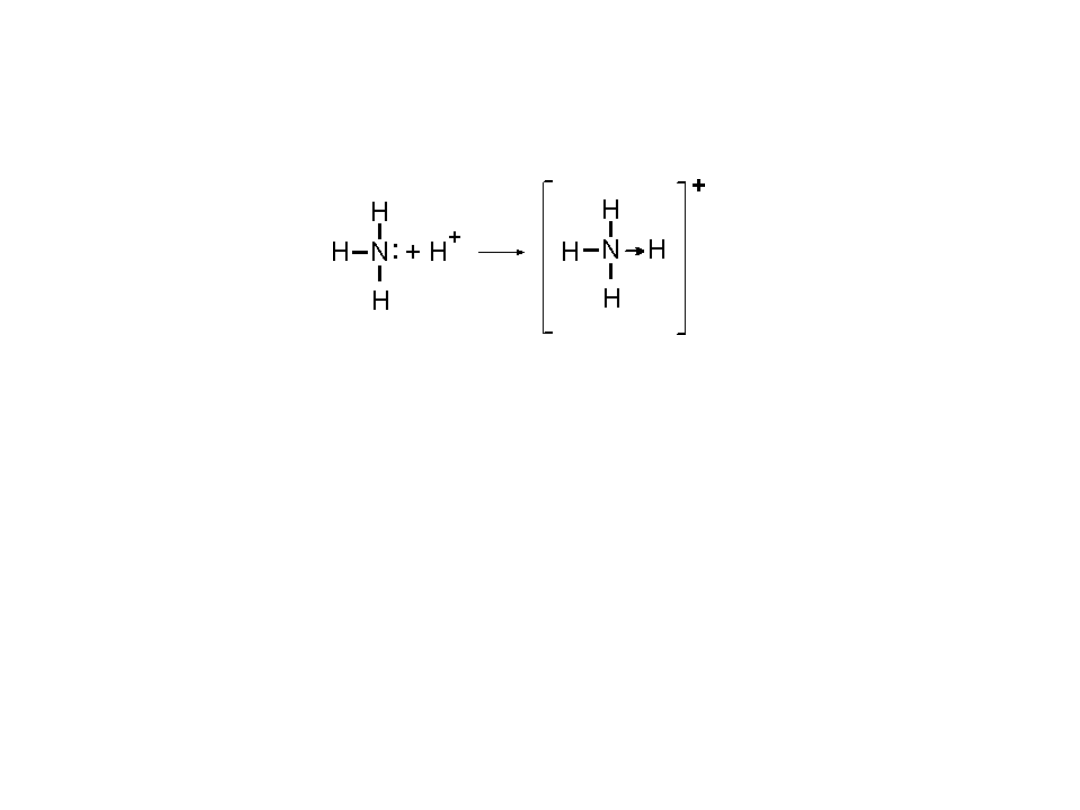
W reakcji z protonem azot wytwarza czwarte wiązanie za pomocą
dwóch elektronów stanowiących do tej pory wolną parę elektronową.
To wiązanie jest wiązaniem donorowo – akceptorowym, w którym
dawcą (donorem) elektronów jest azot, a biorcą (akceptorem) wodór.
To, że wiążąca para elektronów pochodzi od azotu podkreśla się
rysując strzałkę skierowaną w stronę biorcy.

Wiązanie metaliczne
Wiązanie metaliczne polega na przekształceniu
atomów tego samego metalu lub różnych metali
w zbiór kationów i swobodnie poruszających się
między nimi elektronów.
Wiązanie to istnieje tylko w stanie ciekłym lub
stałym.
W kryształach metali w węzłach sieci
przestrzennej znajdują się kationy metalu, a w
obrębie całego kryształu poruszają się
zdelokalizowane elektrony tworzące tzw. gaz
elektronowy.

Metale charakteryzują się specyficznymi
właściwościami polegającymi na dobrym
przewodnictwie elektrycznym i cieplnym, co jest
skutkiem łatwego przemieszczania się
elektronów wewnątrz sieci krystalicznej metalu.
Kryształ metalu zbudowany jest z dodatnich
jonów metalu osadzonych w węzłach sieci,
między którymi poruszają się elektrony
walencyjne.
Elektrostatyczne oddziaływanie jonów i
elektronów utrzymuje kryształ w całości. Typ
sieci i odległości między atomami są
charakterystyczne dla danego metalu.
Znajdujące się wewnątrz sieci krystalicznej
elektrony, tworzą tzw. gaz elektronowy.
Cechą charakterystyczną wiązania
metalicznego jest delokalizacja elektronów i
łatwość ich przemieszczania pod wpływem
zewnętrznego pola elektrycznego.

Polega na przyciąganiu jednego protonu przez kilka
elektronów.
Jądro atomu wodoru (proton) jest przyciągane przez
cząsteczkę, do której należy. Przyciąga je także inna
cząsteczka, która zawiera silnie elektroujemny atom
z wolną parą elektronową (bardzo często jest to
tlen).
Wiązanie wodorowe można rozpatrywać jako
specyficzny typ wiązania koordynacyjnego w ten
sposób, że atom wodoru jest pozbawiany
elektronów przez elektroujemny pierwiastek, z
którym jest związany (np. tlen czy azot). Tym
samym nie ma on teoretycznie elektronów i aby
osiągnąć dublet przyłącza parę elektronową innego
atomu (który ma wolną parę elektronową). Powstaje
wiązanie semikoordynacyjne.
Wiązanie
wodorowe
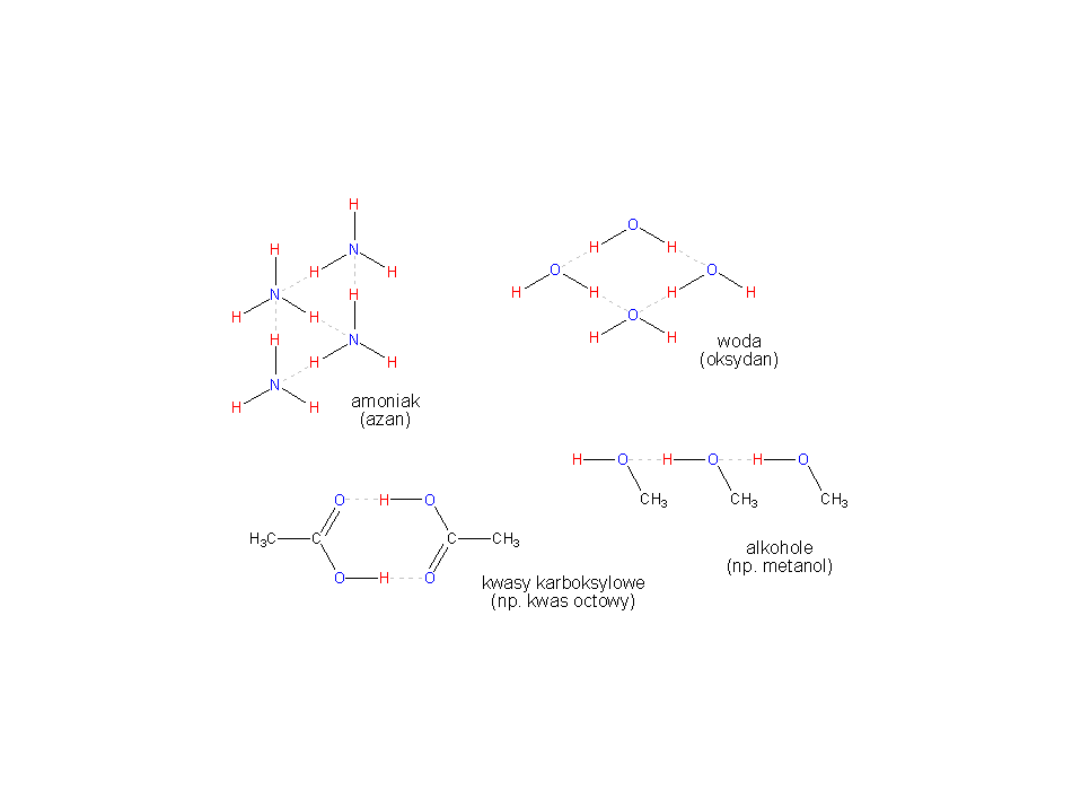

ODZIAŁYWANIE MIĘDZY CZĄSTECZKOWE
Atomy mogą wiązać się w cząsteczki. Cząsteczki,
nawet te pozbawione ładunku elektrycznego,
oddziałują między sobą. Tylko dzięki tym
oddziaływaniom możliwe jest istnienie cieczy i
większości ciał stałych.
Holenderski fizyk, Van der Waals, jako pierwszy
zwrócił uwagę na istotną rolę oddziaływań
międzycząsteczkowych w gazach.
Siły międzycząsteczkowe nazywane są często siłami
Van der Waalsa. Szczegółową teorię oddziaływań Van
der Waalsa podali Wang i London w końcu lat
dwudziestych ubiegłego wieku. Według niej teoria
oddziaływania dwóch molekuł jest sumą energii
oddziaływania elektrostatycznego, E
elst
, oddziaływania
indukcyjnego, E
ind
. Całkowitą pracę potrzebną do
rozbicia ciała stałego na izolowane cząsteczki w
przeliczeniu na jedną molekułę nazywamy energią
kohezji (spójności).

Reakcjami utlenienia i redukcji
, inaczej
mówiąc reakcjami redoks, nazywamy reakcje
chemiczne, które przebiegają ze zmianą
elektrowartościowości (stopnia utlenienia)
reagujących jonów (atomów). Zmiana stopnia
utlenienia wiąże się z pobraniem lub oddaniem
elektronów przez atom. Ze względu na to, że
atom musi pobrać elektrony od innego atomu,
lub oddać elektrony innemu atomowi, proces
utlenienia nieodłącznie wiąże się z procesem
redukcji, czyli obydwie te reakcje są zawsze ze
sobą sprzężone.

Istnieją proste reguły, które pozwalają łatwo wyznaczyć
stopnie utlenienia poszczególnych atomów, nawet w złożonym
związku:
1. Fluor we wszystkich związkach ma stopień
utlenienia -1
2. Wodór ma stopień utlenienia +1, z wyjątkiem
połączeń z metalami, w których wodór ma stopień
utlenienia -1
3. Stopień utlenienia tlenu wynosi -2, z wyjątkiem
połączeń nadtlenkowych, w których tlen jest na -1
stopniu utlenienia, oraz fluorku tlenu OF
2
, w którym
tlen jest na +2 stopniu utlenienia
4. Stopień utlenienia litowców wynosi +1, a
berylowców +2
5. Stopień utlenienia pierwiastków w stanie wolnym
wynosi 0
6. Suma stopni utlenienia w cząsteczce wynosi 0, a
w jonie jest równa ładunkowi jonu
7. Nie bierze się pod uwagę wkładu w stopień
utlenienia pomiędzy atomami tego samego
pierwiastka

Obliczanie stopnia utlenienia najlepiej
prześledzić na przykładach:
NH
3
wodór: (reguła 2) stopień utlenienia +1
ładunek cząsteczki 0
(reguła 6) x+3
.
(+1)=0, x=-3
azot: stopień utlenienia -3

Na
2
S
2
O
3
sód: (reguła 4) stopień utlenienia +1
tlen: (reguła 3) stopień utlenienia -2
(reguła 6) 2
.
x+2
.
(+1)+3
.
(-2)=0
siarka: stopień utlenienia +2

Dobór współczynników równania
reakcji.
W celu zmienienia stopnia utlenienia jednego
atomu (np. utlenienia go) musimy odebrać
mu pewną ilość elektronów. Z uwagi na to, że
w reakcji chemicznej ani atomy, ani elektrony
nie mogą zaginąć, inny atom musi te
elektrony przyjąć - ulega on redukcji. Zatem
całe „skomplikowane” równanie reakcji
chemicznej można rozbić na dwie części, tzw.
równania reakcji połówkowych. W jednym
równaniu reakcji zachodzi proces utlenienia,
a w drugim redukcji. Dla każdego z równań
reakcji połówkowych współczynniki równania
dobiera się oddzielnie.

Liczba elektronów pobranych przez utleniacz
(ten związek który utlenia, a sam ulega
redukcji) musi być równa liczbie elektronów
oddanych przez reduktor. Taką wspólną liczbą
elektronów dla reduktora i utleniacza jest
Najmniejsza Wspólna Wielokrotność - NWW.
Przy dobieraniu współczynników równania reakcji stosuje się
pewien schemat, który został przedstawiony poniżej w postaci
algorytmu, czyli reguł postępowania, wg których dobiera się
współczynniki równania reakcji:
obliczyć stopnie utlenienia atomów po lewej i prawej
stronie równania reakcji (dla substratów i
produktów)
znaleźć atomy, które zmieniły swój stopień utlenienia.
Określić atom który uległ redukcji i atom który uległ
utlenieniu
zapisać połówkowe równania reakcji
- z udziałem atomu, który uległ redukcji
- z udziałem atomu, który uległ utlenieniu (kolejność
dowolna)

do związku w którym atomy występują w
postaci utlenionej dodajemy tyle elektronów, by
uzyskać jego postać zredukowaną. Dobranie
współczynników reakcji połówkowych:
zbilansowanie atomów, które uległy
redukcji/utlenieniu
zbilansowanie atomów tlenu i wodoru
zbilansowanie innych atomów
na koniec sprawdzamy czy każde z równań
reakcji połówkowych z osobna spełnia prawo
zachowania masy i ładunku

Al + H
2
SO
4
Al
2
(SO
4
)
3
+ H
2
Ustalenie stopni utlenienia utleniacza i reduktora
Al
0
+
I
H
2
SO
4
III
Al
2
(SO
4
)
3
+
0
H
2
Ustalenie liczby elektronów oddawanych przez reduktor i
przyjętych przez utleniacz
reduktor
0
Al
III
Al
3+
+ 3e
-
utleniacz 2H
I
+2e
-
0
H
2
Obliczenie najmniejszej wspólnej wielokrotnej ustalonych liczb
elektronów
- 6
Obliczanie współczynników przy substratach i produktach reakcji
dla reduktora 6 ÷ 3 = 2
dla utleniacza 6 ÷ 2 = 3
poprawny zapis bilansu elektronowego
Al Al
3+
+ 3e
-
| ×2
2
I
H
+
+ 2e
-
0
H
2
| ×3
Wpisanie współczynników do równania reakcji
2Al + 3H
2
SO
4
Al
2
(SO
4
)
3
+ 3H
2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
chemia kosmetyków wykłady 6
chemia kosmetyków wykład 4
Wyklad nr 3 chemia kosmetyczna
Przykładowe egzaminy, Studia - Chemia kosmetyczna UŁ, I rok, II semestr, MATEMATYKA wykłady
PRK Wyklad chemia kosmetyczna pracownia
BIO-HETEROCYKLE - PODSTAWY, Studia - Chemia kosmetyczna UŁ, III rok, VI semestr, BIOCHEMIA wykłady
chemia organiczna wykład 6
Chemia medyczna wykład 1
Chemia fizyczna wykład 11
GLAUKONIT I TALK, chemia kosmetyczna
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
Moc borowin, Studium kosmetyczne, Chemia kosmetyczna
Identyfikacja składników kosmetyków., Referaty, Chemia kosmetyczna
więcej podobnych podstron