
Chemia - Budownictwo
WSTiP
dysocjacja elektrolityczna,
reakcje w roztworach wodnych,
pH
wykład nr 2b

Teoria dysocjacji
jonowej
Elektrolity i nieelektrolity
Wpływ polarnej budowy cząsteczki wody na
proces rozpuszczania kryształu jonowego i
cząsteczkowego
Definicja dysocjacji jonowej
Proces dysocjacji kwasów, zasad i soli.

Elektrolity i
nieelektrolity
Elektrolity:
kwasy, zasady i sole podczas rozpuszczania w wodzie
rozpadają się na elementy naładowane elektrycznie, czyli
ulegają tzw. dysocjacji elektrolitycznej(jonowej).
Elementy te nazwano jonami. Jony naładowane dodatnio
nazywa się kationami, a ujemne anionami.
suma ładunków elektrycznych kationów i anionów,
powstających na skutek dysocjacji elektrolitycznej
elektrolitów jest zawsze równa zeru.

Elektrolity i
nieelektrolity
Nieelektrolity:
substancje, które w roztworach i w stanie stopionym nie
przewodzą prądu elektrycznego, nie ulegają dysocjacji
elektrolitycznej.
właściwości chemiczne jonów różnią się zupełnie od
własności obojętnych atomów i cząsteczek

Nie wszystkie substancje dysocjują w roztworach
wodnych. Warunkiem takiego zachowania się jest
odpowiednia budowa i rodzaj wiązania w cząsteczkach
związku chemicznego.
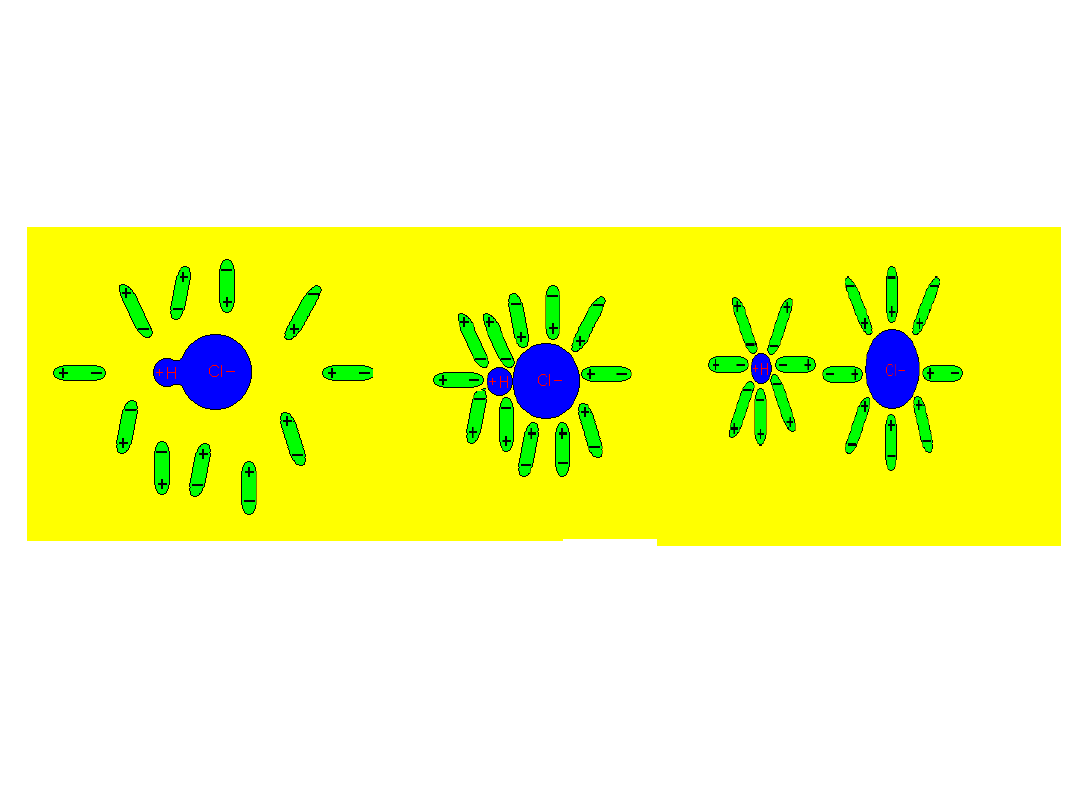
Cząsteczki wody mają budowę polarną, są dipolami:
mechanizm
dysocjacji
H
H
O
-

W rezultacie dipole wody powodują osłabienie, a następnie
rozerwanie wiązania związku i uwolnienie jonów na :
dodatni kation H
+
i ujemny anion B
-
(przykład: dysocjacja
HCl)
HCl
<=> H
+
+ Cl
–
Jeżeli równowaga dysocjacji jest przesunięta w kierunku
tworzenia jonów, to w roztworze nie ma (jest bardzo mało)
cząsteczek niezdysocjowanych. Takie roztwory bardzo
dobrze przewodzą prąd elektryczny.
mechanizm
dysocjacji
mechanizm
dysocjacji
Definicja
dysocjacji
elektrolitycznej
Cząsteczki substancji rozpuszczonej pod wpływem
cząsteczek wody ulegają w roztworze rozpadowi na jony
dodatnie(kationy) i jony ujemne(aniony) jest to proces
dysocjacji elektrolitycznej.

Proces dysocjacji
elektrolitycznej
kwasów,
zasad i soli
Kwasami są związki chemiczne, które podczas
rozpuszczania w wodzie dysocjują całkowicie lub
częściowo na kationy wodorowe i aniony reszt
kwasowych. Dysocjację tę można przedstawić
następująco:
HNO
3
--> H
+
+ NO
3
-
H
2
SO
4
--> 2H
+
+ HSO
4
2-

Proces dysocjacji
elektrolitycznej
kwasów,
zasad i soli
Kwasy takie jak HNO3, które w czasie dysocjacji
odczepiają jeden kation wodorowy nazywamy
jednoprotonowymi. Kwasy posiadające w
cząsteczkach dwa atomy wodoru zdolne do
oddysocjowania w postaci kationów -
dwuprotonowymi, trzy-, trójprotonowymi

Proces dysocjacji
elektrolitycznej
kwasów,
zasad i soli
Zasady są to związki chemiczne, które podczas
rozpuszczania w wodzie dysocjują całkowicie lub
częściowo na aniony wodorotlenowe OH
-
i kationy
metali. A oto równania dysocjacji niektórych
zasad.
NaOH --> Na
+
+ OH
-
KOH --> K
+
+ OH
-
Ca(OH)
2
--> Ca
2+
+ 2OH
-

Proces dysocjacji
elektrolitycznej
kwasów,
zasad i soli
Sole są produktami reakcji kwasów z zasadami.
Związki te w temperaturze pokojowej występują na
ogół w stanie stałym, krystalicznym i mają budowę
jonową, czyli składającą się z kationów metali lub
kationu amonowego i anionów reszt kwasowych.

Proces dysocjacji
elektrolitycznej
kwasów,
zasad i soli
Proces rozpuszczania soli w wodzie polega zatem na
przechodzeniu do roztworu istniejących już w krysztale
kationów i anionów. Jonowa budowa soli tłumaczy również
zdolności przewodzenia prądu przez stopione sole.
NaCl <=> Na
+
+ Cl
-

Moc elektrolitów –
stopień dysocjacji
Definicja stopnia dysocjacji.
Zależność stopnia dysocjacji od rodzaju
elektrolitu i stężenia elektrolitu.
Elektrolity słabe i mocne.

Definicja stopnia
dysocjacji
Do porównania mocy elektrolitów Arrhenius wprowadził
pojęcie stopnia i stałej dysocjacji elektrolitycznej.
Stopień dysocjacji elektrolitu określa się stosunkiem
liczby moli cząsteczek zdysocjowanych na jony do liczby
moli cząsteczek substancji rozpuszczonej.
x
α = -----
n
gdzie: (alfa) - stopień dysocjacji, x - liczba moli
cząsteczek zdysocjowanych na jony, n - liczba moli
cząsteczek substancji rozpuszczonej

Zależność stopnia
dysocjacji od rodzaju
elektrolitu i stężenia
roztworu
Stopień dysocjacji wzrasta z rozcieńczeniem
elektrolitu i w roztworach bardzo rozcieńczonych
wszystkie elektrolity wykazują stopień dysocjacji
zbliżony do jedności, tzn. niemal wszystkie
cząsteczki lub zgrupowania jonów substancji
rozpuszczonej ulegają zdysocjowaniu na jony.

Elektrolity mocne i
słabe
Elektrolitami mocnymi nazywamy takie związki, które w
niezbyt stężonym roztworze wodnym są całkowicie
zdysocjowane na jony. Ich stopień dysocjacji jest równy
jedności. Do elektrolitów mocnych należą prawie
wszystkie sole oraz niektóre kwasy i zasady (H
2
SO
4
,
HNO
3
, HCl, NaOH, KOH).

Elektrolity mocne i
słabe
Elektrolitami słabymi nazywamy takie związki, które w
roztworze wodnym tylko częściowo dysocjują na jony, a
więc roztwór oprócz jonów zawiera zawsze cząsteczki
niezdysocjowane. Stopień dysocjacji słabych elektrolitów
jest mniejszy od jedności ponieważ rośnie wraz z
rozcieńczeniem roztworu więc przy określaniu jego
wartości należy zawsze uwzględniać stężenie elektrolitu.
Należą do nich wszystkie kwasy organiczne oraz
pozostałe kwasy i zasady nie wymienione w mocnych
elektrolitach.

Reakcja zobojętniania –
zapis cząsteczkowy i
jonowy
1.
Przykład reakcji zobojętniania.
2.
Cząsteczkowy, jonowy i jonowy skrócony zapis
równań reakcji zobojętniania.
3.
Stosunki stechiometryczne w reakcjach
zobojętniania.

Przykład reakcji
zobojętniania
Jedną z ważniejszych reakcji chemicznych jest reakcja
zobojętniania. Przedstawia ona połączenie jonu
hydroniowego z jonem wodorotlenowym
H
3
O
+
+ OH
-
--> 2H
2
O
Jest to reakcja odwrotna do reakcji dysocjacji wody.
Wyjaśnia to fakt, że o ile zmieszamy kwas i zasadę, to w
wyniku reakcji tworzy się woda jako produkt końcowy,
czemu towarzyszy efekt cieplny 13,8 kcal/mol.
Całkowitą reakcję zobojętniania można ująć następująco:
H
3
O
+
+ A
-
+ B
+
+ OH
-
--> 2H
2
O + B
+
+ A
-
Drugi obok wody produkt tej reakcji (B
+
+ A
-
) nazywany
jest solą.

Cząsteczkowy zapis
reakcji zobojętniania
NaOH + HCl --> NaCl + H
2
O
Ca(OH)
2
+ 2 HNO
3
--> Ca(NO
3
)
2
+ 2H
2
O
Jonowy zapis reakcji
zobojętniania
Na
+
+OH
-
+ H
+
+ Cl
-
→ Na
+
+ H
2
O + Cl
-
Ca
2+
+ 2 OH
-
+ 2 H
+
+ 2 Cl
-
→ Ca
2+
+ 2 H
2
O + 2 Cl
-
Podkreślone jony biorą udział w tworzeniu cząsteczki
wody, pozostałe występują w tej samej postaci przed
i po reakcji (nie biorą więc udziału w reakcji).

Skrócony jonowy
zapis reakcji
zobojętniania
2 OH
-
+ 2 H
+
→ 2 H
2
O
/ :2
OH
-
+ H
+
→ H
2
O

Stosunki
stechiometryczne , a
rodzaj powstałej soli
Ilość użytych substancji powoduje całkowite zobojętnienie
jonów
H
+
powstanie soli obojętnej, natomiast w przypadku
innej proporcji możemy otrzymać wodorosól (metal +
wodororeszta)- aby z niej otrzymać sól obojętną należy
wodór zastąpić metalem.
Możemy także otrzymać hydroksosól (metal z resztą OH +
reszta kwasowa)- aby z niej otrzymać sól obojętną należy
grupy OH zastąpić resztą kwasową (resztami).

Reakcja strącania
osadów
Definicja reakcji strąceniowych
Przykłady reakcji
Zapisy reakcji
Tablice rozpuszczalności

Definicja reakcji
strąceniowej
Jest to reakcja między jonami, które łącząc
się,dają trudnorozpuszczalny związek.
It’s a reaction between ions that give hardly-
soluble compound while combining.

Przykład reakcji
strącania
Cu
2+
+ 2 OH
-
→ Cu(OH)
2
(Skrócony)
Cu
2+
+SO
4
2-
+ 2 K
+
+ 2 OH
-
→ Cu(OH)
2
+ 2 K
+
+SO
4
2-
(Jonowy)
CuSO
4
+ 2 KOH
→ Cu(OH)
2
+ K
2
SO
4
(Cząsteczkowy)
Ag
+
+ Cl
-
→ AgCl

Tablice
rozpuszczalności
Znajomość rozpuszczalności różnych
związków trudnorozpuszczalnych pozwala
więc przewidzieć przebieg reakcji i sposób
wydzielania produktów. Istnieją odpowiednie
tablice rozpuszczalności związków, z których
można w razie potrzeby skorzystać. W tablicach
przy pomocy symboli i kolorów przedstawia się
barwę powstałego roztworu lub osadu

pH roztworów
wodnych
Cechą charakteryzującą kwasowe lub zasadowe
właściwości roztworów jest ich odczyn. Nadmiar
jonów wodoru H
+
powoduje odczyn kwasowy
roztworu, nadmiar jonów wodorotlenkowych OH
-
odczyn zasadowy roztworu, natomiast gdy jest
równowaga między tymi jonami uzyskujemy odczyn
obojętny roztworu.
When there is a surplus of H
+
ions, solution is acidic.
When there is a surplus of OH
–
ions, solution is basic.
When there is a harmony between these ions,
solution is neutral.

Miara odczynu roztworu
- pH
pH definiujemy jako ujemny logarytm
dziesiętny z wartości liczbowej stężenia
jonów hydroniowych
pH = - lg[H
3
O
+
]
analogicznie
pOH = - lg[OH
-
]

Skala pH
Ponieważ stężenie czystej wody w wodzie jest wielkością
stałą to iloczyn K * [H
2
O]
2
jest również wielkością stałą i
nazywany jest iloczynem jonowym wody K
w
.
K
w
= K * [H
2
O]
2
= [H
3
O
+
] * [OH
-
] = 10
-14
(mol/dm
3
)
W temperaturze 298,15
o
K stężenie jonów hydroniowych w
czystej wodzie jest równe stężeniu jonów
wodorotlenowych i wynosi:
[H
3
O
+
] = [OH
-
] = 1,00 * 10
-7
mol/dm
3

Skala pH
Podobnie jak w czystej wodzie, również we wszystkich
roztworach obojętnych [H
3
O
+
] = 10
-7
mol/dm
3
. W
roztworach kwaśnych [H
3
O
+
] > 10
-7
mol/dm
3
a w
roztworach zasadowych [H
3
O
+
] < 10
-7
mol/dm
3
.
Posługiwanie się tak małymi stężeniami jest niewygodne
w zapisach i obliczeniach. Dlatego przyjęto wyrażać
aktywność jonów wodorowych w roztworze w tzw. skali
pH

Hydroliza soli
Sole pochodzące od mocnych kwasów i słabych zasad
ulegają hydrolizie kationowe – roztwór wodny wykazuje
odczyn kwasowy.
Sole pochodzące od słabych kwasów i mocnych zasad
ulegają hydrolizie anionowej – roztwór wodny wykazuje
odczyn zasadowy.
Sole pochodzące od słabych kwasów i słabych zasad
ulegają hydrolizie kationowo-anionowej – roztwór wodny
wykazuje odczyn obojętny lub słabo zasadowy, lub
słabokwasowy.
Sole mocnych zasad i mocnych kwasów nie ulegają
hydrolizie – roztwór obojętny.

Przyczyna
określonego odczynu
wodnych roztworów
soli
Odczyn kwasowy roztworu powoduje nadmiar
powstałych jonów H
+
(hydroliza kationowa).
Odczyn zasadowy roztworu powoduje nadmiar
powstałych jonów OH
-
(hydroliza anionowa)
Odczyn obojętny powstaje gdy moc słabego kwasu i
słabej zasady jest zbliżona (hydroliza kationowo-
anionowa)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
12 Prąd elektrycznyid 13297 ppt
2 Oddział elektrostatyczneid 20587 ppt
07 Łączniki elektryczneid 6846 ppt
1System elektroenergetycznyid 19195 ppt
07 Zaburzenia gospodarki wodno elektrolitowejid 6782 ppt
13 Równowagi w roztworach elektrolitówid 14769 ppt
Prezentacja o bankowości elektronicznej w ING ppt
14a Zmienne pole elektromagnetyczneid 15868 ppt
08 Stacje elektroenergetyczneid 7511 ppt
01 Wykł 01 Pole elektryczneid 2677 ppt
14 Zmienne pole elektromagnetyczneid 15293 ppt
12 Elektrostatykaid 13441 ppt
więcej podobnych podstron