
1
Gospodarka wapniowo-
Gospodarka wapniowo-
fosforanowa
fosforanowa
Seminarium – Oddział
Stomatologii
13.02 – 17.02.2006
Sem. 12

2
Pule wapnia i fosforanów w organizmie
Istnieją 3 główne pule wapnia w ustroju :
1)
Wapń wewnątrzkomórkowy
: większość wapnia jest
zgromadzona w mitochondriach i siateczce wewnątrzkomórkowej
(reticulum)
.
2)
Wapń we krwi i płynach ustrojowych
: Około 50%
wapnia obecnego we krwi jest związana z białkami. Stężenie
zjonizowanego wapnia Ca
2+
we krwi wynosi ok. 1 mM, czyli
10,000 razy więcej niż podstawowy poziom wolnego wapnia
wewnątrzkomórkowego.
3)
Wapń w kościach
: Większość wapnia organizmu znajduje się
w kościach!!. 99% wapnia występuje w kryształach
hydroksyapatytu, pozostałe 1% może się szybko wymieniać z
wapniem zewnątrzkomórkowym.

3
Hormony regulujące poziom wapnia we
krwi
• Normalne stężenie wapnia i fosforanów we krwi jest
utrzymywane poprzez działanie 3 hormonów:
1)
Parathormon
– zwiększa stężenie wapnia we krwi
2)
Witamina D
– zwiększa stężenie wapnia we krwi
3)
Kalcytonina
– zmniejsza stężenie wapnia we krwi
4
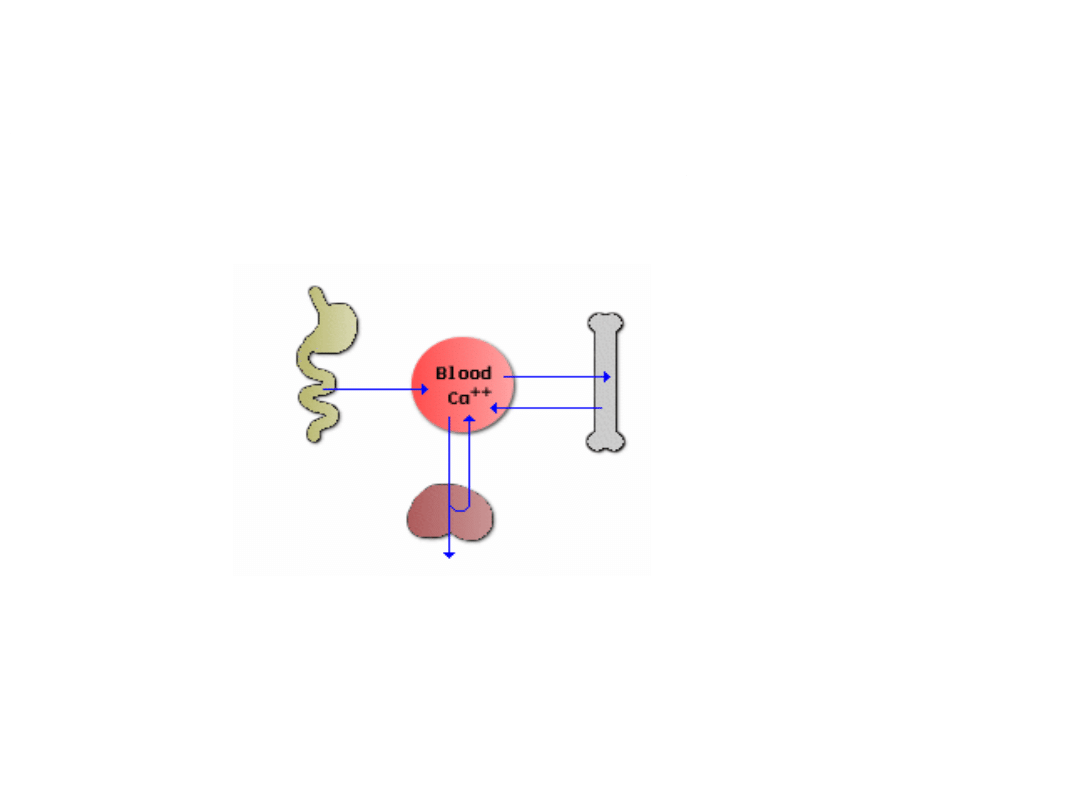
Przemiany wapnia i fosforanów
Jelito cienkie
– miejsce absorbcji
wapnia z pokarmu. Efektywny transport
wapnia zależy od ekspresji białek
wiążących wapń na komórkach nabłonka.
Kość
– magazyn
wapnia. Stymulacja
resoprcji minerałów w
kości uwalnia wapń i
fosforany do krwi –
zahamowanie tego
procesu pozwala na
odkładanie się wapnia
w kościach.
• Nerka
– bardzo ważna w utrzymaniu homeostazy wapniowej. W
warunkach normalnego stężenia wapnia we krwi – prawie cały wapń
z przesączu pierwotnego jest reabsorbowany w kanalikach nerki z
powrotem do krwi. Jeśli zmniejsza się reabsorpcja - wapń jest
tracony z moczem.
5
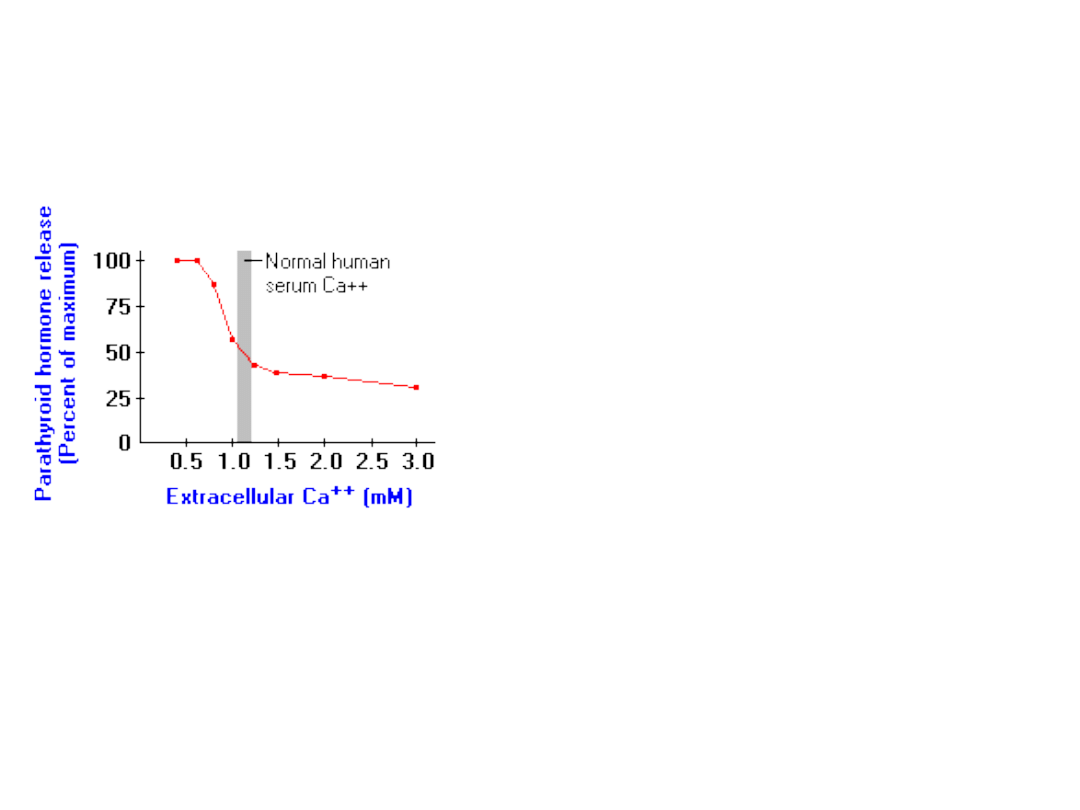
Parathormon
Parathormon – najważniejszy w regulacji stężeń wapnia i
fosforanów w płynach zewnątrzkomórkowych.
Prosty opis zadania PTH:
Jeśli stężenie zjonizowanego wapnia w
płynach zewnątrzkomórkowych
spadnie poniżej normy – doprowadź
do wartości normalnej.
• Komórki przytarczyc kontrolują stężenie wapnia
pozakomórkowego – poprzez receptor błonowy.
• Hormon jest produkowany przez
przytarczyce
.
6
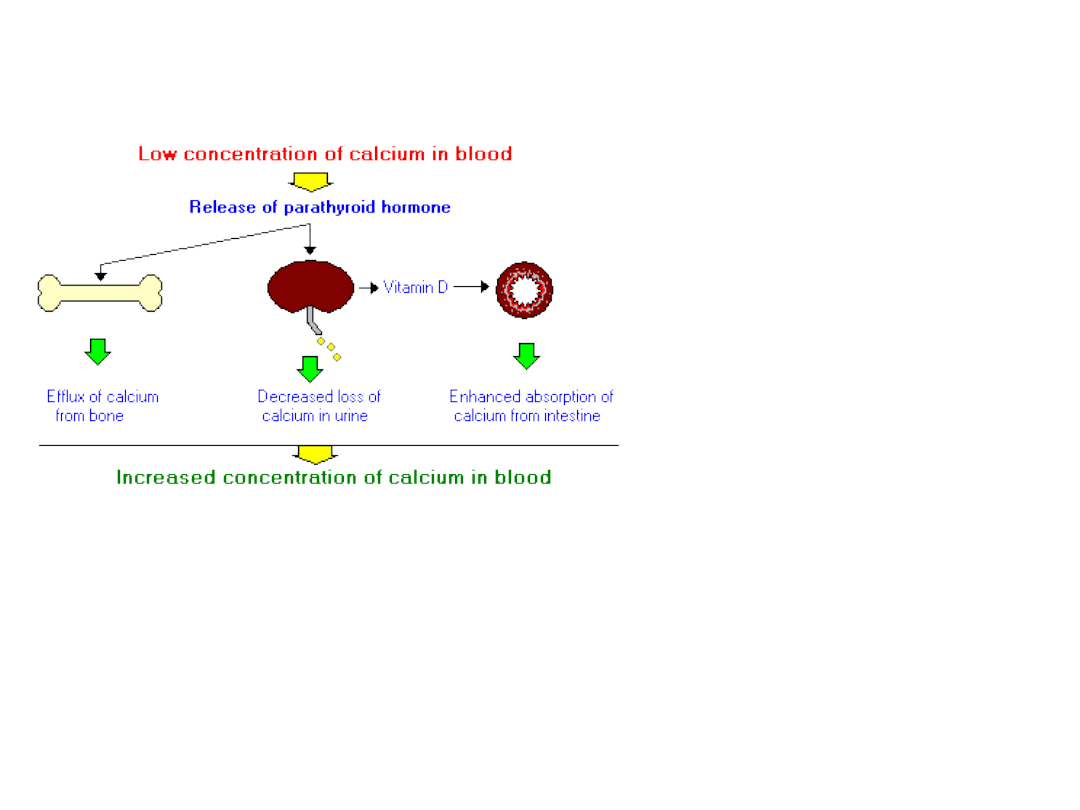
Fizjologiczne efekty PTH
• Mobilizacja
wapnia z kości
–
stymulacja
osteoklastów –
resorpcja kości –
uwalnianie wapnia do
krwi.
• Zwiększenie
adsorpcji wapnia w
jelicie cienkim
–
działanie pośrednie
poprzez stymulację
syntezy aktywnej formy
witaminy D w nerkach.
• Witamina D powoduje
syntezę białka wiążącego
wapń w komórkach
nabłonka
.
• Hamowanie utraty wapnia z
moczem
poprzez stymulację resorpcji
zwrotnej wapnia. Zwiększenie utraty
fosforanów z moczem
.

7
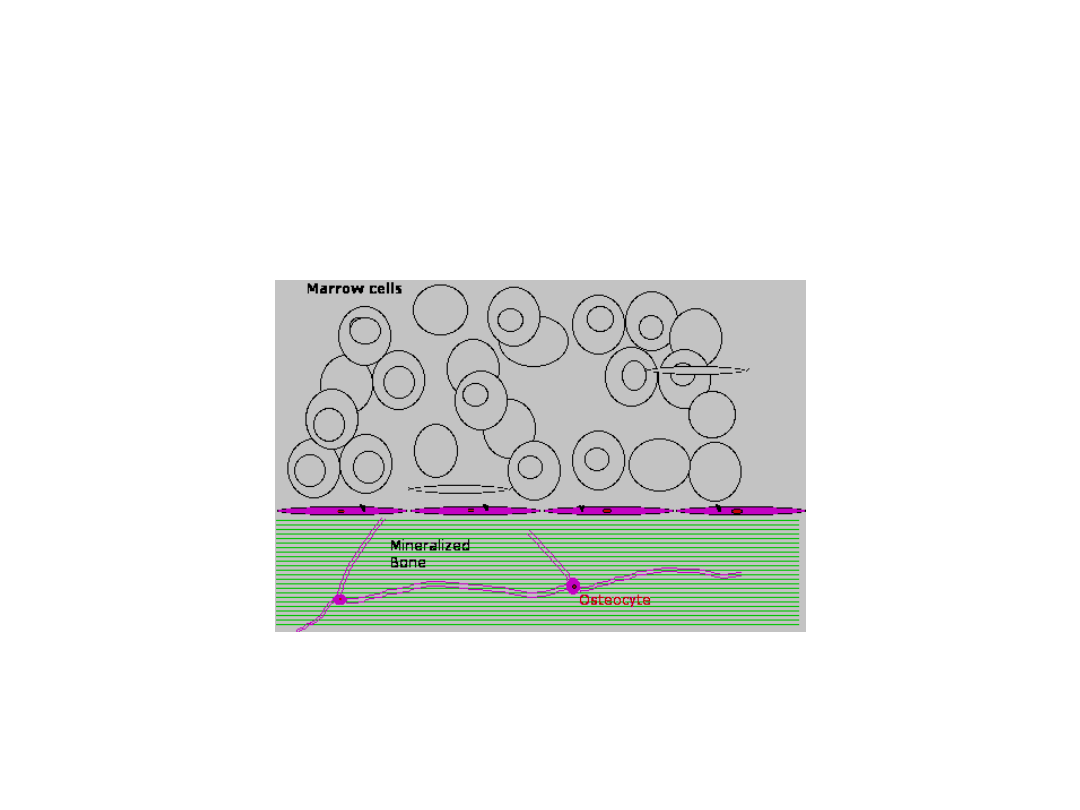
Tkanka kostna nie jest tkanką nieaktywną.
Kości są nieustannie przebudowywane (remodelling) – w ciągu roku
dochodzi do wymiany 2-10% masy kostnej.
BMU – Basic Multicellular Unit –
wędrująca grupa komórek, która rozpuszcza
pewien obszar powierzchni kości i następnie
wypełnia go nową kością.
Obrót kostny
1.
Początek
:
mikrouraz, po stresie
mechanicznym lub pod wpływem cytokin
2.
Rekrutacja osteoklastów
:
a)
Aktywacja komórek wyściełających kość (lining
cells) – zmiana kształtu i sekrecja
RANK-liganda
(może
zostać związany z powierzchnią błony komórkowej).
Prekursory osteoblastów także wydzielają RANK-ligand.
b)
Pre-osteoklasty
mają receptor błonowy –
RANK
.
Po aktywacji RANK-RANK Ligand – fuzja
komórek i różnicowanie do dojrzałych wielojądrzastych osteoklastów – resorbują kość.
3.
Resorpcja kości
– podczas wędrowki BMU aktywowane są nowe osteoklasty – resorpcja
trwa ok. 2 tygodni. Potem osteoklasty umierają – apoptoza.
4.
Rekrutacja osteoblastów
– pochodzą z komórek zrębu szpiku – przyciągane przez czynniki
wzrostu kości
.
5.
Tworzenie osteoidu
– aktywne osteoblasty produkują czynniki organiczne.
6.
Mineralizacja
– proces regulowany przez osteoblasty
.
7. Osteoblasty przekształcają się w komórki wyściełające lub osteocyty.
8
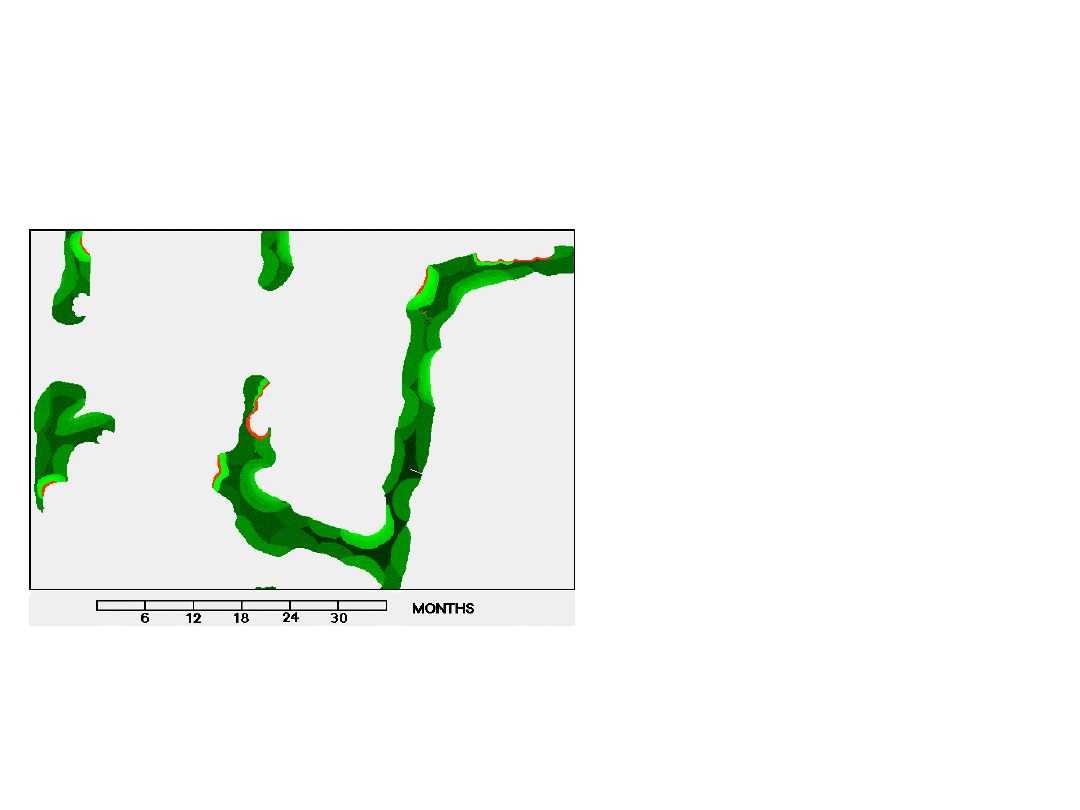
9
Normalny obrót kostny
Czynniki wpływające na przebudowę kości:
1. Stres mechaniczny –
stymuluje aktywność
osteoblastów i tworzenie
macierzy organicznej. Ważny
w zapobieganiu zaniku kości.
2. Zewnątrzkomórkowe
poziomy wapnia i
fosforanów – zmiany
wpływają na odkładanie
wapnia i fosforanów w
kościach.
3. Hormony, lokalne czynniki
wzrostu, cytokiny.

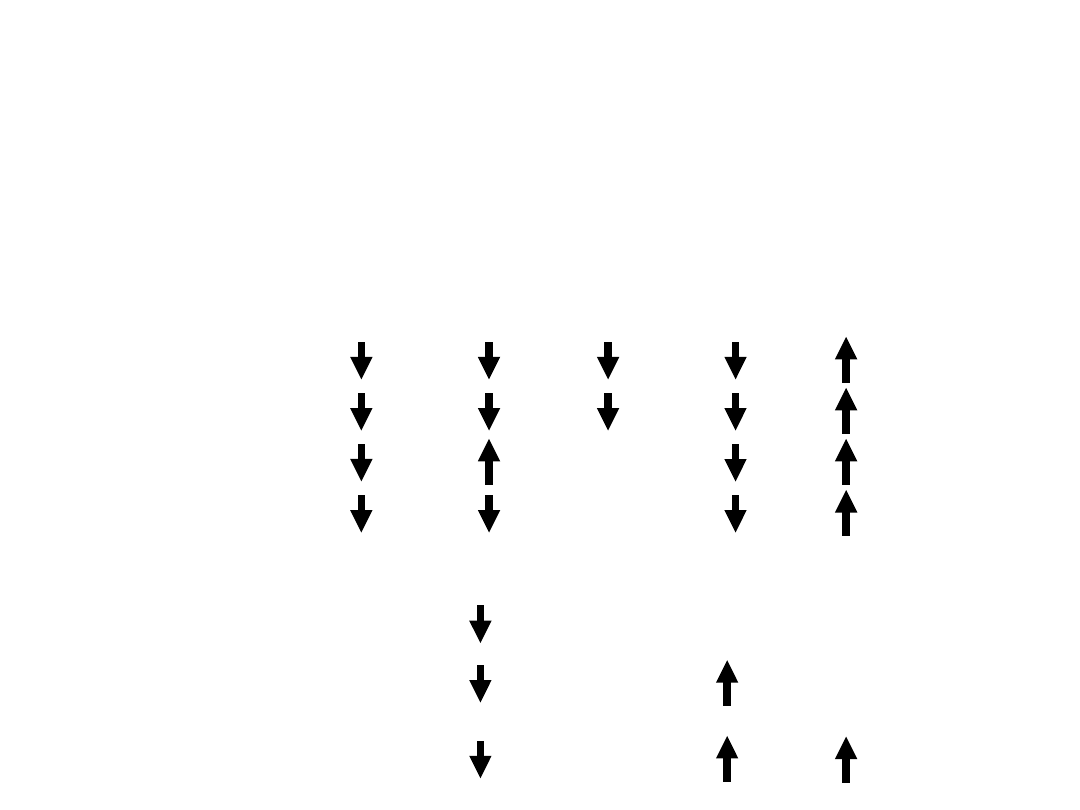
10
Hormony systemowe – wpływające na
obrót kostny
Wzrost tworzenia kości
lub zmniejszona
resorpcja kości
Zmniejszenie tworzenia
kości lub zwiększona
resorpcja kości
Estrogeny
Kalcytonina
Kortykosterydy
GH
Hormony tarczycy
Wit. A
PTH
11
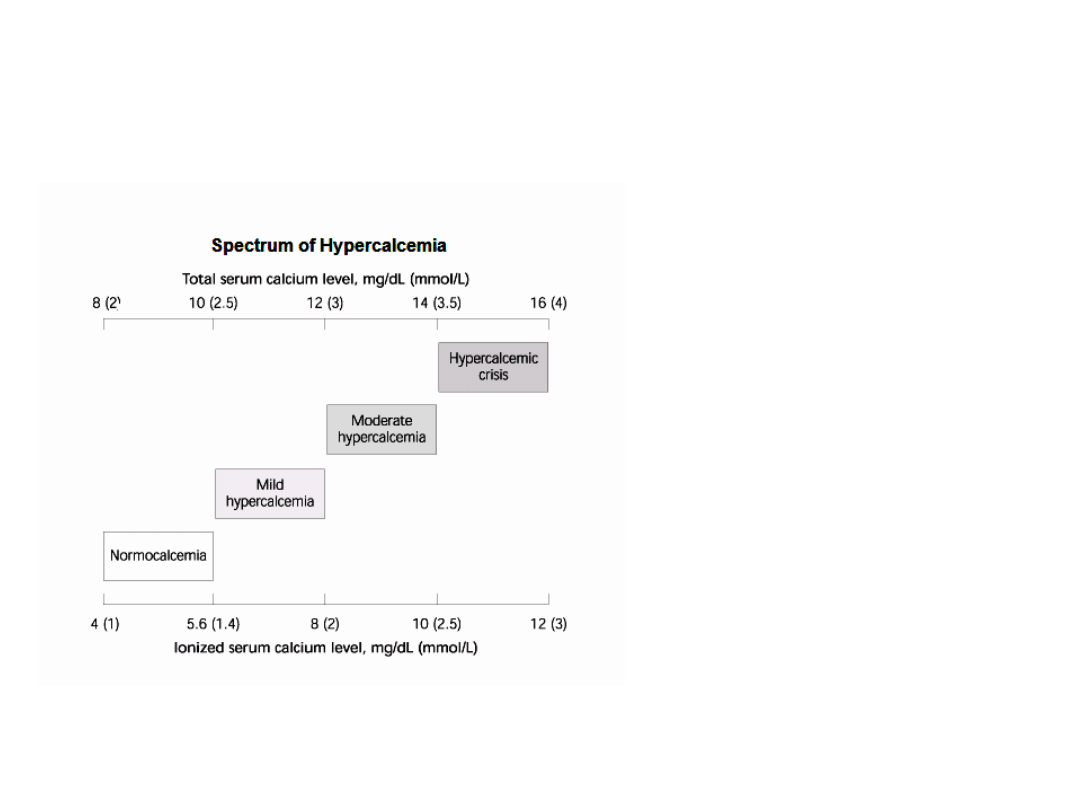
Hiperkalcemia
wyższe niż normalne stężenie wapnia we krwi.
Normalne stężenie wapnia
i fosforanów we krwi i
płynach
zewnątrzkomórkowych jest
bliskie punktowi
wysycenia;
Ich wzrost może prowadzić
do rozsianej precypitacji
fosforanów wapnia w
tkankach – prowadząc w
konsekwencji do
uszkodzenia i
niewydolności narządów.
Am Fam Physician 2003;67:1959-66

12
Objawy hiperkalcemii
Mięśnie
szkieletow
e
Zmiany
przewodnictwa
nerwowego
- Zawroty głowy
- Splątanie
- Zaburzenia mowy
- Otępienie i śpiączka
- Zmiany osobowościowe i
behawioralne
- Osłabienie odruchów głębokich ze
ścięgien
Zaburzeni
e
Patomechaniz
m
Układ
- Osłabienie mięśni
- Zmęczenie mięśni
- Utrata tonu
mięśniowego
Nerwowy
Podwyższenie progu
pobudliwości komórek
mięśni szkieletowych.
Wysoki wapń – zmniejszenie
przepuszczalności błony
komórkowej dla sodu.

13
Objawy hiperkalcemii
Zaburzeni
e
Patomechaniz
m
Układ
Układ
pokarmowy
- Suchość jamy ustnej
- Pragnienie
- Wymioty
- Zaparcia
Podwyższenie
progu pobudliwości
mięśni gładkich.
Układ
moczowy
- polyuria
- nocturia
Niewrażliwość kanalika dystalnego
na ADH, zmniejszona reabsorpcja
sodu i wapnia przez wstępującą
część pętli Henle’go
Przekroczenie iloczynu
rozpuszczalności Ca x Pi
- kamienie nerkowe
- zwapnienia w
miąższu nerek

14
Objawy hiperkalcemii
Zaburzeni
e
Patomechaniz
m
Układ
Serce
- częstoskurcz
- niemiarowość serca
- przedłużenie odcinka PR
- skrócenie odcinka QT
Zmiany pobudliwości
tkanki nerwowej i
mięśniowej.
- osteomalacja
- bóle kości,
- wrażliwość kości na
urazy
- złamania kości
Układ
kostno-
stawowy
Wzrost resorpcji kości –
zwiększona aktywność
osteoklastów.

15
Klasyfikacja przyczyn hiperkalcemii I
1.
Związane z przytarczycami
:
a) Pierwotna nadczynność przytarczyc
b) Terapia litem
c) Rodzinna hipokalciuria z hiperkalcemią
2.
Związane z chorobami nowotworowymi
:
a)
Lite guzy z przerzutami do kości (rak piersi)
b)
Lite guzy z humoralną hiperkalcemią
c)
Nowotwory hematologiczne – szpiczak mnogi, chłoniaki,
białaczki
3.
Związane z witaminą D
:
a)
Zatrucie witaminą D
b)
Wzrost 1,25(OH)2D, sarkoidoza, choroby ziarniniakowe
c)
Idiopatyczna hiperkalcemia noworodków

16
Klasyfikacja przyczyn hiperkalcemii II
4. Związane z wysokim obrotem kostnym
:
•
Nadczynność tarczycy
•
Unieruchomienie
•
Zatrucie witaminą A
5. Związane z niewydolnością nerek:
•
Poważna wtórna nadczynność przytarczyc
•
Zatrucie aluminium
•
Milk alkali syndrome

17
Najczęstsze przyczyny
hiperkalcemii
• 35 % pierwotna nadczynność
przytarczyc
• 55 % nowotwory
• 10 % inne

18
Mechanizmy hiperkalcemii I
Nadmierna produkcja PTH
1. Pierwotna nadczynność przytarczyc
– zwykle guz
(gruczolak) – wydziela PTH bez kontroli.
Połowa pacjentów nie ma objawów; przewlekły wzrost stężenia
wapnia we krwi.
Najczęstsze objawy:
a) kamienie nerkowe – 60-70%,
b) osteitis fibrosa cystica – 10-25%
-
zmniejszona ilość beleczek
kostnych, wzrost ilości osteoklastów, zastąpienie elementów tkanki
kostnej tkalną łączną włóknistą.
c)
objawy ze strony centralnego układu nerwowego, nerwów
obwodowych i mięśni
.
2.
Rodzinna hipokalciuria z hiperkalcemią
– rzadka,
genetycznie uwarunkowana, dziedziczona autosomalnie dominująco;
najczęściej mutacje dotyczą genu receptora czujnika wapnia.

19
Mechanizmy hiperkalcemii II
Choroby nowotworowe
1.
Choroby nowotworowe z przerzutami do kości
(bone metastases, local osteolytic hypercalcemia – LOH)
Hiperkalcemia w chorobach nowotworowych jest efektem lokalnych
zmian osteolitycznych kości – jako skutek przerzutów
nowotworowych.
2. Nowotwory hematologiczne.
Najprawdopodobniej – zajmując szpik kostny, niszczą lokalnie kość
powodując hiperkalcemię.

20
Mechanizmy hiperkalcemii II
Choroby nowotworowe
3. Humoralna hiperkalcemia nowotworowa (Humoral
hypercalcemia of malignancy – HHM).
Hiperkalcemia jest efektem zwiększonego uwalniania wapnia z kości pod
wpływem PTH-rP (parathyroid-hormone related protein).
Zespół rozwija się w przebiegu większości nowotworów
płaskonabłonkowych,
nowotworów nerek, jajników.
Substancja PTH-rP działa podobnie do PTH na kość –
zwiększa
resorpcję kości
,
nie posiada działania na przewód pokarmowy i nie stymuluje reabsorpcji
wapnia
przez nerkę.

21
Mechanizmy hiperkalcemii III
Związane z witaminą D
1. Zwiększone spożycie.
Przewlekłe nadmierne spożycie witaminy D, zwykle 50-100 razy
przekraczające normę; wzrost 25(OH)D we krwi (świadczy o
nadmiernym spożyciu witaminy D); oraz w konsekwencji
prawdopodobnie wzrost 1,25(OH)
2
D.
Skutek: zwiększone jelitowego wchłanianie wapnia.
2.
Nienormalny metabolizm witaminy D.
W sarkoidozie – pozytywna korelacja między 25(OH)D i 1,25(OH)
2
D. Nowe
miejsce hydroksylacji – makrofagi lub inne komórki ziarniny. Brak
regulacji hydroksylacji przez PTH i poziom wapnia; wzrost spożycia
wapnia nie powoduje zmniejszenia syntezy 1,25(OH)2D u pacjentów.
3. Idiopatyczna hiperkalcemia noworodków
(Zespół
Wiliam’sa)
.
Nadmierna wrażliwość na witaminę D; hiperkalcemia rozwija się już przy
spożyciu 2000 do 4000 jednostek/dzień. Podwyższony poziom
1,25(OH)2D w surowicy. Zwiększone wchłanianie wapnia w jelicie.

22
Mechanizmy hiperkalcemii IV
Związane z wysokim obrotem
kostnym
1. Nadczynność tarczycy.
Zwiększona resorpcja kości w stosunki do formowania kości. Bezpośrednie
działanie hormonów tarczycy na kość.
2.
Unieruchomienie.
Rzadko u dorosłych bez dodatkowych chorób, raczej u dzieci i młodych
dorosłych.
Mechanizm – dysproporcja pomiędzy tworzeniem kości i resorpcją kości w
wyniku nagłej utraty ciążenia. Hiperkalciuria i mobilizacja wapnia z
kości u osób poddanych długotrwałemu leżeniu (zwykle bez
hiperkalcemii).
3. Zatrucie witaminą A.
Zwiększa resorpcję kości.

23
Mechanizmy hiperkalcemii V
1. Niewydolność nerek.
Zaburzenia resorpcji zwrotnej – niskie stężenie wapnia we krwi – ciągła
sekrecja PTH w celu przywrócenia stężenia wapnia do normy.
Skutek:
Wtórna nadczynność przytarczyc
– choroba nie dotyczy
bezpośrednio przytarczyc, PTH jest produkowany z innego powodu.
2. Zespół Burnett’a (Milk-Alkali Syndrome)
– efekt spożywania
przetworów mlecznych bogatych w łatwo przyswajalny wapń oraz
jednoczesnego przyjmowania leków alkalizujących (antiacida).
Podawanie leków alkalizujących alkaloza;
Dieta wysokowapniowa hiperkalcemia supresja PTH;
Niskie PTH zwiększa reabsorpcję proksymalną HCO3- nasilenie
alkalozy;
Niskie PTH hiperfosfatemia;
Hiperkalcemia i hiperfosfatemia – kalcyfikacja nerek i rozwój
niewydolności nerek.

24
Najczęstsze przyczyny
hipokalcemii
1. Niedoczynność przytarczyc
– pierwotna,
wtórna, rzekoma.
2. Rodzinna hipokalcemia z hiperkalciurią
–
defekt receptora wapniowego (CaR)
3. Niedobór witaminy D3

25
Objawy hipokalcemii
Nerwy i
mięśnie
• Zwiększona
pobudliwość
przewodnictwa
nerwowego,
• Wzrost
pobudliwości
nerwowo-
mięśniowej,
- Parestezje
- Skurcze mięśni szkieletowych
- Nadmierne efekty pobudzenia – objaw
Chvostka – uderzenie w nerw VII –
grymas twarzy
- Tężyczka,
- Skurcz krtani
Zaburzenia psychiczne
Niepokój
Splątanie
Nadpobudliwość
przewodnictwa nerwowego
Zwapnienie tkanek
miękkich, łamliwość
paznokci
Hiperfosfatemia

26
Niedoczynność przytarczyc
• Niedobór PTH - niskie stężenie wapnia we krwi i zwiększone
stężenie fosforanów.
• Częsta przyczyna – chirurgiczne usunięcie gruczołów
przytarczyc lub choroba niszcząca gruczoł.
• Hipokalcemia często prowadzi do tężyczki i nadpobudliwości
układu nerwowo-mięśniowego.

27
Rzekoma niedoczynność przytarczyc
Niewrażliwość narządów docelowych na działanie PTH i zwiększona
sekrecja PTH.
1. Defekt receptora
2. Defekt poza receptorowy
Zaburzenia gospodarki wapniowej -
hipokalcemia
28
Krzywica i Osteomalacja
Niedobór vit. D3 lub niedobór wapnia w
diecie.
Krzywica- upośledzona mineralizacja macierzy kostnej w fazie wzrostu i
dojrzewania.
Osteomalacja
–
upośledzona mineralizacja macierzy kostnej ukształtowanego
kośćca.
Zaburzenia
vit. D
Ca
PO
4
25-
D
1,25-
D
Inne
Niedobór Vit. D
PTH & Alk. Phos
Choroby wątroby
PTH & Alk. Phos
Choroby Nerek
N
PTH & Alk. Phos
Niedobór 1-
hydroksylazy
N
PTH & Alk. Phos
Hipofosfate
mia
Nerkowa utrata
fosforanów
N
N
N
Nadmierne
przyjmowanie leków
zobojętniających
N
N
Wrodzona hipofosfatemia
z hyperkalciurią
N
N
Wapń w moczu

29
Hiperfosfatemia
Stan, w którym stężenie fosforanu we krwi przekracza wartość 1.45
mmol/l.
Przyczyny:
1. Zmniejszone wydalanie fosforanu przez nerki – niewydolność nerek,
pierwotna niedoczynność przytarczyc.
2. Przemieszczenie fosforanów do płynu pozakomórkowego: stany
kataboliczne, zmiażdżenia, infekcje, kwasica metaboliczna,
uwalnianie z kości.
Konsekwencje:
- hipokalcemia
- kalcyfikacja tkanek miękkich
- wtórna nadczynność przytarczyc

30
Hipofosfatemia
Stan, w którym stężenie fosforanu w osoczu jest < 1.15
mmol/l.
Przyczyny:
1. Straty nerkowe: pierwotna nadczynność przytarczyc, niedobór
wit. D3.
2. Straty pozanerkowe:
a) przemieszczenie fosforanów do komórek – niedożywienie, kwasica
ketonowa.
b) utrata przez przewód pokarmowy – wymioty, biegunki, zespół złego
wchłaniania
31
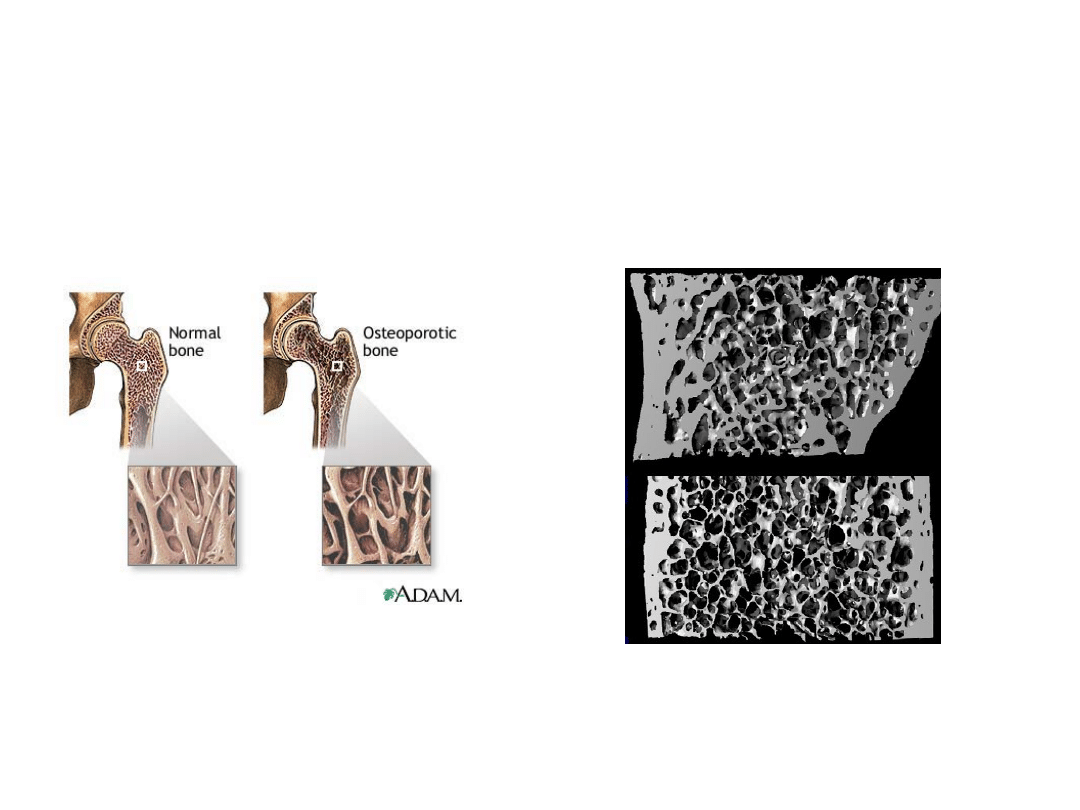
Osteoporoza
Choroba bardzo rozpowszechniona.
30 % kobiet po menopauzie, wśród kobiet 50-letnich – 16-18%.
Osteoporoza – uogólniona choroba układu szkieletowego – mała
masa kości i zaburzenia architektury tkanki kostnej
.

32
Obrót kostny
Kości są nieustannie przebudowywane (remodelling) – w ciągu roku
dochodzi do wymiany 2-10% masy kostnej.
Przebudowa kości trwa przez całe życie. W okresie dzieciństwa i
wczesnej młodości dominuje proces budowy nad resorpcją, ok. 30 rż
człowiek osiąga tzw.
szczytową masę kostną
. Jest ona
uwarunkowana genetycznie.
W okresie późniejszym, zwłaszcza po 45 rż. u kobiet w obrocie kostnym
zaczyna przeważać resorpcja nad syntezą.
Masa i gęstość kości powoli, ale nieustannie maleją.
W warunkach fizjologii roczna utrata masy kostnej wynosi ok. 1%.
Na 2 lata przed menopauzą zaczyna się u kobiet przyśpieszona faza
utraty masy kostnej i trwa ona ok. 10 lat. Utrata roczna – 2% masy
kostnej.
33
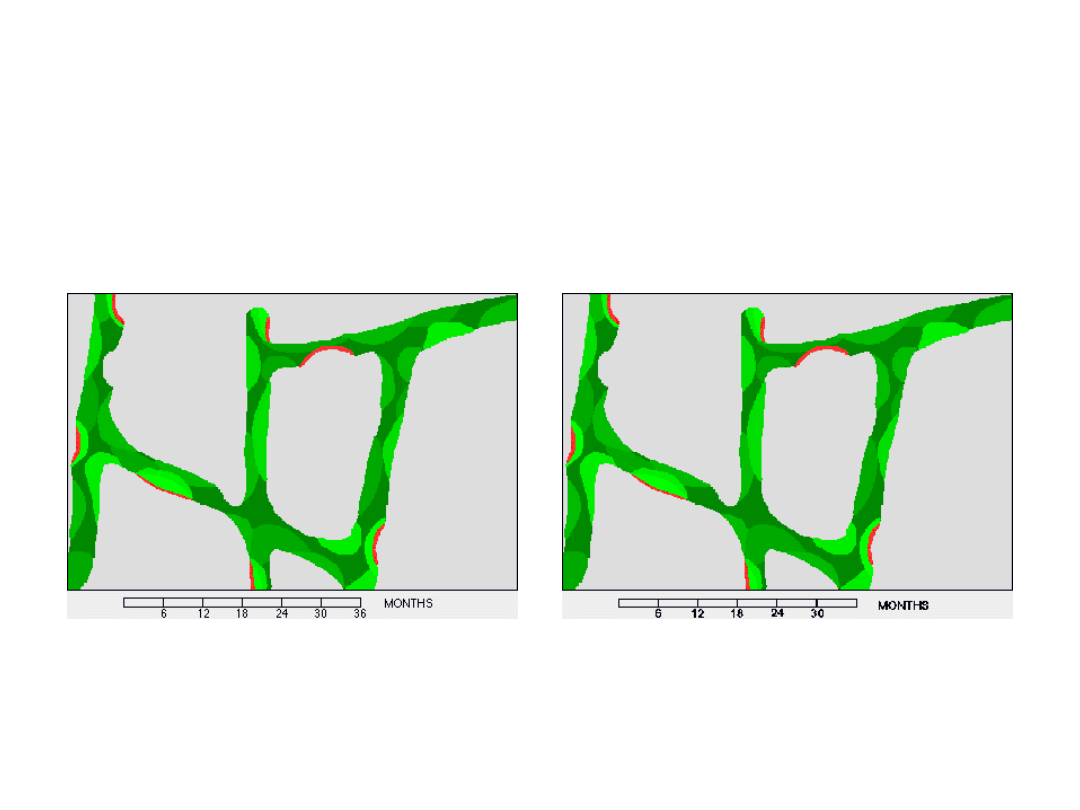
Zmiana obrotu kostnego
Norma
Brak estrogenów
34
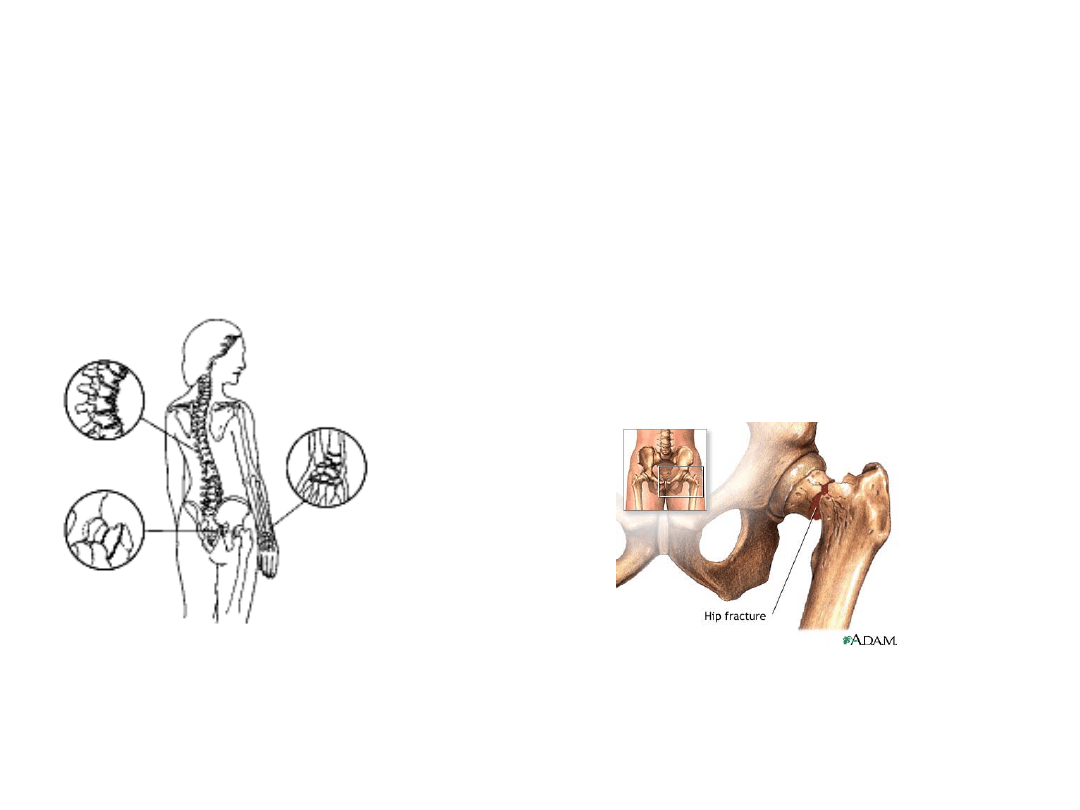
Złamania kości biodrowej, szyjki kości udowej i
kręgów – konsekwencje osteoporozy
U starszych osób - często efekt osteoporozy!!
Skutki:
zmniejszenie wytrzymałości mechanicznej – niewielka
energia kinetyczna może spowodować złamania.
Większość złamań bioder
(międzykrętarzowe i szyjki kości udowej)
oraz kości przedramienia – jest wynikiem
upadku.
35
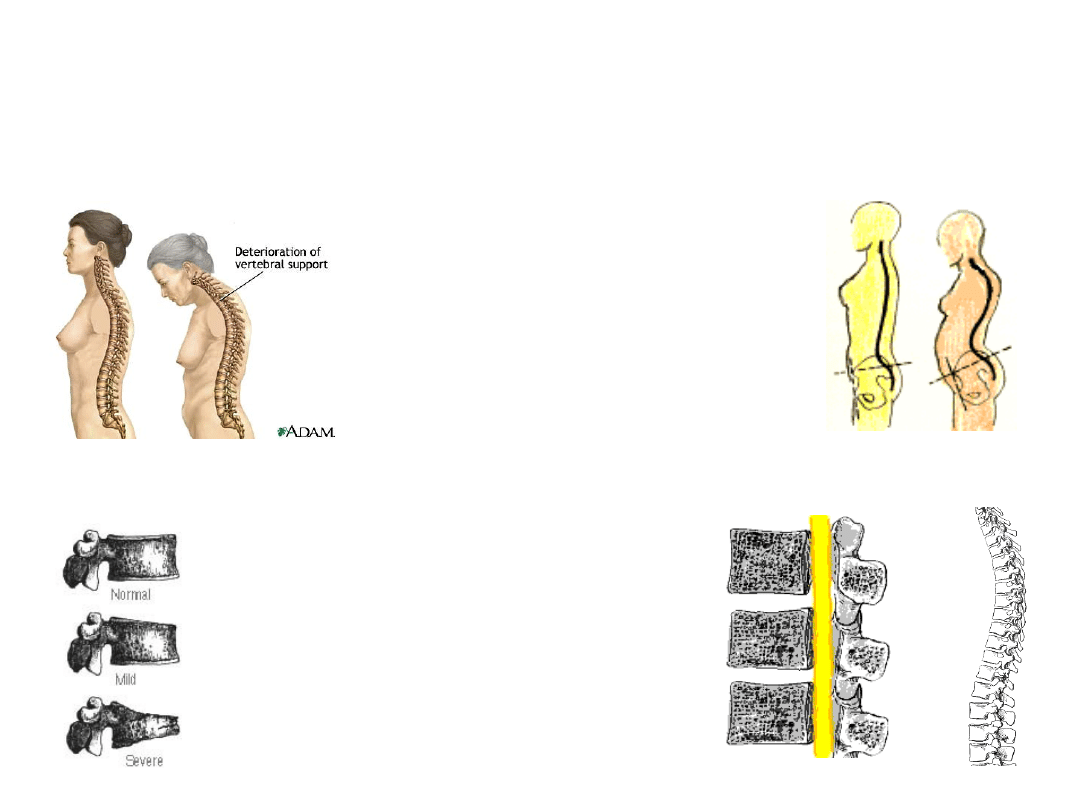
Kompresyjne złamania kręgów – u osób starszych –
spowodowane osteoporozą.
1. Obniżenie wzrostu –
zmniejszenie
wymiarów trzonów
kręgów.
2. „wdowi garb” –
łukowate wygięcie
odcinka piersiowego
kręgosłupa,
nadmierna kyfoza
piersiowa.
3. Wystający brzuch –
zmiana krzywizny
kręgosłupa.
60% kobiet z kompresyjnym
złamaniem kręgów – o tym nie
wie. Brak silnych objawów
bólowych.
36
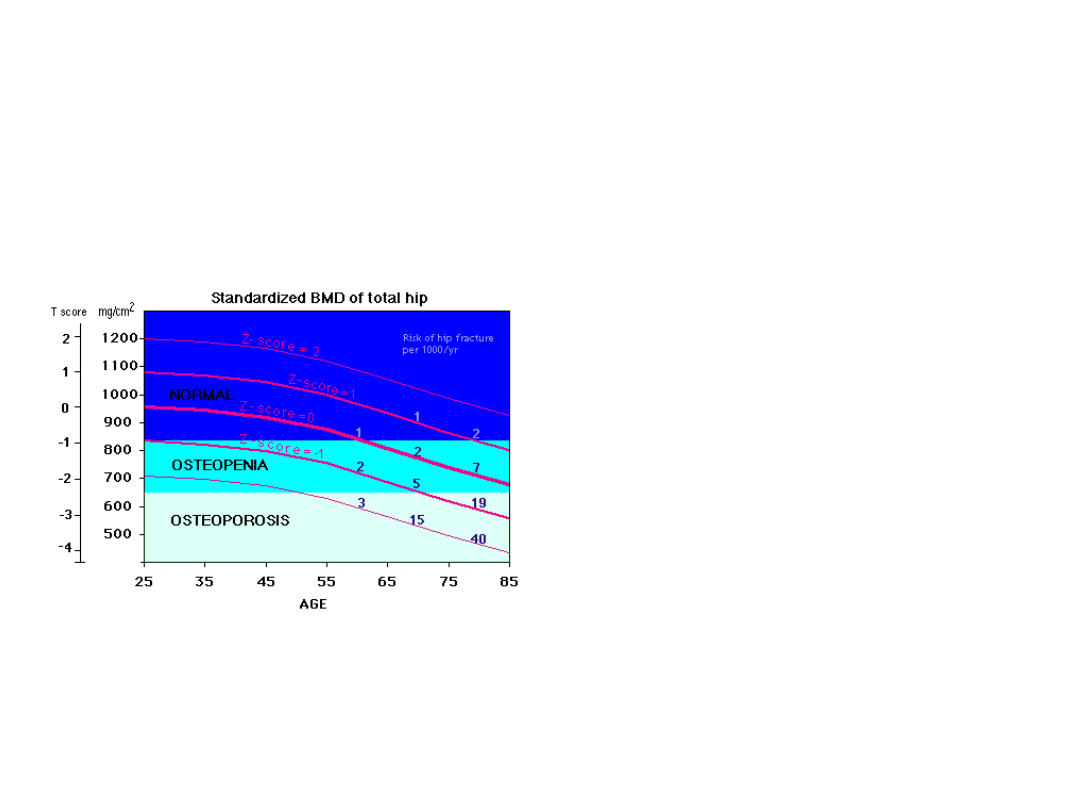
Diagnostyka osteoporozy
BMD (bone mineral density) - ilościowy pomiar gęstości mineralnej
kości.
Densytometria DEXA – dwufotonowa absorpcjometria rentgenowska,
wyniki podawane są w g/cm2.
Klasyfikacja:
Norma – gęstość większa niż 833
mg/cm2
- niższa gęstość – osteopenia –
833 – 648 mg/cm2
- osteoporoza – mniej niż 648
mg/cm2
Wiele badań wykazało zależność pomiędzy gęstością mineralną
kości a ryzykiem wystąpienia złamań oraz ilością złamań.
Ilość złamań biodra 1000/rok.
37
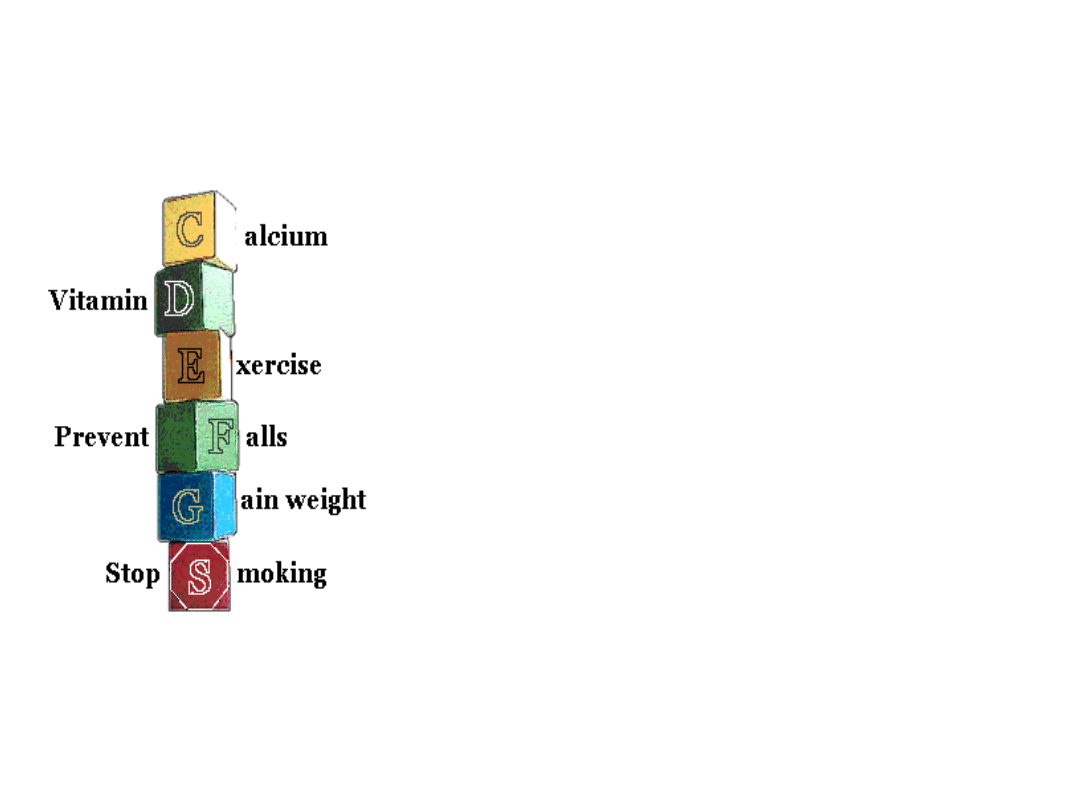
Profilaktyka osteoporozy pierwotnej
Spożywanie dużych ilości wapnia –
dziennie 1000 mg w diecie.
Silna pozytywna korelacja między wagą ciała
a gęstością kości!!
W badaniach – Osteoporotic Fractures -
przybranie na wadze po 25 rż. u kobiet
związane było ze zmniejszonym ryzykiem
złamań.
Ćwiczenia fizyczne – np. aerobik, ale niezbyt
forsowne; biegi długodystansowe – sprzyjają
osteoporozie.
Dzienna dawka vit. D 400 do 800 IU –
optymalizuje wchłanianie wapnia

38
Leczenie farmakologiczne osteoporozy
pierwotnej
1. Estrogeny – udowodnione działanie w zapobieganiu złamań
osteoporotycznych,
5. Przerywane, duże dawki PTH
4. Kalcytonina
3. Raloxifene – selektywny modulator receptora estrogenowego
(SERM), działa podobnie jak estrogeny w zapobieganiu złamań,
ale ma mniejsze skutki negatywne na gruczoł piersiowy i
śluzówkę macicy.
2. Bifosfoniany – u pacjentów z wysokim ryzykiem złamań, są
deponowane w kościach, analogi endogennych, nieorganicznych
pirofosforanów, wiążą się do hydroksyapatytów, hamują resorpcję
kości poprzez hamowanie aktywności osteoklastów.
39
Wpływ leczenia na obrót kostny

40
Osteoporoza wtórna
1. Choroba Cushinga
2. Cukrzyca
3. Nadczynność przytarczyc
4. Nadczynność tarczycy
5. Nowotwory
6. Zespoły złego wchłaniania
7. Niektóre leki: przeciwdrgawkowe, kortykosterydy,
zobojętniacze zawierające aluminium
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
12 Patomechanizmy zaburzeń gospodarki wapniowo fosforanowej osteoporozaid 13289 ppt
Patomechanizmy zaburzeń gospodarki wapniowo fosforanowej; osteoporoza
GOSPODARKA WAPNIOWO FOSFORANOWA (2)
Choroby przytarczyc i zaburzenia gospodarki wapniowo fosforanowej
Gospodarka wapniowo fosforanowa1
Gospodarka wapniowo fosforanowa 2
1 Fizjologia gospodarki wapniowo fosforanowej seminarium dla studentówid 9243 ppt
gospodarka wapniowo fosforanowa
Wyklady kolo 2, Zaburzenia gospodarki wapniowo - fosforanowej
Gospodarka wapniowo-fosforanowa, Pediatria
10 ZABURZENIA GOSPODARKI WAPNIOWO FOSFORANOWEJ
GOSPODARKA WAPNIOWO - FOSFOROWA, Wykłady
Zaburzenia gospodarki wapniowo – fosforanowej, Rat med rok 2, Choroby wewnętrzne
Choroby przytarczyc i zaburzenia gospodarki wapniowo fosforanowej
więcej podobnych podstron