
Gazy
doskonale
Tytuł zagadnienia w programie:
Termodynamika i fizyka cząsteczkowa.
Termodynamika: ciepło i jego ruch w układach.
Termodynamika fenomenologiczna:
opis makroskopowy przy pomocy
takich wielkości jak: ciśnienie, temperatura, objętość, energia,
entropia itp.
Opiera się na zasadach termodynamiki.
Termodynamika statystyczna:
opis mikroskopowy przy pomocy
prędkości, masy, energii, pędu itp., atomów i cząsteczek układu.
Opiera się na mechanice i rachunkach prawdopodobieństwa.
Fizyka cząsteczkowa:
dotyczy fizycznego opisu zjawisk związanych z
zachowaniem się atomów i cząsteczek układu w określonych
warunkach termodynamicznych.
Opiera się na pojęciu gazu fikcyjnego (doskonałego) i gazu i
par
rzeczywistych.

Równanie stanu gazu doskonałego
Gazy rzeczywiste typu wodoru i helu dobrze spełniają równanie
Clapeyrona przy
wysokich temperaturach T i niskich ciśnieniach p
.
,
nRT
pV
gdzie: p - ciśnienie, V - objętość, T – temperatura gazu, R – stała
gazowa (8.314 J/molK), n – liczba moli gazu.
(1
)
Doświadczenia nad własnościami gazów wykazały, że zachowują
się one zgodnie z zależnością:
Równanie (1) nazywamy równaniem stanu gaz. Nosi nazwę
równanie Clapeyrona.
Trzy parametry p, V i T jednoznacznie określające stan pewnej
ilości gazu, to parametry stanu gazu.
Gaz doskonały - fikcyjny gaz, który dokładnie spełniałby
równanie (1).
Gaz doskonały,
to taki gaz w którym brak sił wzajemnego
oddziaływania między jego cząsteczkami a cząsteczki zachowują
się jako sprężyste kulki o znikomo małych rozmiarach.
Dla 1 mola dowolnego gazu liczba cząsteczek jest stała równa
liczbie Avogadro i.e. N
A
= 610
23
cząsteczek/mol. Wtedy
,
A
kT
N
pV
(2
)
gdzie: k = 1.3810
-23
J/K. (k – stała
Boltzmanna)
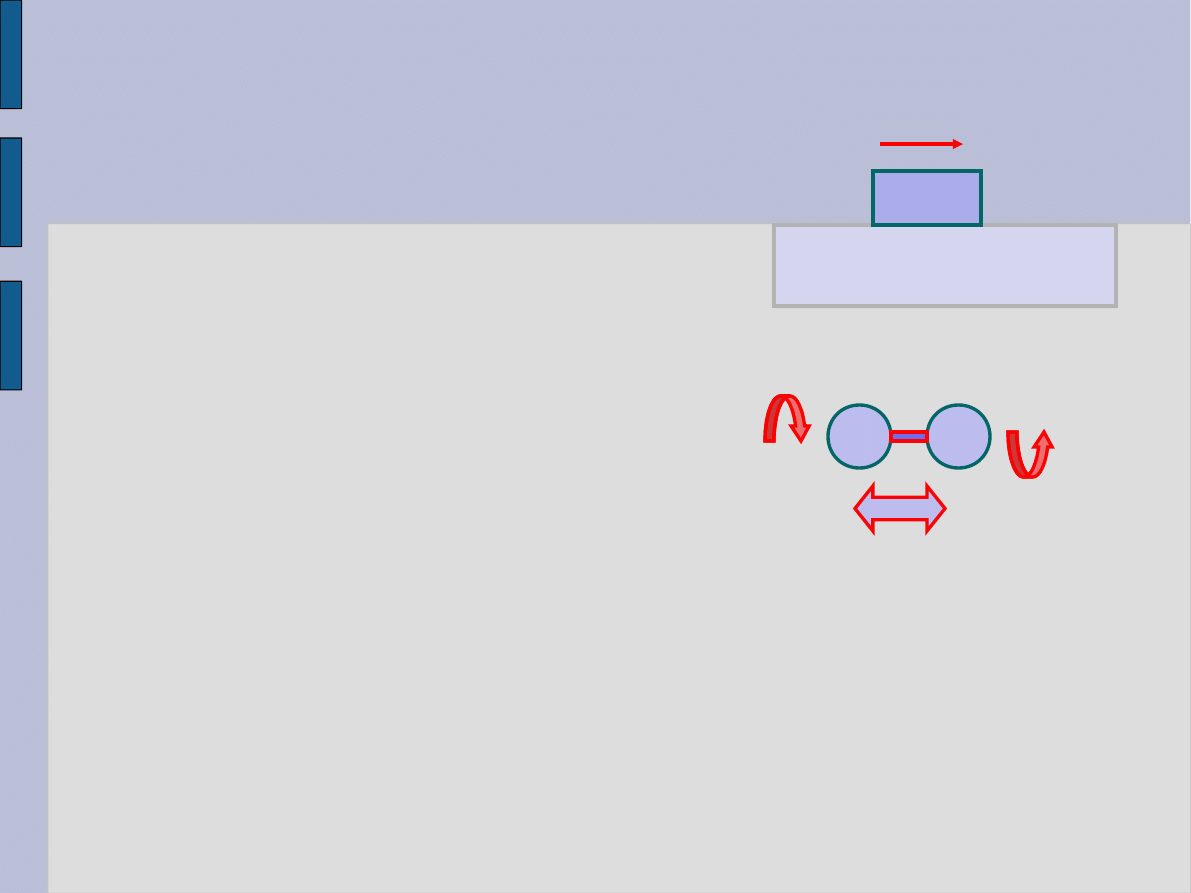
Energia wewnętrzna i ciepło
Rozważmy pchanie bloku na powierzchni innego
ciała.
.
F
F
F
F
zew
tarcie
zach
wyp
F
zew
– zewnętrzna siła do pchania.
Przyrost energii kinetycznej
.
d
)
F
F
(F
kin
zew
B
A
tar
zach
E
s
Wypadkowa siła
gdzie F
tar
’ reakcja na tarcie a F
tar
’ds.= praca wykonana, aby
dostarczyć dodatkowej energii kinetycznej i potencjalnej
indywidualnym cząsteczkom. Praca ta powoduje ogrzewanie
siebie i otoczenia.
Energia przekazana układowi w sposób nie mechaniczny to
ciepło Q
; jednostka ciepła J.
F
zew
Tutaj: F
zach
– siła
zachowawcza.
A
B
,
Δ
d
)
d
(
d
(
d
wew
pot
kin
'
tar
pot
kin
tar
zach
kin
zew
E
E
E
E
E
E
B
A
B
A
B
A
B
A
s
F
s
F
s)
F
s
F
Stąd mamy
rotacja
oscylacja
(1)
(2)
(3)

Zmiana energii wewnętrznej i I zasada
termodynamiki
Energetyczne oddziaływanie układu z jego otoczeniem przejawia
się jako: wymiana ciepła i wykonanie pracy.
W danym stanie układu energia wewnętrzna U ma określoną
wartość. Jeżeli stan układu ulega zmianie, to energia wewnętrzna
układu tez zmienia się.
.
1
2
W
Q
U
U
Siły zewnętrzne powodują zmianę energii wewnętrznej układu ze stanu 1 do 2:
(1)
W przypadku malej zmiany stanu układu równanie (1) można
zapisać w postaci:
(2)
Zmiana energii wewnętrznej układu termodynamicznego jest
równa sumie ciepła oddanego (lub pobranego) przez układ i pracy
wykonanej nad układem przez siły zewnętrzne.
Równanie (1), to pierwsza zasada termodynamiki. Mówi ona:
.
d
d
d
W
Q
U
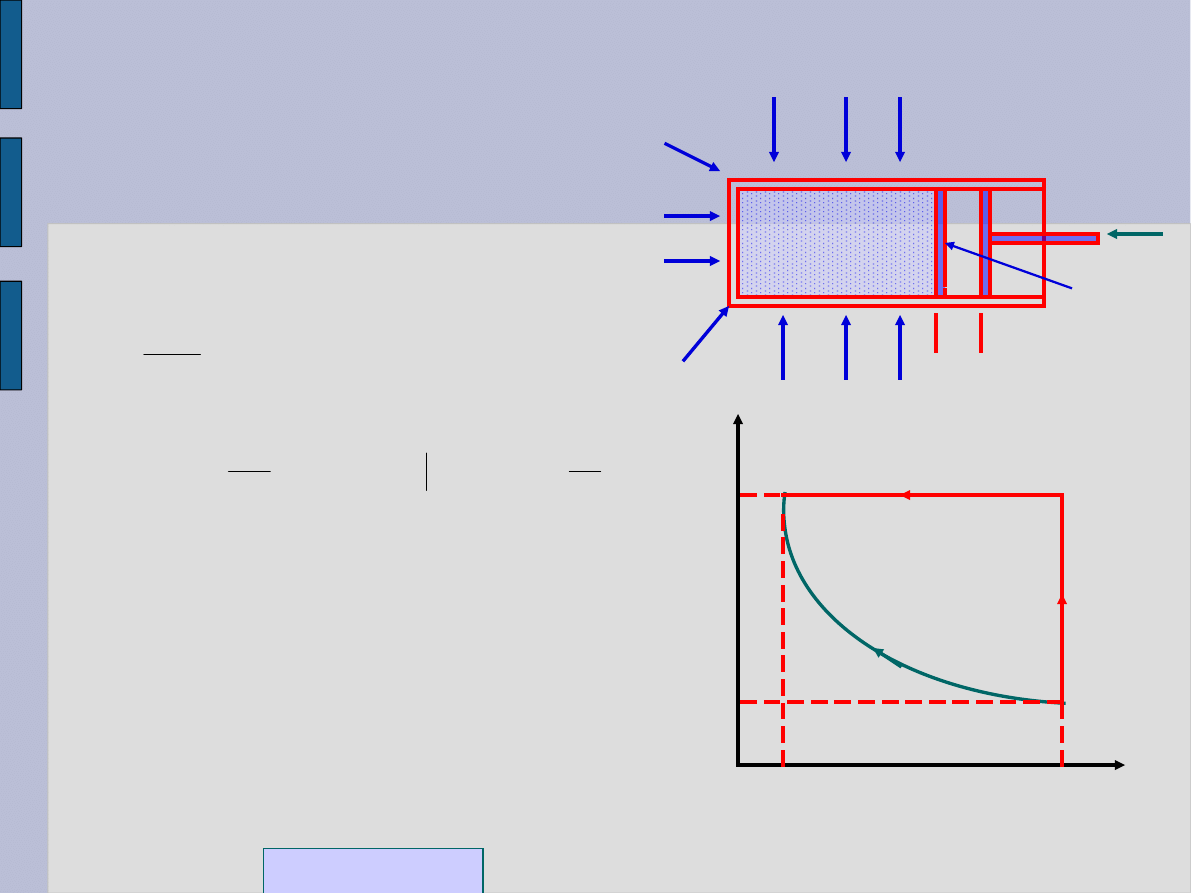
Praca sił ciśnienia gazu
doskonałego
Ciepło Q
Praca wykonana przez siłę
zewnętrzną:
p
V
V
1
V
2
p
2
p
1
F
p
ds
S
W przypadku przemiany
izotermicznej
.
d
d
d
V
p
s
pS
s
F
dW
Praca sił ciśnienia
.
d
2
1
V
V
V
p
W
.
V
nRT
p
Z równań (2) i (3)
mamy
.
ln
ln
d
2
1
2
1
2
1
V
V
nRT
V
nRT
V
V
nRT
W
V
V
V
V
W przemianie izotermicznej
temperatura układu stała; więc nie
ma zmiany w energii wewnętrznej tj.
dU = 0.
(1)
(2)
(3)
(4)
W przypadku przemiany
izobarycznej
.
)
(
d
2
1
2
1
V
V
V
V
p
V
p
W
(5)
Z równań (1) i (3)
otrzymujemy
.
d
d
d
d
Q
T
nR
V
p
W
(6)
Zatem
.
d
const
d
T
Q
Document Outline
Wyszukiwarka
Podobne podstrony:
,pytania na obronę inż,gazy doskonałe półdoskonałe i rzeczywiste
Gazy doskonale id 186794 Nieznany
Gazy doskonałe i rzeczywiste. Lotność, Technologia Chemiczna AGH, inne, Chemia fizyczna
gazy doskonale02
,chemia, Gazy doskonałe, Pod poj˙ciem gazu doskona˙ego ( idealnego ) rozumiemy wyidealizowany stan m
Konkurencja doskonala 2
Wykład 6 konkurencja doskonała
ĆWICZENIA DOSKONALĄCE ODBICIA OBURĄCZ GÓRNE
MP 5 Doskonalenie cech produkcyjnych mikroorganizmów o znaczeniu przemysłowym cz 1
Doskonae serce
Cechy doskonałego rycerza - etos rycerski, j.polski - gimnazjum, Konspekty
Doskonalimy swoją sprawność koordynacyjno-kondycyjną poprzez ćw w obwodzie stacyjnym, Gimnastyka1
więcej podobnych podstron