
Nukleotydopodobne
inhibitory odwrotnej
transkryptazy
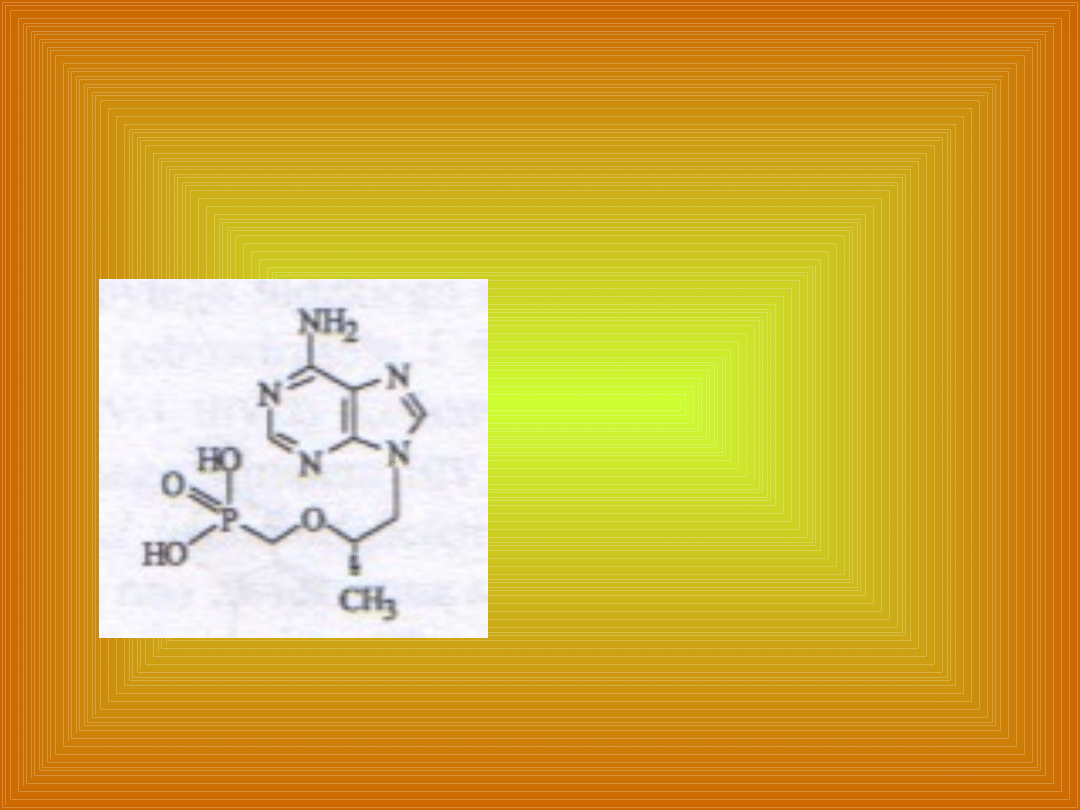
Tenofovir
Fosforan
acyklicznego
analogu adenozyny.
W ustroju ulega
fosforylacji do
difosforanu
tenofowiru.

Nienukleozydowe
inhibitory odwrotnej
transkryptazy (NNRTI)

• Mechanizm działania: inhibicja
allosteryczna
• Nie hamują odwrotnej
transktyptazy HIV-2 i ludzkiej
polimerazy
• NRTI i NNRTI działają
synergistycznie
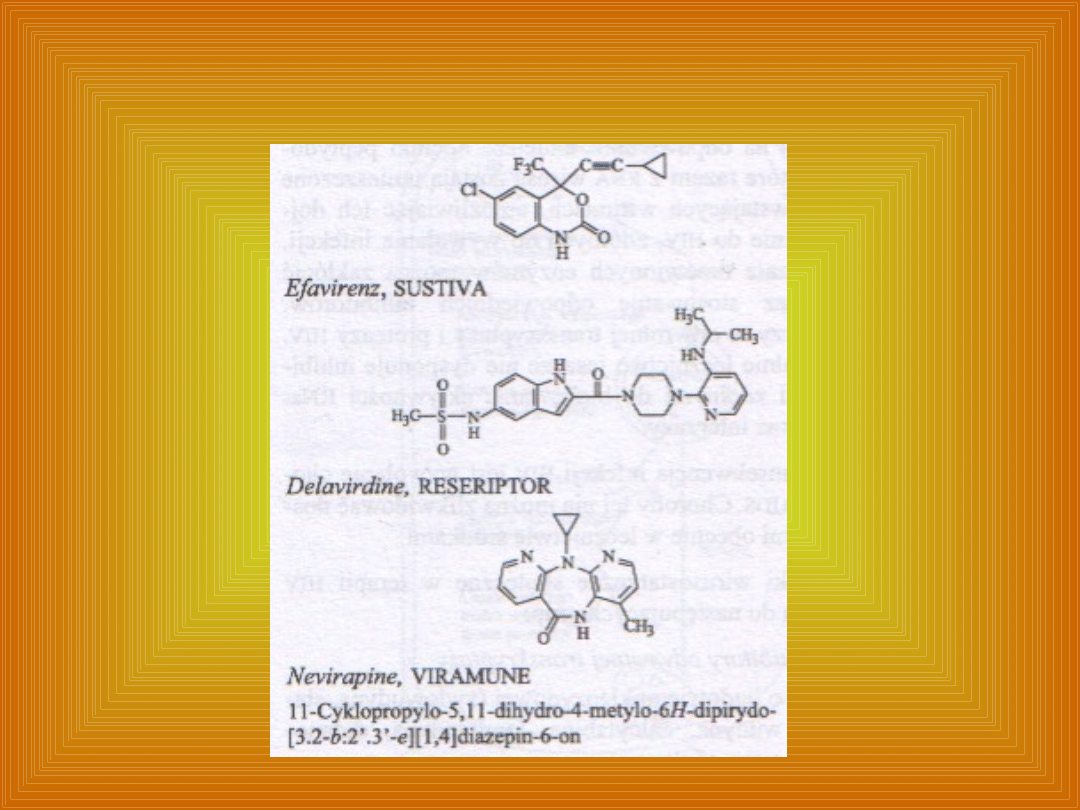
Budowa chemiczna

Farmakokinetyka
• Biodostępność: efawirenz-42%,
delawirdyna-85%, newirapina-93%
• Okres półtrwania w osoczu:
delawirdyna 5-8h, newirapina 25-
30h, efawirenz 40-55h

Metabolizm
• delawirdyna hamuje CYP3A4 i opóźnia
metabolizm: inh. proteazy HIV,
terfenadyny, benzodiazepin, poch.
dihydropirydyny, poch. ergoliny, cizaprydu
• Induktory CYP3A4 przyspieszają jej
rozkład (rifampicyny, rifabutyna,
karbamazepina, barbiturany, fenytoina)
• Newirapina i efawirenz indukują CYP3A4 i
przyspieszają metabolizm I-PT HIV

Działania niepożądane
• Objawy skórne, szczególnie w
przypadku newirapiny i delawirdyny
mogą zagrażać życiu (zespół
Stevensa i Johnsona, zespół Leyella)
• Dolegliwości żołądkowo jelitowe
• Zaburzenia czynności wątroby
• Uczucie zmęczenia

Inhibitory proteazy HIV

Proteaza HIV
• Enzym z grupy aspartyloproteaz
• Ma budowę trójwymiarową
• Składa się z 2 identycznych
łańcuchów peptydowych
• Centrum aktywne zawiera 2
cząsteczki kwasy asparaginowego i
2 cząsteczki wody oraz szereg
aminokwasów hydrofobowych
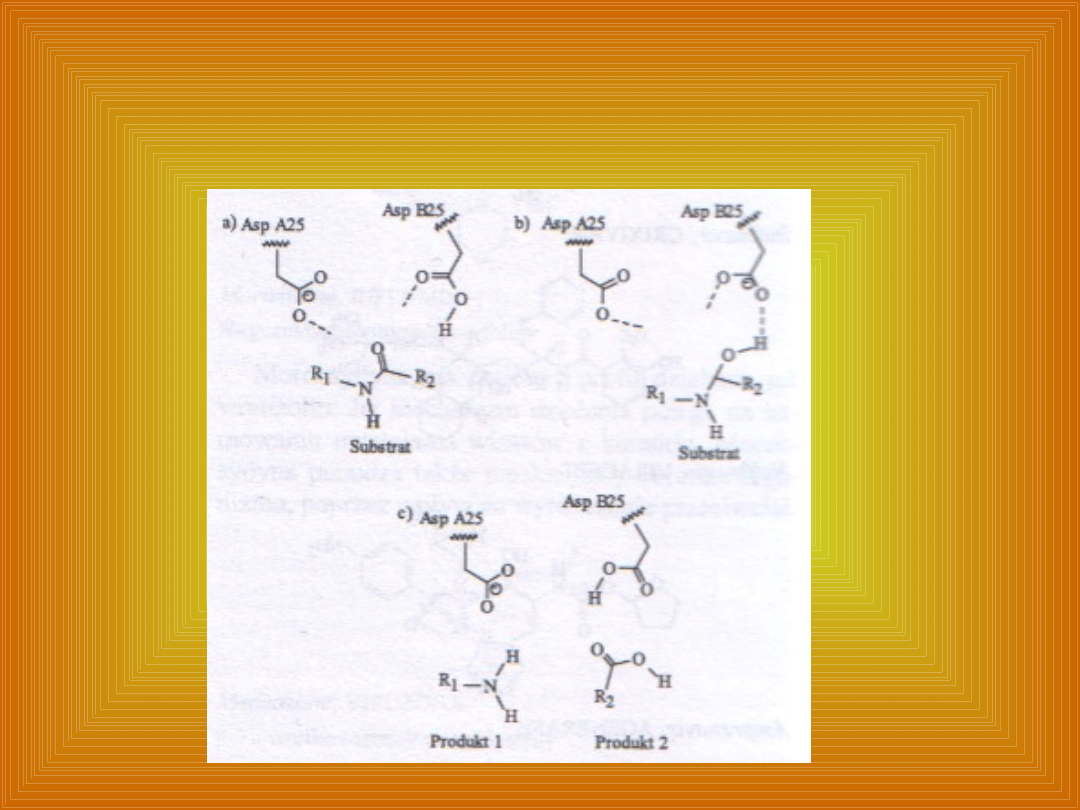
Mechanizm hydrolizy substratu
polipeptydowego przez proteazę
HIV
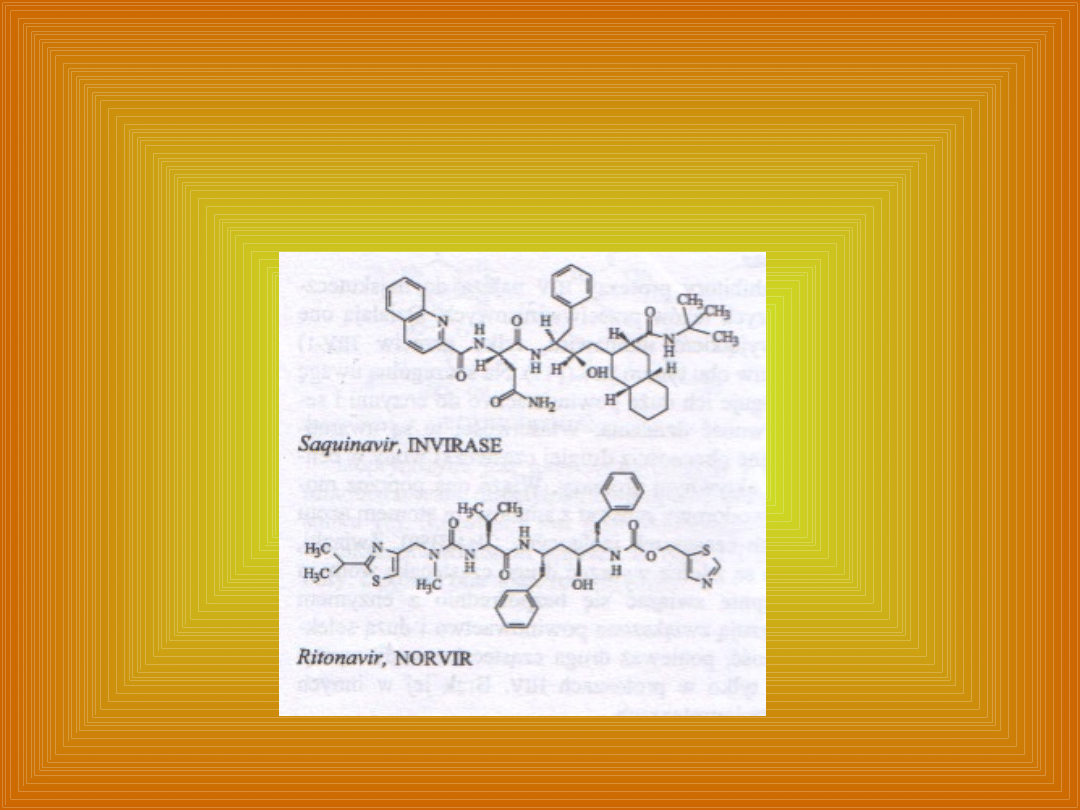
Budowa chemiczna
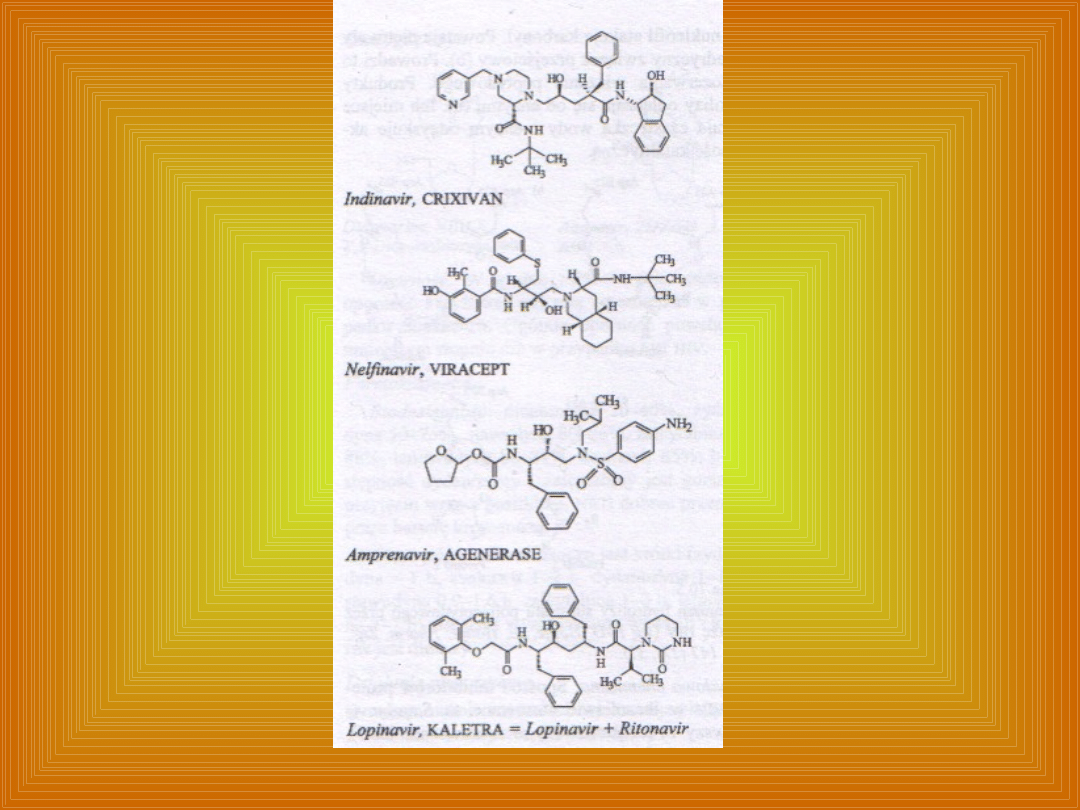

Inhibitory proteazyHIV
• Działają przeciw typom HIV (1 i 2)
• Wykazują duże powinowactwo
enzymu i selektywność działania
• Druga cząsteczka wody w centrum
aktywnym wiąże poprzez mostek
wodorowy substrat z amidowym
atomem azotu 2 cząsteczek
izoleucyny
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
Odwrotna transkryptaza
5 wirusy odwrotnie transkrybujace i ich wlasnosci onkogenne
ODWROTNA TRANSKRYPCJA RT PCR
Odwrotna transkryptaza
Odwrotne transkryptazy, real time PCR
Odwrotna transkryptaza
Inhibitory transkrypcji
Inhibitory aromatazy w leczeniu uzupełniającym raka piersi
BM6 Transkrypcja
inhibicja enzymy wykresy
aldehydy i ketony addycja nukleofilowa
a1 transkrypcja wl
cykliczne nukleotydy
2010 próbny ang transkrypcja
więcej podobnych podstron