
AGH-WIMiR, wykład z chemii ogólnej
Chemia Ogólna
Chemia Ogólna
Wykład 6

AGH-WIMiR, wykład z chemii ogólnej
ELEKTROCHEMIA
ELEKTROCHEMIA
Każda reakcja redoks jest związana z przeniesieniem
elektronu–
elektrony
przechodzą
od
formy
zredukowanej do formy utlenionej.
)
utlenienie
(
odukt
Pr
e
d
Re
)
redukcja
(
odukt
Pr
e
Ox

AGH-WIMiR, wykład z chemii ogólnej
Jeśli procesy utleniania i redukcji zachodzą w tym
samym czasie i miejscu – mamy do czynienia z
procesem chemicznym.
Jeśli procesy utleniania i redukcji są rozdzielone w
czasie i przestrzeni, a wymiana ładunku następuje
poprzez przewodnik elektronów(np. drut metalowy)–
wówczas mówimy o procesie elektrochemicznym.
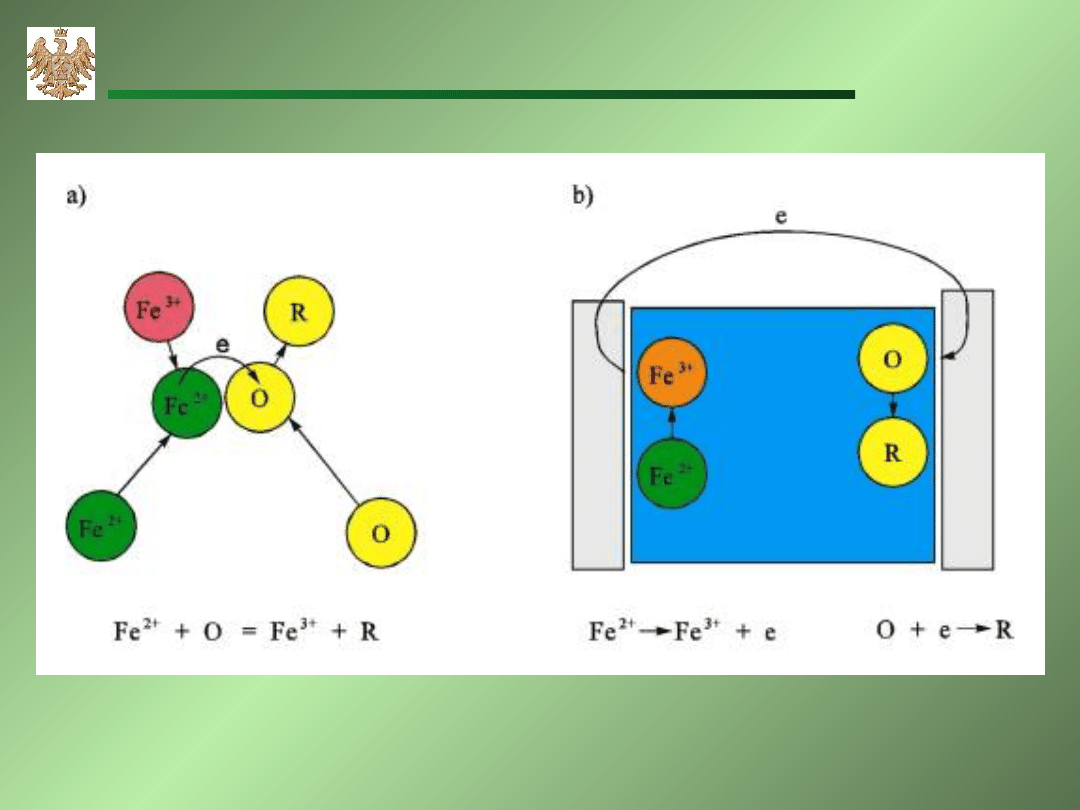
AGH-WIMiR, wykład z chemii ogólnej
Utlenianie żelaza (2+) jako:
a) proces chemiczny, b) proces elektrochemiczny.
AGH-WIMiR, wykład z chemii ogólnej
Elektrody
Elektrody
Elektroda
Elektroda – powierzchnia metalu (lub innego
przewodnika), na której zachodzi reakcja wymiany
ładunku (utleniania, bądź redukcji).
elektroda
elektroda
anoda
katoda
utlenianie
redukcja

AGH-WIMiR, wykład z chemii ogólnej
Pierwiastek w równowadze ze swoimi jonami.
Elektrody te dzielimy na gazowe i metaliczne.
Elektrody gazowe
Elektrody gazowe
Me│X│X
n-
– przewodnik metaliczny (najczęściej platyna),
obmywany gazową postacią pierwiastka, zanurzony
w roztworze jonów danego pierwiastka.
X + ne X
n-
lub
X X
n+
+ ne
Elektrody I rodzaju
Elektrody I rodzaju
AGH-WIMiR, wykład z chemii ogólnej
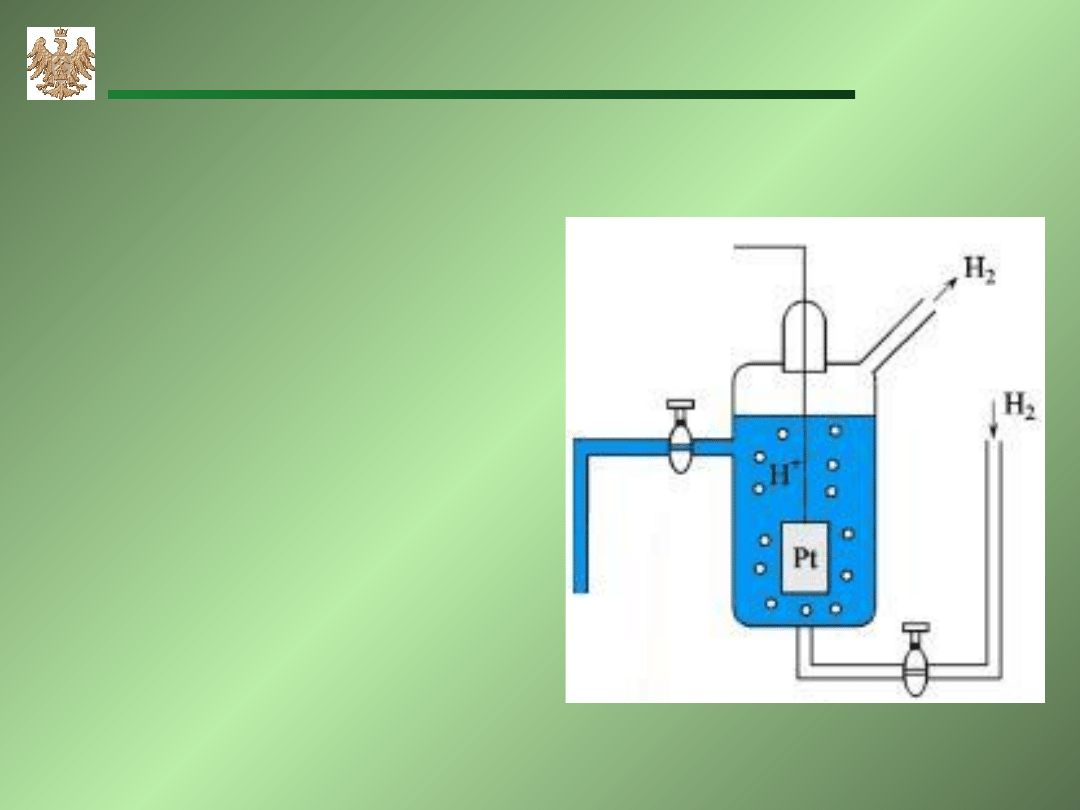
Normalna Elektroda Wodorowa(NEW)
Normalna Elektroda Wodorowa(NEW)
Przewodnik
elektronów
(platyna pokryta czernią
platynową) zanurzony
w kwasie solnym (HCl) o
aktywności a=1, nasycany
gazowym wodorem (H
2
)
pod ciśnieniem 1 atm.
(p=1atm.=101 325 Pa).
E
0
= 0,000V
PtH
2
H
+
AGH-WIMiR, wykład z chemii ogólnej
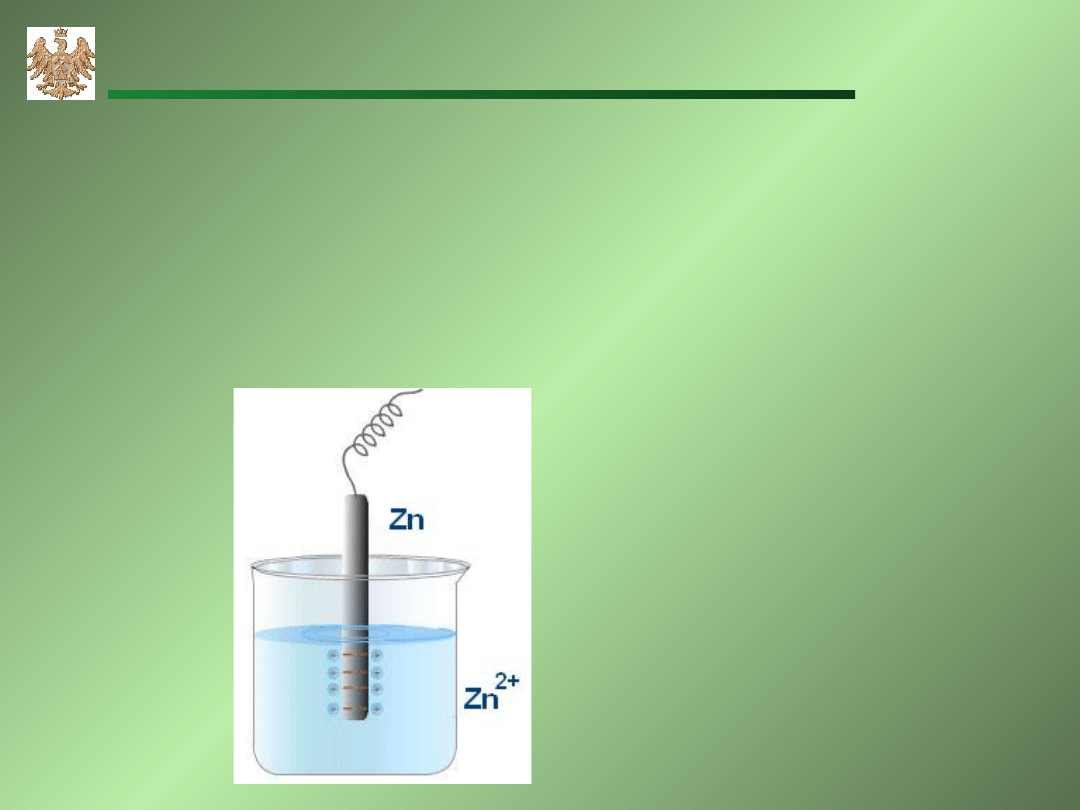
Elektrody metaliczne
Elektrody metaliczne
Me│Me
n+
– metali zanurzony w roztworze jonów własnych
Me Me
n+
+ ne
Zn Zn
2+
+2

AGH-WIMiR, wykład z chemii ogólnej
Metal pokryty swoją trudno rozpuszczalną solą
w równowadze z roztworem soli innego metalu
o takim samym anionie.
Me
1
│Me
1
A
(s)
│Me
2
A
Elektrody II rodzaju
Elektrody II rodzaju
AGH-WIMiR, wykład z chemii ogólnej
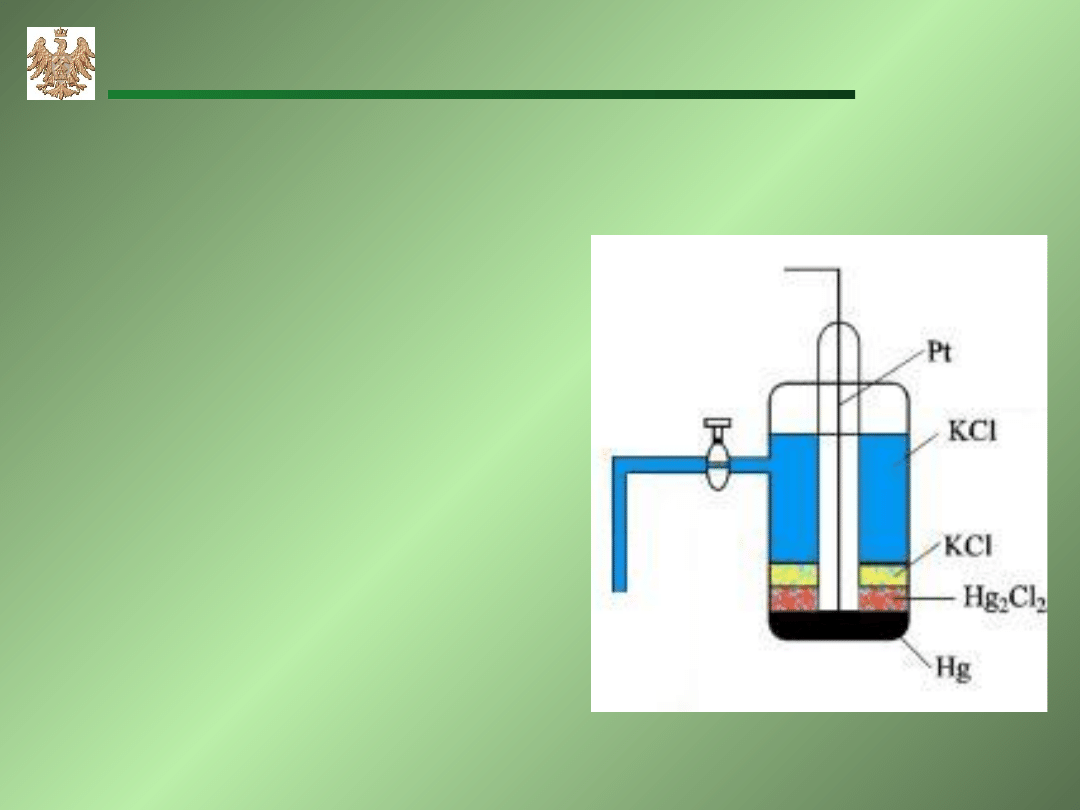
Nasycona Elektroda Kalomelowa (NEK)
Nasycona Elektroda Kalomelowa (NEK)
Przewodnik elektronów (Pt)
połączony
z
metaliczną
rtęcią
(Hg)
pokrytą
kalomelem – chlorkiem rtęci
(I) (Hg
2
Cl
2
) w nasyconym
roztworze (KCl).
E
0
= 0,241V
HgHg
2
Cl
2
Cl
-

AGH-WIMiR, wykład z chemii ogólnej
Szybkość reakcji elektrochemicznej
Szybkość reakcji elektrochemicznej
d
Re
ne
Ox
R
O
O
,
R
–
współczynniki stechiometryczne.
v
v
W stanie równowagi:
Wiedząc, że:
dt
dc
v
oraz:
v
M
m
c

AGH-WIMiR, wykład z chemii ogólnej
Szybkość reakcji można zdefiniować jako:
dt
dm
v
Zgodnie z prawem Farday’a:
F
n
t
I
M
t
I
k
m
m - masa substancji,
k – równoważnik elektrochemiczny,
I - prąd,
t - czas,
M - masa molowa,
n – liczba wymienionych elektronów,
F – stała Faraday’a(96 485 C/mol).

AGH-WIMiR, wykład z chemii ogólnej
Łącząc poprzednie wzory otrzymujemy:
F
n
I
M
dt
dm
v
M
v
F
n
I
0
I
I
I
Prąd anodowy jest równy prądowi katodowemu i osiąga
wartość I
0
zwaną
prądem wymiany.
prądem wymiany.

AGH-WIMiR, wykład z chemii ogólnej
Wiedząć, że szybkość reakcji jest proporcjonalna do
stężenia, to zaś jest powiązane z aktywnością wzorem:
f
c
a
Można zdefiniować prąd anodowy i katodowy jako:
RT
)
E
E
(
nF
O
0
0
O
e
a
k
F
n
I
RT
)
E
E
(
nF
)
1
(
R
0
0
R
e
a
k
F
n
I
k
0
– stała szybkości reakcji,
a
O
,a
R
– aktywności formy utlenionej i zredukowanej,
- współczynnik symetrii bariery energetycznej,
E
0
- potencjał normalny.

AGH-WIMiR, wykład z chemii ogólnej
Porównując do siebie prawe strony poprzednich
równań otrzymany
równanie
równanie
Nernst’a
Nernst’a :
R
O
R
O
0
a
a
ln
nF
RT
E
E
Potencjał normalny
Potencjał normalny – potencjał elektrody mierzony
względem NEW (normalnej elektrody wodorowej),
której potencjał wynosi 0.

AGH-WIMiR, wykład z chemii ogólnej
Ogniwo galwaniczne
Ogniwo galwaniczne
Ogniwo galwaniczne
Ogniwo galwaniczne – dwie elektrody zanurzone w
elektrolitach, połączone przewodnikiem elektronów i
mostkiem elektrolitycznym.
Mostek (klucz) elektrolityczny jest to najczęściej U–
rurka
wypełniona
neutralnym
elektrolitem,
pozwalającym na wymianę ładunku bez mieszania
elektrolitów.

AGH-WIMiR, wykład z chemii ogólnej
Ogniwo galwaniczne

AGH-WIMiR, wykład z chemii ogólnej
Pomiar potencjału elektrodowego
Pomiar potencjału elektrodowego
Elektroda odniesienia
Elektroda odniesienia – elektroda wykazująca
potencjał niezmienny w czasie.
Najważniejsze elektrody odniesienia:
• normalna elektroda wodorowa (NEW),
• nasycona elektroda kalomelowa (NEK),
• nasycona elektroda chlorosrebrna (Ag/AgCl/Cl
–
).

AGH-WIMiR, wykład z chemii ogólnej
Szereg napięciowy
Szereg napięciowy
Poencjał normalny elektrody metalowej
Poencjał normalny elektrody metalowej –
potencjał
metalu
zanurzonego
w
elektrolicie
zawierającym jony tego metalu zmierzony względem
NEW.
Szereg
napięciowy
Szereg
napięciowy
–
metale
ułożone
wg
wzrastającego potencjału normalnego.

AGH-WIMiR, wykład z chemii ogólnej
Potencjały normalne niektórych metali w 25
o
C

AGH-WIMiR, wykład z chemii ogólnej
Ogniwa elektrochemiczne
Ogniwa elektrochemiczne
ogniwa
ogniwa
galwaniczne
elektrolityczne
Spontaniczna
reakcja
redoks
w
ogniwie
powoduje
przepływ
prądu
w
obwodzie
zewnętrznym.
Reakcja redoks w
ogniwie
jest
wymuszana
przez
przepływ prądu z
zewnętrznego źródła
zasilania.
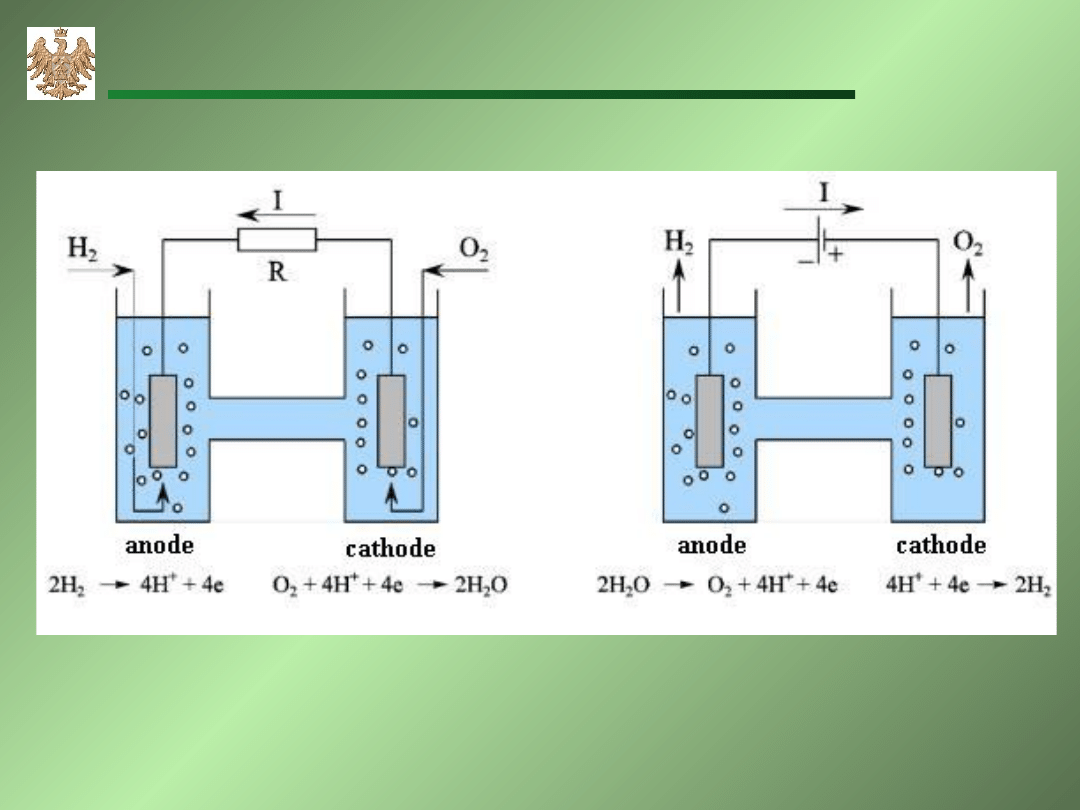
AGH-WIMiR, wykład z chemii ogólnej
Ogniwo PtH
2
H
2
OO
2
Pt pracujące jako:
a) ogniwo galwaniczne, b) ogniwo elektrolityczne.
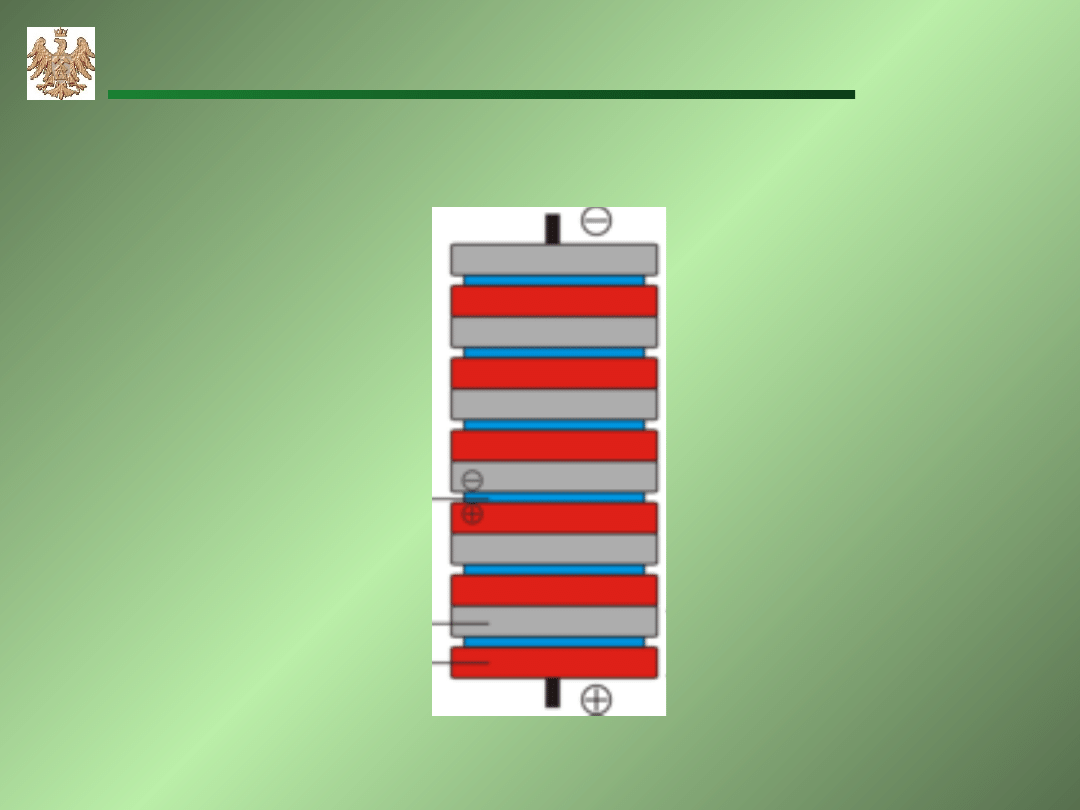
AGH-WIMiR, wykład z chemii ogólnej
Ogniwa galwaniczne
Ogniwa galwaniczne
Stos Volty – pierwsza bateria (1880).
elektrol
it
cynk
miedź
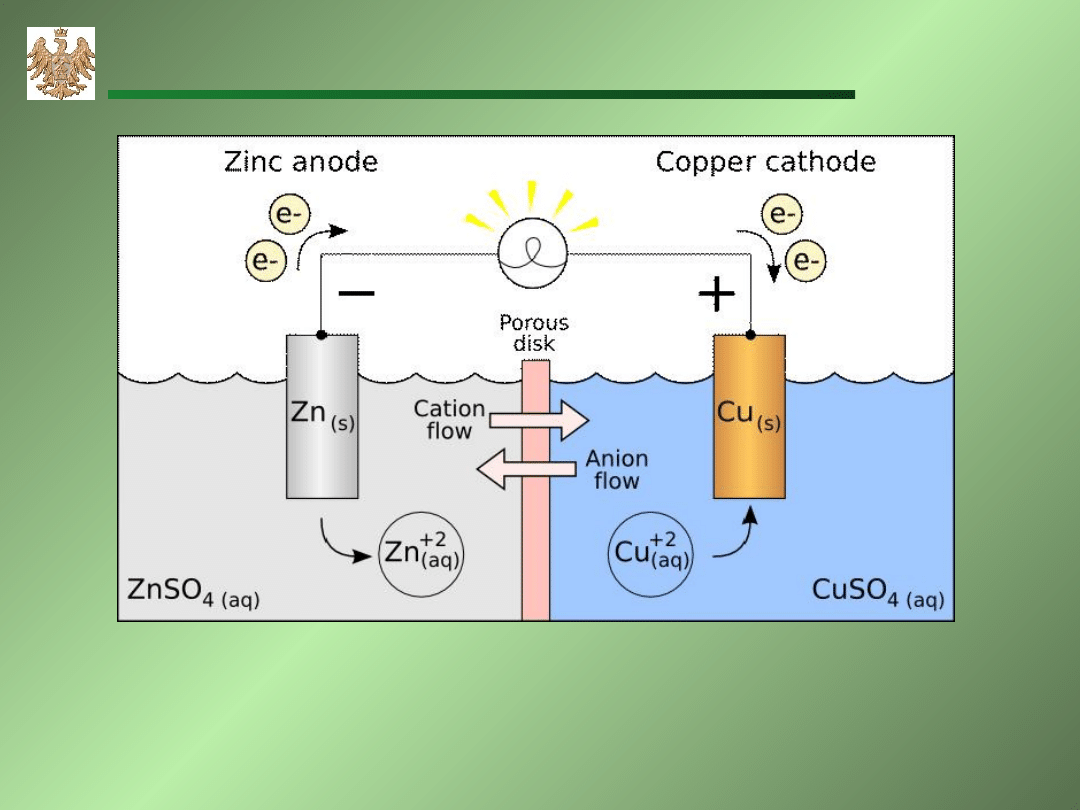
AGH-WIMiR, wykład z chemii ogólnej
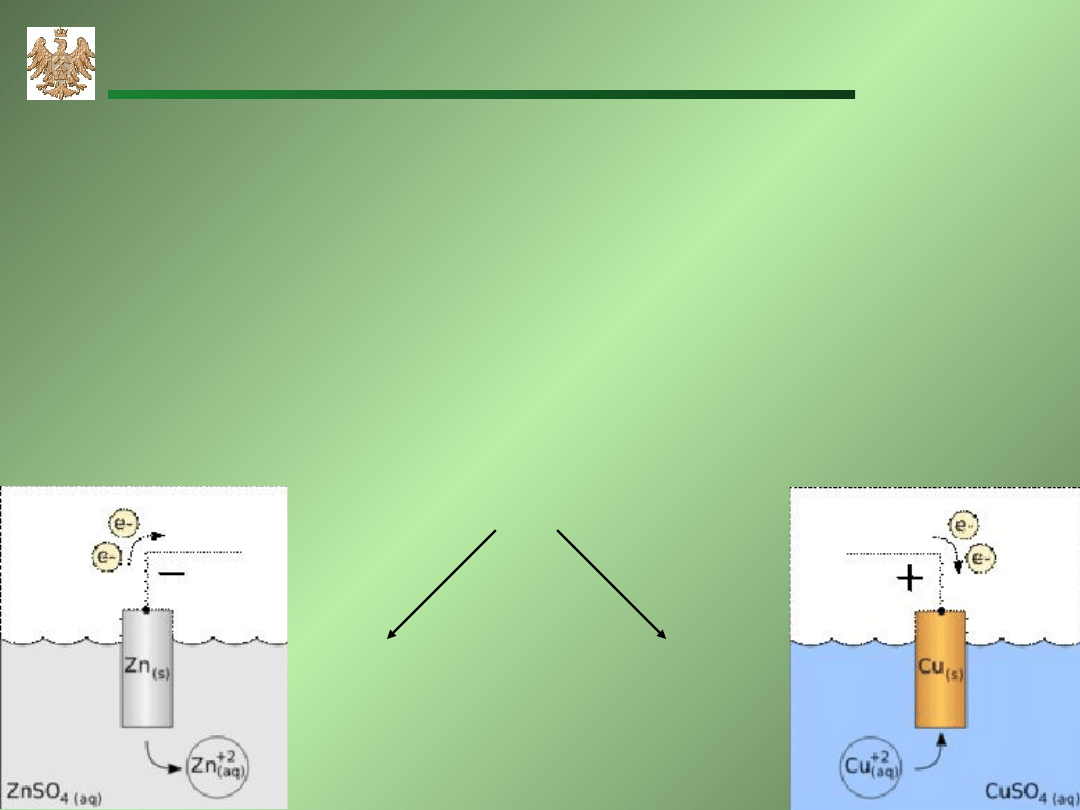
Ogniwo Daniell’a ZnZnSO
4
CuSO
4
Cu
A: Zn Zn
2+
+2e
C: Cu
2+
+2e Cu
AGH-WIMiR, wykład z chemii ogólnej
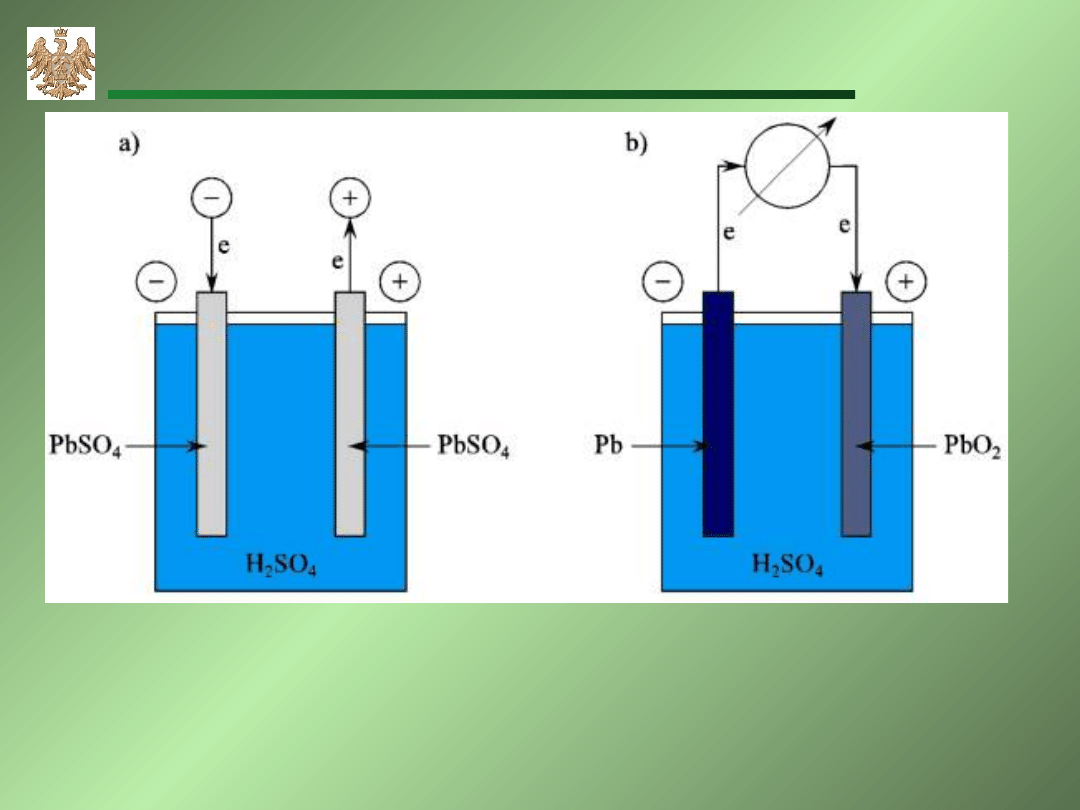
Akumulator ołowiowy Pb|PbO
2
| H
2
SO
4
, H
2
O|PbSO
4
|Pb
Ładowanie:
A: Pb
2+
+2H
2
O PbO
2
+4H
+
+ 2e
C: Pb
2+
+2e Pb
Rozładowanie:
A: Pb Pb
2+
+2e
C: PbO
2
+4H
+
+ 2e Pb
2+
+2H
2
O

AGH-WIMiR, wykład z chemii ogólnej
Akumulatory niklowo–kadmowe
Cd|Cd(OH)
2
|KOH, H
2
O|NiOOH|Ni
Ładowanie: A:2Ni(OH)
2
+2OH
-
2NiOOH+2H
2
O+2e
C: Cd(OH)
2
+2e Cd+2OH
-
Rozładowanie: A: Cd+2OH
-
Cd(OH)
2
+2e
C: 2NiOOH+2H
2
O+2e 2Ni(OH)
2
+2OH
-
AGH-WIMiR, wykład z chemii ogólnej
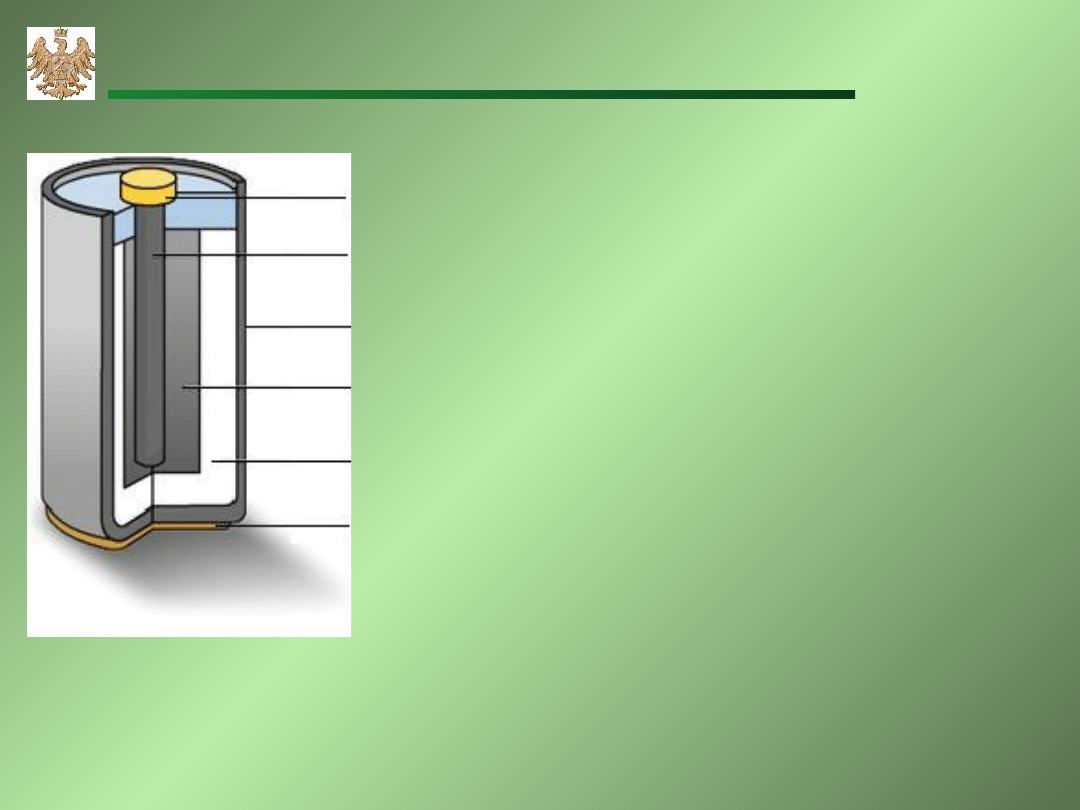
Bateria cynkowo–węglowa – ogniwo Leclanche’go
Zn|Zn
+2
|NH
4
Cl|MnO
2
|C
A: Zn Zn
2+
+2e
C: 2NH
4
+
+2e 2NH
3
+H
2
H
2
+2MnO
2
Mn
2
O
3
+H
2
O
4NH
3
+Zn
2+
[Zn(NH
3
)
4
]
2+
metalowa
zatyczka
pręt
węglowy
osłona
cynkowa
MnO
2
pasta NH
4
Cl
metalowe
dno

AGH-WIMiR, wykład z chemii ogólnej
Elektroliza
Elektroliza
Elektroliza
Elektroliza – proces podczas którego prąd
elektryczny
z
zewnętrznego
źródła
zasilania
powoduje zachodzenie na elektrodach reakcji
utleniania i redukcji.
AGH-WIMiR, wykład z chemii ogólnej
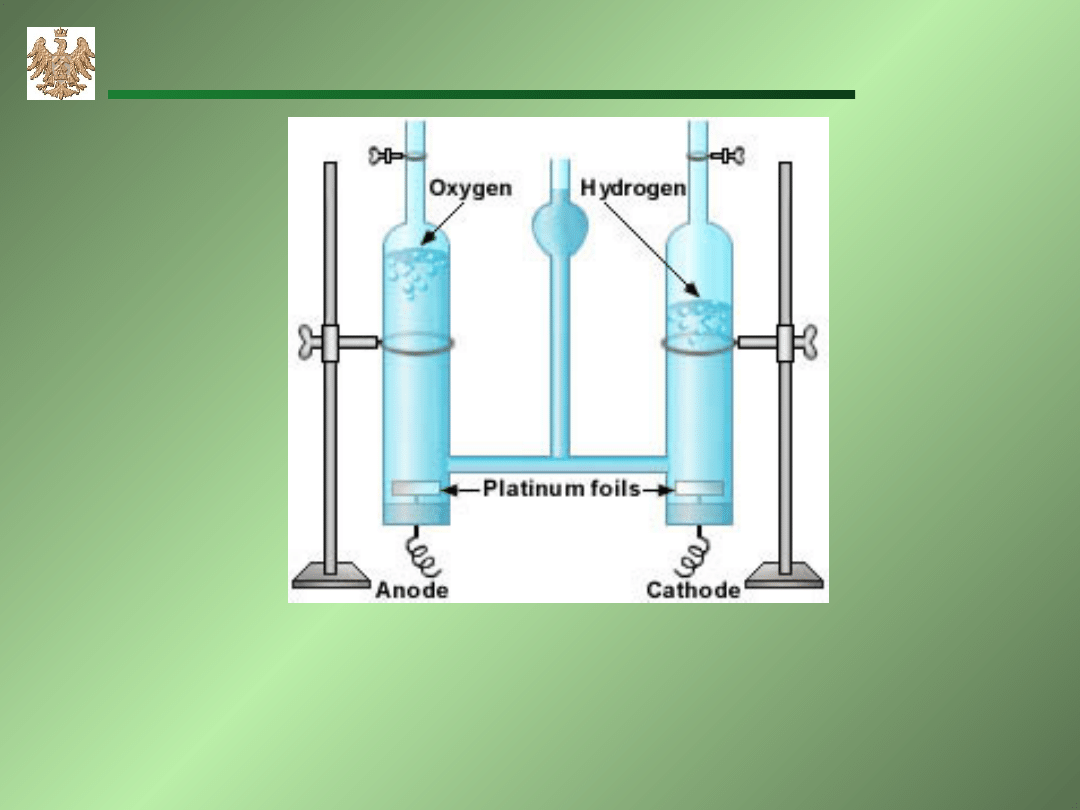
Elektroliza wody w aparacie Hoffman’a
A: 2O
2-
O
2
+4e
C: 4H
+
+4e 2H
2
AGH-WIMiR, wykład z chemii ogólnej
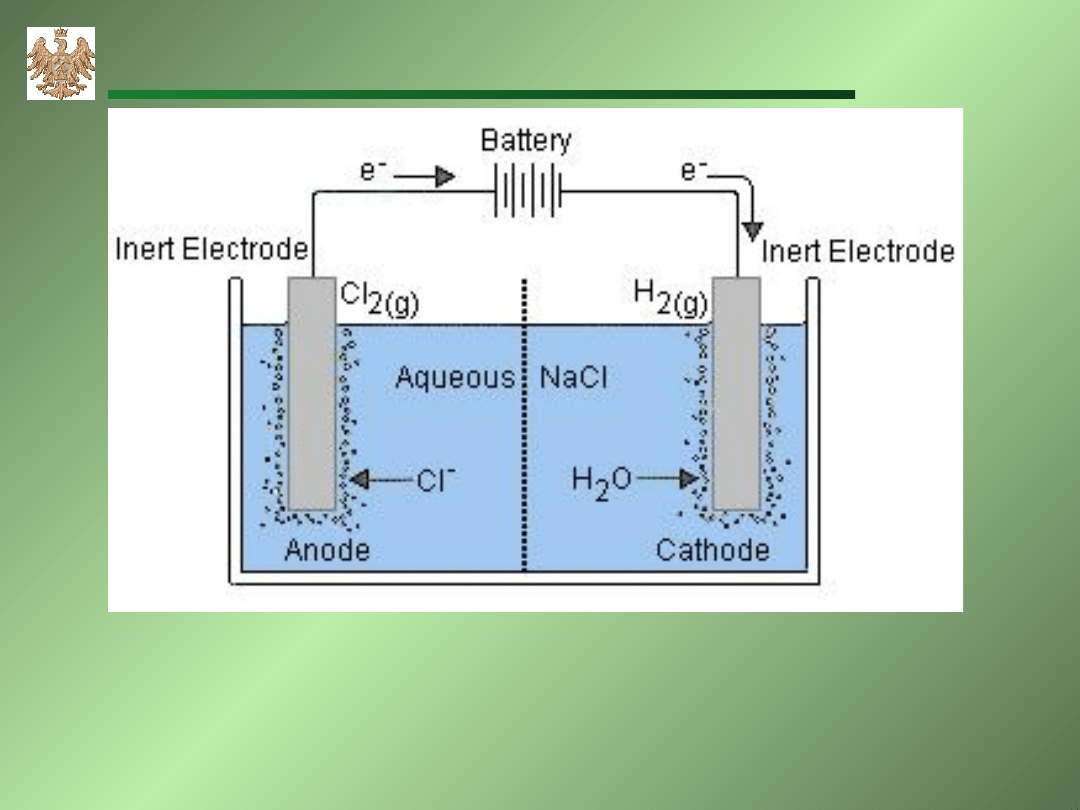
Elektroliza wodnego roztworu NaCl.
A: 2Cl
-
Cl
2
+2e
K: 2H
+
+2e H
2
AGH-WIMiR, wykład z chemii ogólnej
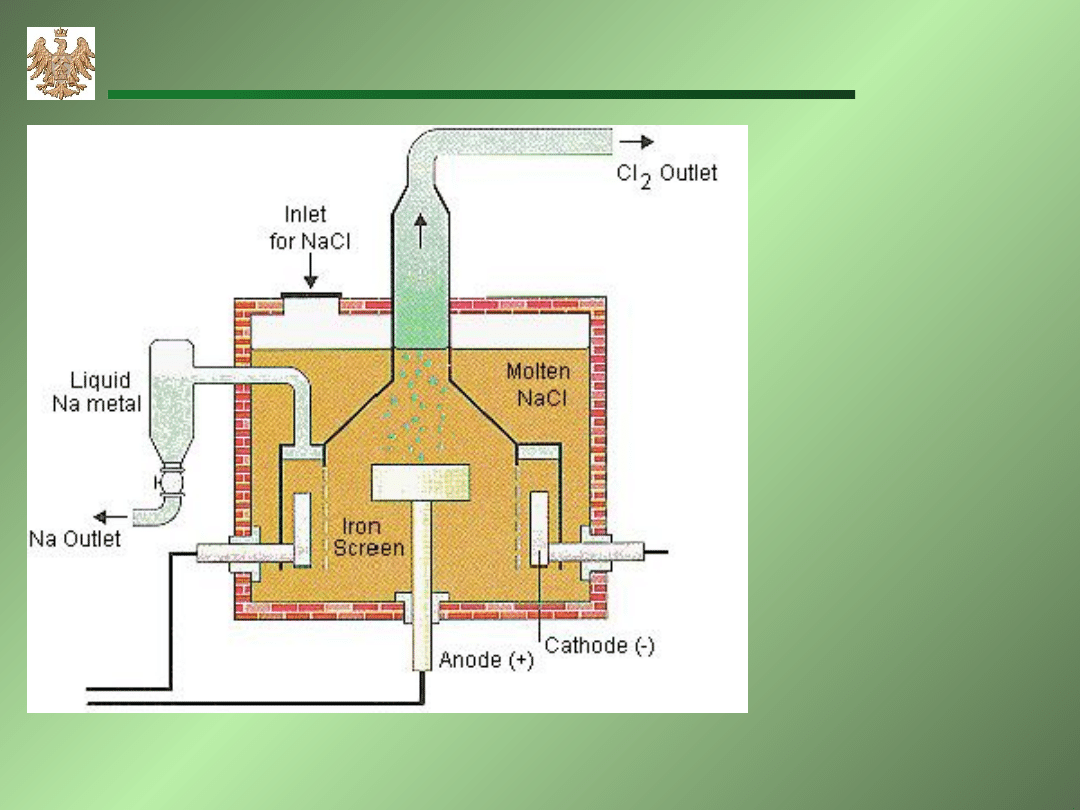
Elektroliza stopionego NaCl.
A: 2Cl
-
Cl
2
+2e
C: 2Na
+
+2e 2Na
AGH-WIMiR, wykład z chemii ogólnej
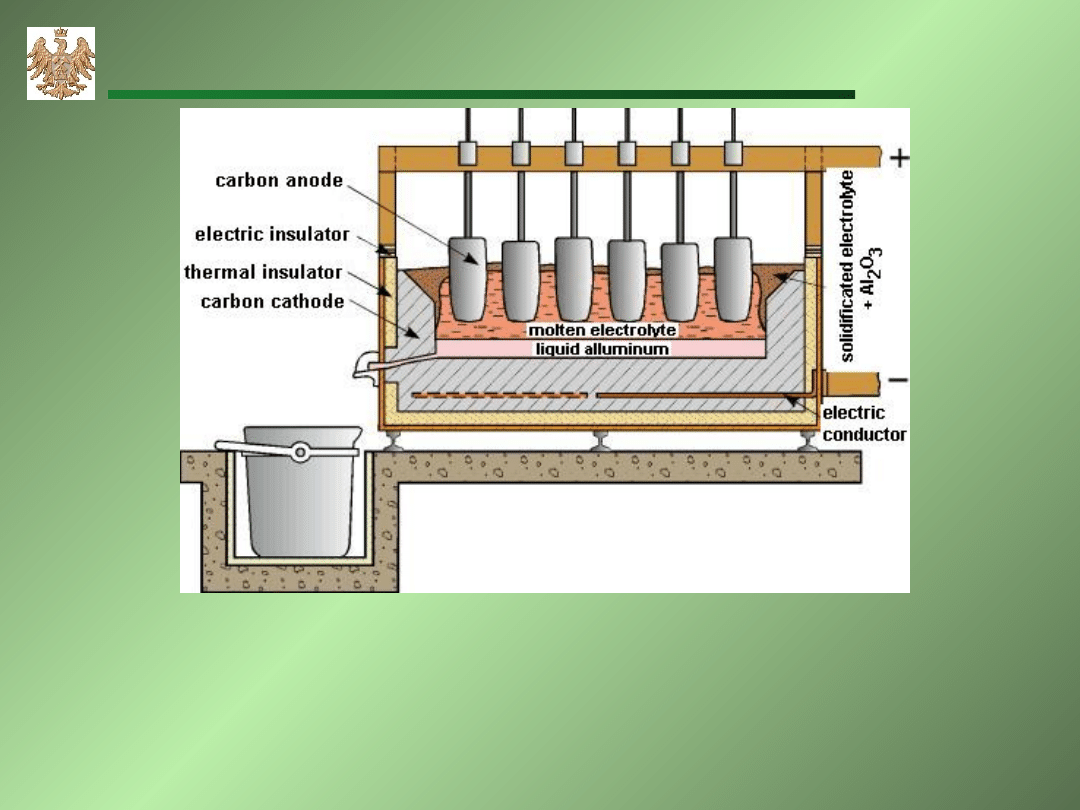
Elektrolityczne otrzymywanie aluminium
A: 6O
2-
3O
2
+12e
C+O
2
CO
2
K: 4Al
3+
+12e 4Al
AGH-WIMiR, wykład z chemii ogólnej
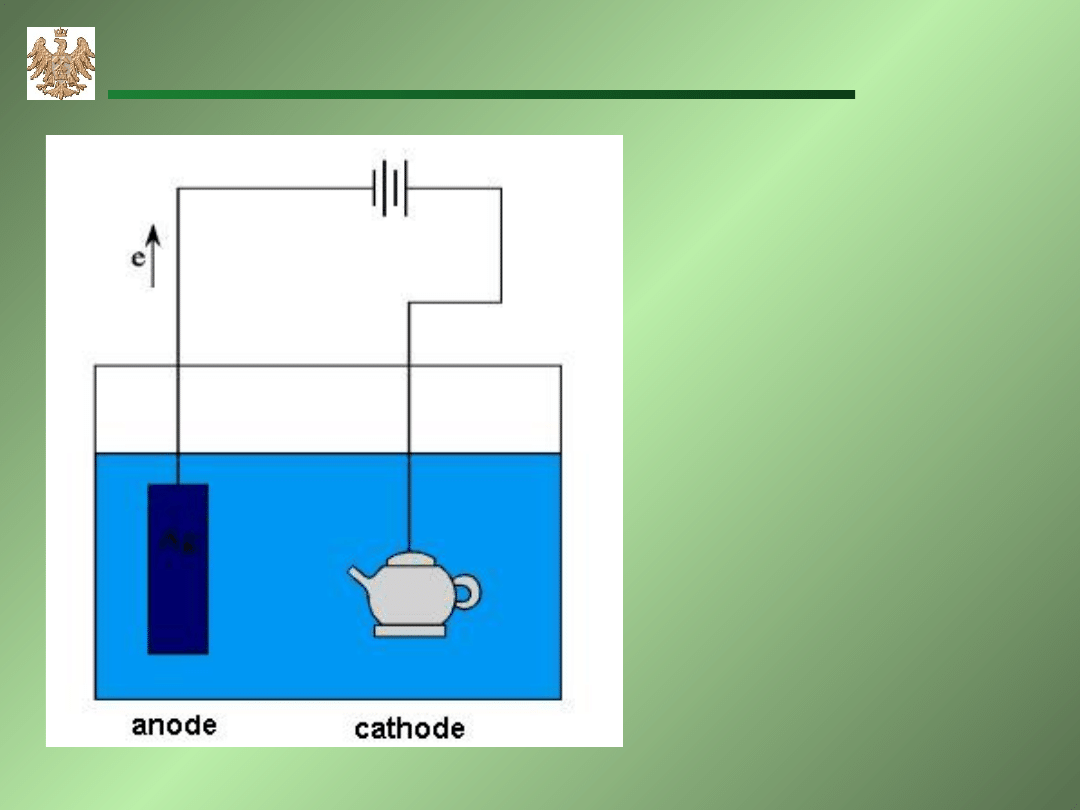
Elektropolerowanie srebra
A: Ag Ag
+
+e
K: Ag
+
+e Ag
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
Wyszukiwarka
Podobne podstrony:
wyklad7 pps
wyklad3 pps
wyklad5 pps
wyklad2 pps
wyklad8 pps
wyklad7 pps
wyklad3 pps
Lachu opracowanie otwarte Kerto me edit, INNE, WYKŁADY Lach, pps na 17 czerwca
Pedagogika specjalna 31.05.2011 WYKŁAD, Studia, PPS
19.04.2011Podstawy pedagogiki specjalna wykład, Studia, PPS
kololach2, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
Lachu opracowanie otwarte Kerto, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
PPS I KOLOKWIUM, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
więcej podobnych podstron