
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
CHEMIA OGÓLNA
CHEMIA OGÓLNA
Wykład 2
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
2
Co to jest materia?
Materia
cząsteczk
a
związki
chemiczne
pierwiast
ki
atom
PbS

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
3
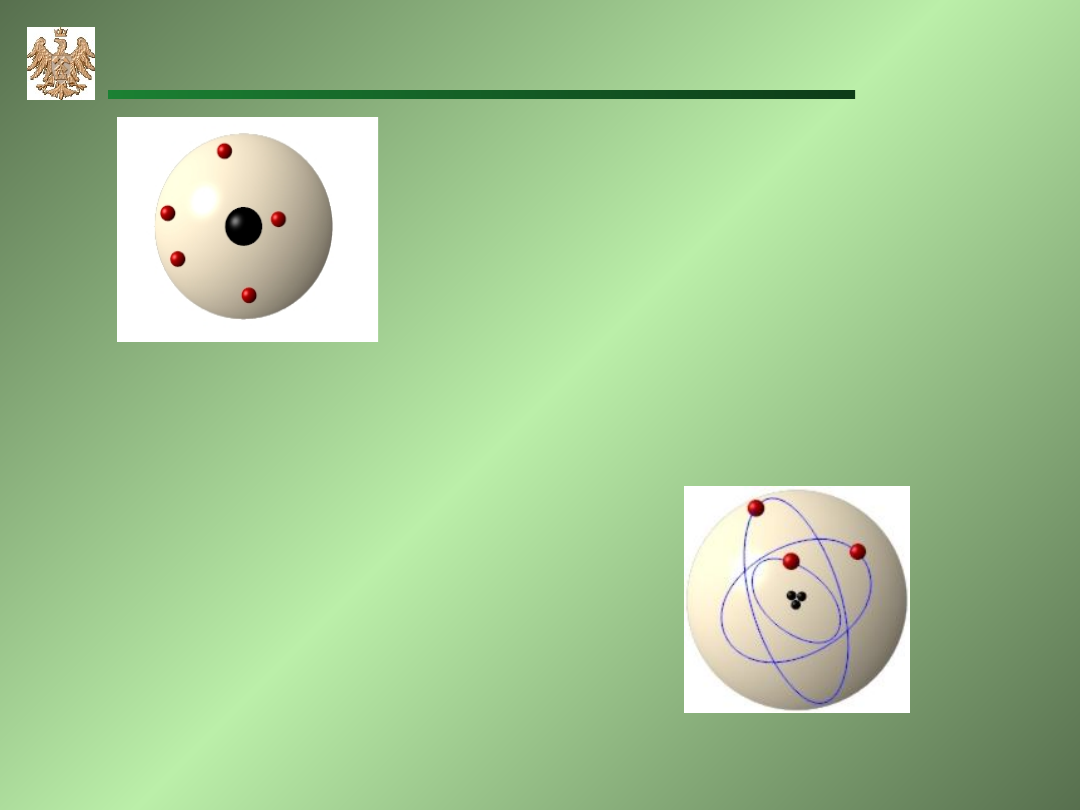
Budowa atomu
atom
atom
jądro
jądro
elektrony
elektrony
proton
proton
neutron
neutron
symbol: e
ładunek: -1 (elementarny),
-1,602x10
-19
[C]
masa: 1/1836 [u]
0,91096x10
-27 [
g]
symbol: n
ładunek: 0 (neutral)
masa: 1 [u]
1,6749x10
-24
[g]
symbol: p
ładunek: +1 (elementarny),
+1,602x10
-19
[C]
masa: 1 [u]
1,6749x10
-24
[g]
1 [u] (jednostka masy atomowej) =1/12masy izotopu węgla
C
12
6

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
4
E
A
Z
Z – liczba atomowa
= liczba protonów w jądrze
Każdy atom jest elektrycznie obojętny liczba protonów = liczbie elektronów
Przykład:
Przykład:
O
16
8
Atom tlenu zawiera:
Z = 8 protonów = 8 elek tronów
A = 16 16 - 8 protonów = 8 neutronów
A – liczba masowa
= liczba protonów + liczba neutronów w jądrze
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
5
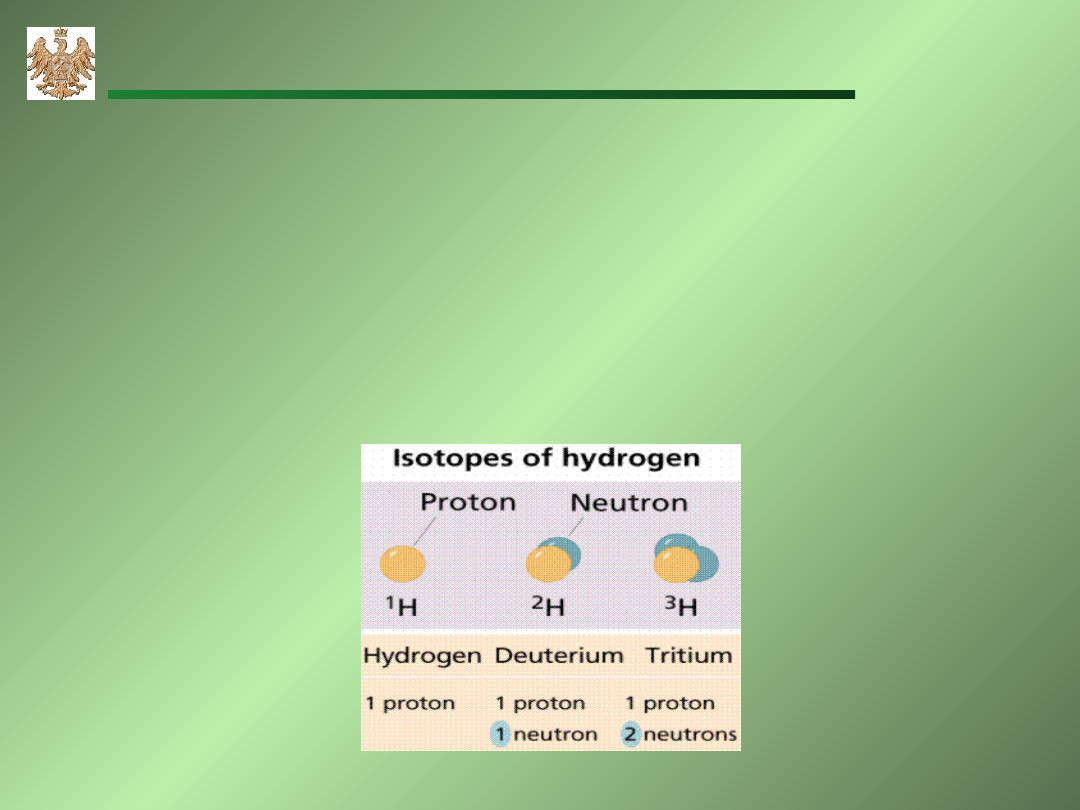
Izotopy
C
12
6
C
13
6
C
14
6
Atomy danego pierwiastka różniące się liczną neutronów
nazywane są izotopami.
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
6
Model atomu Rutherford
Planck
Planck – kwant energii
ν
h
E
E
1
2
h – stała Plancka = 6,625 x10
-34
[Js],
- częstotliwość
Model atomu Bohra

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
7
Prawdopodobieństwo znalezienia elektronu wokół jądra –
rozwiązanie równania Schrödingera orbital
0
Ψ
V
E
h
m
8π
z
Ψ
y
Ψ
x
Ψ
2
2
2
2
2
2
2
2
1
dv
z)
y,
Ψ(x,
2
E – całkowita energia elektronu,
V – energia potencjalna,
m – masa elektronu,
Schrödinger
Schrödinger – funkcja falowa - równanie Schrödingera

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
8
•
n – główna liczba kwantowa
– określa energię elektronu
przyjmuje wartości (1,2,3,...),
•
l – poboczna liczba kwantowa
- określa bardziej
szczegółowo energię elektronu, determinuje kształt orbitalu –
przyjmuje wartości: 0, 1, ..., (n-1)
•
m – magnetyczna liczba kwantowa
– określa orientację
orbitalu w przestrzeni – przyjmuje wartości: ( -l, ..., +l)
Przykład
Przykład
:
:
n = 1, l = 0, m = 0 orbital 1s,
n = 2, l = 1, m = -1 orbital 2p
x
,
n = 3, l = 2, m = 2 orbital
2
2
y
x
3d
Każdy orbital może być opisany trzema liczbami kwantowymi

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
9
Główna liczba
kwantowa
Poboczna
liczba
kwantowa
Magnetyczna
liczba
kwantowa
Typ
orbitalu
Liczba
elektronów
Maksymalna
liczba
elektronów
n = 1
l = 0
m = 0
1s
2
2
n = 2
l = 0
m = 0
2s
2
18
l = 1
m = –1
2p
x
6
m = 0
2p
y
m = 1
2p
z
n = 3
l = 0
m = 0
3s
2
32
l = 1
m = –1
3p
x
6
m = 0
3p
y
m = 1
3p
z
l = 2
m = –2
10
m = –1
m = 0
3d
xy
m = 1
3d
xz
m = 2
3d
yz
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
10
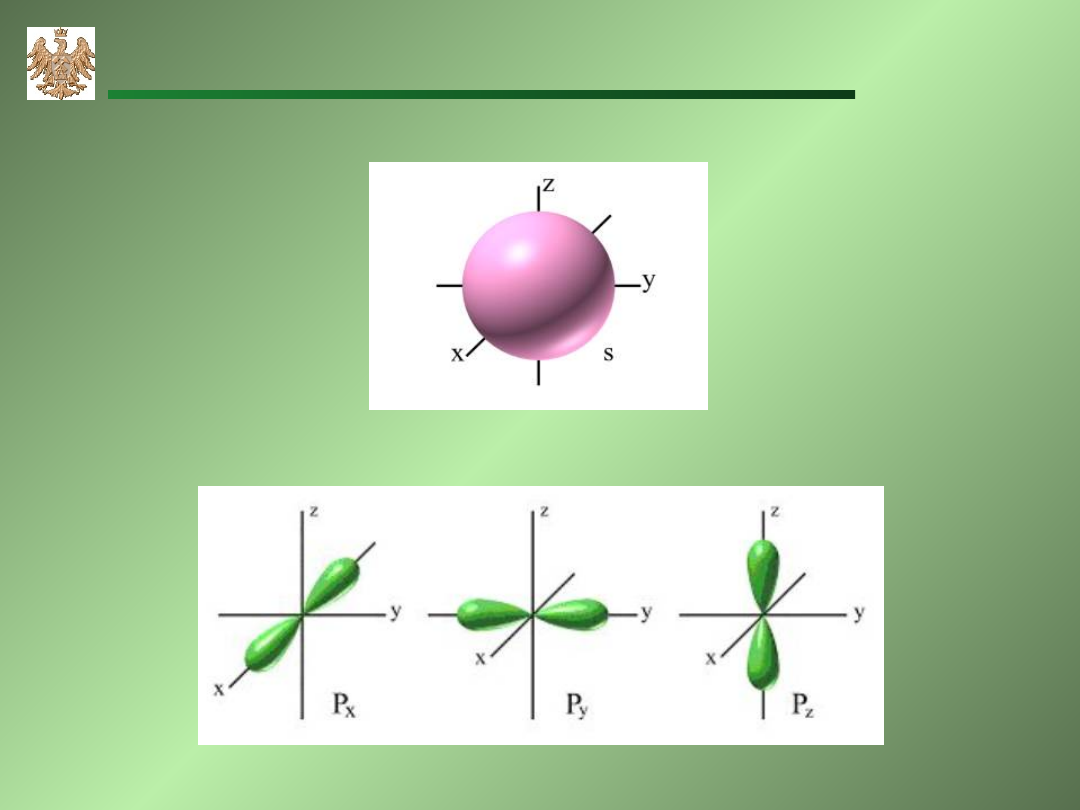
orbital typu s
orbital typu p
Typy orbitali
Typy orbitali
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
11
Każdy orbital może zawierać maksymalnie dwa elektrony różniące się
m
s
– magnetyczna spinowa liczba kwantowa
2
1
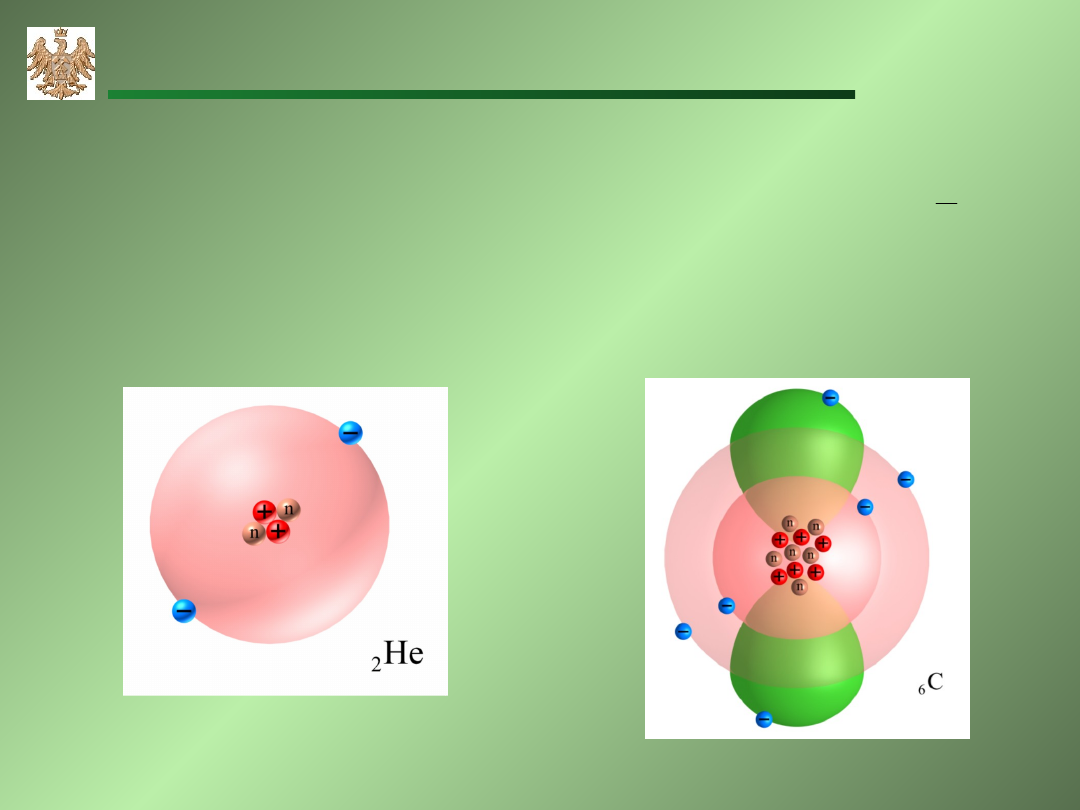
Zasada Paulinga :
Zasada Paulinga : w jednym atomie nie mogą istnieć dwa elektrony
o takich samych liczbach kwantowych, czyli tej samej energii.
Modele orbitali dla atomów helu i węgla

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
Reguła Hundta:
Reguła Hundta: orbitale na tym samym poziomie (np.
trzy orbitale p: p
x,
p
y,
p
z
) są wypełniane najpierw
pojedynczymi elektronami o takim samym spinie.
Dopiero później następuje parowanie przez elektrony o
przeciwnym spinie.

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
13
Symbol orbitalu pozwala opisać strukturę elektronową każdego
1
H 1 elektron na orbitalu s
1
H = 1s
1
2
He = 1s
2
8
O 8 elektronów 1s
2
2s
2
2p
4
lub, wiedząc, że
2
He = 1s
2
8
O = [
2
He] 2s
2
2p
4
6
4d
7
siedem elektronów na orbitalu 4d
6f
7
siedem elektronów na orbitalu 6f
4
4
6

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
14
Przesunięcie poziomu energetycznego
Przesunięcie poziomu energetycznego
s s s s s s s
p p p p p
d d d
f f
1 2 3 4 5 6 7
75
Re = [
54
Xe] 6s
2
4f
14
5d
5
22
Ti = [
18
Ar] 4s
2
3d
2

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
Układ okresowy
Układ okresowy
Dmitrij Iwanowicz Mendelejew,
rosyjski chemik urodzony w Tobolsku
na Syberii odkrył w 1869 roku prawo
okresowości
pierwiastków
chemicznych,
które
mówiło,
że
właściwości
pierwiastków
są
periodycznie zależne od ich mas
atomowych.
Na
tej
podstawie
przewidział
istnienie
pierwiastków
jeszcze wtedy nie odkrytych, jak
skand, wanad.
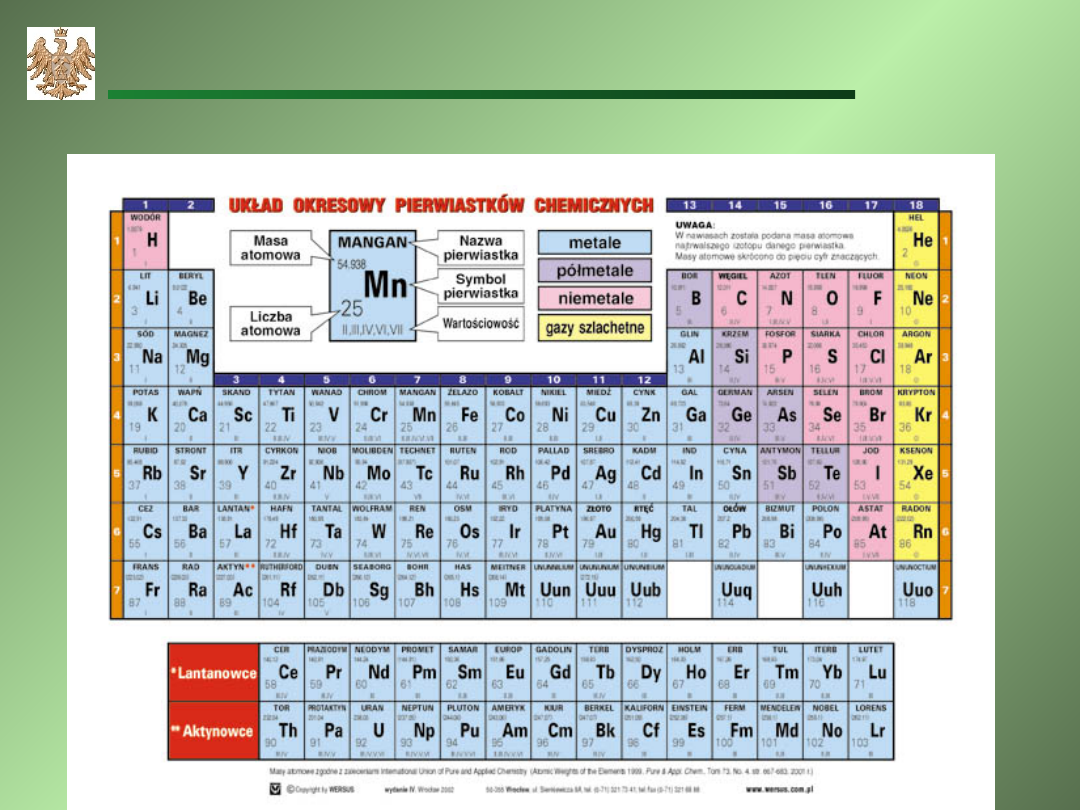
Tablica Mendelejewa
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
16
Współczesny układ okresowy
Współczesny układ okresowy

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
17
Bloki elektronowe w układzie
Bloki elektronowe w układzie
okresowym
okresowym
blok s
blok d
blok p
blok f
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
18
Zmiana właściwości pierwiastków
Zmiana właściwości pierwiastków
w układzie okresowym
w układzie okresowym
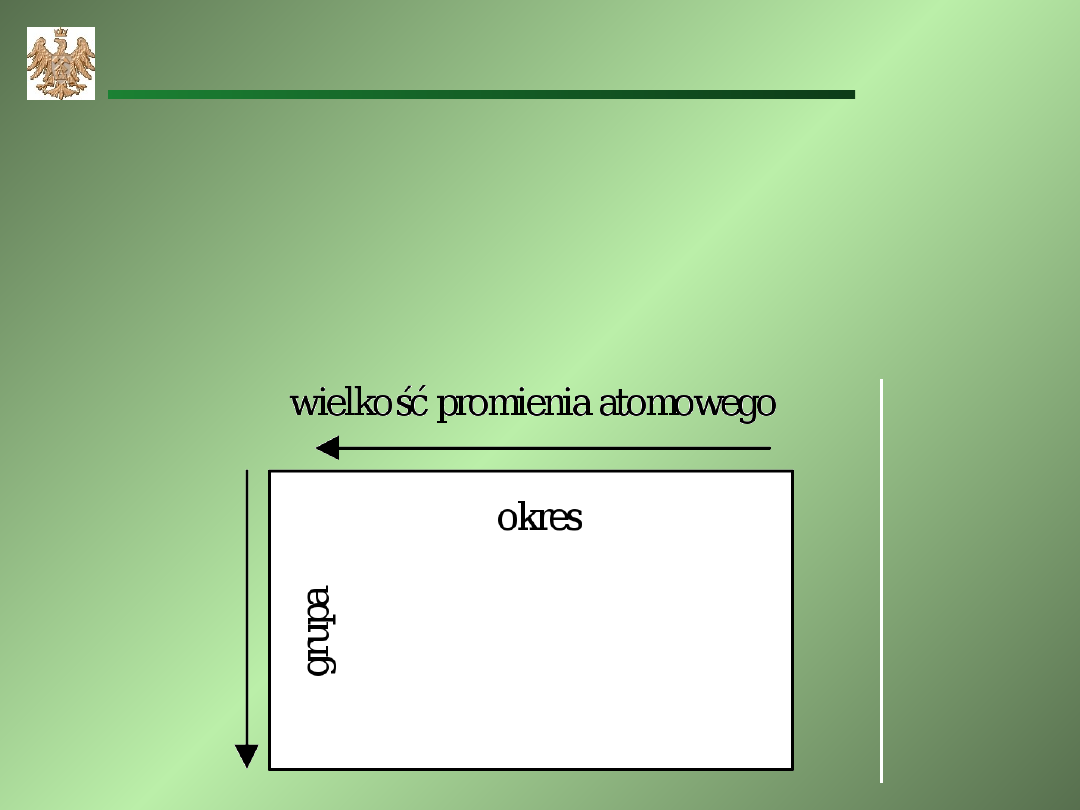
Promień atomowy – odległość od jądra do ostatniej
powłoki zajmowanej przez elektrony
.
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
19
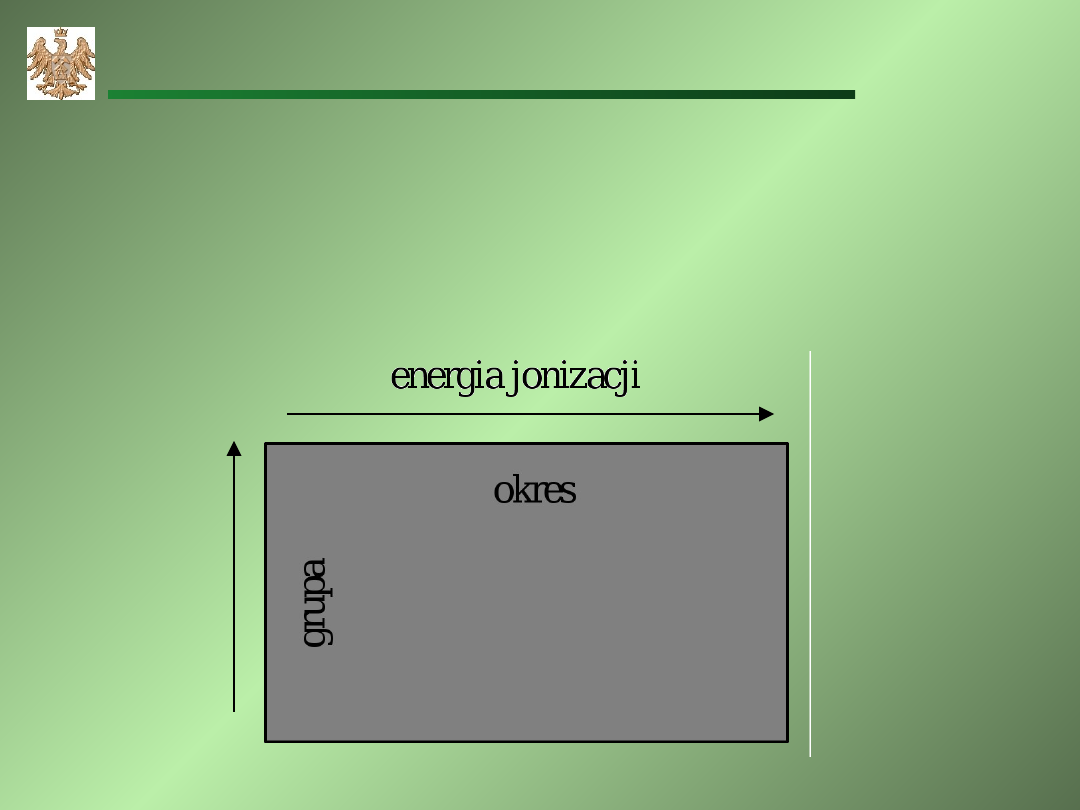
Energia jonizacji – minimalna energia potrzebna do
wybicia elektronu z atomu, czyli jego przejścia w jon.
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
20
Elektroujemność wg Paulinga – zdolność
pierwiastka do przyciągania elektronów.

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
21
Nazewnictwo grup układu okresowego
Nazewnictwo grup układu okresowego
grupa pierwiastków
nazwa
systematyczna
nazwa zwyczajowa
1
litowce
metale alkaliczne
2
berylowce
metale ziem
alkalicznych, wapniowce
(oprócz Be)
13
borowce
glinowce (oprócz B)
14
węglowce
—
15
azotowce
—
16
tlenowce
—
17
fluorowce
chlorowce, halogenowce
18
helowce
gazy szlachetne
Fe, Co, Ni
żelazowce
pierwiastki o l. at. 58 –
71
lantanowce
pierwiastki o l. at. 90 –
103
aktynowce
pierwiastki za uranem
transuranowce
Ru, Rh, Pd, Os, Ir, Pt
platynowce
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
22
Tylko gazy szlachetne mają całkowicie zapełnione elektronami
powłoki elektronowe
Całkowicie zapełniona powłoka elektronowa minimalna energia
Przykład:
Przykład:
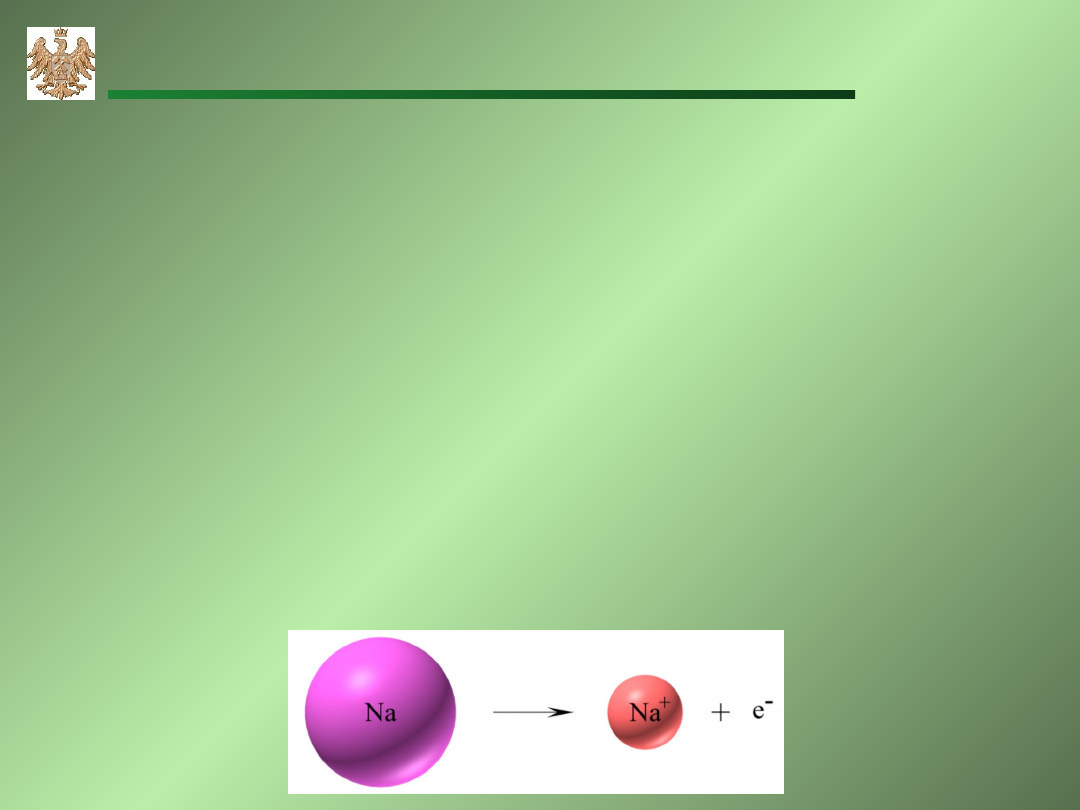
Atom sodu:
11
Na = 1s
2
2s
2
2p
6
3s
1
=[
10
Ne] 3s
1
jeden elektron
walencyjny. Sód daje elektron walencyjny innemu atomowi i staje
się kationem sodu
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
23
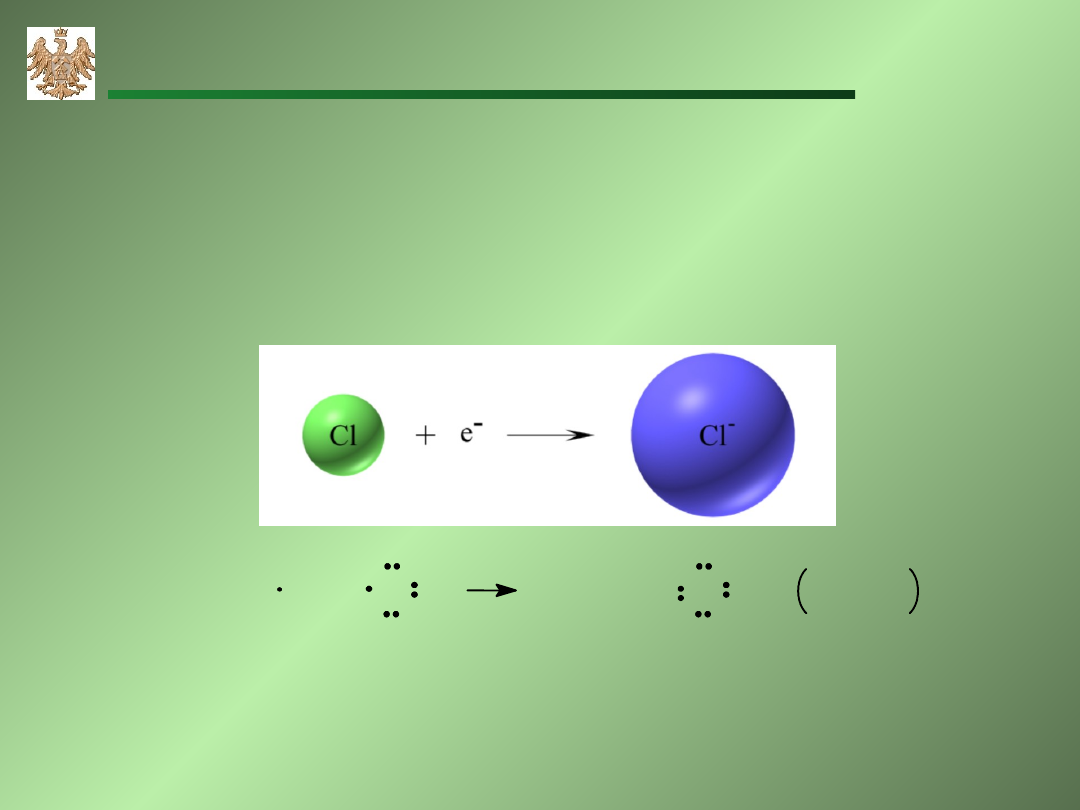
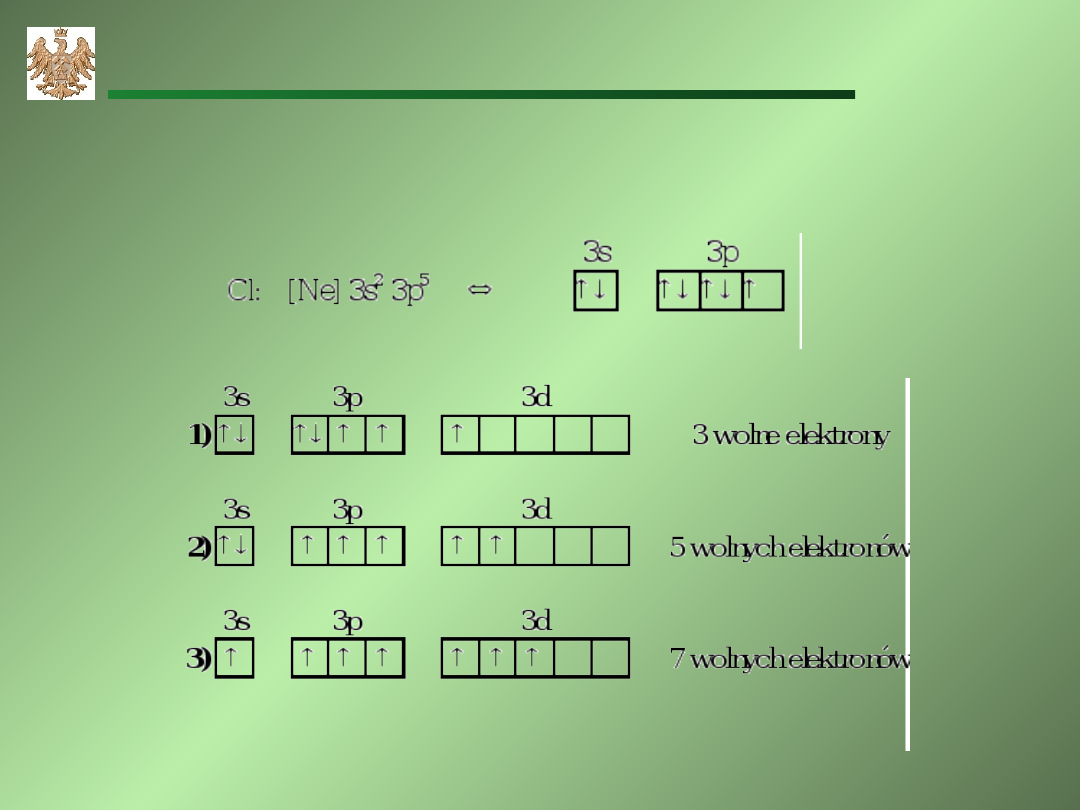
Chlor:
17
Cl =[
10
Ne] 3s
2
3p
5
7 elektronów walencyjnych, potrzebuje
jednego elektronu aby mieć całkowicie zapełnioną powłokę
walencyjną.
+
N
a
C
l
+
-
N
a
+
C
l
Na
+
Cl
-
Taki typ wiązania jest nazywany wiązaniem jonowym
Jony są razem elektrostatyczne przyciąganie
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
24
Wiązanie jonowe jest możliwe między pierwiastkami różniącymi się
elektroujemnością (różnica elektroujemności większa niż 1.7)
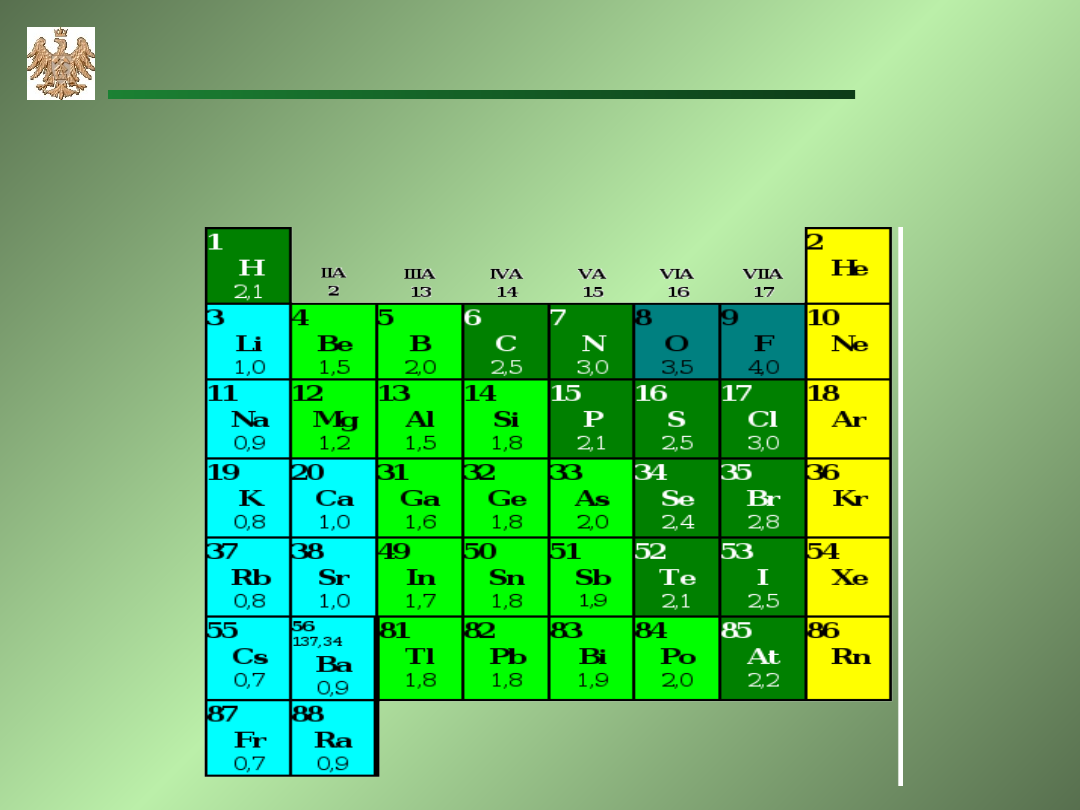
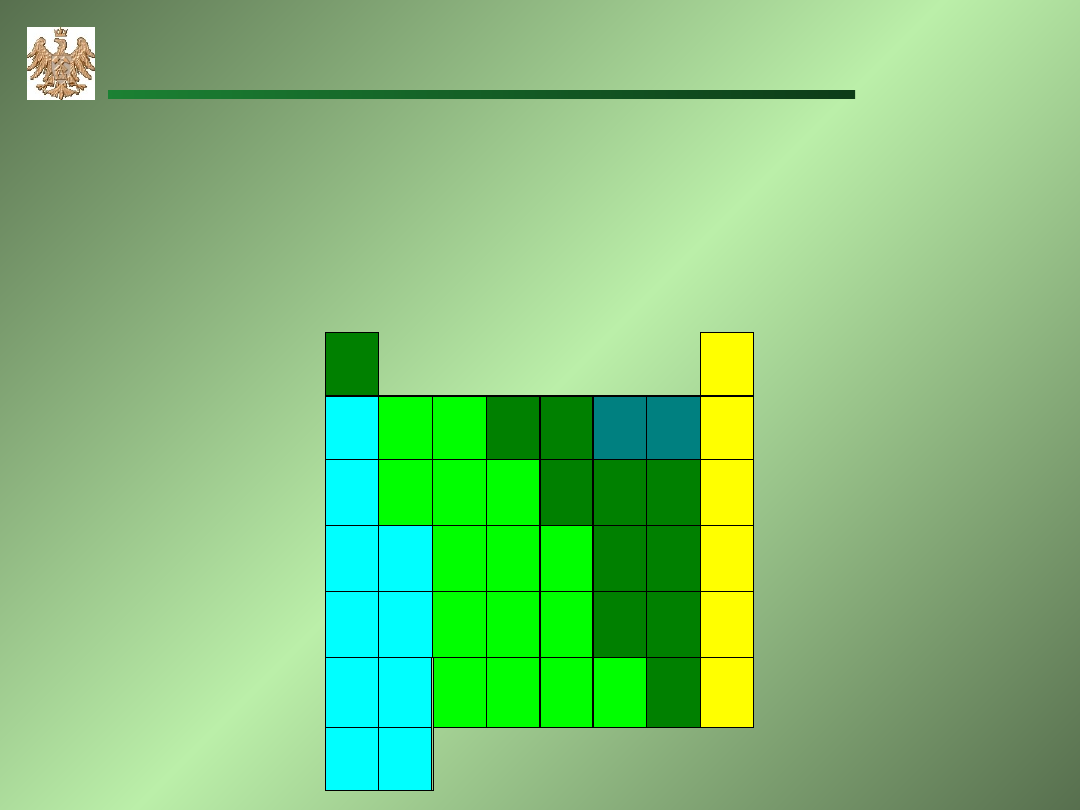
elektroujemność
elektroujemność
- (Pauling) zdolność pierwiastka do przyciągania
elektronów
IA
1
0
18
1
H
2,1
IIA
2
IIIA
13
IVA
14
VA
15
VIA
16
VIIA
17
2
He
3
Li
1,0
4
Be
1,5
5
B
2,0
6
C
2,5
7
N
3,0
8
O
3,5
9
F
4,0
10
Ne
11
Na
0,9
12
Mg
1,2
13
Al
1,5
14
Si
1,8
15
P
2,1
16
S
2,5
17
Cl
3,0
18
Ar
19
K
0,8
20
Ca
1,0
31
Ga
1,6
32
Ge
1,8
33
As
2,0
34
Se
2,4
35
Br
2,8
36
Kr
37
Rb
0,8
38
Sr
1,0
49
In
1,7
50
Sn
1,8
51
Sb
1,9
52
Te
2,1
53
I
2,5
54
Xe
55
Cs
0,7
56
137,34
Ba
0,9
81
Tl
1,8
82
Pb
1,8
83
Bi
1,9
84
Po
2,0
85
At
2,2
86
Rn
87
Fr
0,7
88
Ra
0,9
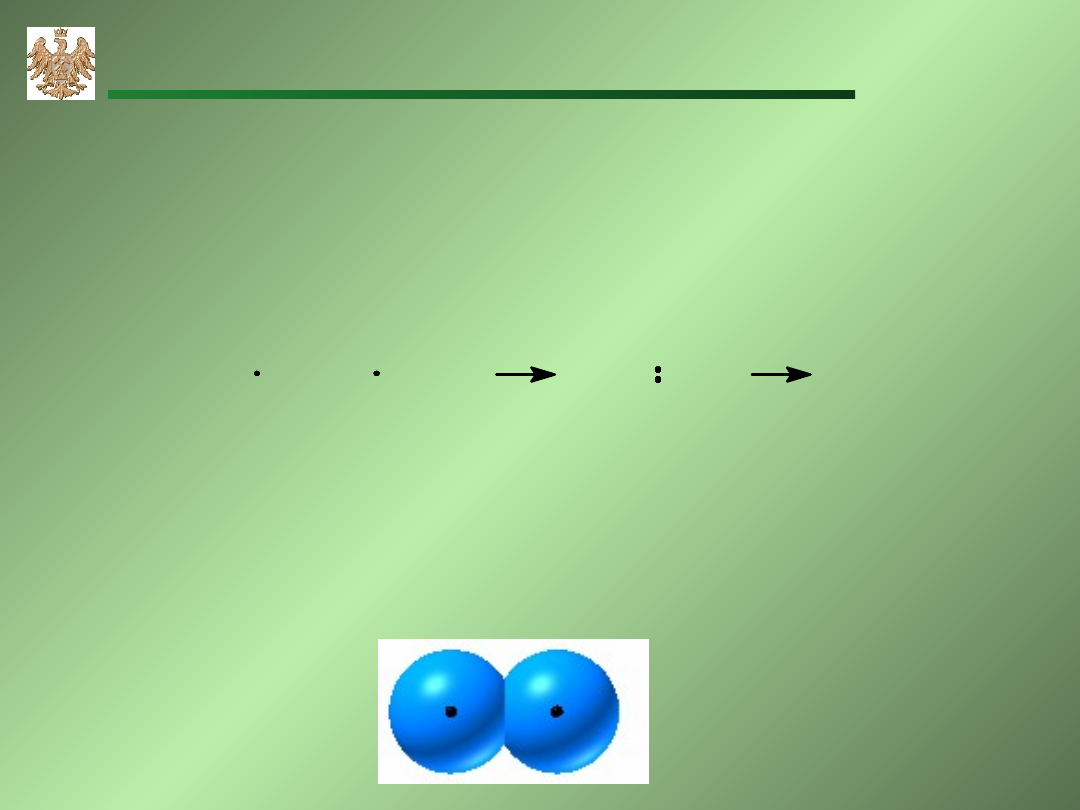
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
25
Dwa atomy wodoru,
1
H = 1s
1
Najbliższy gaz szlachetny -
2
He = 1s
2
Wiązanie każdy atom wodoru daje po jednym elektronie i tworzy
się wspólna para elektronowa
H H
2
+
H
H
Ten typ wiązania nazywany jest wiązaniem atomowym lub wiązaniem
wiązaniem atomowym lub wiązaniem
kowalencyjnym.
kowalencyjnym.
Wiązanie atomowe jest możliwe jeśli
różnica elektroujemności jest
mniejsza niż 0.4
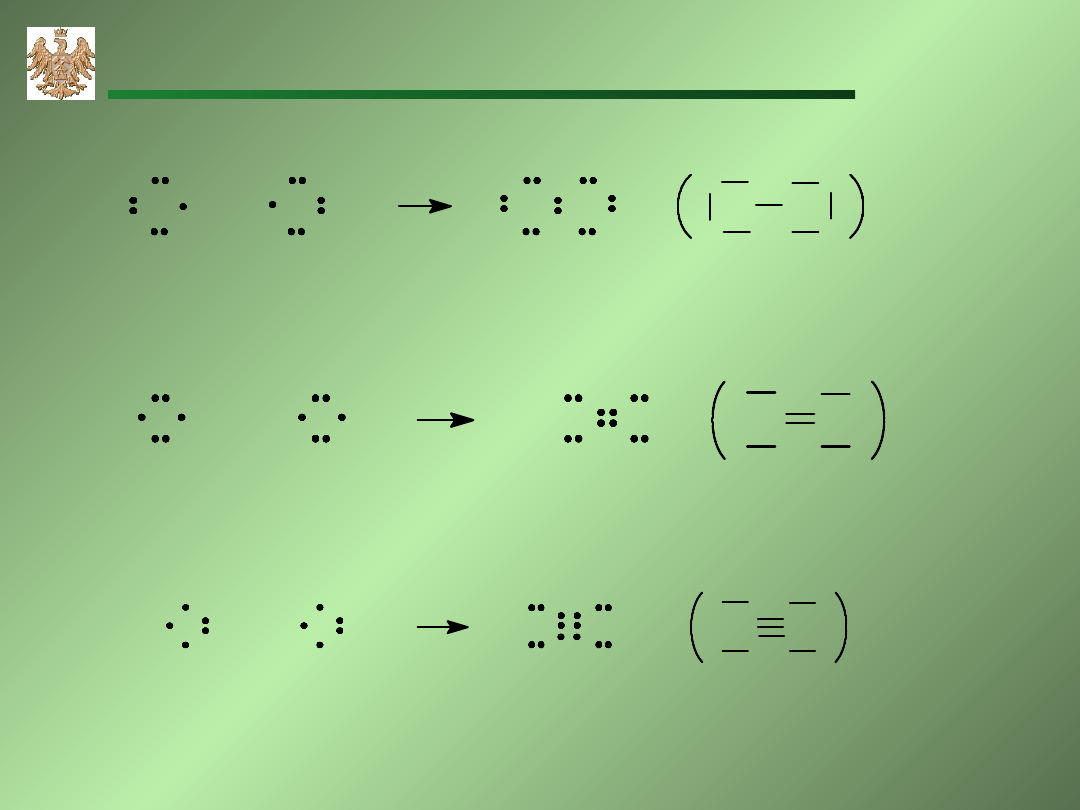
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
26
+
Cl
Cl
Cl
2
Cl
Cl
Cl
Cl
O
O
+
O O
O
2
O
O
N
+
N
N
N
N
2
N
N
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
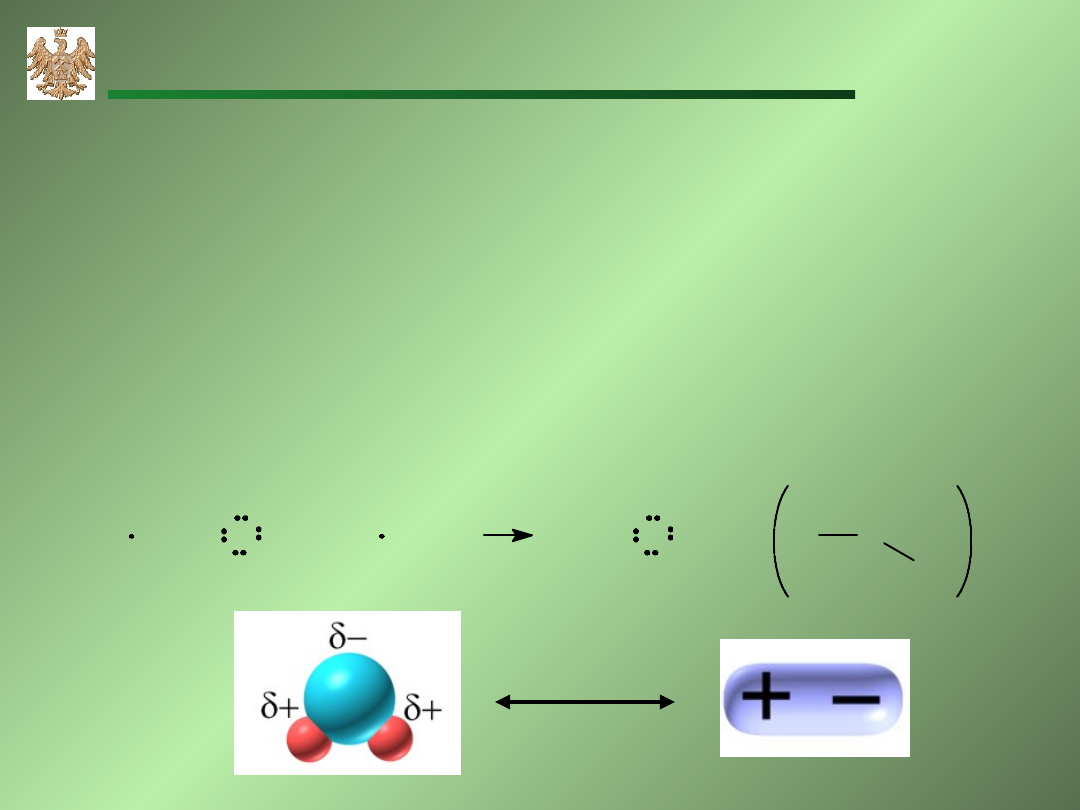
27
Jeśli różnica elektroujemności jest miedzy 0.4 a 1.7?
Wtedy jeden z atomów o większej elektroujemności silniej przyciąga
parę elektronową. Para elektronowa jest przesunię w kierunku atomu
bardziej elektroujemnego.
O
H
H
+
H
+
H
O
O H
H
Taki typ wiązania jest nazywany
wiązaniem atomowym
spolaryzowanym
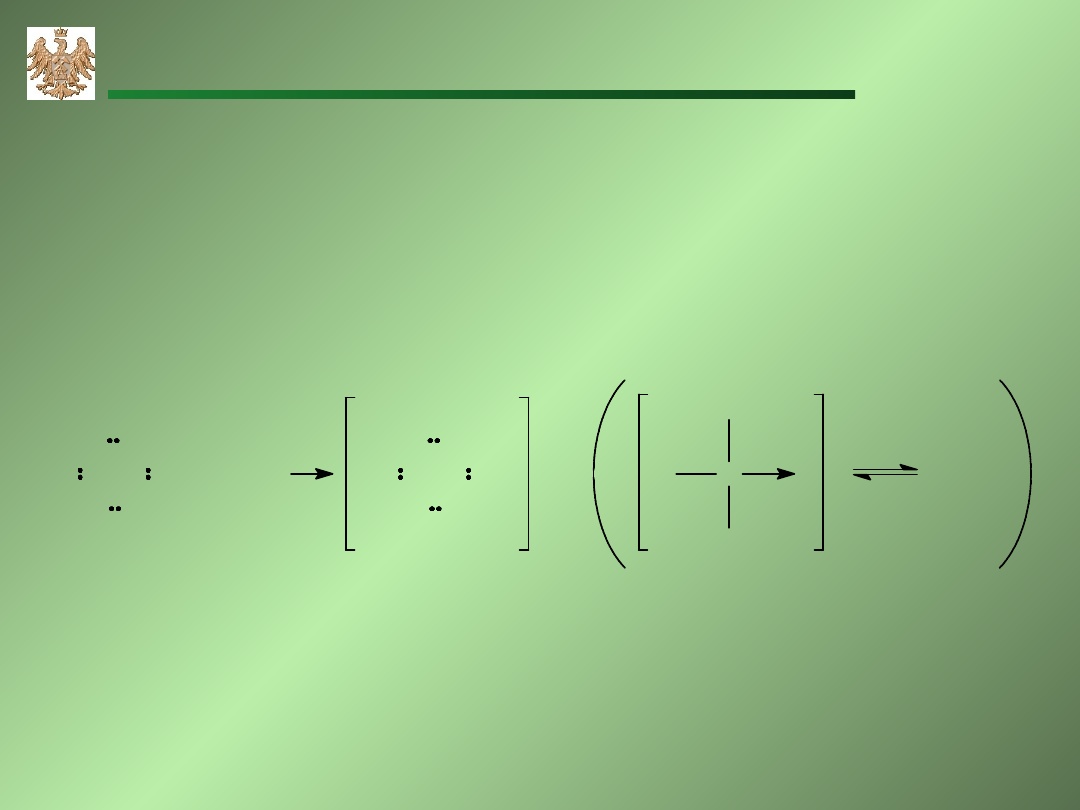
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
28
Takie wiązanie jest nazywane wiązanie koordynacyjne (donorowo
wiązanie koordynacyjne (donorowo
akceptorowe)
akceptorowe)
+
H
+
H
H
N
H
H
N
H
H
H
+
+
NH
4
+
H
N
H
H
H
W niektórych przypadkach para elektronowa pochodzi tylko od
jednego atomu. Atom dający parę elektronową jest nazywany
„donorem”, natomiast atom przyjmujący parę elektronową jest
nazywany „ akceptorem”.

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
29
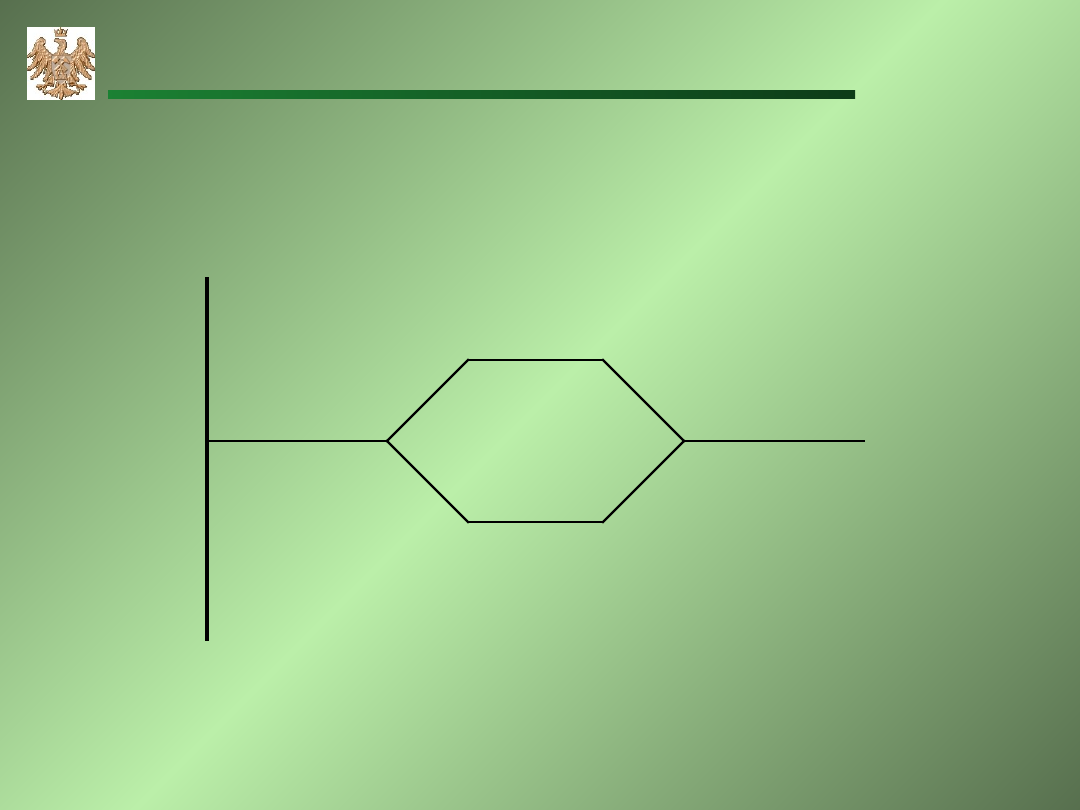
Wiązanie metaliczne
Wiązanie metaliczne
W sieci krystalicznej znajdują się rdzenie atomowe- dodatnie jony, a
między nimi jest - „gaz elektronowy” – wolne elektrony swobodnie
poruszają się w sieci krystalicznej metalu
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
30
Orbitale molekularne
E
N
E
R
G
IA
1s
1s
antywiążący
wiążący
Orbital
atomowy
Orbital
atomowy
Orbital cząsteczkowy
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
31
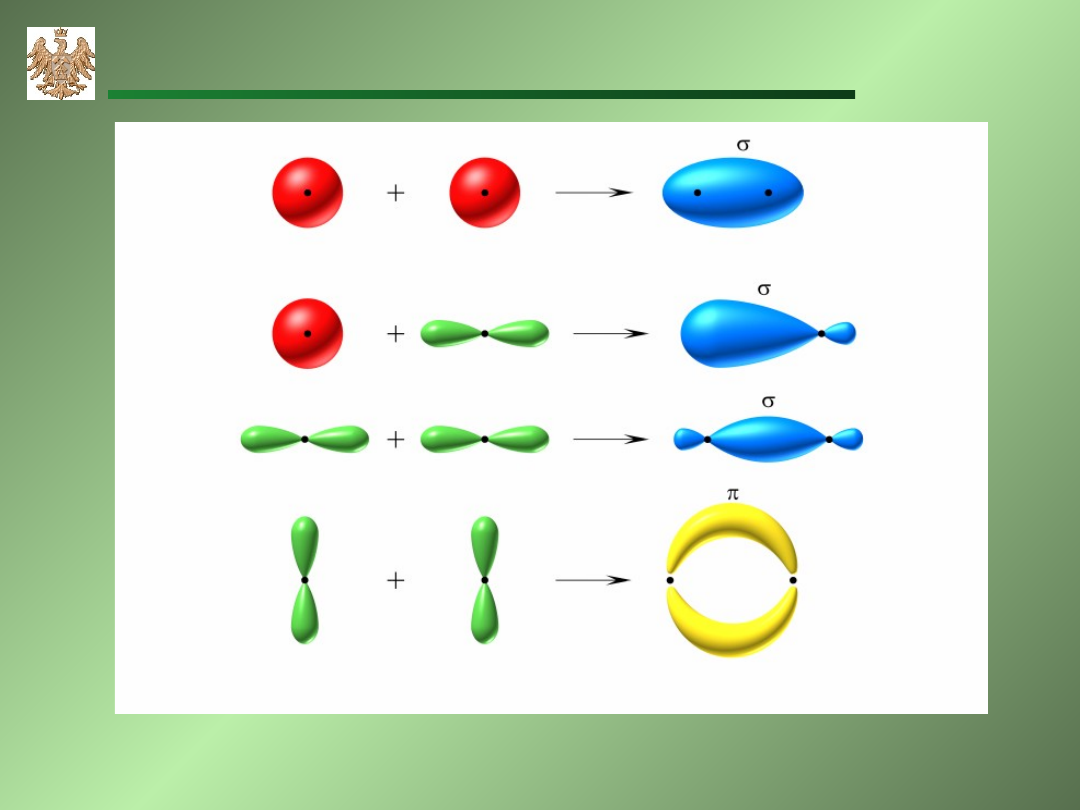
Tworzenie orbitali molekularnych
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
32
Hybr
Hybr
ydyzacja
ydyzacja
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
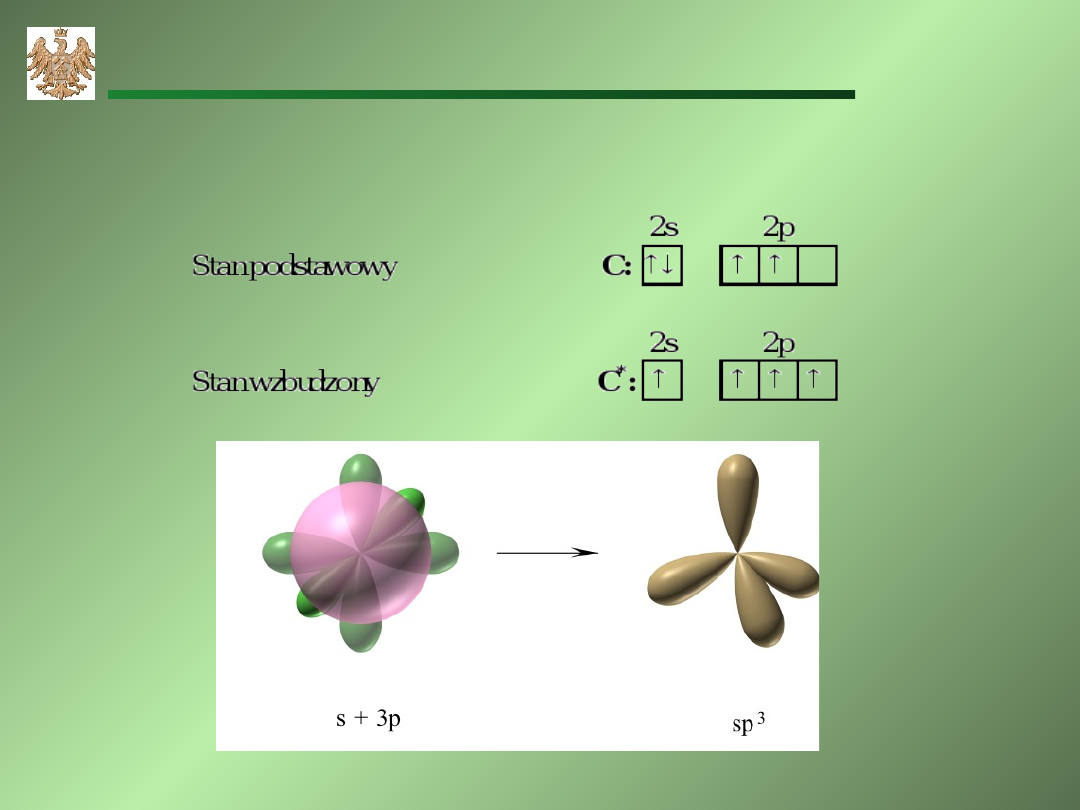
Stany atomowe węgla
Stany atomowe węgla
Hybrydyzacja sp
3
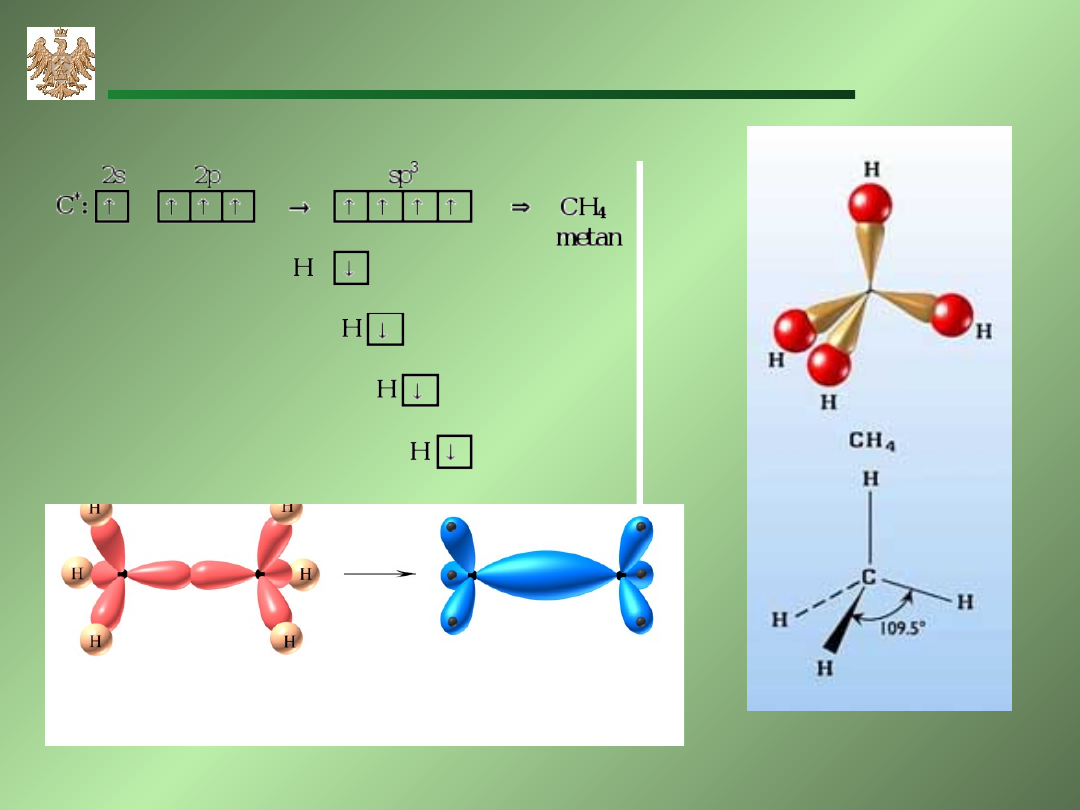
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
34
metan
etan
Hybrydyzacja sp
Hybrydyzacja sp
3
3
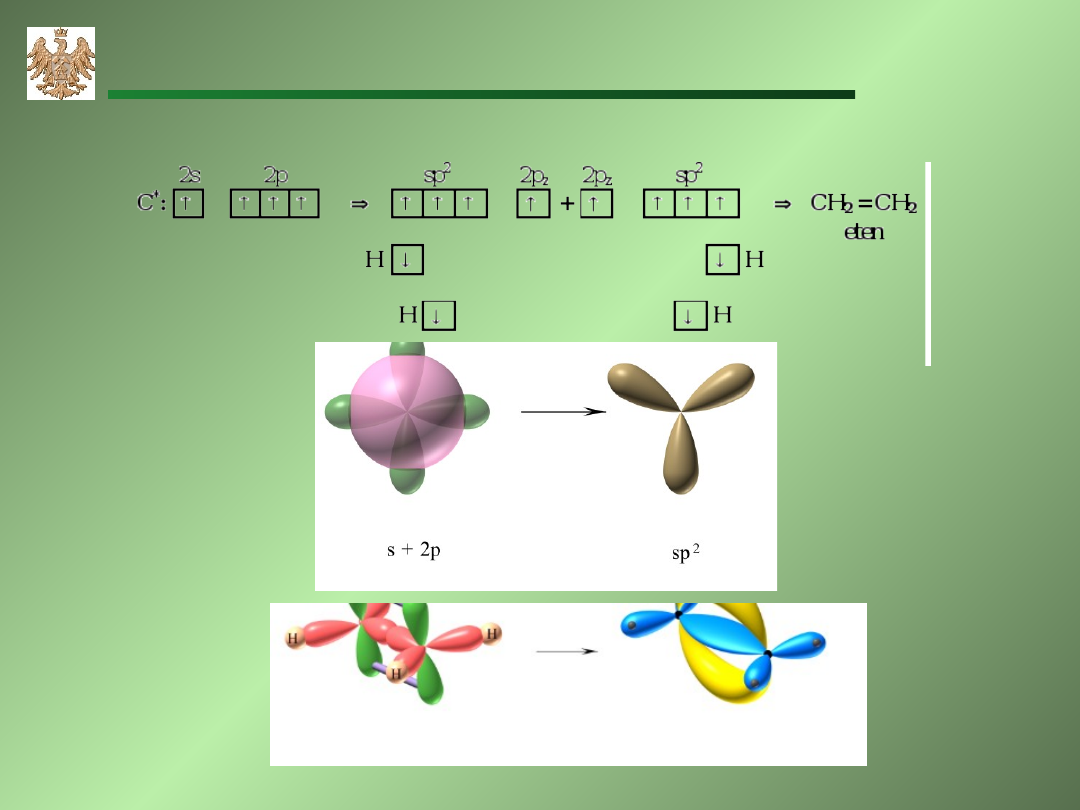
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
35
Hybrydyzacja sp
Hybrydyzacja sp
2
2
eten (etylen)
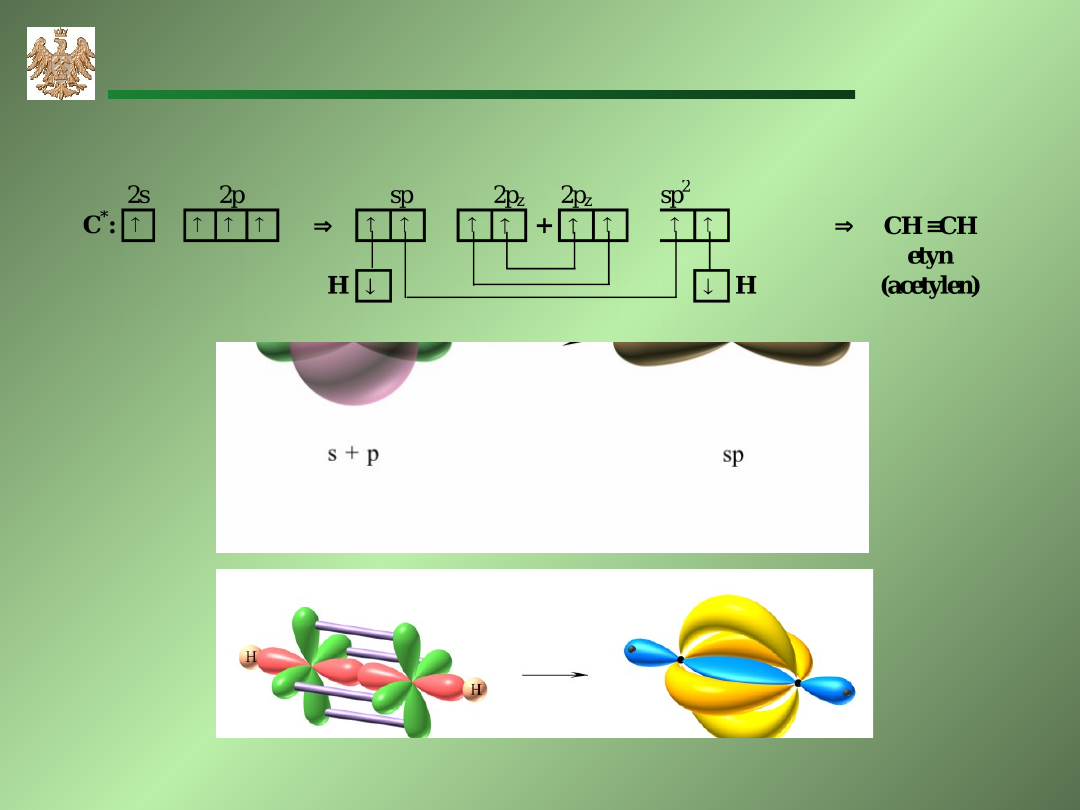
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
36
Hybrydyzacja sp
Hybrydyzacja sp
etyn (acetylen)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
wyklad7 pps
wyklad3 pps
wyklad5 pps
wyklad6 pps
wyklad8 pps
wyklad7 pps
wyklad3 pps
Lachu opracowanie otwarte Kerto me edit, INNE, WYKŁADY Lach, pps na 17 czerwca
Pedagogika specjalna 31.05.2011 WYKŁAD, Studia, PPS
19.04.2011Podstawy pedagogiki specjalna wykład, Studia, PPS
kololach2, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
Lachu opracowanie otwarte Kerto, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
PPS I KOLOKWIUM, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
więcej podobnych podstron