
AGH-WIMiR, wykład z chemii ogólnej
Chemia Ogólna
Chemia Ogólna
Wykład 7

AGH-WIMiR, wykład z chemii ogólnej
KOROZJA
KOROZJA
Korozja – osłabienie podstawowych własności
materiału w wyniku reakcji z otoczeniem.
Korozja metalu
Korozja cegieł

AGH-WIMiR, wykład z chemii ogólnej
• korozja ogólna,
•
korozja
lokalna:
wżerowa,
szczelinowa,
międzykrystaliczna,
•korozja naprężeniowa,
• procesy korozyjno–erozyjne,
• kawitacja,
• korozja atmosferyczna,
• korozja w betonie,
• korozja w glebie,
• korozja biologiczna,
• korozja wysokotemperaturowa.
Rodzaje korozji
Rodzaje korozji

AGH-WIMiR, wykład z chemii ogólnej
Środowiska korozyjne
Środowiska korozyjne
• kwaśne,
• alkaliczne,
• woda morska,
• solanka,
• środowiska organiczne,
• stopione sole.

AGH-WIMiR, wykład z chemii ogólnej
Korozja elektrochemiczna
Korozja elektrochemiczna
Korozja elektrochemiczna (glawaniczna) –
najczęściej występujący typ korozji. Zachodzi
podczas zetknięcia dwóch metali o różnych
potencjałach
elektrochemicznych.
Tworzą
one
ogniwo galwaniczne, gdzie metal o niższym
potencjale stanowi anodę, zaś metal o wyższym
potencjale – katodę.
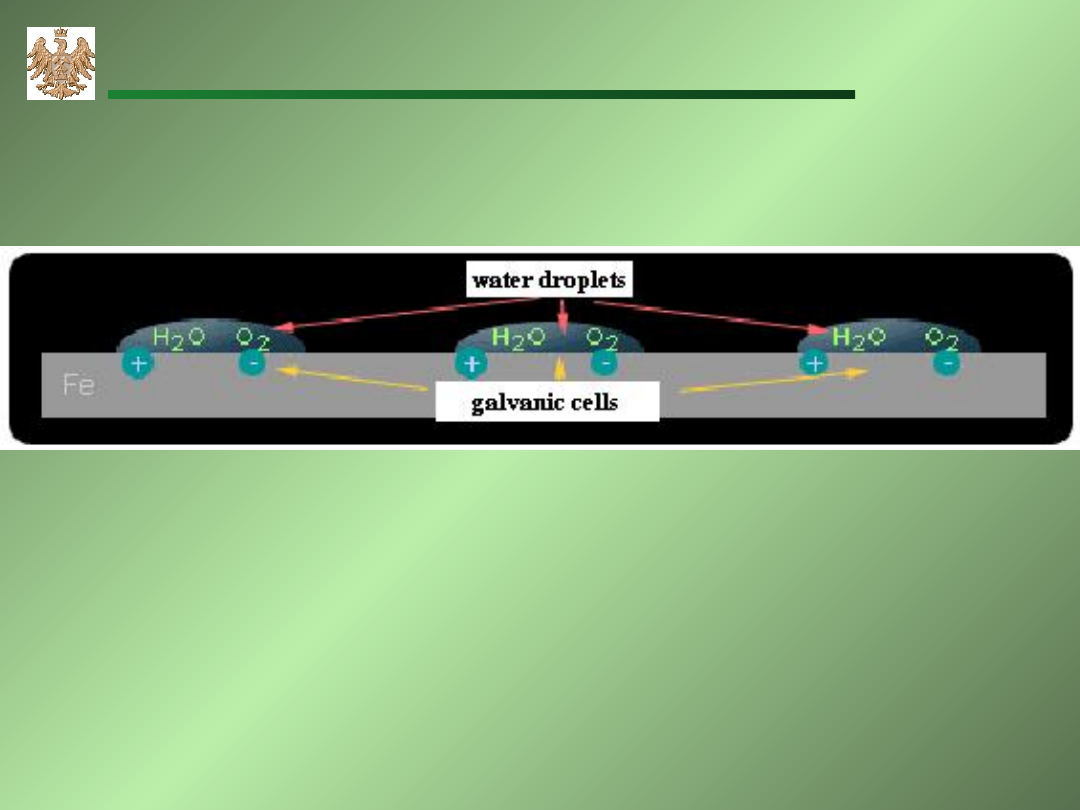
AGH-WIMiR, wykład z chemii ogólnej
Żelazo pokryte kroplami wody jako ogniwo galwaniczne

AGH-WIMiR, wykład z chemii ogólnej
ne
Me
Me
n
d
Re
ne
Ox
Mechanizm korozji elektrochemicznej
Mechanizm korozji elektrochemicznej
Zniszczenie metalu następuje w wyniku reakcji
anodowej:
sprzężonej z procesem katodowym:

AGH-WIMiR, wykład z chemii ogólnej
Typowe reakcje katodowe:
2
H
2
1
e
H
OH
4
e
4
O
H
2
O
2
2
2
3
Fe
e
Fe
Cu
e
Cu
2
AGH-WIMiR, wykład z chemii ogólnej
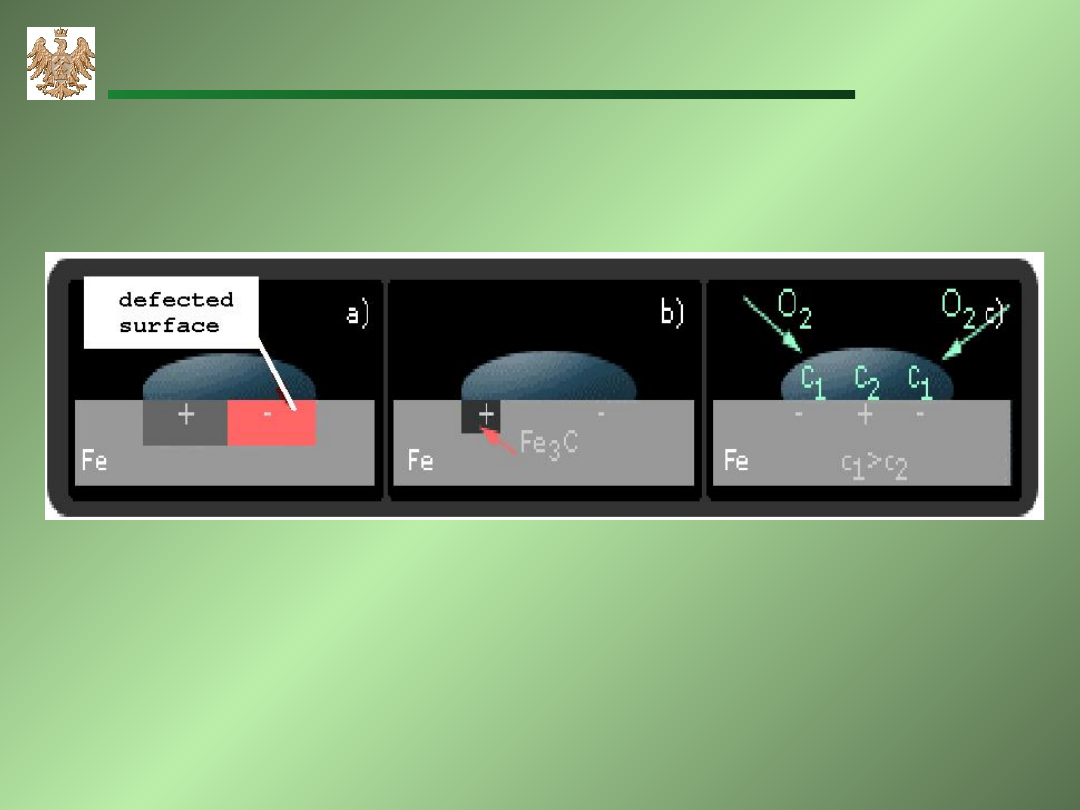
Ogniwa galwaniczne
Ogniwa galwaniczne
Rodzaj procesu korozyjnego związany jest z:
a)występowaniem naprężeń, b) obecnością wtrąceń,
c) różnicą stężeń.
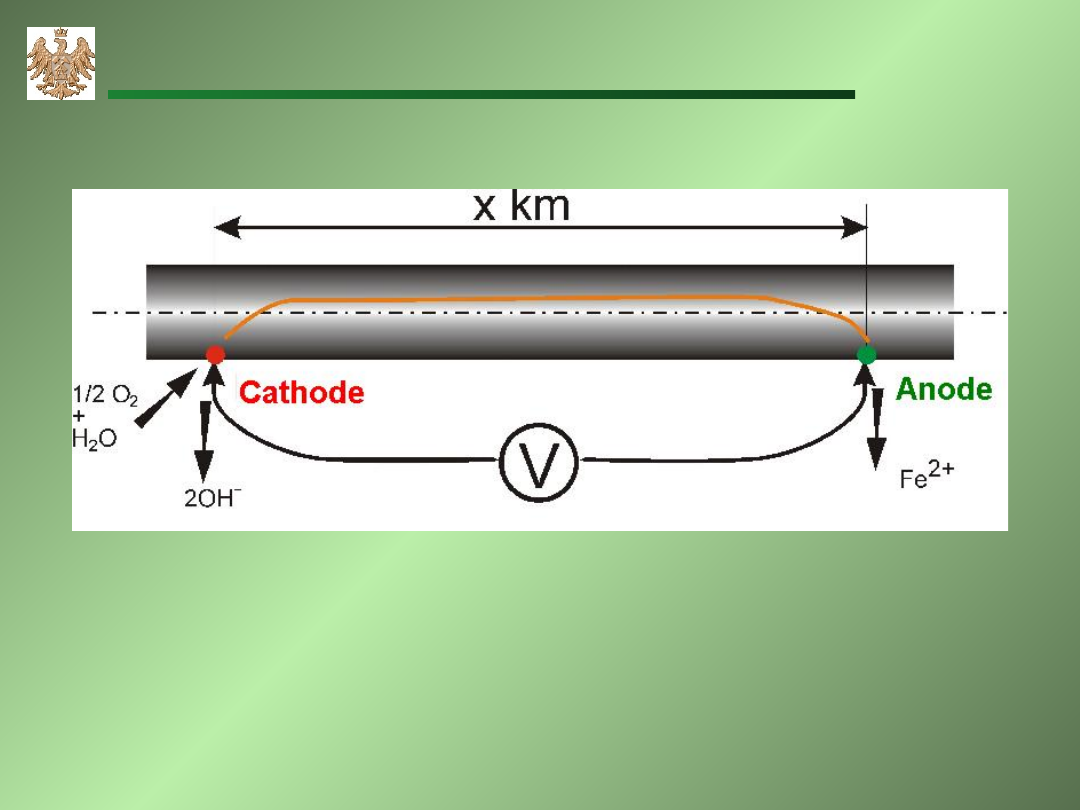
AGH-WIMiR, wykład z chemii ogólnej
Schemat ogniwa korozyjnego w rurociągu
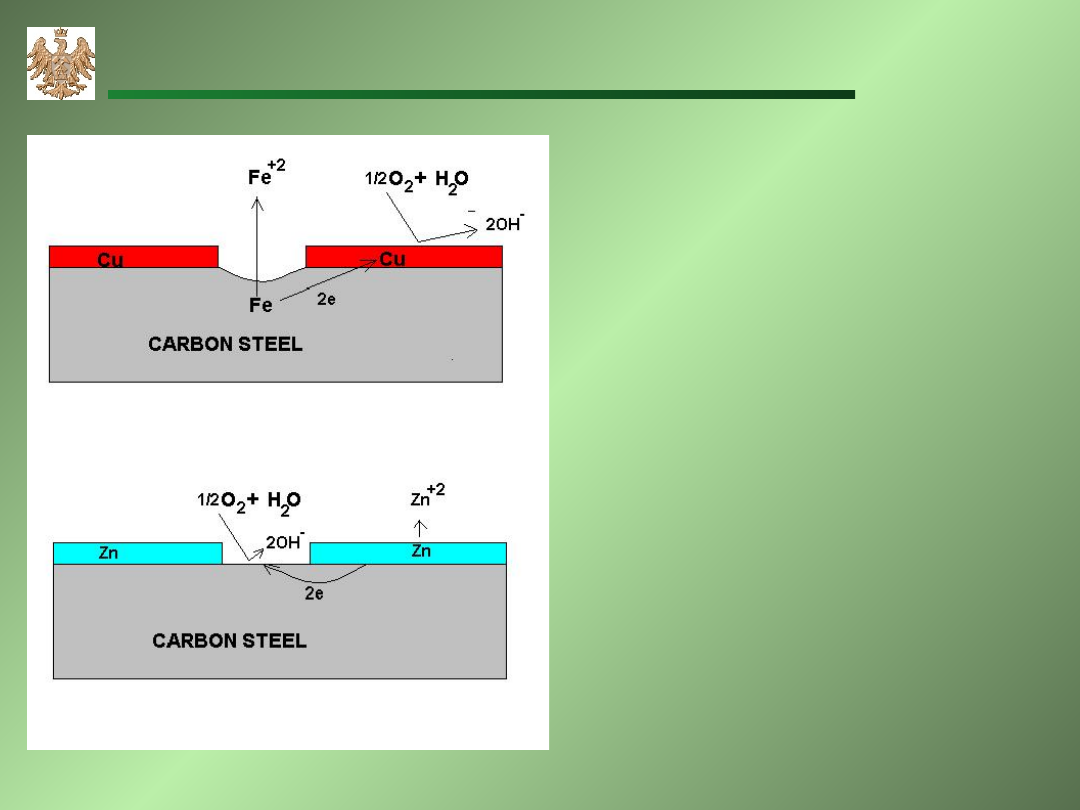
AGH-WIMiR, wykład z chemii ogólnej
Schemat ogniwa korozyjnego:
a) stal węglowa pokryta miedzią,
b) stal węglowa pokryta cynkiem.
AGH-WIMiR, wykład z chemii ogólnej
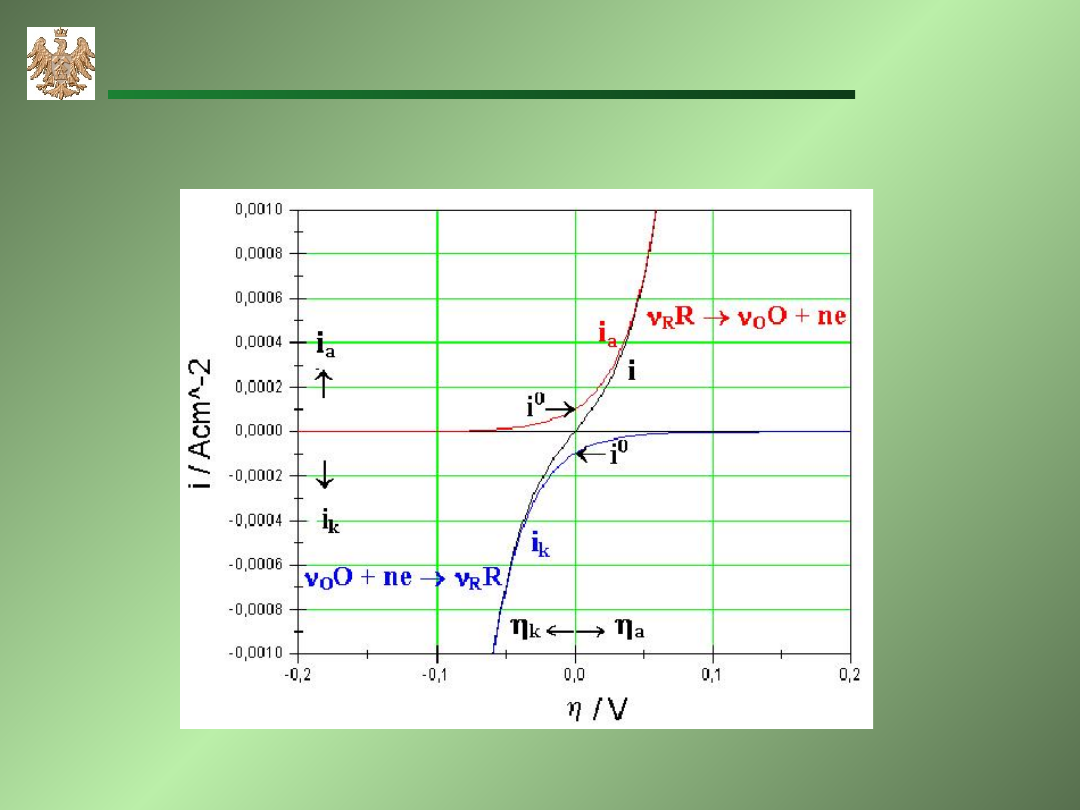
Polaryzacja elektrochemiczna
Polaryzacja elektrochemiczna
Diagram polaryzacyjny dla reakcji:
O
O + ne
R
R
nH
+
+ ne n/2H
2
M M
n+
+ ne

AGH-WIMiR, wykład z chemii ogólnej
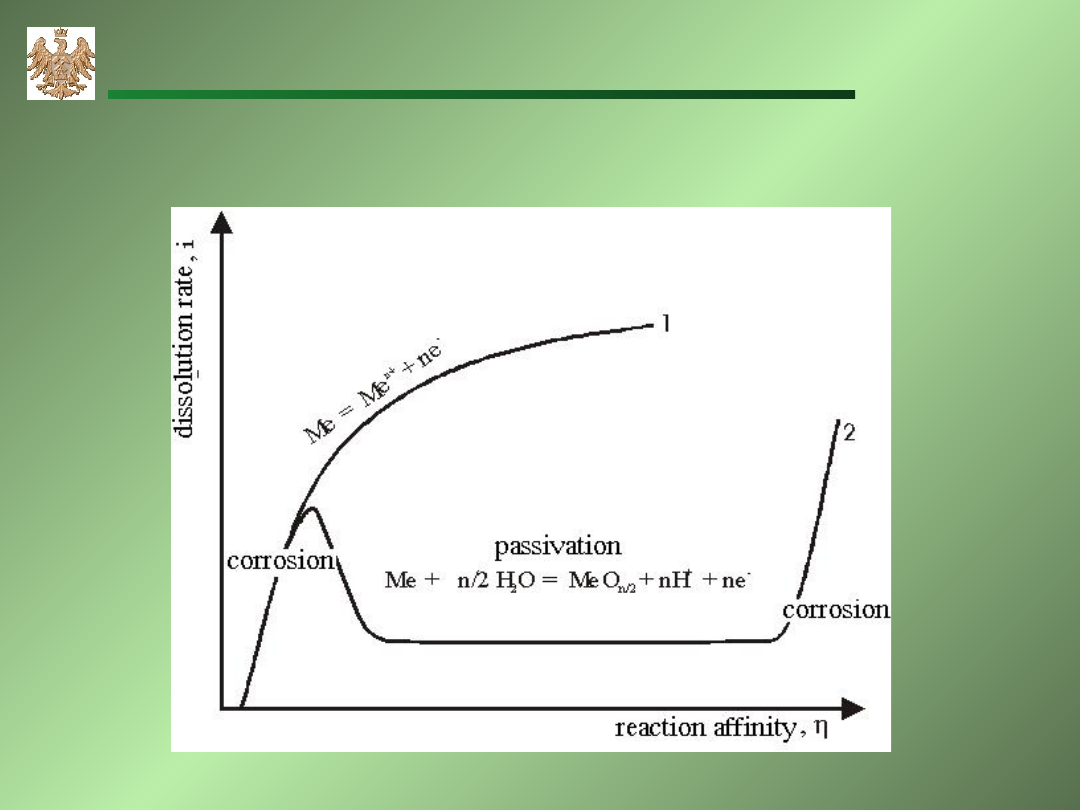
Pasywacja
Pasywacja
Pasywacja
Pasywacja – stan odporności korozyjnej aktywnego
metalu w wyniku utworzenia odpornej warstwy
powierzchniowej inhibitującej proces korozji w
określonym środowisku i określonych warunkach pH.
AGH-WIMiR, wykład z chemii ogólnej
Anodowe zachowanie metali
Anodowe zachowanie metali
AGH-WIMiR, wykład z chemii ogólnej
e
H
MeOH
)
O
H
(
Me
O
H
Me
ad
ad
2
2
e
H
)
OH
(
Me
2
O
H
MeO
2
O
H
2
e
MeOH
O
H
Me
2
2
H
rozpuszczanie
pasywacja
Możliwe ścieżki reakcji metalu w wodzie.

AGH-WIMiR, wykład z chemii ogólnej
Mechanizm of pasywacji
Mechanizm of pasywacji
Źródłem tlenu, niezbędnego dla powstania warstwy pasywnej,
mogą być:
- w środowisku wodnym:
• cząsteczki wody,
• rozpuszczony tlen.
- w środowiskach bezwodnych:
• cząsteczki kwasów tlenowych (H
2
SO
4
, H
3
PO
4
, HNO
3
, HCOOH),
• aniony zawierające tlen (CrO
4
-2
, Cr
2
O
7
-2
, MnO
4
-
),
• cząsteczki rozpuszczalnika (CH
3
OH).
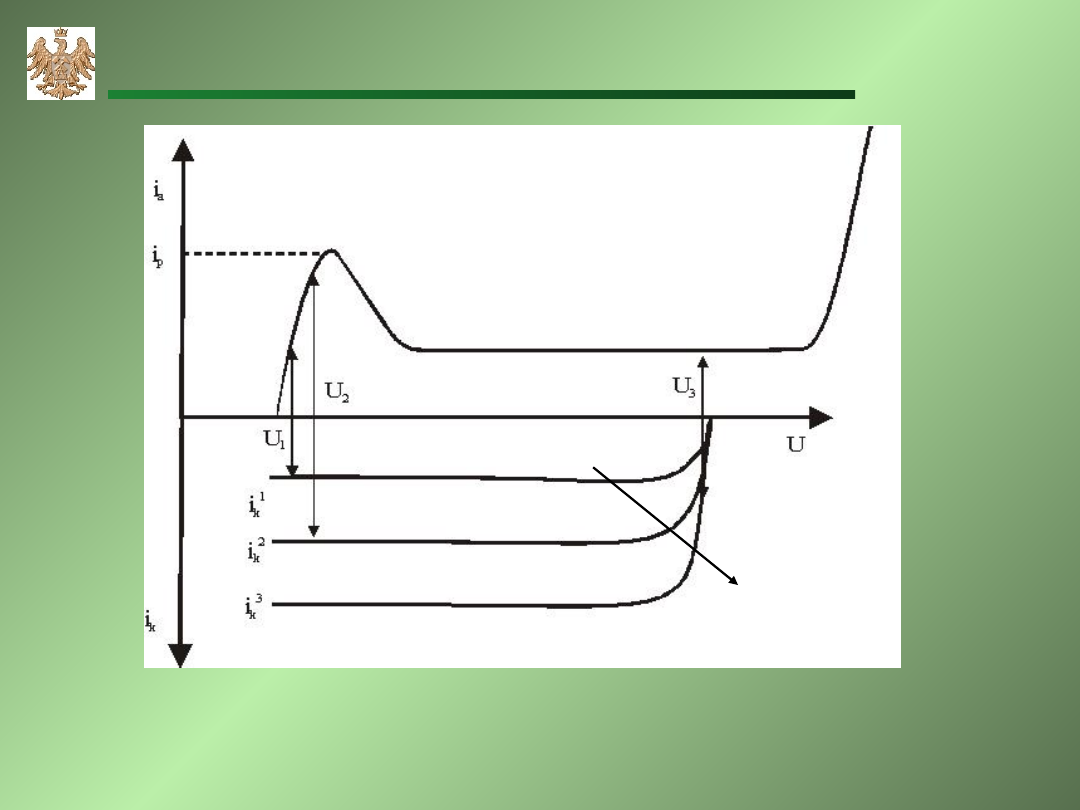
AGH-WIMiR, wykład z chemii ogólnej
2
O
p
3
corr
p
3
k
U
U
i
i
Wpływ stężenia utleniacza na zdolność do pasywacji
AGH-WIMiR, wykład z chemii ogólnej
Odpornośc korozyjna stopów zależy od obecności i ilości
składników
stopowych
posiadających
wysokie
powinowactwo do tlenu i zdolności tworzenia warstwy
pasywnej.
Najważniejszym
pierwiastkiem
stopowym
odpowiedzialnym za pasywację jest chrom.
Pasywacja stopów
Pasywacja stopów
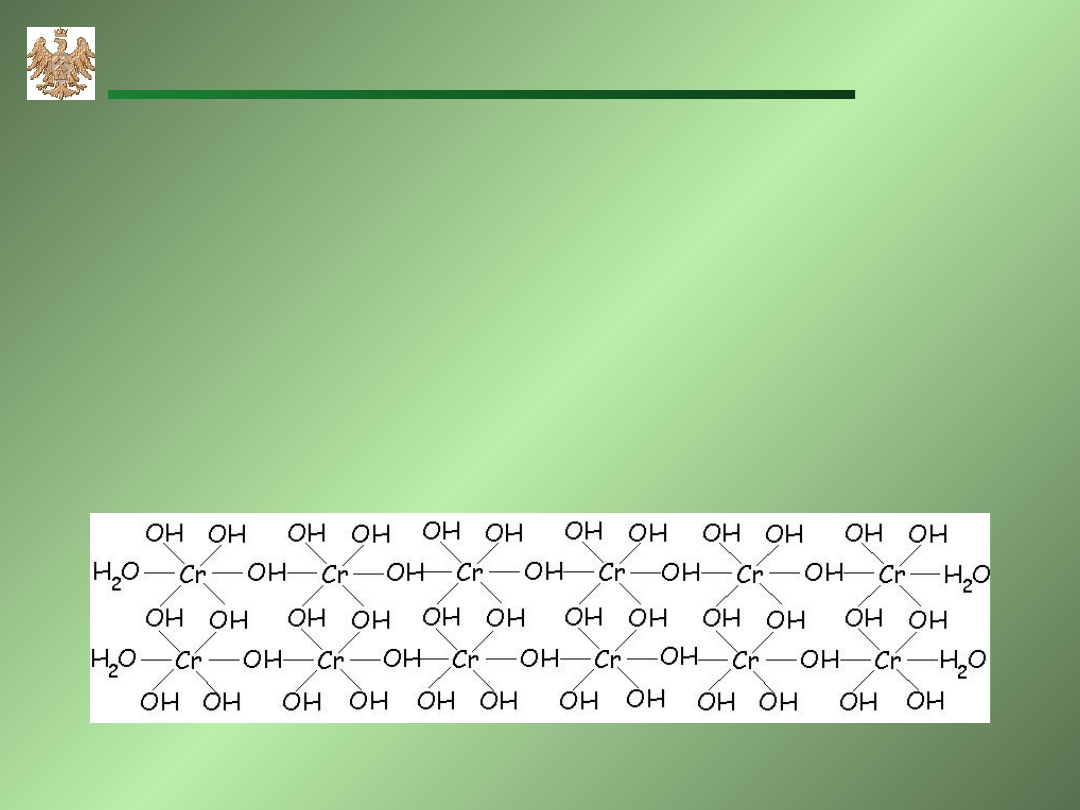
Struktura hydroksytlenku chromu
AGH-WIMiR, wykład z chemii ogólnej
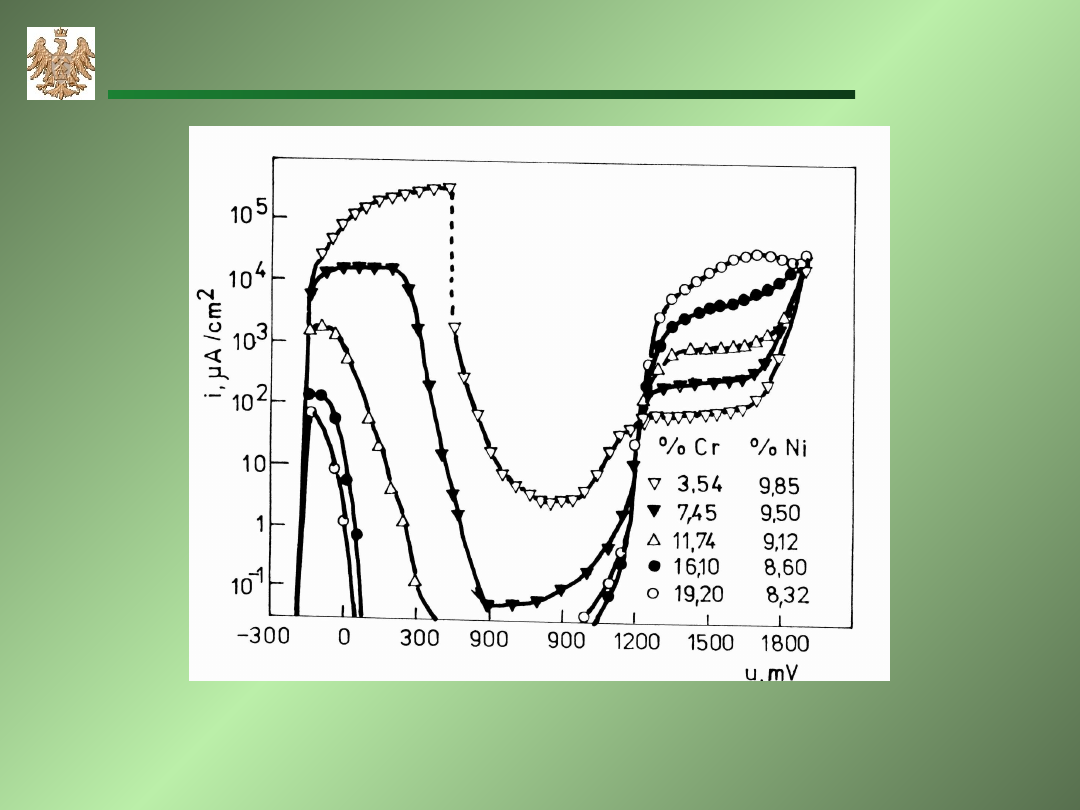
Wpływ zawartości chromu na pasywację stopu Fe-Cr-Ni w 1M H
2
SO
4
.
AGH-WIMiR, wykład z chemii ogólnej
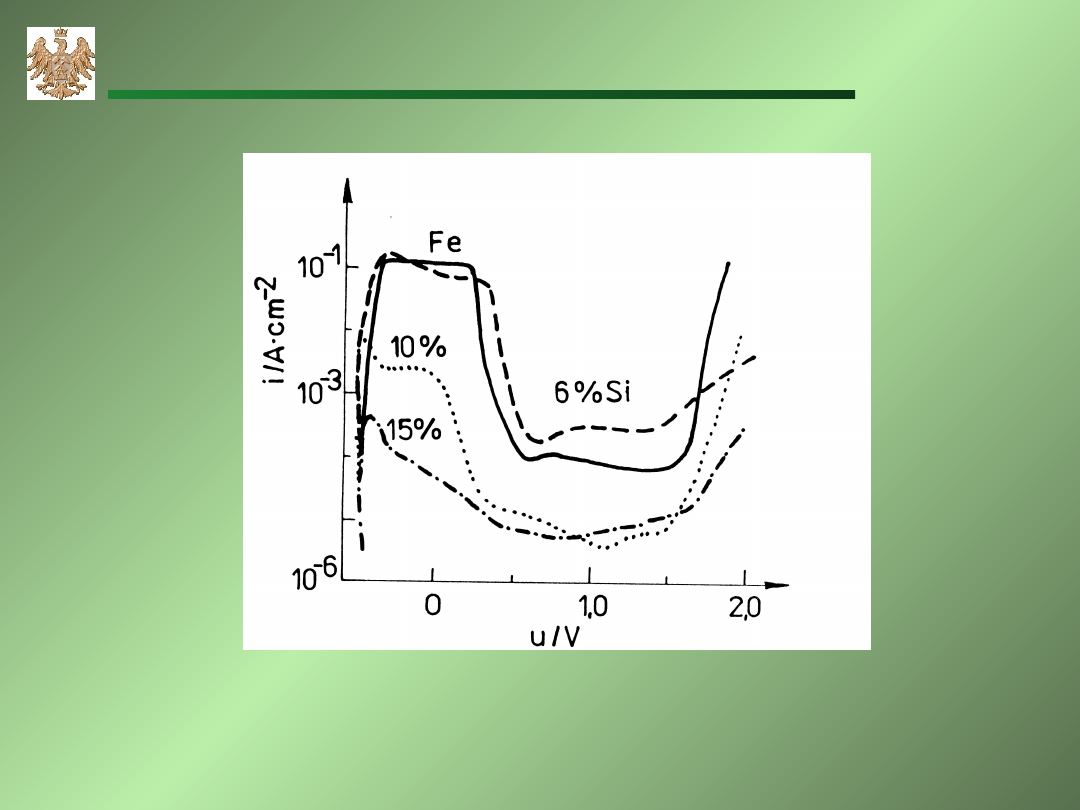
Wpływ zawartości chromu na pasywację stopów Fe-Si w 1M H
2
SO
4
.
AGH-WIMiR, wykład z chemii ogólnej
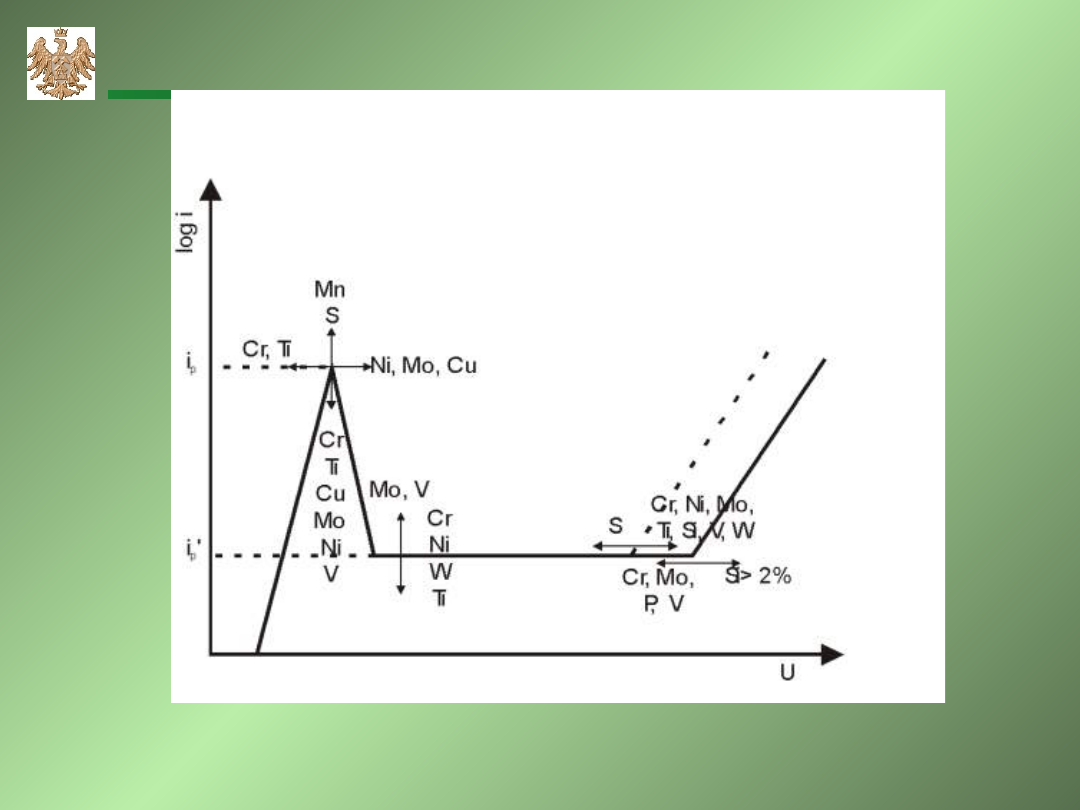
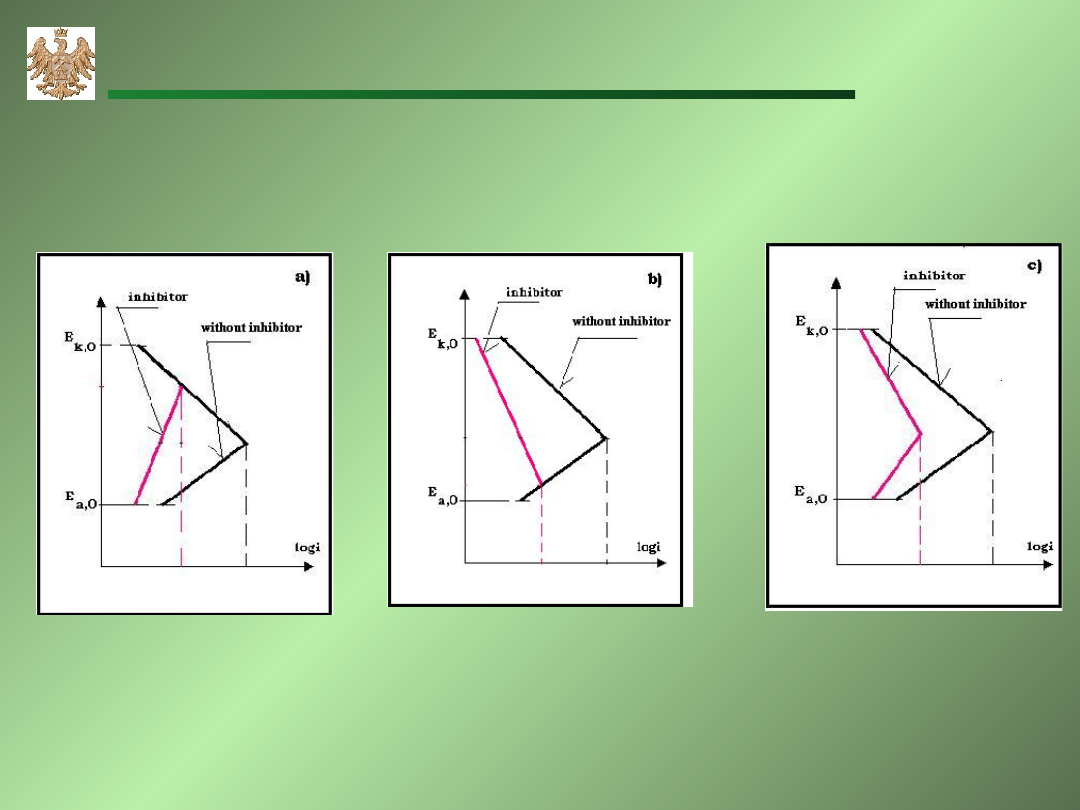
Wpływ składników stopowych na kształt
krzywych polaryzacji stopów żelaza
.
AGH-WIMiR, wykład z chemii ogólnej
Korozja wżerowa
Korozja wżerowa
Korozja wżerowa
Korozja wżerowa – rodzaj korozji lokalnej w wyniku której
powstają „dziury” w materiale.
Jest bardziej niebezpieczna od korozji ogólnej, ponieważ
trudniej ją przewidzieć i jej przeciwdziałać.
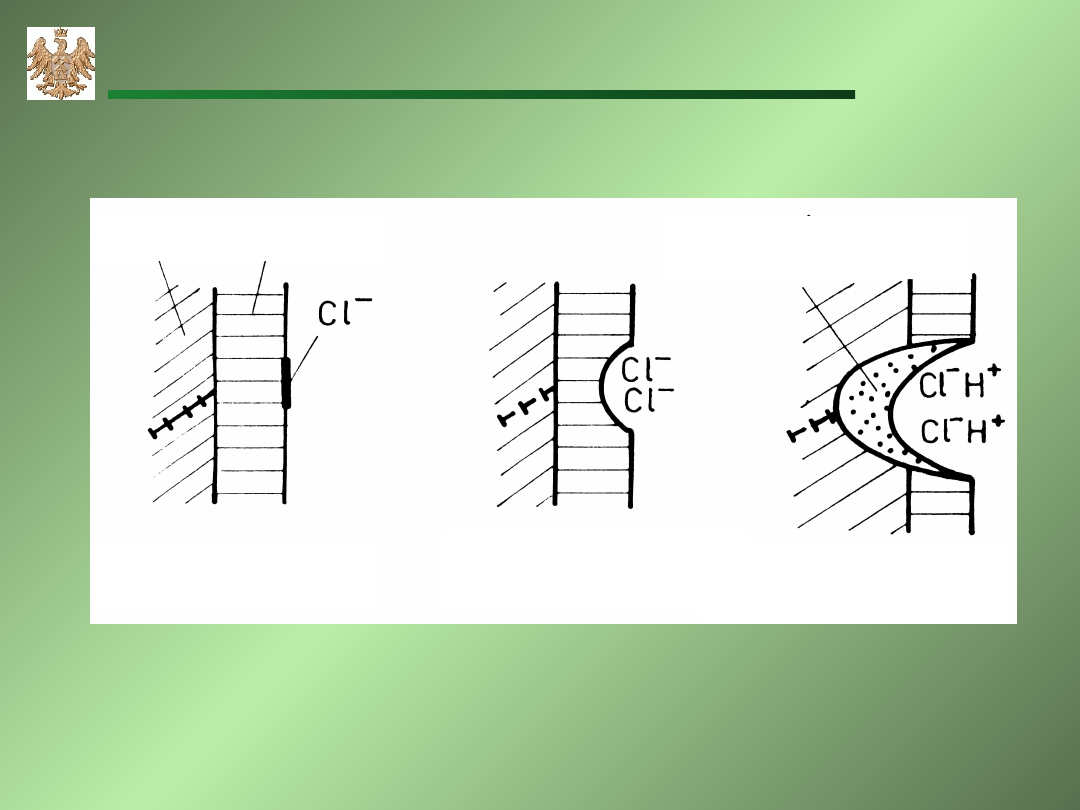
AGH-WIMiR, wykład z chemii ogólnej
metal oxide
salt layer
absorption
of chloride ion
initiation
of pit
development
of pit
Mechanizm korozji wżerowej w chlorkach.
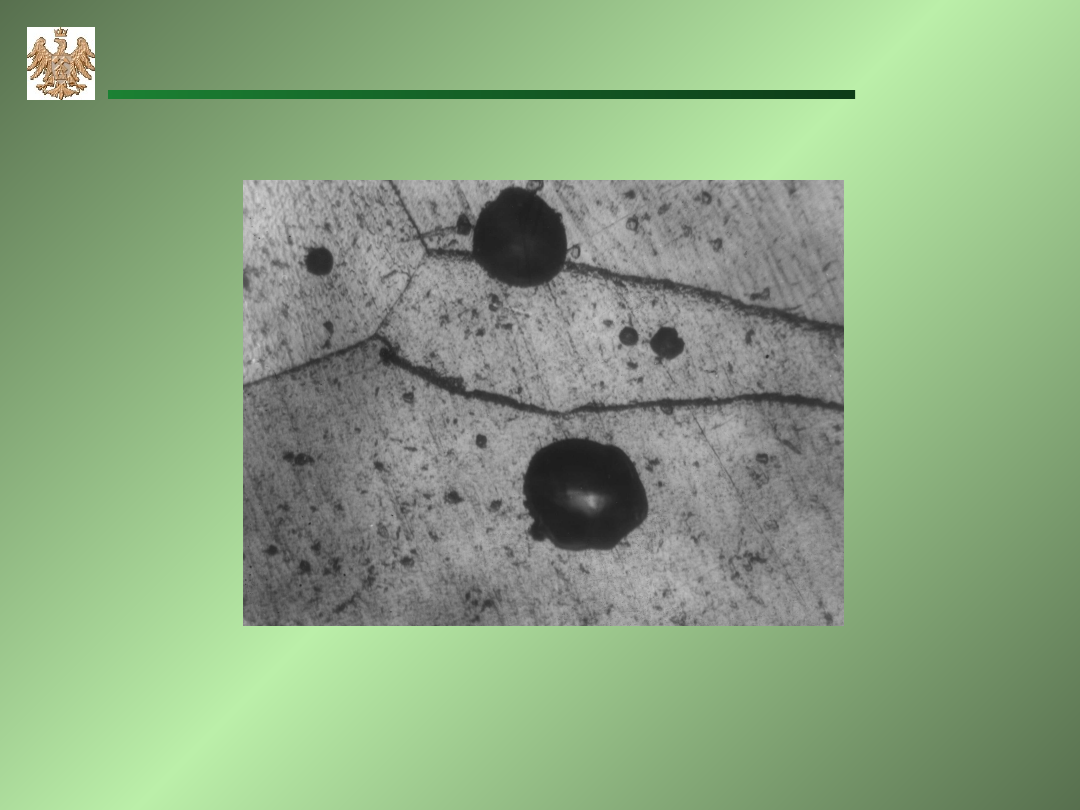
AGH-WIMiR, wykład z chemii ogólnej
Korozja wżerowa stopu Fe - 18% Cr w CH
3
OH - 1MH
2
SO
4
AGH-WIMiR, wykład z chemii ogólnej
Korozja międzykrystaliczna
Korozja międzykrystaliczna
Korozja międzykrystaliczna
Korozja międzykrystaliczna – korozja zachodzą wzdłuż
granic ziaren metalu, osłabiająca znacząco właściwości
mechaniczne stopu.

AGH-WIMiR, wykład z chemii ogólnej
Korozja międzykrystaliczna części samolotu wykonana ze stopu
aluminum 7075-T6

AGH-WIMiR, wykład z chemii ogólnej
Korozja naprężeniowa
Korozja naprężeniowa
Korozja
naprężeniowa
Korozja
naprężeniowa
–
pęknięcia
materiału
spowodowane
naprężeniami
oraz
środowiskiem
korozyjnym.

AGH-WIMiR, wykład z chemii ogólnej
Korozja naprężeniowa wymiennika cieplnego ze stopu
Inconel z pęknięciami wzdłuż granic ziaren.

AGH-WIMiR, wykład z chemii ogólnej
Ochrona przed korozją
Ochrona przed korozją
• stopy odporne na korozję,
• kompozyty,
• powłoki ochronne,
• ochrona katodowa,
• ochrona anodowa,
• inhibitory.
AGH-WIMiR, wykład z chemii ogólnej
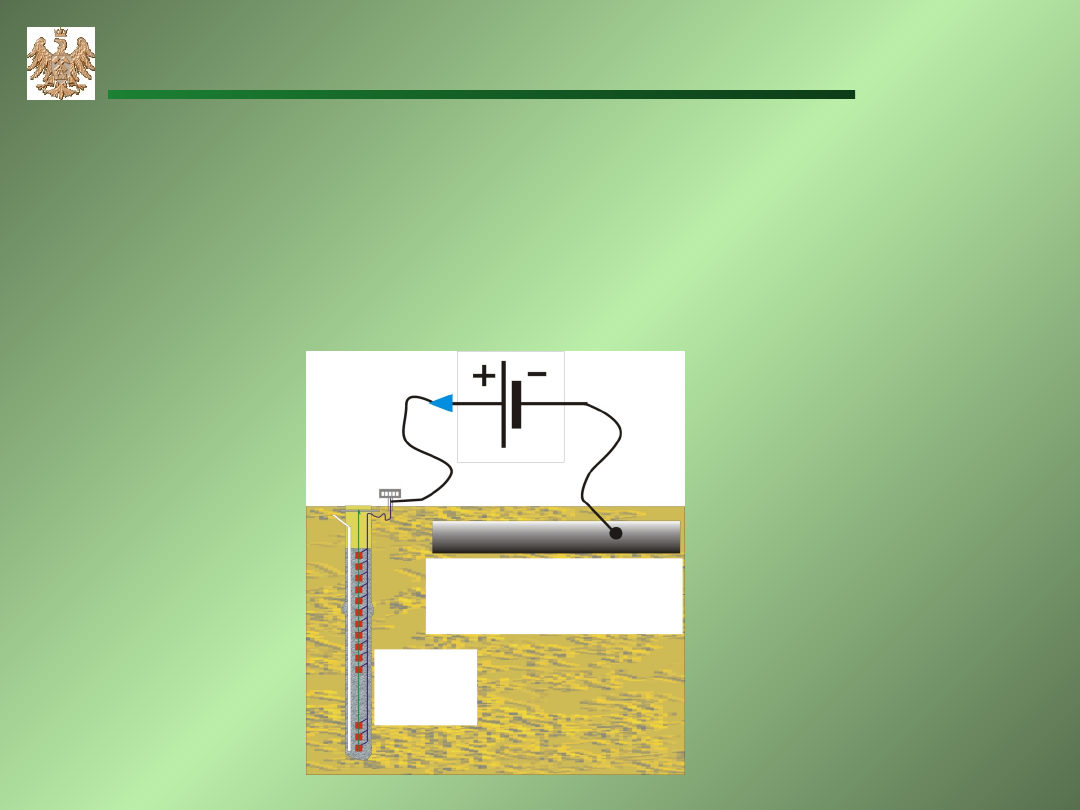
Ochrona katodowa
Ochrona katodowa
Chroniony metal jest katodą – pokrywa się go metalem o
niższym potencjale (protektor), bądź podnosi się jego
potencjał poprzez zewnętrzne źródło zasilania.
pipeline -
cathode
anod
e
current

AGH-WIMiR, wykład z chemii ogólnej
Powłoki ochronne metaliczne
Powłoki ochronne metaliczne
0
n
M
ne
M
Zn
2+
+ 2e Zn
0
Cu
2+
+ 2e Cu
0
Ni
2+
+ 2e Ni
0
Cr
3+
+ 3e Cr
0
Ag
+
+ e Ag
0
Au
3+
+ 3e Au
0
Przykłady:
AGH-WIMiR, wykład z chemii ogólnej
Powłoki ochronne organiczne
Powłoki ochronne organiczne
D r y in g o ils
B itu m e n s
F o s s il r e s in s
L o w - m o le c u la r
C e lu lo s e d e r iv a tiv e s
N a tu r a l r u b b e r
C a s e in
H ig h - m o le c u la r
N a tu r a l
A lk y d r e s in s
P o ly e s te r s
E p o x y r e s in s
P h e n o lic r e s in s
A m in o r e s in s
P o ly a m id e s
P o ly u r e th a n s
S ilic o n s
C o n d e n s a tio n a n d a d d itio n o lig o m e r s
R u b b e r
P o ly o le fi n
P o ly v in y l c h lo r id e
P o ly v in y l a c e ta te s
P o ly a c r y ls
A d d itio n p o ly m e r s
S y n th e tic
F ilm f o r m in g s u b s ta n c e s
o r ig in f r o m
AGH-WIMiR, wykład z chemii ogólnej
a) inhibitory anodowe, np. fosforany, krzemiany);
b) inhibitory katodowe, np. Ca(HCO
3
)
2
, polifosforany,;
c) inhibitory anodowo–katodowe, np. aminy.
Inhibitory
Inhibitory
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
Wyszukiwarka
Podobne podstrony:
wyklad3 pps
wyklad5 pps
wyklad2 pps
wyklad6 pps
wyklad8 pps
wyklad3 pps
Lachu opracowanie otwarte Kerto me edit, INNE, WYKŁADY Lach, pps na 17 czerwca
Pedagogika specjalna 31.05.2011 WYKŁAD, Studia, PPS
19.04.2011Podstawy pedagogiki specjalna wykład, Studia, PPS
kololach2, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
Lachu opracowanie otwarte Kerto, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
PPS I KOLOKWIUM, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
więcej podobnych podstron