
Chemia ogólna
Chemia ogólna
Wykład 8

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
2
Wprowadzenie
Wprowadzenie
Chemia organiczna= chemia węgla
chemia życia

3
Histor
Histor
ia
ia
1828 - F. Wöhler – synteza mocznika
10 000 000 znanych związków organicznych
100 000 nowych związków syntezowanych każdego roku
NH4CNO
NH2
C O
NH2
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

4
Chemia węgla
Chemia węgla
Węgiel we wszystkich związkach organicznych jest
czterowartościowy
4 wolne elektrony
Węgiel może tworzyć łańcuchy otwarte i zamknięte
Stany atomowe węgla
łańcuch prosty
C C C C C
C C C C C
C
C
C
łańcuch rozgałęziony
wiązania
wielokrotne
C C C C C
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

5
Węglowodory
Węglowodory
Związki zbudowane wyłącznie z węgla i wodoru
węglowodory
węglowodory
alifatyczne
• alkany,
• alkeny,
• alkiny
alicykliczne
• cykloalkany,
• cykloalkeny,
• cykloalkiny
aromatyczne
• benzen,
• homologi benzenu,
• pochodne benzenu
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
6
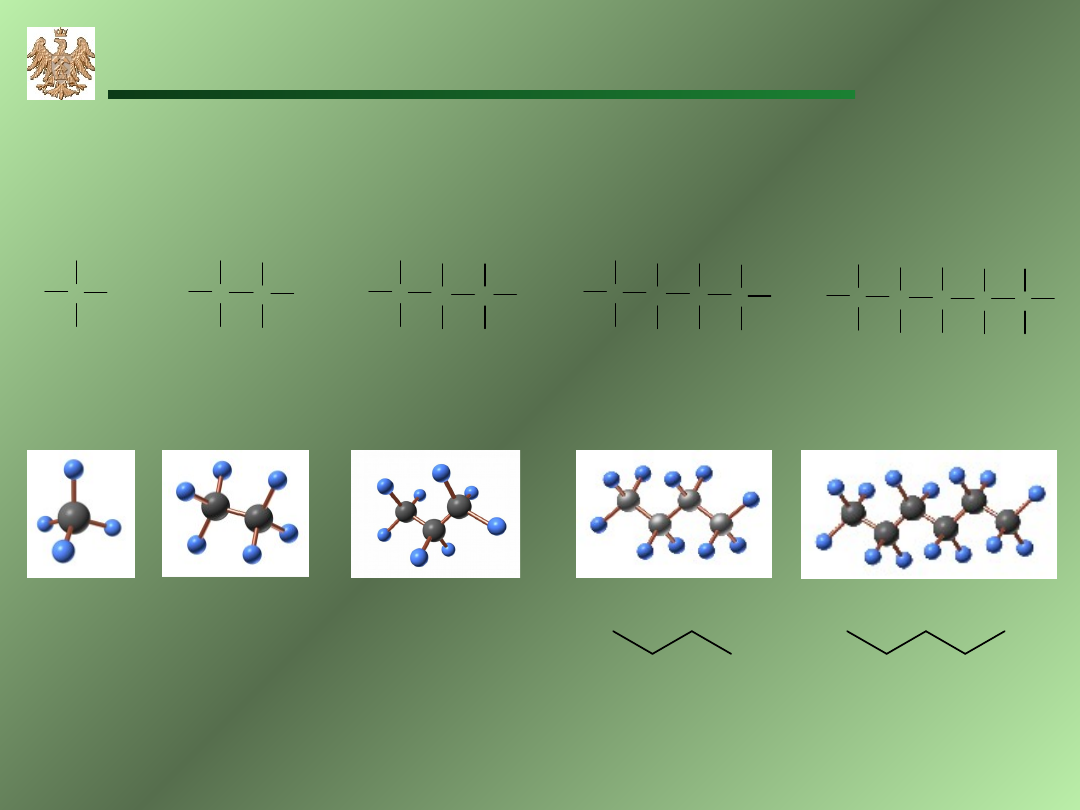
Alkan
Alkan
y
y
C
C
n
n
H
H
2n+2
2n+2
CH
3
metan
etan
propan
butan
CH
3
CH
3
CH
3
CH
2
CH
3
CH
3
CH
2
CH
2
CH
3
pentan
CH
3
CH
2
CH
2
CH
2
CH
3
C
H
H
H
H H
H
C
C H
H
H
H
C
H
H
H
H
H
H
C
C
H
H
C
H
H
H
H
H
C
C
H
H
H
C
H
H
C
H
H
H
H
H
C
C
H
H
H
C
H
H H
H
C
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

7
Nazewnictwo alkanów
Nazewnictwo alkanów
• znajdź najdłuższy łańcuch i ponumeruj atomy węgla zaczynając
od końca z większą ilością podstawników: 9 węgli nonan,
• znajdź wszystkie podstawniki i podaj numery atomów węgla, do
których są doczepione: 2-metylo, 5-(1,2-dimetylopropylo)
• uszereguj podsatwniki w porządku alfabetycznym:
5-(1,2-dimetylopropylo) 2-metylononane
CH3
CH CH
CH
CH3
CH3
CH3
CH3
CH2 CH2
CH2
CH2
CH
CH2
CH3
1
2
3
4
5
6
7
8
9
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

8
Izomeria strukturalna
Izomeria strukturalna
ten sam wzór ogólny, różne struktury
CH3
CH2CH2
CH2
CH3
pentan
CH3
CH
CH3
CH2
CH3
2-metylobutan
CH3
CH3
CH3
CH3 C
2,2-dimetylopropan
C
C
5
5
H
H
12
12
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
9
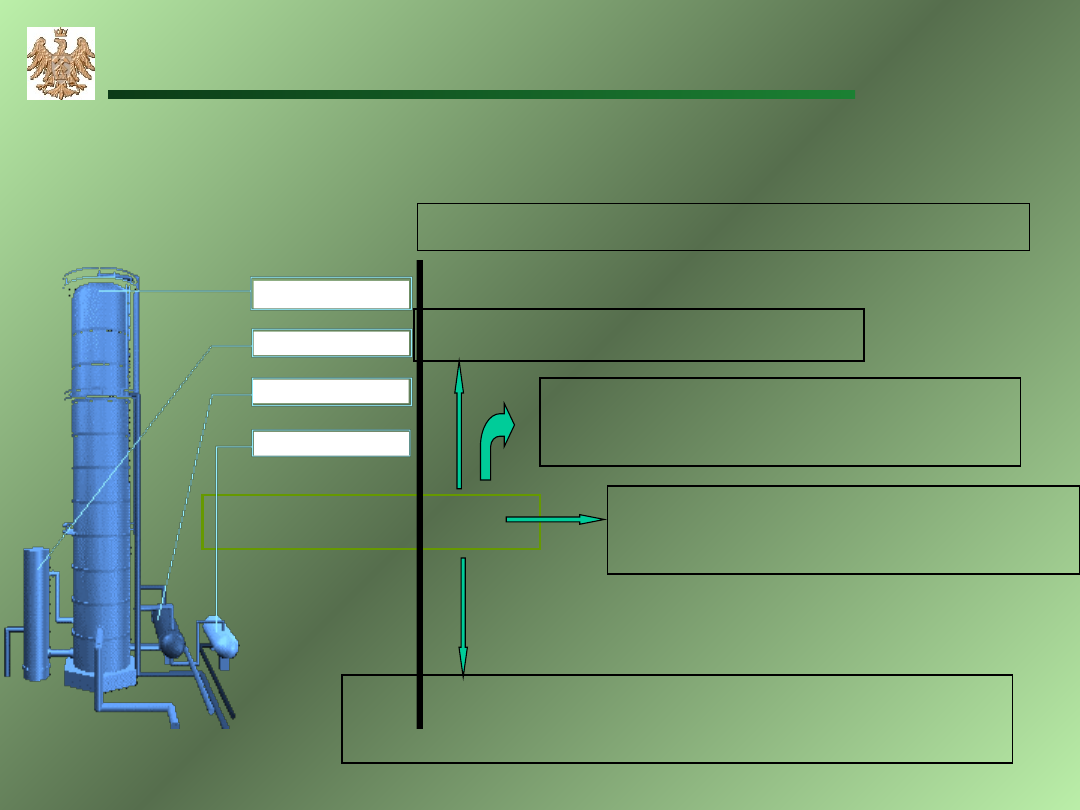
Fizyczne własności alkanów
Fizyczne własności alkanów
Destylacja frakcyjna ropy naftowej
Ropa naftowa
Nafta (C
12
–C
16
- ciecze)
temp. wrzenia (200 – 250ºC)
Olej opałowy(C
15
–C
18
– ciała stałe)
temp. wrzenia (250 – 300ºC)
Gaz ziemny (C
1
–C
4
)
Benzyna (C
4
–C
12
– ciecze)
temp. wrzenia (40–200ºC)
Wieża destylacyjna
redestylator
Kondensator
zbiornik zwrotny
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

10
Rea
Rea
kcje alkanów
kcje alkanów
Q
O
H
CO
O
CH
2
2
2
4
Spalanie
Podstawianie
Odwodornienie
2
.
kat
2
2
H
R
CH
CH
R
R
CH
CH
R
H
X
CH
CH
H
X
H
CH
CH
H
2
2
2
2
np. halogenowanie
HCl
Cl
CH
CH
H
Cl
H
CH
CH
H
2
2
światło
2
2
2
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

11
Alken
Alken
y
y
C
C
n
n
H
H
2n
2n
eten
1–propen
1–buten
CH2
CH2
CH3
C C
H
H
H
CH3
C C
H
H
H
C
H
H
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
12
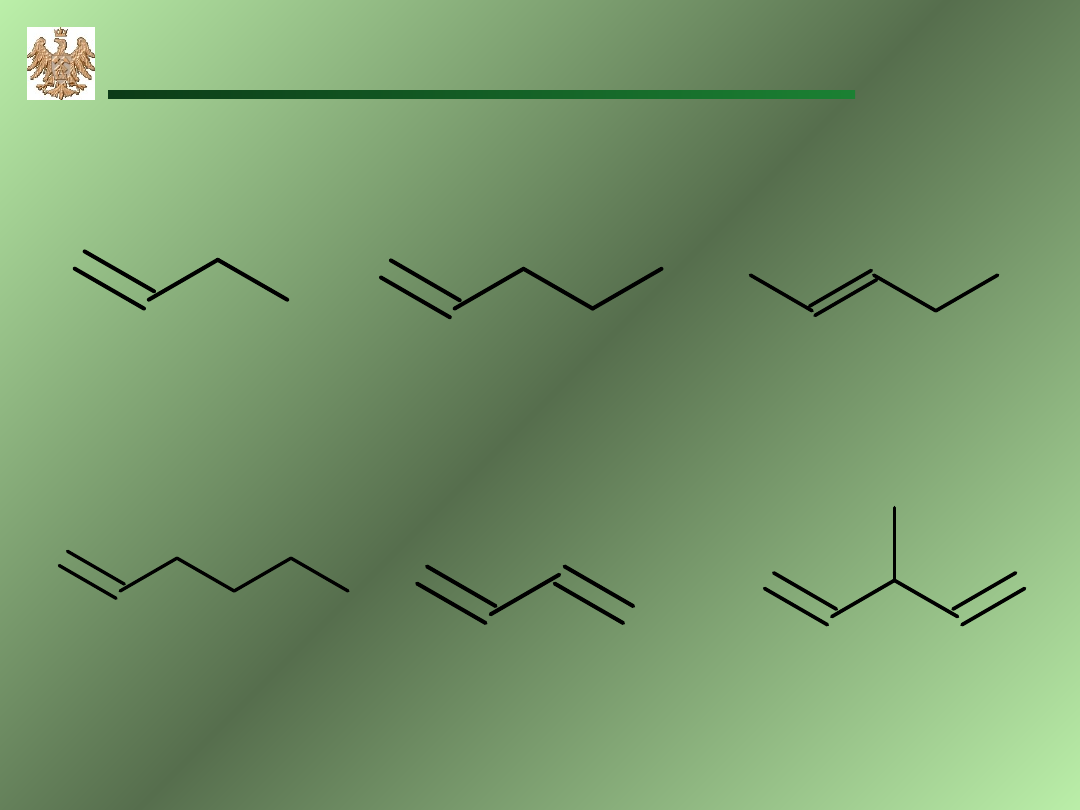
1-buten
1-penten
1-hexen
1,3-butadien
3-metylo-1,4-pentadien
2-penten
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
13
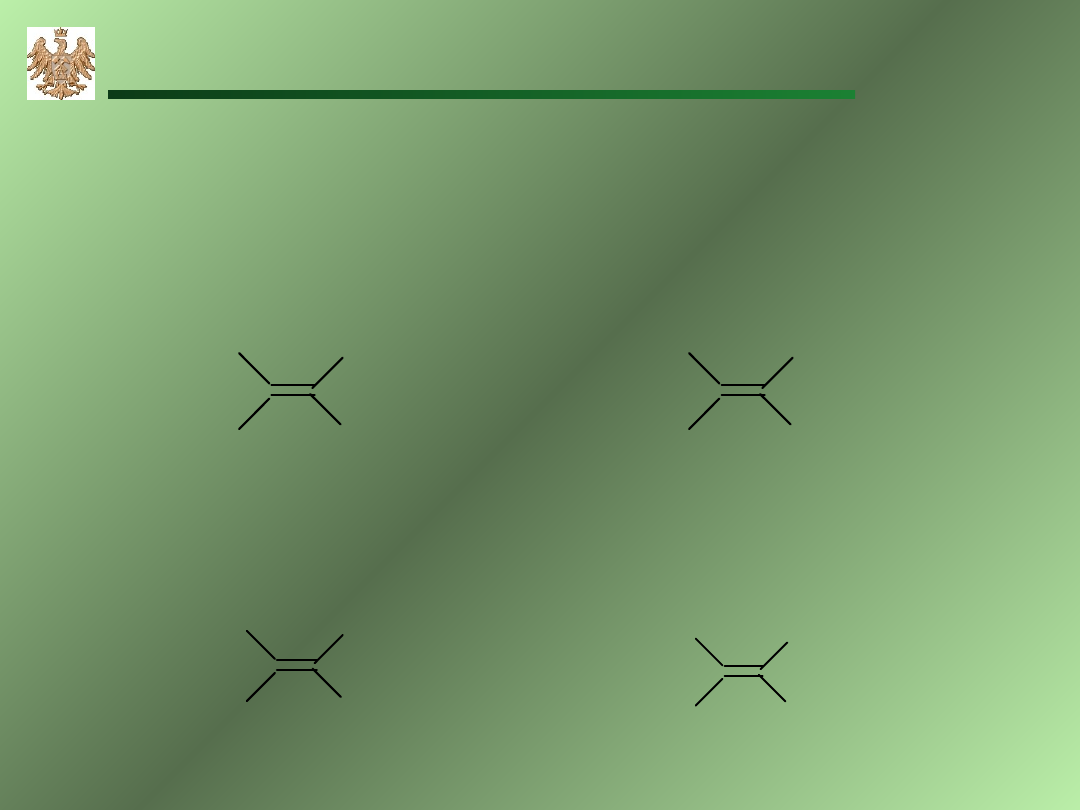
Izomeria geometryczna
Izomeria geometryczna
cis
cis -
trans-
trans-
cis-(Z)-2-buten
trans-(E)-2-buten
Ten sam wzór – różne własności chemiczne i fizyczne
H
H
R
R
H
H
R
R
CH
3
CH
3
H
H
CH
3
CH
3
H
H
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

14
Rea
Rea
kcje
kcje
alken
alken
ów
ów
energy
O
H
2
CO
2
O
3
CH
CH
2
2
2
2
2
Spalanie
Uwodornienie
R
CH
CH
R
H
R
CH
CH
R
2
2
)
Pt
.
np
(
kat
2
Utlenianie
OH
CH
CH
HO
CH
CH
2
2
O
H
,
OH
,
KMnO
2
2
2
4
Polimeryzacja
n
2
2
2
2
CH
CH
CH
nCH
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
15
jedno podstawione
halogenowcopochodne
sulfozwiązki
alkohole
Przyłączanie
2
2
1
2
2
1
R
CH
CH
R
B
A
R
CH
CH
R
B
A
C C
H
X
H OSO3H
H OH
H+
X X
C C
H
X
C C
H
OSO3H
C C
H
OH
C C
X
X
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
dwu podstawione
halogenowcopochodne

16
Alk
Alk
iny
iny
C
C
n
n
H
H
2n–2
2n–2
etyn
etin
acetylen
propyn
propin
but-1-yn
(1-butyn)
C
H C
H
CH3
C
H C
CH3
CH2
C
H C
C
CH3
CH3
C
but-2-yn
(2-butyn)
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

17
Reakcje alkinów
Reakcje alkinów
Q
O
H
CO
2
O
2
3
CH
CH
2
2
2
Spalanie
Alkiny są bardziej aktywne niż alkeny
gaz spawalniczy
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
18
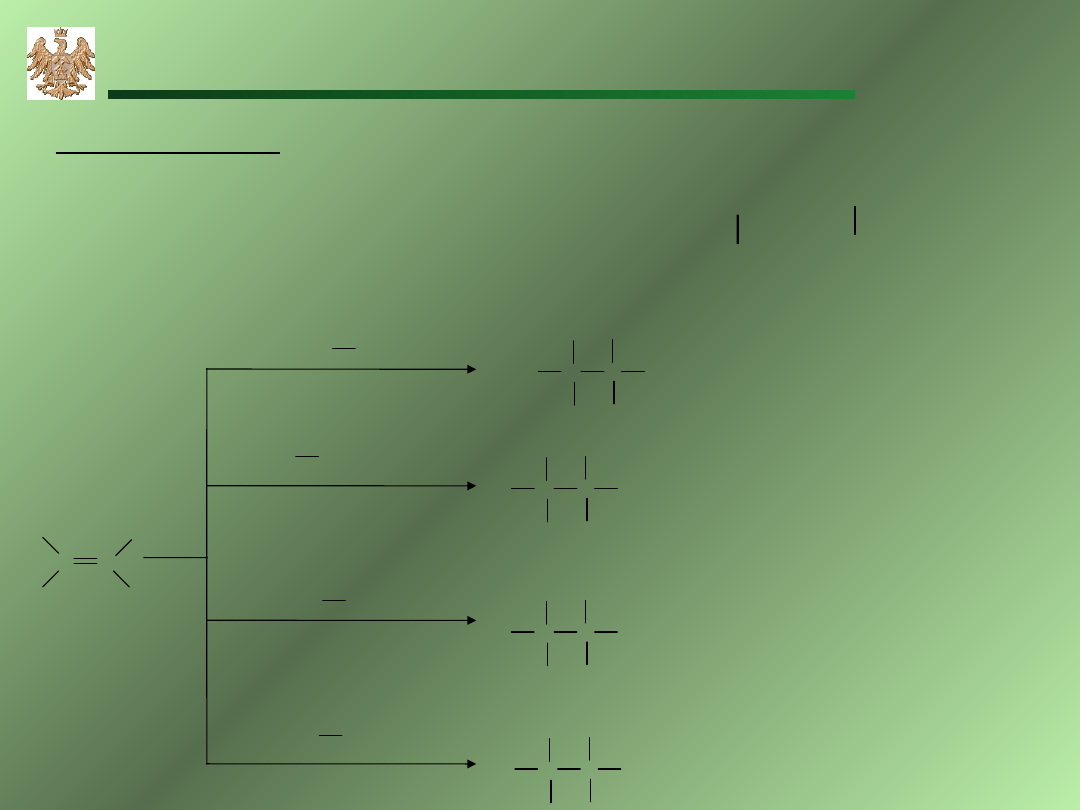
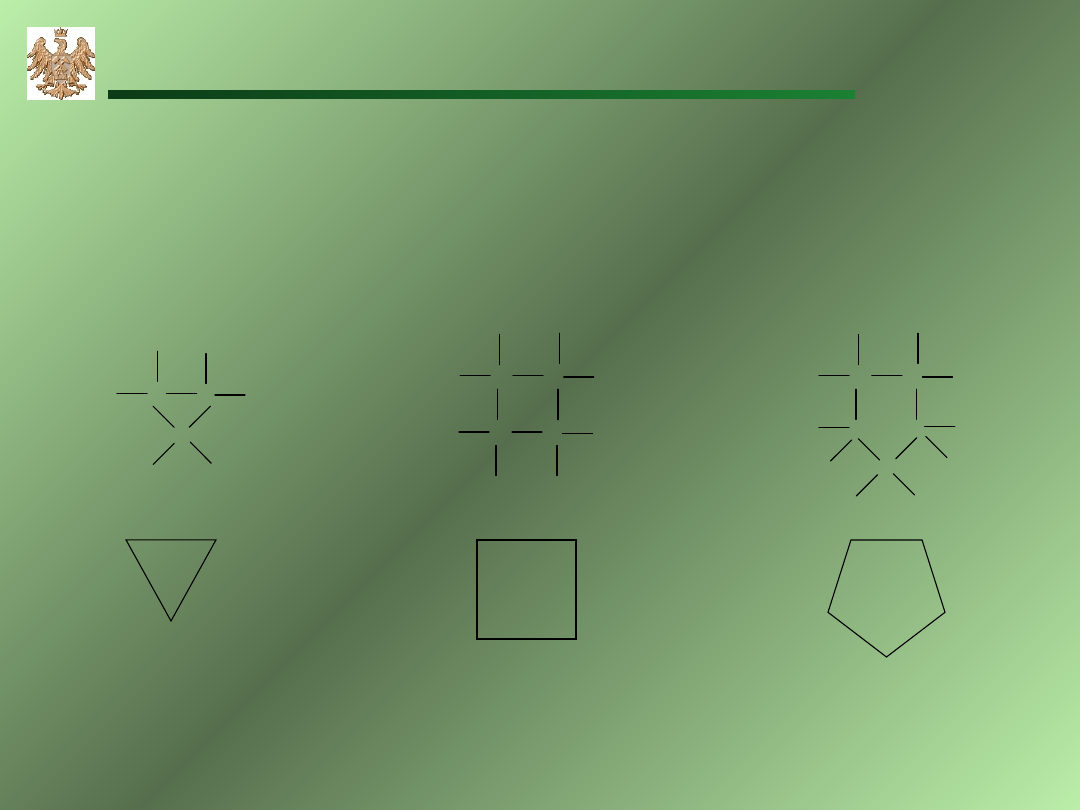
Cy
Cy
k
k
loalkan
loalkan
y
y
C
C
n
n
H
H
2n
2n
cyklopropan
cyklobutan
cyklopentan
C
H
H
H
C
C
H
H
H
C
H
H
H
C
C
H
H
C
H
H
H
C
H
H
H
H
H
C
H
H
C
H
C
H C
H
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
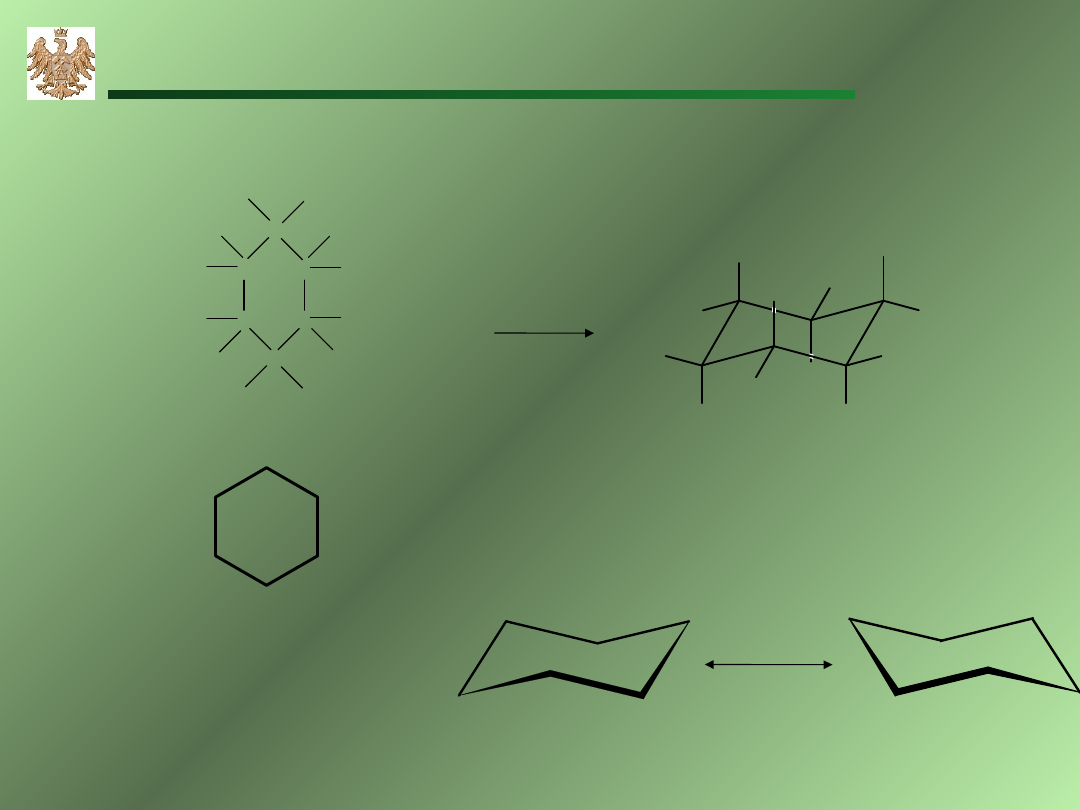
19
H
H
C
H
H
H
C
H
H
C
C
H
H
H
C
C
H
H
cykloheksan
H
H
H
H
H
H
H
H
H
H
H
H
konformacja krzesełkowa
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
20
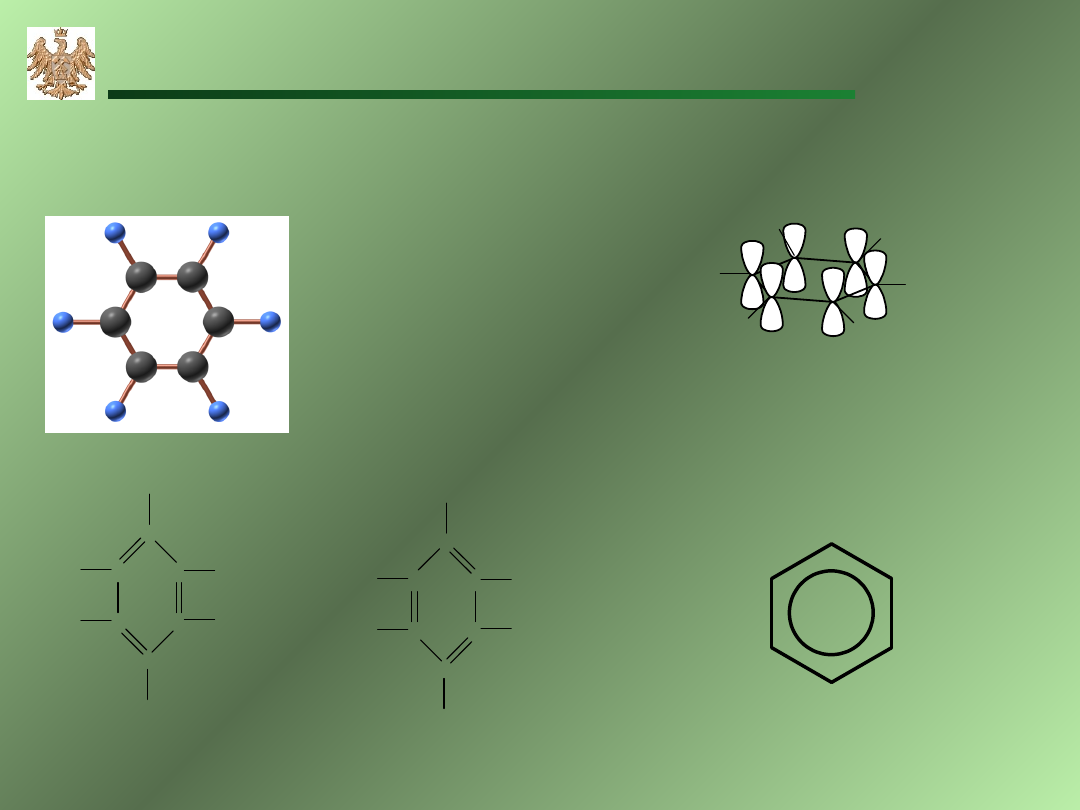
Węglowodory aromatyczne
Węglowodory aromatyczne
Benzen
C
6
H
6
struktury Kekule’go
okrąg reprezentuje
6 elektronów krążących
po całej cząsteczce
H
C
C
H
C
C
H
C
H
C
H
H
H
C
C
H
C
C
H
C
H
C
H
H
6 elektronów z orbitali p
tworzy, chmurę elektronową
stabilizacja aromatyczna
H
H
H
H
H
H
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
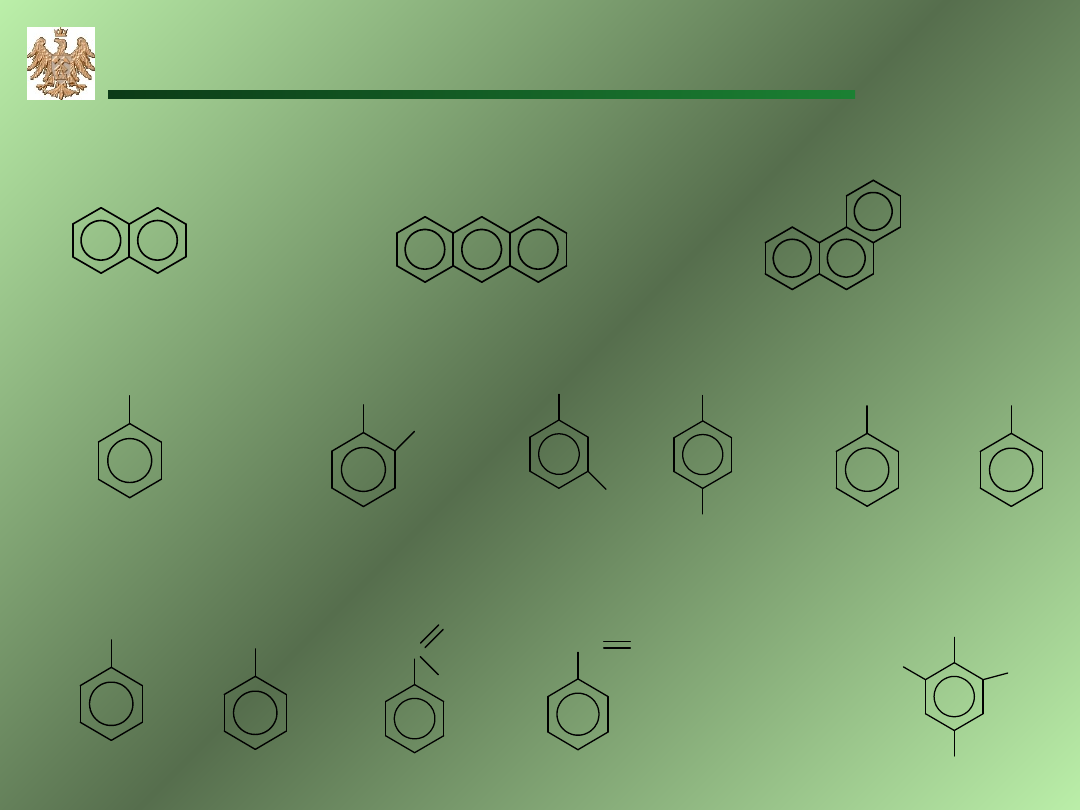
21
Homologi i pochodne beznenu
Homologi i pochodne beznenu
Naftalen
Antracen
Fenantren
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
C
2
H
5
Cl
NH
2
OH
OH
C
O
CH
CH
2
CH
3
NO
2
O
2
N
NO
2
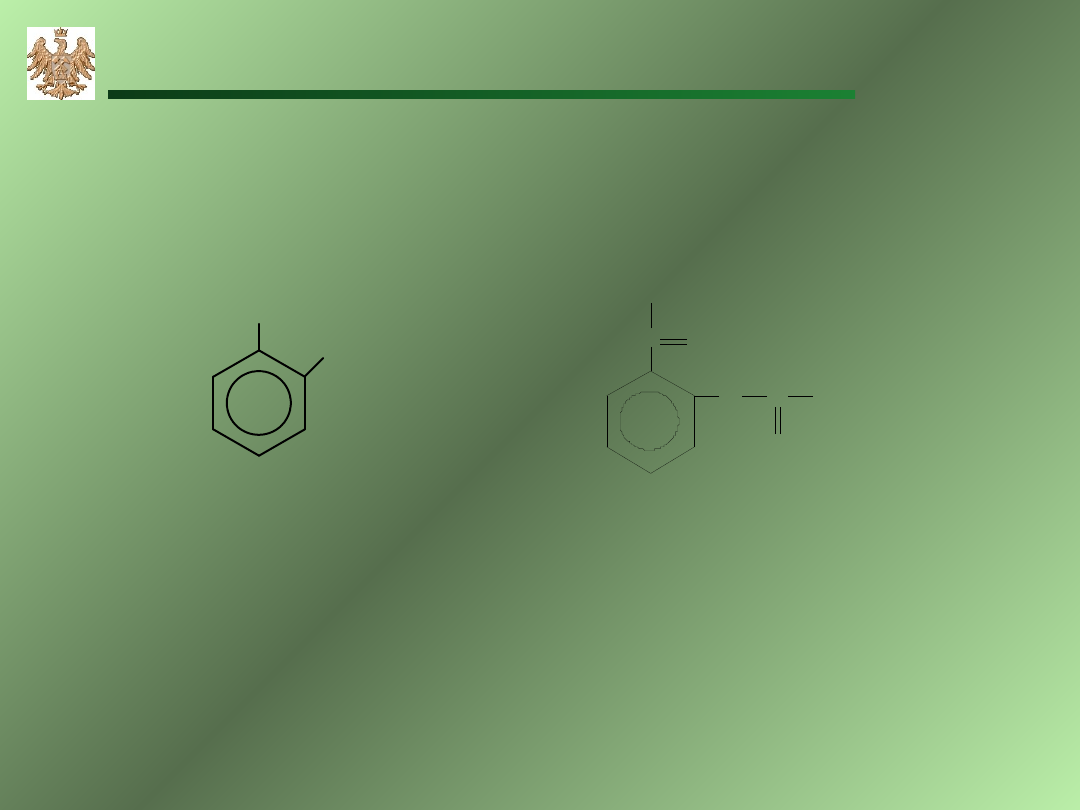
etylobenzen
Toluen
metylobenzen
anilina
fenol
kwas
benzoesowy
chlorobenzen
–meta
-para
2,4,6-trinitrotoluen
(TNT)
1,2–dimetylobenzen
ortho-ksylen
(o–ksylen)
styren
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
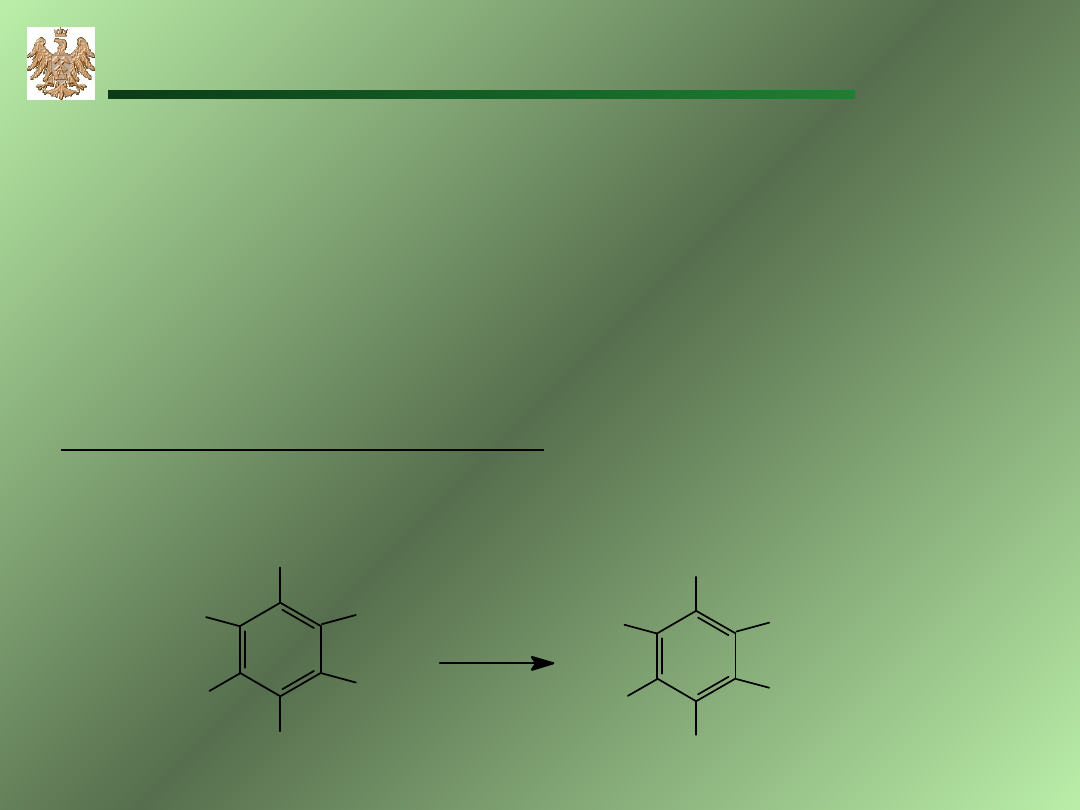
22
Reakcje węglowodorów
Reakcje węglowodorów
aromatycznych
aromatycznych
Elektrofilowe podstawianie
H
H
H
H
H
H
H
H
H
H
H
E
E
+
X
-
H
+
X
-
+
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
Pierścienie aromatyczne są stabilizowane rezonansowo
sprzężonym układem wiązań podwójnych
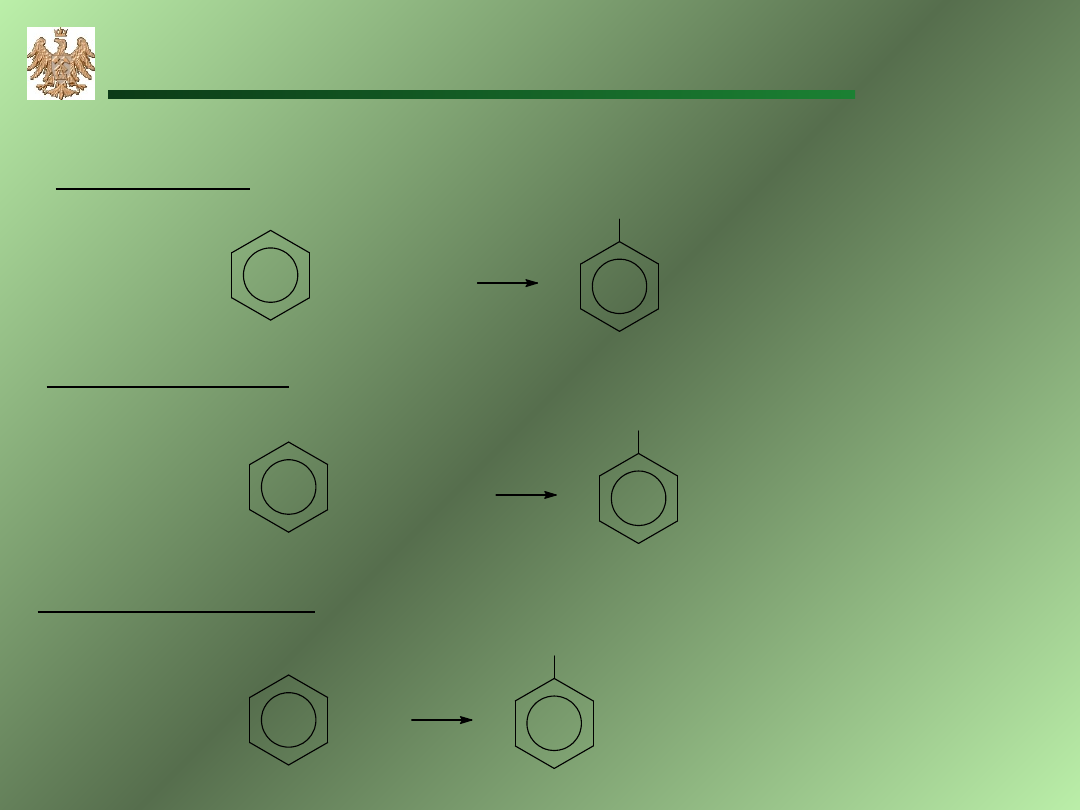
23
Nitrowanie
Sulfonowanie
HONO
2
+
H
2
SO
4
-
H
2
O
NO
2
nitrobenzen
+
-
H
2
O
SO
3
H
HOSO
3
H
Halogenowanie
sulfobenzen
+
Cl
2
AlCl
3
Cl
HCl
+
chlorobenzen
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

24
Grupy funkcyjne
Grupy funkcyjne
Grupa funkcyjna - grupa atomów determinująca własności
całej cząsteczki organicznej
Grupy funkcyjne
Grupy funkcyjne
C, H, O
• alkohole,
• ethery,
• aldehydy,
• ketony,
• kwasy karboksylowe,
• estry,
• węglowodany.
C,H,O,N,S
•
tiole,
• tioetery,
• tioalkohole,
• siarczki,
• sulfonamidy.
C,H,O,N
• aminy,
• amidy,
• nitrozwiązki.
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
25
Al
Al
k
k
ohol
ohol
e
e
R–OH
R–OH
OH
CH3
OH
CH3CH2CH2
OH
CH3
CH
CH3
metanol,
alkohol metylowy
alkohol etylowy, etanol
propan-1-ol
C2H5OH
OH
CH3CH2
propan-2-ol,
izopropanol
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
26
OH
CH3
CH2
CH2
CH2
OH
CH3
C
CH3
CH3
Rzędowość alkoholi
alkohole pierwszorzędowe -
grupa OH przyłączona do
węgla związanego z jednym
atomem C,
n-butanol
alkohole drugorzędowe -
grupa OH przyłączona do węgla
związanego z dwoma atomami C,
butan-2-ol
izobuthanol
alkohole trzeciorzędowe -
grupa OH przyłączona do węgla
związanego z trzema atomami C,
2-metylopropan-2-ol,
tert-butanol
CH3
CH2
CH
CH3
OH
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
27
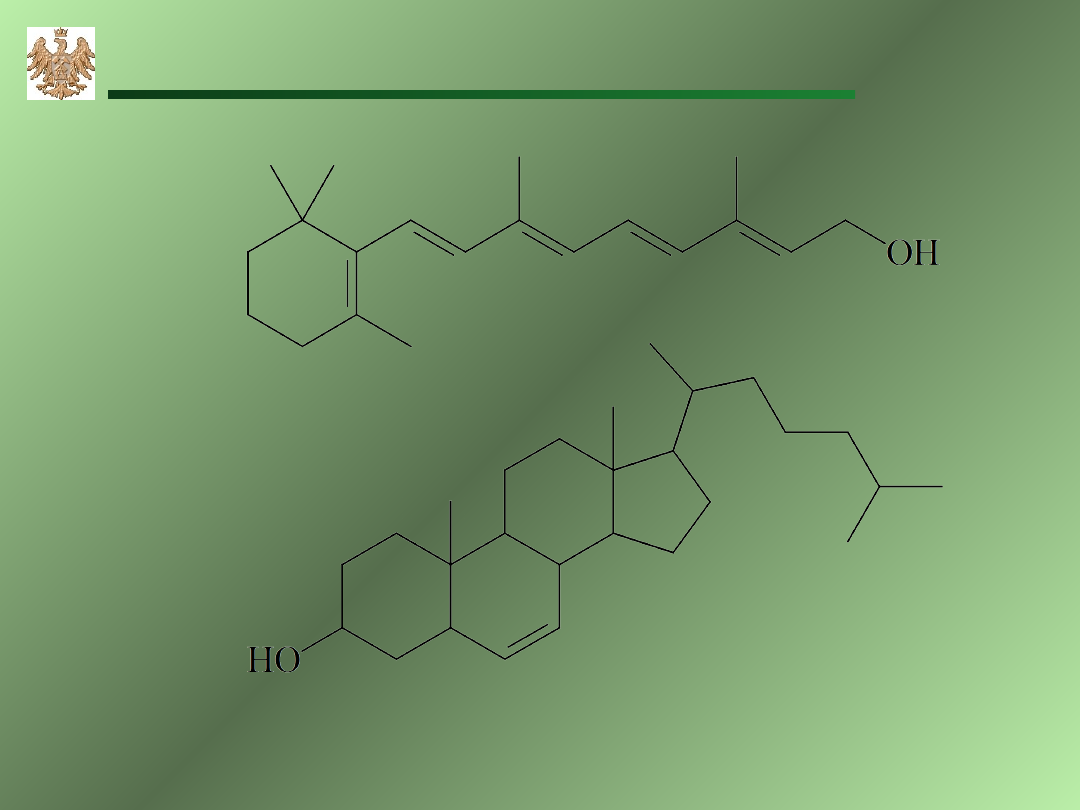
retinol (vit A)
cholesterol

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
28
Pol
Pol
i
i
alcohol
alcohol
e
e
OH OH
CH2
CH2
CH3
OH OH
CH2
CH2
etano-1,2-diol,
glikol etylenowy
propano-1,2-diol,
glikol propylenowy
propano-1,2,3-triol,
gliceryna
OH
OH
CH2
CH2 OH
CH
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
29
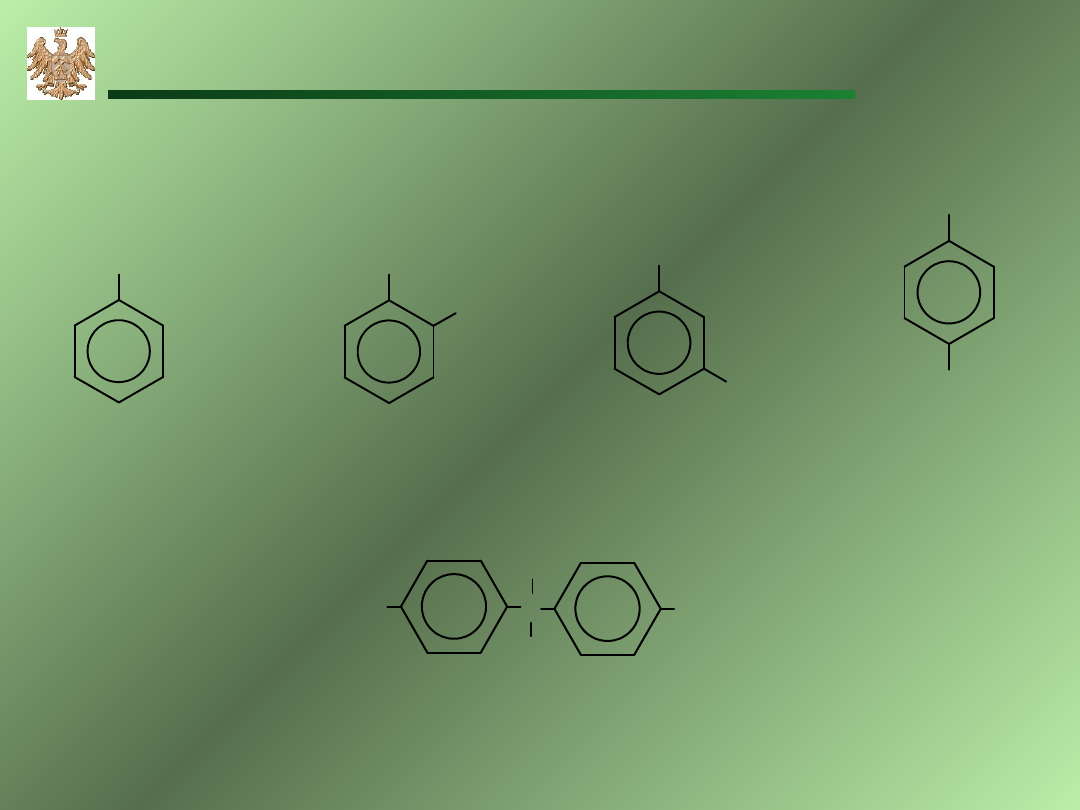
F
F
enol
enol
e
e
Ar-OH
Ar-OH
fenol
OH
CH
3
OH
CH
3
OH
CH
3
OH
CH
3
C
CH
3
OH
HO
ortho–kresol
bisfenol A
meta–kresol
para–kresol
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
30
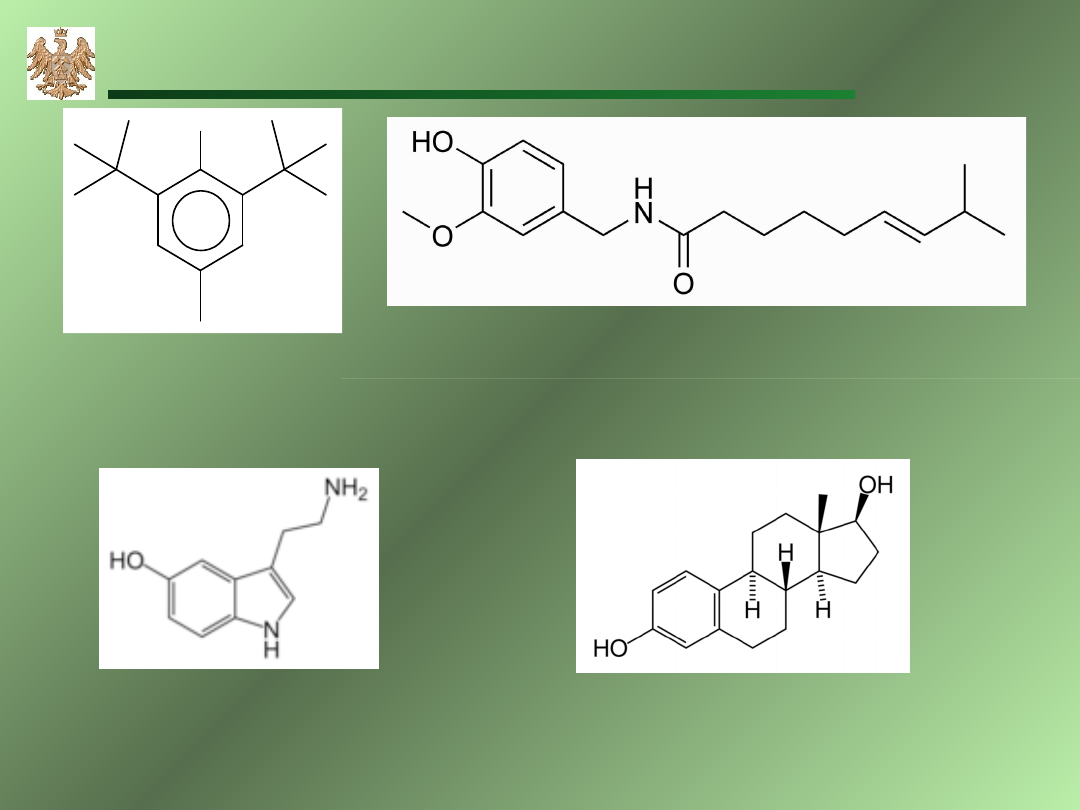
OH
BHT
konserwant
żywności
kapsaicyna
substancja aktywna chili
Estradiol
hormon płciowy
Serotonina
neurotransmiter

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
31
• R=C
1
to C
4
rozpuszczalne w H
2
O, R>C
4
coraz mniej
rozpuszczalne,
• kwasowe, polarne rozpuszczalniki,
•metanol:
rozpuszczalnik
farb,
paliwo
samochodów
wyścigowych, wysokotoksyczny – powoduje ślepotę.
•etanol: alkohol spożywczy, rozpuszczalnik leków, perfum,
olejków zapachowych, antyseptyczny,
•
glikole:
trujące,
stosowane
w
syntezie
polimerów,
rozpuszczalniki barwników, antybakteryjne, składniki odmrażaczy
w samochodach.
• fenol: toksyczne, bezwonne ciało stałe, antyseptyczny,
stosowany w produkcji leków (aspiryny) i syntetycznych żywic
(bakelit).
Fizyczne własności alkoholi
Fizyczne własności alkoholi
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
32
Rea
Rea
kcje
kcje
al
al
k
k
ohol
ohol
i
i
Odwodnienie
O
H
CH
CH
R
OH
CH
CH
R
2
2
Q
,
SO
H
2
2
4
2
Tworzenie alkoholanów i soli
2
2
2
2
2
H
Na
O
CH
CH
R
2
Na
2
OH
CH
CH
R
2
CH
OH
CH2
CH2
OH
OH
+
3 HONO2
ONO2
CH2
CH2
CH ONO2
ONO2
+
3H2O
nitrogliceryna

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
33
Utlenianie
Alkohole pierwszorzędowe
Alkohole drugorzędowe
aldehyd
[O]
C O
CH OH
R1
R2
R1
R2
keton
OH
O
H
C
R
[O]
R
OH
CH2
[O]
R C
O
kwas karboksylowy
Estryfikacja
+
+
H2O
OH
O R1
R2 C
O
R1 OH
O
C
R2
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
34
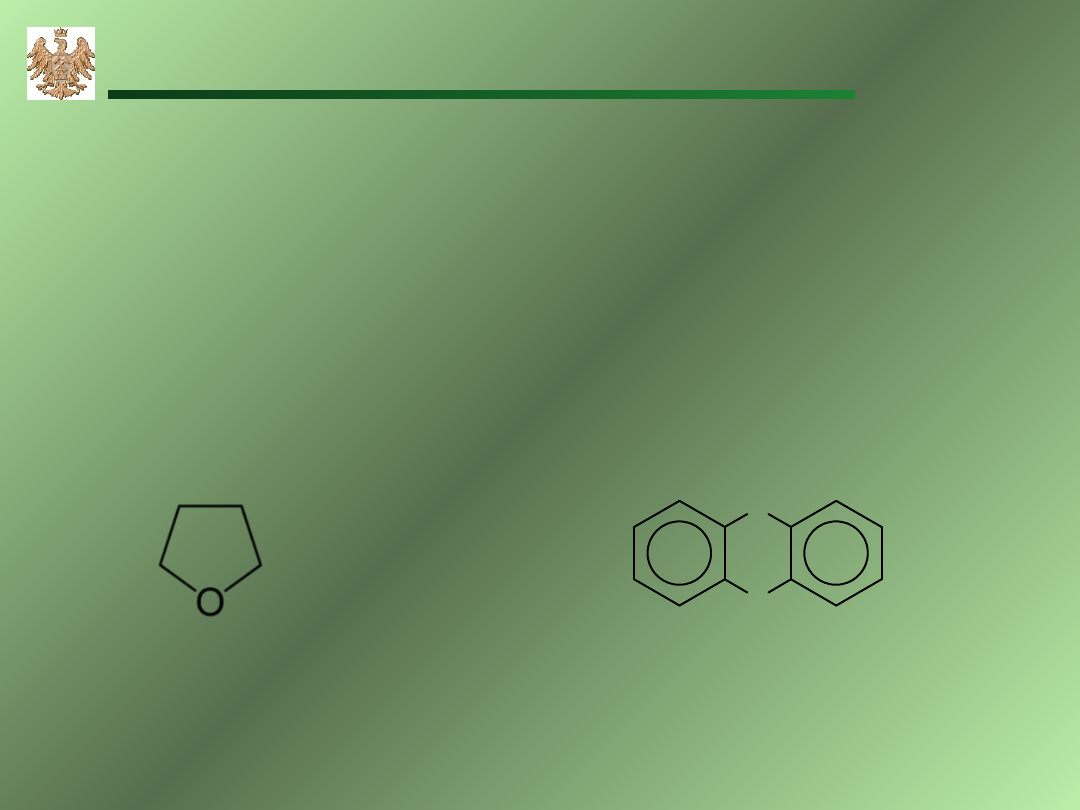
Eter
Eter
y
y
R–O–R
R–O–R
O
O
CH
3
–O–CH
3
dimetyloeter
oksantren
dioksyna
CH
3
–CH
2
–O–CH
2
–CH
3
CH
3
–O–CH
2
CH
3
dietyloeter
metyloetyloeter
tetrahydrofuran
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
35
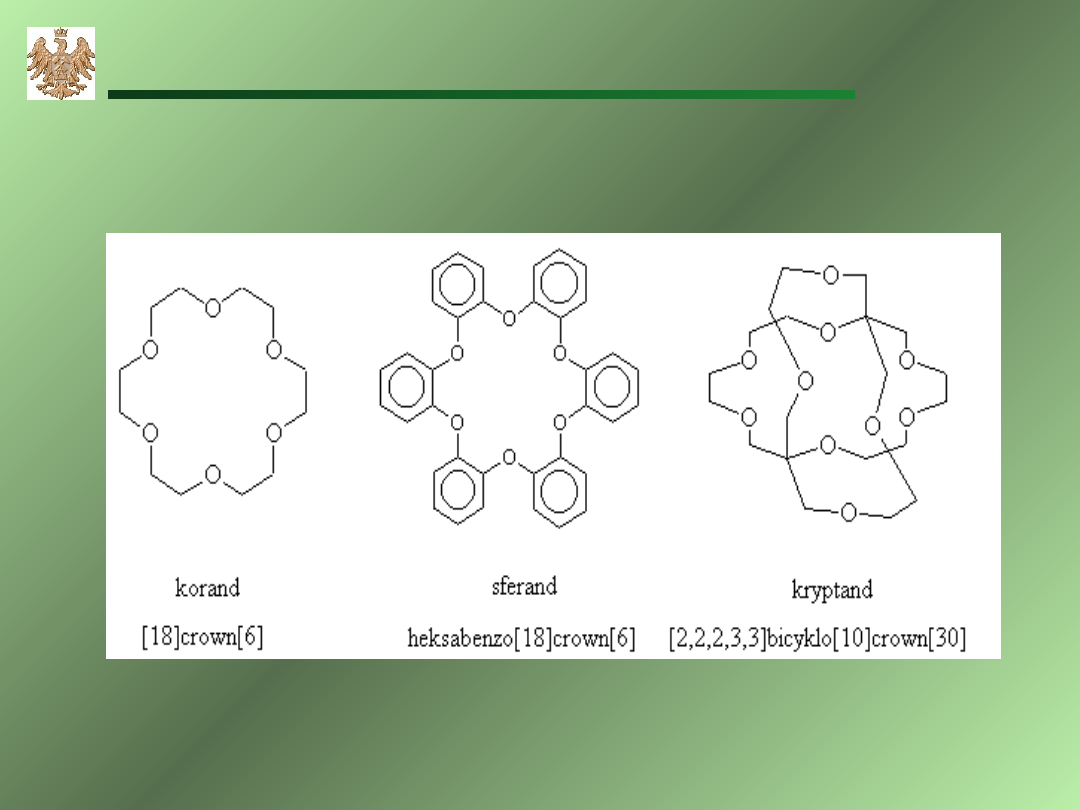
Eter
Eter
y koronowe
y koronowe

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
36
Fizyczne własności eterów
Fizyczne własności eterów
• dimetyloeter i etylometyloeter– gazy, wyższe etery - ciecze,
• niektóre etery mają własności narkotyczne, usypiające i
przeciwbólowe,
•some ethers has narcotic and sleeping effect, painkillers,
• dioksyny – bardzo toksyczne.
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
37
Aldehyd
Aldehyd
y
y
R–CHO, Keton
R–CHO, Keton
y
y
R
R
1
1
–CO–R
–CO–R
2
2
H C
H
O
CH3 C
H
O
C
H
O
C
CH3
CH3
O
formaldehyd,
metanal,
aldehyd metylowy,
formalina
aldehyd octowy
etanal ,
benzaldehyd
aldehyd benzoesowy,
CH2
C
CH3
CH3
O
CH3
C
O
acetofenon,
1-fenyletanone
dimetyloketon
propanon
aceton,
metyloetylo keton
butanon,
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
38
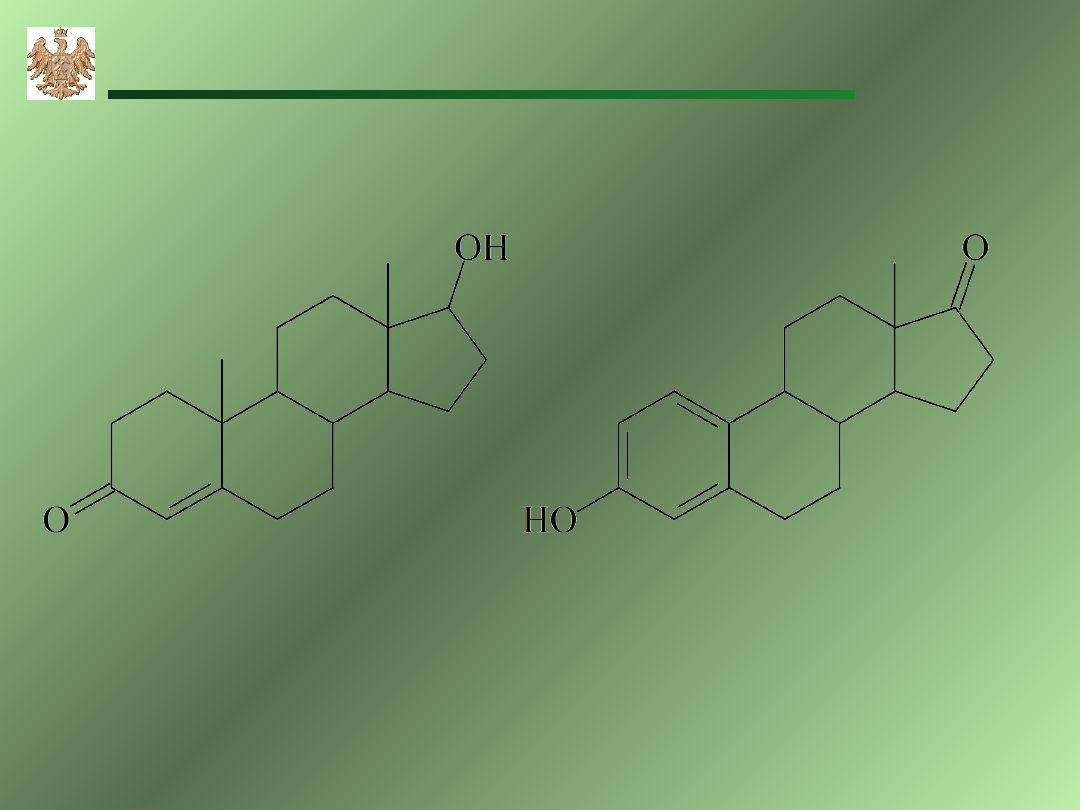
testosteron
(hormonmęski)
estrogen
(hormon żeński)

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
39
Fizyczne własności aldehydów i
Fizyczne własności aldehydów i
ketonów
ketonów
• aldehydy: wodny roztwór formaldehydu używany jest do
dezynfekcji,
• formaldehyd w polikondensacji z fenolem, mocznikiem lub
melaminą tworzy żywice,
• acetofenon: rozpuszczalnik celulozy w przemyśle żywic
rozpuszczalnych w alkoholach,
• ketony: stosowane w przemyśle perfumeryjnym i farbiarskim,
• rozpuszczalniki i substraty w przemyśle chemicznym.

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
40
Rea
Rea
kcje
kcje
aldehydów i ketonów
aldehydów i ketonów
Utlenianie
Redukcja
CH2OH
R
R C
H
O
[H]
[H]
R2
R1
R2
R1
OH
CH
O
C
R C
O
H
[O]
[O]
O
C
R
OH
R CH2OH

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
41
Kwasy karboksylowe
Kwasy karboksylowe
R–COOH
R–COOH
Wzór
Nazwa
zwyczajow
a
Nazwa
systematyczna
Występowanie
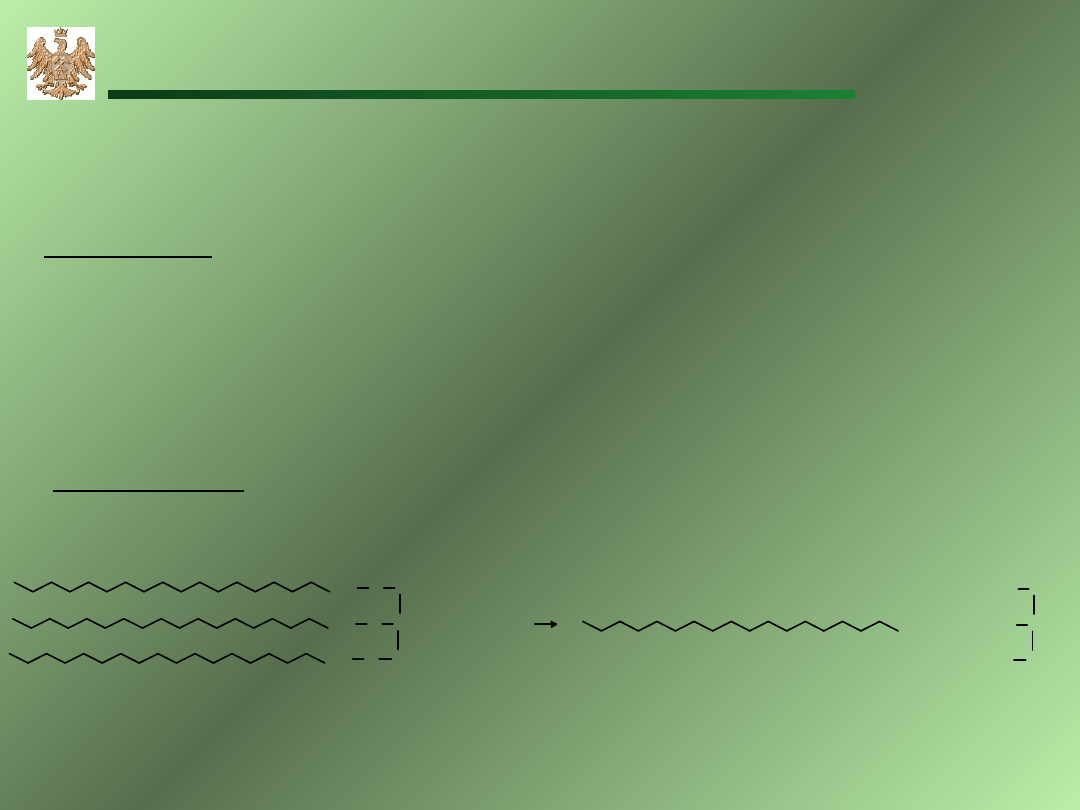
HCOOH
Kwas
mrówkowy
Kwas metanowy
Żądła owadów
CH
3
COOH
Kwas octowy
Kwas etanowy
Ocet winny
CH
3
CH
2
COOH
Kwas
propioniowy
Kwas propanowy
CH
3
(CH
2
)
2
COOH
Kwas
masłowy
Kwas butanowy
Zjełczałe masło
CH
3
(CH
2
)
3
COOH
Kwas
walerianowy
Kwas pentanowy
CH
3
(CH
2
)
10
COOH
Kwas
laurowy
Kwas dodekanowy
Olejek kokosowy
CH
3
(CH
2
)
16
COOH
Kwas
stearynowy
Kwas
oktadekanowy
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
42
OH
COOH
C
C
C H
3
O
O H
O
O
kwas salicylowy
aspirina

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
43
Fizyczne własności kwasów
Fizyczne własności kwasów
karboksylowych
karboksylowych
• polarne, tworzą aglomeraty połączone wiązaniami
wodorowymi,
• R=C
1
do C
4
rozpuszczalne w H
2
O, R>C
4
słabo rozpuszczalne ze
względu na hydrofobowe własności łańcucha węglowego,
• nienasycone, długołańcuchowe – kwasy tłuszczowe
• rozpuszczalne w eterach i alkoholach,

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
44
Rea
Rea
kcje kwasów karboksylowych
kcje kwasów karboksylowych
Zobojętnianie
O
C
C
O
OH
CH
3
CH
3
O
H
2
+
+
NaOH
ONa
Estryfikacja
+
+
H
2
CH
3
O
OH
O
CH
3
CH
3
CH
3
CH
2
CH
2
OH
O
C
C
O
Redukcja do aldehydów i ketonów
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
45
Estr
Estr
y
y
R
R
1
1
–COO–R
–COO–R
2
2
H
O
C
O CH
3
O
C
CH
3
O CH
3
O
C
CH
2
CH
3
O
CH
3
O CH
2
C
O
CH
3
O CH
3
C
O
CH
2
O
CH
3
C
O

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
46
Fizyczne własności estrów
Fizyczne własności estrów
• rozpuszczalne w wodzie nieco gorzej niż kwasy, od kórych
pochodzą,
• większość posiada charakterystyczny zapach, stąd
stosowane jako sztuczne dodatki smakowe i zapachowe.
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
47
Rea
Rea
kcje
kcje
estrów
estrów
Hydroliza
CH
3
COOC
2
H
5
+ H
2
OCH
3
COOH+ C
2
H
5
OH
+
CH
2
CH
CH
2
CO O
CO O
CO O
NaOH
3
3
COONa
+
CH
2
CH
CH
2
HO
HO
HO
Zmydlanie
Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
Amin
Amin
y
y
R–NH
R–NH
2
2
NH
2
CH
3
NH
2
metyloamina
NH
2
CH
2
NH
2
metylodiamina
NH
2
NH
2
CH
3
NHCH
3
dimetyloamina
heksametylenodiamin
a
anilina
benzoamina

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
Fizyczne własności amin
Fizyczne własności amin
• metylo-, dimetylo-, trimetylo- oraz etyloamina – gazy w
warunkach normalnych, dietyloamina i trietyloamina -
ciecze, wyższe aminy – ciała stałe,
• gazowe aminy posiadają charakterystyczny zapach
amoniakalny, ciekłe aminy posiadają „rybi” zapach,
• większość amin alifatycznych wykazuje rozpuszczalność w
wodzie malejącą ze wzrostem liczby atomów węgla w
łańcuchu,
• aminy alifatyczne wykazują rozpuszczalność w polarnych
rozpuszczalnikach organicznych.

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
50
Węglowodany
Węglowodany
C
C
n
n
(H
(H
2
2
O)
O)
n
n
(monosachar
(monosachar
ydy
ydy
)
)
OH
OH
OH
OH
CH
2
HO
C
O
H
C
C
C
H
H
H
H C
OH
OH
CH
2
HO
HO
C
O
H
C
C
C
H
H
H
C
HO
H
H
H
C
C
C
H
O
C
HO
HO
HO
CH
2
OH
ryboza
glukoza
fruktoza

Akademia Górniczo-Hutnicza, WIMiR, wykład z chemii ogólnej
51
Fizyczne własności węglowodanów
Fizyczne własności węglowodanów
Węglowodany spełniają w organizmach następujące
funkcje:
• zapasowe – podczas wieloetapowego spalania 1 g
glukozy w komórkach wyzwala się 17,2 kJ energii. U roślin
magazynem energii jest głównie skrobia i inulina, a u
zwierząt oraz ludzi glikogen,
• transportowa – u roślin transportową formą cukru jest
sacharoza, a u zwierząt oraz ludzi glukoza,
• budulcowa (celuloza, hemiceluloza) - wchodzą w skład
DNA i RNA, stanowią modyfikację niektórych białek,
• hamują krzepnięcie krwi – heparyna,
• są materiałem energetycznym (fruktoza) i odżywczym
(maltoza, laktoza, rafinoza).
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
wyklad7 pps
wyklad3 pps
wyklad5 pps
wyklad2 pps
wyklad6 pps
wyklad7 pps
wyklad3 pps
Lachu opracowanie otwarte Kerto me edit, INNE, WYKŁADY Lach, pps na 17 czerwca
Pedagogika specjalna 31.05.2011 WYKŁAD, Studia, PPS
19.04.2011Podstawy pedagogiki specjalna wykład, Studia, PPS
kololach2, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
Lachu opracowanie otwarte Kerto, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
PPS I KOLOKWIUM, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
więcej podobnych podstron